一种洋葱雄性不育系的选育方法与流程
本发明属于植物育种领域,具体涉及一种洋葱雄性不育系的选育方法。
背景技术
洋葱(alliumcepa)是一种重要的世界性与保健型蔬菜,在我国蔬菜的周年供应与出口贸易中占有十分重要的地位。我国的洋葱每年种植面积在30万公顷以上,居世界第2位,但因品种等原因,单产却排在20位以后。由于我国洋葱品种选育工作起步较晚,重视不够,加之洋葱品种选育的周期较长,导致国内洋葱自育的品种水平与国际先进国家有较大的差距。长期以来,国内洋葱杂交种子甚至一些常规品种均由国外种子公司垄断或来源国外。进口种子的价格昂贵且种子来源不稳定,加重了我国洋葱生产的风险与市场价格波动,导致主产区种子价格昂贵,成本上升。因此,加快我国自主创新的洋葱优良品种的选育,对推动我国出口创汇型洋葱产业的可持续发展有着十分重要的意义。
自主创新的洋葱优良品种的选育关键在于洋葱雄性不育系的创制。目前所利用的洋葱细胞质雄性不育主要为s型雄性不育,由不育的细胞质因子(s)和核隐性单基因(ms)共同控制的,不育系转育比较容易,被广泛用来配制洋葱杂种。但转育过程复杂、时间长。而且这种细胞质的同一性给洋葱生产带来很大的潜在风险特别是给病害大流行带来了可能性。
洋葱异源胞质雄性不育系skia是一个较好的洋葱不育源材料。与s型洋葱雄性不育系相比,洋葱异源胞质雄性不育系skia的育性由细胞质控制,不受核基因控制,转育利用简单方便;而且洋葱异源胞质雄性不育系skia完全不同于s、t型雄性不育系的新型细胞质雄性不育系,可有效避免细胞质同一性给洋葱产业带来的风险。然而洋葱异源胞质雄性不育系skia为长日照,鳞茎为黄色球形,这些都与常规育种目标不符。如何将洋葱异源胞质雄性不育系skia不育性快速转育到综合性状优良、符合育种目标的洋葱自交系,创制出雄性不育系是洋葱育种亟待解决的主要问题。传统的方法是连续回交4-6代,但需10年以上,费时费力。
技术实现要素:
本发明的目的是快速创制洋葱雄性不育系。
本发明首先保护一种洋葱雄性不育系的选育方法,可为以洋葱细胞质雄性不育系为供体、洋葱自交系为受体,进行原生质体非对称融合,得到洋葱雄性不育系。
上述选育方法中,所述洋葱雄性不育系具体可为所述洋葱自交系的雄性不育系。
上述选育方法中,所述原生质体非对称融合可包括如下步骤:
(1)获得核失活的洋葱细胞质雄性不育系的原生质体;
(2)获得胞质失活的洋葱自交系的原生质体;
(3)将核失活的洋葱细胞质雄性不育系的原生质体和胞质失活的洋葱自交系的原生质体进行原生质体融合,培养。
所述步骤(1)中,获得核失活的洋葱细胞质雄性不育系的原生质体的方法可为:取洋葱细胞质雄性不育系的原生质体,辐射。
所述步骤(1)中,辐射可为紫外线辐射。所述辐射的辐射剂量可为36-72j/cm2(如36j/cm2或72j/cm2)。
所述步骤(2)中,获得胞质失活的洋葱自交系的原生质体的方法可为:取洋葱自交系的原生质体,碘乙酞胺处理。
所述步骤(2)中,碘乙酞胺处理的浓度可为0.1-0.4mmol/l(如0.1-0.3mmol/l、0.3-0.4mmol/l、0.1mmol/l、0.3mmol/l或0.4mmol/l)。
所述步骤(3)中,原生质体融合的方式具体可为电融合。
上述任一所述的选育方法中,所述洋葱细胞质雄性不育系可为洋葱异源胞质雄性不育系skia。所述洋葱自交系为洋葱品种中生赤玉。
采用上述任一所述的选育方法选育的洋葱雄性不育系也属于本发明的保护范围。
本发明还保护a1)或a2):
a1)上述任一所述的选育方法在洋葱育种中的应用;
a2)洋葱异源胞质雄性不育系skia在选育洋葱雄性不育系中的应用。
上述应用中,所述洋葱育种为将上述任一所述的方法选育的洋葱雄性不育系作为亲本,与其它洋葱品种或品系进行杂交和/或回交,得到具有所述其它洋葱品种或品系遗传背景的洋葱新品系。
实验证明,采用本发明提供的方法利用洋葱异源胞质雄性不育系skia和中生赤玉选育出5个洋葱雄性不育系。这5个洋葱雄性不育系均表现出与双亲不同的形态:植株生长势强,中日照,鳞茎外皮赤红色,无花粉。本发明提供的洋葱雄性不育系的选育方法育种周期短,具有重要的应用价值。
附图说明
图1为利用原生质体非对称融合技术创制洋葱雄性不育系。
图2为体细胞杂交植株的染色体数目分析。
图3为体细胞杂交植株的分子检测。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的实验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量实验,均设置三次重复实验,结果取平均值。
洋葱异源胞质雄性不育系skia是利用实葶葱与洋葱进行远缘杂交,创造的一种新的异源洋葱雄性不育系。该不育系没有花药,没有恢复基因,鳞茎大小、叶片等与保持系完全一致,每个花球生产杂交种的产量和s型、t型不育没有显著差异,具有较强的抗病性等优点;长日照,球形,外皮铜黄色,耐贮藏,球形指数0.99,水分含量低,辛辣味重。植株生长势强,株高75~80cm,叶片深绿色,蜡粉多。
中生赤玉是以日本紫红皮洋葱早熟赤玉为母本、韩国中晚熟紫玉为父本杂交后经4代系统选育而成。中早熟,生育期240d左右;植株生长势中等,株高65~70cm,叶片浅绿色,蜡粉少;鳞茎厚扁圆形,球形指数0.78,外皮赤红色,有光泽,微甜,商品性,适宜大部分中日照地区种植。
实施例1、利用原生质体非对称融合技术创制洋葱雄性不育系
一、洋葱异源胞质雄性不育系skia的原生质体和中生赤玉的原生质体的获得
按照文献(陈丽,梁毅,汪李平,田保华.洋葱愈伤原生质体分离和纯化研究.中国农学通报,2011,27(31):147-151.)中记载的方法分离和纯化洋葱异源胞质雄性不育系skia的原生质体。具体步骤如下:
1、取饱满健壮的洋葱异源胞质雄性不育系skia的种子,先用无菌水冲洗10min(目的为去除表面杂质),再用75%(v/v)乙醇水溶液浸泡30s,最后用0.1%hgcl2溶液浸泡10min,用无菌水冲洗5遍。
2、完成步骤1后,取所述洋葱异源胞质雄性不育系skia的种子,接种于1/2ms固体培养基上,25±2℃光暗交替培养(光照16h/黑暗8h)20d,得到无菌苗。
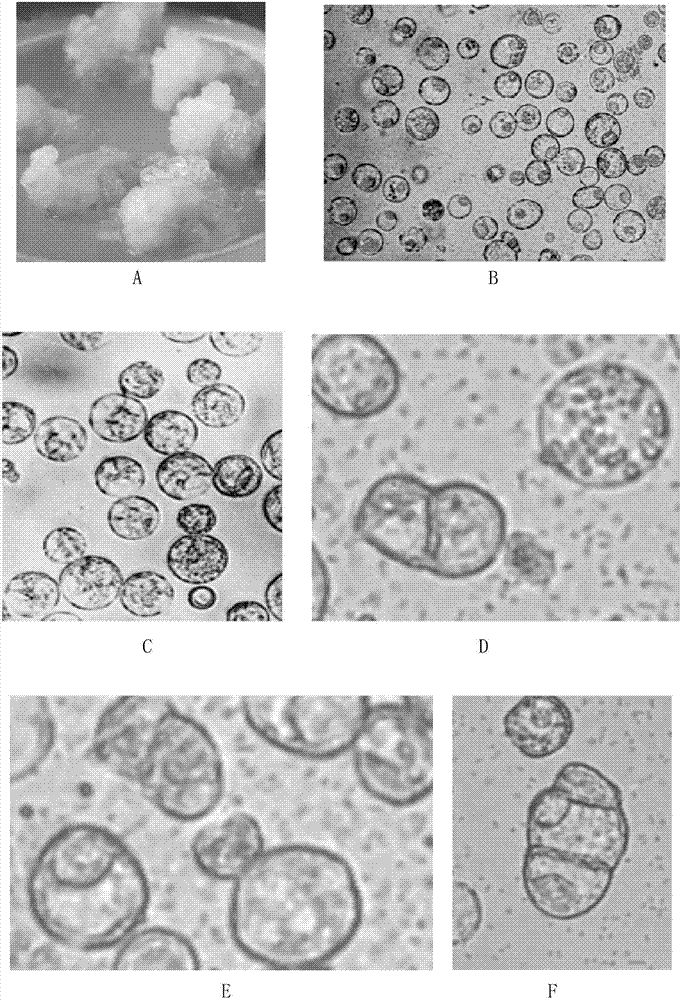
3、完成步骤2后,取所述无菌苗的鳞茎盘,接种于含1.0mg/l2,4-d和1.0mg/l6-ba的ms固体培养基上,25±2℃光暗交替培养(光照16h/黑暗8h)10d,得到愈伤组织。将该愈伤组织再次接种于含1.0mg/l2,4-d和1.0mg/l6-ba的ms固体培养基上,25±2℃光暗交替培养(光照16h/黑暗8h)12d,得到胚性愈伤组织(见图1中a)。
4、完成步骤3后,取所述胚性愈伤组织,接种于装有25ml含1.0mg/l2,4-d和1.0mg/l6-ba的ms液体培养基的三角瓶(三角瓶规格为100ml)中,25℃、120rpm振荡黑暗培养3-5d,得到悬浮愈伤组织。
5、完成步骤4后,取所述悬浮愈伤组织,按1:10(1g悬浮愈伤组织:10ml酶解液)的比例加入酶解液(经0.22μm孔径滤膜过滤灭菌),黑暗条件下,28℃、25rpm振荡6h(目的为进行酶解),得到原生质体。
酶解液的溶质及其浓度为2.0%(m/v)纤维素酶onozukar-10、0.5%(m/v)离析酶macerozymer-10和0.1%(m/v)果胶酶pectinasey-23,溶剂为cpw-0.6mol/l甘露醇溶液(含cacl2·2h2o10mmol/l、kh2po40.2mmol/l、kno31.0mmol/l、mgso4·7h2o1.0mmol/l、cuso4·5h2o0.1μmol/l、ki10μmol/l、2-吗啉乙磺酸15.37μmol/l和0.6mol/l甘露醇的水溶液,ph值为5.6),ph值为5.8-6.0(用naoh调节)。
6、完成步骤5后,取所述原生质体,经双层不锈钢网(孔径分别为100μm和38.5μm)过滤,得到滤液。将该滤液置于低速离心机,600r/min离心5min,弃上清,收集沉淀。
7、完成步骤6后,取所述沉淀,用1mlcpw-0.6mol/l甘露醇溶液重悬,然后轻轻加入装有3mlcpw-25%蔗糖(含cacl2·2h2o10mmol/l、kh2po40.2mmol/l、kno31.0mmol/l、mgso4·7h2o1.0mmol/l、cuso4·5h2o0.1μmol/l、ki10μmol/l、2-吗啉乙磺酸15.37μmol/l和25%(m/v)蔗糖的水溶液,ph值为5.6)的离心管(规格为10ml)中,600r/min离心5min,在溶液的界面收集乳白色的原生质体条带。收集的原生质体条带即为洋葱异源胞质雄性不育系skia的原生质体(见图1中b)。
按照上述步骤,将洋葱异源胞质雄性不育系skia替换为中生赤玉,其它步骤均不变,得到中生赤玉的原生质体(见图1中c)。
二、紫外线辐射
辐射光源为超净工作台30w紫外灯,辐射强度约为1200μw/cm2。
1、取步骤一得到的洋葱异源胞质雄性不育系skia的原生质体2.0ml,平铺于玻璃培养皿(直径为60mm)。
2、完成步骤1后,将所述玻璃培养皿置于紫外灯垂直下方10cm处,进行辐射。辐射时间分别为0s、30s、60s、90s和120s(相应的辐射剂量依次为0、36、72、108和144j/cm2)。
3、完成步骤2后,取所述玻璃培养皿,倒出洋葱异源胞质雄性不育系skia的原生质体,1000rpmin离心5min,收集沉淀。
4、完成步骤3后,取所述沉淀,用电融合液洗涤两次,然后用电融合液稀释,得到密度为5×105个/ml的洋葱异源胞质雄性不育系skia的原生质体的稀释液(以下简称不育系原生质体稀释液)。
电融合液:含甘露醇0.5mol/l和cacl20.5mmol/l的水溶液,ph值为5.7。
三、检测原生质体活力
利用荧光素双醋酸酯(fluoresceindiacetat,fda)染色检测原生质体活力。实验重复三次取平均值,每次重复观察5个视野,具体步骤如下:
1、取1mlfda贮存液(2mgfda溶于1ml丙酮),加入50mlddh2o进行稀释,得到fda稀释液。
2、将1体积份原生质体(不育系原生质体稀释液)和1体积份fda稀释液混合,静置5min后置于荧光显微镜(leicadm2500)下观察,能够发出绿色荧光的原生质体即为有活力的原生质体。统计不育系原生质体稀释液培养7d内的原生质体活力(暗视野中发出绿色荧光的原生质体数占同一明视野中总原生质体数的比例)、培养第7d的分裂频率(同一视野下分裂的原生质体个数占总原生质体个数的比例)和培养20d的植板率(同一视野下细胞团的个数占总原生质体个数的比例)。
实验结果表明(表1),紫外线对原生质体的影响主要表现在原生质体活力、分裂频率和植板率。原生质体活力、分裂频率和植板率随着辐射剂量的增加而降低。紫外线辐射致使原生质体活力下降,且随辐射时间延长,原生质体活力下降显著:未辐射的原生质体和辐射剂量为36j/cm2的原生质体分别在第2d和第3d时开始第1次分裂,之后不断分裂,15d左右形成细胞团;辐射剂量为72j/cm2的原生质体培养5d后才进行第一次分裂,随后形成少量的小细胞团,未见形成愈伤组织;辐射剂量为108j/cm2的原生质体早期比较正常,有少量的分裂,但10d后逐渐破碎直至死亡;辐射剂量大于108j/cm2的原生质体在第一次分裂后停止生长。对经紫外线处理的原生质体按1×105个/ml密度培养,辐射30s-300s的原生质体可进行细胞分裂,并最终形成胚性愈伤组织,辐射时间超过400s的原生质体无细胞分裂。因此,选择72j/cm2为紫外线致死剂量用于后续的原生质体不对称融合。
表1.紫外线辐射剂量对洋葱原生质体的影响
注:数据统计为平均数±标准差。差异显著性水平为p≤0.05.字母a、b、c、d、e表示同一天不同uv剂量辐射的原生质体活力差异水平。
原生质体不对称融合前,将洋葱异源胞质雄性不育系skia的原生质体依次进行如下处理:(1)取步骤一得到的洋葱异源胞质雄性不育系skia的原生质体2.0ml,平铺于玻璃培养皿(直径为60mm);(2)完成步骤(1)后,将所述玻璃培养皿置于紫外灯垂直下方10cm处,辐射60s(相应的辐射剂量为72j/cm2);(3)完成步骤(2)后,取所述原生质体,1000rpmin离心5min,收集沉淀;(4)完成步骤(3)后,取所述沉淀,用电融合液洗涤两次,然后用电融合液稀释,得到密度为5×105个/ml的不育系的原生质体工作液。
四、碘乙酞胺(ioa)处理
ioa母液的溶质及其浓度为5mmol/lioa,溶剂为cpw溶液,ph值为5.8(用naoh调节)。ioa母液需过滤灭菌。cpw溶液:含cacl2·2h2o10mmol/l、kh2po40.2mmol/l、kno31.0mmol/l、mgso4·7h2o1.0mmol/l、cuso4·5h2o0.1μmol/l、ki10μmol/l和2-吗啉乙磺酸15.37μmol/l的水溶液。
1、取ioa母液,加入ddh2o进行稀释,得到浓度为0.1mmol/l的稀释液1、浓度为0.4mmol/l的稀释液2、浓度为0.8mmol/l的稀释液3或浓度为1.2mmol/l的稀释液4。
2、完成步骤1后,取离心管,加入稀释液(稀释液1、稀释液2、稀释液3或稀释液4)和步骤一得到的中生赤玉的原生质体,室温处理15min(期间每隔5min取出轻轻晃动离心管,以免原生质体沉积影响处理效果)。
3、完成步骤2后,取离心管,1000rpmin离心5min,收集沉淀。
4、完成步骤3后,取所述沉淀,用电融合液洗涤两次,然后用电融合液稀释,得到密度为5×105个/ml的中生赤玉的原生质体稀释液(以下简称中生赤玉原生质体稀释液)。
五、检测原生质体活力
利用荧光素双醋酸酯(fluoresceindiacetat,fda)染色检测原生质体活力。实验重复三次取平均值,每次重复观察5个视野,具体步骤如下:
1、取1mlfda贮存液(2mgfda溶于1ml丙酮),加入50mlddh2o进行稀释,得到fda稀释液。
2、将1体积份原生质体(中生赤玉原生质体稀释液)和1体积份fda稀释液混合,静置5min后置于荧光显微镜(leicadm2500)下观察,能够发出绿色荧光的原生质体即为有活力的原生质体。统计不育系原生质体稀释液培养7d内的原生质体活力(暗视野中发出绿色荧光的原生质体数占同一明视野中总原生质体数的比例)、培养第7d的分裂频率(同一视野下分裂的原生质体个数占总原生质体个数的比例)和培养20d的植板率(同一视野下细胞团的个数占总原生质体的个数的比例)。
实验结果表明(表2),用不同浓度ioa处理中生赤玉原生质体后,发现原生质体活力随着处理浓度升高而降低。处理过的原生质体第一次分裂比未处理的原生质体要晚,分裂频率和植板率要低。未处理的原生质体经培养可再生植株;用0.1mmol/lioa处理,原生质体也能再生成植株;而ioa浓度为0.4mmol/l时,原生质体能再生愈伤,却未能再生植株;当浓度达到0.8mmol/l时,原生质体不再形成生愈伤组织;用更高的1.2mmol/l浓度处理后原生质体逐渐褐化,形状不规则直至破裂。因此,选择0.4mmol/l为ioa最低失活浓度用于后续的原生质体不对称融合。
原生质体不对称融合前,将中生赤玉的原生质体进行如下处理:(1)取ioa母液,加入ddh2o进行稀释,得到浓度为0.4mmol/l的稀释液;(2)完成步骤(1)后,取离心管,加入稀释液和步骤一得到的中生赤玉的原生质体,室温处理15min;(3)完成步骤(2)后,取离心管,1000rpmin离心5min,收集沉淀;(4)完成步骤(3)后,取所述沉淀,用电融合液洗涤两次,然后用电融合液稀释,得到密度为5×105个/ml的中生赤玉的原生质体工作液。
表2.ioa对洋葱原生质体的影响
注:数据统计为平均数±标准差。差异显著性水平为p≤0.05.字母a、b、c、d、e表示同一天不同uv剂量辐射的原生质体活力差异水平。
六、原生质体不对称融合和再生植株的获得
1、取1ml步骤三制备的不育系的原生质体工作液和1ml步骤五制备的中生赤玉的原生质体工作液,混合,然后进行电融合。电融合参数如下:交流电场强度为60v/cm,时间为60s;直流电场强度为1500v/cm,脉冲时间50μs,脉冲次数5次,每次脉冲间隔1s。
2、取完成步骤1的混合液,先静置20min(目的为便于球形化),再用电融合液洗涤两次,得到融合原生质体培养物。
3、取盛有含0.3mol/l山梨醇和0.1mg/l2,4-d的ms液体培养基的玻璃培养皿(规格为15mm×60mm),加入融合原生质体培养物,得到培养体系。该培养体系中,原生质体的密度为5×105个/ml。
4、完成步骤3后,取所述培养体系,27℃暗培养30d。
实验结果如下:培养第5h,原生质体融合(图1中d和e);第6d,细胞开始分裂(图1中f);第30d,形成肉眼可见的胚状体或胚性愈伤(图1中g)。
5、完成步骤4后,取胚状体或胚性愈伤,转移至含0.1m山梨醇的ms液体培养基培养两周左右(降压培养),然后用吸管吸取转移至ms固体培养基上,进行液固双层培养。
6、待步骤5中上层的液体培养基干燥后,将胚状体或胚性愈伤转移至含2,4-d1.0mg/l和6-ba1.0mg/l的ms固体培养基上继代培养,当胚状体或胚性愈伤变为颗粒状胚性愈伤组织(鲜亮的米黄色)时,再转移至含6-ba2.0mg/l和naa1.0mg/l的ms固体培养基上培养,直至分化出子叶苗。
7、将步骤6分化出的子叶苗转移至含0.1%活性炭的1/2ms培养基上培养25d(目的为生根),得到再生幼苗(图1中h)。将再生幼苗移栽到盛有新鲜蛙石的苗盘中,常规培养,得到再生植株(图1中i)。
部分再生植株表现出与双亲不同的形态:植株生长势强,中日照,鳞茎外皮赤红色(图1中l),无花粉(图1中k为花序),这些在形态上表现出与双亲不同的形态的再生植株初步鉴定为体细胞杂交植株。洋葱异源胞质雄性不育系skia的花序见图1中j。
按照上述步骤,将步骤1中的“步骤三制备的不育系的原生质体工作液”替换为电融合液,其它步骤均不变(作为对照)。无法得到再生植株。
按照上述步骤,将步骤1中的“步骤五制备的中生赤玉的原生质体工作液”替换为电融合液,其它步骤均不变(作为对照)。也无法得到再生植株。
七、染色体数目分析
1、取洋葱(洋葱异源胞质雄性不育系skia、中生赤玉或步骤六初步鉴定为体细胞杂交植株)根尖,置于饱和的对二氯苯溶液中,室温预处理4h。
2、完成步骤1后,将所述洋葱根尖转移至卡诺固定液(3体积份无水乙醇和1体积份冰醋酸混合而成),4℃固定24h。
3、完成步骤2后,取所述洋葱根尖,先用蒸馏水清洗,再加入浓度为6mol/l的hcl水溶液,65℃水浴10min,最后用5%(m/v)卡宝品红溶液染色5min,压片。
在光学显微镜下观察洋葱根尖的染色体数目。
结果表明,洋葱异源胞质雄性不育系skia(图2中a)、中生赤玉或部分步骤六初步鉴定为体细胞杂交植株(图2中b)的根尖的染色体数目均为16条,为二倍体。
步骤六初步鉴定的体细胞杂交植株中,在细胞水平上根尖染色体数目显示为16条的即鉴定为体细胞杂交植株。这些体细胞杂交植株与其双亲的倍性完全相同。
八、分子检测
待测洋葱为双亲和5株体细胞杂交植株。双亲分别为洋葱异源胞质雄性不育系skia和中生赤玉。
1、rapd分析待测洋葱的细胞核基因组
采用ctab法从待测洋葱叶片中提取基因组dna,然后按照文献(崔成日,徐启江,崔崇士,李景鹏.洋葱rapd遗传多样性分析.园艺学报.2006年第04期)中记载的方法进行rapd分析。
反应体系为25μl,由待测洋葱的基因组dna(约40ng)、2.5μl10×pcrbuffer(mg2+plus)、1.4μldntp(datp、dttp、dgtp和dctp的浓度均为2.5mmol·l-1)、1.0μlrapd引物(10mmol/l)、0.25μllataq酶(浓度为5u/μl)和蒸馏水组成。
反应程序:94℃预变性5min;94℃变性30s,36℃退火30s,72℃延伸90s,40个循环;72℃延伸7min。
rapd分析在pe-9700型pcr仪上进行。扩增产物在0.8%琼脂糖凝胶(含溴化乙锭0.5μg/ml)中以5v/cm的电压电泳分离,经全自动凝胶成像系统syngenegenegenius观察、照像。
当采用sbsa-19:5’-caaacgtcgg-3’或sbsb20:5’-ggacccttac-3’进行rapd分析时,双亲和体细胞杂交植株的扩增图谱差异明显(见图3中a,泳道1为dnamarker,泳道2为中生赤玉,泳道3为洋葱异源胞质雄性不育系skia,泳道4-8为体细胞杂交洋葱植株)。
2、cpssr分析待测洋葱的细胞质基因组
采用ctab法从待测洋葱叶片中提取总dna,然后按照文献(chengyj,guoww,anddengxx.cpssr:anewtooltoanalyzechloroplastgenomeofcitrussomatichybrids.actabotanicasinca,2003,45(8))中记载的方法进行cpssr分析。cpssr引物为cp40,由5’-taatttgattcttcgtcgc-3’和5’-gatgtagccaagtggatca-3’组成。
反应体系为25μl,由待测洋葱的总dna(约40ng)、3.0μl10×pcrbuffer、3.0μlmg2+(20mmol/l)、3.0μldntp(datp、dttp、dgtp和dctp的浓度均为2.5mmol·l-1)、2.0μlcp40(浓度为50pmol/l)、0.4μltaq酶(浓度为5u/μl)和蒸馏水组成。
反应程序:94℃预变性5min;94℃变性30s,52℃退火30s,72℃延伸90s,45个循环;72℃延伸10min。
扩增产物在0.8%琼脂糖凝胶(含溴化乙锭0.5μg/ml)中以5v/cm的电压电泳分离,经全自动凝胶成像系统syngenegenegenius观察、照像。
结果见图3中b(泳道1-5为体细胞杂交洋葱植株,泳道6为中生赤玉,泳道7为洋葱异源胞质雄性不育系skia)。采用cp40进行cpssr分析时,双亲各产生一条特征带,而体细胞杂交植株只有洋葱异源胞质雄性不育系skia的特征条带。
经过上述步骤,体细胞杂交植株即为创制的洋葱雄性不育系。
- 还没有人留言评论。精彩留言会获得点赞!