一株耐盐拮抗菌M4-1及其菌剂的制备和应用的制作方法
本发明提供一株耐盐拮抗菌m4-1及其菌剂的制备和应用,属于农用微生物技术领域。
背景技术
盐碱土壤最主要的特征是可溶性盐分和代换性钠的含量较多,当土壤含盐量超过0.1%或土壤ph值在8.0以上,钠碱化度(esp)大于或等于5%时,就属于盐碱土的范围。土地盐碱化属于土地荒漠化的一种,是土地退化中的最大难题,可导致土壤肥力下降,表现为土壤的通气、透水性和保水、保肥性降低,造成作物根系吸水困难,减产甚至绝产。
我国盐碱地面积巨大,盐碱土壤的理化性质较差、生态环境恶劣,土壤微生物的数量和种类明显少于正常的种植土壤,因此,盐碱地区的植被成活率和农业生产效率较低,严重影响农、林生产。
世界各国一直在积极地进行盐碱地治理和改良方面的研究和实践工作,盐碱地改良的主要方式有修建排水网、种植耐盐植物、培肥地力和添加化学物质等。土壤微生物是土壤系统中极其重要和最为活跃的部分,在土壤有机物的降解、矿化释放无机元素,营养物质转化,系统稳定性及抗干扰能力中居于支配地位,控制着土壤生态系统功能的关键过程,被认为是表征土壤质量变化最敏感、最有潜力的指标。因此,适合的微生物肥料产品能够有效调理土壤生态,提高土壤质量,实现对土壤的有效改良。
耐盐微生物能够有效疏松土壤,提高土壤透气、贮水能力,改良土壤理化性质,促进土壤酸碱平衡,改善根际微生物群落结构。耐盐微生物与有机肥、矿物肥、控释肥等肥料混合,提高肥料利用率,节约资源,降低成本,调理土壤结构,提高作物产量与品质。耐盐拮抗菌可以有效抑制土壤中病原菌的数量或杀死病原菌,对改善土壤生态环境,促进作物生长,抑制病害发生具有多重作用。
技术实现要素:
为了解决上述问题,本发明提供了一株耐盐拮抗菌m4-1及其菌剂的制备和应用,可用于盐碱地小麦、玉米、蔬菜和果树等作物土传病害的防治和调理土壤环境。
发明人从黄河三角洲盐碱地小麦根际土壤中分离获得一株耐盐广谱性拮抗细菌;该菌株已于2018年5月21日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所。保藏号为cgmccno.15774。分类命名:甲基营养型芽孢杆菌(bacillusmethylotrophicus)m4-1;该菌株的16srdna序列如seq.no.1所示,gyrb序列如seq.no.2所示,rep-pcr基因指纹图谱如图3所示。
本发明还提供了一种利用甲基营养型芽孢杆菌m4-1制备微生物菌剂的方法,步骤如下:
(1)菌种活化:将低温保存的甲基营养型芽孢杆菌m4-1于lb固体培养基平板上划线,32℃培养24~36h;挑取m4-1菌株单菌落再次划线转接于lb固体培养基平板上,32℃培养16~24h,备用。
所述lb固体培养基组分为:蛋白胨10.0g,酵母粉5.0g,nacl10.0g,琼脂15.0g,水1.0l。
(2)一级种子液制备:用接种环刮取2环步骤(1)活化后的m4-1菌株菌苔,接种于一级种子液培养基中,32℃,200~220r/min,摇瓶培养16h得到一级种子液。
所述一级种子液培养基组分为:蛋白胨10.0g,酵母粉5.0g,nacl10.0g,水1.0l。
(3)二级种子液制备:将步骤(2)制得的一级种子液按照二级种子培养基1~2%(体积百分比)的比例接种到种子罐中发酵培养;转速120r/min,温度32℃,通气量1:1~1:1.2,发酵罐压强0.05-0.06mpa,培养12-16h,作为二级种子液。
所述二级种子培养基组分为:玉米粉25.0g,蔗糖10.0g,黄豆饼粉10.0g,磷酸二氢钾4.0g,硫酸铵4.0g,硫酸镁2.5g,水1.0l。
(4)发酵培养:将步骤3)所得二级种子液按照10%(体积比)接种到发酵培养基中发酵培养;转速120r/min,温度32℃,通气量1:1~1:1.2,发酵罐压强0.05~0.06mpa,培养时间为20~30h,得到m4-1m4-1微生物液体菌剂。
所述发酵培养基组分为:玉米粉25.0g、蔗糖10.0g、黄豆饼粉10.0g、磷酸二氢钾4.0g,硫酸铵4.0g,硫酸镁2.5g,水1.0l。
(5)m4-1微生物固体菌剂制备:将步骤4)获得的m4-1微生物液体菌剂,6000~8000r/min离心20~30min,去除离心上清液,向沉淀物中缓慢加入硅藻土或玉米粉作为载体基质,加入硅藻土或玉米粉的量为液体菌剂重量的6~8%,搅拌均匀后进行喷雾干燥,通过雾化器(65℃左右)的分散和高温空气(180℃)迅速蒸干,料液中的固体物质经旋风分离器收集,即得m4-1微生物固体菌剂。
本发明还涉及m4-1微生物菌剂在抑制盐碱地小麦、玉米、蔬菜和果树作物立枯丝核菌、镰刀菌、小麦根腐平脐蠕孢、胶胞炭疽菌、链格孢和溃疡病菌中的应用;m4-1菌株具有较广的抗菌谱,对引起小麦、玉米、蔬菜和果树等作物病害的立枯丝核菌、镰刀菌、小麦根腐平脐蠕孢、炭疽菌、链格孢和溃疡病菌等病原菌具有较强的抑制效果;能够在盐碱土壤中的小麦、玉米、蔬菜和果树等作物根际稳定定殖;m4-1微生物菌剂菌剂能有效防治盐碱地小麦、玉米、蔬菜和果树等作物的土传病害和土壤改良。
利用甲基营养型芽孢杆菌m4-1制备的m4-1微生物菌剂`,具有较高的耐盐性;m4-1菌株能够在大量元素含量≥500g/l的液体水溶肥和大量元素含量≥45%的固体水溶肥产品中保持较高存活率。
所述m4-1微生物菌剂作为生物有机肥或复合微生物肥料菌种使用,能提高肥料利用率,减少土壤结构破坏、提高作物产量与品质,有效改良土壤理化环境,改善土壤的微生物群落结构。
本发明还涉及m4-1微生物菌剂的使用方法:将所述m4-1微生物液体菌剂按照2~3l/亩的用量,使用时与水按照体积比1:100混合均匀,灌根施用;或将所述m4-1微生物固体菌剂按照1.0~2.0kg/亩的用量,拌种或加适量水稀释后灌根施用。
本发明具有以下优点:
1、m4-1菌株具有较广的抗菌谱,利用m4-1菌株制备的菌剂可有效防治由镰刀菌、小麦根腐平脐蠕孢菌、炭疽菌和链格孢等植物病原菌引起的小麦、玉米、蔬菜和果树等多种作物的根腐类病害或其它土传真菌病害。
2、m4-1菌株具有较高的耐盐性,能够在盐碱土壤中稳定定殖。能够有效改善作物根际微生物群落结构,改良土壤环境,促进作物生长。
3、利用m4-1菌株生产的菌剂可以与液体水溶肥和固体水溶肥混合使用。
4、m4-1菌株发酵性状好,菌剂生产工艺简单、生产周期短,原料成本低,有利于工业化生产、运输。
附图说明
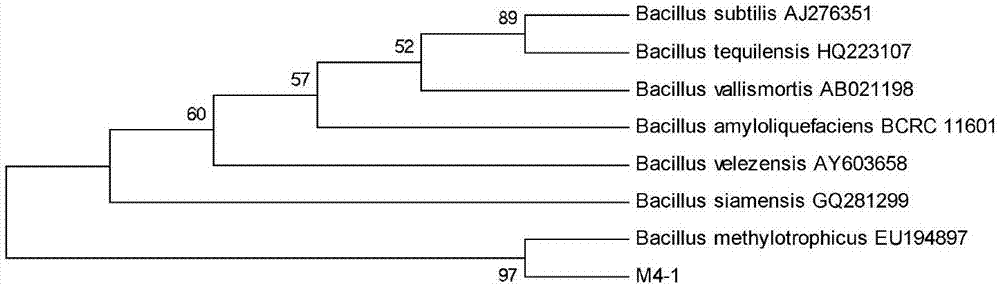
图1为根据m4-1菌株的16srdna序列,利用mega5.0构建的系统进化树。
由图1可以看出,m4-1菌株与已知菌株bacillusmethylotrophicus(eu1948907)的16srdna同源性达到100%,结合m4-1菌株的菌体形态、菌落特征及生理生化指标测定结果,鉴定m4-1菌株为芽孢杆菌属(bacillus)。
图2为根据m4-1菌株的gyrb序列,利用mega5.0分析构建的系统进化树。
由图2可以看出,m4-1菌株与已知菌株bacillusmethylotrophicus(cp011937)的gyrb同源性达到99%,结合m4-1菌株的菌体形态、菌落特征及生理生化指标测定结果,鉴定m4-1菌株为甲基营养型芽孢杆菌(bacillusmethylotrophicus)。
图3为m4-1菌株基因组dna通过重复片段pcr(repetitive-elementpcr)构建的菌株基因指纹图谱,通过电泳条带对比分析,找到菌株重复序列单元的数量和在染色体分布上的特征,这些重复序列分布在细菌基因组上的不同位点,并以不同的距离分隔,存在种属水平和同种不同株间的差异,经过多次的重复试验,电泳图谱完全一致,具有很好的重复性。因rep-pcr条带具有菌株种间特异性,可用于专利菌株m4-1维权中菌株的的识别、鉴定。
图3a为采用box-air引物(如seq.no.5所示)rep-pcr,m4-1菌株与本实验室保藏的其他9株甲基营养型芽孢杆菌的rep-pcr产物在1.5%浓度琼脂糖凝胶电泳中基因指纹图谱对比情况。
图3b为采用box-air引物(如seq.no.5所示)和eric1r引物(如seq.no.3所示)、eric2(如seq.no.4所示)rep-pcr,m4-1菌株的rep-pcr产物在2%浓度琼脂糖凝胶电泳中基因指纹图谱。
图4为m4-1菌株的抑菌谱;
图4表明m4-1菌株能够有效抑制尖孢镰刀菌、立枯丝核菌、禾谷镰刀菌、假禾谷镰刀菌、胶胞炭疽菌、链格孢菌、小麦根腐平脐蠕孢菌等植物病原真菌。
图5中:图5a为不同发酵时间对m4-1菌株发酵液中菌体数量及芽孢率的影响;
图5a说明,发酵48h时,m4-1菌株发酵液中菌体数量及芽孢率最高。
图5b为不同发酵温度对m4-1菌株发酵液的菌体数量及芽孢率的影响;
图5b说明,当发酵温度为32℃时,m4-1菌株发酵液中菌体数量及芽孢率最高。
图5c为不同接种量对m4-1菌株发酵液的菌体数量及芽孢率的影响;
图5c说明,当接种量为6.0%时,m4-1菌株发酵液中菌体数量及芽孢率最高。
图5d为不同磷酸二氢钾添加量对m4-1发酵液的菌体数量及芽孢率的影响;
图5d说明,当磷酸二氢钾添加量为4.0g/l时,m4-1菌株发酵液中菌体数量最高,芽孢率达到90%以上。
图5e为不同硫酸镁添加量对m4-1菌株发酵液的菌体数量及芽孢率的影响;
图5e说明,当硫酸镁添加量为2.5g/l时,m4-1菌株发酵液中菌体数量及芽孢率最高。
图5f为不同硫酸铵添加量对m4-1菌株发酵液的菌体数量及芽孢率的影响;
图5f说明,当硫酸铵添加量为4.0g/l时,m4-1菌株发酵液中菌体数量及芽孢率最高。
具体实施方式:
实施例1
m4-1菌株的分离。
取黄河三角洲盐碱地小麦根际土样,在无菌条件下取土样10g,溶于装有90ml无菌水的250ml三角瓶中,30℃,200r/min,振荡培养30min,吸取1ml与9ml无菌水混匀,即得10-1的稀释液,再取1ml10-1的稀释液与9ml无菌水混匀,即得10-2的稀释液,依稀类推,制备10-3,10-4,10-5,10-6,10-7等一系列稀释液。选用的稀释度为10-5、10-6、10-7的土壤稀释液,用移液器分别吸取100ml于lb培养基平板中央,用涂布器将稀释液涂抹均匀,32℃恒温培养1~3d。挑取单菌落,划线成纯培养物,保存。
将上述获得的若干株纯培养物进行平板对峙试验,用接种环挑取一环纯化的菌落,点在距pda平板中央两端3cm处,以尖孢镰刀菌、立枯丝核菌、禾谷镰刀菌、假禾谷镰刀菌、胶胞炭疽菌、链格孢菌、小麦根腐平脐蠕孢菌等植物病原真菌为靶标病原菌,用打孔器切下直径为5mm的菌盘接种于pda平板中央,28℃培养48h后,测量抑菌带宽度,筛选获得抗菌谱广、抗菌效果强的拮抗细菌m4-1菌株。
pda培养基组分:马铃薯200.0g,牛肉膏5.0g,葡萄糖20.0g,琼脂15.0g,(nh4)2so41.0g,mgso41.0g,kh2po40.6g,caco33.0g,ph6.8~7.2,水1.0l。
实施例2
m4-1菌株的鉴定
(1)菌体形态与菌落特征
m4-1菌株在lb固体平板上的菌落呈白色,表面湿润,边缘不整齐,随培养时间延长,菌落表面形成微小皱褶,菌落中间稍微隆起,显微镜下观察的菌体形态呈杆状。
(2)生理生化特征
m4-1菌株的生理生化特征见表1。该菌株需氧性为兼性厌氧;接触酶、硝酸盐还原、明胶液化、淀粉水解、柠檬酸盐利用、v-p测定、甲基红试验、h2s试验、葡萄糖产气试验、mr试验等反应呈阳性;吲哚试验和苯丙氨酸脱氨酶试验呈阴性;可在nacl浓度为5%和10%的液体lb培养基中生长。
液体lb培养基组分:蛋白胨10.0g,酵母粉5.0g,nacl10.0g,水1.0l。
表1m4-1菌株的生理生化特征
注:+,为阳性;-,为阴性。
(3)菌株16srdna序列分析
m4-1菌株的16srdna序列如下:
ccccagacggagcctatactgcaagtcgagcggacagatgggagcttgctccctgatgttagcggcggacgggtgagtaacacgtgggtaacctgcctgtaagactgggataactccgggaaaccggggctaataccggatggttgtctgaaccgcatggttcagacataaaaggtggcttcggctaccacttacagatggacccgcggcgcattagctagttggtgaggtaacggctcaccaaggcgacgatgcgtagccgacctgagagggtgatcggccacactgggactgagacacggcccagactcctacgggaggcagcagtagggaatcttccgcaatggacgaaagtctgacggagcaacgccgcgtgagtgatgaaggttttcggatcgtaaagctctgttgttagggaagaacaagtgccgttcaaatagggcggcaccttgacggtacctaaccagaaagccacggctaactacgtgccagcagccgcggtaatacgtaggtggcaagcgttgtccggaattattgggcgtaaagggctcgcaggcggtttcttaagtctgatgtgaaagcccccggctcaaccggggagggtcattggaaactggggaacttgagtgcagaagaggagagtggaattccacgtgtagcggtgaaatgcgtagagatgtggaggaacaccagtggcgaaggcgactctctggtctgtaactgacgctgaggagcgaaagcgtggggagcgaacaggattagataccctggtagtccacgccgtaaacgatgagtgctaagtgttagggggtttccgccccttagtgctgcagctaacgcattaagcactccgcctggggagtacggtcgcaagactgaaactcaaaggaattgacgggggcccgcacaagcggtggagcatgtggtttaattcgaagcaacgcgaagaaccttaccaggtcttgacatcctctgacaatcctagagataggacgtccccttcgggggcagagtgacaggtggtgcatggttgtcgtcagctcgtgtcgtgagatgttgggttaagtcccgcaacgagcgcaacccttgatcttagttgccagcattcagttgggcactctaaggtgactgccggtgacaaaccggaggaaggtggggatgacgtcaaatcatcatgccccttatgacctgggctacacacgtgctacaatggacagaacaaagggcagcgaaaccgcgaggttaagccaatcccacaaatctgttctcagttcggatcgcagtctgcaactcgactgcgtgaagctggaatcgctagtaatcgcggatcagcatgccgcggtgaatacgttcccgggccttgtacacaccgcccgtcacaccacgagagtttgtaacacccgaagtcggtgaggtaacctttatgagccagccgccgtaacgtgacagcggg
将此序列与genbank数据库中序列进行blast分析比对,发现与其同源性较高的菌株均属于芽孢杆菌属,选取7株与m4-1菌株序列相似性较高的菌株进行系统发育分析,利用mega5.0软件,采取neighbor-joining法构建以16srdna全序列为基础的系统进化树(附图1)。m4-1菌株的16srdna序列同公开发表的bacillusmethylotrophicus(eu194897)的16srdna的同源性达到100%,结合其菌体形态、菌落特征和生理生化特征,鉴定m4-1菌株为芽孢杆菌属(bacillus)。
(4)菌株gyrb序列分析
m4-1菌株的gyrb序列如下:
atgtctcgtaagagtatactgtctttggatacgcgctttttcaagattaaaatcttctccgattcctgttccgagggccgtgatcattgatctgacctcattgtttgagagaatcttatcaagtctggctttctcaacgttcagaatcttaccgcgcagcggcagaatggcttggaaatgacggtcccgtccctgtttcgctgatccgcccgcagagtcaccctctacgatatacagctcggaaatgctcggatctttagaagaacagtccgccagtttgcccggcagattggaaatctcaagcgcacttttgcgccgggtcaattcccgggcttttttcgccgccatccgcgctcttgcggccattaaacctttttcaacgattttgcgggctgagtccggattttcaagaaggaatgtttccagcgcagaagaaaacagcgtatcagtgatcgttctcgcttcggagttgccgagcttggttttcgtctgcccttcgaattgcggatcagggtgcttaattgaaataatggcagtcagcccttctctcacatcatccccgcttaaattcggatcattttctttgaaaatcccttttcttcttgcatagtcgtttatgacacgggtcagaccggttttaaatccggcctcgtgcgtgccgccttcgtatgtgttgatattatttgtgaaagaataaatattgcttgtatagctgtcgttgtattgcaatgcaacttcaaccgttatgccgtctttctcgccttcgatataaatcggctcttcatgaacgacttctttggaacggtttaagtactcaacatagcttttgattccgccttcgtagtggtactcgtttttccgttcttgtccttcacgtttgtcttcaatcgtgatgtttacgccttttgtcaggaaggccaattcccggacacggtttgaaagcagatcatagtcatatacagttgtttctttgaaaatttccgggtccggaacgaagtgcgtaatcgttccggtcttatcagtttcgccgatcacttcaagatcggccacaggtacaccgcgctcgtacgcctgataatggatttttccgtcacgatgaaccgtaacgtcaagagtggtcgacaaggcgtttacgacggatgcccctacaccgtgaagaccgccggatacttttatatccgctccccgttg
将此序列与genbank数据库中序列进行blast分析比对,发现与其同源性较高的菌株均属于芽孢杆菌属,选取7株与m4-1菌株序列相似性较高的菌株进行系统发育分析,利用mega5.0软件,采取neighbor-joining法构建以gyrb全序列为基础的系统进化树(附图2)。m4-1菌株的gyrb序列同公开发表的bacillusmethylotrophicus(cp011937)的16srdna的同源性达到100%,结合其菌体形态、菌落特征和生理生化特征,鉴定m4-1菌株为甲基营养型芽孢杆菌(bacillusmethylotrophicus),命名为甲基营养型芽孢杆菌(bacillusmethylotrophicus)m4-1。
实施例3
m4-1菌株rep-pcr基因指纹图谱分析。
1、m4-1菌株基因组dna提取
采用tiangen细菌基因组dna提取试剂盒dp302
(1)取细菌培养液1-5ml,10000rpm离心1min,尽量吸净上清;
(2)向菌体沉淀中加入110mlte缓冲液和70ml溶菌酶(终浓度为20μg/ml),37℃处理30min以上;
(3)向管中加入20mlproteinasek溶液,混匀;
(4)加入200ml缓冲液gb震荡15sec,70℃放置10min,溶液应变清亮,简短离心10-15s以去除管盖内壁的水珠;
(5)加入220ml无水乙醇,充分振荡混匀15sec,此时可能会出现絮状沉淀,简短离心10-15s以去除管盖内壁的水珠;
(6)将上一步所得溶液和絮状沉淀都加入一个吸附柱cb3中(吸附柱放入收集管中),12000rpm离心30sec,倒掉废液,将吸附柱cb3放入收集管中;
(7)向吸附柱cb3中加入500ml缓冲液gd(使用前请先检查是否已加入无水乙醇),12000rpm离心30sec,倒掉废液,将吸附柱cb3放入收集管中;
(8)向吸附柱cb3中加入600ml漂洗液pw(使用前请先检查是否已加入无水乙醇),12000rpm离心30sec,倒掉废液,将吸附柱cb3放入收集管中;
(9)重复操作步骤8;
(10)将吸附柱cb3放回收集管中,12000rpm离心2min,倒掉废液。将吸附柱cb3置于室温放置10-15min分钟,以彻底晾干吸附材料中残余的漂洗液。
(11)将吸附柱cb3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50-200ml洗脱液te,室温放置2-5min,12000rpm离心2min,将溶液收集到离心管中,离心管所收集的溶液即为m4-1菌株基因组dna。
2、rep-pcr
本发明通过box、eric两种引物对m4-1菌株基因组dna进行rep-pcr。m4-1菌株rep-pcr引物序列见表2。
表2m4-1菌株rep-pcr引物序列
box-air引物扩增体系(50ml)为:10×taqpcrmastermix25ml,模板1ml,box-air2ml,用ddh2o补齐至50ml。rep-pcr反应条件如下:95℃7min;94℃1min,53℃1min,65℃8min,35个循环;65℃16min;4℃pause。pcr产物进行1.5%的琼脂糖凝胶电泳,电解液为1×tae,选取trans8kdnamarker作为marker。
eric1r、eric2引物扩增体系(50ml)为:10×taqpcrmastermix25ml,模板1ml,eric1r引物1ml,eric2引物1ml,用ddh2o补齐至50ml。反应条件如下:95℃7min;94℃1min,53℃1min,65℃8min,35个循环;65℃16min;4℃pause。pcr产物进行2%的琼脂糖凝胶电泳,电解液为1×tae,选取normalruntm250bp-ivdnaladder作为marker。
采用box-air引物对m4-1菌株与本实验室分离并保藏的其他9株甲基营养型芽孢杆菌的基因组dna进行rep-pcr,其产物在1.5%浓度琼脂糖凝胶电泳中基因指纹图谱见图3a。
采用eric1r引物、eric2和box-air引物对m4-1菌株基因组dna进行rep-pcr,其产物在2%浓度琼脂糖凝胶电泳中基因指纹图谱见图3b。
通过对菌株基因指纹图谱的条带进行对比分析,找到菌株重复序列单元的数量和在染色体分布上的特征,这些重复序列分布在细菌基因组上的不同位点,并以不同的距离分隔,存在种属水平和同种不同株间的差异。
本发明分离获得的m4-1菌株已保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为cgmccno.15774。对m4-1菌株16srdna、gyrb序列进行比对鉴定,对box、eric两种引物扩增后基因指纹图谱表现出的特征条带进行反复验证,m4-1菌株与其他甲基营养型芽孢杆菌在条带大小及数量上存在明显差异,特定引物下,m4-1菌株的条带信息具有特异性。m4-1菌株的16srdna、gyrb鉴定及基因指纹图谱信息,能对m4-1菌株的准确识别、鉴定提供依据。
实施例4
1、m4-1菌株的耐盐性试验
(1)菌种活化
将4℃保存的甲基营养型芽孢杆菌m4-1划线或涂布接种于固体lb培养基平板上,32℃培养24~36h;挑取单菌落再次划线转接于固体lb培养基平板上,32℃培养16~30h,备用。
(2)种子液制备
用接种环刮取2环步骤(1)活化后的m4-1菌株菌苔,接种于液体lb培养基中,32℃,200~220r/min,摇瓶培养16h得到种子液。
(3)耐盐性试验:
吸取步骤(2)种子液以2%(体积比)的接种量接种到nacl浓度分别为50g/l、100g/l、150g/l、200g/l、250g/l、300g/l、350g/l浓度的液体lb培养基中培养24h,设置三次重复,分别吸取上述不同nacl浓度的液体lb培养基200μl划线或涂布于固体lb平板上。
结果表明,m4-1菌株具有极高的耐盐性,能够耐受350g/l的盐浓度,在50-150g/l盐浓度的液体lb培养基中生长旺盛,在200-300g/l盐浓度的液体lb培养基中生长良好,在350g/l盐浓度的液体lb培养基中仍可以生长,耐盐试验结果见表3。
表3m4-1菌株在不同naci浓度液体lb培养基中生长状况
注:+++,生长旺盛;++,生长良好;+,可以生长。
2、m4-1菌株在水溶肥中的存活率试验
(1)m4-1菌株在液体水溶肥中的存活率
试验选用山东农大肥业科技有限公司液体水溶肥(超速硝钾-含腐殖酸水溶肥料)产品,该产品主要成分为:大量元素≥400g/l,总氮≥360g,钾≥45g/l,腐殖酸≥30g/l,硝态氮≥90g/l,铵态氮≥90g/l,酰胺态氮≥180g/l。
将m4-1菌株发酵液(芽孢率95%以上)以10%(体积比)加入液体水溶肥中,混合均匀,密封储存于阴凉处,每隔30d测定一次水溶肥中的菌体数量,连续测定240d。结果显示,液体水溶肥中菌体数量没有大幅下降,总体水平较高,损失率较低。经过为期240d的试验,菌体存活率为84.56%,试验结果见表4。
表4m4-1菌株在液体水溶肥中的菌体数量变化
(2)m4-1菌株在固体水溶肥中的存活率
试验选用山东农大肥业科技有限公司固体水溶肥(硝铵黄钾-含腐殖酸水溶肥料)产品,该产品主要成分为:n-p2o5-k2o=17-5-23,大量元素≥45%,硝态氮≥9%,黄腐酸≥3%。
将m4-1菌株发酵液(芽孢率95%以上)以10%(体积比)加入固体水溶肥中,混合均匀,密封储存于阴凉处,每隔30d测定一次水溶肥中的菌体数量,连续测定240d。结果显示,固体水溶肥中菌体数量变化趋势平稳,总体水平较高,菌体损失率较低,经过为期240d的试验,菌体存活率为75.44%,试验结果见表5。
表5m4-1菌株在固体水溶肥中菌体数量变化
实施例4中:
所述的液体lb培养基组分为:蛋白胨10g,酵母粉5g,nacl10g,水1l。
所述的固体lb培养基组分为:蛋白胨10g,酵母粉5g,nacl10g,琼脂15g,水1l。
所述的m4-1菌株发酵液组分为:玉米粉25.0g、蔗糖10.0g,黄豆饼粉10.0g,磷酸二氢钾4.0g,硫酸铵4.0g,硫酸镁2.5g,水1.0l。
实施例5
1、m4-1菌株在小麦、玉米、蔬菜和果树根际的定殖能力测定
(1)m4-1菌株的双抗生素筛选及稳定性检测
刮取2环活化好的m4-1菌株菌苔接种到不含利福平的液体lb培养基中,30℃,200r/min培养24h,作为种子液。将种子液以2%(体积比)的接种量接种到含5μg/ml利福平(rif)的液体lb培养基中,摇瓶培养24h;将该培养液以2%(体积百分比)的接种量接种到含10μg/ml利福平的液体lb培养基中,摇瓶培养24h;依次类推,使利福平的浓度逐渐由5μg/ml、10μg/ml、20μg/ml、40μg/ml、80μg/ml、150μg/ml直至增加到300μg/ml,培养得到抗利福平的菌株。将得到的抗利福平菌株接种到含300μg/ml利福平和5μg/ml壮观霉素(spe)的液体lb培养基中,对同时抗利福平和壮观霉素的双抗菌株进行筛选,筛选过程中,液体lb培养基中利福平的浓度为300μg/ml,抗壮观霉素菌株与抗利福平菌株抗生素浓度的递加及筛选方法相同,最终获得同时抗利福平和壮观霉素的双抗生素标记菌株。
将筛选的双抗标记菌株在不含利福平和壮观霉素的固体lb培养基和液体lb培养基中,传代培养5代,再分别回接到含利福平300μg/ml和壮观霉素300μg/ml的液体lb培养基中进行培养,以证实m4-1菌株耐药稳定性,最终获得能够稳定遗传并且同时抗利福平和壮观霉素的双抗标记菌株。
刮取2环活化好的m4-1双抗标记菌株菌苔接种到液体lb培养基中,30℃、200r/min振荡培养18-20h,作为种子液。将种子液以2%(体积比)的接种量接种到同时含有利福平300μg/ml和壮观霉素300μg/ml的液体lb培养基中,32℃、200-220r/m振荡培养18-20h;再将该培养液以2%(体积比)的接种量接种到液体lb培养基中,32℃、200-220r/mim振荡培养18-20h,即得到m4-1菌株的双抗生素标记菌株菌液。
盐碱土取自黄河三角洲,通过盆栽试验,研究m4-1菌株的双抗生素标记菌株在3‰盐碱土中种植的小麦、玉米、辣椒和苹果根际的定殖能力。花盆内径22cm,小麦每盆种植5棵,玉米每盆种植4棵,辣椒每盆种植3棵,苹果每盆种植2棵,每种作物10个重复。待植株幼苗株高10cm左右,去除植株根部表土,分别接种培养好的m4-1双抗生素标记菌株菌液,每盆接种菌液10ml,灌根,将表土覆盖好。接种菌液后的第10、20、30、40d、50d分别取根际土样,检测m4-1双抗生素标记菌株的定殖情况。
分别称取四种作物的10g根际土,加到装有90ml无菌水的三角瓶中,30℃振荡30min,使土壤颗粒及微生物充分分散。用移液器吸取1ml土壤悬液,加到9ml无菌水中,振荡混匀,制得10-2土壤稀释液,再从10-2土壤稀释液中吸取1ml加到9ml无菌水中,充分混匀制得10-3土壤稀释液,以此类推,制备10-2、10-3、10-4系列梯度的土壤稀释液,用移液枪吸取10-4稀释度稀释液200μl,涂布在同时含有壮观霉素300μg/ml和利福平300μg/ml的pda平板培养基中涂布计数。
本实施例中:所述pda平板培养基组分:马铃薯200.0g,牛肉膏5.0g,葡萄糖20.0g,琼脂15.0g,(nh4)2so41.0g,mgso41.0g,kh2po40.6g,caco33.0g,ph6.8~7.2,水1.0l。
试验结果表明,m4-1菌株在小麦、玉米、辣椒、苹果根际定殖数量较高,试验50d后,根际土中菌体数量虽有一定程度的下降,但均在2.15×104cfu/g以上,说明m4-1菌株能够在小麦、玉米、辣椒、苹果根际中稳定定殖,试验结果见表6。
表6m4-1菌株在小麦、玉米、辣椒和苹果根际的定殖结果
实施例5中:
所述的固体lb培养基组分:蛋白胨10g,酵母粉5g,nacl10g,琼脂15g,水1l。
所述的液体lb培养基组分:蛋白胨10g,酵母粉5g,nacl10g,水1l。
实施例6
m4-1菌株对多种植物病原真菌的拮抗效果。
用接种环挑取一环纯化的m4-1菌株菌苔,接种在距pda平板培养基中央两端2.5cm处,以立枯丝核菌、禾谷镰刀菌、胶胞炭疽菌、链格孢菌、小麦根腐平脐蠕孢菌、尖孢镰刀菌、假禾谷镰刀菌、杨树溃疡病菌这8种病原真菌为靶标,用打孔器取直径为5mm的菌盘接种于pda平板中央,30℃培养2-3d,测量抑菌带宽度。试验结果表明m4-1菌株对供试的8株病原真菌有较好的拮抗效果,试验结果见表7,m4-1菌株的抗菌谱见附图4。
表7m4-1菌株对各种病原真菌的相对抑菌率
本实施例中:所述的pda平板培养基组分:马铃薯200.0g,牛肉膏5.0g,葡萄糖20.0g,琼脂15.0g,(nh4)2so41.0g,mgso41.0g,kh2po40.6g,caco33.0g,ph6.8~7.2,水1.0l。
实施例7
m4-1菌株产芽孢发酵培养基组分及发酵条件优化
(1)基础发酵培养基的筛选
发明人基于培养基组成成分简单、来源方便和成本低等原则,对m4-1菌株基础发酵培养基组分进行筛选,通过对初始发酵组分发酵液中菌体数量及产芽孢时间的分析,获得发酵性状较好的基础培养基组分为:玉米粉25.0g、蔗糖10.0g、黄豆饼粉10.0g、磷酸二氢钾1.8g,硫酸铵1.5g,硫酸镁2.5g,水1.0l。
(2)发酵时间对发酵液菌体数量及芽孢率的影响
不同发酵时间对菌体数量及芽孢率有显著影响。发酵时间从12h至48h,菌体数量及芽孢率呈递增趋势,48h至72h菌体数量及芽孢率均出现先下降后上升趋势,36h与48h芽孢率较高,且无显著差异(p>0.05),发酵时间为48h时,发酵液中菌体数量达到最高值,且存在显著差异(p<0.05),故选择发酵时间为48h,结果见图5a。
(3)发酵温度对发酵液菌体数量及芽孢率的影响
设置不同发酵温度,研究不同发酵温度对菌体数量及芽孢率的影响。不同发酵温度对菌体数量和芽孢率存在显著影响,随着发酵温度的提高,菌体数量及芽孢率呈递增趋势,当温度高于32℃时,菌体数量及芽孢率出现下降趋势,当发酵温度为32℃时,发酵液中菌体数量及芽孢率最高,故选择发酵温度为32℃,结果见图5b。
(4)接种量对发酵液菌体数量及芽孢率的影响
设置不同接种量,研究不同接种量对菌体数量及芽孢率的影响。接种量为2%、4%、6%、8%、10%时,菌体数量及芽孢率存在显著差异(p<0.05),当接种量为6%时,发酵液中菌体数量及芽孢率最高且达到显著水平,故选择接种量为6%,结果见图5c。
(5)磷酸二氢钾质量浓度对发酵液菌体数量及芽孢率的影响
设置不同磷酸二氢钾含量,研究不同磷酸二氢钾含量对菌体数量及芽孢率的影响。磷酸二氢钾添加量为2g、3g时菌体数量及芽孢率有显著差异(p<0.05),而接种量为1g、2g时,菌体数量及芽孢率在较低水平,无显著性差异(p>0.05),当接种量在3g、4g、5g时,菌体数量及芽孢率均在较高水平,无显著性差异(p>0.05),当磷酸二氢钾添加量为4g时,发酵液中菌体数量最高,芽孢率达到90%以上,故选择磷酸二氢钾添加量为4g,结果见图5d。
(6)硫酸镁质量浓度对发酵液菌体数量及芽孢率的影响
设置不同硫酸镁添加量,研究不同硫酸镁含量对菌体数量及芽孢率的影响。硫酸镁添加量为0.5~1.5g/l时菌体数量及芽孢率均呈上升趋势,添加量为1.5~2.5g/l时芽孢率无显著差异(p>0.05),均在较高水平,但菌体数量呈先下降后上升的趋势,存在显著差异(p<0.05),当硫酸镁添加量为2.5g时,发酵液中菌体数量及芽孢率最高,故选择硫酸镁添加量为2.5g,结果见图5e。
(7)硫酸铵质量浓度对发酵液菌体数量及芽孢率的影响
设置不同硫酸铵添加量,研究不同硫酸铵含量对菌体数量及芽孢率的影响。硫酸铵添加量为1g、2g时菌体数量及芽孢率均在较低水平,而添加量为3g、4g、5g时,菌体数量及芽孢率均在较高水平,当添加为3g、4g时,菌体数量及芽孢率无显著性差异(p>0.05),当铵添加量为4g时,发酵液中菌体数量最高,芽孢率达到90%以上,故选择硫酸铵添加量为4g,结果见图5f。
经过产芽孢发酵组分优化,确定m4-1菌株的最优发酵组分为:玉米粉25.0g、蔗糖10.0g、黄豆饼粉10.0g、磷酸二氢钾4.0g、硫酸铵4.0g、硫酸镁2.5g、水1.0l。发酵时间为48h,发酵温度32℃,接种量6%。发酵液中菌体数量达到95.35×108cfu/ml。
实施例8
m4-1菌剂的制备
(1)菌种活化:将4℃保存的甲基营养型芽孢杆菌m4-1划线接种于lb固体培养基平板上,32℃培养24~36h;挑取单菌落再次划线转接于lb固体培养基平板上,32℃培养16~24h,备用。
lb固体培养基组分为:蛋白胨10.0g,酵母粉5.0g,nacl10.0g,琼脂15.0g,水1.0l。
(2)一级种子液制备:用接种环刮取2环步骤(1)活化后的m4-1菌株菌苔,接种于lb液体培养基(一级种子液培养基)中,32℃,200~220r/min,摇瓶培养16h得到一级种子液。
所述一级种子液培养基组分:蛋白胨10.0g,酵母粉5.0g,nacl10.0g,水1.0l。
(3)二级种子液制备:将步骤(2)制得的一级种子液按照二级种子培养基1~2%(体积百分比)的比例接种到种子罐中发酵培养;转速120r/min,温度32℃,通气量1:1~1:1.2,发酵罐压强0.05-0.06mpa,培养12h-16h,作为二级种子液。
所述二级种子培养基组分为:玉米粉25.0g,蔗糖10.0g,黄豆饼粉10.0g,磷酸二氢钾4.0g,硫酸铵4.0g,硫酸镁2.5g,水1.0l。
(4)发酵培养:将步骤(3)所得二级种子液按照10%(体积比)接种到发酵培养基中发酵培养;转速120r/min,温度为32℃,通气量1:1~1:1.2,发酵罐压强0.05~0.06mpa,培养时间为20~30h,得到m4-1菌株液体菌剂。
所述发酵培养基组分为:玉米粉25.0g,蔗糖10.0g,黄豆饼粉10.0g,磷酸二氢钾4.0g,硫酸铵4.0g,硫酸镁2.5g,水1.0l。
(5)固体菌剂制备:将步骤(4)获得的m4-1菌株液体菌剂,6000~8000r/min离心20~30min,去除离心上清液,向沉淀物中缓慢加入硅藻土或玉米粉作为载体基质,加入硅藻土或玉米粉的量为液体菌剂重量的6~8%,搅拌均匀后进行喷雾干燥,通过雾化器(65℃左右)的分散和高温空气(180℃)迅速蒸干,料液中的固体物质经旋风分离器收集,即得m4-1菌株固体菌剂。
实施例8中涉及的液体lb培养基组分:蛋白胨10g,酵母粉5g,nacl10g,水1l。
实施例8中涉及的固体lb培养基组分:蛋白胨10g,酵母粉5g,nacl10g,琼脂15g,水1l。
实施例9
m4-1菌剂的应用
(1)盆栽试验1:m4-1菌剂对小麦根际禾谷镰刀菌的拮抗作用
试验选用山东省黄河三角洲盐度3‰盐碱土壤,将小麦种子用清水冲洗干净,75%乙醇浸泡10min,30%次氯酸钠浸泡30-60s,再用无菌水冲洗5-6次、晾干。挑选质量、大小均匀一致的小麦种子播种到内径40cm的塑料盆中,10粒/盆,6个重复。待小麦出芽后,选择长势一致的小麦幼苗,进行施加m4-1菌剂处理,同时设置不加m4-1菌剂的空白对照。
病原真菌禾谷镰刀菌孢子悬浮液的制备:用直径7mm的打孔器将pda平板培养的禾谷镰刀菌打成均匀一致的菌饼,每瓶取三个菌饼接种于察氏培养基中,200-220r/min,32℃培养5-7d,过滤,无菌水稀释,使其浓度达到5×106cfu/ml。
察氏培养基组分:硝酸钠3.00g,磷酸氢二钾1.00g,七水硫酸镁0.50g,氯化钾0.50g,硫酸亚铁0.01g,蔗糖30.00g,琼脂20.00g,水1.00l。
pda培养基组分:马铃薯200.0g,牛肉膏5.0g,葡萄糖20.0g,琼脂15.0g,(nh4)2so41.0g,mgso41.0g,kh2po40.6g,caco33.0g,ph6.8~7.2,水1.0l。
本试验设置处理组和对照组各一组。处理组:加禾谷镰刀菌孢子悬浮液和m4-1液体菌剂各10ml;对照组:加禾谷镰刀菌孢子悬浮液和灭活的m4-1液体菌剂各10ml。加菌后每隔10天取小麦根际土样,提取土壤总dna,通过实时荧光定量pcr技术对土壤中禾谷镰刀菌数量进行监测,连续测定50d,试验结果见表8。
表8实时荧光定量pcr-禾谷镰刀菌数量监测结果
注:表中数据为3次重复的平均值±标准误差。同行中数据后缀字母不同表示不同处理组之间存在显著差异(p<0.05),字母相同则表示不同处理组之间差异不显著。
从试验结果来看,对照组小麦根际禾谷镰刀菌的数量在10d、20d、30d、40d和第50d均呈现先下降后上升的情况,这是由于刚开始将高浓度的禾谷镰刀菌孢子悬浮液加入到小麦根际土中后,短时间内,小麦根际土中禾谷镰刀菌的数量会维持在一个较高的浓度;随着时间延长,病原菌在定殖过程中会有部分死亡,数量急剧下降;待其定殖达到稳定期时,存活下来的禾谷镰刀菌在小麦根际开始繁殖,数量再次增加,并维持在一个相对稳定的水平。试验数据经sas分析表明,处理组的小麦根际土于5个不同时间点取样,监测到的镰刀菌的数量显著低于对照组,说明m4-1菌株在小麦根际的定殖能够显著抑制小麦根际土中禾谷镰刀菌的数量。
(2)田间小区试验
田间小区试验设计。
本试验在山东农业大学实验站进行,共设2个处理,2个对照。处理1:接种小麦根腐平脐蠕孢菌和m4-1菌剂;处理2:接种假禾谷镰刀菌、禾谷镰刀菌和m4-1菌剂;ck1:接种小麦根腐平脐蠕孢菌和灭活m4-1菌剂;ck2:接种假禾谷镰刀菌、禾谷镰刀菌和灭活m4-1菌剂。试验共设置12个小区,每个小区面积设定为25m2,随机区组排列,每个处理和对照均设置3个重复,每个小区种植8行小麦。
病原菌固体培养物制备:
小麦根腐病和茎基腐病病原菌:小麦根腐平脐蠕孢菌、假禾谷镰刀菌和禾谷镰刀菌由本实验室保存。取麦粒3kg,分装在3个可灭菌的袋中(袋口用卷好的棉花堵住,用绳子系好),每袋1kg,放到高温灭菌锅中121℃灭菌20min,灭菌后取出自然降温至常温,在无菌工作台中,将准备的小麦根腐平脐蠕孢菌、假禾谷镰刀菌和禾谷镰刀菌平板(9cm直径,长满菌丝的平板)各装到1袋灭菌的麦粒中,系好口,光照培养箱暗培养15~20天左右,自然风干,分别得到小麦根腐平脐蠕孢菌、假禾谷镰刀菌和禾谷镰刀菌的固体培养物。
施加病原菌方法:
小麦拔节时,将小麦根腐平脐蠕孢菌、假禾谷镰刀菌和禾谷镰刀菌的固体培养物撒在小麦基部,保湿2~3天后添加m4-1固体菌剂,处理两次,两次间隔15天。
病原菌及m4-1菌剂施加量:
小麦根腐平脐蠕孢菌固体培养物100g/小区(约2.6kg/亩);禾谷镰刀菌、假禾谷镰刀菌固体培养物80g/小区(约2.0kg/亩)。m4-1固体菌剂施加量为80g/小区(约2.0kg/亩)。
m4-1菌剂对小麦根腐病和茎基腐病的防治效果。
在小麦灌浆期末、成熟期前阶段进行发病率统计,试验结果见表9。未经m4-1菌剂处理的ck1和ck2,发病率分别为48.3%和56.7%;施加m4-1菌剂的处理1和处理2,发病率分别为10.82%和12.34%,m4-1菌剂的防病效果分别为77.63%和78.25%。试验结果表明由m4-1菌株制备的m4-1菌剂对由小麦根腐平脐蠕孢菌、假禾谷镰刀菌和禾谷镰刀菌引起的小麦根腐病和茎基腐病具有较好的防治效果。
表9m4-1菌剂的田间防效小区试验结果
序列表
<110>山东农业大学
<120>一株耐盐拮抗菌及其菌剂的制备和应用
<160>5
<170>siposequencelisting1.0
<210>1
<211>1453
<212>dna
<213>人工序列(人工序列)
<400>1
ccccagacggagcctatactgcaagtcgagcggacagatgggagcttgctccctgatgtt60
agcggcggacgggtgagtaacacgtgggtaacctgcctgtaagactgggataactccggg120
aaaccggggctaataccggatggttgtctgaaccgcatggttcagacataaaaggtggct180
tcggctaccacttacagatggacccgcggcgcattagctagttggtgaggtaacggctca240
ccaaggcgacgatgcgtagccgacctgagagggtgatcggccacactgggactgagacac300
ggcccagactcctacgggaggcagcagtagggaatcttccgcaatggacgaaagtctgac360
ggagcaacgccgcgtgagtgatgaaggttttcggatcgtaaagctctgttgttagggaag420
aacaagtgccgttcaaatagggcggcaccttgacggtacctaaccagaaagccacggcta480
actacgtgccagcagccgcggtaatacgtaggtggcaagcgttgtccggaattattgggc540
gtaaagggctcgcaggcggtttcttaagtctgatgtgaaagcccccggctcaaccgggga600
gggtcattggaaactggggaacttgagtgcagaagaggagagtggaattccacgtgtagc660
ggtgaaatgcgtagagatgtggaggaacaccagtggcgaaggcgactctctggtctgtaa720
ctgacgctgaggagcgaaagcgtggggagcgaacaggattagataccctggtagtccacg780
ccgtaaacgatgagtgctaagtgttagggggtttccgccccttagtgctgcagctaacgc840
attaagcactccgcctggggagtacggtcgcaagactgaaactcaaaggaattgacgggg900
gcccgcacaagcggtggagcatgtggtttaattcgaagcaacgcgaagaaccttaccagg960
tcttgacatcctctgacaatcctagagataggacgtccccttcgggggcagagtgacagg1020
tggtgcatggttgtcgtcagctcgtgtcgtgagatgttgggttaagtcccgcaacgagcg1080
caacccttgatcttagttgccagcattcagttgggcactctaaggtgactgccggtgaca1140
aaccggaggaaggtggggatgacgtcaaatcatcatgccccttatgacctgggctacaca1200
cgtgctacaatggacagaacaaagggcagcgaaaccgcgaggttaagccaatcccacaaa1260
tctgttctcagttcggatcgcagtctgcaactcgactgcgtgaagctggaatcgctagta1320
atcgcggatcagcatgccgcggtgaatacgttcccgggccttgtacacaccgcccgtcac1380
accacgagagtttgtaacacccgaagtcggtgaggtaacctttatgagccagccgccgta1440
acgtgacagcggg1453
<210>2
<211>1191
<212>dna
<213>人工序列(人工序列)
<400>2
atgtctcgtaagagtatactgtctttggatacgcgctttttcaagattaaaatcttctcc60
gattcctgttccgagggccgtgatcattgatctgacctcattgtttgagagaatcttatc120
aagtctggctttctcaacgttcagaatcttaccgcgcagcggcagaatggcttggaaatg180
acggtcccgtccctgtttcgctgatccgcccgcagagtcaccctctacgatatacagctc240
ggaaatgctcggatctttagaagaacagtccgccagtttgcccggcagattggaaatctc300
aagcgcacttttgcgccgggtcaattcccgggcttttttcgccgccatccgcgctcttgc360
ggccattaaacctttttcaacgattttgcgggctgagtccggattttcaagaaggaatgt420
ttccagcgcagaagaaaacagcgtatcagtgatcgttctcgcttcggagttgccgagctt480
ggttttcgtctgcccttcgaattgcggatcagggtgcttaattgaaataatggcagtcag540
cccttctctcacatcatccccgcttaaattcggatcattttctttgaaaatcccttttct600
tcttgcatagtcgtttatgacacgggtcagaccggttttaaatccggcctcgtgcgtgcc660
gccttcgtatgtgttgatattatttgtgaaagaataaatattgcttgtatagctgtcgtt720
gtattgcaatgcaacttcaaccgttatgccgtctttctcgccttcgatataaatcggctc780
ttcatgaacgacttctttggaacggtttaagtactcaacatagcttttgattccgccttc840
gtagtggtactcgtttttccgttcttgtccttcacgtttgtcttcaatcgtgatgtttac900
gccttttgtcaggaaggccaattcccggacacggtttgaaagcagatcatagtcatatac960
agttgtttctttgaaaatttccgggtccggaacgaagtgcgtaatcgttccggtcttatc1020
agtttcgccgatcacttcaagatcggccacaggtacaccgcgctcgtacgcctgataatg1080
gatttttccgtcacgatgaaccgtaacgtcaagagtggtcgacaaggcgtttacgacgga1140
tgcccctacaccgtgaagaccgccggatacttttatatccgctccccgttg1191
<210>3
<211>16
<212>rna
<213>人工序列(人工序列)
<400>3
agaagcccggggacac16
<210>4
<211>18
<212>rna
<213>人工序列(人工序列)
<400>4
aagaaggacgggggagcg18
<210>5
<211>20
<212>rna
<213>人工序列(人工序列)
<400>5
cacggcaaggcgacgcgacg20
- 还没有人留言评论。精彩留言会获得点赞!