具有调节免疫功能的复合菌剂及其制备方法和应用与流程
本发明涉及功能性食品领域,具体涉及具有调节免疫功能的复合菌剂及其制备方法和应用。
背景技术:
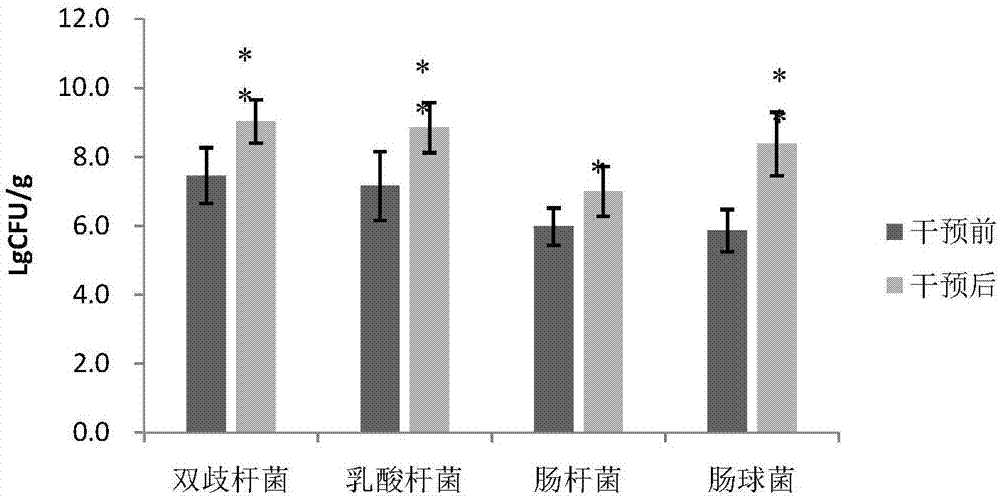
:免疫功能(immunologicfunction;immunefunction;immunologicalfunction;immunity)是指机体对疾病的抵抗力,机体的免疫功能是在淋巴细胞、单核细胞和其他有关细胞及其产物的相互作用下完成的;免疫功能是免疫系统根据免疫识别而发挥的作用。目前,用于调节免疫功能的方式良多,但利用复合菌剂来改善免疫功能方面的研究仍有待进一步深入。技术实现要素:本发明的目的是为了克服现有技术存在的问题,提供具有调节免疫功能的复合菌剂及其制备方法和应用。本发明的发明人在研究中发现格氏乳杆菌、长双歧杆菌和丁酸梭菌三株菌与低聚糖配合时能够有效改善免疫功能,因此,为了实现上述目的,本发明一方面提供了一种具有调节免疫功能的复合菌剂,该复合菌剂含有低聚糖以及活菌数之间的比值为0.5-1.5:0.5-1.5:1的格氏乳杆菌(lactobacillusgasseri)、长双歧杆菌(bifidobacteriumlongum)和丁酸梭菌(clostridiumbutyricum),其中,所述格氏乳杆菌的保藏编号为cgmccno.15501,所述长双歧杆菌的保藏编号为cgmccno.15503,所述丁酸梭菌的保藏编号为cgmccno.15502。本发明第二方面提供了制备上述复合菌剂的方法,该方法包括:混合格氏乳杆菌、长双歧杆菌和丁酸梭菌。本发明第三方面提供了上述复合菌剂在制备用于调节免疫的功能性食品中的应用。本发明第四方面提供了调节免疫的方法,该方法包括将如上所述的复合菌剂给药至受试者。本发明提供的复合菌剂具有良好的调节免疫的作用,能够有效改善机体的免疫功能,增强免疫力。而且,还对增加肠道有益菌群的比例也具有良好的效果。生物保藏本发明的格氏乳杆菌于2018年3月23日被保藏在中国微生物菌种保藏管理委员会普通微生物中心(缩写为cgmcc,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮政编码:100101),保藏编号为cgmccno.15501。本发明的长双歧杆菌于2018年3月22日被保藏在中国微生物菌种保藏管理委员会普通微生物中心(缩写为cgmcc,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮政编码:100101),保藏编号为cgmccno.15503。本发明的丁酸梭菌于2018年3月22日被保藏在中国微生物菌种保藏管理委员会普通微生物中心(缩写为cgmcc,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮政编码:100101),保藏编号为cgmccno.15502。附图说明图1是试验组1粪便菌群在使用复合菌剂干预前后的变化图;图2是试验组2粪便菌群在使用复合菌剂干预前后的变化图。具体实施方式在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。本发明提供的具有调节免疫功能的复合菌剂含有低聚糖以及活菌数之间的比值为0.5-1.5:0.5-1.5:1的格氏乳杆菌、长双歧杆菌和丁酸梭菌,其中,所述格氏乳杆菌的保藏编号为cgmccno.15501,所述长双歧杆菌的保藏编号为cgmccno.15503,所述丁酸梭菌的保藏编号为cgmccno.15502。只要按照上述方式配合使用格氏乳杆菌、长双歧杆菌和丁酸梭菌即可实现本发明的目的,然而,根据本发明的优选实施方式,所述复合菌剂含有活菌数之间的比值为0.9-1.1:0.9-1.1:1(最优选1:1:1)的格氏乳杆菌、长双歧杆菌和丁酸梭菌。本发明中,所述低聚糖可以为本领域常见的以葡萄糖或果糖等为结构单元的低聚糖(含有2-10个糖苷键聚合而成的化合物),优选地,所述低聚糖为低聚果糖。低聚果糖是指2-5个果糖基为链节,以一个葡萄糖基为链的端基,以果糖基→果糖连接键为主体骨架连结形成的碳水化合物,即是指1-4个果糖基以β-2,1键连接在蔗糖的d-果糖基上而形成的蔗果三糖(gf2)、蔗果四糖(gf3)、蔗果五糖(gf4)和蔗果六糖(gf5)的混合物。100克干重菊芋中约有60-70克菊粉,菊粉是通过线性的β-2,1-糖苷链连接的果聚糖,其末端为一蔗糖基,故以菊粉为原料用菊糖内切酶水解作用,经精制最终可得低聚果糖浆。根据本发明更优选的实施方式,所述低聚糖由菊芋糖浆提供。所述菊芋糖浆的糖度(也即干基含量)通常为55-60重量%。菊芋糖浆的提取方法通常包括:提取菊芋块茎得到菊粉,再将菊粉用菊糖内切酶进行水解。根据本发明的优选实施方式,相对于活菌数为107的丁酸梭菌,所述低聚糖的含量为550-850g(如550g、600g、650g、680g、684g、685g、690g、700g、750g、800g、850g或上述数值之间的任意值)。根据本发明,所述复合菌剂可以以各种常规的形态存在,例如,固体粉剂、液体制剂(如菌悬液),根据本发明一种优选的实施方式,所述复合菌剂以固体粉剂的形式存在。固体粉剂可以由微生物菌体与水、甘油、脱脂奶粉、蔗糖、谷氨酸钠和维生素c等辅料,混合均匀后低温冷冻干燥而成。根据本发明,对复合菌剂中总活菌数的含量没有特别的要求,优选地,复合菌剂中的总活菌数为105-108cfu/g,进一步优选为106-107cfu/g(以复合菌剂的干基为基准)。本发明提供的制备上述复合菌剂的方法包括:混合格氏乳杆菌、长双歧杆菌和丁酸梭菌。另外,本发明还提供了如上所述的复合菌剂在制备用于调节肠道菌群和/或增强免疫调节能力的功能性食品中的应用。本发明的复合菌剂能够增强淋巴细胞的增殖能力和nk细胞活性,并调节血清免疫球蛋白(特别是igg1、igg2a、igg2b、igg3、iga、ige)和细胞因子(特别是ifn-γ、il-5和tnf-α)的含量,也即能够改善免疫调节能力。此外,在给药本发明的复合菌剂后,受试者粪便中的双歧杆菌、乳酸杆菌及肠球菌等有益肠道菌的组成比例均有所增加。根据本发明另一种实施方式,还提供了上述复合菌剂在制备用于调节(提高或降低)血清免疫球蛋白(特别是igg1、igg2a、igg2b、igg3、iga和ige)和细胞因子(特别是ifn-γ、il-5和tnf-α)中的至少一种的含量的药剂中的应用。本发明还提供了一种调节免疫的方法,其特征在于,该方法包括将如上所述的复合菌剂给药至受试者。本发明中,对复合菌剂的给药量没有特别的要求,以小鼠为例,所述复合菌剂的给药量以活菌数计为103-104cfu/20g体重/天。本发明中,对给药的方式没有特别的限制,可以采用本领域常规的方式,例如胃肠道给药,更具体如口服、灌胃等。本发明中,所述受试者可以为哺乳动物和/或啮齿类动物,例如,人和/或鼠。以下将通过实施例对本发明进行详细描述。以下实施例中,使用的复合菌剂的组成如下所示:复合菌剂1:保藏编号为cgmccno.15501的格氏乳杆菌、保藏编号为cgmccno.15503的长双歧杆菌和保藏编号为cgmccno.15502的丁酸梭菌,三者活菌数之间的比值为1:1:1,三种菌做成干粉制剂,混匀后待用,总活菌含量为107cfu/g,还含有菊芋糖浆(购自英纽林(北京)科技有限公司,糖度57%,下同)(相对于活菌数为107的丁酸梭菌,糖浆用量为1200g),再用无菌水配制成菌悬液待用,每毫升中总活菌含量为2×103cfu;复合菌剂2:保藏编号为cgmccno.15501的格氏乳杆菌、保藏编号为cgmccno.15503的长双歧杆菌和保藏编号为cgmccno.15502的丁酸梭菌,三者活菌数之间的比值为1:1:1,三种菌做成干粉制剂,混匀后待用,总活菌含量为107cfu/g,还含有菊芋糖浆(相对于活菌数为107的长双歧杆菌,糖浆用量为1200g),再用无菌水配制成菌悬液待用,每毫升中总活菌含量为2×104cfu;复合菌剂3:与复合菌剂1相同,只是不含菊芋糖浆;复合菌剂4:与复合菌剂2相同,只是不含菊芋糖浆。实施例1实验动物:健康雄性成年babl/c小鼠140只,饲养于中国检验检疫科学研究院动物实验室:维持室温(25±2℃),相对湿度(55±2)%,12h/12h光照,自由进食和饮水。实验分组:按照体重,利用随机数字,分为4组,分别为对照组、模型组、试验组1、试验组2、试验组3和试验组4,每组35只;再将每组35只小鼠按体重分为5个小组,每组7只。使用苦味酸编号,普通饲料常规饲养,适应性喂养3天后开始正式实验。建立肠道损伤模型:小鼠禁食16小时,自由饮水,除对照组外,将三硝基苯磺酸(tnbs)溶液缓慢推入小鼠结肠,并迅速堵住小鼠肛门并倒置60s。造模剂量为10mg/kg体重。干预:依据小鼠体重,每日灌胃给予样品(对照组和模型组:蒸馏水;试验组1:复合菌剂1;试验组2:复合菌剂2;试验组3:复合菌剂3;试验组4:复合菌剂4)进行干预,干预剂量为1ml/20g体重。小鼠粪便采集:取无菌离心管,编号,于试验开始前(0天)、3天、7天、14天及28天每组每次采集7只小鼠粪便,-80℃条件下保存,低温条件转移并进行菌群的检测。小鼠血清样品采集:粪便采集结束后,动物取血,分离血清,处死。并于实验开始3天、7天、14天、28天取脾脏进行小鼠淋巴细胞转化实验和nk细胞活性测定。数据统计及结果判定:采用spss对实验数据进行统计。按照保健食品检验与功能评价技术规范中的判定标准进行比较。分别按照如下所述的方法检测干预前后小鼠肠道菌群、淋巴细胞活性、nk细胞活性、免疫球蛋白含量、细胞因子含量的变化:菌群检测:将采集的小鼠粪便,置于装有1ml生理盐水的灭菌管中,配制成菌悬液,使用前振荡1min。使用灭菌生理盐水10倍梯度稀释,稀释后振荡或反复吹打使其混匀,直至105倍结束。根据待鉴定菌种的活菌数,选择两个连续的适宜稀释度,每个稀释度使用10μl微量移液器吸取10μl菌悬液,在选择性琼脂平板上进行表面涂布,按如下所示的培养条件进行培养。菌落计数方法参考《gb4789.2-2010食品安全国家标准食品微生物学检验菌落总数测定》进行。结果判定:比较实验前后自身及组间双歧杆菌、乳酸杆菌、肠球菌、肠杆菌的变化情况,试验组实验前后自身比较变化有显著性,或实验后试验组与对照组组间比较差异具有显著性、且试验组实验前后自身比较差异具有显著性,符合以下任意一项,可以判定该受试样品动物实验结果阳性。第一,粪便中双歧杆菌或者乳酸杆菌明显增加,肠球菌、肠杆菌无明显变化。第二,粪便中双歧杆菌或者乳酸杆菌明显增加,肠球菌、肠杆菌明显增加,但增加的幅度低于双歧杆菌或者乳酸杆菌增加的幅度。结果显示,粪便双歧杆菌在复合菌剂的刺激下,在干预的五个时间点:0天、3天、7天、14天、28天,与模型组比较,均没有显著性变化(p>0.05)。具体见表1。表1不同干预时间粪便双歧杆菌的比较(lgcfu/g)分组0d3d7d14d28d对照组8.30±0.917.43±0.688.33±1.137.73±0.878.12±0.44模型组7.78±0.768.45±1.068.38±1.168.61±0.658.82±0.61试验组17.46±0.818.42±0.468.49±0.438.87±0.269.03±0.63试验组28.12±0.607.91±0.707.65±0.678.43±0.847.96±0.50试验组37.21±0.927.63±0.547.35±0.298.74±1.118.28±0.65试验组47.63±0.757.79±0.757.69±0.718.84±0.248.32±0.38注:*表示与对照组比较p<0.05,#表示与模型组比较p<0.05。另外,粪便乳酸杆菌仅在试验组2的复合菌剂干预7天后,其含量较对照组有显著下降趋势(p<0.05),在其他情况下均没有显著性变化(p>0.05)。具体见表2。表2不同干预时间粪便乳酸杆菌的比较(lgcfu/g)分组0d3d7d14d28d对照组8.08±0.827.35±1.008.47±0.997.68±0.848.07±0.29模型组7.73±1.038.04±0.987.97±1.208.54±0.748.45±0.34试验组17.16±1.008.33±0.378.33±0.538.46±0.658.85±0.73试验组28.09±0.677.80±0.666.92±0.77*7.92±0.887.92±0.44试验组37.09±1.107.26±0.609.04±0.528.76±1.158.13±0.79试验组47.08±0.417.70±0.567.36±0.778.80±0.997.98±0.54注:*表示与对照组比较p<0.05,#表示与模型组比较p<0.05。此外,粪便肠杆菌在试验组1的复合菌剂的刺激下,在干预后3天含量明显低于模型组(p<0.05)。在试验组2的复合菌剂的刺激下,在干预3天后,粪便肠杆菌的含量明显低于模型组(p<0.05),而在干预28天后,粪便肠杆菌的含量明显高于模型组(p<0.05)。具体见表3。表3不同干预时间粪便肠杆菌的比较(lgcfu/g)分组0d3d7d14d28d对照组6.21±0.996.49±0.546.22±0.616.21±0.757.43±0.50模型组6.23±0.826.84±0.676.72±0.686.47±0.916.38±0.43*试验组15.98±0.545.77±0.26#6.24±0.855.89±0.577.00±0.72试验组26.49±0.465.84±0.40#5.77±0.405.67±0.207.02±0.21#试验组36.51±1.016.39±0.356.41±0.767.28±0.907.65±0.63试验组45.84±0.416.03±0.245.70±0.236.35±0.396.91±0.39注:*表示与对照组比较p<0.05;#表示与模型组比较p<0.05。而粪便肠球菌在试验组1的复合菌剂的刺激下,在干预28天后,含量明显高于对照组和模型组(p<0.05)。在试验组2的复合菌剂的刺激下,在干预7天后,含量明显低于模型组,在干预14天后,含量明显高于对照组(p<0.05)。具体见表4。表4不同干预时间粪便肠球菌的比较(lgcfu/g)分组0d3d7d14d28d对照组6.54±0.816.44±0.587.22±0.835.98±0.756.49±0.56模型组5.99±0.647.25±1.057.83±1.226.50±1.116.78±0.47试验组15.87±0.616.87±1.375.89±0.60#6.26±0.988.38±0.92*#试验组26.66±1.057.34±0.925.94±0.22#8.11±0.75*7.28±0.88试验组36.28±0.636.28±0.337.66±0.387.09±0.807.25±1.30试验组46.43±0.926.47±0.556.82±1.046.95±1.667.32±0.94注:*表示与对照组比较p<0.05;#表示与模型组比较p<0.05。试验组1粪便菌群干预前后变化,见图1,干预后小鼠粪便双歧杆菌、乳酸杆菌、肠杆菌及肠球菌均显著增加(p<0.05)。试验组2粪便菌群干预前后变化,见图2,干预前后小鼠粪便双歧杆菌、乳酸杆菌及肠球菌均无显著性差异(p>0.05),肠杆菌干预后显著性增加(p<0.05)。小鼠脾淋巴细胞转化实验:参考《保健食品检验与功能评价技术规范》中增强免疫力功能评价方法。当t淋巴细胞吸收cona刺激后母细胞发生增殖反应,活细胞特别是增殖细胞中线粒体水解酶可将mtt分解为蓝紫色结晶,其光密度值能反映细胞的增殖情况。具体操作是:将小鼠处死,在75%(体积分数)酒精的烧杯中消毒后,无菌取脾,置于装有3cm×3cm四层纱布(高压灭菌)的小平皿中,加入适量无菌hank’s液,用纱布将脾包住,用弯头蹑轻轻地将脾磨碎,制成单细胞悬液,用hank’s液洗2次,每次1000rpm离心10min,然后将细胞悬浮于2ml的完全培养液中,计数活细胞数,调整细胞浓度为5×106个/ml。再将细胞悬液分两孔加入24孔培养板中,每孔1ml,在其中一孔加入75μlcona液(相当于7.5μg/ml),另一孔作为对照,置于5%co2,37℃培养72h。培养结束前4h,每孔轻轻吸去上清液0.7ml不含小牛血清的rpmi1640培养液(购自gibico),同时加入噻唑蓝(mtt,5mg/ml)50μl/孔,继续培养4h。培养结束后,每孔加入1ml酸性异丙醇,吹打均匀,使紫色结晶完全溶解。然后分装到96孔培养板中,每个孔分装2孔作为平行样,用酶联免疫检测仪,以570nm波长测定光密度值。淋巴细胞的增殖能力用加cona孔的光密度值减去不加cona孔的光密度值表示。结果判定:用加cona孔的光密度值减去不加cona孔的光密度值代表淋巴细胞的增殖能力,受试样品组的光密度差值显著高于模型组的光密度差值,则可判定该项实验结果阳性。结果显示,干预3天,复合菌剂刺激后,其od差值均显著高于对照组(p<0.05);试验组1在干预14天后,od值显著高于模型组(p<0.05)(表5)。表5小鼠脾淋巴细胞转化实验结果分组3d7d14d28d对照组0.039±0.0090.205±0.1120.098±0.0510.069±0.032模型组0.090±0.0520.129±0.0480.184±0.0620.108±0.059试验组10.137±0.021*0.109±0.0550.079±0.066#0.134±0.055试验组20.136±0.083*0.080±0.0500.139±0.0240.043±0.017试验组30.103±0.0410.121±0.0790.118±0.0770.031±0.006试验组40.053±0.0070.079±0.0730.050±0.0450.079±0.040注:*表示与对照组比较p<0.05;#表示与模型组比较p<0.05。nk细胞活性测定:参考《保健食品检验与功能评价技术规范》中增强免疫力功能评价方法。正常情况下,活细胞浆内含有的ldh不能透过细胞膜,当细胞受到nk细胞的杀伤后,ldh释放到细胞外。ldh可使乳酸锂脱氢,进而使nad还原成nadh,后者再经递氢体还原成紫红色甲胺类化合物,在490nm处测定吸光值。具体操作是:开始实验前24h将靶细胞yac-1进行传代培养,用前以hank’s液洗2次,用含10%(体积分数)小牛血清的rpmi1640完全培养液调整细胞浓度为1×105个/ml(靶细胞)。小鼠颈椎脱臼猝死,无菌取脾,制成皮细胞悬液,用hank’s液洗2次,1000rpm离心10min,再用2ml含10体积%含小牛血清的rpmi1640完全培养基重悬,用台盼蓝活细胞染色计数(活细胞数应在95%以上),调整细胞浓度为1×107个/ml(效应细胞),使效靶比为100:1。取靶细胞和效应细胞各100μl,加入u型96孔培养板中,靶细胞自然释放孔加靶细胞和培养液各100μl,靶细胞最大释放孔加靶细胞和1%np40各100μl,上述均设三个平行孔。37℃、5%co2培养箱中培养4h,将96孔培养板以1500rpm离心5min,每孔吸取上清100μl置平底96孔培养板中,同时加入ldh基质液100μl,反应3min,然后每孔加入1mol/l的hcl溶液30μl终止反应,在酶标仪490nm处测od值,nk活性按下式计算:结果判定:受试样品组的nk细胞活性显著高于模型组的nk细胞活性,可判定实验结果阳性。结果显示,干预7天后,试验组2的nk细胞活性与模型组比较显著升高(p<0.01)(表6)。表6小鼠nk细胞活性检测结果(%)分组3d7d14d28d对照组59.91±13.6161.51±10.5656.21±15.0357.96±10.72模型组47.35±10.5546.88±7.1456.91±11.8863.85±22.72试验组158.77±18.0451.69±9.0157.23±10.5662.69±12.16试验组258.34±14.9265.59±12.68#62.96±13.0167.51±11.62试验组358.92±9.6752.59±5.6346.53±10.4758.55±17.74试验组451.15±14.3746.77±6.2854.57±9.4958.35±5.14注:*表示与对照组比较p<0.05;#表示与模型组比较p<0.01。血清免疫球蛋白和细胞因子检测:分别使用ebioscience抗体分型产品(antibodyisotyping7-plexmouseprocartaplexpanel,购自ebioscience,型号为epx070-20815-901)和细胞因子产品(essentialth1/th2cytokine6-plexmouseprocartaplexpanel,购自ebioscience,型号为epx060-20831-901)检测小鼠血清中七种免疫球蛋白(igg1,igg2a,igg2b,igg3,iga,ige,igm)和六种常见细胞因子(ifn-γ,il-12p70,il-4,il-5,il-6,tnf-α)的变化。具体操作是:配制标准品:取出试剂盒中提供的pcr8联管用于稀释标准品;向第一管中加入200μl的混合标准品作为标准品1;向管2-8中分别加入150μl的1xuniversalassaybuffer;从管1中取50μl混合标准品加入管2中,上下吹打10次混匀,尽量避免气泡的产生;更换新的枪头,从管2中吸取50μl的稀释标准品转移到管3中,上下吹打10次混匀。依次转移,完成混合标准品的梯度稀释;置于冰上备用。准备微球:涡旋微球30s;向96孔板中的每孔中加入50μl预混微球。将96孔板放入磁性分离板中,确保孔板被牢牢卡住。待板静止2min,让微球沉底。然后将磁板快速倒置,倒出孔板中的液体。此过程中不可将96孔板从磁性分离板中取出;向每孔中加入150μl1x的washbuffer,静置30s,然后将磁板倒置,倒出孔板中的液体;在倒置的状态下,用纸巾吸附孔板表面的残留液体。微球与样本孵育:每孔中分别加入25μl的universalassaybuffer;向指定的孔中分别加入25μl的标准品或样本;向空白对照中加入25μl的universalassaybuffer;孔板封膜,500rpm室温下震荡孵育30min,于4度静置过夜。第二天取出,500rpm室温下震荡孵育30min。洗板并加入检测抗体:将96孔板置于磁性分离板中,静置2min;轻轻去除封膜,避免液体飞溅;将孔板中的液体倒置去掉;向每孔中加入150μl1xwashbuffer,静置30s,将孔板中的液体倒置去掉。重复步骤4,共洗3次;最后一次清洗结束时,用纸巾吸附残留液体。向每孔中加入25μl1x检测抗体混合液;使用新的封膜密封孔板;将96孔板从磁性分离板中取出,至于孔板振荡器中500rpm室温震荡30min。洗板并加入sa-pe:将96孔板置于磁性分离板中,静置2min;轻轻去除封膜,避免液体飞溅;将孔板中的液体倒置去掉;向每孔中加入150μl1xwashbuffer,静置30s,将孔板中的液体倒置去掉,共洗3次;最后一次清洗结束时,用纸巾吸附残留液体。向每孔中加入50μlsa-pe;使用新的密封膜密封孔板;将96孔板从磁性分离板中取出,至于孔板振荡器中500rpm室温震荡30min。洗板并上机检测:将96孔板置于磁性分离板中,静置2min;轻轻去除封膜,避免液体飞溅;将孔板中的液体倒置去掉;向每孔中加入150μl1xwashbuffer,静置30s,将孔板中的液体倒置去掉,共洗3次;最后一次清洗结束时,用纸巾吸附残留液体。向每孔中加入120μlreadingbuffer;使用新的密封膜密封孔板;将96孔板从磁性分离板中取出,至于孔板振荡器中500rpm室温震荡5min;轻轻去除密封膜,放入bio-plex200仪器中读数。结果判定:用procartaplextmanalystsoftware分析,采用五参数非线性回归的方式拟合标准曲线,计算出浓度值。采用五参数非线性回归的方式拟合标准曲线,计算出浓度值。血清免疫球蛋白的检测结果显示,试验组1在干预14天和28天后,血清igg1的含量明显高于对照组(p<0.05)(表7);试验组1在干预28天后,血清igg2a的含量明显高于对照组(p<0.01)(表8);试验组1在干预7天后,血清igg2b的含量明显高于模型组(p<0.01)(表9);试验组2在干预28天后,血清igg3的含量明显低于模型组(p<0.05)(表10);试验组1在干预7天、14天、和28天后,血清ige的含量明显低于对照组(p<0.05);试验组2在干预7天、和28天后,血清ige的含量也显著低于对照组(p<0.01)(表11);试验组1在干预7天后,血清iga的含量显著低于对照组(p<0.01)(表12)。表7血清igg1的含量(μg/ml)注:*表示与对照组比较p<0.05;**表示与对照组比较p<0.01;#表示与模型组比较p<0.01。表8血清igg2a的含量(μg/ml)分组0d3d7d14d28d对照组45.91±25.0443.87±18.7968.41±21.0357.50±15.59283.65±142.40模型组68.27±56.1693.75±100.0239.57±19.2197.08±142.841522.0±2433.21试验组143.79±29.1754.09±49.5252.95±51.6788.30±42.62843.57±237.90**试验组246.64±12.1136.15±16.7935.84±12.28*215.47±181.09346.78±144.29试验组353.40±15.0070.66±71.7486.96±59.8750.93±40.49623.11±607.36试验组436.11±16.5471.70±54.3239.15±28.1352.69±9.04360.81±175.18注:*表示与对照组比较p<0.05;**表示与对照组比较p<0.01;#表示与模型组比较p<0.01。表9血清igg2b的含量(μg/ml)分组0d3d7d14d28d对照组106.93±39.62101.87±32.83114.49±37.64228.87±104.271252.99±710.71模型组83.97±31.89140.29±69.9182.32±25.34512.95±703.291367.51±370.14试验组1110.03±77.53123.12±24.92157.04±46.28##221.87±137.911167.28±87.77试验组2151.13±125.44113.62±35.7298.98±37.01254.02±128.02924.95±472.50试验组3120.40±41.78107.59±31.76110.11±30.15244.48±159.45994.03±343.15试验组4109.54±80.96145.82±69.62139.22±42.29111.19±22.95948.20±247.43注:*表示与对照组比较p<0.05;**表示与对照组比较p<0.01;#表示与模型组比较p<0.05;##表示与模型组比较p<0.01。表10血清igg3的含量(μg/ml)分组0d3d7d14d28d对照组108.72±54.73166.43±82.91175.16±60.371756.65±1550.361331.61±1297.41模型组160.83±73.75155.27±58.13215.51±158.77361.64±228.632437.38±1190.83试验组195.26±45.49128.11±48.97658.67±1006.96680.61±993.303173.29±2331.33试验组2111.76±57.61151.63±59.53204.11±48.20*1164.04±1182.241099.24±962.28#试验组3170.00±96.34124.38±25.97280.12±120.45432.53±176.612943.92±2633.00试验组4117.72±36.81186.06±77.34227.93±94.39352.25±223.642246.04±1235.51注:*表示与对照组比较p<0.05;**表示与对照组比较p<0.01;#表示与模型组比较p<0.05;##表示与模型组比较p<0.01。表11血清ige的含量(μg/ml)分组0d3d7d14d28d对照组25.54±8.0631.26±6.0031.48±2.6035.94±2.7040.21±3.14模型组28.15±7.0729.27±4.5226.18±5.0333.76±5.5640.22±8.72试验组119.59±4.0523.05±5.1721.70±4.30**27.25±3.46*31.37±2.90*试验组223.73±5.3322.32±3.2821.51±1.63**30.30±8.6229.66±2.68**试验组323.63±6.3521.94±2.8021.55±2.8631.91±3.2331.37±2.90*试验组420.01±1.9521.89±2.2021.68±4.2132..60±5.1631.85±3.05注:*表示与对照组比较p<0.05;**表示与对照组比较p<0.01;#表示与模型组比较p<0.05;##表示与模型组比较p<0.01。表12血清iga的含量(μg/ml)分组0d3d7d14d28d对照组125.48±28.41154.97±53.00167.45±28.83153.48±17.64201.97±34.00模型组132.96±40.22160.26±64.88138.20±25.44174.43±41.60256.32±133.88试验组191.36±25.16113.87±31.40131.73±41.45*147.53±31.80205.41±33.15试验组2101.60±12.71118.10±26.80119.88±11.02186.69±82.52177.70±43.01试验组3132.70±48.74116.85±22.57114.60±26.84118.03±27.03199.19±50.29试验组494.63±16.04119.01±20.66113.74±43.72119.71±20.49166.68±24.66注:*表示与对照组比较p<0.05;**表示与对照组比较p<0.01;#表示与模型组比较p<0.05;##表示与模型组比较p<0.01。血清细胞因子的检测结果显示,试验组1在干预3天后,血清ifn-γ的含量明显低于对照组(p<0.05),干预28天后,血清ifn-γ的含量尽管与对照组和模型组没有显著性差异,但远远低于对照组和模型组的含量(表13);试验组1在干预3天和14天后,血清il-5的含量明显低于模型组(p<0.05);试验组2在干预14天后,血清il-5的含量也明显低于对照组(p<0.05)(表14);试验组1在干预3天和28天后,血清tnf-α的含量明显低于对照组和模型组(p<0.01)(表15)。表13血清ifn-γ的含量(pg/ml)分组0d3d7d14d28d对照组3.70±6.261.14±0.310.64±0.373.28±3.241.12±0.81模型组4.14±9.260.58±0.560.67±0.861.20±1.357.20±8.36试验组10.86±0.610.46±0.48*1.66±2.573.38±5.340.53±0.3试验组20.55±0.352.73±4.553.67±6.011.81±0.521.25±1.05试验组30.79±1.4611.11±22.463.55±5.302.21±2.322.86±3.12试验组40.11±0.160.07±0.160.52±0.512.30±2.421.75±0.88注:*表示与对照组比较p<0.05;#表示与模型组比较p<0.05。表14血清il-5的含量(pg/ml)分组0d3d7d14d28d对照组2.41±3.343.35±3.780.37±0.678.61±5.531.88±1.87模型组2.63±2.222.33±1.472.01±2.1614.92±10.124.28±6.11试验组18.52±13.942.4±5.37#4.24±3.569.41±17.43#2.08±3.71试验组20±00±00.64±1.440.48±0.87*0±0试验组32.80±3.401.79±3.343.92±2.632.09±2.803.37±2.23试验组43.38±3.383.97±2.571.93±1.792.67±2.411.90±1.97注:*表示与对照组比较p<0.05;#表示与模型组比较p<0.05。表15血清tnf-α的含量(pg/ml)分组0d3d7d14d28d对照组2.36±0.562.04±0.341.88±0.712.89±0.982.29±0.66模型组1.94±1.372.06±0.741.83±1.282.14±1.224.39±3.48试验组11.13±1.230.28±0.38*#1.77±1.442.1±2.20.75±0.74*试验组20.79±0.661.03±0.991.33±1.42.1±0.531.34±0.94试验组32.04±1.262.08±1.103.37±2.322.36±1.223.07±0.91试验组41.15±1.331.19±0.581.22±0.831.29±0.601.18±0.82注:*表示与对照组比较p<0.01;#表示与模型组比较p<0.01。以上用两种不同剂量的复合菌剂饲喂急性腹泻造模小鼠,并在干预的五个时间点,分别是0天、3天、7天、14天、和28天取小鼠粪便、脾脏、血清样本,比较不同时间点,小鼠肠道菌群、淋巴细胞活性、nk细胞活性、免疫球蛋白含量、细胞因子含量的变化。结果表明,低剂量复合菌剂(试验组1)对于改善小鼠肠道菌群的作用更为显著。粪便双歧杆菌与对照组和模型组比较,在五个时间点均没有显著变化。粪便乳酸杆菌和粪便肠杆菌分别在干预后7天和3天与对照组或模型组比较,具有显著下降趋势,而在高剂量复合菌剂(试验组2)干预28天后,粪便肠杆菌的含量显著高于模型组(p<0.05)。粪便肠球菌的变化最为显著,低剂量干预后7天和28天,肠球菌的含量明显高于模型组,高剂量组也在干预后14天,含量远远高于对照组(p<0.05)。同时,组内小鼠的肠道菌群变化更为显著,结果表明,低剂量干预后小鼠粪便双歧杆菌、乳酸杆菌、肠杆菌及肠球菌均显著增加(p<0.05或p<0.01)。此外,小鼠的免疫功能实验表明,低剂量刺激后3天,t淋巴细胞的活性显著高于对照组(p<0.05),刺激后28天,尽管t淋巴细胞的活性与对照组和模型组没有显著性差异,但od值高于对照组和模型组;igg1的含量在低剂量干预14天和28天后,含量明显高于对照组(p<0.05);低剂量干预28天后,血清igg2a的含量明显高于对照组(p<0.01);干预7天后,血清igg2b的含量明显高于模型组(p<0.01);干预7天、14天、和28天后,血清ige的含量明显低于对照组(p<0.05);干预7天后,血清iga的含量显著低于对照组(p<0.01)。与此同时,细胞因子ifn-γ在干预3天后,血清ifn-γ的含量明显低于对照组(p<0.05),在低剂量干预28天后,其含量尽管与对照组和模型组没有显著性差异,但远远低于对照组和模型组的含量;低剂量干预3天和14天后,血清il-5的含量明显低于模型组(p<0.05);血清tnf-α的含量在低剂量干预3天和28天后,明显低于对照组和模型组(p<0.01)。这些结果均表明,低剂量菌剂的刺激不但增加了小鼠肠道有益菌群的组成比例,同时增加了小鼠的免疫调节能力。另外,比较试验组1-4可以看出,配合菊芋糖浆(低聚糖)与格氏乳杆菌、长双歧杆菌和丁酸梭菌才能够更有效地在增加小鼠肠道有益菌群的组成比例同时改善小鼠的免疫调节能力。以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1