一种成纤维细胞的培养基及利用其培养成纤维细胞的方法与流程
本发明涉及细胞培养领域,尤其涉及一种成纤维细胞的培养基及利用其进行培养成纤维细胞的方法。
背景技术:
成纤维细胞(fibroblast)是疏松结缔组织的主要细胞成分,由胚胎时期的间充质细胞(mesenchymalcell)分化而来。成纤维细胞较大,轮廓清楚,多为突起的纺锤形或星形的扁平状结构,其细胞核呈规则的卵圆形,核仁大而明显。成纤维细胞对不同程度的细胞变性、坏死和组织缺损以及骨创伤的修复有着十分重要的作用,因此体外培养成纤维细胞在组织工程、美容、医疗等领域具有广泛的应用。制备的自体成纤维细胞可以供治疗女性尿失禁和消除皱纹及凹陷性疤痕的细胞移植之用。移植到尿道周围组织、皱纹和疤痕处的皮肤真皮层内后,在人体内是一种自然生理性的修复,不会产生免疫排斥等副作用。
目前体外培养成纤维细胞的培养基只由基本培养基组成,对成纤维细胞的培养没有针对性,因此这类培养基存在如下缺点:
1.成纤维细胞得不到特异性营养,生长速度收到制约,想要得到一定量的成纤维细胞所需时间长。
2.传代培养细胞基数增大,会有营养竞争,使得细胞活力降低,影响得到的成纤维细胞的品质。
3.成纤维细胞的培养方法不得当,使得培养基的作用得不到充分发挥。
因此,本发明为解决上述问题,提供成纤维细胞的培养基及利用其进行培养成纤维细胞的方法,特异性提高了成纤维细胞的增长速度,在短时间内得到一定量的细胞,节省了时间和原料,且能保证所得到成纤维细胞的活性,有利于其在后续利用中充分发挥作用。
技术实现要素:
本发明所要解决的技术问题是提供供成纤维细胞的培养基及利用其进行培养成纤维细胞的方法,特异性提高了成纤维细胞的增长速度,在短时间内得到一定量的细胞,节省了时间和原料,且能保证所得到成纤维细胞的活性,有利于其在后续利用中充分发挥作用。
本发明解决上述技术问题的技术方案如下:一种成纤维细胞的培养基,包括基础培养基、nh4hco3、丝氨酸、维生素c、茶多酚和胰岛素,所述基础培养基包括imdm培养基和f12培养基。
本发明的有益效果是:利用此培养基对成纤维细胞进行培养,能够有效增加细胞的生长速度,可能原因为成纤维细胞呈弱碱性,所添加的nh4hco3提供弱碱性环境,同时为细胞提供氮源有利于细胞成长,丝氨酸是细胞膜的重要组成成分,同时在细胞代谢中起到重要作用,成纤维细胞在代谢过程对丝氨酸具有更大的吸收量,胰岛素能够增加成纤维细胞对葡萄糖的吸收,充分利用碳源,维生素c对某些酶的活性起到重要作用促进成纤维细胞的代谢过程进行,茶多酚能够对维生素c起到保护作用,同时防止细胞内发生氧化中毒引起细胞生长速率减慢,在利用基础培养基的基础上,添加nh4hco3、丝氨酸、维生素c、茶多酚、胰岛素这一组合能够使成纤维细胞快速增长,在短时间内得到一定量的细胞,节省了时间和原料,同时培养基为无动物源性培养基,减少了污染来源及不稳定性。
在上述技术方案的基础上,本发明还可以做如下改进。
进一步,所述所述imdm培养基和f12培养基的体积比为2.5:1。
采用上述进一步方案的有益效果是使得imdm与f12培养基中的营养具有更好的配比利于成纤维细胞的吸收。
进一步,所述所述基础培养基、nh4hco3、丝氨酸、维生素c、茶多酚、胰岛素和表皮生长因子按照1.4ml:90-120μg:200-250μg:20-60μg:20-40μg:10-20μg:10-15μg。
采用上述进一步方案的有益效果是,提供各种营养的合理配比,符合成纤维细胞的代谢吸收比例,从而使各种物质更好的发挥作用。
进一步,所述培养基还包括乙醇胺和胆碱。
采用上述进一步方案的有益效果是在成纤维细胞离体培养中有效增加了细胞活性,便于成纤维细胞在实践中更好的发挥作用,可能原因为成纤维细胞具有丰富的内质网和高尔基体,而内质网和高尔基体是维持细胞活性重要的细胞器,乙醇胺和胆碱是构成膜类细胞器的重要物质。
进一步,所述基础培养基、乙醇胺和胆碱的比为1ml:50-80μg:90-150μg。
采用上述进一步方案的有益效果是合适的乙醇胺和胆碱的用量及配比,使乙醇胺和胆碱在细胞代谢及物质合成中充分发挥作用。
进一步,一种成纤维细胞培养方法,包括如下步骤,
步骤1:获取受术者皮肤组织放入培养皿中,在生物安全柜中用生理盐水冲洗所述皮肤组织,并将所述皮肤组织剪成组织块,再用生理盐水冲洗所述组织块;
步骤2:将所述步骤1中所述组织块夹取至培养皿中,每个所述培养皿中加入如权利要求1至5任一项所述培养基,将所述培养皿放入培养箱静置,然后取出所述培养皿放入生物安全柜中,将所述培养皿中的所述培养基倒出,再加入新的所述培养基后放回所述培养箱中,三天后进行半换液,之后每两天半换液,直至细胞从组织中爬出量超过底板的60%,换新的所述培养基,得到原代培养皿;
步骤3:将所述步骤2中所述原代培养皿在所述培养箱培养3天后倒入胰蛋白酶,静置后用胰酶抑制剂终止消化,得到首次细胞悬液;
步骤4:将所述步骤3中所述首次细胞悬液倒入离心管进行离心,去掉上清得到首次离心重悬细胞;
步骤5:将所述步骤4中所述首次离心重悬细胞转移至培养瓶中,加入所述培养基;
步骤6:在所述步骤5中所述培养瓶中细胞长到细胞密度为90%时加入胰蛋白酶,静置后倒入胰酶抑制剂终止消化,得到二次细胞悬液,将所述二次细胞悬液进行离心,去掉上清液,得到二次离心重悬细胞,将所述二次离心重悬细胞传代扩瓶培养。
采用上述进一步方案的有益效果是提供一种成纤维细胞的培养方法,其步骤及参数的设定能够使培养基的成分得到充分的发挥,使得细胞增殖更快,细胞活性更高。
进一步,所述步骤1中所述皮肤组织面积为20mm2,所述组织块面积为0.5mm2。
采用上述进一步方案的有益效果是取较小面积的皮肤组织,对受术者损伤减少,将皮肤组织分为合适大小的组织块,增大组织与皮肤的接触面积,同时根据实验要求选取即可,不造成资源的浪费。
进一步,所述步骤2中所述培养皿直径为7.5cm,每个所述培养皿放入的组织块数为两个,每次加入所述培养基的体积为3ml,所述静置时间为45min-1h,所述步骤2和3中所述培养箱温度设置为37℃,co2浓度设置为5%,所述步骤3中所述胰蛋白酶浓度为为2.5g/l,所述胰蛋白酶体积为1ml,所述静置的时间为1.5min,所述胰酶抑制剂体积为1ml。
采用上述进一步方案的有益效果是设置培养皿、组织块数和培养基体积,使得组织块能够有合适的生存环境和营养量,规定培养箱温度和co2浓度使得细胞在合适的外界环境下繁殖,设定消化过程的参数,充分利用胰蛋白酶消化细胞,且对应定量的胰蛋白酶终止液。
进一步,所述步骤4和所述步骤6中,所述离心速率为800rmp,所述离心时间为2min,所述步骤5和6中的培养瓶为t25培养瓶,所述培养瓶中的培养基体积为8ml。
采用上述进一步方案的有益效果是设置离心过程的参数,在对细胞损伤最小的情况下使细胞和培养基分离,合适的培养瓶规格和合适的培养基体积为细胞提供合适大小的环境和适量的营养。
进一步,所述步骤6中所述胰蛋白酶浓度为2.5g/l,所述胰蛋白酶体积为2ml,所述静置时间为3min,所述胰酶抑制剂体积为2ml。
采用上述进一步方案的有益效果是设定消化过程的参数,充分利用胰蛋白酶,消化细胞,且对应定量的胰蛋白酶终止液。
附图说明
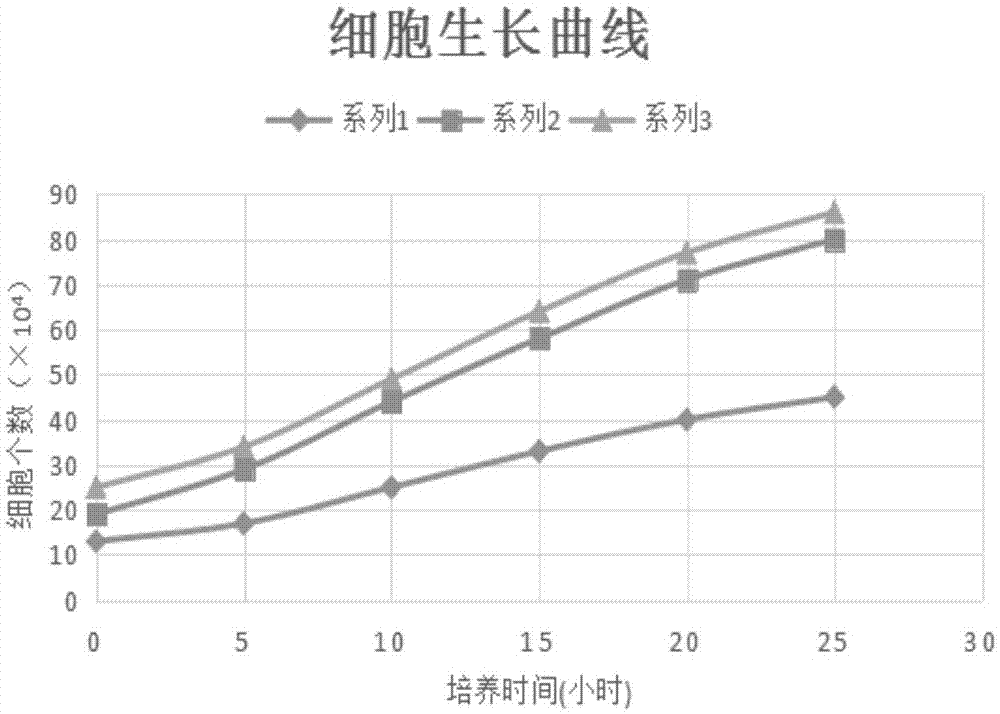
图1为本发明细胞生长曲线图;
图2为本发明利用mtt法测细胞活性的吸光光度值示意图;
具体实施方式
以下结合附图对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
如图1所示,本发明细胞生长曲线图,系列1为实施例1-3对应时间细胞数的平均值,系列2为实施例4-6对应时间细胞数的平均值,系列3为对比例1-3对应时间细胞数的平均值,培养时间单位为小时。
图2为本发明利用mtt法测细胞活性的吸光光度值示意图,系列1为实施例1-3对应培养时间取出细胞进行mtt实验的分光光度值的平均值,系列2为实施例4-6对应培养时间取出细胞进行mtt实验的分光光度值的平均值,系列3为对比例1-3对应培养时间取出细胞进行mtt实验的分光光度值的平均值,培养时间单位为小时。
表1.实施例1-3基础培养基中的添加物种类及含量(单位:μg)
表2.实施例4-6基础培养基中的添加物种类及含量(单位:μg)
实施例1
培养基的配制:
基础培养基:取imdm培养基500ml及f12培养基200ml作为基础培养基搅拌均匀,
添加物:向培养基中加入nh4hco345000μg,丝氨酸100000μg,维生素c10000μg,茶多酚10000μg,胰岛素5000μg搅拌均匀得到实施例1的培养基
将得到的实施例1培养基按照如下步骤进行成纤维细胞的培养:
步骤1:获取受术者20mm2皮肤组织放入培养皿中,在生物安全柜中用生理盐水冲洗所述皮肤组织,并将所述皮肤组织剪成0.5mm2的组织块,再用生理盐水冲洗所述组织块;
步骤2:将所述步骤1中所述组织块夹取至直径7.5cm,高度1.5cm的培养皿中,每个所述培养皿中加入两个所述组织块及3ml培养基,所述组织块真皮层向下,将所述培养皿放入培养箱静置,设置培养箱温度为37℃,co2浓度为5%,45min-1h后取出所述培养皿放入生物安全柜中,将所述培养皿的培养基倒出,再加入培养基3ml后放回培养箱中,设置培养箱温度为37℃,co2浓度为5%,三天后进行半换液,之后每两天半换液一次,直至细胞从组织中爬出量超过底板面积的60%,换新培养基3ml,得到原代培养皿;
步骤3:将所述步骤2中所述去组织块培养皿在培养箱培养3天后倒入质量分数为0.25%的胰蛋白酶1ml,1.5min后用胰酶抑制剂1ml终止消化,得到首次细胞悬液;
步骤4:将所述步骤3中所述首次细胞悬液倒入离心管进行离心,离心速度为800rpm,离心时间为2min,去掉上清得到首次离心重悬细胞;
步骤5:将所述步骤4中所述首次离心重悬细胞转移至t25培养瓶中,加入培养基8ml;
步骤6:在所述步骤5中所述t25培养瓶中细胞长到细胞浓度为90%时加入胰酶溶液2ml,消化3min,倒入胰酶抑制剂2ml终止消化,得到二次细胞悬液,将所述二次细胞悬液进行离心,离心速度为800rpm,离心时间为2min,去掉上清液,得到二次离心重悬细胞,将所述二次离心重悬细胞接种到10个培养瓶中,每3天全量换液,每5天按1传10的比例进行传代。
实施例2
培养基的配制:
基础培养基:取imdm培养基500ml及f12培养基200ml作为基础培养基搅拌均匀,
添加物:向培养基中加入nh4hco352500μg,丝氨酸112500μg,维生素c20000μg,茶多酚15000μg,胰岛素7500μg搅拌均匀得到实施例2的培养基。
将实施例2的培养基用于成纤维细胞的培养,其方法与实施例1相同。
实施例3
培养基的配制:
基础培养基:取imdm培养基500ml及f12培养基200ml作为基础培养基搅拌均匀,
添加物:向培养基中加入nh4hco360000μg,丝氨酸125000μg,维生素c30000μg,茶多酚20000μg,胰岛素10000μg搅拌均匀得到实施例3的培养基。
将实施例3的培养基用于成纤维细胞的培养。其方法与实施例1相同。
实施例4
培养基的配制:
基础培养基:取imdm培养基500ml及f12培养基200ml作为基础培养基搅拌均匀,
添加物:向培养基中加入nh4hco345000μg,丝氨酸100000μg,维生素c10000μg,茶多酚10000μg,胰岛素5000μg,乙醇胺35000μg,胆碱63000μg搅拌均匀得到实施例4的培养基
将得到的实施例4培养基按照如下步骤进行成纤维细胞的培养:
步骤1:获取受术者20mm2皮肤组织放入培养皿中,在生物安全柜中用生理盐水冲洗所述皮肤组织,并将所述皮肤组织剪成0.5mm2的组织块,再用生理盐水冲洗所述组织块;
步骤2:将所述步骤1中所述组织块夹取至直径7.5cm,高度1.5cm的培养皿中,每个所述培养皿中加入两个所述组织块及3ml培养基,所述组织块真皮层向下,将所述培养皿放入培养箱静置,设置培养箱温度为37℃,co2浓度为5%,45min-1h后取出所述培养皿放入生物安全柜中,将所述培养皿的培养基倒出,再加入培养基3ml后放回培养箱中,设置培养箱温度为37℃,co2浓度为5%,三天后进行半换液,之后每两天半换液一次,直至细胞从组织中爬出量超过底板面积的60%,换新培养基3ml,得到原代培养皿;
步骤3:将所述步骤2中所述去组织块培养皿在培养箱培养3天后倒入质量分数为0.25%的胰蛋白酶1ml,1.5min后用胰酶抑制剂1ml终止消化,得到首次细胞悬液;
步骤4:将所述步骤3中所述首次细胞悬液倒入离心管进行离心,离心速度为800rpm,离心时间为2min,去掉上清得到首次离心重悬细胞;
步骤5:将所述步骤4中所述首次离心重悬细胞转移至t25培养瓶中,加入培养基8ml;
步骤6:在所述步骤5中所述t25培养瓶中细胞长到细胞浓度为90%时加入胰酶溶液2ml,消化3min,倒入胰酶抑制剂2ml终止消化,得到二次细胞悬液,将所述二次细胞悬液进行离心,离心速度为800rpm,离心时间为2min,去掉上清液,得到二次离心重悬细胞,将所述二次离心重悬细胞接种到10个培养瓶中,每3天全量换液,每5天按1传10的比例进行传代。
实施例5
培养基的配制:
基础培养基:取imdm培养基500ml及f12培养基200ml作为基础培养基搅拌均匀,
添加物:向培养基中加入nh4hco352500μg,丝氨酸112500μg,维生素c20000μg,茶多酚15000μg,胰岛素7500μg,乙醇胺45500μg,胆碱84000μg搅拌均匀得到实施例5的培养基.
将实施例5的培养基用于成纤维细胞的培养,其方法与实施例4相同。
实施例6
培养基的配制:
基础培养基:取imdm培养基500ml及f12培养基200ml作为基础培养基搅拌均匀,
添加物:向培养基中加入nh4hco360000μg,丝氨酸125000μg,维生素c30000μg,茶多酚20000μg,胰岛素10000μg,乙醇胺56000μg,胆碱105000μg搅拌均匀得到实施例6的培养基.
将实施例6的培养基用于成纤维细胞的培养,其方法与实施例4相同。
对比例1
培养基的配制:取700mlimdm培养基。
将得到的对比例1培养基按照如下步骤进行成纤维细胞的培养:
步骤1:获取受术者20mm2皮肤组织放入培养皿中,在生物安全柜中用生理盐水冲洗所述皮肤组织,并将所述皮肤组织剪成0.5mm2的组织块,再用生理盐水冲洗所述组织块;
步骤2:将所述步骤1中所述组织块夹取至直径7.5cm,高度1.5cm的培养皿中,每个所述培养皿中加入两个所述组织块及3ml培养基,所述组织块真皮层向下,将所述培养皿放入培养箱静置,设置培养箱温度为37℃,co2浓度为5%,45min-1h后取出所述培养皿放入生物安全柜中,将所述培养皿的培养基倒出,再加入培养基3ml后放回培养箱中,设置培养箱温度为37℃,co2浓度为5%,三天后进行半换液,之后每两天半换液一次,直至细胞从组织中爬出量超过底板面积的60%,换新培养基3ml,得到原代培养皿;
步骤3:将所述步骤2中所述去组织块培养皿在培养箱培养3天后倒入质量分数为0.25%的胰蛋白酶1ml,1.5min后用胰酶抑制剂1ml终止消化,得到首次细胞悬液;
步骤4:将所述步骤3中所述首次细胞悬液倒入离心管进行离心,离心速度为800rpm,离心时间为2min,去掉上清得到首次离心重悬细胞;
步骤5:将所述步骤4中所述首次离心重悬细胞转移至t25培养瓶中,加入培养基8ml;
步骤6:在所述步骤5中所述t25培养瓶中细胞长到细胞浓度为90%时加入胰酶溶液2ml,消化3min,倒入胰酶抑制剂2ml终止消化,得到二次细胞悬液,将所述二次细胞悬液进行离心,离心速度为800rpm,离心时间为2min,去掉上清液,得到二次离心重悬细胞,将所述二次离心重悬细胞接种到10个培养瓶中,每3天全量换液,每5天按1传10的比例进行传代。
对比例2
培养基的配制:取700mlf12培养基。
将对比例2的培养基用于成纤维细胞的培养方法与实施例4相同。
对比例3
培养基的配制:imdm培养基500ml及f12培养基200ml的混合培养基。
将对比例3的培养基用于成纤维细胞的培养方法与实施例4相同。
结果分析:
1细胞个数的测定:用血球计数板进行细胞计数,用酒精冲洗计数板,擦净后将盖片铺在计数板上,微微移向一侧,以便滴加细胞悬液,用移液枪吸取20ul细胞悬液,使其充满计数板和盖片间的空隙(勿使液体漫过盖片或者出现气泡),镜下观察并计算计数板的四角大格内的细胞数(压线者只计算左侧和上方的,右侧和下方的不计算在内),
细胞数=(4大格细胞数/4)×10000×稀释倍数×原液毫升数。
2.细胞活性的测定
采用mtt法测定细胞活性,以10000个/ml密度,接种于96孔板中,48h后每孔加入20μlmtt溶液(1mg/ml),37℃厌氧孵化4h,移除mtt后,使用200μldmso(二甲基亚砜)溶解结晶,570nm下测定吸光度值,以空白组调零。
结果分析
1.细胞个数指标的测定
系列1为实施例1-3对应时间细胞数的平均值,系列2为实施例4-6对应时间细胞数的平均值,系列3为对比例1-3对应时间细胞数的平均值,步骤5中细胞数目绘制成细胞生长曲线,实施例4-6的细胞数平均值最高,实施例1-3的细胞数平均值次之,二者相差不多,对比例1-3细胞数平均值最低,明显低于实施例1-3和实施例4-6,说明在本发明基础培养基基础上添加nh4hco3、丝氨酸、维生素c、茶多酚、胰岛素,或者在基础培养基上添加nh4hco3、丝氨酸、维生素c、茶多酚、胰岛素、乙醇胺和胆碱及各种成分对应的比例所制成的成纤维细胞培养基能够使细胞充分利用培养基物质,有效提高成纤维细胞的分裂速度。
3.细胞活性测定结果
在mtt实验中,系列1为实施例1-3对应培养时间取出细胞进行mtt实验的分光光度值的平均值,系列2为实施例4-6对应培养时间取出细胞进行mtt实验的分光光度值的平均值,系列3为对比例1-3对应培养时间取出细胞进行mtt实验的分光光度值的平均值,分光光度值的大小与细胞活性成正比。实施例4-6的细胞活性最高,实施例1-3的细胞活性次之,对比例1-3细胞活性最低,且实施例4-6细胞的活性明显高于实施例1-3和对比例1-3,说明在本发明基础培养基基础上添加nh4hco3、丝氨酸、维生素c、茶多酚、胰岛素、乙醇胺和胆碱及各种成分对应的比例所制成的成纤维细胞培养基能够使细胞活性显著提高,提高了生产实践的成功率。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!