一种基于血液游离核酸的检测结核分枝杆菌的试剂盒的制作方法
本发明属于生物医学检测
技术领域:
,尤其涉及一种基于血液游离核酸的检测结核分枝杆菌的试剂盒。
背景技术:
:结核分枝杆菌(mycobacteriumtuberculosis,mtb)简称结核杆菌或结核菌,是引发结核病(tuberculosis,tb)的主要致病菌。结核菌为细长略带弯曲的杆菌,是无孢子形成、不动的单细胞细菌。结核病是一种慢性传染病,其可通过空气进行传播。结核病是一类严重危害人类生命健康的重要疾病:全球约有35%的人口感染结核病,每年新增的病例超过800万,超过200万人死于该类疾病。我国亦是世界上结核病高负担国家之一,现有肺结核病人约500万,每年约有数万人死于该病,tb不仅流行范围广,还具有高感染率、高发病率和高死亡率的特点。虽然随着医学技术的发展进步,不断有新的抗结核药物被发现,使得有效控制了该病的流行,但由于艾滋病与结核病双重感染及多重耐药结核菌的增多,这导致该病的发病率又呈现递增的趋势。因此,及时的早期诊断和精准治疗对结核病的防控和治愈仍旧十分关键。目前,结核病的临床诊断主要依据病史、ct、痰涂片法、痰培养法和免疫诊断等方法,这些诊断方法存在以下不足:1)传统的“金标准”(痰培养)可以鉴别不同种类的分枝杆菌感染,但其周期长、灵敏度低,常常延误患者的最佳治疗时间;2)ct检查通常只能发现已有肺部病灶的患者,无法进行早期诊断,而且与其他肺部疾病无法区分,不能得到确诊的结果;3)痰涂片是常用的肺结核筛查技术,简单快速,但其阳性率极低,大于60%的结核病人被诊断为涂片阴性;虽然涂片阴性病人的结核菌含量较低,但其仍然是结核病重要的传染源之一,易造成漏诊;4)免疫诊断是基于特异性抗原抗体的检测方法,操作简单,但特异性和灵敏度不够。总之,缺乏一种高灵敏度、高特异性的临床诊断方法,以及后续有效的治疗方案,是结核病不能有效防控和治愈的重要原因。分子诊断技术是近几年发展起来的诊断方法,根据病原体保守序列设计特异性的引物、探针,搭配特殊的反应体系和仪器,对致病菌进行准确的定性或定量检测,其具有高灵敏度和高特异性的特点。针对结核分枝杆菌的分子诊断产品,现市面上主要有荧光pcr产品和恒温扩增产品,其检测灵敏度介于1~10个菌/ml,通常能在3~4小时内得到检测结果,简便快速,但其也存在一些不足:1)大多数是针对新鲜痰液样本进行定性或耐药检测,而痰液样本在儿童、肺外结核患者和hiv患者中的诊断率低;2)取样难、样本间差异性大,所得检测结果的准确性低。血液游离核酸是指外周循环血中游离于细胞结构外的小片段dna、rna或microrna等核酸分子,通常是指来源于机体内细胞凋亡释放或部分降解了的内源性核酸分子;其含有重要的遗传信息。健康人血液中仅存在少量的游离核酸,不易被检测到;但在孕妇和肿瘤患者的血液中游离核酸的量会随着孕期的增加或肿瘤患者病情加重而成倍增加,利用先进的核酸提取和分子检测技术可对机体内部分遗传信息进行解读。现市面上已有多种基于血液游离核酸的分子诊断技术,如利用母体血液中胎儿游离dna(cellfreefetaldna,cffdna)、肿瘤患者血液中游离dna(cellfreetumordna,ctdna)的无创产前筛查(nipt)和肿瘤液体活检(liquidbiopsy)技术。据近期的文献报道,nanyingche等人和e.s.click等人先后在结核病患者的胸腔积液和血浆中发现了外源性游离的结核分枝杆菌dna,这预示着人类血浆中tbcfdna的检测将是一个有巨大潜在价值的诊断靶标,尤其是改善了临床上痰液收集困难或痰样检测不稳定患者的病原体检测情况,将更准确的反应疾病的严重程度。故本发明试剂盒与国内多种基于痰液样本的结核分枝杆菌检测试剂盒的设计理念不同,旨在研发一款新颖的基于血液游离核酸的结核杆菌检测试剂盒和检测方法。技术实现要素:本发明目的在于克服现有技术不足,而提供一种基于血液游离核酸的检测结核分枝杆菌的试剂盒,该检测试剂盒包括两种:一种是基于pcr-荧光探针法,另一种是基于pcr-膜层析杂交法,根据结核杆菌的保守序列设计并筛选出高灵敏度、高特异性的引物、探针、反应体系和反应程序,实现基于血液游离核酸的高敏感性检测。为实现上述目的,本发明采取的技术方案为:一种基于血液游离核酸的检测结核分枝杆菌的试剂盒,其包括pcr反应液、引物、酶和内标,所述引物包括检测mtb靶核苷酸引物和检测内标引物,所述检测mtb靶核苷酸引物的核苷酸序列如seqidno.1、seqidno.2、seqidno.3、seqidno.4所示。作为上述技术方案的改进,所述内标是核苷酸序列如seqidno.7所示的质粒,所述质粒浓度为2×104copies/ml,所述检测内标引物的核苷酸序列如seqidno.5、seqidno.6所示。作为上述技术方案的改进,所述pcr反应液包括以下组分:pcr缓冲液、dutpplusdntpmixture和金属阳离子,所述酶由热启动taq酶和ung酶构成。优选地,在pcr反应中,pcr反应液中各组分的浓度为:1×pcr缓冲液、0.2~2mmdutpplusdntpmixture和1~3mm金属阳离子;内标为0.5~2μl,每种引物为0.1~0.5μm,热启动taq酶为0.5~1.5u,ung酶(选择性水解断裂含有du的双链或单链dna中的尿嘧啶糖苷键)为0.05~0.5u,探针为0.05~0.25μm。作为上述技术方案的改进,还包括质控品,所述质控品由阳性质控品和阴性质控品组成,所述阳性质控品为含mtb靶核苷酸序列的克隆菌液,克隆菌液中克隆菌浓度为1000cfu/ml,所述mtb靶核苷酸序列如seqidno.8、seqidno.9所示;所述阴性质控品为无菌生理盐水。作为上述技术方案的进一步改进,试剂盒还包括检测mtb靶核苷酸荧光探针和检测内标荧光探针,所述检测mtb靶核苷酸荧光探针的核苷酸序列如seqidno.10和seqidno.11所示,检测mtb靶核苷酸荧光探针的5’端标记有荧光基团,检测探针的3’端标记淬灭基团;所述检测内标荧光探针的核苷酸序列如seqidno.12所示,检测内标荧光探针的5’端标记有荧光基团,检测内标荧光探针的3’端标记淬灭基团;荧光基团选自fam、hex、vic、ned、cy5中一种,淬灭基团选自mgb、tamra、bhq中一种,检测mtb靶核苷酸荧光探针和检测内标荧光探针的5’端标记有不同的荧光基团。作为上述技术方案的进一步改进,试剂盒还包括杂交膜条和显色液,所述杂交膜条上附着有杂交探针,所述显色液包括连接有第二显色标记物的微球;检测内标引物的上游引物的5’端还依次连接有c3间臂(c3spacer)和第一标签序列,第一标签序列如seqidno.15所示;检测内标引物的下游引物的5’端还连接有第一显色标记物,第一显色标记物能与结合有微球的第二显色标记物相连接,微球富集后显色;检测mtb靶核苷酸引物的上游引物的5’端还依次连接有c3间臂和第二标签序列,第二标签序列如seqidno.16所示;检测mtb靶核苷酸引物的下游引物的5’端还连接有第一显色标记物;杂交探针包括第一杂交探针和第二杂交探针;第一杂交探针的核苷酸序列如seqidno.13所示,所述第一杂交探针与所述第一标签序列互补配对;第二杂交探针的核苷酸序列如seqidno.14所示,所述第二杂交探针与所述第二标签序列互补配对。作为上述技术方案的更进一步改进,所述第一显色标记物为生物素,所述第二显色标记物为链霉亲和素,微球为富集显示蓝色的乳胶微球。作为上述技术方案的更进一步改进,所述杂交膜条包括聚氯乙烯板,聚氯乙烯板上固定有硝酸纤维薄和吸水纸,硝酸纤维薄和吸水纸存在重叠,硝酸纤维膜附着有上下间隔的所述第一杂交探针和所述第二杂交探针。本发明的有益效果在于:本发明提供一种基于血液游离核酸的检测结核分枝杆菌的试剂盒,该检测试剂盒包括两种:一种是基于pcr-荧光探针法,另一种是基于pcr-膜层析杂交法,该试剂盒具有以下优点:1)检测的样品为血液:均一性高、取样简单、传染性低等,能有效降低医疗人员和专业检验人员的安全风险系数;2)特异性强:本发明选择两个高度保守的基因序列设计扩增引物和探针,有效减少因特定人群中丢失基因片段而造成的假阴性结果;又经ncbi数据库的blast软件评估保守序列、扩增引物、荧光探针和杂交探针的特异性,有效避免了非特异性扩增产物生成和多种病原体间交叉反应的发生;3)敏感性高:本发明通过大量的临床样本的检测数据证实,能显著提高痰涂片呈阴性结核患者、肺外结核患者和hiv并发结核感染患者的阳性检出率,以及对高危人群中tb感染者的精准筛查,对tb的指导用药和疾病防控具有重大、突破性的临床价值;同时,对结核分枝杆菌国家参考品的最低检出量参考品s4(1个菌/ml)重复检测20次的阳性检出率(+/+)为100%;4)准确性高:本发明提供的试剂盒中均加入内控系统,内控系统的设置能有效监控样本提取过程和pcr检测过程,防止由于样本质量、样本提取或pcr反应管内抑制造成的假阴性;同时,试剂盒中加入dutp-ung防污染系统,可有效的避免扩增产物的污染,防止假阳性结果;5)快速、简便、低成本:本发明提供的检测试剂盒(pcr-膜层析杂交法)无需依赖昂贵的荧光pcr仪、杂交仪等设备,室温下进行杂交反应,杂交反应时间为5~15min,操作简便和结果分析快速,检测成本低,对技术人员专业要求低,便于常规筛查项目的推广;6)实用性强:本发明提供了两种不同的检测试剂盒和方法,对于拥有不同基础设施水平的医院,可选择性多、覆盖面广,亦可结合全自动化的核酸检测设备,实现全自动化检测。附图说明图1显示本发明实施例2中引物修饰、杂交膜条标记及标准比色卡;图2显示本发明实施例3中两种试剂盒(pcr-荧光探针法和pcr-膜层析杂交法)与痰液涂片法的对比结果;图3显示本发明实施例4中两种试剂盒(pcr-荧光探针法和pcr-膜层析杂交法)与痰液培养法的对比结果;图4显示本发明实施例5中两种试剂盒(pcr-荧光探针法和pcr-膜层析杂交法)与tb-igra释放反应法的对比结果;图5显示本发明实施例6中两种试剂盒(pcr-荧光探针法和pcr-膜层析杂交法)与xpertmtb/rif实验法的对比结果;图6显示本发明实施例7中两种试剂盒的最低检出限的检测结果;图7显示本发明实施例7中两种试剂盒的pcr扩增产物防污染的检测结果;图8显示本发明实施例7中两种试剂盒的特异性实验的检测结果;图9显示本发明实施例7中两种试剂盒对潜在内源物质抗干扰实验的检测结果;图10显示本发明实施例7中两种试剂盒对潜在外源药物残留抗干扰实验的检测结果;图11显示本发明实施例8中两种试剂盒与市面上荧光pcr试剂盒的对比结果。具体实施方式为更好地说明本发明的目的、技术方案和优点,下面将结合具体实验和附图对本发明作进一步说明。除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的
技术领域:
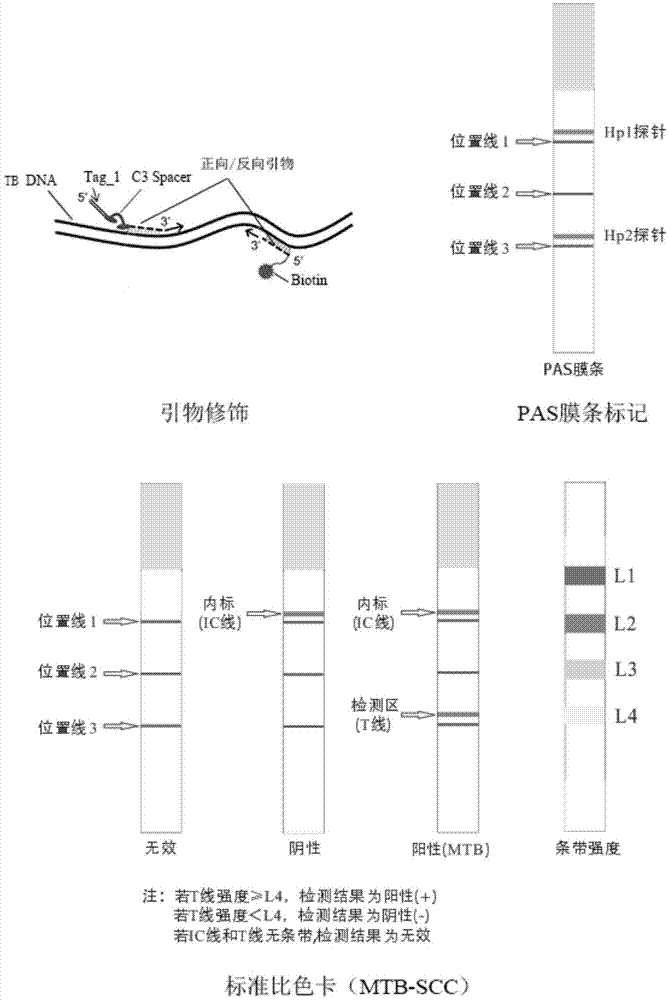
的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。另外,应当理解的是,本发明中采用术语“第一”、“第二”等来描述各种信息,但这些信息不应限于这些术语,这些术语仅用来将同一类型的信息彼此区分开。例如,在不脱离本发明范围的情况下,“第一”信息也可以被称为“第二”信息,类似的,“第二”信息也可以被称为“第一”信息。实施例1本实施例提供一种基于血液游离核酸的检测结核分枝杆菌的试剂盒(pcr-荧光探针法),其包括pcr反应液、引物、酶、内标、质控样品、检测mtb靶核苷酸荧光探针、检测内标荧光探针、阳性质控品和阴性质控品,引物包括检测mtb靶核苷酸引物和检测内标引物,检测mtb靶核苷酸引物的核苷酸序列如seqidno.1、seqidno.2、seqidno.3、seqidno.4所示(2对引物);内标是为核苷酸序列如seqidno.7所示的质粒,质粒浓度为2×104copies/ml,检测内标引物的核苷酸序列如seqidno.5、seqidno.6所示;pcr反应液包括以下组分:pcr缓冲液、dutpplusdntpmixture和金属阳离子,酶由热启动taq酶和ung酶构成;在pcr反应中,pcr反应液中各组分的浓度为:1×pcr缓冲液、0.2~2mmdutpplusdntpmixture和1~3mm金属阳离子;内标为0.5~2μl,每种引物为0.1~0.5μm,热启动taq酶为0.5~1.5u,ung酶为0.05~0.5u,每种荧光探针为0.05~0.25μm;阳性质控品为含mtb靶核苷酸序列的克隆菌液,克隆菌液中克隆菌浓度为1000cfu/ml,mtb靶核苷酸序列如seqidno.8、seqidno.9所示;阴性质控品为无菌生理盐水;检测mtb靶核苷酸荧光探针的核苷酸序列如seqidno.10、seqidno.11所示,检测mtb靶核苷酸荧光探针的5’端标记有荧光基团,检测mtb靶核苷酸荧光探针的3’端标记淬灭基团;检测内标荧光探针的核苷酸序列如seqidno.12所示,检测内标荧光探针的5’端标记有荧光基团,检测内标荧光探针的3’端标记淬灭基团;荧光基团选自fam、hex、vic、ned、cy5中一种,淬灭基团选自mgb、tamra、bhq中一种,检测mtb靶核苷酸荧光探针和检测内标荧光探针的5’端标记有不同的荧光基团;核酸序列如表1所示。表1另外,本实施例还提供上述试剂盒(pcr-荧光探针法)的检测方法,其包括以下步骤:s1)试剂准备根据待测样本及质控品的数量(n),每份检测试剂是按以下组分和用量配制:pcr反应液、检测mtb靶核苷酸引物、检测内标引物、检测mtb靶核苷酸荧光探针、检测内标荧光探针共16.2μl,酶液0.3μl,内标1μl;充分混匀,瞬时离心后备用;s2)血液游离核酸的提取及纯化(质控品参与提取过程)a)将血液采集到edta抗凝管中,均匀混合后分装至离心管中;b)4℃,3,000rpm,离心10min,小心吸取上层血浆,转移到新的离心管中;c)4℃,12,000rpm,离心10min,小心吸取上清液,转移到新的离心管中;d)将300μlproteinasek加入15ml离心管中,再加入3ml血浆;e)再加入2.4mlbufferbeo(含1.0μgcarrierrna),涡旋震荡混匀30s;f)60℃孵育30min,向裂解物中加入5.4mlbufferbee,涡旋震荡混匀15~30s,冰上孵育5min;g)将lsampnucleicmini吸附柱插入lsvac20plus上的lcf-connector,打开吸附柱盖子,插入20mltubeextender;h)将裂解物加至吸附柱中,开启真空泵,当其完全通过吸附柱后,关闭真空泵并将压力释放至0mbar;i)闭上吸附柱的盖子,将其从真空管中取出,放入干净的2ml收集管中;j)向吸附柱中加入600μlbufferbez1,12,000rpm离心1min,倒掉废液,将吸附柱放回收集管中;k)向吸附柱中加入750μlbufferbez2,12,000rpm离心1min,倒掉废液,将吸附柱放回收集管中;l)将750μl无水乙醇加入吸附柱中,12,000rpm离心1min,倒掉废液,将吸附柱放回收集管中;m)12,000rpm离心2min,以去除吸附柱中残余液体;n)将吸附柱放入新的1.5ml离心管中,打开盖子,室温静置10min,以彻底晾干吸附材料中残余的漂洗液;o)往吸附柱膜中间加入35μl的bufferbxh(60℃预热),室温静置2min;12,000rpm离心2min,洗脱核酸,dna产物应保存在-20℃,以防dna降解;3)加样向pcr反应管(n)中加入上述步骤1配制的检测试剂17.5μl,再加入上述步骤2所得待测样本及质控品的核酸溶液各2.5μl,轻轻混匀,瞬时离心后备用;4)pcr扩增将上述步骤3所得pcr反应管(n)放入扩增仪(实时荧光定量pcr仪)的样品槽中,按对应的顺序设置待测样本及质控品的名称,按下表设置pcr反应条件,选择荧光检测通道:fam通道检测mtb(reporter:fam,quencher:none),vic通道检测内标(reporter:vic,quencher:none),参比荧光(passivereference)设置为none,反应体积设置为20μl;pcr反应程序如表2所示。表25)结果分析反应结束后,仪器自动保存结果,可利用仪器自带软件进行自动分析,也可以手动调节基线的开始值、结束值及阈值线进行分析,然后记录样本ct值;根据下表3判断检测结果。表3质量控制的标准如下:1)阴性质控品fam通道应无ct值显示,且内标ct值≤30;2)阳性质控品fam通道ct值≤30,且内标ct值≤30;以上要求需在同一次实验中同时满足,否则,本次实验视为无效,需重新进行检测。实施例2本实施例提供一种基于血液游离核酸的检测结核分枝杆菌的试剂盒(pcr-膜层析杂交法),其包括pcr反应液、引物、酶、内标、杂交膜条、显色液、阳性质控品和阴性质控品,杂交膜条上附着有杂交探针;内标是核苷酸序列如seqidno.7所示的质粒,质粒浓度为2×104copies/ml,检测内标引物的核苷酸序列如seqidno.5、seqidno.6所示,检测内标引物的上游引物的5’端还依次连接有c3间臂(c3spacer)和第一标签序列,第一标签序列如seqidno.15所示;检测内标引物的下游引物的5’端还连接有第一显色标记物,第一显色标记物能与结合有微球的第二显色标记物相连接,微球富集后显色;第一显色标记物为生物素,第二显色标记物为链霉亲和素。引物包括检测mtb靶核苷酸引物(即mtb引物对)和上述检测内标引物,检测mtb靶核苷酸引物的核酸序列如seqidno.1、seqidno.2、seqidno.3、seqidno.4所示;检测mtb靶核苷酸引物的上游引物的5’端还依次连接有c3间臂和第二标签序列,第二标签序列如seqidno.16所示;检测mtb靶核苷酸引物的下游引物的5’端还连接有第一显色标记物;pcr反应液包括以下组分:pcr缓冲液、dutpplusdntpmixture和金属阳离子,酶由热启动taq酶和ung酶构成;在pcr反应中,pcr反应液中各组分的浓度为:1×pcr缓冲液、0.2~2mmdutpplusdntpmixture和1~3mm金属阳离子;内标为0.5~2μl,每种引物为0.1~0.5μm,热启动taq酶为0.5~1.5u,ung酶为0.05~0.5u;质控品由阳性质控品和阴性质控品组成,阳性质控品为含mtb靶核苷酸序列的克隆菌液,克隆菌液中克隆菌浓度为1000cfu/ml,mtb靶核苷酸序列如seqidno.8、seqidno.9所示;阴性质控品为无菌生理盐水;显色液包括连接有第二显色标记物的微球,显色液所含物质的终浓度为:100mmhepps-hcl缓冲液(hepps,4-羟乙基哌嗪丙磺酸)、ph8.0;1m氯化钠,0.4mmedta溶液、ph8.0,1%latex微球。杂交探针包括第一杂交探针和第二杂交探针,第一杂交探针的序列如seqidno.13所示,第二杂交探针的序列如seqidno.14所示;杂交膜条的制备方法为:将硝酸纤维素膜(4.6cm×20cm)贴附于pvc板上(6cm×20cm),再将吸水纸(2cm×20cm)粘贴于pvc板上,与硝酸纤维素膜有0.6cm重叠;将2种探针以20ng/μl的浓度喷划在硝酸纤维素膜上(probe:200ng/cm,hp1、hp2),并以喷划红色打印油墨为位置线区分(第一杂交探针在第二杂交探针的上方);将制好的半成品pvc板置于37℃烘箱干燥过夜,最后切成(2mm×6cm)的成品pas膜条即可,如图1所示;同时,核酸序列如表1所示。另外,本实施例还提供上述试剂盒(pcr-膜层析杂交法)的检测方法,依次包括以下步骤:s1)试剂准备根据待测样本及质控品的数量(n),每份检测试剂是按以下组分和用量配制:pcr反应液13μl,内标和引物共4.2μl,酶液0.3μl;充分混匀,瞬时离心后备用试剂准备;s2)血液游离核酸的提取及纯化(质控样品参与提取过程)a)将血液采集到edta抗凝管中,均匀混合后分装至离心管中;b)4℃,3,000rpm,离心10min,小心吸取上层血浆,转移到新的离心管中;c)4℃,12,000rpm,离心10min,小心吸取上清液,转移到新的离心管中;d)将300μlproteinasek加入15ml离心管中,再加入3ml血浆;e)再加入2.4mlbufferbeo(含1.0μgcarrierrna),涡旋震荡混匀30s;f)60℃孵育30min,向裂解物中加入5.4mlbufferbee,涡旋震荡混匀15~30s,冰上孵育5min;g)将lsampnucleicmini吸附柱插入lsvac20plus上的lcf-connector,打开吸附柱盖子,插入20mltubeextender;h)将裂解物加至吸附柱中,开启真空泵,当其完全通过吸附柱后,关闭真空泵并将压力释放至0mbar;i)闭上吸附柱的盖子,将其从真空管中取出,放入干净的2ml收集管中;j)向吸附柱中加入600μlbufferbez1,12,000rpm离心1min,倒掉废液,将吸附柱放回收集管中;k)向吸附柱中加入750μlbufferbez2,12,000rpm离心1min,倒掉废液,将吸附柱放回收集管中;l)将750μl无水乙醇加入吸附柱中,12,000rpm离心1min,倒掉废液,将吸附柱放回收集管中;m)12,000rpm离心2min,以去除吸附柱中残余液体;n)将吸附柱放入新的1.5ml离心管中,打开盖子,室温静置10min,以彻底晾干吸附材料中残余的漂洗液;o)往吸附柱膜中间加入35μl的bufferbxh(60℃预热),室温静置2min;12,000rpm离心2min,洗脱核酸,dna产物应保存在-20℃,以防dna降解;3)加样向pcr反应管(n)中加入上述步骤1配制的检测试剂17.5μl,再加入上述步骤2所得待测样本和质控品的核酸溶液各2.5μl,轻轻混匀,瞬时离心后备用;4)pcr扩增将上述步骤3所得pcr反应管(n)放入扩增仪(普通基因扩增仪)的样品槽中,反应体积设置为20μl,pcr反应程序如表4所示。表45)层析杂交反应结束后,将pcr反应管(n)瞬时离心,在生物安全柜内等体积加入20μl显色溶液,充分混匀后,在pcr反应管(n)中插入pas膜条,5~15min快速杂交反应后即可判读结果。6)结果分析可参见图1中标准比色卡所示区域的条带相对位置进行定性判读,亦可参照下表5,对显色结果进行拍照保存。表5结果质控区检测区判读1有/无蓝色条带有蓝色条带阳性2有蓝色条带无蓝色条带阴性质量控制的标准如下:1)阴性质控品应出现1条蓝色条带,位于内标(ic线),且检测区(t线)没有条带或强度<l4;2)阳性质控品应出现2条蓝色条带,分别位于内标(ic线)和检测区(t线),且强度≥l4;3)若样本检测为阴性,则内标(ic线)条带强度应≥l2,样本有效;4)若样本检测为阳性,则内标(ic线)条带强度可强可弱,甚至无条带,样本有效;以上要求需在同一次实验中同时满足,否则,本次实验视为无效,需重新进行检测。实施例3本实施例采用实施例1~2试剂盒和痰涂片法对临床样本进行检测,临床样本实际情况为:肺结核病例103例,肺外结核病例26例,阴性病例43例,病例总数为172例;本实施例两种试剂盒(pcr-荧光探针法和pcr-膜层析杂交法)测定结果如图2所示,并与痰液涂片法进行对比,对比结果如表6所示;注:表6竖着看是痰涂片检测结果,横着看是本发明两种试剂盒检测结果;以下表格看法类似。表6如表6所示,使用痰涂片方法检查的总体阳性率和阴性率分别为20.93%(36/172)和79.07%(136/172),肺结核患者、肺外结核患者的阳性率分别为20.93%(36/172)、0%(0/172);其中,12例肺结核阳性病例,根据后续临床跟进,确诊为ntm(非结核分枝杆菌)感染;采用临床诊断结果为金标准,经统计,痰涂片法的假阳性率为27.91%(12/43),假阴性率为81.4%(105/129),诊断符合率为31.98%(55/172),此法虽操作简便,适于普通筛查,但不能区分ntm感染病例,对肺外结核检测难,敏感性和特异性太差,诊断符合率低。然而,本发明两种试剂盒检测结果是一致的:172例血液样本的总体阳性率和阴性率分别为75%(129/172)和25%(43/172),肺结核患者、肺外结核患者的阳性率分别为59.88%(103/172)、15.12%(26/172);采用临床诊断结果为金标准,经统计,该试剂盒的假阳性率为0%(0/43)、假阴性率为0%(0/129)、诊断符合率为100%(172/172),有效的区分mtb感染与ntm感染病例,显著提高痰涂片阴性结核病例和肺外结核患者的诊断率,提高tb诊断的准确率和符合率。实施例4本实施例采用实施例1~2试剂盒和痰培养法对临床样本进行检测,临床样本实际情况为:肺结核病例126例,肺外结核病例39例,阴性病例是48例,病例总数为213例;本实施例两种试剂盒(pcr-荧光探针法和pcr-膜层析杂交法)测定结果如图3所示,并与痰培养法法进行对比,对比结果如表7所示。表7如表7所示,痰培养方法检测的总体阳性率和阴性率分别为29.58%(63/213)和70.42%(150/213),肺结核患者、肺外结核患者的阳性率分别为28.64%(61/213)、0.94%(2/213);采用临床诊断结果为金标准,经统计,该方法假阳性率为0%(0/48),假阴性率为61.82%(102/165),诊断符合率为52.11%(111/213)。此法虽特异性较好,但检测周期过长,对肺外结核患者诊断难,敏感性较差,易造成漏诊。然而,本发明两种试剂盒检测结果是一致的:213例血液样本的总体阳性率和阴性率分别为77.46%(165/213)和22.54%(48/213),肺结核患者、肺外结核患者的阳性率分别为59.15%(126/213)、18.31%(39/213);采用临床诊断结果为金标准,经统计,该方法假阳性率为0%(0/48),假阴性率为0%(0/165),诊断符合率为100%(213/213),本发明试剂盒的检测周期明显缩短、操作更简便,减少由于结核菌死亡或活力低下造成的假阴性结果,显著提高痰培养阴性结核病例和肺外结核患者的阳性率,提高tb诊断的准确率和符合率。实施例5本实施例采用实施例1~2试剂盒和痰培养法对临床样本进行检测,临床样本实际情况为:肺结核病例24例,hiv+tb病例37例,肺外结核病例15例,阴性病例是13例,病例总数为89例;本实施例两种试剂盒(pcr-荧光探针法和pcr-膜层析杂交法)测定结果如图4所示,并与tb-igra释放反应法进行对比,对比结果如表8所示。表8如表8所示,tb-igra释放反应法检测的总体阳性率和阴性率分别为56.18%(50/89)和43.82%(39/89),肺结核患者、hiv+tb患者、肺外结核患者的阳性率分别为25.84%(23/89)、15.73%(14/89)、14.61%(13/89);采用临床诊断结果为金标准,经统计,该方法假阳性率为46.15%(6/13),假阴性率为42.11%(32/76),诊断符合率为57.3%(51/89),此法对于肺感染结核菌的阳性检出率高(87.5%,21/24),据报道γ-干扰素定量较高与活动性结核病有一定相关性,并不能完全鉴别潜伏性结核菌感染和活动性结核病,能区分mtb感染与ntm感染,亦能对肺外结核感染有较高的阳性检出率(80%,12/15),但由于部分病例存在免疫缺陷或接受过免疫治疗,机体内的免疫应答能力低下,其对于hiv并发活性结核感染患者的阳性检出率明显偏低(29.73%,11/37),易造成误诊。然而,本发明两种试剂盒检测结果是一致的:89例血液样本的总体阳性率和阴性率分别为85.39%(76/89)和14.61%(13/89),肺结核患者、hiv+tb患者、肺外结核患者的阳性率分别为26.97%(24/89)、41.57%(37/89)、16.85%(15/89);采用临床诊断结果为金标准,经统计,该方法假阳性率为0%(0/13),假阴性率为0%(0/76),诊断符合率为100%(89/89)。本发明使用血液中游离核酸作为检测靶标,能避免免疫诊断的缺陷,显著提高了hiv并发结核感染病例的阳性检出率,同时兼顾对肺结核与肺外结核的高敏感性和特异性,提高tb诊断的准确率和符合率。实施例6本实施例采用实施例1~2试剂盒和xpertmtb/rif实验法对临床样本进行检测,临床样本实际情况为:肺结核病例31例、hiv+tb病例17例、肺外结核病例18例,阴性病例是55例,病例总数为121例;本实施例两种试剂盒(pcr-荧光探针法和pcr-膜层析杂交法)测定结果如图5所示,并与xpertmtb/rif实验法进行对比,对比结果如表9所示。表9如表9所示,使用xpertmtb/rif实验法检测的总体阳性率和阴性率分别为38.02%(46/121)和61.98%(75/121),肺结核患者、hiv+tb患者、肺外结核患者的阳性率分别为27.27%(33/121)、6.61%(8/121)、4.13%(5/121);采用临床诊断结果为金标准,经统计,该方法假阳性率为7.27%(4/55),假阴性率为36.36%(24/66),诊断符合率为76.86%(93/121),此法简便快速、全自动检测,且能对结核菌耐药情况进行检测,具有较高的灵敏度和特异性,是目前较普遍使用的分子诊断方法,但对于某些特殊病例,痰液的采集相对困难,如儿童tb患者或肺外结核患者,对咳出痰或诱导痰、胃液等样本的检测敏感度较差,检测精密度差,故存在一定的缺点。然而,本发明两种试剂盒检测结果是一致的:121例血液样本的总体阳性率和阴性率分别为54.55%(66/121)和45.45%(55/121),肺结核患者、hiv+tb患者、肺外结核患者的阳性率分别为25.62%(31/121)、14.05%(17/121)、14.88%(18/121);采用临床诊断结果为金标准,经统计,该方法假阳性率为0%(0/55),假阴性率为0%(0/66),诊断符合率为100%(121/121)。由于待测样本为血液,能有效避免上述特殊病例采样困难的情况,样本的均一性更好,且利用先进的游离核酸提取技术,经检测结果精密度良好,对于上述特殊病例有更好的敏感性和特异性,提高tb诊断的准确率和符合率。总之,根据上述4组临床数据表明,本发明两种试剂盒(pcr-荧光探针法和pcr-膜层析杂交法)具有极好的敏感性和特异性,与现有的检测手段相比较,能显著提高痰涂片、痰培养阴性结核患者的阳性检出率及hiv并发结核感染患者和肺外结核患者的阳性检出率,解决了特殊病例痰液采集样本困难及均一性差的问题,检测周期短、简便快速,且不与非结核的肺部疾病发生交叉反应,与临床诊断结果的符合率达到100%。实施例7为证明本发明的合理性和可行性,对试剂盒及方法进行了以下性能评估研究:1)最低检出限实验(灵敏度实验)根据上述实施例1、2试剂盒和方法对中国食品药品检定研究院提供的结核分枝杆菌pcr检测试剂盒用国家参考品中的最低检出量参考品s4(1个菌/ml)进行20次重复检测,其阳性检出率(+/+)为100%(20/20),说明本发明所提供的检测试剂盒和方法具有很高的灵敏度(个菌/ml),明显优于普通的荧光pcr方法和杂交法,结果如图6所示。2)pcr产物污染的预防实验在对pcr产物的后续处理时,容易产生气溶胶现象(含有阳性样本的pcr扩增产物,浓度一般低于1×103copies/ml),导致实验室环境污染,给后续实验带来一定的假阳性风险,因此在pcr体系中设置预防pcr产物污染的措施很重要。本发明试剂盒中设置有ung-dutp防污染系统,利用ung酶水解反应体系中的u-dna扩增产物,同时通过高温灭活ung酶,不影响新一轮pcr产物的生产,从而达到预防污染的作用。根据上述实施例1、2试剂盒和方法对以下待测样本进行检测,以两组不同的反应体系(第1组:含ung酶、第2组:不含ung酶)进行对比实验,测定ung酶对u-dna扩增产物的防污染效果,待测样本的配制及检测结果如表10所示。表10如表10和图7所示,本发明试剂盒中加入ung-dutp防污染系统,可以有效的预防u-dna扩增产物的污染。3)特异性实验根据上述实施例1、2试剂盒和方法对中国食品药品检定研究院提供的结核分枝杆菌pcr检测试剂盒用国家参考品中的阴性参考品(鸟分枝杆菌、土地分枝杆菌、施氏分枝杆菌、堪萨斯分支杆菌、亚洲分枝杆菌、瘰疬分枝杆菌、戈登分枝杆菌、龟脓分枝杆菌、偶然分枝杆菌、草分枝杆菌、巴西诺卡氏菌、北京棒杆菌、肺炎球菌、嗜肺军团菌、百日咳博德特氏菌)以及肺炎支原体、肺炎衣原体、呼吸道合胞病毒和流感病毒等样本进行提取和检测,其阴性检出率(-/-)为100%(19/19),说明本发明所提供的检测试剂盒和方法具有很高的特异性,不会与其他常见呼吸道病原菌发生交叉反应;检测结果如图8所示。4)对潜在内源物质的抗干扰性根据上述实施例1、2试剂盒和方法对含有5%用量潜在内源物质(15%edta溶液、120g/l血红蛋白、1mm甘油三酯)的临床血液样本进行提取和检测。如图9所示,检测结果均与正常对照组及临床诊断结果一致,说明本发明所提供的试剂盒和方法对潜在内源物质的抗干扰性强。5)对潜在外源药物残留的抗干扰性根据上述实施例1、2试剂盒和方法对含有5%用量医学相关水平的潜在外源药物浓度(10μg/ml异烟肼、250μg/ml利福平、10μg/ml左氧氟沙星、50μg/ml乙胺丁醇、250μg/ml吡嗪酰胺)的临床血液样本进行提取和检测。如图10所示,检测结果均与正常对照组及临床诊断结果一致,说明本发明所提供的试剂盒和方法对潜对外源药物残留的抗干扰性强。实施例8本实施例采用上述实施例3中所得临床血液样本的cfdna样本(n=50例),样本来自临床上已确诊的肺结核患者、hiv+tb患者、肺外结核患者和排除结核的肺部疾病患者,样本数分别为9例、11例、13例、17例,采用市面上较好的结核分枝杆菌荧光pcr试剂盒,严格按照厂家说明书进行检测;检测结果如表11和图11所示。表11如表11所示,某厂家结核分枝杆菌荧光pcr试剂盒的总体阳性率和阴性率分别为12%(6/50)和88%(44/50);采用临床诊断结果为金标准,经统计,该方法诊断符合率为46%(23/50)。然而,本发明两种试剂盒检测结果是一致的:总体阳性率和阴性率分别为66%(33/50)和34%(17/50);采用临床诊断结果为金标准,经统计,该方法诊断符合率为100%(50/50),本发明检测试剂盒和方法的特异性和敏感性大大优于目前市面上的荧光pcr检测试剂盒。最后所应当说明的是,以上实施例用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者同等替换,而不脱离本发明技术方案的实质和范围。序列表<110>广州市宝创生物技术有限公司<120>一种基于血液游离核酸的检测结核分枝杆菌的试剂盒<130>2018.9.12<160>16<170>patentinversion3.3<210>1<211>20<212>dna<213>人工合成序列<400>1cgtacaaggccttcgattgg20<210>2<211>20<212>dna<213>人工合成序列<400>2gctcagttcaccttgcacaa20<210>3<211>19<212>dna<213>人工合成序列<400>3gtaggcgtcggtgacaaag19<210>4<211>19<212>dna<213>人工合成序列<400>4ggaccaccagcacctaacc19<210>5<211>18<212>dna<213>人工合成序列<400>5gagtatgcctgccgtgtg18<210>6<211>18<212>dna<213>人工合成序列<400>6aatccaaatgcggcatct18<210>7<211>110<212>dna<213>人工合成序列<400>7gagtatgcctgccgtgtgaaccatgtgactttgtcacagcccaagatagttaagtgggat60cgagacatgtaagcagcatcatggaggtttgaagatgccgcatttggatt110<210>8<211>119<212>dna<213>人工合成序列<400>8cgtacaaggccttcgattgggaccaggcctatcgcaagccaatcacctatgacacgctgt60ggcaggctgacaccgatccgctgccagtcgtcttccccattgtgcaaggtgaactgagc119<210>9<211>96<212>dna<213>人工合成序列<400>9gtaggcgtcggtgacaaaggccacgtaggcgaaccctgcccaggtcgacacataggtgag60gtctgctacccacagccggttaggtgctggtggtcc96<210>10<211>20<212>dna<213>人工合成序列<400>10cctatcgcaagccaatcacc20<210>11<211>22<212>dna<213>人工合成序列<400>11cacgtaggcgaaccctgcccag22<210>12<211>20<212>dna<213>人工合成序列<400>12tgactttgtcacagcccaag20<210>13<211>23<212>dna<213>人工合成序列<400>13cgagatcggtggttacttagatt23<210>14<211>21<212>dna<213>人工合成序列<400>14gcaaccttagagcaaggtcaa21<210>15<211>23<212>dna<213>人工合成序列<400>15gctctagccaccaatgaatctaa23<210>16<211>21<212>dna<213>人工合成序列<400>16cgttggaatctcgttccagtt21当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1