环烯酮类化合物及其制备方法和应用与流程
本发明属于医药技术领域,具体涉及一种从植物白花败酱草中分离得到的新的环烯酮类化合物及其应用。
背景技术:
白花败酱草(patriniavillosa(thunb.)juss),为多年生直立草本植物。根茎及根有陈腐臭味,故得名。花期为8-10月,果期为9-11月。瘦果椭圆形,仅一室发育,内有种子1枚。种子扁椭圆形,胚直立,无胚乳。白花败酱草在我国大部分地区均有分布,生于海拔400-1500米的山地林下、林缘或灌丛、草丛中,在东亚地区也有分布。白花败酱草全草可入药,其性味苦、寒、无毒;具有散瘀消肿,活血排脓、治肠痈有脓,血气心腹痛,目赤障膜弩肉及敷疮疖疥癣等功效;在中医中主要用于治疗阑尾炎、痢疾、肝炎、扁桃体炎、痈肿疮毒等症。
临床常用抗肿瘤药物多为化学合成药物,这类药物虽然对肿瘤细胞具有较强的抑制效果,但是其对正常细胞的杀伤作用也同样明显,毒副作用较大。传统中药具有较长的应用历史,其毒副作用相对较小,因此以植物药、中药为依托的药物开发一直成为研究热点。
技术实现要素:
本发明的目的是通过对白花败酱草进行系统的化学成分研究,明确其化学成分,为天然药物化学研究积累资料。本发明首次从白花败酱草中提取出具有良好活性的天然产物环烯酮a,通过深入的研究其在抗肿瘤中具有显著的效果。
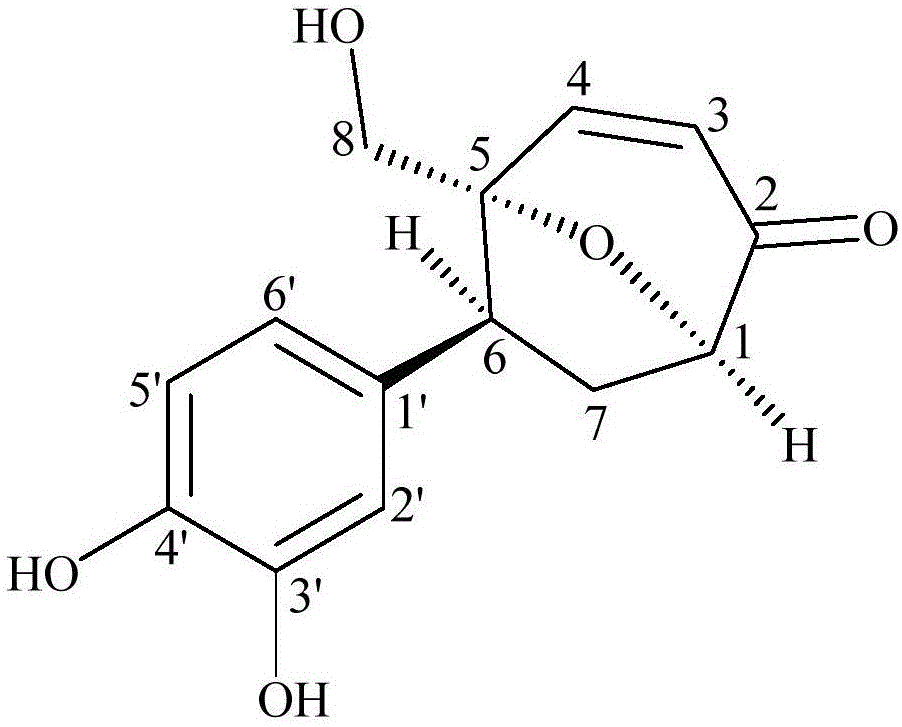
本发明采用的技术方案是:环烯酮类化合物,是从白花败酱草叶片中提取分离得到的一种新的环烯酮类化合物,命名为环烯酮a(impecylonea),具有如(i)所示的结构式:
环烯酮类化合物的制备方法,包括如下步骤:
1)提取:将白花败酱草的叶片粉碎,风干,用70%乙醇于85-95℃下加热回流提取120-180min,提取液过滤,滤液减压蒸发浓缩成浸膏;
2)分离:将步骤1)所得浸膏加水制成水悬液,将水悬液依次用石油醚和二氯甲烷进行萃取,收集二氯甲烷层,将二氯甲烷层减压蒸发回收二氯甲烷制浸膏;
3)步骤2)所得浸膏用正相硅胶柱层析色谱,以体积比为40:1的二氯甲烷-甲醇混合液进行洗脱,收集洗脱液,将收集的洗脱液再经ods硅胶柱层析,以体积分数为40%的甲醇-水混合液进行洗脱,收集洗脱液,高效液相色谱纯化后得环烯酮a。
本发明的有益效果是:
1.本发明的化合物,制备原料资源丰富,提取分离技术难度小,溶剂可回收使用,生产成本低。
2.本发明的化合物,经实验研究表明,本发明的化合物对肿瘤有明显的抑制作用。因此,可以用于制备抗肿瘤药物。
附图说明
图1是本发明环烯酮a的结构图。
图2是本发明环烯酮a的1hnmr谱。
图3是本发明环烯酮a的13cnmr谱。
图4是本发明环烯酮a的1h-1hcosy谱。
图5是本发明环烯酮a的hsqc谱。
图6是本发明环烯酮a的hmbc谱。
图7是本发明环烯酮a的roesy谱。
图8是本发明环烯酮a的hr-esi-ms谱。
图9a是药物对肿瘤细胞hepg2的抑制作用。
图9b是药物对肿瘤细胞a549的抑制作用。
图9c是药物对肿瘤细胞a2780的抑制作用。
图10是形态学观察药物对hepg2和a549细胞活性的影响。
图11a是不同浓度药物对hepg2细胞凋亡的影响。
图11b是不同浓度药物对hepg2细胞凋亡的影响的柱状图。
图11c是不同浓度药物对a549细胞凋亡的影响。
图11d是不同浓度药物对a549细胞凋亡的影响的柱状图。
图12a是不同浓度药物药物对hepg2细胞周期的影响。
图12b是不同浓度药物对hepg2细胞周期的影响的柱状图。
图12c是不同浓度药物对a549细胞周期的影响。
图12d是不同浓度药物对a549细胞周期的影响的柱状图。
具体实施方式
下面通过实施例进一步描述本发明,使本专业技术更全面地理解本发明,但不以任何方式限制本发明。
实施例1
(一)环烯酮a的制备
1)提取:取白花败酱草(patriniavillosa(thunb.)juss)叶片,风干,粉碎,得白花败酱草粉末。取白花败酱草粉末15kg,用120l70%乙醇于90℃下加热回流150min,共提取3次,合并提取液。提取液过滤,所得滤液减压蒸发浓缩得2.8kg浸膏。
2)取1000g步骤1)所得浸膏,加4000ml水制成水悬液,将水悬液依次用(4000×3)ml石油醚和(4000×3)ml二氯甲烷和(4000×3)ml正丁醇进行萃取,收集二氯甲烷层,将二氯甲烷层萃取物减压蒸发浓缩回收二氯甲烷制浸膏(110g)。
3)将步骤2)获得的浸膏用正相硅胶柱层析色谱,分别以体积比为100:0-0:100的二氯甲烷-甲醇混合液进行梯度洗脱得到10个馏分,薄层层析检测,收集经体积比为40:1的二氯甲烷-甲醇混合液洗脱得到产物,将产物再经ods硅胶柱层析,分别以体积分数为20%、40%、60%及80%的甲醇-水混合液进行洗脱,经检测收集经体积分数为40%的甲醇-水混合液洗脱得到的馏分,最后经制备型高效液相色谱仪纯化,得到新化合物环烯酮a(impecylonea),称重为51.2mg。
(二)检测
1、本发明的新化合物环烯酮a,黄色油状,hr-esi-ms在m/z261.0727处给出[m-h]-峰,13c核磁共振数据显示有不饱和度为8,推算其分子式为c14h14o5,1h和13c核磁共振数据如表1所示。
表1环烯酮a的1h和13c核磁共振数据
2、环烯酮a(impecylonea)结构解析:
如图2-8所示,本发明获得的环烯酮a的1hnmr、13cnmr、2d-nmr(1h-1hcosy、hsqc、hmbc、和rosey)谱,以及hr-esi-ms谱得知化合物结构。具体地说:
13c-nmr(100mhz,dmso-d6)谱给出了14个碳信号,包括2个亚甲基、7个次甲基和5个季碳。1h-nmr(400mhz,dmso-d6)谱中,δh6.56(1h,d,j=1.8hz,h-2’),6.62(1h,d,j=8.1hz,h-5’),6.43(1h,dd,j=8.1,1.8hz,h-6’),提示结构中存在一个对位和间位取代的苯环片段,这与13c-nmr(100mhz,dmso-d6)谱中给出的碳信号相一致,δc115.8(c-2’),115.3(c-5’),119.5(c-6’)。hmbc谱中的交叉峰信号提示以下三个碳信号属于同一个苯环,δc127.9(c-1’),144.2(c-3’),144.8(c-4’)。
结合1hnmr、13cnmr和hsqc谱数据,δh6.17(1h,d,j=10.0,1.8hz,h-3),δc127.0(c-3);δh6.80(1h,d,j=10.0hz,h-4),δc154.5(c-4),δc196.9(c-2),提示存在α,β不饱和酮;δh3.57(d,j=12.7hz),3.69(d,j=12.7hz),δc62.2(c-8),提示存在一个ch2oh基团;碳信号δc85.7所对应的季碳与一个氧原子相连。在苯环上,δh4.50(1h,dd,j=8.5,1.2hz,h-1),δc79.6(c-1),δh3.41(1h,dd,j=10.1,7.8hz,h-6),δc46.4(c-6),提示存在2个次甲基基团;δh2.82(1h,ddd,j=13.2,9.6,9.0hz,h-7α),1.76(1h,ddd,j=13.2,7.2,1.8hz,h-7β),δc32.9,提示存在1个亚甲基基团。
hmbc谱中,芳香质子信号δh6.56(h-2’)与δc46.4(c-6)相关,芳香质子信号δh6.43(h-6’)与δc46.4(c-6)相关,提示一个存在对位和间位取代的苯环与c-6位相连。检测该化合物中的5个氧原子后发现,其中4个氧原子包含于α,β不饱和酮中。在这4个氧原子中,包含1个ch2oh基团和2个酚羟基,因此在这个化合物中仍然还有1个氧原子未确定。考虑到hmbc谱中δh4.50(h-1)与δc85.7(c-5)之间的相关性以及13c-nmr(100mhz,dmso-d6)谱中c-1和c-5的碳信号化学位移值出现在相对低场区,所以剩余1个氧原子应与c-1和c-5相连并在c-1和c-5之间形成了一个氧桥。通过hmbc,1h-1hcosy以及roesy相关谱确定了该化合物的完整分子结构。通过比较该化合物的波谱数据和impecylone的波谱数据发现该化合物除了在c-3’位上存在一个酚羟基取代基外,其它结构相似。由于与impecylone中的hepatomic环相同的波谱数据,该化合物的相对构型得以确定。该化合物命名为(1r,5r,6s)5-(hydroxymethyl)-6-(3’,4’-dihydroxyphenyl)-8-oxa-bicyclo[3,2,1]oct-3-en-2-one,为一未见文献报道的新环烯酮类化合物。
实施例2环烯酮a(impecylonea)的细胞毒活性实验
1、实验材料
1.1、受试样品:
impecylonea用dmso溶解,加入pbs配成溶液或均匀的混悬液,然后用含有dmso的pbs稀释,得impecylonea药液。
1.2、细胞株
hepg-2(人肝癌细胞)、a549(人肺癌细胞)、a2780(人卵巢癌细胞)。
1.3、培养液
rpmi1640培养基、高糖dmem基本细胞培养液、mem基本培养液、胎牛血清(fbs)。
1.4、其他材料
酶标仪、96孔培养板、6孔培养板、死活试剂盒、细胞周期检测试剂盒、annexinv/pi细胞凋亡检测试剂盒。
2、mtt法检测
方法:取对数生长期的肿瘤细胞,经0.25%胰蛋白酶-edta消化后,用培养液调节细胞密度为5000个/孔,接种于96孔细胞培养板中,每孔100μl,置于37℃、5%co2条件下培养24h,弃去培养液后,加入100μl药液,培养24h后加入10μlmtt(5mg/ml),继续孵育4h,弃上清液,加入150μldmso,振荡溶解结晶10min,酶标仪检测570nmod值。计算公式为:抑制率%=(1-给药组od570/对照组od570)×100%。
实验结果如图9a-图9c所示,药物对hepg2和a549均有杀伤作用,而随着浓度的增加,细胞的存活率降低,药物以剂量依赖的方式抑制hepg2和a549细胞增殖:当浓度低于10μm时,药物对hepg2细胞和a549细胞没有明显的抑制作用;当浓度高于50μm时,药物对hepg2细胞和a549细胞具有明显的抑制作用。药物作用24h后对hepg2细胞和a549细胞的半数抑制率(ic50)分别为38.37μm和29.22μm,在相同浓度范围内药物对a2780细胞无明显生长抑制现象。由此可见,a549细胞对药物最为敏感。
3、live/dead细胞染色法
方法:死活试剂盒中包含两种荧光探针分别为钙黄绿素-am和乙锭二聚体-1(ethd-1),绿色荧光钙黄绿素-am可着染活细胞,红色荧光ethd-1可着染死细胞。钙黄绿素-am可轻易的穿透活细胞的细胞膜,进入细胞质后酯酶会将其水解为钙黄绿素,发出强绿色荧光。ethd-1不能穿透完整的细胞质膜,可进入细胞膜破损的死细胞中,与细胞内的核酸反应产生红色荧光。具体配方为取0.8ul的钙黄绿素-am母液和2ul的ethd-1母液,加入到1ml的pbs溶液中混合均匀,室温下避光孵育30min。然后用pbs溶液冲洗3次将多余的荧光染料清洗干净。经染色的细胞在荧光倒置显微镜下进行荧光检测。
实验结果如图10所示,其中死细胞为红色,活细胞为绿色。标尺为200μm。随着处理浓度增加,hepg2和a549细胞死亡数量增加。当药物浓度为20μm时,药物无明显hepg2细胞毒性,浓度为40μm时药物处理组死亡细胞数量增加,当浓度达到80μm时处理组中几乎都为死细胞。而对于a549细胞,当药物浓度为12.5μm、25μm和50μm时,依次出现上述情况。总体来看,随着药物浓度的增加,两种细胞死亡数量均逐渐增加,细胞总数均明显少于对照组。
4、细胞周期及凋亡检测
方法:取对数生长期的细胞,用培养液调节细胞密度为5×104个/孔,接种于6孔细胞板中,37℃、5%co2培养箱内孵育24h,随机分为空白对照组和给药组,以mtt法结果为依据,选择不同浓度的药物作为干预浓度,作用于肿瘤细胞24h后取样,70%乙醇于-20℃固定12h,离心,pbs清洗除尽乙醇,分别采用细胞周期和annexinv/pi双染法检测试剂盒对细胞周期和凋亡进行检测,染色方法按照试剂盒要求进行操作。
药物对hepg2细胞凋亡率的影响见图11a和图11b。结果表明,以20、40、80μm的药物作用于hepg2细胞后,晚期凋亡/坏死的hepg2细胞增多,在各浓度药物组间比较有统计学差异(p<0.01),早期凋亡细胞增多,活细胞减少,药物以剂量依赖的方式诱导hepg2细胞凋亡。
药物对a549细胞凋亡率的影响见图11c和图11d。结果表明,以12.5、25、50μm的药物作用于a549细胞后,晚期凋亡/坏死的a549细胞增多,在各浓度药物组间比较有统计学差异(p<0.01),早期凋亡细胞增多,在各浓度药物组间比较有统计学差异(p<0.05),活细胞减少,药物以剂量依赖的方式诱导a549细胞凋亡。
药物作用hepg2细胞24h后,结果如图12a和图12b,与正常对照组比较,随着药物剂量的增加,g0/g1期细胞有所减少;s期细胞百分率基本保持不变;g2/m期细胞有所增加,由18.6%增加到29.2%,说明药物导致hepg2细胞阻滞于g2/m。
药物作用a549细胞24h后,结果如图12c和图12d,与正常对照组比较,随着药物剂量的增加,g0/g1期细胞逐渐减少;s期细胞百分率基本保持不变;g2/m期细胞逐渐增加,说明药物导致a549细胞阻滞于g2/m。
实验结果表明,impecylonea对hepg-2(人肝癌细胞)、a549(人肺癌细胞)均具有较好的抑制活性,但对a2780(人卵巢癌细胞)无明显的抑制作用。这说明该药物对于肿瘤细胞具有选择性,具有良好的抗肿瘤开发前景。同时本实验通过annexinv/pi双染将早期凋亡、晚期凋亡及坏死细胞区分开,并计算出各自的百分比。研究表明药物对hepg2和a549细胞增殖具有抑制作用,均是通过使周期阻滞并且诱导细胞凋亡途径实现的。
- 还没有人留言评论。精彩留言会获得点赞!