基于脱氧罗丹明的一氧化氮荧光探针的制备和应用的制作方法
本发明属于荧光探针技术领域,具体涉及基于脱氧罗丹明的一氧化氮荧光探针的制备和应用。
背景技术:
一氧化氮(no)是一种重要的气体信号分子,在不同的生理和病理过程中扮演重要角色(s.moncada,e.a.higgs,eur.j.clin.chem.,1991,21361-374)。通过一氧化氮合酶(nos)产生的内生源一氧化氮与多种生理过程紧密相关(d.j.stuehr,j.santolini,z.q.wang,c.c.wei,s.adak,j.biol.chem.,2004,279,36167-36170),比如:一氧化氮可作为信号分子参与信号传导过程(d.a.wink,j.b.mitchell,freeradicalbiol.med.,1998,25,434-456;v.calabrese,c.mancuso,m.calvani,e.rizzarelli,d.a.butterfield,a.m.g.stella,nat.rev.neurosci.,2007,8,766);而且,一氧化氮也可作为内皮衍生舒张因子,参与心血系统的调节和平滑肌舒张(a.demel,f.murad,a.m.seifalian,chem.rev.,2011,111,5742-5767;j.loscalzo,circ.res.,2001,88,756-762.)。此外,水平异常的一氧化氮导致活性氮的产生,与一些疾病相关,比如:癌症,炎症,内皮功能障碍和神经退行性疾病(d.fukumura,s.kashiwagi,r.k.jain,nat.rev.cancer,2006,6,521;p.pacher,j.s.beckman,l.liaudet,physiol.rev.,2007,87,315-424;a.g.tennyson,s.j.lippard,chem.biol.,2011,18,1211-1220)。由于一氧化氮有着重要的生理及临床意义,因此设计有效的方法去准确检测它的含量就显得非常必要。
目前有许多检测no的方法,比如:比色法(x.q.chen,f.wang,j.y.hyun,t.wei,j.qiang,x.ren,i.shin,j.yoon,chem.soc.rev.,2016,45,2976-3016),电化学法(m.m.musameh,c.j.dunn,m.h.uddin,t.d.sutherland,t.d.rapson,biosens.bioelectron.,2018,103,26-31),电子自旋共振波谱法(n.hogg,freeradicalbiol.med.,2010,49,122-129)和化学发光法(j.n.bates,neuroprotocols,1992,1,141-149)。相比于这些传统的方法,荧光分析方法更简单,灵敏,高效,并且能对生物体内外的检测进行实时监控。到目前为止,有许多检测no的荧光探针被报道(m.yang,j.fan,j.zhang,j.du,x.peng,chem.sci.,2018,9,6758-6764;s.-t.wang,y.lin,c.d.spicer,m.m.stevens,chem.commun.,2015,51,11026-11029;y.-q.sun,j.liu,h.zhang,y.huo,x.lv,y.shi,w.guo,j.am.chem.soc.,2014,136,12520-12523;p.zhang,y.tian,h.liu,j.ren,h.wang,r.zeng,y.long,j.chen,chem.comm.,2018,54,7231-7234)。但是,这些探针存在一些问题:(1)以前所报道的这些探针选择性较低,探针与脱氢抗坏血酸,抗坏血酸,丙酮醛反应生成具有荧光的喹喔啉或杂环化合物;(2)这些荧光探针具有相对较长的响应时间,反应时间在5分钟以上。因此,设计和合成具有高选择性且快速响应的荧光探针是非常有意义的。
罗丹明衍生物是荧光探针领域中应用最广泛的一类染料,具有极好的光学性质。最为关键的是,罗丹明的内酰胺螺环状结构没有荧光,破坏这种环状结构后能够引起荧光发射增强。由于结构上的优势,罗丹明内酰胺类化合物是理想的off-on型荧光分子探针,从而实现对分析物高灵敏度的荧光检测。据我们所知,罗丹明类荧光探针已经被广泛地用来检测各种分析物(x.zheng,r.ji,x.cao,y.ge,anal.chim.acta,2017,978,48-54;j.tang,z.guo,y.zhang,b.bai,w.-h.zhu,chem.comm.,2017,53,10520-10523;d.wu,j.-c.ryu,y.w.chung,d.lee,j.-h.ryu,j.-h.yoon,j.yoon,anal.chem.,2017,89,10924-10931;q.wang,x.jiao,c.liu,s.he,l.zhao,x.zeng,j.mater.chem.b,2018,6,4096-4103)。虽然脱氧罗丹明具有与罗丹明相似的化学性质,但是以脱氧罗丹明作为荧光团用来检测仍鲜有报道(x.wu,z.wu,y.yang,s.han,chem.commun.,2012,48,1895-1897;l.he,x.yang,m.ren,x.kong,y.liu,w.lin,chem.commun.,2016,52,9582-9585)。因此设计和合成一个脱氧罗丹明类探针来检测no是非常必要的。
技术实现要素:
根据所提出的要求,本发明人对此进行了深入研究,在付出了大量创造性劳动后,提供了基于脱氧罗丹明的快速响应,高选择性的一氧化氮荧光探针。
本发明的技术方案是,一种基于脱氧罗丹明的一氧化氮荧光探针,其结构式如下:
基于脱氧罗丹明的一氧化氮荧光探针的制备方法。步骤如下:
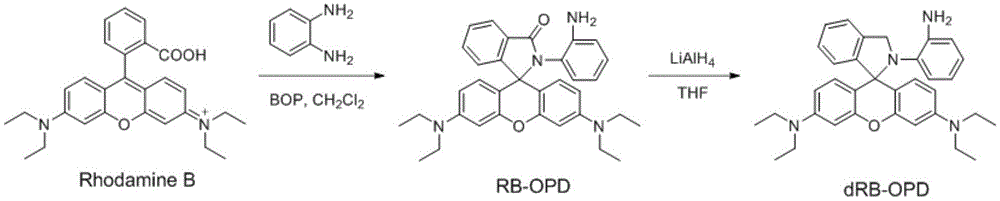
1)在含有30ml二氯甲烷的100ml的圆底烧瓶中加入1当量的罗丹明b,5当量的邻苯二胺和1当量的卡特缩合剂,在室温下搅拌10~14小时,减压蒸馏除去溶剂,粗产品用ch2cl2/ch3cooc2h5体积比约为5:1~3:1的洗脱剂进行柱层析,得到白色固体(rb-opd)(产率73%)。2)在100ml圆底烧瓶中,将0.5当量的化合物rb-opd,5当量的氢化铝锂溶于无水thf中,室温下,在氮气中搅拌10~14小时后,缓慢加入乙醇淬灭,待气体逸出后,加入100ml蒸馏水,反应混合物用100ml二氯甲烷萃取三次,收集有机相,并用无水硫酸镁干燥,通过减压蒸馏除去溶剂,粗产品用ch2cl2/ch3ch2oh体积比约为5:1~3:1的洗脱剂进行柱层析,得到紫色固体产物,即为荧光探针。
基于罗丹明染料的一氧化氮荧光探针的性能研究。首先,研究了该探针的荧光光谱性质,加入no之前,荧光探针没有罗丹明的荧光发射峰,说明探针分子处于内酰胺闭环结构;随着no的加入,在590nm处出现了罗丹明的最大发射峰,并且随着no浓度的增大,探针分子的荧光强度不断增强,当加入25μmno时,荧光强度增强170倍,说明该探针可以高灵敏的对no进行检测。该探针的检测范围从0.005μm到25μm,检测限为1.7nm,这说明该探针可以高灵敏的检测no。其次,还研究了探针对活性氮(onoo-,no2-,no3-),活性氧(hclo,h2o2,·oh,o2-),dha,aa,mgo,生物硫醇(cys,hcy,gsh)和金属离子(k+,mg2+,ca2+,na+,zn2+)的荧光响应情况。结果发现,只有no能引起荧光光谱的改变,其他检测物对探针的荧光光谱没有明显的影响,这说明该探针具有很好的选择性。此外,该荧光探针响应迅速,响应时间在40秒以内。
基于脱氧罗丹明染料的一氧化氮荧光探针的应用。在细胞中加入荧光探针,有红色微弱荧光,这说明细胞中的no含量较低。细胞用脂多糖(lps)处理,刺激细胞内no的产生,然后用探针染色,检测到细胞内出现了很强的红色荧光信号。细胞用氨基胍盐酸盐(ag)处理,抑制细胞内no的产生,发现细胞内红色荧光大大减弱。这些结果说明荧光探针drb-opd能监控细胞内no含量的变化,这为监控人体内和一氧化氮相关病变提供一种可靠的手段。
附图说明
图1为荧光探针的合成路线。
图2为荧光探针与不同浓度的no作用后的荧光光谱图。
横坐标为波长,纵坐标为荧光强度。荧光探针的浓度均为10μm,dea·nonoate(no释放剂)浓度分别为:0,0.005,2.0,4.0,6.0,8.0,10.0,12.0,14.0,16.0,18.0,20.0,22.0,24.0,25.0μm。荧光激发波长为550nm。
图3为荧光探针对不同no浓度的荧光线性响应图。
图4为荧光探针与no作用后的紫外可见吸收光谱图。
横坐标为波长,纵坐标为吸光度。荧光探针的浓度均为10μm,dea·nonoate浓度为25μm。
图5为荧光探针的选择性图。
荧光探针的浓度均为10μm,dea·nonoate浓度为25μm,其它分析物浓度均为200μm。
图6为荧光探针与no作用后荧光强度随时间变化的关系曲线图。
图7为细胞毒性试验。横坐标为荧光探针的浓度,纵坐标为细胞的存活率。
图8荧光探针与no作用的细胞成像图。(a)细胞用探针染色10min。(b)细胞用lps和处理12h,然后用探针染色10min。(c)细胞用lps和ag处理12h,然后用探针染色10min。
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明,但不限于此。
实施例1:
荧光探针的合成
合成路线如图1。化合物rb-opd的合成:在含有30ml二氯甲烷的100ml的圆底烧瓶中加入罗丹明b(0.48g,1.0mmol),邻苯二胺(0.54g,5.0mmol)和卡特缩合剂(0.44g,1.0mmol),在室温下搅拌10~14小时,减压蒸馏除去溶剂,粗产品用体积比约为5:1~3:1的ch2cl2/ch3cooc2h5的洗脱剂柱层析分离得白色固体(0.39g,产率:73%),即为化合物rb-opd。
no荧光探针drb-opd的合成:在100ml圆底烧瓶中,将化合物rb-opd(0.27g,0.50mmol)和氢化铝锂(0.19g,5.0mmol)溶于无水thf中,室温下,在氮气中搅拌10~14小时后,缓慢加入乙醇淬灭,待气体逸出后,加入100ml蒸馏水,反应混合物用100ml二氯甲烷萃取三次,收集有机相,并用无水硫酸镁干燥,通过减压蒸馏除去溶剂,粗产品用体积比约为5:1~3:1的ch2cl2/ch3ch2oh洗脱剂进行柱层析,得到紫色固体产物0.11g(42%),即为所述的荧光探针。1hnmr(400mhz,cdcl3)δ7.46(d,j=6.8hz,1h),7.41(t,j=8.4hz,1h),7.34(t,j=7.2hz,1h),7.11(d,j=7.6hz,1h),6.70-6.84(m,4h),6.49(d,j=7.6hz,1h),6.44(d,j=8.4hz,2h),6.32(s,2h),6.20(d,j=8.0hz,1h),4.43(s,2h),3.71(s,2h),3.37(d,j=6.8hz,8h),1.17(t,j=7.2hz,12h).13cnmr(100mhz,cdcl3)δ154.4,149.3,140.9,134.8,132.6,131.0,129.8,128.9,127.5,125.7,120.2,117.9,116.7,115.4,112.7,108.7,98.1,65.6,58.3,44.7,12.6.ms(tof)m/z519.4.
实施例2:
荧光探针和no溶液配制
探针溶液的制备:称取一定量探针溶解在二甲基亚砜中,配成1×10-4m的探针溶液。no溶液的配制:将一定量的dea·nonoate溶解在0.1mnaoh溶液后,转移到500ml的容量瓶中,加水至刻度线,得到浓度为1.0×10-2mol·l-1的dea·nonoate。将1.0×10-2mol·l-1的dea·nonoate溶液逐渐稀释,得到1.0×10-3-1.0×10-8mol·l-1的dea·nonoate水溶液。将1.0ml探针的备用溶液和1.0ml的dea·nonoate水溶液加入到10ml的容量瓶中,用缓冲溶液定容后,得到浓度为1.0×10-5mol·l-1的荧光探针和1.0×10-4-1.0×10-9mol·l-1的no混合待测溶液。
实施例3:
荧光探针与no作用的荧光光谱的测定
图2为荧光探针与no作用的荧光光谱,荧光探针的浓度为10μm,no的浓度依次为0,0.005,2.0,4.0,6.0,8.0,10.0,12.0,14.0,16.0,18.0,20.0,22.0,24.0,25.0μm。激发波长固定为550nm,发射波长范围为560~640nm,狭缝宽度为5.0nm/5.0nm。所用的荧光测定仪器为日立f4600荧光分光光度计。从图3可以看出,加入no之前,荧光探针在590nm处有较弱的荧光发射峰。随着no的加入,在590nm处发射峰大幅度的增强,并且随着no浓度的增大,探针的荧光强度不断增强,当加入25μm的no时,荧光强度增强至未加入no时的170倍。这是因为探针分子的邻苯二胺与no反应生成苯三唑化合物,探针结构从罗丹明的闭环形式转变为开环形式。图3为探针对不同no浓度的线性响应图,荧光强度跟no的浓度呈现线性关系,线性范围是5.0×10-9~2.5×10-5m,检测限是1.7×10-9m。这说明该探针可以高灵敏的检测no。
实施例4:
荧光探针与no作用的紫外可见吸收光谱的测定
图4为荧光探针与no作用后的紫外可见吸收光谱图,荧光探针的浓度为10μm,no的加入量为25μm。从图4中可以看出,没有加入no时,探针在550nm处有较弱的吸收峰,加入no之后,在该处的吸收峰大幅度增强。紫外可见吸收光谱测定用的仪器为安捷伦cary60紫外可见分光光度计。
实施例5:
荧光探针对no测定的选择性
图5为荧光探针对no测定的选择性图。考察在浓度为10μm的荧光探针溶液中加入no(25μm)及其活性氮(onoo-,no2-,no3-),活性氧(hclo,h2o2,·oh,o2-),dha,aa,mgo,生物硫醇(cys,hcy,gsh)和金属离子(k+,mg2+,ca2+,na+,zn2+)(200μm)的荧光响应情况。从图5中可以看出,只有no能引起荧光光谱的改变,其他检测物对探针的荧光光谱没有明显的影响。这些结果表明,荧光探针对no有较好的选择性。
实施例6:
荧光探针与no作用的响应时间的测定
我们研究了荧光探针对no的响应时间,其结果如图6。从图中可以看出,该探针对no的响应时间不到40秒,这能够满足在实际样品中进行实时监测时对响应时间的要求。从图6我们还可以看出,荧光强度达到最大值后,在之后的时间里,荧光强度不再发生变化,这表明此荧光探针光稳定性较好。
实施例7:
荧光探针在活细胞中的应用
首先,我们做了细胞毒性试验,如图7所示。当加入0~30μmno探针,细胞的成活率均在91%以上,因此可以说明,该荧光探针毒性较小,可应用于检测活细胞内的no。然后,我们研究荧光探针在活细胞中的应用,选择巨噬细胞raw264.7进行共聚焦显微成像,结果如图8所示。在细胞中加入荧光探针,能检测到微弱的红色荧光信号,这说明细胞中的no含量较低(图8a)。文献报道脂多糖(lps)可以刺激小鼠巨噬细胞释放no。细胞用lps预先处理12小时,然后用探针染色10min,检测到细胞内出现了很强的红色荧光信号(图8b);细胞用ag处理12h,然后用探针染色10min,细胞内没有荧光(图8c)。这些结果说明荧光探针能监控细胞内no含量的变化,这为监控人体内和一氧化氮相关病变提供一种可靠的手段。
- 还没有人留言评论。精彩留言会获得点赞!