一种T淋巴细胞无血清培养基及其制备方法与流程
本发明涉及细胞培养
技术领域:
,尤其涉及一种t淋巴细胞无血清培养基及其制备方法。
背景技术:
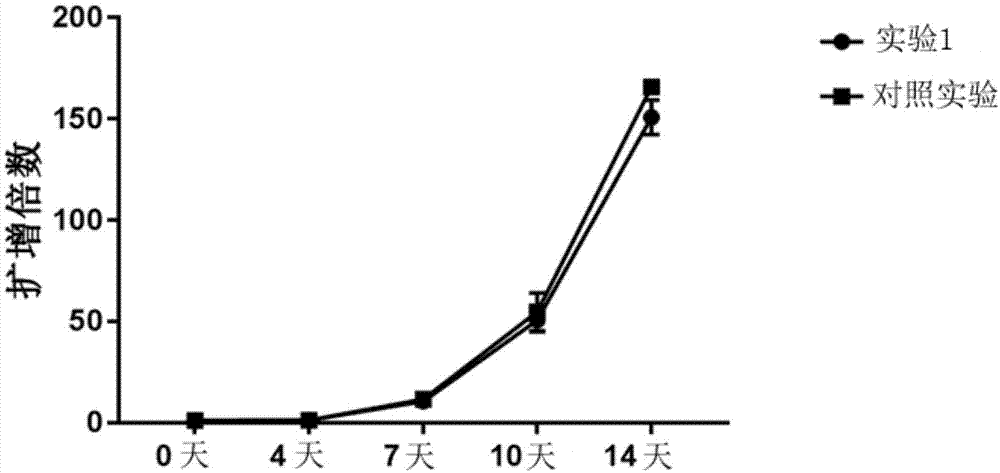
:人外周血中含有多种免疫细胞,其中淋巴细胞是人体主要的免疫细胞类型,包括t细胞、b细胞和自然杀伤细胞等。特异性t细胞主要分为两种,cd4+t细胞和cd8+t细胞。在过继性免疫细胞治疗中,cd4+t细胞除了自身具有杀伤能力外,更可以辅助机体自身的免疫细胞以及共过继的免疫细胞,具有很强的泛用性,并能与cd8+t细胞相互补充。cd4+t淋巴细胞可以分为三个亚群,初始t淋巴细胞、效应性t淋巴细胞以及记忆性t淋巴细胞。由于t淋巴细胞的重要性及在免疫细胞治疗中的推广应用,有效地培养扩增t淋巴细胞以满足供给需求尤为重要,而在扩增培养技术中,培养基对细胞培养的成败及效率有决定性的影响,因此,开发一种具有更好的安全、稳定、高效、廉价等特性的更适用于临床使用的t淋巴细胞培养基,是该领域目前研究的重点项目之一。技术实现要素:本发明针对现有技术存在的以上问题,提供一种使用安全,质量稳定且成本低廉,适用于临床使用的t淋巴细胞无血清培养基,以及该种t淋巴细胞无血清培养基的制备方法。为实现上述目的,本发明采用以下技术方案。一种t淋巴细胞无血清培养基,包括基础培养基和添加物;所述基础培养基由rpmi-1640培养基和imdm培养基组成;所述添加物由以下物质组成且各物质在所述t淋巴细胞无血清培养基中的浓度如下:胰岛素的浓度为3-50mg/l;人血清白蛋的浓度为1-10g/l;人转铁蛋白的浓度为3-50mg/l;乙醇胺的浓度为3-50μmol/l;glutamax-i的浓度为5-20ml/l;硫代甘油的浓度为10-100μmol/l;维生素c的浓度为10-200mg/l;丙酮酸钠的浓度为50-200mg/l;铜元素的浓度为6.26×10-7-6.7×10-5mmol/l;铁元素的浓度为8.27×10-5-5.79×10-2mmol/l;锌元素的浓度为1.24×10-4-7.43×10-2mmol/l;硒元素的浓度为5.78×10-7-3.47×10-4mmol/l。优选的,所述基础培养基由等体积的rpmi-1640培养基和imdm培养基组成。优选的,所述铜元素以硫酸铜的形式添加到基础培养基中,所述t淋巴细胞无血清培养基中硫酸铜的浓度为0.1-10.7μg/l。优选的,所述铁元素以硝酸铁的形式添加到基础培养基中,所述t淋巴细胞无血清培养基中硝酸铁的浓度为0.02-14mg/l。优选的,所述锌元素以硫酸锌的形式添加到基础培养基中,所述t淋巴细胞无血清培养基中硫酸锌的浓度为0.02-12mg/l。优选的,所述硒元素以亚硒酸钠的形式添加到基础培养基中,所述t淋巴细胞无血清培养基中亚硒酸钠的浓度为0.1-60μg/l。优选的,所述胰岛素为使用酵母为载体生产出来的重组人胰岛素。优选的,所述人转铁蛋白来源于人血浆。以上所述t淋巴细胞无血清培养基的制备方法,包括以下步骤:s1、将rpmi-1640培养基与imdm培养基混合均匀,形成基础培养基;s2、向基础培养基中添加胰岛素、人血清白蛋白和转铁蛋白,并混合均匀;s3、继续向基础培养基中添加乙醇胺,并混合均匀;s4、继续向基础培养基中添加glutamax-i,并混合均匀;s5、继续向基础培养基中添加硫代甘油、维生素c和丙酮酸钠,并混合均匀;s6、继续向基础培养基中添加铜元素、铁元素、锌元素和硒元素,并混合均匀;s7、用0.22μm的滤膜过滤步骤s6形成的混合液体,收集滤液,即为t淋巴细胞无血清培养基。与现有技术相比,本发明的有益效果是:本发明通过以rpmi-1640培养基和imdm培养基组成基础培养基,再添加适量的各所述物质,形成一种新的可适用于临床使用的t淋巴细胞无血清培养基,该培养基使用安全,质量稳定且成本低廉。采用该培养基扩增培养t淋巴细胞与采用现有技术常用的gibcoaim-v培养基扩增培养t淋巴细胞,两者的扩增倍数无明显差异;另外,cd3+、cd3+cd4+、cd3+cd8+、cd3+cd56+细胞亚群比较及体外杀伤结果比较均无明显差异。本发明的培养基避免了使用含血清培养基带来的动物源性成分和病原体污染等问题。附图说明图1为实验1和对照实验培养的t淋巴细胞扩增倍数对比图;图2为实验1和对照实验的t淋巴细胞培养14天后细胞表型检测对比图;图3为实验1和对照实验的t淋巴细胞培养14天后细胞体外杀伤率对比图。具体实施方式为了更充分的理解本发明的技术内容,下面结合具体实施例对本发明的技术方案作进一步介绍和说明。实施例使用的部分物质组分如下:胰岛素是使用酵母为载体生产出来的重组人胰岛素,购自sigma公司;人血清白蛋白购自cslbehring公司;人转铁蛋白来源于人血浆,购自biovision公司;glutamax-i购自thermo公司;乙醇胺、硫代甘油、维生素c、丙酮酸钠均购自sigma公司。实施例1本实施例提供一种t淋巴细胞无血清培养基,以及该种t淋巴细胞无血清培养基的制备方法。本实施例的t淋巴细胞无血清培养基包括基础培养基和添加物。基础培养基由等体积的rpmi-1640培养基和imdm培养基组成。添加物由以下物质组成,且各物质在t淋巴细胞无血清培养基中的浓度如下:胰岛素的浓度为5mg/l;人血清白蛋的浓度为5g/l;人转铁蛋白的浓度为5mg/l;乙醇胺的浓度为20μmol/l;glutamax-i的浓度为10ml/l;硫代甘油的浓度为50μmol/l;维生素c的浓度为80mg/l;丙酮酸钠的浓度为110mg/l;硫酸铜的浓度为1.3μg/l硝酸铁的浓度为0.65mg/l;硫酸锌的浓度为0.432mg/l;亚硒酸钠的浓度为14μg/l。本实施例的t淋巴细胞无血清培养基的制备方法如下:s1、将rpmi-1640培养基与imdm培养基混合均匀,形成基础培养基;s2、向基础培养基中添加胰岛素、人血清白蛋白和转铁蛋白,并混合均匀;s3、继续向基础培养基中添加乙醇胺,并混合均匀;s4、继续向基础培养基中添加glutamax-i,并混合均匀;s5、继续向基础培养基中添加硫代甘油、维生素c和丙酮酸钠,并混合均匀;s6、继续向基础培养基中添加铜元素、铁元素、锌元素和硒元素,并混合均匀;s7、用0.22μm的滤膜过滤步骤s6形成的混合液体,收集滤液,即为t淋巴细胞无血清培养基。实施例2本实施例提供一种t淋巴细胞无血清培养基,以及该种t淋巴细胞无血清培养基的制备方法。本实施例的t淋巴细胞无血清培养基包括基础培养基和添加物。基础培养基由等体积的rpmi-1640培养基和imdm培养基组成。添加物由以下物质组成,且各物质在t淋巴细胞无血清培养基中的浓度如下:胰岛素的浓度为3mg/l;人血清白蛋的浓度为1g/l;人转铁蛋白的浓度为3mg/l;乙醇胺的浓度为3μmol/l;glutamax-i的浓度为5ml/l;硫代甘油的浓度为30μmol/l;维生素c的浓度为10mg/l;丙酮酸钠的浓度为50mg/l;硫酸铜的浓度为10.7μg/l硝酸铁的浓度为14mg/l;硫酸锌的浓度为12mg/l;亚硒酸钠的浓度为60μg/l。本实施例的t淋巴细胞无血清培养基的制备方法与实施例1的相同。实施例3本实施例提供一种t淋巴细胞无血清培养基,以及该种t淋巴细胞无血清培养基的制备方法。本实施例的t淋巴细胞无血清培养基包括基础培养基和添加物。基础培养基由等体积的rpmi-1640培养基和imdm培养基组成。添加物由以下物质组成,且各物质在t淋巴细胞无血清培养基中的浓度如下:胰岛素的浓度为50mg/l;人血清白蛋的浓度为10g/l;人转铁蛋白的浓度为50mg/l;乙醇胺的浓度为50μmol/l;glutamax-i的浓度为20ml/l;硫代甘油的浓度为100μmol/l;维生素c的浓度为200mg/l;丙酮酸钠的浓度为200mg/l;硫酸铜的浓度为5μg/l硝酸铁的浓度为7mg/l;硫酸锌的浓度为6mg/l;亚硒酸钠的浓度为30μg/l。本实施例的t淋巴细胞无血清培养基的制备方法与实施例1的相同。实施例4本实施例提供一种t淋巴细胞无血清培养基,以及该种t淋巴细胞无血清培养基的制备方法。本实施例的t淋巴细胞无血清培养基包括基础培养基和添加物。基础培养基由等体积的rpmi-1640培养基和imdm培养基组成。添加物由以下物质组成,且各物质在t淋巴细胞无血清培养基中的浓度如下:胰岛素的浓度为30mg/l;人血清白蛋的浓度为7g/l;人转铁蛋白的浓度为40mg/l;乙醇胺的浓度为35μmol/l;glutamax-i的浓度为15ml/l;硫代甘油的浓度为10μmol/l;维生素c的浓度为150mg/l;丙酮酸钠的浓度为130mg/l;硫酸铜的浓度为0.1μg/l硝酸铁的浓度为0.02mg/l;硫酸锌的浓度为0.02mg/l;亚硒酸钠的浓度为0.1μg/l。本实施例的t淋巴细胞无血清培养基的制备方法与实施例1的相同。分别使用上述实施例1-4配制的t淋巴细胞无血清培养基培养扩增t淋巴细胞(分别记为实验1-4),然后分别检测各培养实验的扩增倍数及扩增培养的t淋巴细胞的体外杀伤率。具体的实验方法如下:一、外周血单个核细胞提取1)采集健康志愿者的外周血,加入到含有肝素钠抗凝剂的离心管内,将外周血用移液器上下吹打混匀后,取样进行全血计数,然后进行离心(离心参数为500×g,离心时间为7min),离心结束后,用移液器吸取上层淡黄色血浆层并转移到新的离心管内,将离心管置于56℃水浴箱内对血浆进行灭活30min;血浆灭活完成后进行离心(离心参数为900×g,离心时间10min),取上层清液于新的离心管中,即为灭活自体血浆,置于2-8℃保存备用。2)用移液器吸取上层淡黄色血浆层后,剩余的液体即为浓缩血细胞,用生理盐水稀释浓缩血细胞至原体积,即为血液稀释液。3)将ficoll分离液加入离心管的底部,将步骤2)中的血液稀释液缓慢的加到ficoll分离液上层,血液稀释液与ficoll分离液的体积比为2:1,然后进行离心(离心参数为700×g,离心时间20min),离心结束后,吸取离心管内的白膜层(外周血单个核细胞),转移到50ml的离心管内并补加生理盐水至50ml,洗涤离心两次,收集外周血单个核细胞。二、t淋巴细胞培养1)用实施例配制的t淋巴细胞培养基重悬上述收集到的外周血单个核细胞并计数,调整细胞密度为0.5×106cell/ml进行培养。2)向培养瓶内的细胞悬液中添加cd3、cd28和il-2细胞因子,使这三种细胞因子的终浓度分别控制在500-550u/ml的范围内;轻轻晃动培养瓶,混匀,培养瓶放置于37℃及co2体积浓度为5%的培养箱中进行培养。3)之后每隔2天向培养瓶内补加一次实施例配制的t淋巴细胞培养基和il-2,并计数,补充t淋巴细胞培养基后使细胞密度保持在0.8-1.0×106cell/ml范围内,细胞因子il-2的浓度控制在500-600u/ml的范围内。4)总共培养14天后,进行细胞计数、流式表型检测及体外杀伤活性检测。对照实验一、外周血单个核细胞提取外周血单个核细胞的提取方法与上述实施例的提取方法一致。二、t淋巴细胞培养1)用现有技术常用于培养t淋巴细胞的gibcoaim-v培养基重悬上述收集到的外周血单个核细胞,并添加5%自体血浆,调整细胞密度为0.5×106cell/ml进行培养。2)向培养瓶内的细胞悬液中添加cd3、cd28和il-2细胞因子,使这三种细胞因子的终浓度分别控制在500-600u/ml的范围内;轻轻晃动培养瓶,混匀,培养瓶放置于37℃及co2体积浓度为5%的培养箱中进行培养。3)之后每隔2天向培养瓶内补加一次实施例配制的t淋巴细胞培养基和il-2,并计数,补充t淋巴细胞培养基后使细胞密度保持在0.8-1.0×106cell/ml范围内,细胞因子il-2的浓度控制在500-600u/ml的范围内。4)总共培养14天后,进行细胞计数、流式表型检测及体外杀伤活性检测。上述分别采用各实施例配制的t淋巴细胞培养基的实验及采用gibcoaim-v培养基的对照实验,扩增培养14天后,各培养实验和对照实验的扩增倍数如下表1所示,实验1和对照实验培养的t淋巴细胞扩增倍数对比图如图1所示。采用本发明所述t淋巴细胞培养基扩增培养t淋巴细胞,扩增倍数与现有技术常用的gibcoaim-v培养基的扩增倍数无明显差异。表1扩增培养14天后t淋巴细胞的扩增倍数实验实验1实验2实验3实验4对照实验扩增倍数150133127149170实验1和对照实验,t淋巴细胞培养14天后细胞表型检测对比图如图2所示,cd3+、cd3+cd4+、cd3+cd8+、cd3+cd56+细胞亚群比较无明显差异。实验1和对照实验,t淋巴细胞培养14天后细胞体外杀伤率对比图如图3所示,实验1的t淋巴细胞培养14天后细胞体外杀伤率为53%,对照实验的t淋巴细胞培养14天后细胞体外杀伤率为57%,体外杀伤结果比较无较大差异。采用本发明所述的t淋巴细胞培养基可以很好地促进t淋巴细胞扩增,为细胞治疗技术的临床应用提供支持。以上所述仅以实施例来进一步说明本发明的技术内容,以便于读者更容易理解,但不代表本发明的实施方式仅限于此,任何依本发明所做的技术延伸或再创造,均受本发明的保护。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1