ROS响应的基因递送载体及其制备方法和应用与流程
本发明属于生物医学材料领域,具体涉及一种ros响应的基因递送载体及其制备方法和应用。
技术背景
基因治疗不仅可以用于治疗遗传性疾病,而且在病毒感染、糖尿病、艾滋病及癌症等的预防和治疗方面也是一种良好的方法策略。然而,由于高分子量和带负电的特性,游离的核酸分子不能有效地被细胞摄取、并且易被胞内胞外的核酸酶降解,生物利用度极低,因此需要合适的载体将其安全有效地递送到靶部位并发挥作用。与病毒载体相比,非病毒载体没有细胞毒性、免疫原性和装载外源基因尺寸限制的缺点,同时还具有制备简便,成本较低的优点。但是,非病毒载体的转染效率较低,限制了其在临床上的应用,因此,开发安全、有效、可控的非病毒载体成为目前基因治疗的一个热门研究领域。
阳离子聚合物聚乙烯亚胺(polyethyleneimine,pei)在非病毒基因载体领域发挥了重要作用,特别是相对分子质量为25kda的支化型pei(branchedpei,bpei),由于具有较高的转染效率,在阳离子聚合物基因载体领域被称为“黄金标准”。肽类树状大分子具有一般树枝状大分子的普遍特性,同时又具有多肽的生物特性,凭借其独特的分子结构、无免疫原性、可生物降解、易于修饰等特性在基因载体方面显示出重要应用前景。其中,将肽类树状大分子与多臂分子结合制备星型阳离子聚合物成为国内外研究者关注的热点。例如多面体低聚倍半硅氧烷(poss)、环糊精和葡聚糖等,经常用做核心以制备出星型阳离子聚合物,它们表现出优异的基因递送能力。
研究发现,肿瘤具有不同于正常组织的微环境,如微酸性环境、高水平表达的某些酶类及活性氧自由基ros等。随着科学技术的发展,基于肿瘤微环境与正常组织的特殊差异设计的刺激响应性载体受到了越来越多的关注。肿瘤及炎症等病灶部位细胞的ros水平比正常细胞要高,因此设计合成ros刺激响应的基因递送载体可以实现基因的有效释放,从而提高其在肿瘤细胞内的转染效率。
技术实现要素:
本发明的目的在于提供一种基于poss三代赖氨酸的具有ros响应性的星型阳离子聚合物作为新型的基因递送载体。
为实现上述技术目的,本发明采用如下技术方案:
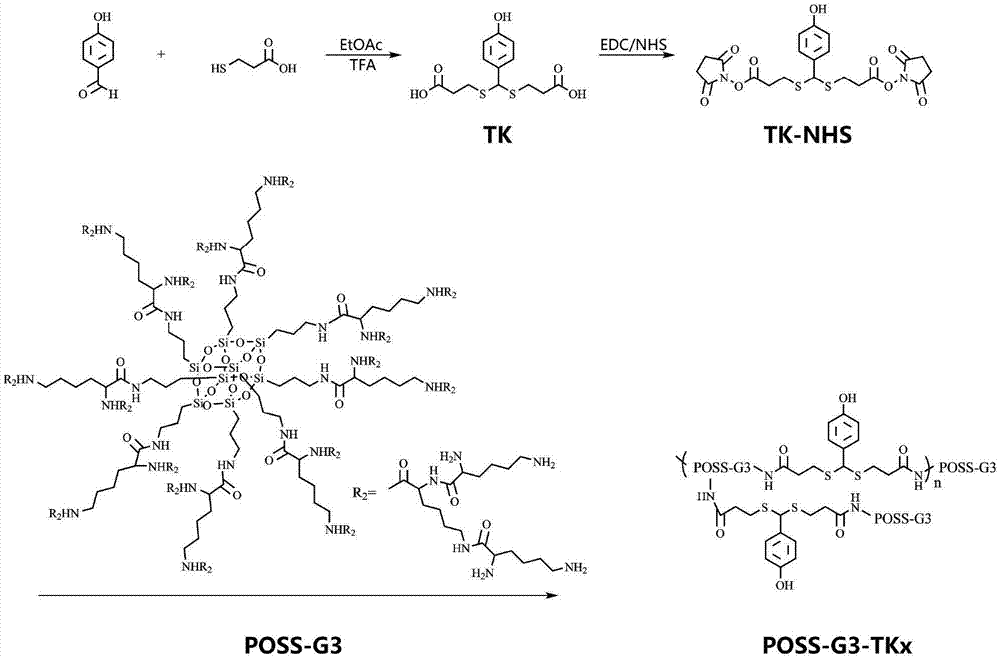
一种ros响应的基因递送载体,所述基因递送载体由缩硫酮linker与基于poss三代赖氨酸星型阳离子聚合物poss-g3交联而成,其结构式为:
上述结构式中,n≥1。
进一步地,所述缩硫酮linker的结构式是:
所述缩硫酮linker具有ros敏感的特性,可被ros切断。
本发明的另一目的在于提供上述的基因递送载体的制备方法,包括:
将缩硫酮linker和n-羟基琥珀酰亚胺混合,在氮气保护和搅拌下将1-(3-二甲氨基丙基)-3-乙基碳二亚胺缩合剂溶液逐滴加至混合溶液中,反应生成活性中间体;
其中,n-羟基琥珀酰亚胺与缩硫酮linker的摩尔比为2.0~4.0:1,缩合剂与缩硫酮linker的摩尔比为2.0~4.0:1;
所述活性中间体用溶剂溶解形成溶液,将活性中间体溶液和poss-g3的二甲基亚砜溶液加入反应容器反应,之后用真空泵抽去溶解活性中间体的溶剂,再充入氮气搅拌反应,反应完毕经透析纯化、冷冻干燥得到胶状的基因递送载体。
其中,溶解活性中间体(tk-nhs)的溶剂为无水二氯甲烷、无水四氢呋喃或无水二甲亚砜中的至少一种。
进一步的,所述缩硫酮linker制备方式为:将3-巯基丙酸和对羟基苯甲醛溶解于乙酸乙酯中,加入三氟乙酸作为催化剂,室温反应直至对羟基苯甲醛消耗完毕,将溶剂旋干后,用二氯甲烷和冰水洗涤粗反应产物,真空干燥获取产物缩硫酮linker。
进一步的,所述poss-g3制备方式为:
将浓盐酸和3-氨基丙基三乙氧基硅烷分别加入甲醇溶液中加热回流,反应完毕后,用四氢呋喃洗涤,干燥得八氨基笼状聚倍半硅氧烷,即八氨基poss;
称取八氨基poss、1-羟基苯并三唑、苯并三氮唑-n,n,n',n'-四甲基脲六氟磷酸酯溶解于无水二甲基亚砜中,逐滴加入过量溶解于无水二甲基亚砜中的boc-lys(boc)-oh反应;然后加入n,n'-二异丙基乙胺,室温反应2-3天;反应完毕加入等体积三氯甲烷,之后用无水氯化钠洗涤三次,用无水硫酸镁干燥,将粗产物浓缩后用乙腈沉淀,干燥后得poss-g1-boc;将poss-g1-boc溶解于二氯甲烷,之后加入过量三氟乙酸,在室温下反应后,旋蒸,乙醚沉淀,除去乙醚得到白色粉末poss-g1;重复poss-g1的合成步骤,合成得到白色粉末poss-g3。
本发明的又一目的在于提供所述基因递送载体在基因递送中的应用。
所述基因递送载体以复合物的形式进行基因递送,所述复合物组成包括:
组分(1):权利要求1所述的基因递送载体;和
组分(2):在真核细胞中表达的质粒dna;
带正电的组分(1)与带负电的组分(2)结合,形成所述复合物。
所述复合物中,组分(1)和组分(2)的n/p比值为:组分(1):组分(2)>5;优选组分(1):组分(2)=10~100;更优选组分(1):组分(2)=40。
进一步的,所述复合物的粒径≤300nm,优选80~150nm。
本发明的基因递送载体基于新型缩硫酮linker和poss三代赖氨酸的星型阳离子聚合物构建,正电荷更加集中,可增强聚合物负载基因的能力;其敏感键缩硫酮linker,在正常生理条件下可保持稳定,不被降解,当进入细胞后,在细胞内高水平ros条件下发生断裂,该基因载体材料降解为低分子量的片段,从而降低细胞毒性,提高转染效率。本发明的基因递送载体的制备方法,操作简单,对环境不会产生污染,有利于工业化生产。
附图说明
图1为本发明实施例1中所述ros响应的基因递送载体的合成路线图。
图2为本发明实施例3中poss-g3-tkx/dna复合物表征结果;其中,图2a为,琼脂糖凝胶电泳显示poss-g3-tkx对质粒的压缩能力;图2b显示复合物的粒径和zeta电位;图2c显示复合物的粒径和强度关系图及透射电镜观察复合物形态的结果。
图3为本发明实施例4中载体对hela细胞的毒性;其中,图3a为不同浓度载体的毒性(μg/ml);图3b为不同n/p制备的复合物的毒性。
图4为本发明实施例5中采用pegfp法定性评价材料在hela细胞中的转染效率。
图5为本发明实施例5中采用pgl3法定量评价材料在hela细胞中的转染效率。
具体实施方式
以下结合附图说明和具体实施方式对本发明的上述内容作进一步的详细说明。但不应当将此理解为本发明上述主题的范围仅限于以下的实例。在不脱离本发明的精神和原则之内做的任何修改,以及根据本领域普通技术知识和惯用手段做出的等同替换或者改进,均应包括在本发明的保护范围内。
实施例中使用的试剂与材料如下:
支化pei(25kda,800da),n-羟基琥珀酰亚胺(nhs)购自sigma-aldrich(shanghai,china)。
(s)-2,6-二叔丁氧羰基氨基己酸(boc-lys(boc)-oh)购自吉尔生化(上海)有限公司。
1-羟基苯并三唑(hobt)、苯并三氮唑-n,n,n',n'-四甲基脲六氟磷酸酯(hbtu)和n,n'-二异丙基乙胺(dipea)购自astatechpharmaceuticalco.,ltd.(chengdu,china)。
1-(3-二甲氨基丙基)-3-乙基碳二亚胺(1-ethyl-3-[3-(dimethylamino)-propyl]carbodiimide,edc)购自j&kchemicalco.,ltd.(usa)。
去内毒素质粒提取试剂盒购自invitrogen(milan,italy)。
dulbecco改良的高糖培养基(dulbecco’smodifiedmediumwithhighglucose,dmem-hg)和胎牛血清(fetalbovineserum)购自lifetechnologiescorporation(
带有绿色荧光蛋白的质粒pegfp-c1和可表达luc的pgl3质粒购自promega(usa)。
荧光素酶测定试剂盒购自promega(usa)。
其他溶剂及试剂均达到分析标准。
实施例1:基因递送载体(poss-g3-tkx)的制备方法
poss-g3-tkx的合成路线如图1所示,包括如下步骤:
步骤一:合成ros敏感的新型缩硫酮linker(tk)
将3-巯基丙酸(11.44g,108.02mmol)和对羟基苯甲醛(6.0g,49.1mmol)溶解于乙酸乙酯中,将混合溶液用适量的三氟乙酸(tfa)催化,于室温下连续反应至对羟基苯甲醛消耗完毕。旋转蒸发除去溶剂,将所得粗产物分别用二氯甲烷和冰水洗涤三次。最后,在真空干燥箱中干燥得到白色粉末,为含有羧基末端残基的缩硫酮linker(tk)。
步骤二:活性中间体(tk-nhs活性酯)的制备
缩硫酮linker(0.44g,1.4mmol)和nhs(0.39g,3.4mmol)用5.0ml无水四氢呋喃溶解于反应容器中,向反应容器中通入干燥的氮气并将其置于冰浴(0℃)上,将edc(0.53g,3.4mmol)用5.0ml无水四氢呋喃溶解形成溶液,在氮气保护和搅拌下将edc溶液逐滴加至上述反应容器中,edc溶液滴加完毕后,将反应容器从冰浴中取出,在室温下继续搅拌反应过夜生成活性中间体,经过滤除杂后,将滤液旋干即得活性中间体(tk-nhs)。
步骤三:星型阳离子聚合物(poss-g3)的合成
(1)八氨基poss(八氨基笼状聚倍半硅氧烷)的合成
将350ml甲醇加入500ml反应瓶中,加热至50℃时加入30ml浓盐酸,继续加热至90℃时加入3-氨基丙基三乙氧基硅烷(15ml,60mmol),于90℃加热回流24h,反应完毕后,用四氢呋喃洗涤数次,干燥得产物。
(2)poss-g3的合成
称取八氨基poss(1.5g,1.27mmol)、1-羟基苯并三唑(hobt)(1.7g,12.19mmol)、苯并三氮唑-n,n,n',n'-四甲基脲六氟磷酸酯(hbtu)(5.8g,15.24mmol)溶解于无水二甲基亚砜(dmso)中,然后逐滴加入溶解于无水dmso中的过量的(s)-2,6-二叔丁氧羰基氨基己酸(boc-lys(boc)-oh),并于0℃条件下反应30min。然后加入n,n'-二异丙基乙胺(dipea)(6.8ml,40.64mmol),并于室温反应48h。反应完毕加入等体积三氯甲烷后,用无水氯化钠洗涤三次,并用无水硫酸镁干燥,将粗产物浓缩后用乙腈沉淀,干燥后得poss-g1-boc。将poss-g1-boc溶解于无水二氯甲烷,之后加入三氟乙酸(tfa),在室温下反应12h后,旋蒸,乙醚沉淀,除去乙醚得到白色粉末poss-g1。重复poss-g1的合成步骤,合成得到白色粉末poss-g3。
步骤四:交联反应
将步骤(2)制备的活性中间体用2ml二氯甲烷溶解形成溶液,然后将活性中间体溶液和步骤(3)所配制的poss-g3溶液加入反应容器,活性中间体溶液与poss-g3溶液的摩尔比达到0.5~3.0:1为限,之后用真空泵抽去溶解活性中间体的二氯甲烷,再充入氮气于35℃条件下继续搅拌反应48h,反应时间满后,经透析纯化(透析袋截留分子量3500da)、冷冻干燥得到浅黄色胶状物,即为新型缩硫酮linker(tk)与基于poss三代赖氨酸星型阳离子聚合物(poss-g3)交联而成的ros响应的基因递送载体,简写为poss-g3-tkx。
实施例2:基因递送载体/dna复合物的制备方法
将不同质量的poss-g3-tkx用hbg缓冲液(20mmol/l4-羟乙基哌嗪乙磺酸水溶液,用naoh调ph值至7.4,加入5%(w/v)葡萄糖)溶解,与相同剂量的质粒dna轻轻混合,制备出不同n/p比的poss-g3-tkx/dna复合物,然后在室温(25℃)下孵育30min用于后续实验。除非另有说明或约定,本发明中使用的以下poss-g3-tkx/dna(otd)复合物的n/p比值为40。
实施例3:复合物poss-g3-tkx/dna的表征
(1)琼脂糖凝胶电泳检测载体对基因的压缩能力
通过琼脂糖凝胶电泳实验确认复合物poss-g3-tkx/dna的形成(琼脂糖凝胶电泳见图2a),凝胶电泳表明n/p≥10时,poss-g3-tkx就可以有效压缩质粒pegfp-c1并形成稳定的基因复合物,表明poss-g3-tkx具有较好的基因压缩能力。
(2)复合物的粒径及zeta电位
复合物poss-g3-tkx/dna的粒径及zeta电位用nano-zs90nanosizer(malverninstrumentsltd,worcestershire,uk)检测(复合物的粒径和zeta电位见图2b)。聚合物poss-g3-tkx与质粒pegfp-c1在不同n/p时形成复合物的粒径和电位如图所示。n/p为20到250时,poss-g3-tkx可以与质粒形成低于200nm的复合物,其zeta电位在+30mv左右。其中,图2b表明,n/p=40时,poss-g3-tkx可以与质粒形成粒径为107.5nm左右的复合物,图2c中粒径与强度的关系图显示,复合物粒径为107.5nm左右时强度最高。
(3)透射电镜(transmissionelectronicmicroscopy,tem)检测复合物的形态及粒径。
图2c的透射电镜图结果表明,n/p=40时,聚合物poss-g3-tkx能压缩dna形成球状、规整的、粒径为70nm左右的复合物纳米粒子。透射电镜观察到的复合物的粒径较小,可能是因为tem实验中水的蒸发造成的收缩效应。
实施例4:体外细胞毒性实验
用cck-8法评价聚合物poss-g3-tkx的细胞毒性,poss-g3和pei(分子量为25kda的聚乙烯亚胺)用作对照组,每个样品设6个复孔。用hbg缓冲液(20mmol/l4-羟乙基哌嗪乙磺酸水溶液,用naoh调ph值至7.4,加入5%(w/v)葡萄糖)制备不同浓度的聚合物溶液以及不同n/p复合而成的基因复合物。
将hela细胞按照8×103个细胞/孔接种于96孔板上,用100μl含10%血清的dmem培养基,在5%co2培养箱中于37℃条件下培养24h,使细胞融合度达到70%~80%。弃去96孔板中培养基,加入90μl新鲜的含10%血清的dmem培养基,然后将10μl不同浓度的聚合物溶液以及不同n/p复合而成的基因复合物分别加入含hela细胞的孔中。继续孵育24h后,弃去每孔中的培养基,用pbs洗涤细胞并更换为100μl含10%cck-8的无血清dmem培养基,将96孔板放入培养箱内孵育2小时。最后用酶标仪测定每孔在490nm处的吸光值,计算细胞存活率。
细胞存活率(%)=(od样品-od空白)/(od对照-od空白)×100%
结果如图3所示,在所研究的范围内,poss-g3及其基因复合物基本无细胞毒性,而其余聚合物溶液及其基因复合物的毒性随浓度的增加而增加,但poss-g3-tkx及其基因复合物的毒性都远低于pei及其基因复合物。基因载体的毒性主要来源于其上大量的阳离子,由于poss-g3-tkx进入体内,在ros的作用下降解为降解为低分子量片段,因此聚合物的毒性远低于pei。而与带阴离子的dna复合后,复合物的净阳离子浓度进一步降低,因此毒性进一步减小。
实施例5:体外转染效率实验
(1)定性转染效率评价:pegfp法
不同质量的poss-g3-tkx用hbg缓冲液(20mmol/l4-羟乙基哌嗪乙磺酸水溶液,用naoh调ph值至7.4,加入5%(w/v)葡萄糖)溶解,与相同剂量的质粒dna:pegfp轻轻混合(200ng/孔),制备出不同n/p比的poss-g3-tkx/dna复合物,然后在室温(25℃)下孵育30分钟用于转染实验。pei(分子量为25kda的聚乙烯亚胺)用作对照样品(pei与pegfp的n/p比为10)。
将hela细胞按照8×103个细胞/孔接种于96孔板上,用100μl含10%血清的dmem培养基,在5%co2培养箱中于37℃条件下培养24h,当细胞融合度达到70%~80%时,将有血清的培养基更换为90μl新鲜的不含血清的dmem培养基,然后将10μl不同n/p比复合而成的基因复合物溶液(含200ng质粒)分别加入含hela细胞的孔中,在37℃、5%co2条件下孵育4h。然后将培养基更换为新鲜的含10%血清的dmem培养基继续培养48小时,用倒置荧光显微镜观察细胞对gfp的表达情况。
图4为倒置荧光显微镜下的细胞转染情况。图中可见,poss-g3-tkx组的绿色荧光数量随着n/p比的变化而有所不同。其中,poss-g3-tkx的n/p比为40时gfp表达量最高(最适n/p比),且高于pei组的最适n/p比。
(2)定量转染效率评价:pgl3法
不同质量的poss-g3-tkx用hbg缓冲液(20mmol/l4-羟乙基哌嗪乙磺酸水溶液,用naoh调ph值至7.4,加入5%(w/v)葡萄糖)溶解,与相同剂量的质粒dna:pgl3轻轻混合(200ng/孔),制备出不同n/p比的poss-g3-tkx/dna复合物,然后在室温(25℃)下孵育30分钟用于转染实验。poss-g3和pei(分子量为25kda的聚乙烯亚胺)用作对照样品(pei与pgl3的n/p比为10)。
将hela细胞按照8×103个细胞/孔接种于96孔板上,用100μl含10%血清的dmem培养基,在5%co2培养箱中于37℃条件下培养24h,当细胞融合度达到70%~80%时,将有血清的培养基更换为90μl新鲜的不含血清的dmem培养基,然后将10μl不同n/p复合而成的基因复合物溶液(每孔加入量为复合物含200ng质粒dna:pgl3)分别加入含hela细胞的孔中,在37℃、5%co2条件下孵育4h。然后将培养基更换为新鲜的含10%血清的dmem培养基继续培养24小时,测定每孔中荧光素酶的表达(荧光素酶测定试剂盒,promega,美国)。
图5为测定情况,从图中可以看出poss-g3-tkx组不同n/p比和pei组最适n/p比的相对发光量/毫克蛋白均高于poss-g3组不同n/p比的相对发光量/毫克蛋白。其中,poss-g3-tkx组最适n/p比为40时的相对发光量/毫克蛋白比poss-g3组高了6个数量级,且高于pei组最适n/p比。由此表明,poss-g3-tkx具有较高的转染效率,其转染效率可以达到高于pei的水平,与定性转染实验数据相符。
综合以上实施例,可见基因递送载体poss-g3-tkx具有较高的转染效率,并且有较低的细胞毒性,说明poss-g3-tkx适合作为基因递送载体。
- 还没有人留言评论。精彩留言会获得点赞!