一种三肽及其制备方法与用途与流程
本发明涉及多肽技术领域,尤其涉及一种三肽及其制备方法与用途。
背景技术:
cd38酶催化底物环腺苷二磷酸核糖(cadpr)、腺苷二磷酸核糖(adpr)以及烟酸腺苷二核苷磷酸(naadp)可以与不同的受体或通道结合,从而参与调控细胞中的钙信号,通过作用于人体相关受体系统,这些ca2+信使小分子可以在生理条件下调控细胞内钙库钙离子的释放和胞外钙离子的内流,进而调节细胞的功能和生命活动。烟酰胺腺嘌呤二核苷酸(nad+)作为sir2-相关酶类(sir2-relatedenzymessirtuins)的底物并作为连接尼克酰胺磷酸核糖转移酶(nicotinamidephosphoribosyltransferase,nampt)和sirt1的分子,最近受到了广泛的研究,因为nad+的水平高低直接决定了sirtuins家族的活性,而sirtuins活性又对细胞寿命有着重要的影响。机体中nad+的水平与其合成酶和降解酶或者两者的结合相关,机体中nad+合成酶有烟酰胺磷酸核糖转移酶(nmnpt1-3)、烟酸单核苷酸转移酶(nmnat)和烟酰磷酸核糖转移酶(naprt)等,nad+降解酶有cd38,聚(adp-核糖)聚合酶(parp)和sirtuins等,研究发现,在衰老过程中,机体的肝脏、脂肪组织、脾脏、骨骼肌中的cd38蛋白水平相比其他nad+合成酶或降解酶含量明显增加,cd38的mrna也表达明显增加、nad+水平下降,说明cd38相较于其他其他nad+合成酶或降解酶对nad+水平影响更为明显,即cd38是nad+下水平降的关键因素。cd38是哺乳动物组织中主要的nad+降解酶,超过90%的cd38发挥nad+水解酶的作用,将nad+分子水解为烟酰胺与二磷酸腺苷核糖(adpr),不到10%的cd38发挥adp-核糖基环化酶的作用,环化nad+为cadpr与烟酰胺。此外,cd38降解nad+产生的烟酰胺也是sirtuins的内源性抑制剂。基于维持nad+水平在衰老和年龄相关疾病的重要性,通过抑制cd38酶的活性来提高衰老人群的nad+水平,是一种潜在的延缓衰老的重要方法。
衰老(aging)是生物个体随年龄增长而发生的不可逆的退行性变化,而氧化则是引起衰老的主要原因之一。目前,人口老龄化已成为全球性的社会问题。为了延缓衰老,临床上常使用一些合成的抗氧化剂来清除体内自由基及代谢废物,从而防止过度氧化,但长期用药会对机体产生毒副作用。因此,探索和开发天然抗氧化剂对于延缓衰老具有重要意义。自由基学说认为,衰老过程中的退行性变化是由自由基积累产生的毒害作用所导致的。机体正常代谢过程会产生一定量的自由基,它们在体内具有信号传导、调控基因转录和表达、调节细胞分裂和分化等生理功能。同时机体内有一套内源性自由基清除系统,由酶促和非酶促抗氧化体系共同组成,使自由基维持在低量无害的动态平衡状态。随着年龄的增长,体内自由基清除系统逐步退化,自由基水平的动态平衡被打破。过量的自由基在机体内累积,促使生物膜中的不饱和脂肪酸发生脂质过氧化反应,引起细胞膜结构破坏和功能紊乱。同时,产生的脂质过氧化物促使蛋白质分子发生交联,破坏酶结构并降低酶活性,从而损伤dna双螺旋结构并影响遗传信息的正确表达。这些自由基损伤效应的累积造成细胞结构破坏、功能减退甚至细胞凋亡或坏死,是机体衰老和多种老年疾病的重要根源之一。研究证实,活性氧(reactiveoxygenspecies,ros)是细胞内多种氧化还原反应的正常代谢产物,在机体内的产生和清除处于动态平衡状态。当机体受到内源性或外源性有害因素刺激时,可致ros生成增加,即出现氧化应激(oxidativestress,os)。氧化应激可引起dna氧化损伤和蛋白质的表达异常,使机体处于易损状态。动脉粥样硬化、心脏病、帕金森氏综合征、阿尔兹海默症、肿瘤、衰老糖尿病等疾病,大多数是在氧化应激基础上发生的疾病,年龄越大,罹患风险越高。当自身清除自由基能力不足、氧化和抗氧化之间的平衡被打破时,补充外援抗氧化剂能够抑制氧化应激、缓解机体损伤,对于延缓机体衰老及许多老年疾病的预防和治疗,具有重要的意义。
生物活性肽是一类具有生物活性的肽分子,对人体具有多种生理功能。与氨基酸和蛋白质相比,多肽更容易被人体消化吸收,与其他化合物小分子相比,其更安全、特异性更强,且不易引起严重的免疫排斥反应。目前国内外对于抗衰老肽的研究仍处于初步阶段。
技术实现要素:
有鉴于此,本发明要解决的技术问题在于提供一种三肽及其制备方法与用途,该三肽具有良好的抗氧化活性。
本发明提供了氨基酸序列如seqidno:1所示的三肽。
所述三肽的氨基酸序列为phe-gln-phe,简称fqf。其中,phe为苯丙氨酸的氨基酸相应残基,gln为谷氨酰胺的氨基酸相应残基。
其化学式如式i所示:
本发明还提供了编码权利要求1所述三肽的dna分子。
本发明中,所述编码所述三肽的dna分子的核苷酸序列如seqidno:2所示,具体为aaagttaaa。
本发明所述三肽可采用固相合成法、液相合成法或固液结合的方式进行人工合成,也可以采用基因工程的手段进行三肽的合成。
本发明所述三肽的制备方法,包括:按照seqidno:1所示氨基酸序列,在固相载体上逐一偶联氨基酸得到肽树脂,裂解后得到三肽。
具体的,所述固相合成的方法具体包括:按照所述seqidno:1所示多肽的氨基酸序列,从氨基酸序列的c端到n端,将fmoc保护氨基酸和树脂进行逐一偶联,然后裂解液脱除树脂和保护氨基酸侧链保护基,获得粗品,粗品纯化后获得所述三肽。
固相合成发合成三肽的方法中,所述固相载体为二氯树脂。
固相合成发合成三肽的方法中,所述偶联的偶联剂为diea。所述偶联剂用量优选为过量。具体为10倍树脂摩尔量。所述偶联的条件为室温30min。
固相合成发合成三肽的方法中,所述裂解的裂解剂由tfa、水、edt和tis组成。优选的,tfa、水、edt和tis的体积比为94.5:2:2.5:1。所述裂解的条件为30℃,2h。
进一步的,所述逐一偶联方式中在每步偶联前还包括脱除fmoc步骤。在一些实施例中,所述脱除fmoc的试剂为20%哌啶dmf溶液,即哌啶:dmf=1:4(体积比),反应时间为15min。
本发明所述制备方法还包括对制得的多肽进行纯化的步骤。优选采用高效液相色谱纯化多肽。
流动相是水和乙腈,所述制备高效液相色谱的起始梯度为:水95%,乙腈5%,结束梯度为:水25%,乙腈75%,梯度时间40min。纯度达到99%以上。
所述三肽的基因工程制备方法,包括:将包含编码所述三肽的dna分子的表达载体转化宿主细胞,诱导表达所述的三肽。
所述基因工程的宿主细胞为原核生物、真核生物。具体为大肠杆菌。酵母菌或昆虫细胞。
三肽在制备抑制cd38活性的产品中的应用。
采用分子对接技术,将fqf肽配体与cd38晶体结构进行对接处理。结果表明,fqf可以与cd38的活性位点lys129及asp156发生相互作用,并且能够进入cd38的疏水区域,从而抑制其活性。
三肽在制备降低ros水平的制剂中的应用。
不同浓度过氧化氢诱导下hek293细胞的存活率,表明过氧化氢诱导的损伤能使细胞内ros水平上升,最终导致细胞死亡。而fqf高、低剂量组的fitc荧光强度均具有显著性差异,表明fqf可以显著性降低细胞内ros水平,起到抗氧化的作用。可应用于制备抗氧化的药物或食品,或者应用于制备预防或治疗过氧化引起的疾病的药物或食品,改善相关疾病医疗状况。
三肽在制备抗氧化、抗衰老产品中的应用。
本发明还提供了一种抗氧化的产品,其包括本发明所述的三肽。
所述产品为药物或食品。
本发明提供的药物还包含药学上可接受的辅料。
本发明所述的药物还包含其他治疗剂,所述其他治疗剂选自其他具有抗氧化活性的物质。
所述食品为保健食品,剂型包括颗粒剂、胶囊剂、糖浆剂、片剂、粉剂、软糖、乳剂或口服液。
所述药物的剂型包括膏剂、颗粒剂、丸剂、散剂、片剂、胶囊剂、口服液或糖浆剂。
本发明还提供了一种抗氧化的治疗方法,其为给予本发明所述的药物。
与现有技术相比,本发明具有如下优点和有益效果:
本发明提供了三肽fgf,氨基酸序列为phe-gln-phe,并提供了该三肽的制备方法和用途,实验表明,fqf高、低剂量组的fitc荧光强度均具有显著性差异,表明fqf可以显著性降低细胞内ros水平,起到抗氧化的作用。可广泛应用于制备抑制cd38酶活的药物或食品,或者应用于制备具有抗氧化、延缓衰老功效的药物或食品。
附图说明
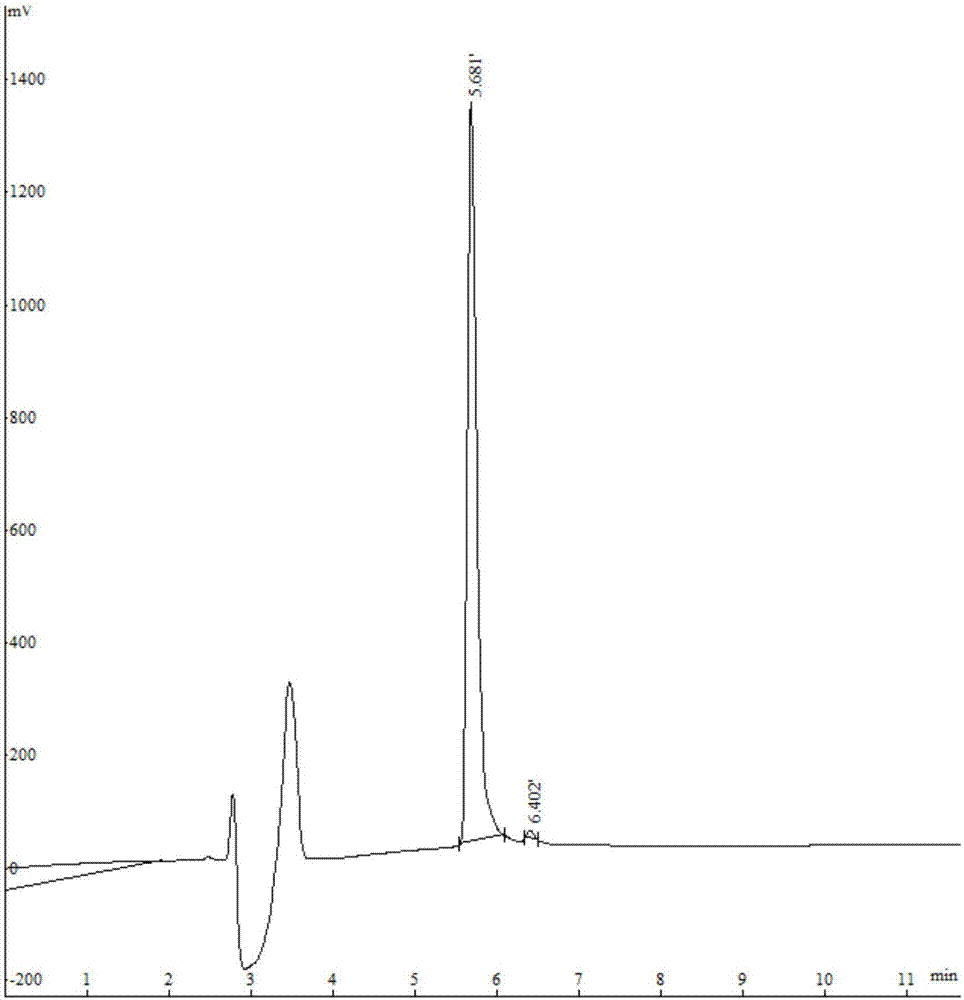
图1a为实施例1合成的多肽fqf的高效液相色谱(hplc)图;
图1b为实施例1合成的多肽fqf的液相色谱-质谱(lc-ms)图;
图2a为实施例2中小分子配体fqf结构式图;
图2b为实施例2中fqf与cd38疏水腔结合图;
图3a为实施例3细胞模型中不同浓度过氧化氢诱导下hek293细胞的存活率图;
图3b为实施例3中fqf处理组与模型组hek细胞ros水平变化图;
图3c为实施例3中fqf处理与模型组流式直方图。
具体实施方式
本发明提供了一种三肽及其制备方法与用途,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明采用的试材皆为普通市售品,皆可于市场购得。
下面结合实施例,进一步阐述本发明:
实施例1多肽固相合成法合成多肽fqf
采用标准fomc方案,选用二氯树脂,按照氨基酸序列phe-gln-phe的序列特征,使肽链从c端逐个向n端延伸,每步缩合采用20%哌啶/n,n-二甲基甲酰胺(dmf)溶液(15ml/g)处理15min,去除fmoc保护基;之后要进行检测,抽掉哌啶溶液,取十几粒树脂,用乙醇洗三次,加入茚三酮,吡啶,苯酚各一滴,105℃-110溶加热5min,变深蓝色为阳性反应,可以继续接下一个氨基酸,如果不变色则为阴性,需要重新脱保护。每次清洗是依次用15mldmf,15ml甲醇,15mldmf分别清洗两次。首次清洗后进行缩合,加入3倍树脂摩尔量的fmoc-l-gln(trt)-oh,3倍树脂摩尔量的hbtu,均用少量的dmf溶解,立刻加入10倍树脂摩尔量的diea,反应30min。第二次清洗后再进行检测,抽掉溶剂,取十几粒树脂,用乙醇洗三次,加入茚三酮,吡啶,苯酚各一滴,105℃-110℃加热5min,无色为阳性反应,若为蓝色则需要重新缩合。按照以上方法重复操作,依次接完剩余的氨基酸。等最后一个氨基酸接好以后整条肽的合成就反应完成了。进入最后的收缩阶段,用dmf洗涤反应3遍,dcm洗涤反应3遍,甲醇洗涤反应3遍,最后抽干肽树脂即可。肽侧链合成后,将含有树脂的肽链加入到体积比例为tfa(94.5%)、水(2%)、edt(2.5%)、tis(1%)混合液中,将肽链从树脂上切割下来。将树脂装入烧瓶中,恒温(30℃)振荡2h。将裂解液用氮气尽量吹干,然后倒入离心管中,缓慢倒入乙醚。封口并放入离心机中离心5min,倒掉上清液,下方为白色固体。再用乙醚洗6次,然后常温挥干,采用50%乙腈溶液进行溶解,然后采用色谱条件为起始梯度为:水95%,乙腈5%,结束梯度为:水25%,乙腈75%,梯度时间40min。收集从检测器出来的样品。
合成的多肽的高效液相色谱图和液相色谱-质谱(lc-ms)图分别如图1a和图1b所示,由图1a和图1b分析表明,合成的多肽质荷比为441.4,其一级氨基酸序列是phe-gln-phe,即得到目标多肽,一种具有抑制cd38酶活及具有抗氧化功效的合成多肽。
实施例2分子对接评价多肽的cd38抑制活性
1.目标受体结构确定
根据其捕获的方式或结合的小分子物质而各有不同,在蛋白质数据库pdb中通过比较晶体结构,鉴于关键残基glu226的稳定性及复合物对nad+分子与cd38结合情况的模拟体现,选择cd38与烟酰胺单核苷酸(nmn)共结晶的结构进行分子对接,pdbid为3dzk。
2.fqf配体建立
采用chem3d软件绘制多肽fqf生成三维结构,并对其结构进行力场优化,保存备用。
3.分子对接
从pdb数据库中下载得cd38的晶体结3dzk,将a链进行能量格点运算,确定的原始配体位置即为分子对接配体-受体结合位点的位置。配体-受体结合位置确定好后,将原始配体nmn删除,除去原有水分子,添加极性氢原子,计算gasteiger电荷后重新分配ad4类型原子。对大分子受体和小分子配体间结合情况进行打分,根据3dzk中原来配体nmn的位置,设置对接中心坐标及对接盒子大小。将fqf肽配体与cd38晶体结构进行对接处理。图2a为fqf多肽配体的结构图。从图2b中可以看出fqf可以与cd38的活性位点lys129及asp156发生相互作用,并且能够进入cd38的疏水区域,从而抑制其活性。
实施例3合成多肽fqf体外抗氧化实验
1.溶液的配制
0.1mm和0.5mm的合成肽(fqf)溶液配制:准确称取4.405mg的合成肽,用10ml的培养基溶解,过0.22μm的滤头后,母液浓度为1mm,再用培养基将母液稀释至实验所需浓度。
h2o2溶液的配制:将30%过氧化氢配用dmem配成浓度为2mmol/l的母液,再用培养基稀释至0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0和2.0的溶液
2.过氧化氢损伤模型的构建
hek293细胞以10000/孔的密度种于96孔板中,待24h贴壁完全后各组分别加入浓度为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0和2.0mmol/l的过氧化氢培养基,于37℃、5%的co2的培养箱中培养2h。采用pbs洗涤细胞2次,充分去除残留的过氧化氢。随后每孔各加入mtt(0.5mg/ml)20μl,于培养箱中孵育4h,吸去培养基,每孔加入dmso150μl;采用酶标仪测定570nm处光密度值(od值)。每组设5个复孔,重复实验3次,计算细胞存活率。
细胞存活率=(od给药-od空白)/(od对照-od空白)。
不同浓度过氧化氢诱导下hek293细胞的存活率,从图3a中可以看出随着h2o2浓度的增加,细胞存活率降低,表明过氧化氢诱导的损伤能使细胞内ros水平上升,最终导致细胞死亡。选择细胞存活率为60%的浓度进行造模,即h2o2浓度为600μm。
3.多肽多过氧化氢诱导氧化应激损伤模型的保护作用
hek293细胞以10w/ml的密度铺板在12孔板中,待贴壁完全后对照组加入不含多肽的培养基溶液;给药组加入0.1mmol/l和0.5mmol/l的fqf多肽培养基。48h后,加入含有600μmh2o2且含有相同浓度多肽的培养基孵育2h。用pbs清洗细胞2次,加入1:1000稀释的dcfh-da染料0.5ml于37℃继续孵育30min,迅速吸弃dcfh-da染料,用pbs洗涤细胞两次。用0.25%edta消化细胞,收集在1.5mlep管,置于冰上。用cytofle流式细胞仪检测细胞中dcf的荧光强度,通道选择fitc通道。以fitc的平均荧光强度进行统计。
从流式直方图3b中可以看出,多肽给药组相对模型组fitc直方图左移,表明经多肽处理后细胞内ros水平下降。根据直方图的fitc平均荧光强度进行统计,如从图3c所示。模型组与fqf高、低剂量组组fitc荧光强度均具有显著性差异,表明fqf可以显著性降低细胞内ros水平,起到抗氧化的作用。
上述结果表明,多肽fqf具有显著的抗氧化功效(p<0.05)可应用于制备抗氧化的药物或食品,或者应用于制备预防或治疗过氧化引起的疾病的药物或食品,改善相关疾病医疗状况。
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>无限极(中国)有限公司
<120>一种三肽及其制备方法与用途
<130>mp1826325
<160>2
<170>siposequencelisting1.0
<210>1
<211>3
<212>prt
<213>人工序列(artificialsequence)
<400>1
pheglnphe
1
<210>2
<211>9
<212>dna
<213>人工序列(artificialsequence)
<400>2
aaagttaaa9
- 还没有人留言评论。精彩留言会获得点赞!