作为BRPF1抑制剂的三环化合物的制作方法
本发明属于化学医药领域,具体涉及一种作为brpf1抑制剂的三环化合物。
背景技术:
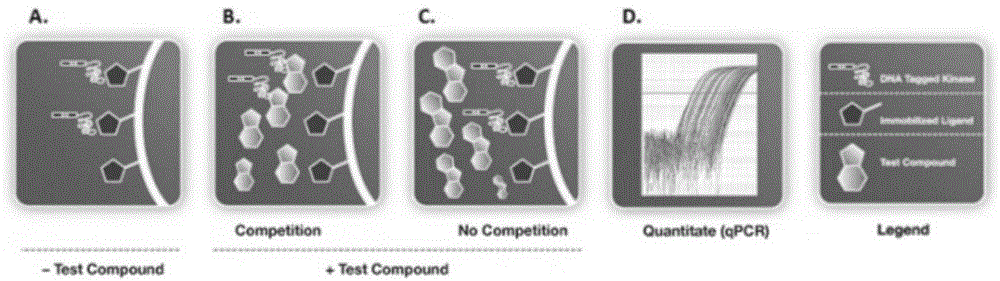
:表观遗传可调节生物体内基因转录过程,因而与生命生长发育有关的基础生理过程(比如细胞分化、分裂、增殖的调节等)密切相关。研究发现,表观遗传修饰调控失调与许多单因素疾病、复杂综合征(如脑疾病,糖尿病等)甚至癌症的发生发展均有密切关系。表观遗传修饰机制按作用底物不同,可分为以下多种机制:dna修饰、组蛋白修饰、rna的修饰、染色质修饰、非编码rna以及x染色体的失活等,其中,组蛋白赖氨酸的乙酰化是最为重要的翻译后修饰方式之一,组蛋白与赖氨酸残基上的ε-氨基的乙酰化作用,能够使组蛋白与dna的结合由紧密变得松弛,同时,乙酰化赖氨酸也能促进聚合酶和转录因子等形成的复合物与dna结合,进而激活基因转录。bromodomains(brds)是一类能够特异性识别乙酰化赖氨酸的保守蛋白结构域,通过参与蛋白-蛋白相互作用而促进蛋白复合物的形成,进而激活基因转录。在研究疾病的进展中,brds因能识别并编码基因组而成为表观遗传领域研究最为频繁和成功的靶点之一。bromodomainandphdfingercontaining(brpf)作为brds中的一大成员,具有可识别乙酰化赖氨酸的结构域,能够与不同组蛋白上乙酰化残基相互作用,是装备myst组蛋白乙酰转移酶复合物的支架蛋白,该复合物在dna修复、重组、复制及转录和表达中起了重要的作用。近年来的研究表明:brpf1和癌症相关,其能和moz–tif2形成复合物,引起hox基因上调,从而导致白血病的产生;并且,brpf1在一些血癌和实体瘤中存在过表达,比如膀胱癌、卵巢癌、小型细胞型肺癌以及急性髓性白血病。目前已有一些brpf1抑制剂被发现,按分子结构的不同可以将他们分为以下两类:(1)具1,3-二甲基苯并咪唑酮骨架的双环衍生物;(2)具1,3-二甲基喹啉酮的双环衍生物。这些抑制剂虽然对brpf1有不错的抑制活性,但骨架较为单一。因此,开发具新骨架的brpf1小分子抑制剂不仅可以丰富brpf1抑制剂的骨架多样性,同时也对多种癌症(如膀胱癌、卵巢癌、小型细胞型肺癌以及急性髓性白血病)的研究与治疗有着重要意义。技术实现要素:本发明的目的在于提供了一种作为brpf1抑制剂的三环化合物。本发明提供了式i所示的化合物或其药学上可接受的盐:其中,r1独立选自-h、-oh、卤素、-cn、-cf3、c1~c8烷基、c1~c8烷氧基、取代或未取代的c5~c10芳基;所述取代c5~c10芳基的取代基为卤素或c1~c8烷基;r2独立选自-h、-oh、卤素、c1~c8烷基、c1~c8烷氧基、取代或未取代的c5~c10芳基;所述取代c5~c10芳基的取代基为卤素或c1~c8烷基;r3独立选自-h、-oh、卤素、c1~c8烷基、c1~c8烷氧基、取代或未取代的c5~c10芳基;所述取代c5~c10芳基的取代基为卤素或c1~c8烷基;r4独立选自-h、c1~c8烷基、c3~c8的环烷基、取代或未取代的c5~c10芳基或5~10元芳杂环;所述芳杂环的杂原子为n、o、s,杂原子个数为1~4;所述取代的c5~c10芳基的取代基为-oh、卤素、-cn、-no2、-cf3、-ocf3、-nh2、c1~c8烷基、c1~c8的烷氧基或x为ch2或o。进一步地,r1独立选自h或c1~c8烷氧基;r2独立选自-h或c1~c8烷基;r3独立选自-h或-c1~c8烷基;r4独立选自c1~c8烷基、取代或未取代的c5~c10芳环或5~10元芳杂环;所述芳杂环的杂原子为n、o,杂原子个数为1~4;所述取代c5~c10芳基的取代基为卤素、-cn、-no2、-ocf3、c1~c8烷基、c1~c8的烷氧基或x为ch2或o。进一步地,当x为o时,所述化合物结构式如下:其中,r1独立选自-h;r2独立选自-h、c1~c8烷基;r3独立选自-h、c1~c8烷基;r4独立选自取代或未取代的c5~c10芳环或5~10元芳杂环;所述芳杂环的杂原子为n、o,杂原子个数为1~4;所述取代c5~c10芳基的取代基为卤素、-no2、-ocf3、c1~c8烷基、c1~c8的烷氧基。进一步地,当x为ch2时,所述化合物结构式如下:其中,r1独立选自-h或c1~c8烷氧基;r2独立选自-h、c1~c8烷基;r3独立选自-h、c1~c8烷基;r4独立选自c1~c8烷基、取代或未取代的c5~c10芳环或5~10元芳杂环;所述芳杂环的杂原子为n、o,杂原子个数为1~4;所述取代c5~c10芳基的取代基为卤素、-cn、-no2、-ocf3、c1~c8烷基、c1~c8的烷氧基或进一步地,所述化合物选自如下结构式之一:本发明还提供了一种制备前述化合物的方法,它包括如下路线之一:当x=o时,其合成路线为:当x=ch2时,其合成路线为:本发明还提供了前述化合物或其药学上可接受的盐作为brpf1抑制剂的用途。进一步地,所述brpf1抑制剂是治疗与乙酰化赖氨酸相关的疾病或症状的药物。进一步地,所述与乙酰化赖氨酸相关的疾病或症状为肿瘤;优选所述肿瘤为膀胱癌、卵巢癌、小型细胞型肺癌或急性髓性白血病。本发明还提供了一种药物,它是以前述的化合物或其药学上可接受的盐,加上药学上可接受的辅料或者辅助性成分制备而成的制剂。本发明提供的三环化合物对brpf1结构域有很强的结合作用,可作为brpf1抑制剂,而brpf1抑制剂可与蛋白结构域brpf1结合,抑制brpf1与乙酰化赖氨酸相互作用,治疗与乙酰化赖氨酸相关的疾病或症状的药物,如膀胱癌、卵巢癌、小型细胞型肺癌或急性髓性白血病。因此,本发明化合物作为brpf1抑制剂,可以用于制备治疗与乙酰化赖氨酸相关的疾病或症状的药物,如膀胱癌、卵巢癌、小型细胞型肺癌或急性髓性白血病。显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。附图说明图1为化合物与溴结构域结合的示意图。具体实施方式当x=o时,其合成路线为:当x=ch2时,其合成路线为:实施例1制备7-硝基-2h-苯并[b][1,4]噁嗪-3(4h)-酮(中间体1)在圆底烧瓶中,加入2-氨基-5-硝基苯酚(7.7g,50mmol),碳酸钠(26.5g,250mmol),苄基三乙基氯化铵(11.4g,50mmol),用氯仿溶解后于冰浴下搅拌。在30分钟内向其中缓慢滴加氯乙酰氯(5.7g,50mmol)的氯仿溶液。加毕后,于冰浴下继续搅拌1小时,移至油浴锅中,回流搅拌过夜。反应完毕后,旋走溶剂,加水洗涤,过滤,滤渣用乙醇重结晶,得黄色固体7.9g(83%收率)。1hnmr(400mhz,dmso)δ11.32(s,1h),7.90(dd,j=8.7,2.5hz,1h),7.76(d,j=2.5hz,1h),7.06(d,j=8.7hz,1h),4.73(s,2h).esi-ms(m/z):195.1[m+h]+实施例2制备7-硝基-2h-苯并[b][1,4]噁嗪-3(4h)-硫酮(中间体2)在圆底烧瓶中,加入7-硝基-2h-苯并[b][1,4]噁嗪-3(4h)-酮(3.9g,20mmol),劳森试剂(16g,40mmol),用四氢呋喃溶解后回流过夜。反应完毕后,旋干反应液,柱层析分离得黄色固体1.7g(41%收率)。1hnmr(400mhz,dmso)δ13.16(s,1h),7.93(dd,j=8.7,2.4hz,1h),7.81(d,j=2.4hz,1h),7.25(d,j=8.7hz,1h),4.98(s,2h).esi-ms(m/z):211.0[m+h]+实施例3制备1-甲基-7-硝基-4h-苯并[b][1,2,4]三唑并[4,3-d][1,4]噁嗪(中间体3)在圆底烧瓶中,加入水合肼(6ml),乙醇溶解,80℃搅拌下向其中滴加7-硝基-2h-苯并[b][1,4]噁嗪-3(4h)-硫酮(1.1g,5mmol)的乙醇溶液,加毕后80℃下继续搅拌1小时,反应完毕后,旋走溶剂,直接向反应瓶中加入原甲酸三乙酯及醋酸酐,搅拌回流过夜。反应完毕后,旋走溶剂,柱层析分离,得黄色固体625mg(54%收率)。1hnmr(400mhz,cdcl3)δ8.14–8.02(m,2h),7.75–7.65(m,1h),5.42(s,2h),2.85(s,3h).esi-ms(m/z):233.1[m+h]+实施例4制备1-甲基-7-氨基-4h-苯并[b][1,2,4]三唑并[4,3-d][1,4]噁嗪(中间体4)在圆底烧瓶中,加入1-甲基-7-硝基-4h-苯并[b][1,2,4]三唑并[4,3-d][1,4]噁嗪(464mg,2mmol),氯化铵(214mg,4mmol),使用乙醇:水(2:1)溶解,60℃搅拌下,分批加入铁粉(336mg,6mmol),加毕后,升温至回流搅拌4小时。反应完毕后,过滤,旋干滤液,用二氯甲烷溶解,饱和碳酸氢钠洗涤,饱和食盐水洗涤,合并有机相,无水硫酸钠干燥,过滤,旋干,组层析分离,得棕褐色固体250mg(62%收率)。1hnmr(400mhz,dmso)δ7.38(dd,j=7.6,1.5hz,1h),6.37(dd,j=7.9,1.9hz,2h),5.44(s,2h),5.22(s,2h),2.63(s,3h).esi-ms(m/z):203.1[m+h]+实施例5制备2-甲氧基-n-(1-甲基-4h-苯并[b][1,2,4]三唑并[4,3-d][1,4]噁嗪-7-基)苯磺酰胺(化合物1aa)在反应试管中,加入1-甲基-7-氨基-4h-苯并[b][1,2,4]三唑并[4,3-d][1,4]噁嗪(20mg,0.1mmol),2-甲氧基苯磺酰氯(21mg,0.1mmol),用吡啶溶解后,室温下搅拌4小时。反应完毕后,旋走溶剂,柱层析分离,得黄色固体28mg(75%收率)。1hnmr(400mhz,dmso)δ10.33(s,1h),7.82(dd,j=7.8,1.7hz,1h),7.63–7.56(m,2h),7.19(d,j=7.9hz,1h),7.08(t,j=7.6hz,1h),6.91(dd,j=7.2,2.3hz,2h),5.28(s,2h),3.88(s,3h),2.62(s,3h).esi-ms(m/z):373.1[m+h]+按照化合物1aa类似的制备方法,可以制备得到化合物1aa-1cb。表征数据如下:实施例6制备7-甲氧基-6-硝基-3,4-二氢喹啉-2(1h)-酮(中间体5)在圆底烧瓶中,加入7-甲氧基-3,4-二氢喹啉-2(1h)-酮(2.8g,13.6mmol),用浓硫酸(40ml)溶解后,在-10℃搅拌下,依次加入水(10ml)及浓硝酸(1ml),加毕后于冰浴下搅拌10分钟。反应完毕后,加大量水淬灭反应,过滤,滤渣用水洗涤,得黄色固体1.7g(56%收率)。1hnmr(400mhz,dmso)δ10.48(s,1h),7.87(s,1h),6.73(s,1h),3.86(s,3h),2.89(t,j=7.5hz,2h),2.51(t,j=7.5hz,2h),1.06(t,j=7.0hz,1h).esi-ms(m/z):223.1[m+h]+实施例7制备6-氨基-7-甲氧基-3,4-二氢喹啉-2(1h)-酮(中间体6)在圆底烧瓶中,加入7-甲氧基-6-硝基-3,4-二氢喹啉-2(1h)-酮(1.6g,7mmol),钯碳(160mg,10%wt),用甲醇溶解,置换氢气后于40℃下搅拌过夜。反应完毕后,过滤,滤渣用乙醇洗涤,旋干滤液,得棕褐色固体1.2g(90%收率)。1hnmr(400mhz,dmso)δ9.62(s,1h),6.46(s,1h),6.39(s,1h),4.58(s,2h),3.69(s,3h),2.67(t,j=7.5hz,2h),2.32(t,j=7.5hz,2h).esi-ms(m/z):193.1[m+h]+实施例8制备6-氨基-7-甲氧基-3,4-二氢喹啉-2(1h)-硫酮(中间体7)在圆底烧瓶种,加入乙腈(30ml)与三乙胺(20ml),冰浴搅拌下,分批加入五硫化二磷(1.1g,5.8mmol),加毕后,冰浴下搅拌,直至五硫化二磷完全溶解,再加入7-甲氧基-6-硝基-3,4-二氢喹啉-2(1h)-酮(920mg,4.8mmol),加毕后,升温至回流反应2小时。反应完毕后,旋干溶剂,乙酸乙酯溶解后,用碳酸钠、食盐水萃取,合并有机相,无水硫酸钠干燥,过滤,旋干,柱层析分离得黄色固体400mg(40%收率)。1hnmr(400mhz,dmso)δ11.85(s,1h),6.64(s,1h),6.45(s,1h),4.67(s,2h),3.70(s,3h),2.82(t,j=7.6hz,2h),2.58(t,j=7.6hz,2h).esi-ms(m/z):209.1[m+h]+实施例9制备8-甲氧基-1-甲基-4,5-二氢-[1,2,4]三唑并[4,3-a]喹啉-7-胺(中间体8)在圆底烧瓶中,加入6-氨基-7-甲氧基-3,4-二氢喹啉-2(1h)-硫酮(290mg,1.4mmol),乙酰肼(126mg,1.7mmol),用环己醇溶解后,回流反应6小时。反应完毕后,旋干溶剂,二氯甲烷溶解,用水、饱和食盐水萃取,合并有机相,无水硫酸钠干燥,过滤,旋干,柱层析分离得红棕色固体191mg(60%收率)。1hnmr(400mhz,dmso)δ7.03(s,1h),6.64(s,1h),4.91(s,2h),3.83(s,3h),2.89(t,j=6.9hz,2h),2.74(t,j=6.9hz,2h),2.67(s,3h).esi-ms(m/z):231.1[m+h]+实施例10制备2-甲氧基-n-(8-甲氧基-1-甲基-4,5-二氢-[1,2,4]三唑并[4,3-a]喹啉-7-基)苯磺酰胺(化合物2aa)在反应试管中,加入8-甲氧基-1-甲基-4,5-二氢-[1,2,4]三唑并[4,3-a]喹啉-7-胺(23mg,0.1mmol),2-甲氧基苯磺酰氯(21mg,0.1mmol),用吡啶溶解后,室温下搅拌4小时。反应完毕后,旋走溶剂,柱层析分离,得砖红色固体28mg(71%收率)。1hnmr(400mhz,dmso)δ8.82(s,1h),7.66(dd,j=7.8,1.4hz,1h),7.62–7.54(m,1h),7.32(s,1h),7.22(d,j=8.3hz,1h),7.10(s,1h),7.00(t,j=7.5hz,1h),3.90(s,3h),3.69(s,3h),2.91(t,j=6.4hz,2h),2.82(t,j=6.4hz,2h),2.66(s,3h).esi-ms(m/z):401.1[m+h]+按照化合物2aa类似的制备方法,可以制备得到化合物2aa-2fb。表征数据如下:实施例11:化合物与brpf1的作用能力测试本实验由discoverx公司通过bromoscan技术进行测定。具体实施方法如下:1.分析过程(1)分析组件用dna标签标记大肠杆菌或哺乳动物细胞表达的溴结构域,以便用于qpcr读数;将已知溴结构域配体固定在固体支持物上;需测试的化合物或对照样品(仅限溶液);(2)平衡;(3)洗涤固体支持物以除去未与化合物或对照结合的溴结构域;(4)通过qpcr量化固体支持物上已知配体所捕获的溴结构域;(5)比较测试化合物和对照样品中qpcr所量化的捕获的溴结构域蛋白水平。2.操作方法将表达溴结构域的t7噬菌体以bl21菌株衍生来的大肠杆菌为宿主,在24孔板中平行培养生长。大肠杆菌生长至对数期时,使用来自冻存的t7噬菌体进行感染(感染复数=0.4),在32℃下振荡孵育直至细胞裂解(90-150分钟)。将裂解物进行离心(5000g)后过滤(0.2μm)以除去细胞碎片,得到具dna标签标记的溴结构域。将链霉亲和素所包被的磁珠,在室温下用生物素化的小分子或乙酰化多肽配体处理30分钟,以产生可用于溴结构域测定的亲和树脂。配体磁珠使用过量的生物素进行封闭,并使用封闭缓冲液(seablock(pierce),1%bsa,0.05%tween20,1mmdtt)进行洗涤,以除去未结合的配体并减少非特异性噬菌体的结合,得到固定具已知溴结构域配体的固体支持物。结合能力的测试,是将溴结构域、具已知溴结构域配体的磁珠以及受试化合物溶液,在结合缓冲液(16%seablock,0.32倍pbs,0.02%bsa,0.04%tween20,0.004%叠氮化钠,7.9mmdtt)中反应来进行的。将受试化合物用100%dmso制备为1000x的储备液,随后在单乙二醇(meg)中以1:25的比例进行稀释。随后在测试中将化合物直接进行稀释,使得该化合物在dmso和meg中的最终浓度分别为0.1%和2.4%。所有的测试反应均在384孔聚丙烯板中进行,单孔最终的体积为0.02ml。将此测定板在室温下振荡孵育1小时后,使用洗涤液(1xpbs,0.05%tween20)洗涤磁珠。最后将洗涤后的珠子悬浮在洗脱缓冲液(1xpbs,0.05%tween20,2μm非生物素化的亲和配体)中,并在室温下振荡孵育30分钟,通过qpcr测量该洗脱液中的溴结构域浓度。3.分析原则若化合物具有结合所测定的特有的溴结构域的能力,该化合物会阻止溴结构域与固定在固体支持物上的已知配体的结合,从而减少固体支持物所捕获溴结构域蛋白量(图1a和图1b)。相反,不具备该能力的所测化合物对固体支持物上所捕获的溴结构域蛋白量没有影响(图1c)。通过使用精确且高灵敏的qpcr来量化相关dna标签的量,检测测试后固体支持物上已知配体所捕获的带dna标签的溴结构域的量,从而比较所测试化合物与对照样品与溴结构域的结合能力(图1d)。通过类似的方式,在不同浓度化合物作用下,测定固体支持物上所捕获的溴结构域蛋白量,则可计算化合物与所测定溴结构域的亲和力(kd值)。化合物配制与kd值测试:将受试化合物配制成10.000nm的100%dmso溶液,并进行11点的连续3倍稀释。所有用于kd值测量的化合物都是在100%dmso中通过超声分布均匀的。化合物均在测试中进行直接稀释,并使最低测试浓度为0.169nm的dmso溶液。结合常数(kd值)均通过hill方程用标准剂量-反应曲线计算:hillslope被设置为-1。曲线采用非线性最小二乘拟合和levenberg-marquardt算法进行拟合。4.数据分析在所要求的浓度下测试化合物,与溴域蛋白的作用强弱以“%ctrl”来进行反映,越低的数字表示受试化合物与溴域蛋白具有越强的作用。%ctrl数值计算方法:(受试化合物信号–阳性对照化合物信号)/(阴性对照化合物信号–阳性对照化合物信号)*100阴性对照化合物:dmso(%ctrl值为100)阳性对照化合物:对照化合物(%ctrl值为0)表一:单浓度下受试化合物与brpf1的作用强度表二:化合物1ba对溴域家族不同蛋白的选择性表三:化合物2aa、2ab、2ad、2ba对brpf1的kd值测试受试化合物kd值(nm)受试化合物kd值(nm)2aa6002ab25002ad6702ba790综上,本发明提供的三环化合物对brpf1结构域有很强的结合作用,可作为brpf1抑制剂,而brpf1抑制剂可与蛋白结构域brpf1结合,抑制brpf1与乙酰化赖氨酸相互作用,治疗与乙酰化赖氨酸相关的疾病或症状的药物,如膀胱癌、卵巢癌、小型细胞型肺癌或急性髓性白血病。因此,本发明化合物作为brpf1抑制剂,可以用于制备治疗与乙酰化赖氨酸相关的疾病或症状的药物,如膀胱癌、卵巢癌、小型细胞型肺癌或急性髓性白血病。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- SPNP‑I在制备Nav1.7通道工具试剂中的应用的制造方法与工艺
- SPNP‑I在制备Nav1.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.3通道工具试剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.5通道抑制剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- 一种多肽在制备Nav1.3钠通道工具试剂中的应用的制造方法与工艺
- SPKP‑XI在制备Kv4.2通道抑制剂中的应用的制造方法与工艺
- SGLT‑2糖尿病抑制剂及其中间体的制备方法与流程