一种多肽序列及其自组装材料的制备方法及应用与流程
本发明属于生物材料领域,涉及一种自组装多肽、其制备方法及其应用。
背景技术:
自组装是指基本结构单元自发形成有序结构的一种技术。在自组装的过程中,基本结构单元在基于非共价键的相互作用下自发的组织或聚集为一个稳定、具有一定规则几何外观的结构。自组装多肽是最常见也是最为重要的一种,绝大多数的生物内存在的天然凝胶以及许多合成高分子凝胶均属于自组装多肽。自组装多肽作为一种软物质,在很多方面具有广泛应用,比如隐型眼镜、人造肌肉、细胞分离与培养、物料萃取、固定化酶、药物的控制释放等。制备自组装多肽材料主要有两大类,一类是合成高分子,一类是天然生物材料如多糖和蛋白等。其中多肽凝胶是具有较好的生物相容性以及环境友性新型材料,氨基酸的排列的多样性使得多肽自组装分子具有广泛的应用前景。
胆碱结合序列是指肺炎链球菌编码的,或肺炎链球菌噬菌体编码的蛋白中含有多个重复序列。含有胆碱结合重复序列的蛋白统称胆碱结合蛋白。多种结合蛋白在肺炎链球菌生物被膜的形成中有作用。一倍证实:lyta酰胺酶,lytc溶菌酶,lytb氨基葡糖苷酶,cbpa粘附素,pcpa粘附素和pspa(肺炎球菌表面蛋白a)突变体形成生物被膜的能力降低。
组氨酸标签体是指6个连续的组氨酸,可简写为6×his。组氨酸标签常作为重组蛋白末端融合多肽段。组氨酸是具有杂环的氨基酸,每个组氨基酸含有一个咪唑基团,这个化学结构带有很多额外电子,对于带正电的化学物质有静电引力,这个标签在ph8.0时不带电,且无免疫原性,对蛋白质的分泌、折叠、功能基本上无影响。凭借此组氨酸肽段可与多种金属离子发生特殊的相互作用,包括ca2+、mg2+、ni(2+)、co2+等,其中以镍离子使用最为广泛。便于用金属螯合亲和层析纯化蛋白质。
磷是一种不可再生的有限资源,过度排放会带来严重的水体富营养化。天然水溶性磷,是指溶解在土壤溶液中的无机磷和少量与可溶性低相对分子质量有机化合物结合的磷。城市污水中的磷浓度约为5-15mg/l,部分污水中磷的含量则更高。磷是一种不可再生的有限资源,且磷是水体藻类生长的限制因子,因此磷的富集就成为解决磷资源枯竭及水体净化的重要方法。利用强化生物除磷(ebpr)技术,借助于聚磷菌(paos)的作用能够将污水中的磷富集于厌氧池或者污泥沉淀池,也可获得较高的溶解性磷,可溶性磷酸盐高效简便的的去除方法将更好的提高为磷的回收效率。
水体重金属污染是指含有重金属离子的污染物进入水体对水体造成的污染。矿冶、机械制造、化工、电子、仪表等工业生产过程中产生的重金属废水(含有铬、镉、铜、汞、镍、锌等重金属离子)是对水体污染最严重和对人类危害最大的工业废水之一。现阶段我国排放废水中含有多种重金属。2014年全国工业废水排放量为205.3亿吨。工业废水中重金属汞、镉、六价铬、总铬、铅及砷排放量分别为0.7吨、16.9吨、34.8吨、131.8吨、71.8吨和109.2吨。工业废水总排放量及工业废水中的重金属排放量巨大。以各种化学状态或化学形态存在的重金属,在进入环境或生态系统后就会存留、积累和迁移,造成危害。如随废水排出的重金属,即使浓度小,也可在藻类和底泥中积累,被鱼和贝的体表吸附,产生食物链浓缩,从而造成公害。废水中的重金属是各种常用水处理方法不能分解破坏的。
技术实现要素:
有鉴于以上内容,本发明的目的在于设计一种触发型自发组装的含有6×his的两亲性多肽,6×his形成亲水结构存在于所形成的自组装颗粒的表面。其特征在于触发因子为磷酸氢盐,所形成的颗粒水溶液中对ni(2+)等过渡态金属离子具有亲和作用。
本发明所采用的技术方案是:
为了实现上述目的,本发明提供如下技术方案:本发明提供了一种自组装多肽序列及其制备方法和应用,
1、首先根据肺炎链球菌中胆碱结合蛋白的重复序列进行分析,结合氨基酸序列模拟。设计了一种具有较强胆碱结合能力的多肽,其氨基酸序列如seqidno.1/2所示(1-20位氨基酸)。并在其c端连接了6个组氨酸(21-26位氨基酸)。其完整序列见实施列1共26个氨基酸。
2、采用固相合成多肽的方法(比伐卢定-2-cl-resin的合成法),将非天然氨基酸与树脂连接,然后再连接下一个天然氨基酸。合成后的多肽使用高效液相色谱仪分离纯化;采用质谱进行质量检测。
3、称量多肽粉末,使用无菌去离子水进行分散,可观察到样品为可溶状态。向溶液中加入磷酸氢二钠/钾(终浓度大于0.03m)。可观察到白色颗粒状物质析出,多肽浓度高时观察到为絮状白色析出物。所得白的物质即为本文所述自组装多肽。
4、将白色析出物离心收获后,使用无菌去离子水重悬。进行多次去离子水洗涤后,可观察到白色物质不溶,且能够长时间保持其不溶状态(观察时间60天)。将白色颗粒(约5mm)加入到niso4的盐溶液中(5mm)孵育30min。离心去除白色颗粒,对上清进行金属离子溶度检测,发现水溶液中金属离子浓度降低(见附图)。
5、将seqidno.2序列克隆至pet28a载体,转化bl21-de3菌株,经iptg诱导37℃培养4h后可检测到多肽的表达。在普通lb肉汤培养基中加入na2hpo4(10mmol/l)、kh2po4(2mmol/l)、niso4(5mg/l),用于重组菌株的培养,以正常pet28a载体菌株作为对照。发现培养液中的可溶磷酸盐含量、ni(2+)离子含量明显降低。
与现有技术相比,本发明的有益效果是:
第一、本发明合成多肽无毒,通过细胞毒性分析可知本发明合成多肽对293t细胞生长没有影响;
第二、本发明合成多肽制备自组装多肽的过程中磷酸氢盐可以回收进行再次使用;
第三、本发明制备的自主装多肽具有金属离子的吸附的活性;
第四、本发明制备的自主装多肽在ph为6-8.8的水溶液中具有较高的稳定性。
第五、本发明制备的自主装多肽为水系中金属离子的富集及水系的金属污染的净化提供了一种新的材料。
第六、本发明为多肽,如使用生物合成方法进行大规模生产,则成本更为低廉,便于广泛应用。
第七、本发明多肽经大肠杆菌表达后,不需经过纯化处理。重组菌株表达多肽后即获得磷酸盐及ni(2+)离子富集能力。
附图说明
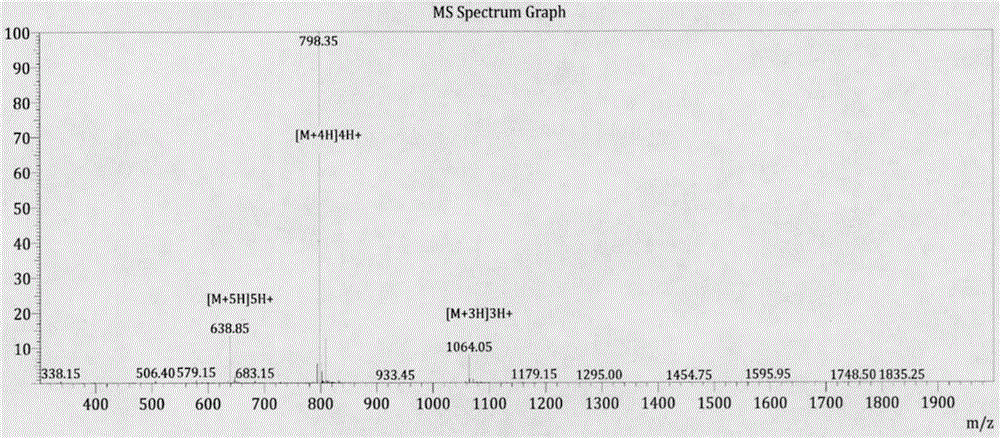
图1-1,1-2为本发明所示合成多肽纯化后质谱分析结果;1-1:合成多肽p26质谱检测结果。图1-2:合成多肽p26高效液相色谱检测结果。
图2-1,2-2为本发明所述合成多肽水溶液圆二色谱及结构分析结果;图2-1:圆二色光谱检测结果。图2-2:根据圆二色光谱检测结果推测的多肽中各种二级结构的含量。
图3为本发明所述合成多肽形成自组装多肽后的光镜显微图像;所形成的自组装多肽倒置显微镜观察结果(400倍)。
图4为本发明多肽形成自组装多肽后的电子显微图像,本文所述自组装多肽电子显微镜观察结果。
图5为本发自组装多肽对水溶液中ni(2+)离子的去除试验结果,niso4标准溶液标准及处理样品,初始浓度分别为1,2,3,4,5mg/l。
图6-1,6-2,6-3为重组seqidno.2菌株构建,及功能鉴定结果。图6-1:seqidno.2重组pet28a载体,构建及蛋白表达检测结果(1号为dna标准分子样品、2号为质粒酶切鉴定结果、3号为诱导表达结果、4号为对照诱导菌株,箭头所示为seqidno.2编码基因片段或蛋白电泳条带)。图6-2:重组pet28a载体菌株培养体系中可溶磷酸盐含量监测结果,虚线为对照菌样品,采用钼锑抗分光光度法测定值为od690。图6-3:重组pet28a载体菌株培养体系中ni2+离子含量监测结果,虚线为对照菌样品,采用丁二酮肟法测定值为od450。
具体实施方式
下面结合附图对本发明进一步说明。
多肽序列:
一种合成多肽,氨基酸序列如seqidno.1、2所示;seqidno.2将首位氨基酸替换为起始密码子编码的氨基酸以用作原核表达。
seqidno.1:tgwvkdngswyylnlsgymlhhhhhh,
thr-gly-trp-val-lys-asp-asn-gly-ser-trp-tyt-tyr-leu-asn-leu-ser-gly-tyr-met-leu-his-his-his-his-his-his
seqidno.2:mgwvkdngswyylnlsgymlhhhhhh。
met-gly-trp-val-lys-asp-asn-gly-ser-trp-tyr-tyr-leu-asn-leu-ser-gly-tyr-met-leu-his-his-his-his-his-his
实施列1:多肽合成,选用2-cl-resin作为载体(树脂)进行多肽合成,采用冰乙醚抽滤获得粗肽产品,采用c18、10um色谱柱进行纯化除杂,送质谱确认产品分子量3189.40g/mol符合理论值。称量冻干后的纯品,经分析计算,产品纯度为82.487%。
实施例2:将多肽冻干粉溶解在去离子水中,配置成200μg/ml溶液,多肽为可溶性多肽,多肽溶液为无色透明状。取5ml溶液做圆二色谱检测。并通过检测结果推算多肽二级结构中各种结构所占的百分比。
圆二色光谱(简称cd)是应用最为广泛的测定蛋白质二级结构的方法,是研究稀溶液中蛋白质构象的一种快速、简单、较准确的方法。
实施例3:将本文所述多肽配置成200μg/ml溶液,溶液为无色透明状。向溶液中中加入终浓度为0.1m的磷酸氢二钠,可见白色颗粒状物质,经检测能够形成白色颗粒的磷酸氢二钠最低浓度为5mm。将溶液吸取50μl置于载玻片上,取一盖玻片覆盖子液滴上。在倒置显微镜下观察结果。
实施例4:将本文所述多肽配置成200μg/ml溶液,溶液为无色透明状。向溶液中中加入终浓度为0.1m的磷酸氢二钠。将样品滴于铜片上,干燥后将载有样品的铜片粘在样品座上的导电胶带上。按步骤进行照片拍摄。
实施例5:将本文所述多肽配置成3mg/ml溶液,溶液为无色透明状。分别取30μl、70μl所述多肽向溶液置于管中。向管内加入终浓度为0.1m的磷酸氢二钠,可见白色析出物。离心分别收获白色物质,使用100μl无菌去离子水重悬,离心并使用移液器去除水,重复4次以去除溶液中残留的磷酸氢二钠。进行多次去离子水洗涤后,可观察到白色物质不溶,且能够长时间保持其不溶状态(观察时间60天)。
将上述白色颗粒分别加入到niso4的盐溶液中(5mm)孵育2min。离心去除白色颗粒,使用丁二酮肟进行ni(2+)浓度检测,发现处理后溶液中ni(2+)离子浓度降低,降低率约为20%-35%(见图5)。
实施例6:采用基因工程技术将seqidno.2序列克隆至pet28a载体,转化bl21-de3菌株,经iptg诱导37℃培养4h后可检测到多肽的表达(图6-1)。在普通lb肉汤培养基中加入na2hpo4(10mmol/l)、kh2po4(2mmol/l)、niso4(5mg/l),用于重组菌株的培养,以正常pet28a载体菌株作为对照。发现培养液中的可溶磷酸盐含量、ni(2+)离子含量与对照组相比明显降低(图6-2,6-3)。lb培养基中可能存在po4(3-),ni(2+)检测有影响的物质,但与对照组比较可明确体现出po4,ni(2+)含量的差异。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的实施例。
- 还没有人留言评论。精彩留言会获得点赞!