环状二肽化合物及其制备方法和应用与流程
本发明属于生物制药技术领域,具体涉及环状二肽化合物及其制备方法和应用。
背景技术:
通常生物学中所指的环肽是指以氨基酸肽键形成的化合物,在植物化学中这一概念被扩大成以酰胺键形成的一类化合物,因此范围被扩大至包括有机胺类和大环生物碱类,根据成环与否分为环肽和直链肽。已报道的环肽类化合物具有多方面的生物活性,包括抗肿瘤、抗hiv、抗菌、抗疟、安眠、抑制血小板聚集、降压、抑制酪氨酸酶、抑制环氧化酶、抑制脂质过氧化酶、雌性激素样、免疫抑制等生物活性。放线菌是产生天然生物活性物质的重要微生物资源,其开发利用一直备受各国重视。迄今所发现的20000余种微生物来源的生物活性物质中,约有50%是由放线菌产生的,但是从放线菌中分离出环肽类化合物并不是很多。因此,放线菌资源的开发以及采用新方法对放线菌资源的深入挖掘一直是放线菌代谢产物研究的重要内容。海洋具有低温、低营养、高盐、无光照、缺氧等独特的物理、化学和生态环境,故海洋放线菌必然产生与陆地微生物不同的代谢途径和机体防御机制,这对发现新型药物先导化合物、研究药物作用新机理、新靶点等具有重要的意义。
技术实现要素:
本发明提供了从海洋放线菌(streptomycesgriseorubens)f8分离的四种环肽类化合物以及上述环状二肽化合物的制备方法和应用。
本发明通过下述技术方案予以实现。
环状二肽化合物,从海洋放线菌的固体平板发酵产物中制备,化学结构式如下:
优选地,所述海洋放线菌为灰略红链霉菌(streptomycesgriseorubens)f8,于2017年11月17日保藏于中国普通微生物菌种保藏管理中心,保藏编号:cgmccno.14923。
一种上述环状二肽化合物的制备方法,其特征在于,采用以下步骤:
(1)发酵粗体物的获得
将海洋放线菌发酵,将ymg琼脂培养基浸泡,将浸泡液浓缩干得粗提物,将粗提物在乙酸乙酯中溶解得溶解液,将无法溶解的部分用水溶解然后乙酸乙酯萃取收集乙酸乙酯相,与之前的乙酸乙酯溶解物合并得到乙酸乙酯相,减压蒸干得到乙酸乙酯提取物,乙酸乙酯提取物再经等体积的甲醇跟石油醚萃取后收集甲醇相减压浓缩,得甲醇提取物;
(2)粗体物的sephadexlh-20柱层析
甲醇溶解步骤(1)制备的甲醇提取物,柱层析收集后经tlc检测,得到组份fr1、fr2、fr3、fr4、fr5、fr6、fr7、fr8、fr9、fr10;
(3)环状化合物的制备
将步骤(2)制备的组份fr4用甲醇溶解经过反向硅胶柱分离纯化,依次用超纯水、10%甲醇、20%甲醇、30%甲醇、50%甲醇、70%甲醇、100%甲醇进行梯度洗脱,经tlc检测,得到组份fr4-1、fr4-2、fr4-3、fr4-4、fr4-5;将组分fr4-2溶于甲醇中用制备液相进行分离纯化,采用13%乙腈恒梯度洗脱,得到保留时间为6.5min的化合物1;
将组份fr4-3溶于甲醇中用制备液相进行分离纯化,采用13%乙腈恒梯度洗脱,得到保留时间为16.5min的化合物2;
将步骤(2)制备的组份fr5用甲醇溶解经过反向硅胶柱分离纯化,依次用超纯水、10%甲醇、20%甲醇、30%甲醇、40%甲醇、50%甲醇、70%甲醇、100%甲醇进行梯度洗脱,经tlc检测得到组份fr5-1、fr5-2、fr5-3、fr5-4、fr5-5;将组份fr5-2用甲醇溶解,通过柱层析后经tlc检测,得到组分fr5-2-a、fr5-2-b、fr5-2-c、fr5-2-d、fr5-2-e;将组分fr5-2-d溶于甲醇中用制备液相进行分离纯化,采用20%乙腈恒梯度洗脱,得到保留时间为3.5min的化合物3;将组份fr5-3溶于的甲醇中用制备液相进行分离纯化,采用35%乙腈恒梯度洗脱,得到保留时间3.5min化合物4。
更优选地,具体的制备方法为:
(1)发酵粗体物的获得
用ymg琼脂培养基将海洋放线菌发酵,28-30℃倒置培养10-14天后,将琼脂培养基切块放入浸提液浸泡6-12h,将浸泡液浓缩至干得粗提物,将粗提物使用乙酸乙酯溶解得溶解液,将无法溶解的部分用水溶解然后用等体积的乙酸乙酯萃取收集乙酸乙酯相,并与之前的乙酸乙酯溶解物合并得到乙酸乙酯相,将乙酸乙酯相减压蒸干得到乙酸乙酯提取物,乙酸乙酯提取物再经等体积的甲醇跟石油醚萃取后收集甲醇相减压浓缩,得甲醇提取物;
(2)粗体物的sephadexlh-20柱层析
用甲醇溶解步骤(1)制备的甲醇提取物3.7g后,通过柱层析收集120管,tlc检测,根据tlc检测结果,合并1-25、26-31、32-36、37-45、46-54、55-61、62-70、71-89、90-103、104-120管得到组份fr1、fr2、fr3、fr4、fr5、fr6、fr7、fr8、fr9、fr10;
(3)环状化合物的制备
将步骤(2)制备的组份fr4用甲醇溶解经过反向硅胶柱分离纯化,依次用超纯水、10%甲醇、20%甲醇、30%甲醇、50%甲醇、70%甲醇、100%甲醇各1l进行梯度洗脱,200ml/管,一共收集35管,经tlc检测,根据tlc检测结果,合并1-5、6-10、11-20、21-25、26-35管得到组份171.8mgfr4-1、70.9mgfr4-2、68.3mgfr4-3、58.3mgfr4-4、47mgfr4-5;
将组分fr4-2溶于1ml的甲醇中用制备液相进行分离纯化,采用13%乙腈恒梯度洗脱,得到5.9mg化合物1保留时间6.5min;将组份fr4-3溶于1ml的甲醇中用制备液相进行分离纯化,采用13%乙腈恒梯度洗脱,得到4.4mg化合物2保留时间16.5min;将步骤(2)制备的组份fr5用甲醇溶解经过反向硅胶柱分离纯化,依次用超纯水、10%甲醇、20%甲醇、30%甲醇、40%甲醇、50%甲醇、70%甲醇、100%甲醇各1l进行梯度洗脱,200ml/管,一共收集40管,经tlc检测,根据tlc检测结果,合并1-10、11-15、16-25、26-40管合并得到组份262.7mgfr5-1、126.7mgfr5-2、29.7mgfr5-3、23.6mgfr5-4、17.3mgfr5-5;将组份fr5-2用甲醇溶解,35-50s/d通过柱层析一共收集50管;经tlc检测,根据tlc检测结果,合并组份1-9、9-16、17-21、22-28、29-50管合并得到组分10mgfr5-2-a、6.3mgfr5-2-b、92.3mgfr5-2-c、20.4mgfr5-2-d、2.4mgfr5-2-e;将组分fr5-2-d溶于1ml的甲醇中用制备液相进行分离纯化,采用20%乙腈恒梯度洗脱,得到2.4mg化合物3保留时间3.5min;将组份fr5-3溶于1ml的甲醇中用制备液相进行分离纯化,采用35%乙腈恒梯度洗脱,得到5.4mg化合物4保留时间3.5min。
优选地,步骤(1)所述的ymg琼脂培养基ph为7.2-7.6;每升ymg琼脂培养基的组成组分为:葡萄糖4g/l,麦芽浸粉10g/l,酵母浸粉4g/l,剩余为自然海水。
优选地,步骤(1)所述的浸提液为乙酸乙酯、甲醇和冰醋酸的混合溶液,其中乙酸乙酯、甲醇和冰醋酸的体积比为80:15:5;所述浸泡液的浸泡时间为8-16小时;浸泡液浸提的次数为3次。
优选地,步骤(2)所述的柱层析为采用的为葡聚糖凝胶sephadexlh-20;步骤(3)所述的反向硅胶柱为rp-18反向硅胶柱;步骤(3)所述的tlc检测的条件为:展开剂为甲醇:二氯甲烷=1:10;显色剂是254nm紫外、碘、5%硫酸-无水乙醇和香草醛-浓硫酸。
一种上述环状二肽化合物的应用,所述化合物1、化合物2、化合物3和化合物4在制备杀菌药物、免疫活性药物或抗肿瘤药物中的应用。
优选地,所述化合物4在制备抑制青枯雷尔氏菌药物中的应用;
有益效果
该专利采用固体平板发酵的方式对海洋放线菌f8进行发酵获得粗提物,发酵获得粗提物有利于目的产物的分离纯化。采用本方法获得四种环肽化合物纯度更高达到了95%以上,本发明制备的化合物经一部拓宽了杀菌抗肿瘤药物的研究领域,具有广泛的应用前景。
菌种保藏信息
保藏时间:2017年11月17日,
保藏单位:中国微生物菌种保藏管理委员会普通微生物中心,
保藏编号:cgmccno.14923,
保藏单位地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,邮政编码:100101
分类命名:灰略红链霉菌streptomycesgriseorubens。
附图说明
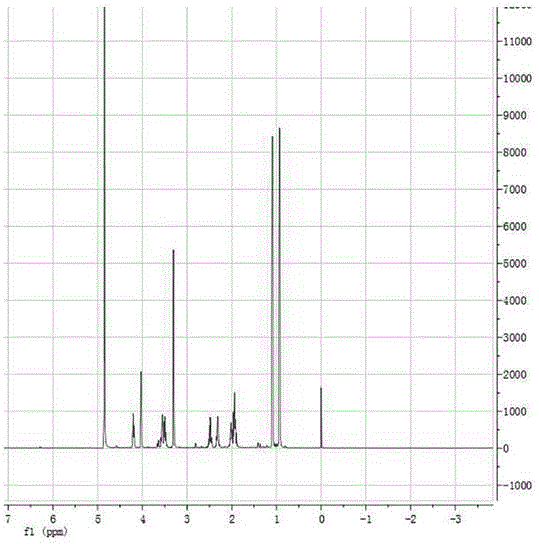
图1为化合物1的氢谱图;
图2为化合物2的氢谱图;
图3为化合物3的氢谱图;
图4为化合物4的氢谱图;
图5为4个化合物的对肺癌细胞侵袭的抑制作用;
图6为4个化合物对肺癌细胞迁移的抑制作用。
具体实施方式
为了方便本领域的技术人员更好地理解本发明方案,并使本发明的上述目的、特征和优点能更加浅显易懂,下面结合实施例对本发明做进一步详细的说明。
实施例1
用ymg琼脂培养基将菌株f8发酵20l,28-30℃倒置培养14天。将琼脂培养基切成小块放入锥形瓶中用浸提液(乙酸乙酯:甲醇:冰醋酸=80:15:5v/v)过夜浸泡,重复三次。将上述浸泡液减压浓缩(42℃)至干得到菌株次级代谢产物粗提物。粗提物先用乙酸乙酯反复溶解3次收集溶解液,将无法溶解的部分用水溶解然后用等体积的乙酸乙酯萃取三次收集乙酸乙酯相,并与之前的乙酸乙酯溶解物合并得到乙酸乙酯相。将乙酸乙酯相42-60℃减压蒸干得到乙酸乙酯提取物。乙酸乙酯提取物再经等体积的甲醇跟石油醚萃取3-5次收集甲醇相42℃减压浓缩,得甲醇提取物3.7g。其中所述ymg琼脂培养基ph为7.2-7.6;每升ymg琼脂培养基的组成组分为:葡萄糖4g/l,麦芽浸粉10g/l,酵母浸粉4g/l,剩余为自然海水。
用尽量小体积的甲醇溶液溶解甲醇提取物3.7g后,通过葡聚糖凝胶sephadexlh-20柱层析(10-15s/d)一共收集120管,经tlc检测(展开剂为甲醇:二氯甲烷=1:10),显色剂是254nm紫外、碘、5%硫酸-无水乙醇和香草醛-浓硫酸。根据tlc检测结果,合并1-25、26-31、32-36、37-45、46-54、55-61、62-70、71-89、90-103、104-120管得到组份fr1、fr2、fr3、fr4(550.7mg)、fr5(535.3mg)、fr6(151.5mg)、fr7、fr8、fr9、fr10。
组份fr4的分离纯化
组份fr4用尽量少的甲醇溶解经过rp-18反向硅胶柱分离纯化,依次用超纯水、10%甲醇、20%甲醇、30%甲醇、50%甲醇、70%甲醇、100%甲醇各1l进行梯度洗脱,200ml/管,一共收集35管。经tlc检测(展开剂为甲醇:二氯甲烷=1:10),显色剂是254nm紫外、碘、5%硫酸-无水乙醇和香草醛-浓硫酸。根据tlc检测结果,合并1-5、6-10、11-20、21-25、26-35管得到组份fr4-1(171.8mg)、fr4-2(70.9mg)、fr4-3(68.3mg)、fr4-4(58.3mg)、fr4-5(47mg)。
将组分fr4-2溶于1ml的甲醇中用制备液相进行分离纯化,采用13%乙腈恒梯度洗脱,得到化合物1(5.9mg)保留时间6.5min。将组份fr4-3溶于1ml的甲醇中用制备液相进行分离纯化,采用13%乙腈恒梯度洗脱,得到化合物2(4.4mg)保留时间16.5min。
组份fr5的分离纯化
组份fr5用尽量少的甲醇溶解经过rp-18反向硅胶柱分离纯化,依次用超纯水、10%甲醇、20%甲醇、30%甲醇、40%甲醇、50%甲醇、70%甲醇、100%甲醇各1l进行梯度洗脱,200ml/管,一共收集40管,经tlc检测(展开剂为甲醇:二氯甲烷=1:10),显色剂是254nm紫外、碘、5%硫酸-无水乙醇和香草醛-浓硫酸。根据tlc检测结果,合并1-10、11-15、16-25、26-40管合并得到组份fr5-1(262.7mg)、fr5-2(126.7mg)、fr5-3(29.7mg)、fr5-4(23.6mg)、fr5-5(17.3mg)。将组份fr5-2用尽量少的甲醇溶解,通过葡聚糖凝胶sephadexlh-20柱层析(35-50s/d)一共收集50管。经tlc检测(展开剂为甲醇:二氯甲烷=1:10),显色剂是254nm紫外、碘、5%硫酸-无水乙醇和香草醛-浓硫酸。根据tlc检测结果,合并组份1-9、9-16、17-21、22-28、29-50管合并得到组分fr5-2-a(10mg)、fr5-2-b(6.3mg)、fr5-2-c(92.3mg)、fr5-2-d(20.4mg)、fr5-2-e(2.4mg)。将组分fr5-2-d溶于1ml的甲醇中用制备液相进行分离纯化,采用20%乙腈恒梯度洗脱,得到化合物3(2.4mg)保留时间3.5min。将组份fr5-3溶于1ml的甲醇中用制备液相进行分离纯化,采用35%乙腈恒梯度洗脱,得到化合物4(5.4mg)保留时间3.5min。
实施例2(4个化合物的对肺癌细胞侵袭的抑制作用)
[材料]1、仪器:co2培养箱、倒置显微镜、超净工作台、酒精灯;2、试剂及耗材:dmem培养基、胎牛血清、transwell小室(24-well,8.0-um孔径)、24孔板、pbs溶液、0.25%胰酶溶液、冰甲醇、0.1%结晶紫染液、小镊子、棉棒、载玻片、盖玻片等。3、肺癌细胞(a549)
[步骤]
1、饥饿处理:培养细胞至对数生长期,无血清培养基对细胞进行饥饿处理12-24h;
2、收集细胞:取出饥饿处理之后的细胞,吸弃培养基,pbs清洗2次,胰酶消化后,加入培养基重悬细胞并转移至离心管中;800rpm离心2min,弃上清;pbs清洗1次后,加入3ml无血清培养基重悬细胞;
3、细胞计数:吸取10μl细胞悬液,滴加至血球计数板上进行细胞计数;
4、细胞稀释:根据细胞计数结果,将细胞稀释至5x105个/ml;
5、细胞接种:在下室加入750μl含10%血清的培养基,分别向培养基中加入10μl的20μg/ml,30μg/ml,40μg/ml的化合物1、化合物2、化合物3以及化合物4的甲醇溶解液,并且以什么都不加作为空白,以加入相同量的甲醇为对照,上室加入100μl稀释后的细胞悬液,放入co2培养箱中继续培养24h(做三个平行);
6、细胞清洗:吸弃培养基,用镊子小心取出小室,转移至1mlpbs中浸泡清洗细胞3次;
7.细胞固定:用镊子小心取出小室,吸干残留液体,转移至1ml冰甲醇固定液中,室温固定15min;
8、细胞清洗:用镊子小心取出小室,吸弃固定液,用湿棉棒小心擦去上室底部膜表面上的细胞,转移小室至1mlpbs中浸泡清洗细胞3次;
9、细胞染色:用镊子小心取出小室,吸干残留液体后,转移到1ml0.1%结晶紫染色中,室温染色10min;
10、细胞清洗:吸弃染色液,用镊子小心取出小室,转移至1mlpbs中浸泡清洗细胞3次;
11、细胞封片:用小镊子小心揭下膜,吸干残留液体并晾干后,转移至载玻片上,用中性树胶封片;
12、拍照计数:显微镜下拍照及计数,统计结果,具体结果见图5。
实施例3
[材料]1、仪器:co2培养箱、倒置显微镜、超净工作台、酒精灯2、试剂及耗材:dmem培养基、胎牛血清、biocoat基底膜基质膜包被侵袭小室(24-well,8.0-μm孔径)、24孔板、pbs溶液、0.25%胰酶溶液、冰甲醇、0.1%结晶紫染液、小镊子,棉棒,载玻片,盖玻片等。
3、肺癌细胞(a549)
[步骤]
1、水化matrigel基质:从-20°c冰箱取出biocoat基底膜基质膜包被侵袭小室,平衡到室温,向上室和下室均加入500μl37°c预热的培养基,置于培养箱(37°c、5%co2)孵育2h;
2、饥饿处理:培养细胞至对数生长期,无血清培养基对细胞进行饥饿处理12~24h;
3、收集细胞:取出饥饿处理之后的细胞,吸弃培养基,pbs清洗2次,胰酶消化后,加入培养基重悬细胞并转移至离心管中;800rpm离心2min,弃上清;pbs清洗1次后,加入3ml无血清培养基重悬细胞;
4、细胞计数:吸取10μl细胞悬液,滴加至血球计数板上进行细胞计数;
5、细胞稀释:根据细胞计数结果,将细胞浓度稀释至1x106个/ml;
6、细胞接种:在下室加入750μl含10%血清的培养基,上室加入150μl稀释后的细胞悬液,分别向培养基中加入10μl的20μg/ml、30μg/ml、40μg/ml的化合物1、化合物2、化合物3以及化合物4的甲醇溶解液,并且以什么都不加作为空白,以加入相同量的甲醇为对照,上室加入100μl稀释后的细胞悬液,放入孵箱中继续培养24h(做三个平行);
7、细胞清洗:吸弃上下室培养基,用镊子小心取出小室,转移至1mlpbs中浸泡清洗细胞3次;
8、细胞固定:用镊子小心取出小室,吸干残留液体,转移至1ml4%多聚甲醛固定液中,室温固定15min;
9、细胞清洗:用镊子小心取出小室,吸弃固定液,用湿棉棒小心擦去上室底部膜表面上的细胞,转移小室至1mlpbs中浸泡清洗细胞3次;
10、细胞染色:用镊子小心取出小室,吸干残留液体后,转移到1ml0.1%结晶紫染色中,室温染色10min;
11、细胞清洗:吸弃染色液,用镊子小心取出小室,转移至1mlpbs中浸泡清洗细胞3次;12、细胞封片:用小镊子小心揭下膜,吸干残留液体并晾干后,转移至载玻片上,用中性树胶封片;13、拍照计数:显微镜下拍照及计数,统计结果,具体结果见图6。
- 还没有人留言评论。精彩留言会获得点赞!