一种柔性微孔膜及应用其制备的细胞分离装置的制作方法
本发明涉及生物医药与先进制造
技术领域:
,具体涉及一种柔性微孔膜及应用其制备的细胞分离装置。
背景技术:
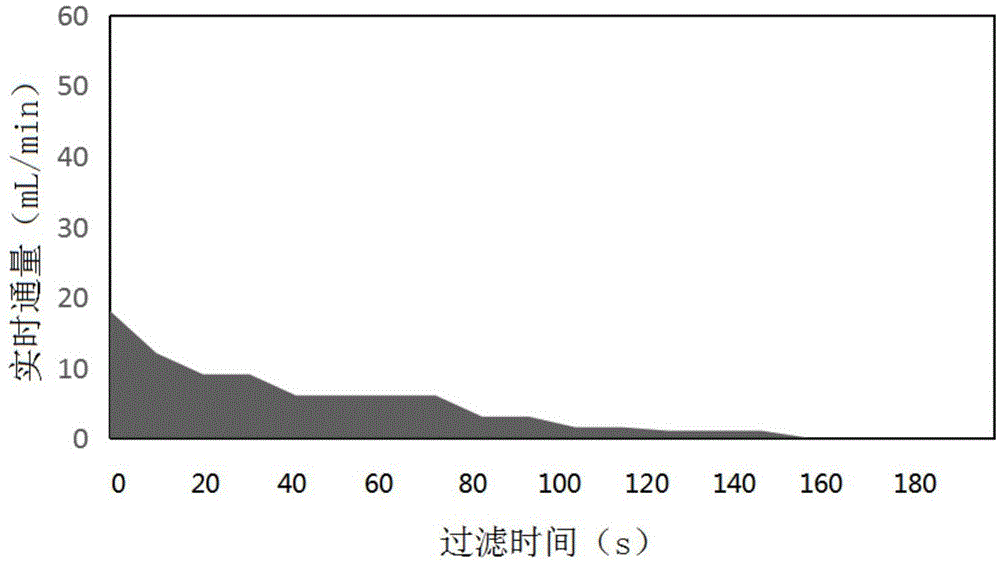
:近年来,液体活检技术成为肿瘤细胞检测领域一个新兴的重要的方法。相对于普通的肿瘤细胞检测技术,液体活检技术不需要组织穿刺,减少创伤,通过收集血液、尿液、临床灌洗液等临床样品中的循环或脱落肿瘤细胞,经分离、俘获和检测即可检测肿瘤细胞,通过原位或是释放培养还可进一步放大目标细胞作为后续研究和测试的来源。由于这些临床样品通常包括血液、尿液、肺泡灌洗液、唾液、组织消化液、脑脊液或腹腔灌洗液,样品体积通量大,其中的循环或脱落肿瘤细胞含量极少,且含有复杂的组织成分、黏液和干扰细胞,而且循环或脱落肿瘤细胞分离后存活性差,导致液体活检技术中目标细胞的捕获率和检出阳性率低。为了克服这个技术问题,在全血中俘获分离循环肿瘤细胞的诸多方法中,从流体力学的角度出发,公认最有望实现大体积通量的方法是微孔滤膜过滤,美国专利us7846393b2介绍了利用微孔滤膜俘获血液中循环肿瘤细胞的方法,但该专利微孔阵列滤膜的微孔间隙尺寸大,过滤过程中流体对细胞的剪切力大,导致细胞的活性差,而且微孔容易被组织成分堵塞,影响通量和检出阳性率。中国专利cn107694347公开了一种微孔阵列滤膜,通过保形淀积聚对二甲苯的方式增加孔隙率和减小相邻微孔间隙尺寸的方式增加通量,减少组织成分和背景细胞的截留,以及增加循环肿瘤细胞的存活性,但是通过大量的临床样本试验,发现在面对复杂的临床样本,比如肺泡灌洗液、胸水或腹水,大块的组织成分和细胞成分都被截留下来,通量急剧变小,会发生堵塞,从而不能实现对于复杂样品的循环或脱落肿瘤细胞的检测。临床常用纱布、钢丝网、尼龙网去分离这些大块的组织及黏液成分,然后再经阵列微孔滤膜作为次级分离膜截留分离,但是这种分离方法存在两方面的缺陷,一方面,纱布、钢丝网或尼龙网微孔孔径太大且均一性差,挡住的大块组织或黏液成分有限,次级的分离膜仍然有很大的概率发生堵塞,第二方面,大块的组织成分中有很大概率找到肿瘤细胞,而纱布、钢丝网或尼龙网的厚度很厚而且不平整,很难通过原位染色直接在镜下观察到捕获的目标细胞。如果通过增大聚对二甲苯阵列微孔滤膜的孔径来分离大块的组织成分和细胞成分,并不改变其厚度及均一性以便于原位染色在镜下观察捕获的肿瘤细胞,例如使这种微孔阵列滤膜的微孔孔径≥15μm,由于孔隙率对于细胞的存活性有很大影响,当孔隙率≥50%时,微孔间隙足够小,满足这种微孔孔径和孔隙率的微孔阵列滤膜满足细胞分离过程的对细胞存活性的需求,但是其刚性和机械强度显著下降,柔性显著增加,导致微孔阵列膜变形、卷曲或褶皱,不能成型,实用性差。技术实现要素:因此,本发明要解决的技术问题在于克服现有技术中具有大孔径阵列微孔的滤膜柔性过大,不能成型,不具有实用性的技术缺陷,从而提供一种具有较大孔径高孔隙率微孔阵列的柔性微孔膜,通过增加支撑区域使之具有合适的刚性和机械强度,用以分离复杂临床液体样品中的大块及高粘度背景成分和细胞成分;本发明要解决的技术问题还在于克服现有技术中使用微孔孔径≤15μm的微孔阵列滤膜检测复杂临床液体样品发生微孔堵塞的技术缺陷,从而提供了一种具有多级分离膜的细胞分离装置,经临床实际测试对复杂液体样品具有较高的通量且能增加目标物的检出率。为此,本发明提供了一种柔性微孔膜,所述柔性微孔膜包括工作区域和位于工作区域四周的支撑区域,所述工作区域具有微孔,所述微孔呈阵列式排布,其微孔孔径≥15μm,孔隙率≥50%,所述柔性微孔膜厚度大于微孔的间隙。优选的,所述工作区域的微孔孔径为25-100μm,孔隙率≥71.2%。优选的,所述柔性微孔膜为聚对二甲苯微孔膜。优选的,所述支撑区域微孔呈阵列式排布,其微孔孔隙率<50%。优选的,所述支撑区域为没有微孔的膜结构。本发明还公开了一种上述柔性微孔膜的制备方法,包括以下步骤:制备微柱阵列:在衬底上制备所述柔性微孔膜微孔的反型微柱阵列,所述微柱的尺寸与所需制备的柔性微孔膜的微孔尺寸一致;淀积聚合物:将聚对二甲苯淀积在微柱阵列上,直至封闭微柱间隙;除聚合物:去除微柱阵列表面以上的聚合物,直至微柱阵列顶端表面全部露出,获得该聚合物的微孔阵列结构;释放:释放柔性微孔膜。优选的,所述反型微柱的高度与所述柔性微孔膜的厚度相同;通过氧等离子体干法刻蚀回刻去除微柱阵列顶端的表面以上的聚合物;通过移除或腐蚀衬底释放聚合物微孔阵列结构。本发明还公开了一种上述柔性微孔膜或上述柔性微孔膜制备方法制备的柔性微孔膜在细胞分离领域的应用。本发明还公开了一种细胞分离装置,包括,过滤腔,包括进样口和出样口;分离膜组件,设置于过滤腔内,包括,至少一个上述柔性微孔膜或上述柔性微孔膜制备方法制备的柔性微孔膜作为初级分离膜,靠近所述进样口;和,至少一个末级分离膜,靠近所述出样口,其微孔孔径≤15μm,孔隙率≥25%;其中,所述初级分离膜和所述末级分离膜的厚度均大于其微孔间隙。优选的,所述末级分离膜上的微孔呈阵列式排布。优选的,所述末级分离膜为微孔阵列滤膜。优选的,包括,进样管、连接管和出样管,所述进样管、连接管和出样管顺次连接形成所述过滤腔,所述初级分离膜设置于所述进样管和所述连接管的连接处,所述末级分离膜设置于所述出样管和所述连接管的连接处。优选的,所述初级分离膜和所述末级分离膜由分离膜卡具进行固定,所述分离膜卡具包括磁性连接件,通过磁力固定所述初级分离膜和所述末级分离膜。优选的,所述分离膜卡具,还包括固定磁环,套设于磁性连接件上加固连接。本发明技术方案,具有如下优点:1.本实用新型提供的柔性微孔膜是一种2.5维的微孔阵列膜,包括工作区域,工作区域的微孔孔径≥15μm,由于该柔性微孔膜的孔隙率≥50%,微孔间隙小,因此在此孔径下,工作区域的柔性过大,刚性和机械强度都显著减小,实际使用时会发生变形、卷曲或褶皱,形状难以维持,因此还包括支撑区域,所述支撑区域的膜结构包括两种情况,一是支撑区域为没有微孔的膜结构;二是支撑区域呈微孔阵列状,其微孔孔隙率<50%;使支撑区域具有合适的机械强度和力学性能,这两类支撑区域的结构都能对整个柔性微孔膜起到支撑作用,增加其刚性和机械性能,防止其变形、卷曲或褶皱,从而提高其实用性。2.本发明采用反型微柱保形淀积法制备支撑区域孔隙率小于50%的柔性微孔膜时,在衬底上制备工作区域和支撑区域的反型微柱阵列,经聚对二甲苯淀积在微柱上后制备得到边缘结构平整的支撑区域,由于聚对二甲苯生长具有无方向性,沿着微柱表面生长,移除微柱后制成的柔性微孔膜微孔形状规则,精确度高,特别适合制备支撑区域微孔间隙较小的柔性微孔膜,制得的柔性微孔膜流体力学性能好,通量高;而且聚对二甲苯具有良好的生物相容性,有利于截留下来的目标细胞的存活性;3.本发明采用传统的掩膜刻蚀法制备没有微孔的膜结构或者支撑区域微孔间隙较大的柔性微孔膜,制备方法简单,成本低,支撑强度高。4.本发明提供的一种细胞分离装置,具有多级分离系统,初级分离膜采用本发明所述的柔性微孔膜,孔径≥15μm,孔隙率≥50%,能有效分离大块背景成分和细胞成分,截留下大块的背景成分,滤下细胞成分,增加整个分离装置的液体通量,而且本发明所述的柔性微孔膜,表面平整,截留的大块背景成分通过原位染色可以直接在镜下观察捕获的目标物,增加阳性检出率;而末级分离膜采用孔径≤15μm的微孔阵列滤膜,孔隙率≥25%,该微孔阵列滤膜微孔孔径大于目标细胞的直径,在该孔隙率条件下,能截留下目标细胞而滤下背景细胞,结合初级分离膜,能最大限度地俘获目标细胞,提高阳性检出率。附图说明为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1是本发明实施例4所得柔性微孔膜结构示意图;图2是本发明实施例4所得柔性微孔膜工作区域和支撑区域交界处的的局部放大图;图3本发明实施例5所得柔性微孔膜结构示意图;图4为本发明实施例10所述细胞分离装置的结构示意图;图5为本发明实施例10所述细胞分离装置的纵截面图;图6为本发明实施例10所述细胞分离装置初级分离膜工作区域的电镜图;图7为图6的局部放大图;图8为本发明实施例10所述细胞分离装置末级分离膜的电镜图;图9为图8的局部放大图;图10为本发明实施例10所述细胞分离装置末级分离膜的结构示意图;图11为本发明实施例10所述细胞分离装置中磁性连接件结构示意图;图12为本发明实施例10所述细胞分离装置中固定磁环结构示意图;图13为本发明评价例3中实施例10所述细胞分离装置对样品1、样品2和样品3的平均通量柱形图;图14为本发明评价例3中采用实施例1所述柔性微孔膜替换实施例10中所述细胞分离装置中初级分离膜对样品1进行过滤分离时的液体实时通量示意图;图15为本发明评价例3中采用实施例2所述柔性微孔膜替换实施例10中所述细胞分离装置中初级分离膜对样品1进行过滤分离时的液体实时通量示意图;图16为本发明评价例3中采用实施例3所述柔性微孔膜替换实施例10中所述细胞分离装置中初级分离膜对样品1进行过滤分离时的液体实时通量示意图;图17为本发明评价例3中采用实施例6所述柔性微孔膜替换实施例10中所述细胞分离装置中初级分离膜对样品1进行过滤分离时的液体实时通量示意图;图18为本发明评价例3中采用实施例7所述柔性微孔膜替换实施例10中所述细胞分离装置中初级分离膜对样品1进行过滤分离时的液体实时通量示意图;图19为本发明实施例10所述细胞分离装置过滤胸水所得初级分离膜进行原位he染色后放于显微镜下检测结果示意图;图20为本发明实施例10所述细胞分离装置过滤肺泡灌洗液所得初级分离膜进行原位he染色后放于显微镜下检测结果示意图;图21为本发明实施例10所述细胞分离装置过滤肺泡灌洗液所得末级分离膜进行原位he染色后放于显微镜下检测结果示意图;附图标记1-过滤腔,11-进样口,12-出样口,2-初级分离膜,21-工作区域,22-支撑区域,23-微孔间隙,3-末级分离膜,4-进样管,5-连接管,6-出样管,7-分离膜卡具,71-磁性连接件,711-连接端,712-固定端,72-固定磁环。具体实施方式提供下述实施例是为了更好地进一步理解本发明,并不局限于所述最佳实施方式,不对本发明的内容和保护范围构成限制,任何人在本发明的启示下或是将本发明与其他现有技术的特征进行组合而得出的任何与本发明相同或相近似的产品,均落在本发明的保护范围之内。实施例中未注明具体实验步骤或条件者,按照本领域内的文献所描述的常规实验步骤的操作或条件即可进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规试剂产品。实施例1本实施例提供了一种柔性微孔膜的具体实施方式,具体包括如下步骤:在硅衬底上制备所述柔性微孔膜工作区域微孔的反型微柱阵列和支撑区域微孔的反型微柱阵列,所述工作区域微孔的反型微柱横截面为六边形,六边形的对边距离为15μm,微孔间隙2.6μm,所述支撑区域微孔的反型微柱横截面为正方形,边长为4μm,微孔间隙2.1μm,所述微孔间隙为相邻两个正方形之间的最短距离,所有微柱的高度为10μm;将聚对二甲苯淀积在微柱阵列上,直至封闭微柱间隙;通过氧等离子体干法刻蚀去除微柱阵列表面以上的聚合物,直至微柱阵列顶端表面全部露出;腐蚀硅衬底获得该聚合物的微孔阵列结构,释放柔性微孔膜;本实施例所述柔性微孔膜工作区域的面积为12×12mm,工作区域和支撑区域的面积和为17×17mm,厚度为10μm。实施例2本实施例提供了一种柔性微孔膜的具体实施方式,具体包括如下步骤:在硅衬底上制备所述柔性微孔膜工作区域微孔的反型微柱阵列和支撑区域微孔的反型微柱阵列,所述工作区域微孔的反型微柱横截面为圆形,圆形的直径为25μm,相邻两个圆形的圆心距离为26.3μm;所述支撑区域微孔的反型微柱横截面为圆形,圆形的直径为4μm,相邻两个圆形的圆心距离为5.2μm,所有微柱的高度为6μm;将聚对二甲苯淀积在微柱阵列上,直至封闭微柱间隙;通过氧等离子体干法刻蚀去除微柱阵列表面以上的聚合物,直至微柱阵列顶端表面全部露出;腐蚀硅衬底获得该聚合物的微孔阵列结构,释放柔性微孔膜;本实施例所述柔性微孔膜工作区域的面积为10×10mm,工作区域和支撑区域的面积和为15×15mm,厚度为6μm。实施例3本实施例提供了一种柔性微孔膜的具体实施方式,具体包括如下步骤:在硅衬底上制备所述柔性微孔膜工作区域微孔的反型微柱阵列和支撑区域微孔的反型微柱阵列,其微孔的反型微柱横截面为矩形,矩形的长边为30μm,矩形的短边为9μm,微孔间隙为2.5μm,微孔间隙为相连两个矩形间的最短距离,孔隙率为73%,所述支撑区域微孔的反型微柱横截面为矩形,矩形的长边为8μm,矩形的短边为2μm,微孔间隙为2.5μm,孔隙率为35%,所有微柱的高度为10μm;将聚对二甲苯淀积在微柱阵列上,直至封闭微柱间隙;通过氧等离子体干法刻蚀去除微柱阵列表面以上的聚合物,直至微柱阵列顶端表面全部露出;腐蚀硅衬底获得该聚合物的微孔阵列结构,释放柔性微孔膜;本实施例所述柔性微孔膜工作区域的面积为13×13mm,工作区域和支撑区域的面积和为18×18mm,厚度为10μm。实施例4本实施例提供了一种柔性微孔膜的具体实施方式,具体包括如下步骤:在硅衬底上制备所述柔性微孔膜工作区域微孔的反型微柱阵列和支撑区域微孔的反型微柱阵列,所述工作区域微孔的反型微柱横截面为六边形,六边形的对边距离为50μm,微孔间隙为4.8μm,微孔间隙为相邻两个六边形之间的最短距离,孔隙率为83.7%,所述支撑区域微孔的反型微柱横截面为正方形,边长为4μm,微孔间隙为4μm,孔隙率为25%,所有微柱的高度为10μm;将聚对二甲苯淀积在微柱阵列上,直至封闭微柱间隙;通过氧等离子体干法刻蚀去除微柱阵列表面以上的聚合物,直至微柱阵列顶端表面全部露出;腐蚀硅衬底获得该聚合物的微孔阵列结构,释放柔性微孔膜;本实施例所述柔性微孔膜工作区域的面积为12×12mm,工作区域和支撑区域的面积和为17×17mm,厚度为10μm,如图1、图2所示。实施例5本实施例提供了一种柔性微孔膜的具体实施方式,具体包括如下步骤:在衬底上淀积一层聚对二甲苯,其厚度为10μm;parylenec表面pvd(physicalvapordeposition,物理气相淀积)淀积光刻及h2o2(1:50)腐蚀后得到图形化的ti掩膜微结构,然后以ti微结构为掩膜进行聚对二甲苯的rie,rie结束后使用体积分数为2%的h2o2水溶液腐蚀残余的掩膜ti;最后使用去离子水浸泡,将微孔阵列滤膜从衬底上释放;所述工作区域微孔六边形的对边距离可为50μm,微孔间隙为8μm,孔隙率为74%;支撑区域为没有微孔的膜结构;所述柔性微孔膜厚度为10μm。实施例6本实施例提供了一种柔性微孔膜的具体实施方式,具体包括如下步骤:在硅衬底上制备所述柔性微孔膜工作区域微孔的反型微柱阵列和支撑区域微孔的反型微柱阵列,所述工作区域微孔的反型微柱横截面为矩形,矩形的长边为70μm,矩形的短边为35μm,微孔间隙为4μm,所述支撑区域微孔的反型微柱横截面为矩形,矩形的长边为16μm,矩形的短边为4μm,微孔间隙为3μm,所有微柱的高度为10μm;将聚对二甲苯淀积在微柱阵列上,直至封闭微柱间隙;通过氧等离子体干法刻蚀去除微柱阵列表面以上的聚合物,直至微柱阵列顶端表面全部露出;腐蚀硅衬底获得该聚合物的微孔阵列结构,释放柔性微孔膜;本实施例所述柔性微孔膜工作区域的面积为15×15mm,工作区域和支撑区域的面积和为19×19mm,厚度为10μm。实施例7本实施例提供了一种柔性微孔膜的具体实施方式,具体包括如下步骤:在硅衬底上制备所述柔性微孔膜工作区域微孔的反型微柱阵列和支撑区域微孔的反型微柱阵列,所述工作区域微孔的反型微柱横截面为正六边形,其对边距离为100μm,微孔间隙为5μm,所述支撑区域微孔的反型微柱横截面为圆形,其直径为20μm,相邻两个圆形的圆心距离为25μm,孔隙率为49%;所有微柱的高度为15μm。将聚对二甲苯淀积在微柱阵列上,直至封闭微柱间隙;通过氧等离子体干法刻蚀去除微柱阵列表面以上的聚合物,直至微柱阵列顶端表面全部露出;腐蚀硅衬底获得该聚合物的微孔阵列结构,释放柔性微孔膜;本实施例所述柔性微孔膜工作区域的面积为16×16mm,工作区域和支撑区域的面积和为20×20mm,厚度为15μm。实施例8本实施例提供了一种末级分离膜的具体实施方式,具体包括如下步骤:在衬底上淀积一层聚对二甲苯,其厚度为12μm;parylenec表面pvd(physicalvapordeposition,物理气相淀积)淀积光刻及体积分数为2%的h2o2水溶液腐蚀后得到图形化的ti掩膜微结构,然后以ti微结构为掩膜进行聚对二甲苯的rie,rie结束后使用体积分数为2%的h2o2水溶液腐蚀残余的掩膜ti;最后使用去离子水浸泡,将微孔阵列滤膜从衬底上释放;得到末级分离膜微孔六边形的对边距离为15μm,微孔间隙为10μm,孔隙率为36%,;所述柔性微孔膜厚度为12μm。实施例9本实施例提供了一种末级分离膜的具体实施方式,采用反型微柱保形淀积法制备,具体包括如下步骤:在硅衬底上制备所述末级分离膜微孔的反型微柱阵列,所述工作区域微孔的反型微柱横截面为六边形,六边形的对边距离为10μm,微柱间隙10μm,所有微柱的高度为12μm;将聚对二甲苯淀积在微柱阵列上,直至封闭微柱间隙;通过氧等离子体干法刻蚀去除微柱阵列表面以上的聚合物,直至微柱阵列顶端表面全部露出;腐蚀硅衬底获得该聚合物的微孔阵列结构,释放柔性微孔膜;得到末级分离膜微孔六边形的对边距离10μm,孔隙率25%,膜厚度12μm。实施例10本实施例公开了一种细胞分离装置,如图4和图5所示,包括,过滤腔1,所述过滤腔包括进样口11出样口12;分离膜组件,设置于过滤腔1内,包括,至少一个柔性微孔膜作为初级分离膜2,所述柔性微孔膜靠近所述进样口11,包括工作区域21和位于工作区域21四周的支撑区域22,所述工作区域21具有微孔,所述微孔呈阵列式排布,其微孔孔径≥15μm,孔隙率≥50%;和,至少一个末级分离膜3,靠近所述出样口12,其微孔孔径≤15μm,孔隙率≥30%;其中,所述初级分离膜2和所述末级分离膜3的厚度均大于其微孔间隙的宽度。所述细胞分离装置包括两个分离膜,所述初级分离膜2截留大块背景成分,滤下细胞成分;所述末级分离膜3截留细胞成分中的目标成分,滤下细胞成分中微小背景成分,两个分离膜同时作用不仅能提高通量防止滤膜发生堵塞,而且初级分离膜和末级分离膜都能在显微镜下观察检测目标细胞,增加检出的阳性率。为了防止所述细胞分离装置的过滤腔1内壁与液体样品发生反应影响检测结果,所述过滤腔1内壁采用不与液体样品发生反应的惰性材料特氟龙,所述进样口11为漏斗状,便于承接液体临床样品,并起导流作用使液体流下;所述出样口12处上宽下细,便于液体流出,在实际应用时,所述出样口可拆卸地连接一废液容器。所述柔性微孔膜孔径越大,孔隙率越高,综合相同密度及厚度下,孔隙率越高机械强度越小,柔性微孔膜在孔径≥15μm,孔隙率≥50%时,变得非常柔软,发生卷曲、褶皱、不能成型,不具有实用性,所述支撑区域22的存在能维持大孔径工作区域的形状和机械强度;因此本实施例细胞分离装置中的初级分离膜2采用本发明实施例4提供的柔性微孔膜,所述柔性微孔膜包括大孔径的工作区域21和支撑区域22;所述工作区域微孔为六边形,六边形的对边距离为50μm,所述支撑区域微孔为正方形,边长为4μm;所述工作区域的面积为12×12mm,工作区域和支撑区域的面积和为17×17mm,厚度为10μm;如图1、图2、图6和图7所示。柔性微孔膜作为阵列微孔滤膜,其机械强度和孔隙率有关,在孔隙率小于50%时具有足够的机械强度而不易变形具有实用性,本实施例所述支撑区域正方形微孔边长为4μm,孔隙率为25%。由于微孔孔径较小,而且柔性微孔膜的厚度较厚,微孔具有一定的深度,为了保证微孔的精密度,也为了进一步增加初级分离膜2的分离性能和液体通量,采用反型微柱保形淀积法制备本实施例初级分离膜,制得的柔性微孔膜内壁平整,液体流过时不对细胞产生损伤影响存活性;本实施例反型微柱保形淀积采用聚对二甲苯为原料,按照实施例4所述制备方法进行制备。当支撑区域22的微孔孔径足够大,在6μm以上,也可采用掩膜刻蚀法进行制备;所述支撑区域22也可以为没有微孔的膜结构,该种初级分离膜2采用常规的掩膜刻蚀法制备,对工作区域21起支撑作用。为了在实际使用时,增加对目标细胞的截留效果以及提高截留下来的目标细胞的存活性,所述末级分离膜3为小孔径微孔阵列滤膜,所述微孔的形状和大小,根据对待分离的目标细胞的分离效果而定,本实施例所述细胞分离装置采用的末级分离膜3上的微孔呈阵列式排布,所述微孔的形状为六边形,六边形的对边距离为10μm,小于目标细胞的直径15μm,以此保证目标细胞的高回收率,相邻微孔间隙的宽度位3μm,小于背景细胞的半径4μm,使得背景细胞在滤液流动过程中更易于被流体带走,而且减小微孔上俘获的细胞的流体剪切力,提高俘获细胞的活性,如图8-10所示。为了进一步提高对液体样品分离过程中的液体通量和分离效果,所述细胞分离装置的末级分离膜2采用反型微柱保形淀积法制备。为了便于装配和更换分离膜组件,所述细胞分离装置为分体式结构,还包括进样管4、连接管5和出样管6,所述进样管4、连接管5和出样管6顺次连接形成所述过滤腔1,所述初级分离膜2设置于所述进样管4和所述连接管5的连接处,所述末级分离膜3设置于所述出样管6和所述连接管5的连接处。为了将分离膜连接到所述细胞分离装置中同时避免其发生破损,所述初级分离膜2和所述末级分离膜3由分离膜卡具7进行固定,所述分离膜卡具7包括磁性连接件71,通过磁力固定所述初级分离膜2和所述末级分离膜3,如图11所示,所述磁性连接件71中间有圆孔,所述圆孔的横截面和过滤腔1的横截面一致,组成过滤腔1的一部分,所述磁性连接件71一端平整,为固定端711,用来和同一分离膜卡具7中另一个磁性连接件71固定端711通过磁力夹住柔性微孔膜,所述磁性连接件71另一端为连接端712,通过与连接管5相连,将分离膜固定到过滤腔1中。由于磁性连接力较弱,为了加固连接,每个所述磁性连接件还设有一个固定磁环42,如图12所示,所述固定磁环72套设于一个磁性连接件71的连接端712。对比例1本对比例提供了一种柔性微孔膜的具体实施方式。本对比例实施方式与实施例1实施方式基本相同,区别在于,本对比例没有支撑区域,本对比例所得柔性微孔膜发生卷曲,不能成型。对比例2本对比例提供了细胞分离装置的具体实施方式。本对比例实施方式与实施例10所述细胞分离装置基本相同,区别在于,本对比例不含有初级分离膜,过滤腔内只有一个末级分离膜。对比例3本对比例提供了细胞分离装置的具体实施方式。本对比例实施方式与实施例10实施方式基本相同,区别在于,本对比例采用相同的分离膜为初级分离膜和末级分离膜,所述分离膜的孔径为六边形,孔径为15μm,孔隙率为30%,厚度为10μm。评价例1孔隙率测试孔隙率采用密度法,已知膜原材料的密度a,通过观测及计算可得膜密度b(膜质量与表观体积之比),则孔隙率可通过公式(a-b)/a得到。表1实施例1-7,对比例1孔隙率测试结果实施例工作区域孔间隙(%)支撑区域孔间隙(%)膜形态15049平整无变形271.245平整无变形37335平整无变形483.725平整无变形574/平整无变形684.547.2平整无变形791.449平整无变形对比例150/发生卷曲和变形评价例2变形测试在液体流速为100ml/min基于彩色共聚焦成像(cci)力学测试装置得到滤膜的力-形变趋势,拟合得到实施例1-实施例7的膜受力和微孔孔径的变化量,如下表2所示。表2实施例1-7柔性微孔膜力-形变测试结果实施例膜受力(×10-2n)微孔孔径变化量(nm)12.12121.92631.93041.83551.82861.74171.548评价例3通量测试分别使用实施例1-3和实施例5-7所述柔性微孔膜替换实施例10所述细胞分离装置中初级分离膜所得,对以下三种样品进行过滤和分离:样品1:正常的清澈肺泡灌洗液;样品2:支气管镜反复冲洗肺部肿瘤收集的较为浑浊的肺泡灌洗液;样品3:支气管镜反复冲洗并发炎症的肺部肿瘤收集的血性肺泡灌洗液;采用实施例10、实施例1-3和实施例5-7所述柔性微孔膜作为实施例10中初级分离膜所得细胞分离装置,采用实施例8所述微孔阵列膜作为末级分离膜,对样品1-3的平均通量结果如下表3所示;采用实施例10所述细胞分离装置对样品1-3的平均通量柱形图如图13所示;采用实施例1-3、实施例6、实施例7所述柔性微孔膜作为实施例10所述细胞分离装置的初级分离膜,采用实施例9所述微孔阵列膜作为末级分离膜,对样品1的实时通量结果如图14-18所示;。表3实施例10、实施例1-3和实施例5-7所述柔性微孔膜作为实施例10中初级分离膜所得细胞分离装置、对比例2和对比例3对样品1-3的平均通量(ml/min)评价例4分离膜上捕获的肿瘤细胞原位观察使用实施例10所述的细胞分离装置过滤含有肿瘤细胞的胸水液体样品,将初级分离膜进行he染色后放于显微镜下观测,结果如图19所示,其中附图标记a为目标肿瘤细胞;使用实施例10所述的细胞分离装置过滤含有肿瘤细胞肺泡灌洗液,取下初级分离膜和末级分离膜进行原位he染色后放于显微镜下观测,结果如图20和图21所示,其中附图标记b为目标肿瘤细胞。通过实施例10所述细胞分离装置对50例含有肿瘤细胞的肺泡灌洗液进行过滤和检测,检测结果阳性准确率达到90.91%,高于传统离心涂片的tct方法。显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定;对于所属领域的普通技术人员来说,在更多的实施例中,为了进一步针对不同的样品获得最好的分离效果,可以制备不同孔径的分离膜,采用不同的膜材料和制备方法,所述初级分离膜和末级分离膜之间还可增加新的分离膜,在上述说明的基础上做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1