人CD30配体抗原结合蛋白的制作方法
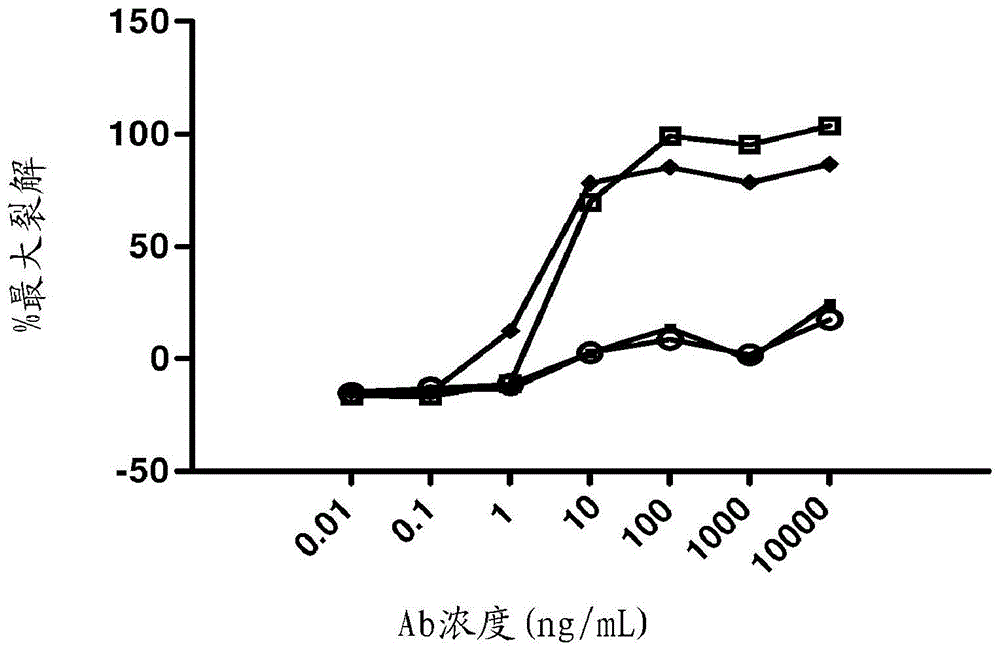
背景cd30配体(cd30l、cd153)(cd30的天然存在的配体)为ii型细胞膜糖蛋白,其特异性结合cd30,触发cd30经由其细胞质结构域传输信号。cd30和cd30l为相互作用细胞表面糖蛋白,其分别为tnfr和tnf超家族的成员(durkop等人,cell,68:421,1992;smith等人,cell,73:1349,1993;美国专利号5,480,981;5,677,430;6,143,869和6,652,854)。cd30和cd30l的表达受限于免疫系统的细胞且受紧密调节。cd30主要在活化b细胞和具有活化/记忆表型的t细胞亚群上表达(ellis等人,j.immun.,151:2380,1993;falini等人,blood,85:1,1995)。cd30l在活化小鼠和人t细胞上大量表达(shimozato等人,biochem.&biophys.res.comm.,256:519,1999;armitage,j.biologicalregulators&homeostaticagents,14:142,2000)。当b细胞通过生发中心(germinalcenter)运输时,cd30l的相对基因表达发生显著变化(klein等人,proc.nat.acad.sci.,usa,100:2639,2003)。因此,b细胞上cd30l的表达可以是阶段和情形特异性的。cd30l也似乎为存在于脾滤泡中的独特的小鼠树突状细胞样辅佐细胞群体的标记,在脾滤泡中,t细胞与b细胞相互作用(kim等人,immunity,18:643,2003)。表达cd30/cd30l的细胞之间的相互作用似乎对产生强t细胞依赖性继发性或类别切换性抗体反应是重要的。所述作用的证据包括来自小鼠系统中的体外(shanebeck等人,eur.j.immunol.,25:2147-53,1995)和体内(gaspal等人,.j.immunol.,174:3891-6,2005)研究的数据。此外,已显示在多种t细胞和/或b细胞依赖性自身免疫性疾病模型中,用针对小鼠cd30l的阻断型但非消耗型大鼠mab对小鼠进行体内处理抑制疾病的发展或进程(美国专利号6,667,039)。在具有强体液免疫组分的模型中,疾病抑制与疾病相关抗体反应的抑制相关。因此,具有包含结合于cd30l的人抗体和/或抗原结合区的组合物对于用于治疗性和诊断性应用中是有用的。发明概述提供结合cd30l(尤其人cd30l)的抗原结合蛋白。人cd30l抗原结合蛋白可降低、抑制、阻碍和/或调节至少一种与cd30l/cd30相互作用有关的生物学反应,且因此可用于改善cd30l相关疾病或病症的影响。cd30l抗原结合蛋白可用于例如降低、抑制、阻碍和/或调节cd30l/cd30相互作用。在一个实施方案中,提供结合cd30l的c末端区域(包括aa201-234)的分离的抗原结合蛋白。在一个其他实施方案中,提供抗原结合蛋白,其结合cd30l的c末端区域(包括aa201-234)和位于胞外区的n末端部分的cd30l中的进一步区域(其由aa75-95界定)。在本发明的其他实施方案中,抗原结合蛋白具有至少一种选自以下的性质:a)抑制cd30/cd30l相互作用;b)抑制cd30l诱导的il-8诱导作用;c)与抗体a-f中的一种交叉竞争结合人cd30l;d)与人cd30l的解离常数为至多70pm和e)以实质上相同或更高的抗体a-f中的一种的亲和力(较低kd)结合于人cd30l。可以如本领域技术人员已知测定亲和力(或kd),诸如通过spr或通过facs,如本文中的实施例4中所述。在一个其他实施方案中,抗原结合蛋白结合cd30l,且与抗体a、b、c、d、e和f中的一种或多种的fab针对与cd30l的结合进行竞争。或者,所述抗原结合蛋白被表征为与hcd30l的结合受抗体a、b、c、d、e和f中的一种或多种的fab的结合所抑制的抗原结合蛋白。在其他特定实施方案中,fab是包括a1、a2、a3、a4、a5和a6中每一种的抗体a的fab。在一个实施方案中,提供结合cd30l的分离的抗原结合蛋白,其包含至少一个重链可变区,所述至少一个重链可变区包含选自以下的cdrh1、cdrh2和cdrh3:a)与如表3中所示的cdrh1相差不超过4、3、2或1个氨基酸取代、插入或缺失的cdrh1;b)与如表3中所示的cdrh2相差不超过7、6、5、4、3、2或1个氨基酸取代、插入和/或缺失的cdrh2;c)与如表3中所示的cdrh3相差不超过11、10、9、8、7、6、5、4、3、2或1个氨基酸取代、插入和/或缺失的cdrh3;和包含至少一个轻链可变区,所述至少一个轻链可变区包含选自以下的cdrl1、cdrl2和cdrl3:d)与如表3中所示的cdrl1相差不超过4、3、2或1个氨基酸取代、插入和/或缺失的cdrl1;e)与如表3中所示的cdrl2相差不超过2个或1个氨基酸取代、插入或缺失的cdrl2;f)与如表3中所示的cdrl3相差不超过2个或1个氨基酸取代、插入或缺失的cdrl3。在相关实施方案中,提供选自以下的cdrh1:seqidnos:14、15、16、17、18和33;选自以下的cdrh2:seqidnos:19、20、21、22、23、24和34;选自以下的cdrh3:seqidnos:25、26、27、28、29和35;选自以下的cdrl1:seqidnos:1、2、3、4、5、6和30;选自以下的cdrl2:seqidnos:7、8、9、10和31;和选自以下的cdrl3:seqidnos:11、12、13和32。另一个实施方案提供结合人cd30l的分离的抗原结合蛋白,其包含至少一个包含cdr1、cdr2和cdr3的轻链可变区,其中cdr1包含seqidnos:36、28、40、42或44的氨基酸残基23-36,cdr2包含seqidnos:36、28、40、42或44的氨基酸残基52-58且cdr3包含seqidnos:36、28、40、42或44的氨基酸残基91-100;或b)包含cdr1、cdr2和cdr3的轻链可变区,其中cdr1包含seqidnos:46的氨基酸残基25-36,cdr2包含seqidnos:46的氨基酸残基52-58且cdr3包含seqidnos:46的氨基酸残基91-100;和至少一个包含cdr1、cdr2和cdr3的重链可变区,其中cdr1包含seqidnos:48、50、52、54、56、58、60、62、64、66、68、70或72的氨基酸残基31-35,cdr2包含seqidnos:48、50、52、54、56、58、60、62、64、66、68、70或72的氨基酸残基50-65且cdr3包含seqidnos:48、50、52、54、56、58、60、62、64、66、68、70或72的氨基酸残基98-113。在一个相关实施方案中,提供抗原结合蛋白,其包含至少一个重链可变区和至少一个轻链可变区。在另一个实施方案中,提供抗原结合蛋白,其包含至少两个重链可变区和至少两个轻链可变区。在另一个实施方案中,提供结合cd30l的分离的抗原结合蛋白,其包含重链可变区和轻链可变区,其中重链可变区序列与如表2中所示的重链可变区序列相差不超过31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2或1个氨基酸取代、添加和/或缺失;且其中轻链可变区序列与如表1中所示的轻链可变区序列相差不超过30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2或1个氨基酸取代、添加和/或缺失。另一个实施方案提供结合cd30l的分离的抗原结合蛋白,其包含重链可变区,所述重链可变区包含与seqidno:48、50、52、54、56、58、60、62、64、66、68、70和72具有至少80%序列同一性的氨基酸序列;和轻链可变区,所述轻链可变区包含与seqidno:36、38、40、42、44和46具有至少88%序列同一性的氨基酸序列。在一个实施方案中,提供结合cd30l的分离的抗原结合蛋白,其选自以下:a)选自seqidnos:48、50、52、54、56、58、60和62的重链可变区和seqidno:36的轻链可变区;b)seqidno:64的重链可变区和seqidno:38的轻链可变区;c)seqidno:66的重链可变区和seqidno:40的轻链可变区;d)seqidno:68的重链可变区和seqidno:42的轻链可变区;e)seqidno:70的重链可变区和seqidno:44的轻链可变区;和f)seqidno:72的重链可变区和seqidno:46的轻链可变区。在一个相关实施方案中,分离的抗原结合蛋白为抗体。在另一个相关实施方案中,抗体为单克隆抗体、重组抗体、人抗体、人源化抗体、嵌合抗体、多特异性抗体或其抗体片段。在一个其他实施方案中,抗体片段为fab片段、fab’片段、f(ab')2片段、fv片段、双抗体或单链抗体分子。在一个相关实施方案中,抗原结合蛋白为人抗体。在另一个相关实施方案中,抗原结合蛋白为单克隆抗体。在一个其他相关实施方案中,抗原结合蛋白为iggl型、igg2型、igg3型或igg4型。在一个相关实施方案中,抗原结合蛋白为iggl型或igg2型。另一个实施方案提供分离的核酸分子,其编码如上所述的抗原结合蛋白。在一个相关实施方案中,至少一个重链可变区由选自seqidnos:49、51、53、55、57、59、61、63、65、67、69、71和73的分离的核酸分子编码且至少一个轻链可变区由选自seqidnos:37、39、41、43、45和47的分离的核酸分子编码。在另一个相关实施方案中,核酸分子与控制序列可操作地连接。在一个其他相关实施方案中,提供包含上述核酸的载体和包含此类载体的宿主细胞。在又一个其他实施方案中,提供足以用作杂交探针、pcr引物或测序引物的分离的多核苷酸,其为如上所述的核酸分子的片段或其互补序列。另一个实施方案提供制备如上所述的抗原结合蛋白的方法,其包括由分泌抗原结合蛋白的宿主细胞制备抗原结合蛋白的步骤。另一个实施方案提供如上所述的分离的抗原结合蛋白,其中所述抗原结合蛋白具有至少一种选自以下的性质:a)抑制cd30/cd30l相互作用;b)抑制cd30l诱导的il-8诱导作用;c)与抗体a-f中的一种交叉竞争结合人cd30l;d)解离常数≤70pm和e)以与抗体a-f中的一种实质上相同的kd结合于人cd30l。在又另一个实施方案中,提供药物组合物,其包含至少一种如上所述的抗原结合蛋白和药学上可接受的赋形剂。一个相关实施方案进一步提供进一步包含标记基团或效应物基团的此类药物组合物。在另一个相关实施方案中,标记基团选自以下:同位素标记、磁性标记、氧化还原活性部分、光学染料、生物素化基团和由二级报道分子识别的预定多肽表位。在一个其他相关实施方案中,效应物基团选自放射性同位素、放射性核素、毒素、治疗基团和化学治疗基团。在另一个相关实施方案中,抗原结合蛋白与标记基团偶联。另一个实施方案提供治疗或预防患者中与cd30l相关的病况的方法,其包括向有其需要的患者施用有效量的至少一种如上所述的分离的抗原结合蛋白。在又另一个相关实施方案中,分离的抗原结合蛋白单独施用或作为组合治疗施用。另一个实施方案提供降低患者中cd30l活性的方法,其包括施用有效量的至少一种如上所述的抗原结合蛋白。在又另一个实施方案中,提供与至少一种如上所述的抗原结合蛋白竞争的抗原结合蛋白。在另一个实施方案中,提供如上所述的抗原结合蛋白,其完全或部分无岩藻糖基化(afucosylated)。附图图1aramos细胞和nk效应物,空心正方形:美罗华(rituxan)(iggl),实心菱形:抗体a1igg1f,实心正方形:抗体a1igg1,空心圆形:抗体a1igg2。图1bjd38细胞和nk效应物,空心正方形:美罗华(iggl),实心菱形:抗体a1igg1f,实心正方形:抗体a1igg1,空心圆形:抗体a1igg2。图1cds179细胞和nk效应物,空心正方形:美罗华(iggl),实心菱形:抗体a1igg1f,实心正方形:抗体a1igg1,空心圆形:抗体a1igg2。图1dew36细胞和nk效应物,空心正方形:美罗华(iggl),实心菱形:抗体a1igg1f,实心正方形:抗体a1igg1,空心圆形:抗体a1igg2。详述本发明提供与cd30l抗原结合蛋白(包括阻断cd30l与cd30之间相互作用的抗原结合蛋白,诸如抗cd30l抗体、抗体片段和抗体衍生物,例如中和抗cd30l抗体、抗体片段或抗体衍生物)有关的组合物、试剂盒和方法。还提供多核苷酸以及其衍生物和片段,其包含编码结合于cd30l的所有多肽或其部分的核酸的序列,例如编码所有抗cd30l抗体、抗体片段或抗体衍生物或其部分的多核苷酸,包含所述核酸的质粒和载体,和包含所述多核苷酸和/或载体和质粒的细胞或细胞系。所提供的方法包括例如制备、鉴定或分离cd30l抗原结合蛋白(诸如抗cd30l抗体)的方法;确定分子是否阻断cd30l与cd30之间相互作用的方法;确定分子是否拮抗cd30l的方法;制备包含cd30l抗原结合蛋白的组合物(诸如药物组合物)的方法;和向主体施用cd30l抗原结合蛋白的方法,例如治疗由cd30l介导的病况和体内或体外阻断cd30l与cd30之间相互作用的方法。除非本文中另有定义,否则结合本发明所用的科学和技术术语应具有本领域普通技术人员通常理解的含义。此外,除非上下文另有要求,否则单数术语应包括复数且复数术语应包括单数。通常,与本文所述的细胞和组织培养、分子生物学、免疫学、微生物学、遗传学以及蛋白和核酸化学和杂交结合使用的命名法和其技术是本领域中众所周知和常用的。除非另有说明,否则本发明的方法和技术通常根据本领域中众所周知的常规方法和如本说明书中引用和论述的各种通用和更特定参考文献中所述进行。参见例如,sambrook等人,molecularcloning:alaboratorymanual,3rded.,coldspringharborlaboratorypress,coldspringharbor,n.y.(2001)和ausubel等人,currentprotocolsinmolecularbiology,greenepublishingassociates(1992),以及harlow和laneantibodies:alaboratorymanualcoldspringharborlaboratorypress,coldspringharbor,n.y.(1990)。酶促反应和纯化技术根据制造商说明书以本领域中常用实现方式或如本文所述进行。结合本文所述的分析化学、合成有机化学以及医药和药物化学使用的术语和其实验室步骤和技术为本领域中众所周知和常用的。可使用标准技术进行化学合成、化学分析、药物制备、配制和递送以及治疗患者。本申请中引用的所有文献或部分文献(包括但不限于专利、专利申请、论文、书籍和专题论文)均以其整体通过引用明确地并入本文中以用于描述和说明目的,例如所述公开中描述的方法可与本文所述的信息结合使用。术语“cd30配体”(cd30l)是指能够结合cd30的多肽类别(如smith等人,cell73:1349-1360,1993和美国专利号5,480,981中所公开),包括其cd30结合突变蛋白;所述多肽包括膜结合蛋白(包含细胞质结构域、跨膜区和胞外结构域)以及保留cd30结合性质的截短蛋白。所述截短蛋白包括例如仅包含细胞外(受体结合)结构域的可溶性cd30l。还包括cd30l片段,包括全长cd30l多肽的部分,其保留cd30结合能力或能够引发与cd30多肽或能够传输生物学信号(诸如nf-κb的活化)的一部分全长cd30特异性结合的抗体。术语“cd30”是指作为tnf/ngf受体超家族的成员的受体,其克隆方法描述于durkop等人(cell68:421,1992)中。短语“可溶性cd30”(scd30)是指包含cd30蛋白的所有胞外结构域或其部分且保留与cd30l特异性结合能力的可溶性分子。可溶性cd30多肽涵盖高度纯化形式的重组scd30和天然存在scd30蛋白。如本文中所用,短语“cd30的片段”是指全长cd30多肽的一部分,其保留cd30l结合能力或能够引发与cd30多肽或能够传输生物学信号(诸如nf-κb的活化)的一部分全长cd30特异性结合的抗体。如本文中所用,短语”cd30/cd30l相互作用”是指cd30与cd30l的特异性结合,其引起由cd30进行的信号转导。此包括其中至少一个结合伴侣为cd30或cd30l的片段的实例,即该术语可是指cd30片段与cd30l、cd30与cd30l片段或cd30片段与cd30l片段的结合相互作用。此外,cd30/cd30l相互作用可涉及cd30类似物(诸如等位基因变体或突变蛋白),其能够特异性结合于cd30l,或可涉及cd30l类似物(诸如等位基因变体或突变蛋白),其可与cd30特异性结合。此外,cd30/cd30l相互作用可涉及内源cd30或cd30l蛋白或可涉及由编码重组蛋白的核酸所转染的细胞表达的重组cd30或cd30l。术语“多核苷酸”包括单链和双链核酸且包括基因组dna、rna、mrna、cdna或其与在自然界中通常发现的序列无关的合成来源或一些组合。包含指定序列的分离的多核苷酸除指定序列外可包括多达10种或甚至多达20种其他蛋白或其部分的编码序列,或可包括控制所述核酸序列的编码区的表达的可操作地连接的调节序列和/或可包括载体序列。包含多核苷酸的核苷酸可以是核糖核苷酸或脱氧核糖核苷酸或任一类型核苷酸的修饰形式。所述修饰包括碱基修饰,诸如溴尿苷和肌核苷衍生物;核糖修饰,诸如2’,3’-二脱氧核糖;和核苷酸间键修饰,诸如硫代磷酸酯、二硫代磷酸酯、硒代磷酸酯、二硒代磷酸酯、苯胺硫代磷酸酯、苯胺磷酸酯(phoshoraniladate)和磷酰胺酸酯。术语“寡核苷酸”意指包含100个或更少核苷酸的多核苷酸。在一些实施方案中,寡核苷酸的长度为10至60个碱基。在其他实施方案中,寡核苷酸的长度为12、13、14、15、16、17、18、19或20至40个核苷酸。寡核苷酸可以是单链或双链,例如用于构建突变基因。寡核苷酸可以是有义或反义寡核苷酸。寡核苷酸可包括用于检测测定法的可检测标记,诸如放射性标记、荧光标记、半抗原或抗原性标记。寡核苷酸可用作例如pcr引物、克隆引物或杂交探针。术语“多肽”或“蛋白”意指具有天然蛋白的氨基酸序列的大分子,即由天然存在且非重组细胞产生的蛋白;或其是由经遗传工程改造或重组细胞产生,且包含具有天然蛋白的氨基酸序列的分子,或与天然序列相比具有一个或多个氨基酸残基缺失、插入和/或取代的分子。该术语还包括氨基酸聚合物,其中一个或多个氨基酸为相应天然存在的氨基酸和聚合物的化学类似物。术语“多肽”和“蛋白”涵盖cd30l抗原结合蛋白(诸如抗体)和序列,其与抗原结合蛋白序列相比具有一个或多个氨基酸残基缺失、添加和/或取代。术语“多肽片段”是指与全长天然蛋白相比具有氨基端缺失、羧基端缺失和/或内部缺失的多肽。所述片段与天然蛋白相比也可含有经修饰的氨基酸。在某些实施方案中,片段长度为约5至500个氨基酸。例如,片段长度可以是至少5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、50、70、100、110、150、200、250、300、350、400或450个氨基酸。有用多肽片段包括抗体的免疫功能性片段,包括结合结构域。在cd30l抗原结合蛋白(诸如抗体)情况下,有用片段包括但不限于一个或多个cdr区、重链或轻链的可变结构域、抗体链的一部分、可变区的一部分(包括不超过3个cdr)等。“氨基酸”包括其在本领域中的正常含义。20种天然存在的氨基酸和其缩写遵循常规用法。参见immunology-asynthesis,2ndedition,(e.s.golub和d.r.gren,编辑),sinauerassociates:sunderland,mass.(1991)。20种常规氨基酸的立体异构体(例如d-氨基酸)、非天然氨基酸(诸如[α]-氨基酸、[α]-双取代氨基酸、n-烷基氨基酸)和其他非常规氨基酸也可以是多肽的合适组分。非常规氨基酸的实例包括:4-羟脯氨酸、[γ]-羧基谷氨酸、[ε]-n,n,n-三甲基赖氨酸、[ε]-n-乙酰基赖氨酸、o-磷丝氨酸、n-乙酰基丝氨酸、n-甲酰基甲硫氨酸、3-甲基组氨酸、5-羟基赖氨酸、[σ]-n-甲基精氨酸和其他类似氨基酸和亚氨基酸(例如4-羟基脯氨酸)。在本文中使用的多肽记号中,根据标准用法和惯例,左手方向为氨基端方向且右手方向为羧基端方向。术语“分离的蛋白”是指由蛋白或多肽或其他将妨碍其治疗性、诊断性、预防性、研究或其他用途的污染物纯化的蛋白,诸如抗原结合蛋白(其实例可以是抗体)。如本文中所用,“实质上纯”意指所述的分子种类为存在的主要种类,即以摩尔计,其丰度大于相同混合物中的任何其他个别种类。在某些实施方案中,实质上纯分子为组合物,其中目标种类包含所有存在的大分子种类的至少50%(以摩尔计)。在其他实施方案中,实质上纯组合物将包含组合物中所有存在的大分子种类的至少80%、85%、90%、95%或99%。在某些实施方案中,基本上均匀物质已纯化至通过常规检测方法在组合物中无法检测到污染种类的水平且因此组合物是由单一可检测大分子种类组成。多肽(例如抗原结合蛋白,诸如抗体)的“变体”包含氨基酸序列,其中相对于另一多肽序列其氨基酸序列中插入、缺失和/或取代一个或多个氨基酸残基。变体包括融合蛋白。多肽的“衍生物”为经与插入、缺失或取代变体不同的某一方式化学修饰(例如经缀合于另一化学部分)的多肽。本说明书中结合生物材料(诸如多肽、核酸、宿主细胞等)使用的术语“天然存在的”或“天然的”是指在自然界中发现的物质。在此上下文中,“重组蛋白”为使用重组技术(即经本文所述的重组核酸的表达)制备的蛋白。制备重组蛋白的方法和技术在本领域中众所周知。术语“抗体”是指任何同种型的完整免疫球蛋白或其可与完整抗体针对与目标抗原的特异性结合进行竞争的片段,且包括例如嵌合抗体、人源化抗体、完全人抗体和双特异性抗体。因此抗体为一种抗原结合蛋白。除非另有说明,否则术语“抗体”除包含两个全长重链和两个全长轻链的抗体外,还包括其衍生物、变体、片段和突变蛋白,其实例描述于下文中。完整抗体通常将包含至少两个全长重链和两个全长轻链,但在一些情况下,其可包括较少的链,诸如天然存在于骆驼中的抗体,其可仅包含重链。抗体可仅由单一来源获得,或可以是“嵌合型”,即抗体的不同部分可来源于两种不同的如下文进一步描述的抗体。可在杂交瘤中、通过重组dna技术或由完整抗体的酶促或化学裂解制备抗原结合蛋白、抗体或结合片段。如本文中所用,抗体或免疫球蛋白链(重链或轻链)的术语“功能性片段”(或简称为“片段”)为抗原结合蛋白,其包含缺少全长链中存在的至少一些氨基酸但仍能够特异性结合于抗原的抗体的一部分(无论该部分如何获得或合成)。所述片段由于其特异性结合于目标抗原且可与其他抗原结合蛋白(包括完整抗体)针对与给定表位的特异性结合进行竞争而是生物学上有活性的。在一个方面,该片段将保留至少一个存在于全长轻链或重链中的cdr,且在一些实施方案中将包含单一重链和/或轻链或其部分。这些生物学活性片段可由重组dna技术制备,或可由抗原结合蛋白(包括完整抗体)的酶促或化学裂解制备。片段包括但不限于免疫功能性片段,诸如fab、fab'、f(ab')2、fv、结构域抗体和单链抗体,且可来源于任何哺乳动物来源,包括但不限于人、小鼠、大鼠、骆驼(camelid)或兔。此外涵盖本文中公开的抗原结合蛋白的功能性部分(例如一个或多个cdr)可共价结合于第二蛋白或小分子以产生针对体内特定目标、具有双功能治疗性质或具有延长的血清半衰期的治疗剂。当在抗原结合蛋白(例如中和抗原结合蛋白或中和抗体)情形中使用时,术语“竞争”意指如由测定法测定的抗原结合蛋白之间的竞争,其中所测试的抗原结合蛋白(例如抗体或其免疫功能性片段)阻止或抑制参考抗原结合蛋白(例如配体或参考抗体)与共同抗原(例如cd30l蛋白或其片段)的特异性结合。可使用多种类型的竞争性结合测定法,例如:固相直接或间接放射免疫测定法(ria)、固相直接或间接酶免疫测定法(eia)、夹心竞争测定法(参见例如stahli等人,1983,methodsinenzymology92:242-253);固相直接生物素-抗生物素蛋白eia(参见例如kirkland等人,1986,j.immunol.137:3614-3619)固相直接标记测定法、固相直接标记夹心测定法(参见例如,harlow和lane,1988,antibodies,alaboratorymanual,coldspringharborpress);使用i-125标记的固相直接标记ria(参见例如morel等人,1988,molec.immunol.25:7-15);固相直接生物素-抗生物素蛋白eia(参见例如cheung,等人,1990,virology176:546-552);和直接标记ria(moldenhauer等人,1990,scand.j.immunol.32:77-82)。通常,所述测定法涉及使用结合于固体表面或细胞的纯化抗原,该固体表面或细胞具有未经标记的测试抗原结合蛋白和经标记的参考抗原结合蛋白这些的任一种。如本领域技术人员已知,可使用不同方法。替代性选项包括使参考抗原结合蛋白结合于板,任选地经由柔性基质。其他变化可基于添加顺序,即抗原是否首先与板结合的参考抗原结合蛋白或测试抗原结合蛋白混合。在所有情况下均需要实现抗原结合蛋白的抗原饱和以避免错误的非竞争性结果。通过在测试抗原结合蛋白存在的情况下测定结合于固体表面或细胞的标记量来测量竞争性抑制。通常,测试抗原结合蛋白过量存在。由竞争测定法鉴定的抗原结合蛋白(竞争抗原结合蛋白)包括与参考抗原结合蛋白结合于相同表位的抗原结合蛋白,和与由参考抗原结合蛋白所结合的表位足够近的相邻表位结合从而发生位阻的抗原结合蛋白。通常,当竞争抗原结合蛋白过量存在时,其将抑制参考抗原结合蛋白与共同抗原的特异性结合达至少40%、45%、50%、55%、60%、65%、70%或75%。在一些情况下,抑制结合作用达至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或以上。竞争实验可以用可具有不同灵敏度的不同类型的分子进行。如果抗原结合蛋白是抗体,则分子将是二价的。如果抗原结合蛋白是fab,则其是单价的且实质上小于全长抗体,这导致更小的空间位阻。在竞争实验中,可以这样。对于某些抗原结合蛋白,与hcd30l的结合受如本文定义的抗体抗原结合蛋白的fab(诸如任一抗体a、b、c、d、e和f)的结合抑制。术语“表位”或“抗原决定簇”是指抗原上由抗原结合蛋白结合的位点。表位可以从连续氨基酸或由蛋白的三级折叠而并置的非连续氨基酸形成。由连续氨基酸形成的表位通常可在暴露于变性溶剂后保留,而由三级折叠形成的表位通常在用变性溶剂处理时丧失。抗原决定簇可包括分子的化学活性表面基团(诸如氨基酸、糖侧链、磷酰基或磺酰基)且可具有特定三维结构特征和/或特定电荷特征。表位通常包括至少3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35个呈独特空间构型的氨基酸。可使用本领域中已知的方法测定表位。抗原结合蛋白的结合也可由与抗原结合蛋白相互作用的抗原的一个或多个区域描述。所述相互作用区域可由本领域中已知的各种方法测定,诸如通过使用变体抗原分子进行结合测定法或通过如本文中示例性的hx-ms(参见实施例6),从而测定抗原与抗原结合蛋白的相互作用区域。hx-ms技术使得可易于在蛋白的氢交换(hx)后进行质谱测定法(ms)。通过用含有氘的含水溶剂置换含有氢的含水溶剂,在蛋白中的给定位点并入氘原子将引起质量增加1da。可在交换反应的猝灭样品中通过质谱测定法作为时间函数监测该质量增加。可通过猝灭条件下的胃蛋白酶消化和根据所得肽的质量增加将氘标记信息亚定位(sub-localized)至蛋白中的区域。可使用hx-ms通过鉴定蛋白-蛋白复合物形成后氢交换降低的区域来探测与分子间相互作用(包括抗体-抗原相互作用)有关的位点。通常,将通过标记的氢交换降低(由溶剂的空间排阻引起)来显示结合界面。可通过hx-ms简单地通过在存在和不存在各个结合伴侣情况下测量并入任一蛋白成员中的氘的总量作为时间的函数来检测蛋白-蛋白复合物形成。hx-ms技术使用天然组分(即蛋白和抗体或fab片段)且在溶液中进行。因此,hx-ms提供模拟体内条件的可能性(关于hx-ms技术的评述,参见例如wales和engen,massspectrom.rev.25,158(2006))。本文所述的某些抗原结合蛋白经由人cd30l的c末端区域(由aa201-234界定)与cd30l相互作用或结合。可以是抗原结合蛋白与人cd30l的由aa201-234界定的c末端区域或诸如aa205-230或aa211-226的较小区域结合。如上所述,表位可以是非连续且因此相互作用区域可以是非连续。在一个实施方案中,本发明的抗原结合蛋白结合于cd30l的至少两个区域。本发明的此类其他抗原结合蛋白可与如上文所界定的c末端区域和人cd30l中位于胞外结构域的n末端部分的另一区域(诸如由全长hcd30l的aa70-100界定的区域)相互作用。除由aa201-234、aa205-230或aa211-226界定的c末端区域外,此类抗原结合蛋白也可结合于aa75-95或较短区域,诸如aa80-90或aa82-88。cd30l抗原结合蛋白如本文中所用,“抗原结合蛋白”意指特异性结合指定目标抗原的蛋白;本文中提供的抗原为cd30l,尤其人cd30l。抗原结合蛋白包括例如阻断或抑制cd30l与cd30的相互作用的抗原结合蛋白。所述“阻断”抗原结合蛋白可以针对cd30l或其片段、变体或衍生物开发且在常规测定法中筛选其阻碍cd30l与cd30的相互作用的能力。合适测定法的实例为本文所述的测试抗原结合蛋白抑制cd30l与cd30的相互作用的能力的测定法。抗原结合蛋白还包括抑制cd30l或活化cd30l的抗原结合蛋白。与不存在抗原结合蛋白的情况下的生物反应相比,所述抑制或中和作用在抗原结合蛋白存在的情况下破坏反应且可使用本领域中已知和本文所述的测定法测定。本文中提供的抗原结合蛋白例如诱导cd30+细胞产生il-8。本文中公开的抗原结合蛋白还不与其他tnf超家族成员(尤其4-1bbl、ox-40l、tnfα、tnfβ、rankl、trail、cd40l或cd27l)结合。不同cd30l抗原结合蛋白可结合于cd30l的不同结构域或表位或通过不同作用机制起作用。cd30l抗原结合蛋白不必完全抑制cd30l诱导的活性以发现本文所述的用途;相反,还涵盖降低cd30l的特定活性的抗原结合蛋白来使用。抗原结合蛋白还包括以下抗原结合蛋白:其与本文所述的任一种参考抗原结合蛋白针对与人cd30l的结合进行交叉竞争;结合于人cd30l的与本文所述的任一种参考抗原结合蛋白相同的表位;以与本文所述的任一种参考抗原结合蛋白实质上相同的kd结合于人cd30l;以与本文所述的任一种参考抗原结合蛋白实质上相同的解离速率结合于cd30l。各种测量所述特征的方法在本领域中已知且描述于本文中。还提供消耗cd30l+细胞的cd30l抗原结合蛋白。通过所述消耗cd30l抗原结合蛋白,抗原结合蛋白与包含其抗原目标的细胞的结合引起抑制抗原或细胞功能或引起细胞死亡。在一个实施方案中,本发明的消耗抗体与cd30l结合且可能阻断或可能不阻断cd30l配体与cd30的结合。因此,消耗抗原结合蛋白具体包括阻断和非阻断抗原结合蛋白。在一个方面,消耗cd30l+细胞的cd30l抗原结合蛋白可诱导细胞凋亡或编程性细胞死亡,如由本领域中已知的细胞凋亡测定法测定。所述cd30l抗原结合蛋白可通过以下机制而具有免疫调节作用:1)消除与cd30l+细胞相互作用以诱导免疫反应的细胞和/或2)消除其中cd30l为一种细胞类型的细胞表面标记的细胞,该细胞类型参与特定免疫反应,但其可能无需与cd30l+细胞相互作用来做到这一点。在此情况下,cd30l将为与特定疾病有关的细胞类型的标记且cd30/cd30l相互作用可能不参与疾病本身的发病。另一个实施方案包括包含缀合毒素或细胞毒性剂的消耗抗原结合蛋白,其中所述毒素或细胞毒性剂诱导结合抗原结合蛋白缀合物的细胞的消耗。抗原结合蛋白可包含结合于抗原的部分和任选地使抗原结合部分采用促进抗原结合蛋白与抗原的结合的构型的支架或构架部分。抗原结合蛋白的实例包括抗体、抗体片段(例如抗体的抗原结合部分)、抗体衍生物和抗体类似物。抗原结合蛋白可包含替代性蛋白支架或人工支架,该替代性蛋白支架或人工支架具有移植的cdr或cdr衍生物。所述支架包括但不限于包含突变的抗体衍生型支架,所述突变经引入以例如使抗原结合蛋白以及包含例如生物相容聚合物的全合成支架的三维结构稳定。参见例如,korndorfer等人,proteins:structure,function,andbioinformatics,(2003)volume53,issue1:121-129;roque等人,biotechnol.prog.,2004,20:639-654。此外,可使用肽抗体模拟物(“pam”),以及基于抗体模拟物的支架(其利用纤维连接蛋白组分作为支架)。本文所述的某些抗原结合蛋白为抗体或来源于抗体。所述抗原结合蛋白包括但不限于分别为单克隆抗体、双特异性抗体、微型抗体、结构域抗体、合成抗体、抗体模拟物、嵌合抗体、人源化抗体、人抗体、抗体融合体、抗体缀合物、单链抗体和其片段。在一些情况下,抗原结合蛋白为抗体的免疫片段(例如fab、fab’、f(ab’)2或scfv)。各种结构进一步描述和定义于本文中。某些所提供的抗原结合蛋白可包含一个或多个如本文所述的cdr(例如1、2、3、4、5、6个或更多cdr)。在一些情况下,抗原结合蛋白包含(a)多肽结构和(b)一个或多个cdr,所述一个或多个cdr插入多肽结构中和/或与多肽结构接合。多肽结构可采用多种不同形式。例如,其可以是或包含天然存在的抗体的构架或其片段或变体,或可本质上为完全合成的。各种多肽结构的实例进一步描述于下文中。某些如本文中提供的抗原结合蛋白特异性结合于人cd30l。如本文中所用的“特异性结合”意指平衡解离常数(kd)为<10-8m至<10-10m,或<10-9m至<10-10m,更具体而言为<10-11m至<10-12m。在一个实施方案中,抗原结合蛋白以高亲和力结合,该高亲和力由平衡解离常数(kd)表示为10-8,或诸如5.0x10-9或诸如10-9或甚至5.0x10-10。可如本领域中已知的方式测定平衡解离常数。在所述实施方案中,通常通过以低密度固定物质(此物质可以是多价)且注射滴定系列的单价物质(结合相),且然后考虑解离相(其中复合物分开)来测定kd。与单价复合物的结合和解离对应的速率常数分别称为结合速率常数ka和解离速率常数kd。然后将所得数据拟合至1:1结合模型,该模型拟合3个参数:结合速率常数ka、解离速率常数kd和rmax(其涉及表面密度和化学计量)。kd/ka的比率等于平衡解离常数kd。还可如本文中的实施例4中所述使用facs分析测定kd,其中抗体与表达于ramos细胞上的cd30l结合。一个实施方案涉及如本文所述的分离的抗原结合蛋白,其中所述抗原结合蛋白对人cd30l的亲和力(或kd)为至少75pm,诸如50pm,诸如40pm。在其他实施方案中,抗原结合蛋白对人cd30l的解离常数(kd)为至多35pm,诸如至多25pm,诸如20pm,诸如至多15pm。在所述实施方案中,可如本文中的实施例4中所述通过facs测定亲和力(或kd)。另一个方面提供体外或体内(例如当向人主体施用时)半衰期为至少1天的抗原结合蛋白。在一个实施方案中,抗原结合蛋白的半衰期为至少3天。在另一个实施方案中,抗体或其部分的半衰期为4天或更长。在另一个实施方案中,抗体或其部分的半衰期为8天或更长。在另一个实施方案中,抗体或其抗原结合部分经衍生或修饰使得其半衰期长于未衍生或未修饰的抗体。在另一个实施方案中,抗原结合蛋白含有点突变以延长血清半衰期,诸如wipo公开号wo00/09560中所述。在将抗原结合蛋白用于治疗性应用的实施方案中,抗原结合蛋白可降低、抑制、阻碍或调节cd30l的一种或多种生物学活性,诸如诱导cd30+细胞产生il-8。一些所提供的抗原结合蛋白具有通常与天然存在的抗体相关的结构。这些抗体的结构单元通常包含一个或多个四聚体,各四聚体由两个相同的多肽链的偶联体(couplet)组成,但一些哺乳动物物种也产生仅具有单一重链的抗体。在典型抗体中,各对或偶联体包括一个全长“轻”链(在某些实施方案中,约25kda)和一个全长“重”链(在某些实施方案中,约50-70kda)。每一个别免疫球蛋白链由几个“免疫球蛋白结构域”构成,各免疫球蛋白结构域由约90至110个氨基酸组成且表达特征折叠模式。这些结构域为构成抗体多肽的基本单元。各链的氨基端部分通常包括负责抗原识别的可变区。羧基端部分与另一链端相比在进化方面更保守且称为“恒定区”或“c区”。人轻链通常分为κ轻链和λ轻链,且这些轻链中的每一种含有一个可变区和一个恒定结构域。重链通常分类为μ、δ、γ、α、或ε链,且这些将抗体的同种型分别定义为igm、igd、igg、iga和ige。igg具有几种亚型,包括但不限于iggl、igg2、igg3和igg4。igm亚型包括igm和igm2。iga亚型包括igal和iga2。在人中,iga和igd同种型含有4个重链和4个轻链;igg和ige同种型含有2个重链和2个轻链;且igm同种型含有5个重链和5个轻链。重链恒定区(ch)通常包含一个或多个可负责效应物功能的结构域。重链恒定区结构域的数目将取决于同种型。igg重链,例如各自含有3个ch区结构域,称为chi、ch2和ch3。所提供的抗原结合蛋白可具有任何这些同种型和亚型,例如cd30l抗原结合蛋白具有iggl、igg2或igg4亚型。如果需要igg4,则也可能需要在铰链区中引入点突变(cpscp->cppcp)(如bloom等人,1997,proteinscience6:407中所述)以缓和形成h链内二硫键(其可引起igg4抗体中的异质性)的倾向。可使用子类转换法将本文中提供的为一种类型的抗体转变为不同类型。参见例如lantto等人,2002,methodsmol.biol.178:303-316。在全长轻链和重链中,可变区和恒定区由约12个或更多氨基酸的“j”区相连,其中重链还包括约10个以上氨基酸的“d”区。参见例如fundamentalimmunology,2nded.,ch.7(paul,w.,编辑)1989,newyork:ravenpress。各轻链/重链对的可变区通常形成抗原结合位点。可变区本文中提供的各种重链和轻链可变区(或结构域)描述于表1和2中。这些可变区中的每一种均可连接至例如上述重链和轻链恒定区。此外,如此产生的重链和轻链序列中的每一种均可组合以形成完整抗原结合蛋白结构。表1示例性变体轻链区序列互补决定区(cdr)为粗斜体,构架区(fr)为普通字体。元件顺序为:fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。表2示例性变体重链区序列互补决定区(cdr)为粗斜体,构架区(fr)为普通字体。元件顺序为:fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。提供抗原结合蛋白,其含有至少一个选自如表1和2中所示的vh1、vh2、vh3、vh4、vh5、vh6、vh7、vh8、vh9、vh10、vh11、vh12和vh13的重链可变区(vh)和/或至少一个选自如表1和2中所示的vl1、vl2、vl3、vl4、vl5、vl6的轻链可变区(vl)。表2中列举的各重链可变区均可与表1中显示的任一轻链可变区组合以形成抗原结合蛋白。在一些情况下,抗原结合蛋白包括来自表1和2中所列举那些的至少一个重链可变区和/或一个轻链可变区。在一些情况下,抗原结合蛋白包括至少两个不同的来自表1和2中所列举那些的重链可变区和/或轻链可变区。重链可变区的不同组合可与轻链可变区的不同组合中的任一种组合。在其他情况下,抗原结合蛋白含有两个相同轻链可变区和/或两个相同重链可变区。例如,抗原结合蛋白可以是抗体或免疫功能性片段,其包含表1和2中列举的轻链可变区对和重链可变区对的组合中的两个轻链可变区和两个重链可变区。所述包含两个相同重链和轻链可变区的抗原结合蛋白的实例包括:抗体avh2/vl1;抗体a1vh1/vl1;抗体a2vh3/vl1;抗体a3vh4/vl1;抗体a4vh5/vl1;抗体a5vh6/vl1;抗体a6vh7/vl1;抗体a7vh8/vl1;抗体bvh9/vl2;抗体cvh10/vl3;抗体dvh11/vl4;抗体evh12/vl5和抗体fvh13/vl6。一些所提供的抗原结合蛋白包含重链可变区和/或轻链可变区,所述重链可变区和/或轻链可变区包含在仅1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、31个或更多个氨基酸残基处与选自表1和2的重链可变区和/或轻链可变区的序列不同的氨基酸序列,其中各所述序列差异独立地为一个氨基酸缺失、插入或取代。在一些抗原结合蛋白中,轻链和重链可变区包含与表1和2中提供的氨基酸序列具有至少70%、75%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的氨基酸序列。仍其他抗原结合蛋白(例如抗体或免疫功能片段)还包括如本文所述的变体重链区形式和/或变体轻链区形式。术语“同一性”是指两个或多个多肽分子或两个或多个多核苷酸的序列之间的关系,如通过比对和比较所述序列而测定。“同一性百分比”意指所比较的分子中的氨基酸或核苷酸之间的相同残基的百分比且基于所比较的最小分子的大小计算。对于这些计算,必须通过特定数学模型或计算机程序(即“算法”)解决比对中的空位(如果存在)。可用于计算比对的核酸或多肽的同一性的方法包括以下文献中描述的方法:computationalmolecularbiology,(lesk,a.m.,编辑),1988,newyork:oxforduniversitypress;biocomputinginformaticsandgenomeprojects,(smith,d.w.,编辑),1993,newyork:academicpress;computeranalysisofsequencedata,parti,(griffin,a.m.,和griffin,h.g.,编辑),1994,newjersey:humanapress;vonheinje,g.,1987,sequenceanalysisinmolecularbiology,newyork:academicpress;sequenceanalysisprimer,(gribskov,m.anddevereux,j.,编辑),1991,newyork:m.stocktonpress;和carillo等人,1988,siamj.appliedmath.48:1073。在计算同一性百分比时,以使得序列之间的匹配最大化的方式将所比较的序列比对。用于测定同一性百分比的计算机程序为gcg程序包,其包括gap(devereux等人,1984,nucl.acidres.12:387;geneticscomputergroup,universityofwisconsin,madison,wi)。用计算机算法gap将待测定序列同一性百分比的两个多肽或多核苷酸比对。比对序列以实现其各自氨基酸或核苷酸的最佳匹配(“匹配跨度”,如由算法测定)。空位开放罚分(其计算为3x平均对角线,其中“平均对角线”为所用比较矩阵的对角线的平均值;“对角线”为由特定比较矩阵指定至各完全氨基酸匹配的得分或编号)和空位延伸罚分(其通常为空位开放罚分的1/10倍)以及比较矩阵(诸如pam250或blosum62)与算法结合使用。在某些实施方案中,算法还使用标准比较矩阵(参见dayhoff等人,1978,atlasofproteinsequenceandstructure5:345-352(pam250比较矩阵);henikoff等人,1992,proc.natl.acad.sci.u.s.a.89:10915-10919(blosum62比较矩阵))。推荐用于使用gap程序测定多肽或核苷酸序列的同一性百分比的参数如下:算法:needleman等人,1970,j.mol.biol.48:443-453;比较矩阵:blosum62,henikoff等人,1992,见上文;空位罚分:12(但末端空位不罚分),空位长度罚分:4,相似性阈值:0。某些用于比对两个氨基酸序列的比对方案可能仅引起两个序列中的较短区域匹配且此较小比对区域可具有非常高序列同一性,即使在两个全长序列之间不存在显著关系。因此,可根据需要调节所选比对方法(gap程序)以使比对跨越目标多肽的至少50个连续氨基酸。互补决定区互补决定区或“cdr”嵌入重链和轻链可变区中的构架内,其中它们构成负责抗原结合和识别的区域。相同物种的免疫球蛋白链的可变结构域例如通常呈现类似整体结构;包含由高变cdr区接合的相对保守构架区(fr)。抗原结合蛋白可具有1、2、3、4、5、6个或更多cdr。以上论述的可变区例如通常包含3个cdr。来自重链可变区和轻链可变区的cdr通常由构架区排列以形成特异性结合于目标抗原(例如cd30l)的结构。从n末端至c末端,天然存在的轻链和重链可变区通常符合这些元件的以下顺序:fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。示例性轻链可变结构域和重链可变结构域的cdr和fr区域于表1和2中突出表示。认识到cdr和fr区域的边界可以从突出表示的那些改变。已设计编号系统以指定占据每一这些结构域中的位置的氨基酸的编号。可使用这些系统标识给定抗原结合蛋白的互补决定区和构架区。编号系统定义于kabat等人,sequencesofproteinsofimmunologicalinterest,5thed.,usdept.ofhealthandhumanservices,phs,nih,nih公开号91-3242,1991,或chothia&lesk,1987,j.mol.biol.196:901-917;chothia等人,1989,nature342:878-883中。其他用于免疫球蛋白链中的氨基酸的编号系统包括(国际免疫遗传学信息系统(theinternationalimmunogeneticsinformationsystem;lefranc等人,dev.comp.immunol.2005,29:185-203);和aho(honegger和pluckthun,j.mol.biol.2001,309(3):657-670)。本文中提供的cdr不仅可用于定义传统抗体结构的抗原结合结构域,且还可如本文所述嵌入多种其他多肽结构中。本文中公开的抗原结合蛋白为多肽,可将一个或多个cdr移植、插入、嵌入和/或接合至其中。抗原结合蛋白可具有例如1个重链cdr1(“cdrh1”)和/或1个重链cdr2(“cdrh2”)和/或1个重链cdr3(“cdrh3”)和/或1个轻链cdr1(“cdrl1”)和/或1个轻链cdr2(“cdrl2”)和/或1个轻链cdr3(“cdrl3”)。一些抗原结合蛋白包括cdrh3和cdrl3两者。特定实施方案通常利用非重复cdr的组合,例如通常不使用一个重链可变区中的两个cdrh2区域制备抗原结合蛋白等。抗原结合蛋白可包含一个或多个与表3中呈现的cdr中的一个或多个的氨基酸序列相同的或仅在1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16个或更多氨基酸残基处与表3中呈现的cdr中的一个或多个的氨基酸序列不同的氨基酸序列,其中各所述序列差异独立地为一个氨基酸缺失、插入或取代。一些抗原结合蛋白中的cdr包含与表3中列举的cdr序列具有至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的氨基酸序列。在一些抗原结合蛋白中,将cdr嵌入”构架”区中,其将cdr定向从而实现合适的cdr的抗原结合性质。表3示例性变体重链区序列seqidno:1tgtssdvgvydyvsseqidno:2tgtssdvglynyvsseqidno:3tgtssdiglydyvsseqidno:4tgtssdiglynyvsseqidno:5tgsssdigtynyvsseqidno:6tgtssdvglynyvsseqidno:7evsnrpsseoidno:8evnnrpsseqidno:9evinrpsseqidno:10evskrpsseqidno:11ssytsrstwvseqidno:12ssytssstwvseqidno:13ssysssstwvseqidno:14syiwsseqidno:15syywtseqidno:16syswsseqidno:17nnywsseqidno:18syywsseqidno:19riyasgntnynpslksseqidno:20riyasgqtnynpslksseqidno:21riytsgitnynpslksseqidno:22rtstsgrnnynpslksseqidno:23rvyssgltnykpslksseqidno:24rifasgstnynpslrsseqidno:25dyrvagtyyyyygldvseqidno:26ervvgasryyyygvdvseqidno:27dftiaarryyyygmdvseqidno:28eratvttryhydgmdvseqidno:29ervgvqdyyhysgmdv本文中提供cdr1区域,其包含seqidnos:36、38、40、42和44的氨基酸残基23-36;seqidno:46的氨基酸残基25-36和seqidnos:48、50、52、54、56、58、60、62、64、66、68、70和72的氨基酸残基31-35。提供cdr2区域,其包含seqidnos:36、38、40、42、44和46的氨基酸残基52-58和seqidnos:48、50、52、54、56、58、60、62、64、66、68、70和72的氨基酸残基50-65。cdr3区域,其包含seqidnos:36、38、40、42、44和46的氨基酸残基91-100和seqidnos:48、50、52、54、56、58、60、62、64、66、68、70和72的氨基酸残基98-113。本文中公开的cdr包括来源于相关序列组的共有序列。cdrl1共有序列由tgx1ssdx2gx3yx4yvs(seqidno:30)组成,其中x1为苏氨酸或丝氨酸,x2为缬氨酸或异亮氨酸,x3为缬氨酸、苏氨酸或亮氨酸且x4为天冬氨酸或天冬酰胺。cdrl2共有序列由evx1x2rps(seqidno:31)组成,其中x1为丝氨酸、天冬酰胺或异亮氨酸且x2为天冬酰胺或赖氨酸。cdrl3共有序列包括ssyx1sx2stwv(seqidnno:32),其中x1为苏氨酸或丝氨酸且x2为精氨酸或丝氨酸。cdrh1共有序列由x1x2x3wx4(seqidno:33)组成,其中x1为丝氨酸或天冬酰胺,x2为酪氨酸或天冬酰胺,x3为异亮氨酸、酪氨酸或丝氨酸且x4为苏氨酸或丝氨酸。在一个不同实施方案中,cdrh1共有序列由syx3wx5(seqidno:75)组成,其中x3为i、s或y且x5为t或s。cdrh2共有序列由rx1x2x3sgx4x5nyx6pslx7s(seqidno:34)组成,其中x1为异亮氨酸、缬氨酸或苏氨酸,x2为酪氨酸、苯丙氨酸或丝氨酸,x3为苏氨酸、丝氨酸或丙氨酸,x4为异亮氨酸、亮氨酸、天冬酰胺、丝氨酸、精氨酸或谷氨酰胺,x5为苏氨酸或天冬酰胺,x6为天冬酰胺或赖氨酸且x7为赖氨酸或精氨酸。cdrh3共有序列由x1x2x3x4x5x6x7x8yx9yx10gx11dv(seqidno:35)组成,其中x1为谷氨酸或天冬氨酸,x2为精氨酸、酪氨酸或苯丙氨酸,x3为缬氨酸、丙氨酸、精氨酸或苏氨酸,x4为缬氨酸、苏氨酸、甘氨酸或异亮氨酸,x5为缬氨酸、丙氨酸或甘氨酸,x6为丙氨酸、苏氨酸、甘氨酸或谷氨酰胺,x7为苏氨酸、天冬氨酸、精氨酸或丝氨酸,x8为精氨酸或酪氨酸,x9为酪氨酸或组氨酸,x10为酪氨酸、天冬氨酸或丝氨酸且x11为甲硫氨酸、亮氨酸或缬氨酸。单克隆抗体所提供的抗原结合蛋白包括结合于cd30l的单克隆抗体。可使用本领域中已知的任何技术制备单克隆抗体,例如通过在完成免疫程序后使从转基因动物获得的脾细胞永生化。可使用本领域中已知的任何技术使脾细胞永生化,例如通过使其与骨髓瘤细胞融合以制备杂交瘤。制备杂交瘤的融合程序中所用的骨髓瘤细胞优选为非抗体产生、具有高融合效率和酶缺乏(使其无法在仅支持所需融合细胞(杂交瘤)生长的某些选择性培养基中生长)。用于小鼠融合的合适细胞系的实例包括sp-20、p3-x63/ag8、p3-x63-ag8.653、ns1/1.ag41、sp210-ag14、fo、nso/u、mpc-11、mpc11-x45-gtg1.7和s194/5xxobul;用于大鼠融合的细胞系的实例包括r210.rcy3、y3-ag1.2.3、ir983f和4b210。其他用于细胞融合的细胞系为u-266、gm1500-grg2、licr-lon-hmy2和uc729-6。在一些情况下,通过以下方法制备杂交瘤细胞系:用cd30l免疫原免疫动物(例如具有人免疫球蛋白序列的转基因动物);从免疫的动物获得脾细胞;使所获得的脾细胞与骨髓瘤细胞系融合,从而产生杂交瘤细胞;从杂交瘤细胞制备杂交瘤细胞系,和鉴定产生与cd30l多肽结合的抗体的杂交瘤细胞系。所述杂交瘤细胞系和由其产生的抗cd30l单克隆抗体为本申请的方面。可使用本领域中已知的任何技术纯化由杂交瘤细胞系分泌的单克隆抗体。可进一步筛选杂交瘤或mab以鉴定具有特定性质(诸如降低、抑制、阻碍或调节cd30l与cd30的相互作用的能力)的mab。嵌合和人源化抗体还提供基于前述序列的嵌合和人源化抗体。用作治疗剂的单克隆抗体可在使用前以多种方式修饰。一个实例为嵌合抗体,其为由来自不同抗体的蛋白区段构成的抗体,所述蛋白区段共价接合以产生功能性免疫球蛋白轻链或重链或其免疫功能部分。通常,重链和/或轻链的一部分与来源于特定物种或属于特定抗体类别或子类的抗体中的相应序列相同或同源,而所述链的其余部分与来源于另一物种或属于另一抗体类别或子类的抗体中的相应序列相同或同源。关于与嵌合抗体有关的方法,参见例如美国专利号4,816,567;和morrison等人,1985,proc.natl.acad.sci.usa81:6851-6855。cdr移植描述于例如美国专利号6,180,370、5,693,762、5,693,761、5,585,089、和5,530,101中。一种有用的嵌合抗体类型为“人源化”抗体。通常,人源化抗体从最初于非人动物中产生的单克隆抗体制备。此单克隆抗体中的某些氨基酸残基(通常来自该抗体的非抗原识别部分)经修饰以与相应同种型的人抗体中的相应残基同源。可例如使用多种方法通过用啮齿动物可变区的至少一部分取代人抗体的相应区域来进行人源化(参见例如,美国专利号5,585,089和5,693,762;jones等人,1986,nature321:522-525;riechmann等人,1988,nature332:323-27;verhoeyen等人,1988,science239:1534-1536)。在某些实施方案中,来自除人以外的物种的恒定区可与人可变区一起使用以制备杂合抗体。完全人抗体还提供完全人抗体。可利用无需使人暴露于给定抗原即可产生对抗原特异性的完全人抗体的方法(“完全人抗体”)。一种所提供的用于实现制备完全人抗体的特定手段为小鼠体液免疫系统的“人源化”。将人免疫球蛋白(ig)基因座引入内源ig基因已失活的小鼠中是一种在小鼠(可使用任何所需抗原免疫的动物)中制备完全人单克隆抗体(mab)的方法。使用完全人抗体可最小化免疫原性和过敏性反应,所述免疫原性和过敏性反应有时可由向人施用小鼠mab或小鼠来源mab作为治疗剂引起。可通过使能够在内源免疫球蛋白产生不存在的情况下产生人抗体的所有组成成分的转基因动物(通常为小鼠)免疫来制备完全人抗体。用于此目的的抗原通常具有6个或更多连续氨基酸,且任选地与载体(诸如半抗原)缀合。参见例如,jakobovits等人,1993,proc.natl.acad.sci.usa90:2551-2555;jakobovits等人,1993,nature362:255-258;和bruggermann等人,1993,yearinimmunol.7:33。在所述方法的一个实例中,通过使其中编码小鼠重链和轻链免疫球蛋白链的内源小鼠免疫球蛋白基因座无能力,且将含有编码人重链和轻链蛋白的基因座的人基因组dna的大片段插入小鼠基因组中来产生转基因动物。然后使部分修饰的动物(其具有少于人免疫球蛋白基因座的全部互补序列)杂交以获得具有所有所需免疫系统修饰的动物。当施用免疫原时,这些转基因动物产生对免疫原具有免疫特异性但具有人而非鼠氨基酸序列(包括可变区)的抗体。关于所述方法的其他细节参见例如wipo专利公开wo96/33735和wo94/02602。其他关于转基因小鼠的用于制备人抗体的方法描述于美国专利号5,545,807;6,713,610;6,673,986;6,162,963;5,545,807;6,300,129;6,255,458;5,877,397;5,874,299和5,545,806;wipo专利公开w091/10741、w090/04036以及ep546073b1和ep546073a1中。上述转基因小鼠含有人免疫球蛋白基因微型基因座(minilocus),其编码未经重排的人重链([μ]和[γ])和[κ]轻链免疫球蛋白序列,以及使内源[μ]和[κ]链基因座失活的靶向突变(lonberg等人,1994,nature368:856-859)。因此,小鼠呈现小鼠igm或[κ]表达降低且对免疫起反应,且所引入的人重链和轻链转基因经历类别转换和体细胞突变以产生高亲和力人igg[κ]单克隆抗体(lonberg等人,见上文;lonberg和huszar,1995,intern.rev.immunol.13:65-93;harding和lonberg,1995,ann.n.yacad.sci.764:536-546)。所述小鼠的制备方法详细描述于taylor等人,1992,nucleicacidsresearch20:6287-6295;chen等人,1993,internationalimmunology5:647-656;tuaillon等人,1994,j.immunol.152:2912-2920;lonberg等人,1994,nature368:856-859;lonberg,1994,handbookofexp.pharmacology113:49-101;taylor等人,1994,internationalimmunology6:579-591;lonberg和huszar,1995,intern.rev.immunol.13:65-93;harding和lonberg,1995,ann.n.yacad.sci.764:536-546;fishwild等人,1996,naturebiotechnology14:845-85中。亦参见美国专利号5,545,806;5,569,825;5,625,126;5,633,425;5,789,650;5,877,397;5,661,016;5,814,318;5,874,299;和5,770,429;以及美国专利号5,545,807;wipo公开号wo93/1227;wo92/22646;和wo92/03918。用于在这些转基因小鼠中产生人抗体的技术还公开于wipo公开号w098/24893和mendez等人1997,naturegenetics15:146-156中。例如,hco7和hcol2转基因小鼠品系可用于产生抗cd30l抗体。使用杂交瘤技术,可从转基因小鼠(诸如上述转基因小鼠)产生和选择具有所需特异性的抗原特异性人mab。所述抗体可使用合适载体和宿主细胞克隆和表达,或可从培养的杂交瘤细胞收集抗体。完全人抗体也可来源于噬菌体展示文库(诸如hoogenboom等人,1991,j.mol.biol.227:381;marks等人,1991,j.mol.biol.222:581;wipo公开号wo99/10494中所公开)。噬菌体展示技术经由在丝状噬菌体表面上展示抗体所有组成成分且随后通过抗体所有组成成分与所选抗原的结合选择噬菌体来模拟免疫选择。双特异性或双功能性抗原结合蛋白“双特异性”、“双重特异性”或“双功能性”抗原结合蛋白或抗体分别为杂合抗原结合蛋白或抗体,其具有两个不同抗原结合位点,诸如如上所述的一个或多个cdr或一个或多个可变区。在一些情况下,其为具有两个不同重链/轻链对和两个不同结合位点的人工杂合抗体。多特异性抗原结合蛋白或“多特异性抗体”为靶向一个以上抗原或表位的抗原结合蛋白或抗体。双特异性抗原结合蛋白和抗体为多特异性抗原结合蛋白抗体中的一种且可由多种方法制备,包括但不限于杂交瘤的融合或fab'片段的连接。参见例如songsivilai和lachmann,1990,clin.exp.immunol.79:315-321;kostelny等人,1992,j.immunol.148:1547-1553。免疫片段抗原结合蛋白还包括抗体的免疫片段(例如fab、fab、f(ab’)2、或scfv)。“fab片段”包含一个轻链(轻链可变区(vl)和其相应恒定结构域(cl))和一个重链(重链可变区(vh)和第一恒定结构域(ch1))。fab分子的重链无法与另一个重链分子形成二硫键。“fab'片段”含有一个轻链和一个重链的一部分,该重链的一部分还含有ch1和ch2结构域之间的区域,使得可在两个fab'片段的两个重链之间形成链间二硫键以形成f(ab')2分子。因此“f(ab')2片段”是由两个fab'片段构成,该两个fab'片段由两个重链之间的二硫键结合在一起。“fv片段”由抗体的单臂的可变轻链区和可变重链区组成。单链抗体“scfv”为fv分子,其中重链和轻链可变区由柔性接头连接以形成单一多肽链,该单一多肽链形成抗原结合区。单链抗体详细论述于wipo公开号wo88/01649、美国专利号4,946,778和5,260,203;bird,1988,science242:423;huston等人,1988,proc.natl.acad.sci.u.s.a.85:5879;ward等人,1989,nature334:544,degraaf等人,2002,methodsmolbiol.178:379-387;kortt等人,1997,prot.eng.10:423;kortt等人,2001,biomol.eng.18:95-108和kriangkum等人,2001,biomol.eng.18:31-40中。“fc”区域含有两个重链片段,包含抗体的ch2和ch3结构域。该两个重链片段由两个或更多二硫键和由ch3结构域的疏水性相互作用结合在一起。还包括结构域抗体,其为仅含有重链可变区或轻链可变区的免疫功能性免疫球蛋白片段。在一些情况下,两个或两个以上vh区域通过肽接头共价接合以产生二价结构域抗体。二价结构域抗体的两个vh区域可靶向相同或不同抗原。双抗体为包含两个多肽链的二价抗体,其中各多肽链包含由接头接合的vh和vl结构域,该接头过短从而无法实现同一链上两个结构域之间的配对,因此使各结构域与另一多肽链上的互补结构域配对(参见例如holliger等人,proc.natl.acad.sci.usa90:6444-48,1993和poljak等人,structure2:1121-23,1994)。类似地,三抗体和四抗体分别为包含三个和四个多肽链且分别形成三个和四个抗原结合位点的抗体,所述抗原结合位点可相同或不同。最大抗体(maxibodies)包含共价连接至igg1的fc区域的二价scfv(参见例如,fredericks等人,2004,proteinengineering,design&selection,17:95-106;powers等人,2001,journalofimmunologicalmethods,251:123-135;shu等人,1993,proc.natl.acad.sci.usa90:7995-7999;hayden等人,1994,therapeuticimmunology1:3-15)。各种其他形式还提供以上公开的抗原结合蛋白的变体形式,一些抗原结合蛋白在一个或多个列举于表1和2中的重链或轻链、可变区或cdr中具有例如一个或多个保守氨基酸取代。天然存在的氨基酸可基于普通侧链性质分类:疏水性(正亮氨酸、met、ala、val、leu、ile);中性亲水性(cys、ser、thr、asn、gln);酸性(asp、glu);碱性(his、lys、arg);影响链方向的残基(gly、pro);和芳族(trp、tyr、phe)。保守氨基酸取代可涉及这些类别中的一种的成员与同一类别中的另一成员的交换。保守氨基酸取代可涵盖非天然存在的氨基酸残基,其通常通过化学肽合成而非生物系统中的合成并入。这些包括肽模拟物(peptidomimetics)和氨基酸部分的其他反向或反转形式。可通过其对维持(a)取代区域中分子主链的结构,例如折叠或螺旋构型,(b)目标位点处分子的电荷或疏水性或(c)侧链的体容度(bulkiness)的作用显著不同的重链和轻链的氨基酸序列中进行取代来实现本文所述的抗原结合蛋白的功能和/或生物化学特性的所述实质修饰。非保守性取代可涉及上述类别中的一种的成员与来自另一类别的成员的交换。可将所述经取代的残基引入与人抗体同源的抗体区域或分子的非同源区域中。在产生所述变化时,根据某些实施方案,可考虑氨基酸的亲水指数。通过将各氨基酸指定一个数值(“亲水指数”)且然后沿肽链重复计算这些值的平均值来计算蛋白的亲水概况。已基于各氨基酸的疏水性和电荷特性指定其亲水指数。其为:异亮氨酸(+4.5);缬氨酸(+4.2);亮氨酸(+3.8);苯丙氨酸(+2.8);半胱氨酸/胱氨酸(+2.5);甲硫氨酸(+1.9);丙氨酸(+1.8);甘氨酸(-0.4);苏氨酸(-0.7);丝氨酸(-0.8);色氨酸(-0.9);酪氨酸(-1.3);脯氨酸(-1.6);组氨酸(-3.2);谷氨酸(-3.5);谷氨酰胺(-3.5);天冬氨酸(-3.5);天冬酰胺(-3.5);赖氨酸(-3,9);和精氨酸(-4.5)。本领域中理解亲水概况对赋予蛋白相互作用生物功能的重要性(参见例如kyte等人,1982,j.mol.biol.157:105-131)。已知某些氨基酸可取代其他具有类似亲水指数或得分的氨基酸且仍保留类似生物活性。在某些实施方案中,当基于亲水指数进行变化时,包括亲水指数在±2范围内的氨基酸的取代。在一些方面,包括亲水指数在±1范围内的氨基酸的取代,且在其他方面,包括亲水指数在±0.5范围内的氨基酸的取代。本领域中还理解,可基于亲水性有效地进行类似氨基酸的取代,尤其当由此产生的生物学功能蛋白或肽意欲用于免疫学实施方案(如本发明的情况)时。在某些实施方案中,蛋白的最大局部平均亲水性(如取决于其邻近氨基酸的亲水性)与其免疫原性和抗原结合或免疫原性有关,即与蛋白的生物学性质有关。已指定这些氨基酸残基具有以下亲水性值:精氨酸(+3.0);赖氨酸(+3.0);天冬氨酸(+3.0±1);谷氨酸(+3.0±1);丝氨酸(+0.3);天冬酰胺(+0.2);谷氨酰胺(+0.2);甘氨酸(0);苏氨酸(-0.4);脯氨酸(-0.5±1);丙氨酸(-0.5);组氨酸(-0.5);半胱氨酸(-1.0);甲硫氨酸(-1.3);缬氨酸(-1.5);亮氨酸(-1.8);异亮氨酸(-1.8);酪氨酸(-2.3);苯丙氨酸(-2.5)和色氨酸(-3.4)。当基于类似亲水性值进行变化时,在某些实施方案中,包括亲水性值在±2范围内的氨基酸的取代,在其他实施方案中,包括亲水性值在±1范围内的氨基酸的取代且在仍其他实施方案中,包括亲水性值在±0.5范围内的氨基酸的取代。在一些情况下,还可基于亲水性鉴定来自一级氨基酸序列的表位。这些区域也称为“表位核心区域”。示例性保守氨基酸取代阐述于表4中。表4保守氨基酸取代残基=原始残基取代=示例性取代。技术人员将能够使用众所周知的技术确定如本文中阐述的多肽的合适变体。本领域技术人员可鉴定可由靶向据信对活性不重要的区域在不损害活性情况下改变的合适分子区域。技术人员还能够鉴定类似多肽间保守的残基和分子部分。在其他实施方案中,甚至可能对生物活性或结构重要的区域也可在不损害生物活性或对多肽结构无不利影响的情况下经历保守氨基酸取代。此外,本领域技术人员可回顾鉴定类似的对活性或结构重要的多肽中的残基的结构-功能研究。鉴于所述比较,可预测蛋白中氨基酸残基(对应于类似蛋白中对活性或结构重要的氨基酸残基)的重要性。本领域技术人员可选择化学上类似的氨基酸取代以用于所述预测重要的氨基酸残基。本领域技术人员还可分析与类似多肽中的该结构有关的三维结构和氨基酸序列。鉴于所述信息,本领域技术人员可关于抗体的三维结构预测其氨基酸残基的比对。本领域技术人员可选择对预计位于蛋白表面上的氨基酸残基不造成根本变化,因为所述残基可能参与重要的与其他分子的相互作用。此外,本领域技术人员可产生在各所需氨基酸残基处含有单一氨基酸取代的测试变体。然后可使用测定法筛选这些变体的cd30l活性(参见以下实施例部分),从而产生关于哪些氨基酸可变化且哪些氨基酸不可变化的信息。换言之,基于由所述常规实验收集到的信息,本领域技术人员可容易地确定应避免进行进一步取代(单独或与其他突变组合)的氨基酸位置。许多科技出版物已经致力于预测二级结构。参见,moult,1996,curr.op.inbiotech.7:422-427;chou等人,1974,biochem.13:222-245;chou等人,1974,biochemistry113:211-222;chou等人,1978,adv.enzymol.relat.areasmol.biol.47:45-148;chou等人,1979,ann.rev.biochem.47:251-276;和chou等人,1979,biophys.j.26:367-384。此外,当前可使用计算机程序帮助预测二级结构。一种预测二级结构的方法基于同源性建模。例如,具有序列同一性大于30%或相似性大于40%的两个多肽或蛋白通常具有类似结构拓扑学。近来蛋白结构数据库(pdb)的发展使二级结构(包括多肽或蛋白结构内的可能折叠数)的可预测性增强。参见holm等人,1999,nucl.acid.res.27:244-247。已提出(brenner等人,1997,curr.op.struct.biol.7:369-376)给定多肽或蛋白中存在有限数目的折叠且一旦已解析临界数目的结构,则结构预测将变得显著更加精确。其他预测二级结构的方法包括“穿线法(threading)”(jones,1997,curr.opin.struct.biol.7:377-387;sippl等人,1996,structure4:15-19),“概况分析”(bowie等人,1991,science253:164-170;gribskov等人,1990,meth.enzym.183:146-159;gribskov等人,1987,proc.nat.acad.sci.84:4355-4358),和“进化连锁(evolutionarylinkage)”(参见holm,1999,见上文;和brenner,1997,见上文)。在一些实施方案中,进行具有以下作用的氨基酸取代:(1)降低对蛋白水解作用的敏感性,(2)降低对氧化的敏感性,(3)改变用于形成蛋白复合物的结合亲和力,(4)改变配体或抗原结合亲和力,和/或(4)赋予所述多肽其他物理化学或功能性质或改变这些性质,诸如保持取代区内分子主链的结构,例如作为折叠或螺旋构型;保持或改变目标位点处分子的电荷或疏水性,或保持或改变侧链的体容度。例如,可在天然存在的序列中进行单个或多个氨基酸取代(在某些实施方案中,保守氨基酸取代)。取代可在抗体位于形成分子间接触的结构域外部的部分中进行。在所述实施方案中,可使用不实质上改变亲本序列的结构特性的保守氨基酸取代(例如一个或多个不破坏表征亲本或天然抗原结合蛋白的二级结构的置换氨基酸)。本领域公认的多肽二级和三级结构的实例描述于proteins,structuresandmolecularprinciples(creighton,ed.),1984,w.h.newyork:freemanandcompany;introductiontoproteinstructure(brandenandtooze,编辑),1991,newyork:garlandpublishing;和thornton等人,1991,nature354:105中。其他变体包括半胱氨酸变体,其中亲本或天然氨基酸序列中的一个或多个半胱氨酸残基缺失或被另一氨基酸(例如丝氨酸)取代。半胱氨酸变体是有用的,尤其当抗体(例如)必须再折叠为生物学活性构型时。半胱氨酸变体的半胱氨酸残基可少于天然蛋白,且通常具有偶数个半胱氨酸残基以最小化由未配对半胱氨酸引起的相互作用。所公开的重链和轻链可变区以及cdr可用于制备抗原结合蛋白,其含有可特异性结合于cd30l多肽的抗原结合区。“抗原结合区”意指特异性结合指定抗原的蛋白或蛋白的部分,诸如含有与抗原相互作用且赋予抗原结合蛋白对目标抗原的特异性和亲和力的氨基酸残基的区域。抗原结合区可包括一个或多个cdr且某些抗原结合区还包括一个或多个“构架”区。例如,表3中列举的cdr中的一个或多个可以共价或非共价并入分子(例如多肽)中以产生免疫粘附。免疫粘附可并入cdr作为较大多肽链的一部分、可将cdr共价连接至另一多肽链或可以非共价并入cdr。cdr使免疫粘附能够特异性结合于特定目标抗原(例如cd30l多肽)。其他抗原结合蛋白包括基于本文所述的可变区和cdr的模拟物(例如“肽模拟物(peptidemimetics)或(peptidomimetics)”)。这些类似物可以是肽、非肽或肽与非肽区的组合。fauchere,1986,adv.drugres.15:29;veber和freidinger,1985,tinsp.392;和evans等人,1987,j.med.chem.30:1229。结构上类似于治疗上有用肽的肽模拟物可用于产生类似治疗性或预防性作用。通常借助于计算机化分子建模开发所述化合物。通常,肽模拟物为结构上类似于显示所需生物活性(诸如抑制或阻断cd30与cd30l的相互作用的能力)的抗原结合蛋白的蛋白,但肽模拟物具有一个或多个任选地通过本领域中众所周知的方法由选自例如以下的键置换的肽键:-ch2nh-,-ch2s-,-ch2-ch2-,-ch-ch-(顺式和反式),-coch2-,-ch(oh)ch2-,和-ch2so-。在某些实施方案中可使用相同类型d-氨基酸对共有序列的一个或多个氨基酸进行系统取代(例如d-赖氨酸代替l-赖氨酸)以产生更稳定的蛋白。此外,可通过本领域中已知的方法产生包含共有序列或实质上相同的共有序列变化的限制性肽(rizo和gierasch,1992,ann.rev.biochem.61:387),例如通过添加能够形成分子内二硫键(其使肽环化)的内部半胱氨酸残基。还提供本文所述的抗原结合蛋白的衍生物。衍生化抗原结合蛋白可包含任何赋予抗原结合蛋白或片段所需性质(诸如在特定用途中半衰期延长)的分子或物质。衍生化抗原结合蛋白可包含(例如)可检测(或标记)部分(例如放射性、比色性、抗原性或酶性分子,可检测珠粒(诸如磁性或电子致密(例如金)珠粒)或结合于另一分子的分子(例如生物素或链霉抗生物素蛋白))、治疗性或诊断性部分(例如放射性、细胞毒性或药学活性部分)或增加抗原结合蛋白用于特定用途(例如施用于主体(诸如人主体)或其他体内或体外用途)的适宜性的分子。可用于衍生抗原结合蛋白的分子的实例包括白蛋白(例如人血清白蛋白)和聚乙二醇(peg)。可使用本领域中众所周知的技术制备抗原结合蛋白的白蛋白连接和聚乙二醇化衍生物。在一个实施方案中,抗原结合蛋白缀合于或以其他方式连接于运甲状腺素蛋白(ttr)或ttr变体。可用例如选自以下的化学品对ttr或ttr变体进行化学修饰:葡聚糖、聚(n-乙烯基吡咯啶酮)、聚乙二醇、丙二醇均聚物、聚环氧丙烷/环氧乙烷共聚物、聚氧乙烯化多元醇和聚乙烯醇。其他衍生物包括cd30l抗原结合蛋白与其他蛋白或多肽的共价或聚集缀合物(诸如通过包含与cd30l抗原结合蛋白的n末端或c末端融合的异源多肽的重组融合蛋白的表达)。例如,缀合肽可以是异源信号(或前导)多肽,例如酵母α-因子前导序列,或肽诸如表位标签。含有cd30l抗原结合蛋白的融合蛋白可包含所添加的肽以促进cd30l抗原结合蛋白的纯化或鉴定(例如聚his)。cd30l抗原结合蛋白还可连接于flag肽,如hopp等人,1988,bio/technology6:1204;和美国专利号5,011,912中所述。flag肽为高抗原性且提供由特异性单克隆抗体(mab)可逆结合的表位,从而使得可快速测定和易于纯化经表达的重组蛋白。可用于制备其中flag肽与给定多肽融合的融合蛋白的试剂是可商购的(sigma,st.louis,mo)。含有一种或多种cd30l抗原结合蛋白的寡聚体可用作cd30l拮抗剂。寡聚体可呈共价连接或非共价连接二聚体、三聚体或更高级寡聚体形式。预期使用包含两种或两种以上cd30l抗原结合蛋白的寡聚体,其中一个实例为同质二聚体。其他寡聚体包括异质二聚体、同质三聚体、异质三聚体、同质四聚体、异质四聚体等。还包括包含多个经与cd30l抗原结合蛋白融合的肽部分之间的共价或非共价相互作用接合的cd30l结合蛋白的寡聚体。所述肽可以是肽接头(间隔物),或具有促进寡聚性质的肽。美国专利号4,751,180和4,935,233中所述的那些在合适肽接头之中。亮氨酸拉链和某些来源于抗体的多肽在可促进所连接的cd30l抗原结合蛋白的寡聚作用的肽之中。适用于制备可溶性寡聚蛋白的亮氨酸拉链结构域的实例描述于wipo公开号wo94/10308;hoppe等人,1994,febsletters344:191;和fanslow等人,1994,semin.immunol.6:267-278中。在一种方法中,包含与亮氨酸拉链肽融合的cd30l抗原结合蛋白片段或衍生物的重组融合蛋白表达于合适宿主细胞中,且从培养物上清液回收所形成的可溶性寡聚cd30l抗原结合蛋白片段或衍生物。所述寡聚体可包含2至4个cd30l抗原结合蛋白。寡聚体的cd30l抗原结合蛋白部分可呈任一种上述形式,例如变体或片段。寡聚体优选包含具有cd30l结合活性的cd30l抗原结合蛋白。可使用来源于免疫球蛋白的多肽制备寡聚体。包含某些与抗体衍生的多肽的各个部分(包括fc结构域)融合的异源多肽的融合蛋白的制备方法已例如由ashkenazi等人,1991,proc.natl.acad.sci.usa88:10535;byrn等人,1990,nature344:677;和hollenbaugh等人,1992"constructionofimmunoglobulinfusionproteins",incurrentprotocolsinimmunology,suppl.4,第10.19.1-10.19.11页描述。还包括二聚体,其包含两个由cd30l抗原结合蛋白与抗体的fc区域融合产生的融合蛋白。可例如通过以下方式制备二聚体:将编码融合蛋白的基因融合体插入合适表达载体中,在用重组表达载体转化的宿主细胞中表达基因融合体和使经表达的融合蛋白装配更类似的抗体分子,此后在fc部分之间形成链间二硫键以产生二聚体。所述fc多肽包括来源于抗体的fc区域的多肽的天然和突变蛋白形式。还包括所述多肽的截短形式,其含有促进二聚化作用的铰链区。包含fc部分的融合蛋白(和由其形成的寡聚体)提供易于在蛋白a或蛋白g柱上通过亲和层析纯化的优点。一种合适fc多肽(描述于wipo公开号wo93/10151和美国专利号5,426,048和5,262,522中)为从人igg1抗体的fc区域的n末端铰链区延伸至天然c末端的单链多肽。另一种有用的fc多肽为美国专利号5,457,035和baum等人1994,emboj.13:3992-4001中所述的fc突变蛋白。除氨基酸19已由leu变为ala、氨基酸20已由leu变为glu且氨基酸22已由gly变为ala外,此突变蛋白的氨基酸序列与wipo公开号wo93/10151中呈现的天然fc序列的氨基酸序列相同。突变蛋白对fc受体的亲和力降低。糖基化抗原结合蛋白可具有与天然物种中发现的模式不同或改变的糖基化模式。如本领域中已知,糖基化模式可取决于蛋白序列(例如存在或不存在特定糖基化作用氨基酸残基,下文中论述)或产生蛋白的宿主细胞或生物体。特定表达系统论述于下文中。多肽的糖基化通常为n-连接型或o-连接型。n-连接型是指碳水化物部分连接至天冬酰胺残基的侧链。三肽序列天冬酰胺-x-丝氨酸和天冬酰胺-x-苏氨酸(其中x为除脯氨酸以外的任何氨基酸)为碳水化物部分与天冬酰胺侧链的酶促连接的识别序列。因此,多肽中存在这些三肽序列中的任一种均可产生潜在糖基化位点。o-连接型糖基化作用是指糖类n-乙酰基半乳糖胺、半乳糖或木糖中的一种连接至羟基氨基酸,最通常为丝氨酸或苏氨酸,但也可使用5-羟脯氨酸或5-羟赖氨酸。通过改变氨基酸序列使得其含有一个或多个上述三肽序列来便利地实现向抗原结合蛋白中添加糖基化位点(对于n-连接型糖基化位点)。还可通过向起始序列中添加一个或多个丝氨酸或苏氨酸残基或用一个或多个丝氨酸或苏氨酸残基进行取代来进行改变(对于o-连接型糖基化位点)。为方便起见,可经由dna水平变化来改变抗原结合蛋白氨基酸序列,尤其通过使编码目标多肽的dna中预先选择的碱基突变使得产生将翻译为所需氨基酸的密码子来改变。另一种增加抗原结合蛋白上碳水化合物部分数目的手段为通过糖苷与蛋白的化学或酶促偶联。这些程序的有利之处在于其无需在具有进行n-连接型和o-连接型糖基化的糖基化能力的宿主细胞中产生蛋白。取决于所用偶联模式,糖可连接至(a)精氨酸和组氨酸,(b)游离羟基,(c)游离巯基,诸如半胱氨酸的游离巯基,(d)游离羟基,诸如丝氨酸、苏氨酸或羟脯氨酸的游离羟基,(e)芳族残基,诸如苯丙氨酸、酪氨酸或色氨酸的那些或(f)谷氨酰胺的酰胺基。这些方法描述于pct公开号wo87/05330,以及aplin和wriston,1981,crccrit.rev,biochem.,pp.259-306中。可由化学或酶促方式完成移除起始抗原结合蛋白上存在的碳水化合物部分。化学去糖基化需要使蛋白暴露于化合物三氟甲磺酸或等效化合物。此处理导致除连接糖(n-乙酰基葡萄糖胺或n-乙酰基半乳糖胺)以外的大部分或所有糖裂解而使多肽完整。化学去糖基化由hakimuddin等人,1987,arch.biochem.biophys.259:52和edge等人,1981,anal.biochem.118:131描述。多肽上的碳水化合物部分的酶促裂解可使用多种内糖苷酶和外糖苷酶实现,如由thotakura等人,1987,meth.enzymol.138:350描述。可使用化合物衣霉素(tunicamycin)阻止潜在糖基化位点处的糖基化,如由duskin等人,1982,j.biol.chem.257:3105描述。衣霉素阻断蛋白-n-糖苷键的形成。因此,方面包括抗原结合蛋白的糖基化变体,其中与亲本多肽的氨基酸序列相比,糖基化位点的数目和/或类型已改变。在某些实施方案中,抗原结合蛋白变体的n-连接型糖基化位点数目大于或小于亲本多肽。消除或改变此序列的取代可阻止添加亲本多肽中存在的n-连接型碳水化合物链。例如,可通过缺失asn或通过用不同氨基酸取代asn来降低糖基化。抗体通常在fc区域中具有n-连接型糖基化位点。标记和效应物基团抗原结合蛋白可包含一个或多个标记。术语“标记”或“标记基团”是指任何可检测标记。通常,取决于检测标记的测定法,其分为多种类别:a)同位素标记,其可以是放射性或重同位素;b)磁性标记(例如磁性粒子);c)氧化还原活性部分;d)光学染料;酶基团(例如辣根过氧化物酶、β-半乳糖苷酶、荧光素酶、碱性磷酸酶);e)生物素化基团;和f)由二级报道分子识别的预定多肽表位(例如亮氨酸拉链对序列、用于二级抗体的结合位点、金属结合结构域、表位标签等)。在一些实施方案中,标记基团经由各种长度的间隔臂(spacerarm)与抗原结合蛋白偶联以降低潜在位阻。本领域中已知多种用于标记蛋白的方法。合适标记基团的实例包括但不限于以下:放射性同位素或放射性核素(例如3h、14c、15n、35s、90y、99tc、111in、125i、131i)、荧光基团(例如fitc、若丹明(rhodamine)、镧系元素、磷光体)、酶促基团(例如辣根过氧化物酶、β-半乳糖苷酶、荧光素酶、碱性磷酸酶)、化学荧光基团、生物素基团或由二级报道分子识别的预定多肽表位(例如亮氨酸拉链对序列、用于二级抗体的结合位点、金属结合结构域、表位标签)。在一些实施方案中,标记基团经由各种长度的间隔臂与抗原结合蛋白偶联以降低潜在位阻。本领域中已知多种用于标记蛋白的方法且可在适当时使用。术语“效应物基团”意指任何与充当细胞毒性剂的抗原结合蛋白偶联的基团。合适效应物基团的实例为放射性同位素或放射性核素(例如3h、14c、15n、35s、90y、99tc、111in、125i、131i)。其他合适基团包括毒素、治疗基团或化学治疗基团。合适基团的实例包括卡里奇霉素(calicheamicin)、奥瑞斯达汀(auristatins)、格尔德霉素(geldanamycin)和美登素(maytansine)。在一些实施方案中,效应物基团经由各种长度的间隔臂与抗原结合蛋白偶联以降低潜在位阻。编码cd30l抗原结合蛋白的多核苷酸还提供编码本文所述的抗原结合蛋白或其部分的多核苷酸,包括编码抗体中的一个或两个链或其片段、衍生物、突变蛋白或变体的多核苷酸;编码重链可变区或仅编码cdr的多核苷酸;足以用作用于鉴定、分析、突变或扩增编码多肽的多核苷酸的杂交探针、pcr引物或测序引物的多核苷酸;用于抑制多核苷酸的表达的反义核酸;和以上的互补序列。多核苷酸可以是任何长度。其长度可以是例如5、10、15、20、25、30、35、40、45、50、75、85、95、100、125、150、175、200、250、300、350、400、450、500、750、1,000、1,500、3,000、5,000个或更多核酸(包括之间的所有值)和/或可包含一个或多个其他序列(例如调节序列)和/或为更大多核苷酸(例如载体)的一部分。多核苷酸可以是单链或双链且可包含rna和/或dna核酸和其人工变体(例如肽核酸)。可从已使用cd30l或其免疫原片段进行免疫的小鼠的b细胞分离编码某些抗原结合蛋白或其部分(例如全长抗体、重链或轻链、可变结构域、或cdrh1、cdrh2、cdrh3、cdrl1、cdrl2或cdrl3)的多核苷酸。可通过常规程序(诸如聚合酶链式反应(pcr))分离多核苷酸。噬菌体展示为通过其可制备抗体和其他抗原结合蛋白的衍生物的已知技术的另一个实例。在一种方法中,作为目标抗原结合蛋白的组分的多肽表达于任何合适重组表达系统中,且允许表达的多肽装配以形成抗原结合蛋白分子。还使用噬菌体展示经链改组衍生具有不同性质(即对其结合的抗原的亲和力不同)的抗原结合蛋白,参见marks等人,1992,biotechnology10:779。由于遗传密码简并性,本文中描绘的多肽序列中的每一种还由除所提供的多核苷酸以外的许多其他多核苷酸序列编码。例如,本文中提供的重链可变结构域可由多核苷酸序列seqidnos:49、51、53、55、57、59、61、63、65、67、69、71和73编码。轻链可变结构域可由多核苷酸序列seqidnos:37、39、41、43、45和47编码。本领域普通技术人员应理解,本申请因此提供编码每种抗原结合蛋白的每种简并核苷酸序列的充分书面说明和实现方法。一个方面进一步提供在特定杂交条件下与其他多核苷酸分子杂交的多核苷酸。杂交核酸方法、影响杂交条件选择的基本参数和设计合适条件的指导已在本领域中众所周知。参见例如sambrook,fritsch,andmaniatis(2001,molecularcloning:alaboratorymanual,coldspringharborlaboratorypress,coldspringharbor,n.y.andcurrentprotocolsinmolecularbiology,1995,ausubel等人,编辑,johnwiley&sons,inc.。如本文中定义,中等严格杂交条件使用含有5x氯化钠/柠檬酸钠(ssc)、0.5%sds、1.0mmedta(ph8.0)、约50%甲酰胺的杂交缓冲剂、6xssc的预洗溶液和55℃的杂交温度(或其他类似杂交溶液,诸如含有约50%甲酰胺的杂交溶液和42℃的杂交温度),且洗涤条件为60℃下于0.5xssc、0.1%sds中。严格杂交条件在45℃下于6xssc中杂交,然后在68℃下于0.1xssc,0.2%sds中洗涤一次或多次。此外,本领域技术人员可操纵杂交和/或洗涤条件以增加或降低杂交严格性,使得包含核酸序列的多核苷酸通常保持彼此杂交,所述核酸序列彼此具有至少65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性(包括之间的所有值)。可通过突变将变化引入多核苷酸中,从而引起其编码的多肽(例如抗原结合蛋白或抗原结合蛋白衍生物)的氨基酸序列的变化。可使用本领域中已知的任何技术引入突变,诸如定点诱变和随机诱变。可针对所需性质表达和选择突变体多肽。可在不显著改变多核苷酸编码的多肽的生物活性的情况下将突变引入多核苷酸中。例如,非必需氨基酸残基处的取代。或者,可将选择性改变多核苷酸编码的多肽的生物活性的一个或多个突变引入多核苷酸中。例如,突变可以定量或定性改变生物活性,诸如增加、降低或消除活性和改变抗原结合蛋白的抗原特异性。另一方面提供适合用作用于检测核酸序列的引物或杂交探针的多核苷酸。多核苷酸可仅包含编码全长多肽的核酸序列的一部分,例如可用作探针或引物的片段或编码多肽的活性部分(例如cd30l结合部分)的片段。基于核酸序列的探针可用于检测核酸或类似核酸,例如编码多肽的转录物。探针可包含标记基团,例如放射性同位素、荧光化合物、酶或酶辅因子。所述探针可用于鉴定表达多肽的细胞。表达抗原结合蛋白的方法本文中提供的抗原结合蛋白可由多种常规技术中的任一种制备。例如,可使用本领域中已知的任何技术通过重组表达系统制备cd30l抗原结合蛋白。参见例如,monoclonalantibodies,hybridomas:anewdimensioninbiologicalanalyses,kennet等人(编辑)plenumpress,newyork(1980);和antibodies:alaboratorymanual,harlowandlane(编辑),coldspringharborlaboratorypress,coldspringharbor,n.y.(1988)。本文中还提供呈质粒、表达载体、转录或表达盒形式的表达系统和构建体,其包含至少一种如上所述的多核苷酸,以及包含所述表达系统或构建体的宿主细胞。如本文中所用,“载体”意指任何适用于将蛋白编码信息转移至宿主细胞中的分子或实体(例如核酸、质粒、噬菌体或病毒)。载体的实例包括但不限于质粒、病毒载体、非附加型哺乳动物载体和表达载体,例如重组表达载体。表达载体(诸如重组表达载体)可用于宿主细胞的转化且含有核酸序列,所述核酸序列引导和/或控制(与宿主细胞结合)一个或多个与其可操作地连接的异源编码区的表达。表达构建体可包括但不限于影响或控制转录、翻译和(如果存在内含子)影响与其可操作地连接的编码区的rna剪接的序列。“可操作地连接”意指该术语所适用的组分处于允许其行使其固有功能的关系。例如,排列载体中与蛋白编码序列“可操作地连接”的控制序列(例如启动子),使得控制序列的正常活性引起蛋白编码序列的转录,从而引起所编码蛋白的重组表达。另一方面提供宿主细胞,已将表达载体(诸如重组表达系统)引入所述宿主细胞中。宿主细胞可以是任何原核细胞(例如大肠杆菌(e.coli))或真核细胞(例如酵母细胞、昆虫细胞或哺乳动物细胞(例如cho细胞))。可经由常规转化或转染技术将载体dna引入原核或真核细胞中。对于哺乳动物细胞的稳定转染,已知取决于所用表达载体和转染技术,仅小部分细胞可将外部dna整合至其基因组中。为了鉴定和选择这些整合体,通常将编码可选择标记(例如用于抗生素抗性)的基因连同目标基因引入宿主细胞中。优选的可选择标记包括赋予抗药性的标记(诸如g418、潮霉素(hygromycin)和甲氨喋呤)。可通过药物选择鉴定用所引入的多核苷酸稳定转染的细胞(例如已并入可选择标记基因的细胞将存活,而其他细胞死亡),也可使用其他方法。抗原结合蛋白可表达于杂交瘤细胞系中(例如尤其抗体可表达于杂交瘤中)或除杂交瘤以外的细胞系中。编码抗原结合蛋白的表达构建体可用于转化哺乳动物、昆虫或微生物宿主细胞。可使用任何已知的用于将多核苷酸引入宿主细胞中的方法进行转化,包括例如将多核苷酸包装于病毒或噬菌体中且用构建体通过本领域中已知的转染程序对宿主细胞进行转导,如由美国专利号4,399,216;4,912,040;4,740,461;4,959,455所例举。所用最佳转化程序将取决于所转化的宿主细胞的类型。用于将异源多核苷酸引入哺乳动物细胞中的方法在本领域中众所周知且包括但不限于葡聚糖介导的转染、磷酸钙沉淀、聚凝胺介导的转染、原生质体融合、电穿孔、脂质体中多核苷酸的封装、将核酸与带正电荷的脂质混合和将dna直接显微注射至细胞核中。重组表达构建体通常包含编码多肽的多核苷酸。多肽可包含以下中的一种或多种:一个或多个诸如本文中提供的cdr;轻链可变区;重链可变区;轻链恒定区;重链恒定区(例如ch1、ch2和/或ch3);和/或cd30l抗原结合蛋白的另一支架部分。使用标准连接技术将这些核酸序列插入合适表达载体中。在一个实施方案中,将重链或轻链恒定区附接至本文中提供的重链或轻链可变区的c末端且连接至表达载体中。通常选择在所用特定宿主细胞中具有功能性的载体(即载体与宿主细胞机相容、可发生允许基因的扩增和/或表达)。在一些实施方案中,使用可使用蛋白报道分子诸如二氢叶酸还原酶进行蛋白-片段互补测定法的载体(参见例如美国专利号6,270,964)。合适表达载体可例如从invitrogenlifetechnologies(carlsbad,ca)或bdbiosciences(sanjose,ca)购得。其他可用于抗体和片段的克隆和表达的载体包括bianchi和mcgrew,2003,biotech.biotechnol.bioeng.84:439-44中描述的载体。其他合适表达载体论述于例如methodsenzymol.,vol.185(d.v.goeddel,编辑),1990,newyork:academicpress中。通常,用于任一种宿主细胞中的表达载体均将含有用于质粒保持和用于外源核苷酸序列的克隆和表达的序列。在某些实施方案中,所述序列(统称为“侧接序列”)将通常包括以下核苷酸序列中的一种或多种:启动子、一个或多个增强子序列、复制起点、转录终止序列、含有供体和受体剪接位点的完整内含子序列、编码用于多肽分泌的前导序列的序列、核糖体结合位点、聚腺苷酸化序列、用于插入编码待表达多肽的多核苷酸的多接头(polylinker)区域和可选择的标记元件。可从起始载体(诸如市售载体)构建所提供的表达载体。所述载体可能含有或可能不含有所有所需侧接序列。当载体中已不存在一个或多个本文所述的侧接序列时,可个别地获得它们且将其连接至载体中。用于获得各侧接序列的方法已为本领域技术人员所众所周知。任选地,载体可含有“标签”编码序列(即位于cd30l抗原结合蛋白编码序列的5’或3’端处的寡核苷酸分子);编码多his(诸如六his)的寡核苷酸序列或其市售抗体存在的另一“标签”(诸如ha(血细胞凝集素流感病毒)或myc)。此标签通常在多肽表达之后与多肽融合,且可充当用于从宿主细胞亲和纯化或检测cd30l抗原结合蛋白的手段。亲和纯化可例如通过使用针对标签的抗体作为亲和基质进行柱层析来完成。任选地,然后可通过多种手段(诸如使用某些用于裂解的肽酶)从纯化的cd30l抗原结合蛋白去除标签。侧接序列可以是同源(即来自与宿主细胞相同的物种和/或品系)、异源(即来自除宿主细胞物种或品系以外的物种)、杂合(即来自一种以上来源的侧接序列的组合)、合成或天然的。因此,侧接序列的来源可以是任何原核或真核生物体、任何脊椎动物或无脊椎动物生物体或任何植物,条件为侧接序列在宿主细胞机中发挥功能且可由宿主细胞机活化。可用于载体中的侧接序列可由本领域中众所周知的几种方法中的任一种获得。通常,本文中可用的侧接序列已通过定位和/或限制性内切酶消化预先鉴定,且因此可使用合适的限制性内切酶从合适组织来源分离。在一些情况下,侧接序列的全核苷酸序列可以是已知的。此处,可使用本文所述用于核酸合成或克隆的方法合成侧接序列。无论已知所有侧接序列或仅已知一部分侧接序列,其均可使用聚合酶链式反应(pcr)和/或通过用来自相同或另一物种的合适探针(诸如寡核苷酸和/或侧接序列片段)筛选基因组文库来获得。当侧接序列为未知时,可从较大片的可能含有例如编码序列或甚至另一种或多种基因的dna分离含有侧接序列的dna片段。分离可通过限制性内切酶消化以产生合适dna片段,然后使用琼脂糖凝胶纯化、柱层析(qiagen,chatsworth,ca)或本领域技术人员已知的其他方法进行分离来实现。选择实现此目的的合适酶对于本领域普通技术人员是容易地显而易见的。复制起点通常为那些市售原核表达载体的一部分,且起点有助于宿主细胞中载体的扩增。如果所选载体不含复制位点起点,则可基于已知序列化学合成且连接至载体中。例如,来自质粒pbr322(newenglandbiolabs,beverly,ma)的复制起点适用于大部分革兰氏阴性细菌(gram-negativebacteria)且多种病毒起点(例如sv40、多瘤、腺病毒、水泡性口炎病毒(vsv)或乳头状瘤病毒(诸如hpv或bpv))可用于克隆哺乳动物细胞中的载体。通常,哺乳动物表达载体无需复制起点组分(例如通常仅使用sv40起点,因为其还含有病毒早期启动子)。转录终止序列通常位于多肽编码区的末端3’位且用于终止转录。通常,原核细胞中的转录终止序列为富含g-c的片段,随后为多聚t序列。尽管序列易于从文库克隆或甚至作为载体的部分商购,但其也可使用核酸合成方法(诸如本文所述的核酸合成方法)容易地合成。可选择标记基因编码生长于选择性培养基中的宿主细胞的存活和生长所必需的蛋白。典型选择标记基因编码起以下作用的蛋白:(a)赋予原核宿主细胞对抗生素或其他毒素(例如氨苄青霉素、四环素或卡那霉素)的抗性;(b)补充细胞的营养缺陷型缺损;或(c)提供无法从复合或已知成分培养基获得的关键营养物。特定可选择标记为卡那霉素抗性基因、氨苄青霉素抗性基因和四环素抗性基因。有利的是,新霉素抗性基因还可用于原核宿主细胞和真核宿主细胞两者中的选择。其他可选择基因可用于扩增待表达基因。扩增为其中产生对生长或细胞存活关键的蛋白所需的基因在逐代重组细胞的染色体内串联重复的过程。适用于哺乳动物细胞的可选择标记的实例包括二氢叶酸还原酶(dhfr)和无启动子胸苷激酶基因。将哺乳动物细胞转化体置于选择压力下,其中借助于存在于载体中的可选择基因使得仅转化体独特地适于存活。通过在培养基中的选择试剂的浓度连续增加(从而引起可选择基因和编码另一基因(诸如结合于cd30l的抗原结合蛋白)的dna的扩增)条件下培养转化的细胞来施加选择压力。因此,从扩增的dna合成增加量的多肽(诸如抗原结合蛋白)。核糖体结合位点通常为mrna的翻译起始所必需且由shine-dalgarno序列(原核生物)或kozak序列(真核生物)表征。该元件通常位于启动子的3'位和待表达多肽的编码序列的5'位。在一些情况下,诸如当真核生物宿主细胞表达系统中需要糖基化时,可操纵多个前序列或原序列以改善糖基化或产率。例如,可改变特定信号肽的肽酶裂解位点,或添加也可影响糖基化的原序列。最终蛋白产物可能在-1位(相对于成熟蛋白的第一氨基酸)具有一个或多个易于表达的额外氨基酸(其可能尚未完全移除)。例如,最终蛋白产物可具有一个或两个在肽酶裂解位点中可见的氨基酸残基,其连接至氨基端。或者,使用一些酶裂解位点可产生所需多肽的轻微截短形式(如果酶在成熟多肽内该区域处切割)。表达和克隆将通常含有启动子,其由宿主生物体识别且与编码cd30l抗原结合蛋白的分子可操作地连接。启动子为位于结构基因的起始密码子上游(即5'位)的未转录序列(通常在约100bp至1000bp内),其控制结构基因的转录。启动子常规分为两种类型之一:诱导型启动子和组成型启动子。诱导型启动子响应于培养条件的一些变化(诸如存在或不存在营养物或温度变化)起始在其控制下从dna的转录水平增加。另一方面,组成型启动子均匀地转录与其可操作地连接的基因,即对基因表达控制极小或无控制。许多由多种潜在宿主细胞识别的启动子是众所周知的。通过限制酶消化从来源dna移除启动子且将所需启动子序列插入载体中来使合适启动子与编码cd30l抗原结合蛋白的重链可变区或轻链可变区的dna可操作地连接。用于与酵母宿主一起使用的合适启动子也在本领域中众所周知。酵母增强子有利地与酵母启动子一起使用。适于与哺乳动物宿主细胞一起使用的启动子是众所周知的,且包括但不限于从病毒(诸如多瘤病毒、禽痘病毒、腺病毒(诸如腺病毒2)、牛乳头状瘤病毒、鸟类肉瘤病毒、巨细胞病毒、逆转录病毒、乙型肝炎病毒和猿猴病毒40(sv40))的基因组获得的启动子。其他合适哺乳动物启动子包括异源哺乳动物启动子,例如热休克启动子和肌动蛋白启动子。其他可能的目标启动子包括但不限于:sv40早期启动子(benoist和chambon,1981,nature290:304-310);cmv启动子(thornsen等人,1984,proc.natl.acad.u.s.a.81:659-663);劳斯肉瘤病毒(roussarcomavirus)的3'长末端重复中所含启动子(yamamoto等人,1980,cell22:787-797);疱疹胸苷激酶启动子(wagner等人,1981,proc.natl.acad.sci.u.s.a.78:1444-1445);来自金属硫蛋白基因的启动子和调节序列(prinster等人,1982,nature296:39-42);和原核启动子,诸如β-内酰胺酶启动子(villa-kamaroff等人,1978,proc.natl.acad.sci.u.s.a.75:3727-3731);或tac启动子(deboer等人,1983,proc.natl.acad.sci.u.s.a.80:21-25)。还关注以下动物转录控制区,其呈现组织特异性且已用于转基因动物中:弹性蛋白酶i基因控制区,其在胰脏腺泡细胞中具有活性(swift等人,1984,cell38:639-646;ornitz等人,1986,coldspringharborsymp.quant.biol.50:399-409;macdonald,1987,hepatology7:425-515);胰岛素基因控制区,其在胰脏β细胞中具有活性(hanahan,1985,nature315:115-122);免疫球蛋白基因控制区,其在淋巴样细胞中具有活性(grosschedl等人,1984,cell38:647-658;adames等人,1985,nature318:533-538;alexander等人,1987,mol.cell.biol.7:1436-1444);小鼠乳腺瘤病毒控制区,其在睾丸、乳房、淋巴样和肥大细胞中具有活性(leder等人,1986,cell45:485-495);白蛋白基因控制区,其在肝脏中具有活性(pinkert等人,1987,genesanddevel.1:268-276);甲胎蛋白基因控制区,其在肝脏中具有活性(krumlauf等人,1985,mol.cell.biol.5:1639-1648;hammer等人,1987,science253:53-58);α1-抗胰蛋白酶基因控制区,其在肝脏中具有活性(kelsey等人,1987,genesanddevel.1:161-171);β-珠蛋白基因控制区,其在骨髓细胞中具有活性(mogram等人,1985,nature315:338-340;kollias等人,1986,cell46:89-94);髓磷脂碱性蛋白基因控制区,其在脑中的少树突神经胶细胞中具有活性(readhead等人,1987,cell48:703-712);肌球蛋白轻链-2基因控制区,其在骨骼肌中具有活性(sani,1985,nature314:283-286);和促性腺释放激素基因控制区,其在丘脑下部中具有活性(mason等人,1986,science234:1372-1378)。可将增强子序列插入载体中以增加由高等真核细胞的转录。增强子为dna的顺式作用元件(长度通常为约10bp-300bp),其对启动子起作用以增强转录。已在转录单元的5'位和3'位处发现,增强子在方向和位置上相对独立。已知几种可从哺乳动物基因获得的增强子序列(例如珠蛋白、弹性蛋白酶、白蛋白、甲胎蛋白和胰岛素)。然而通常使用来自病毒的增强子。本领域中已知的sv40增强子、巨细胞病毒早期启动子增强子、多瘤增强子和腺病毒增强子为用于真核启动子的活化的示例性增强元件。尽管增强子可位于载体中编码序列的5'或3'位处,但其通常位于启动子的5'位处。可将编码合适天然或异源信号序列(前导序列或信号肽)的序列并入表达载体中,以促进抗体的细胞外分泌。信号肽或前导序列的选择取决于将产生抗体的宿主细胞的类型,且异源信号序列可置换天然信号序列。在哺乳动物宿主细胞中具有功能性的信号肽的实例包括以下:美国专利号4,965,195中描述的白介素-7的信号序列;cosman等人,1984,nature312:768中描述的白介素-2受体的信号序列;ep专利号0367566中描述的白介素-4受体信号肽;美国专利号4,968,607中描述的i型白介素-1受体信号肽;ep专利号0460846中描述的ii型白介素-1受体信号肽。在已经构建载体后,可将完成的载体插入合适宿主细胞中以用于扩增和/或多肽表达。可通过众所周知方法使抗原结合蛋白的表达载体转化至所选宿主细胞中,包括转染、感染、磷酸钙共沉淀、电穿孔、显微注射、脂质体转染、deae-葡聚糖介导的转染或其他已知技术。所选择方法将部分随待使用的宿主细胞类型而变。这些方法和其他合适方法已为本领域技术人员所众所周知且阐述于例如sambrook等人,molecularcloning:alaboratorymanual,3rded.,coldspringharborlaboratorypress,coldspringharbor,n.y.(2001)中。当在适当条件下培养时,宿主细胞合成蛋白,然后所述蛋白可从培养基收集(如果宿主细胞将其分泌入培养基中)或直接从产生其的宿主细胞收集(如果未分泌)。适当宿主细胞的选择将取决于多种因素,诸如所需表达水平、活性所需或必需的多肽修饰(诸如糖基化或磷酸化)和折叠成生物学活性分子的易操作性。可用作用于表达的宿主的哺乳动物细胞系在本领域中所众所周知且包括但不限于可从美国典型培养物保藏中心(americantypeculturecollection;atcc)获得的永生化细胞系,包括但不限于中国仓鼠卵巢(cho)细胞、hela细胞、幼仓鼠肾(bhk)细胞、猴肾细胞(cos)、人肝细胞癌细胞(例如hepg2)和多种其他细胞系。在某些实施方案中,可经由确定哪些细胞系具有高表达水平和组成型产生具有cd30l结合性质的抗原结合蛋白来选择细胞系。在另一个实施方案中,还可选择来自b细胞谱系的细胞系,其不产生其自有抗体但具有产生和分泌异源抗体的能力。在另一个实施方案中,岩藻糖基转移酶敲除细胞系,其产生完全或部分无岩藻糖基化抗体(美国专利6,946,292、us7,425,446、us7,846,725、us8,067,232、细胞、biowa,princeton,nj)。cd30l体外生物测定法还提供鉴定抑制cd30/cd30l相互作用的拮抗剂的方法。这些方法利用cd30+细胞响应于cd30l产生的标记细胞因子的诱导作用。该方法包含以下步骤:组合目标测试化合物与cd30l来源;向能够响应于cd30与cd30l的相互作用表达标记细胞因子的cd30+细胞中添加测试化合物/cd30l组合;收集细胞上清液;和通过测量细胞上清液中产生和/或释放入其中的标记细胞因子的量来确定测试化合物是否抑制cd30/cd30l相互作用。例如,所述cd30l依赖性体外生物测定法可使用人间变性大细胞淋巴瘤(alcl)细胞系、内源cd30的karpas-299(k299)表达和这些细胞响应于cd30与cd30l的相互作用而释放il-8。这些方法进一步例举于本文中提供的实施例中。测试化合物包括cd30l抗原结合蛋白,包括但不限于抗体、其抗原结合片段和其衍生物。测试化合物还可包括重组可溶性cd30化合物(诸如与fc标签、聚his标签、标签等融合的cd30胞外结构域)以及小分子。合适cd30+细胞系响应于cd30与cd30l的相互作用表达标记细胞因子;所述细胞系包括人cd30+间变性大细胞淋巴瘤细胞系k299(karpas-299,dsmz,germany)。cd30l来源包括可溶性cd30l构建体和细胞膜相关cd30l。可溶性cd30l包括嵌合组合物,其包含cd30l片段,优选为cd30l的胞外区的片段。所述可溶性构建体包括多聚亮氨酸或异亮氨酸拉链构建体。所述构建体包含连接至人或食蟹猴cd30l的胞外结构域n末端的33个氨基酸的亮氨酸拉链基序。可溶性重组cd30l构建体还可商购(r&dsystems,minneapolis,mn)。其他可溶性cd30l还包括与标签(axxorallc,sandiego,ca)融合的cd30l胞外结构域。细胞膜相关cd30l包括天然和经转染的cd30l表达细胞和细胞系。所述细胞系包括但不限于人细胞,诸如cd30l+人b细胞系ramos(atcc,manassas,va)。还考虑食蟹猴血液t细胞和小鼠树突状细胞系。本文中提供确定cd30l诱导从cd30+细胞产生il-8的方法,其包含以下步骤:组合测试化合物与cd30l来源;向经照射的cd30+细胞中添加测试化合物-cd30l组合;收集细胞上清液;和确定释放入细胞上清液中的il-8量。此cd30l依赖性体外生物测定法使用人间变性大细胞淋巴瘤(alcl)细胞系、内源cd30的karpas-299(k299)表达和这些细胞响应于cd30与cd30l的相互作用而释放il-8。可例如通过il-8elisa对所释放的il-8进行定量。cd30l拮抗剂(诸如本文所述的抗原结合蛋白)与可溶性cd30l(单细胞测定法)或细胞膜相关cd30l(双细胞测定法)一起孵育且然后与k299细胞一起培养。然后收集细胞上清液且使用il-8夹心elisa测定响应于cd30l拮抗剂(诸如本文所述的抗原结合蛋白)的阻断而抑制k299细胞释放il8的作用。对于单细胞测定法,将cd30l拮抗剂滴定至96孔微量滴定板(诸如96孔板(corning;acton,ma))中以得到所需最终浓度范围,例如1μg/ml至10pg/ml。cd30l抗原结合蛋白(诸如本文所述的抗原结合蛋白)可用作阳性对照。将所述板在室温下孵育约45分钟。然后向各孔中添加cd30+细胞来源。将所述板在37℃5%co2下孵育24小时。对于双细胞测定法,cd30l来源为膜结合和照射。cd30l表达细胞包括但不限于细胞诸如人cd30l+人b细胞系ramos(atcc,manassas,va)、活化食蟹猴血液t细胞或小鼠鼠dc细胞系。在用于选择具有最高细胞表面cd30l表达水平的那些细胞前,cd30l表达细胞可经受facs分选。cd30l表达细胞与cd30l拮抗剂组合且孵育45分钟,随后添加至cd30+细胞来源中。再次,将所述板在37℃、5%co2下孵育24小时。对于两种测定法,可通过任何用于检测il-8的方法(诸如例如il-8夹心elisa)测定释放的il8和对其进行定量。所述测定法可商购,诸如由r&dsystems(minneapolis,mn)提供的测定法。可由elisa标准曲线和使用市售软件(诸如deltasoft(deltasoft,inc.,hillsborough,nj)和graphpadprism(graphpadsoftwareinc.,sandiego,ca)所测定的ic50值通过内插法获得il-8水平。人cd30l抗原结合蛋白用于诊断性和治疗性目的的用途本文中提供的抗原结合蛋白可用于检测生物样品中的cd30l和鉴定产生cd30l的细胞或组织。特异性结合于cd30l的抗原结合蛋白可用于诊断和/或治疗有其需要的患者中与cd30l有关的疾病,例如cd30l抗原结合蛋白可用于诊断测定法,例如诱导来自cd30+细胞的il-8。结合于cd30l的抗原结合蛋白在改善与cd30l有关的疾病中可具有治疗性用途。适应症本发明还涉及cd30l抗原结合蛋白用于医学病症(诸如本文中公开的医学病症)的预防或治疗性处理的用途。cd30l抗原结合蛋白可用于治疗多种与cd30l有关或cd30l在促进潜在疾病或病症中起作用或以其他方式促进不良症状的病况。提供通过向有其需要的患者施用有效量的包含一种或多种本文所述的cd30l抗原结合蛋白的组合物来治疗多种疾病(诸如自身免疫性和慢性炎性疾病和癌症)的方法。所述组合物可用于通过阻断cd30+与cd30l+细胞之间的相互作用;消耗cd30l+细胞;或通过cd30l+细胞上的激动活性来体内调节免疫反应。cd30l可呈现“反向信号传导(reversesignaling)”,表达于嗜中性粒细胞和外周血t细胞上的cd30l可由交联活化以刺激那些细胞中的代谢活性(wiley等人,jimmunol157:3235-39,1996;cerutti等人,j.immunol.165:786,2000;cerutti等人,nat.immunol.2:150,2001)。因此,本文所述的结合cd30l的抗原结合蛋白可用于阻断反向cd30l信号传导或刺激cd30l+细胞。cd30+细胞与霍奇金氏病(hodgkin’sdisease)强烈相关且cd30为广泛用于多种血液恶性肿瘤的临床标记(关于评述,参见horie和watanabe,immuno.10:457-470,1998)。包含一种或多种本文所述的cd30l抗原结合蛋白(单独或与其他治疗的组合)的组合物可用于治疗所述病况。cd30l在活化的t细胞和某些b细胞以及树突状细胞群体上表达。cd30在一部分活化的t细胞和b细胞上表达。此表达模式表明靶向cd30l可用于调节t细胞、b细胞与树突状细胞之间的相互作用。已显示cd30l影响体液免疫。本文所述的抗原结合蛋白可用于与炎性疾病(尤其由t细胞依赖性b细胞反应引起的疾病)有关的治疗方案。本文中公开的方法和组合物可治疗关节炎。如本文中所用,术语“关节炎”是指慢性炎性病况,其主要影响关节或关节周围的结缔组织,尽管各种身体器官也可能变得受影响。关节炎可由自身免疫或创伤引起,或其可由暴露于外部抗原,随后引起不再依赖于引发抗原持续存在的慢性病况而引起。如本文中所用,术语“关节炎”包括:变形性关节炎;骨关节炎;类风湿性关节炎(成人和青少年);莱姆病关节炎(lymediseasearthritis);反应性关节炎,包括莱特尔氏病(reiter'sdisease);牛皮癣关节炎;结节性关节炎;血清阴性脊椎关节病,包括但不限于僵直性脊椎炎。本文所述的抗原结合蛋白可用于治疗多种风湿病,其在本文中定义为任何与疼痛有关的慢性病症且通常为关节、肌肉、神经、肌腱、皮肤、眼睛、结缔组织或各种其他器官系统中的多局部炎症。这些病症包括但不限于:关节炎;硬皮病;痛风;全身性红斑狼疮;风湿性多肌痛;斯蒂尔氏病(still’sdisease);慢性葡萄膜炎;引起随意肌炎症的病症,包括皮肌炎和多肌炎,包括偶发性包涵体肌炎。全身性红斑狼疮可引起关节、皮肤、肾、心脏、肺、血管和脑部炎症。在其晚期形式中,全身性红斑狼疮这种病况可引起肾衰竭。还提供在治疗中使用本文所述的抗原结合蛋白治疗内分泌系统的各种病症的方法,所述病症包括但不限于:青少年或成年发病型糖尿病(包括自身免疫、胰岛素依赖型糖尿病;非胰岛素依赖型糖尿病和肥胖症介导的糖尿病);特发性肾上腺萎缩;艾迪森氏病(addison’sdisease);甲状腺功能低下;格雷氏病(grave’sdisease);自身免疫甲状腺炎,诸如桥本氏甲状腺炎(hashimoto’sthyroiditis);和多腺体自身免疫综合征(i型和ii型)。本文所述的抗原结合蛋白还可用于治疗胃肠系统病况的治疗中,所述病况包括但不限于:自身免疫硬化性胆管炎;腹腔病;炎性肠疾病,包括克罗恩氏病(crohn’sdisease)和溃疡性结肠炎;自身免疫胰脏炎,包括慢性胰腺炎;特发性胃轻瘫;和特发性溃疡,包括胃和十二指肠溃疡。还包括在治疗中使用本文所述的抗原结合蛋白治疗生殖泌尿系统病症的方法,所述病症诸如自身免疫和特发性肾小球肾炎;和慢性特发性前列腺炎(非细菌性),包括良性前列腺肥大。本文中还提供在治疗中使用本文所述的抗原结合蛋白治疗各种血液病症的方法,所述病症包括但不限于:贫血和血液病症,包括恶性贫血和再生障碍性贫血,和范康尼氏再生障碍性贫血(fanconi’saplasticanemia);自身免疫性溶血性贫血;特发性血小板减少性紫癜(itp);脊髓增生异常综合征(包括难治性贫血、伴有环形铁粒幼红细胞的难治性贫血、伴有胚细胞过量的难治性贫血、伴有转化中胚细胞过量的难治性贫血);和自身免疫淋巴增生综合征(alps)。所公开的抗原结合蛋白还可用于治疗影响肝脏的病况,诸如自身免疫或慢性炎性肝炎。此外,所公开的抗原结合蛋白和组合可用于治疗各种与听力损失有关的自身免疫或慢性炎性病症。这些中的一种是内耳或蜗神经相关听力损失,认为其是由自身免疫过程引起,即自身免疫听力损失。当前用类固醇、甲氨喋呤和/或环磷酰胺治疗此病况,其可与cd30/cd30l相互作用抑制剂或阻断剂同时施用。还可用所公开的抗原结合蛋白治疗多种炎性肺病,包括:特发性淋巴管平滑肌增多症;与慢性非传染性支气管炎或肺气肿有关的慢性阻塞性肺病(copd);和纤维变性肺病,诸如囊肿性纤维化和特发性肺纤维化。还可用所公开的抗原结合蛋白治疗与移植有关的病症,包括移植物抗宿主疾病。为了预防或改善移植物抗宿主疾病,可在骨髓或实体器官移植(包括心脏、肝脏、肺、皮肤、肾或其他器官移植)之前、移植同时或移植之后施用包含一种或多种所公开的抗原结合蛋白的组合物。所公开的抗原结合蛋白还可用于治疗慢性炎性眼病,包括自身免疫葡萄膜炎。所述化合物还可用于治疗与呼吸道炎症有关的疾病,诸如哮喘。本文所述的抗原结合蛋白还可用于治疗影响雌性生殖系统的炎性病症,包括:多次植入失败/不育症;流产综合征或iv胚胎丢失(自发性流产);和子宫内膜异位。可用本文所述的抗原结合蛋白治疗的其他医学病症包括中枢神经系统的慢性炎症和/或退化性疾病。这包括例如与脱髓鞘有关的疾病,诸如多发性硬化、全身性硬化症和格-巴二氏综合征(guillain-barresyndromes)(包括急性炎性脱髓鞘多发性神经病变、急性运动轴突神经病变、急性运动感觉轴突神经病变和费歇尔综合征(fishersyndrome))。多发性硬化是中枢神经系统的慢性退化性疾病的代表,其可用能够抑制或阻断cd30与cd30l的相互作用的药剂治疗。参见例如美国专利号6,652,854。其他可用所公开的抗原结合蛋白治疗的慢性炎性病况包括冷凝集素病;白塞氏综合征(behcet’ssyndrome);舍格伦氏综合征(sjogren’ssyndrome);和特发性腱鞘炎,以及各种与遗传缺陷有关的慢性炎性病症。目标抑制剂、组合物和组合治疗还可用于治疗贝尔氏麻痹(bell’spalsy)(特发性面部神经麻痹);慢性疲劳综合征(与进行性感染无关);慢性退化性椎间盘疾病;海湾战争综合征(gulfwarsyndrome);和重症肌无力,其可同时用皮质类固醇治疗。本文所述的抗原结合蛋白还可用于治疗与皮肤或粘膜有关的病症。这些病症包括:皮肤棘层松解疾病,包括盘状狼疮、亚急性皮肤红斑性狼疮、皮肤血管炎、达里埃氏病(darier’sdisease)、毛囊角化症、寻常天疱疮和副肿瘤天疱疮;红斑痤疮;斑脱;大疱性类天疱疮;湿疹;红斑,包括多形性红斑和大疱性多形红斑(stevens-johnson综合征);炎性皮肤病;扁平苔癣;线状iga大疱皮病(儿童慢性大疱皮病);皮肤弹性损失;嗜中性皮炎(斯威特氏综合征(sweet’ssyndrome));毛发红糠疹:牛皮癣;坏疽性脓皮病;皮肤弹性损失;和中毒性表皮坏死溶解。其他可使用所公开的抗原结合蛋白治疗的疾病包括:自身免疫相关慢性皮肤粘膜念珠菌病;变应性疾病;类肉瘤病;多中心网状组织细胞增生症;韦格纳氏肉芽肿病(wegener’sgranulomatosis);动脉炎,包括巨细胞性动脉炎;血管炎和慢性自身免疫心肌炎。为了使用本文所述的抗原结合蛋白治疗医学病症,向有其需要的哺乳动物施用治疗有效量的治疗剂。根据足以诱导至少一个反映病症严重性的指标的持续改善的剂量和施用频率方案施用药剂。如果患者至少在间隔至少1天(但优选间隔1周、2周、3周或4周或4周以上)的两个时刻呈现改善,则认为改善为“持续的”。病症严重性基于体征或症状确定,或可通过施用于患者的问卷调查确定,诸如医师通常用于评估慢性疾病病况的状态的生活质量问卷调查。可评估一个或多个反映患者疾病严重性的指标以确定药物治疗的频率和持续时间是否足够。通过在施用第一剂量的治疗剂之前对患者进行检查来建立所选指标的基线值。基线检查优选在施用第一剂量前约60天内进行。如果所治疗的病况为全身性红斑狼疮,则用于确定治疗充分性的指标可由观察以下症状中的一种的改善组成:疲劳;发烧;口腔和鼻的溃疡;面部皮疹(“蝶形疹”);光敏感性(sle通常在暴露于阳光后发作);胸膜炎;心包炎;雷诺氏现象(raynaud’sphenomenon)(暴露于寒冷后手指和脚趾的循环降低);肾功能;和白细胞计数(sle患者的白细胞计数通常降低)。提供药物组合物,其包含与药学上可接受的载体配制的本文中公开的抗原结合蛋白。在一些实施方案中,药学上可接受的载体适用于施用于人主体。诊断方法所述抗原结合蛋白可用于诊断目的以检测、诊断或监测与cd30/cd30l相互作用有关的疾病和/或病况。可用于检测cd30l存在的方法的实例包括免疫测定法,诸如酶联免疫吸附测定法(elisa)和放射免疫测定法(ria)。对于诊断应用,通常用可检测标记基团标记抗原结合蛋白。合适标记基团包括但不限于以下:放射性同位素或放射性核素(例如3h,14c,15n,35s,90y,99tc,111in,125i,131i)、荧光基团(例如fitc、若丹明、镧系元素磷光体)、酶促基团(例如辣根过氧化物酶、β半乳糖苷酶、荧光素酶、碱性磷酸酶)、化学荧光基团、生物素基团或由二级报道分子识别的预定多肽表位(例如亮氨酸拉链对序列、用于二级抗体的结合位点、金属结合结构域、表位标签)。在一些实施方案中,标记基团经由各种长度的间隔臂与抗原结合蛋白偶联以降低潜在位阻。本领域中已知且可使用多种用于标记蛋白的方法。提供其他用于鉴定一个或多个表达cd30l的细胞的诊断方法。在特定实施方案中,用标记基团标记抗原结合蛋白且检测所标记的抗原结合蛋白与cd30l的结合。在其他特定实施方案中,体内检测抗原结合蛋白与cd30l的结合。在其他特定实施方案中,分离cd30l抗原结合蛋白且使用本领域中已知的技术进行测量。参见例如harlow和lane,1988,antibodies:alaboratorymanual,newyork:coldspringharbor(ed.1991及定期增刊);johne.coligan,编辑,1993,currentprotocolsinimmunologynewyork:johnwiley&sons。其他方法提供用于检测测试分子存在,该测试分子与所提供的抗原结合蛋白针对与cd30l的结合进行竞争。一种此类测定法的实例将涉及在测试分子存在或不存在的情况下检测含有一定量cd30l的溶液中游离抗原结合蛋白的量。游离抗原结合蛋白(即未结合于cd30l的抗原结合蛋白)的量的增加将表明测试分子能够与抗原结合蛋白针对与cd30l的结合进行竞争。在一个实施方案中,用标记基团标记抗原结合蛋白。或者,标记测试分子且在抗原结合蛋白存在和不存在的情况下监测游离测试分子的量。治疗方法:药物制剂、给药途径提供药物组合物,其包含治疗有效量的一种或多种抗原结合蛋白和药学上可接受的赋形剂、稀释剂、载体、增溶剂、乳化剂、防腐剂和/或佐剂。此外,包括通过施用所述药物组合物来治疗患者的方法。术语“患者”包括人患者。术语“治疗(treat)”和“治疗(treatment)”涵盖减轻或预防病症的至少一种症状或其他方面,或降低疾病严重性等。术语“治疗有效量”或”有效量”是指经测定在哺乳动物中产生任何治疗反应的cd30l抗原结合蛋白的量。所述治疗有效量可由本领域普通技术人员容易地确定。用于本发明的目的,术语“病”、“疾病”、“医学病况”、“异常病况”、“疾患”、“医学病症”、“病症”和其类似术语可互换使用。抗原结合蛋白对于构成可行的治疗剂无需实现完全治愈或根除疾病的每一种症状或表现。如相关领域中认可,用作治疗剂的药物可降低给定疾病病况的严重性,但无需根除疾病的每一种表现,即可视为有用治疗剂。类似地,预防性施用的治疗对于构成可行的预防剂无需完全有效性预防病况发作。仅降低疾病影响(例如通过降低其症状数目或严重性,或通过增加另一种治疗的有效性,或通过产生另一种有益作用)或降低主体中疾病发作或恶化的可能性是足够的。本文中提供的某些方法包含以足以诱导与反映特定病症的严重性的指标的基线相比产生持续改善的量和时间向患者施用cd30l拮抗剂(诸如本文中公开的抗原结合蛋白)。如相关领域中所理解,以适用于适应症的方式将包含本发明分子的药物组合物施用于患者。可通过任何合适技术(包括但不限于肠胃外、局部或通过吸入)施用药物组合物。如果进行注射,则可例如经由关节内、静脉内、肌内、病灶内(intralesional)、腹膜内或皮下途径通过快速浓注或连续输注施用药物组合物。涵盖例如在疾病或损伤部位处的局部施用,也涵盖经皮递送和从植入剂持续释放。通过吸入递送包括例如鼻或口腔吸入,使用喷雾器、以气溶胶形式吸入拮抗剂,等。其他替代方式包括滴眼剂;口服制剂,包括丸剂、糖浆、锭剂或口嚼胶;和局部制剂,诸如洗剂、凝胶、喷雾剂和软膏剂。还涵盖在离体程序中使用抗原结合蛋白。例如,可使患者血液或其他体液与抗原结合蛋白(其离体结合cd30l)接触。抗原结合蛋白可结合于合适不可溶基质或固体载体物质。有利的是,抗原结合蛋白以包含一种或多种其他组分(诸如生理学上可接受的载体、赋形剂或稀释剂)的组合物的形式施用。组合物任选地额外包含一种或多种用于组合治疗的生理学活性剂。药物组合物可包含cd30l抗原结合蛋白以及一种或多种选自以下的物质:缓冲剂、抗氧化剂(诸如抗坏血酸)、低分子量多肽(诸如具有小于10个氨基酸的多肽)、蛋白、氨基酸、碳水化合物(诸如葡萄糖、蔗糖或糊精)、螯合剂(诸如edta)、谷胱甘肽、稳定剂和赋形剂。与同种血清白蛋白混合的中性缓冲盐水或盐水为合适稀释剂的实例。根据适当工业标准,也可添加防腐剂,诸如苯甲醇。可使用合适赋形剂溶液(例如蔗糖)作为稀释剂将组合物配制为冻干产物。合适组分在所用剂量和浓度下对受体无毒。可用于药物制剂中的组分的其他实例呈现于任一remington’spharmaceuticalsciences中,包括第21版(2005),mackpublishingcompany,easton,pa。供医学操作者使用的试剂盒包括用于治疗本文中论述的任一种病况的cd30l抗原结合蛋白和标签或其他说明。在一个实施方案中,试剂盒包括一种或多种cd30l结合型抗原结合蛋白的无菌制剂,其可以是上文公开的组合物形式且可处于一个或多个小瓶中。剂量和施用频率可根据诸如施用途径、所用特定抗原结合蛋白、待治疗的疾病的性质和严重性、病况是否为急性或慢性和主体的体型和总体状况的因素而变化。合适剂量可通过相关技术中已知的程序确定,例如在可涉及剂量递增研究的临床试验中。根据上述因素,典型剂量可在约0.1μg/kg至多达约30mg/kg或30mg/kg以上范围内。在特定实施方案中,剂量可在0.1μg/kg直至约30mg/kg范围内,任选地为1μg/kg直至约30mg/kg,任选地为10μg/kg直至约10mg/kg,任选地为约0.1mg/kg至5mg/kg或任选地为约0.3mg/kg至3mg/kg。给药频率将取决于所用制剂中特定cd30l抗原结合蛋白的药代动力学参数。通常,临床医师施用组合物直至达到实现所需作用的剂量。因此,组合物可随时间以单次剂量或以两次或两次以上剂量(其可能含有或可能不含相同量的所需分子)施用,或经由植入装置或导管以连续输注形式施用。可使用合适剂量-反应数据确定合适剂量。本发明的cd30l抗原结合蛋白可例如一次性或不止一次施用,例如在一段时间内以固定时间间隔施用。在特定实施方案中,在至少1个月或1个月以上时间内(例如1、2或3个月或甚至无限期)施用cd30l抗原结合蛋白。对于治疗慢性病况,长期治疗通常最有效。然而,对于治疗急性病况,短期施用(例如1至6周)可以是足够的。通常,施用抗原结合蛋白直至患者与所选一种或多种指标的基线相比呈现医学相关程度的改善。考虑以足以诱导至少一个反映所治疗的病症的严重性的指标改善(优选持续改善)的量和时间向患者施用cd30l抗原结合蛋白。可评估多种反映患者病患、疾病或病况程度的指标以确定治疗量和时间是否足够。所述指标包括例如所述病症的疾病严重性、症状或表现的临床认可指标。在一个实施方案中,如果主体在至少两个间隔2至4周的时刻呈现改善,则认为改善为持续的。改善程度通常由医师确定,医师可基于体征、症状、活组织检验或其他测试结果来进行该确定且也可使用向主体发放的调查问卷(诸如针对给定疾病开发的生活质量调查问卷)。本发明的方法和组合物的特定实施方案涉及使用cd30l抗原结合蛋白和一种或多种其他cd30l拮抗剂,例如两种或两种以上本发明的抗原结合蛋白,或本发明的抗原结合蛋白与一种或多种其他cd30l拮抗剂。还提供cd30l抗原结合蛋白,其可单独施用或与其他适用于治疗患者所患有的病况的药剂组合施用。所述药剂的实例包括蛋白类药物和非蛋白类药物。所述药剂包括例如tnfα、il-1、il-2、rank或其他可促进自身免疫或慢性炎症的细胞因子的拮抗剂。细胞因子拮抗剂包括靶向细胞因子和/或其受体的拮抗剂。靶向细胞因子的拮抗剂可包含针对细胞因子的可溶性受体且通常包括细胞因子的受体的部分或所有胞外结构域。可溶性细胞因子受体可以作为单体或二聚体或更高级多聚体(例如作为融合分子,其中可溶性受体连接至人免疫球蛋白的二聚体促进的fc部分)形式使用。在其他实施方案中,可溶性细胞因子受体经聚乙二醇化以延长其血清半衰期。在一些实施方案中,可溶性细胞因子拮抗剂包含可溶性tnf受体(i型或ii型)。抑制炎性细胞因子的小有机分子也可与目标治疗剂组合使用。可同时施用一种以上cd30配体抗原结合蛋白和/或其抗原结合区以治疗自身免疫或慢性炎性疾病,且可单独施用或与其他对相同自身免疫或慢性炎性病况有效或经施用以治疗同一患者中的不同病况的药物一起施用。当共同施用多种治疗剂时,如相关技术中公认或已知,可相应调节剂量。所述药剂可同时、依序、交替或根据任何其他使总疗程有效的方案施用。除人患者外,cd30l抗原结合蛋白还可用于治疗非人动物,诸如家养宠物(犬、猫、鸟、灵长类动物等)、家养农用动物(马、牛、绵羊、猪、鸟等)。在所述情况下,可根据动物体重确定合适剂量。例如,可使用0.2mg/kg至1mg/kg的剂量。或者,根据动物表面积确定剂量,示例性剂量范围为0.1mg/m2至20mg/m2,或更优选为5mg/m2至12mg/m2。对于小型动物(诸如犬或猫),合适剂量为0.4mg/kg。通过注射或其他合适途径每周一或多次施用cd30l抗原结合蛋白(优选由来源于受体物种的基因构建)直至动物的病况得到改善,或其可无限期施用。以下实施方案和实施例(包括所进行的实验和所得结果)仅出于说明目的而提供且不应视为限制随附权利要求的范围。实施方案1.结合cd30l的分离的抗原结合蛋白,其包含至少一个包含选自以下的cdrh1、cdrh2和cdrh3的重链可变区:a)与如表3中所示的cdrh1相差不超过4个氨基酸取代、插入或缺失的cdrh1;b)与如表3中所示的cdrh2相差不超过7个氨基酸取代、插入和/或缺失的cdrh2;c)与如表3中所示的cdrh3相差不超过11个氨基酸取代、插入和/或缺失的cdrh3;和包含至少一个包含选自以下的cdrl1、cdrl2和cdrl3的轻链可变区:d)与如表3中所示的cdrl1相差不超过4个氨基酸取代、插入和/或缺失的cdrl1;e)与如表3中所示的cdrl2相差不超过2个氨基酸取代、插入或缺失的cdrl2;f)与如表3中所示的cdrl3相差不超过2个氨基酸取代、插入或缺失的cdrl3。2.实施方案1的分离的抗原结合蛋白,其包含:选自seqidnos:14、15、16、17、18和33的cdrh1;选自seqidnos:19、20、21、22、23、24和34的cdrh2;选自seqidnos:25、26、27、28、29和35的cdrh3;选自seqidnos:l、2、3、4、5、6和30的cdrl1;选自seqidnos:7、8、9、10和31的cdrl2;和选自seqidnos:11、12、13和32的cdrl3。3.结合人cd30l的分离的抗原结合蛋白,其包含至少一个选自以下的轻链可变区:a)包含cdr1、cdr2和cdr3的轻链可变区,其中cdr1包含seqidnos:36、28、40、42或44的氨基酸残基23至36,cdr2包含seqidnos:36、28、40、42或44的氨基酸残基52至58且cdr3包含seqidnos:36、28、40、42或44的氨基酸残基91至100;或b)包含cdr1、cdr2和cdr3的轻链可变区,其中cdr1包含seqidno:46的氨基酸残基25至36,cdr2包含seqidno:46的氨基酸残基52至58且cdr3包含seqidno:46的氨基酸残基91至100;和至少一个包含cdr1、cdr2和cdr3的重链可变区,其中cdr1包含seqidnos:48、50、52、54、56、58、60、62、64、66、68、70或72的氨基酸残基31至35,cdr2包含seqidnos:48、50、52、54、56、58、60、62、64、66、68、70或72的氨基酸残基50至65且cdr3包含seqidnos:48、50、52、54、56、58、60、62、64、66、68、70或72的氨基酸残基98至113。4.权利要求1的分离的抗原结合蛋白,其包含至少一个重链可变区和至少一个轻链可变区。5.实施方案1的分离的抗原结合蛋白,其包含至少两个重链可变区和至少两个轻链可变区。6.结合cd30l的分离的抗原结合蛋白,其包含重链可变区和轻链可变区,其中重链可变区序列与如表2中所示的重链可变区序列相差不超过31个氨基酸取代、添加和/或缺失;且其中轻链可变区序列与如表1中所示的轻链可变区序列相差不超过30个氨基酸取代、添加和/或缺失。7.结合cd30l的分离的抗原结合蛋白,其包含重链可变区,其包含与seqidno:48、50、52、54、56、58、60、62、64、66、68、70和72具有至少80%序列同一性的氨基酸序列;和轻链可变区,其包含与seqidno:36、38、40、42、44和46具有至少88%序列同一性的氨基酸序列。8.结合cd30l的分离的抗原结合蛋白,其选自以下a)分离的抗原结合蛋白,其包含选自seqidnos:48、50、52、54、56、58、60和62的重链可变区和seqidnos:36的轻链可变区;b)分离的抗原结合蛋白,其包含seqidno:64的重链可变区和seqidno:38的轻链可变区;c)分离的抗原结合蛋白,其包含seqidno:66的重链可变区和seqidno:40的轻链可变区;d)分离的抗原结合蛋白,其包含seqidno:68的重链可变区和seqidno:42的轻链可变区;e)分离的抗原结合蛋白,其包含seqidno:70的重链可变区和seqidno:44的轻链可变区;和f)分离的抗原结合蛋白,其包含seqidno:72的重链可变区和seqidno:46的轻链可变区。9.前述实施方案1至8中任一项的分离的抗原结合蛋白,其中所述抗原结合蛋白为抗体。10.实施方案9的分离的抗原结合蛋白,其中所述抗体为单克隆抗体、重组抗体、人抗体、人源化抗体、嵌合抗体、多特异性抗体或其抗体片段。11.实施方案10的分离的抗原结合蛋白,其中所述抗体片段为fab片段、fab'片段、f(ab')2片段、fv片段、双抗体或单链抗体分子。12.实施方案10的分离的抗原结合蛋白,其中所述抗原结合蛋白为人抗体。13.实施方案10的分离的抗原结合蛋白,其中所述抗原结合蛋白为单克隆抗体。14.实施方案9的分离的抗原结合蛋白,其中所述抗原结合蛋白为iggl型、igg2型、igg3型或igg4型。15.实施方案14的分离的抗原结合蛋白,其中所述抗原结合蛋白为iggl型或igg2型。16.前述实施方案中任一项的分离的抗原结合蛋白,其中所述抗原结合蛋白具有至少一种选自以下的性质:a)抑制cd30/cd30l相互作用;b)抑制cd30l诱导的il-8诱导作用;c)与抗体a-f中的一种交叉竞争结合人cd30l;d)解离常数≤70pm;和e)以与抗体a-f中的一种实质上相同的kd结合于人cd30l。17.结合cd30l的分离的抗原结合蛋白,其中所述抗原结合蛋白结合cd30l中由aa201至234,或诸如aa205至230或aa211-226,界定的c末端区域。18.实施方案17的分离的抗原结合蛋白,其中所述抗原结合蛋白结合cd30l中由aa75至95,诸如aa80至90或aa82-88,界定的其他区域。19.实施方案17或18的分离的抗原结合蛋白,其中所述抗原结合蛋白具有至少一种选自以下的性质:a)抑制cd30/cd30l相互作用;b)抑制cd30l诱导的il-8诱导作用;c)与抗体a-f中的一种交叉竞争结合人cd30l;d)对人cd30l的解离常数为至多70pm;和e)以与抗体a-f中的一种实质上相同的或更低的kd结合于人cd30l。20.前述实施方案17-19中任一项的分离的抗原结合蛋白,其中所述抗原结合蛋白与hcd30l的结合受抗体a、b、c、d、e和f中的一种或多种的fab的结合的抑制。21.前述实施方案17-19中任一项的分离的抗原结合蛋白,其中所述抗原结合蛋白与抗体a、b、c、d、e和f中的一种或多种的fab竞争结合cd30l。22.实施方案20-21中任一项的分离的抗原结合蛋白,其中所述fab是抗体a1的fab。23.前述实施方案17-22中任一项的分离的抗原结合蛋白,其中所述抗原结合蛋白对人cd30l的解离常数(kd)为至多75pm,诸如至多50pm,诸如40pm。24.前述实施方案17-23中任一项的分离的抗原结合蛋白,其包含cdrh1、cdrh2和cdrh3以及cdrl1、cdrl2和cdrl3,其中cdrl1为seqidno:30的cdrl1共有序列,其中cdrl2为seqidno:31的cdrl2共有序列,其中cdrl3为seqidno:32的cdrl3共有序列,其中cdrh1为seqidno:33的cdrh1共有序列,其中cdrh2为seqidno:34的cdrh2共有序列;和其中cdrh3为seqidno:35的cdrh3共有序列。25.前述实施方案17-23中任一项的分离的抗原结合蛋白,其包含cdrh1、cdrh2和cdrh3以及cdrl1、cdrl2和cdrl3,其中cdrl1为seqidno:30的cdrl1共有序列,其中cdrl2为seqidno:31的cdrl2共有序列,其中cdrl3为seqidno:32的cdrl3共有序列,其中cdrh1为seqidno:17的序列或seqidno:75的cdrh1共有序列,其中cdrh2为seqidno:34的cdrh2共有序列;和其中cdrh3为seqidno:35的cdrh3共有序列。26.前述实施方案17-23中任一项的分离的抗原结合蛋白,其包含cdrh1、cdrh2和cdrh3其中cdrl1为seqidno:30的cdrl1共有序列,其中cdrl2为seqidno:31的cdrl2共有序列,其中cdrl3为seqidno:32的cdrl3共有序列,以及cdrl1、cdrl2和cdrl3,其中cdrh1为seqidno:17的序列或seqidno:75的cdrh1共有序列,其中cdrh2选自序列idno:19、20、21、22、23和24,和其中cdrh3为seqidno:35的cdrh3共有序列。27.前述实施方案17-23中任一项的分离的抗原结合蛋白,其包含cdrh1、cdrh2和cdrh3其中cdrl1为seqidno:30的cdrl1共有序列,其中cdrl2为seqidno:31的cdrl2共有序列,其中cdrl3为seqidno:32的cdrl3共有序列,以及cdrl1、cdrl2和cdrl3,其中cdrh1为seqidno:17的序列或seqidno:75的cdrh1共有序列,其中cdrh2选自seqidno:19、20、21、22、23和24,和其中cdrh3选自seqidno:25、26、27、28和29。28.前述实施方案17-23中任一项的分离的抗原结合蛋白,其包含:选自seqidnos:14、15、16、17和18的cdrh1;选自seqidnos:19、20、21、22、23和24的cdrh2;选自seqidnos:25、26、27、28和29的cdrh3;选自seqidnos:1、2、3、4、5和6的cdrl1;选自seqidnos:7、8、9和10的cdrl2;和选自seqidnos:11、12和13的cdrl3。29.前述实施方案17-23中任一项的分离的抗原结合蛋白,其包含:a)由seqidnos:14、19、25标识的cdrh1、cdrh2和cdrh3以及由seqidnos:l、7和11标识的cdrl1、cdrl2和cdrl3,b)由seqidnos:15、21、26标识的cdrh1、cdrh2和cdrh3以及由seqidnos:2、8和12标识的cdrl1、cdrl2和cdrl3,c)由seqidnos:15、21、26标识的cdrh1、cdrh2和cdrh3以及由seqidnos:3、8和12标识的cdrl1、cdrl2和cdrl3,d)由seqidnos:16、22、27标识的cdrh1、cdrh2和cdrh3以及由seqidnos:4、9和12标识的cdrl1、cdrl2和cdrl3,e)由seqidnos:17、23、28标识的cdrh1、cdrh2和cdrh3以及由seqidnos:5、8和13标识的cdrl1、cdrl2和cdrl3,或f)由seqidnos:18、24、29标识的cdrh1、cdrh2和cdrh3以及由seqidnos:6、10和12标识的cdrl1、cdrl2和cdrl3。30.抗原结合蛋白,其与实施方案1-29中任一项的至少一种抗原结合蛋白竞争。31.实施方案1-29中任一项的抗原结合蛋白,其经完全或部分无岩藻糖基化。32.分离的核酸分子,其编码前述实施方案中任一项的抗原结合蛋白。33.实施方案32的分离的核酸分子,其中至少一个重链可变区是由选自seqidnos:49、51、53、55、57、59、61、63、65、67、69、71和73的分离的核酸分子编码且至少一个轻链可变区是由选自seqidnos:37、39、41、43、45和47的分离的核酸分子编码。34.实施方案33的核酸分子,其中所述核酸分子与控制序列可操作地连接。35.载体,其包含实施方案32的核酸分子。36.宿主细胞,其包含实施方案32的核酸分子。37.宿主细胞,其包含实施方案35的载体。38.分离的多核苷酸,其足以用作杂交探针、pcr引物或测序引物,其为实施方案33或34的核酸分子的片段或其互补序列。39.制备实施方案1至31中任一项的抗原结合蛋白的方法,其包括由分泌所述抗原结合蛋白的宿主细胞制备所述抗原结合蛋白的步骤。40.药物组合物,其包含至少一种实施方案1至31中任一项的抗原结合蛋白和药学上可接受的赋形剂。41.实施方案40的药物组合物,其进一步包含标记基团或效应物基团。42.实施方案41的药物组合物,其中所述标记基团选自同位素标记、磁性标记、氧化还原活性部分、光学染料、生物素化基团和由二级报道分子识别的预定多肽表位。43.实施方案42的药物组合物,其中所述效应物基团选自放射性同位素、放射性核素、毒素、治疗基团和化学治疗基团。44.治疗或预防患者中与cd30l相关的病况的方法,其包括向有其需要的患者施用有效量的实施方案1至31中任一项的至少一种分离的抗原结合蛋白。45.实施方案44的方法,其中所述分离的抗原结合蛋白是单独施用或作为组合治疗施用。46.降低患者中cd30l活性的方法,其包括施用有效量的实施方案1至31中任一项的至少一种抗原结合蛋白。47.前述实施方案1至31中任一项的抗原结合蛋白,其用于治疗方法。48.前述实施方案1至31中任一项的抗原结合蛋白,其用于治疗炎性疾病。49.前述实施方案1至31中任一项的抗原结合蛋白,其用于治疗自身免疫疾病,诸如关节炎(包括类风湿性关节炎(ra))和全身性红斑狼疮(sle)、炎性肠疾病(ibd),包括克罗恩氏病和溃疡性结肠炎。本申请还包括以下实施方案:实施方案一.结合cd30l的分离的抗原结合蛋白,其中所述抗原结合蛋白结合由aa201-234界定的cd30l的c末端区域。实施方案二.实施方案一的分离的抗原结合蛋白,其中所述抗原结合蛋白结合由aa75-95界定的cd30l的另一区域。实施方案三.实施方案一或二的分离的抗原结合蛋白,其中所述抗原结合蛋白具有至少一种选自以下的性质:a)抑制cd30/cd30l相互作用;b)抑制cd30l诱导的il-8诱导作用;c)与抗体a-f中的一种交叉竞争结合人cd30l;d)对人cd30l的解离常数为至多70pm和e)以与抗体a-f中的一种实质上相同的或更低的kd结合人cd30l。实施方案四.前述实施方案一至三中任一项的分离的抗原结合蛋白,其中所述抗原结合蛋白与抗体a、b、c、d、e和f中的一种或多种的fab竞争结合cd30l。实施方案五.结合cd30l的分离的抗原结合蛋白,其包含cdrh1、cdrh2和cdrh3以及cdrl1、cdrl2和cdrl3,其中cdrl1为seqidno:30的cdrl1共有序列,其中cdrl2为seqidno:31的cdrl2共有序列,其中cdrl3为seqidno:32的cdrl3共有序列,其中cdrh1为seqidno:33的cdrh1共有序列,其中cdrh2为seqidno:34的cdrh2共有序列,和其中cdrh3为seqidno:35的cdrh3共有序列。实施方案六.实施方案五的分离的抗原结合蛋白,其包含:选自seqidnos:14、15、16、17和18的cdrh1;选自seqidnos:19、20、21、22、23和24的cdrh2;选自seqidnos:25、26、27、28和29的cdrh3;选自seqidnos:l、2、3、4、5和6的cdrl1;选自seqidnos:7、8、9和10的cdrl2;和选自seqidnos:11、12和13的cdrl3。实施方案七.实施方案五的分离的抗原结合蛋白,其包含:a)由seqidnos:14、19、25标识的cdrh1、cdrh2和cdrh3以及由seqidno:l、7和11标识的cdrl1、cdrl2和cdrl3,b)由seqidnos:15、21、26标识的cdrh1、cdrh2和cdrh3以及由seqidno:2、8和12标识的cdrl1、cdrl2和cdrl3,c)由seqidnos:15、21、26标识的cdrh1、cdrh2和cdrh3以及由seqidno:3、8和12标识的cdrl1、cdrl2和cdrl3,d)由seqidnos:16、22、27标识的cdrh1、cdrh2和cdrh3以及由seqidno:4、9和12标识的cdrl1、cdrl2和cdrl3,e)由seqidnos:17、23、28标识的cdrh1、cdrh2和cdrh3以及由seqidno:5、8和13标识的cdrl1、cdrl2和cdrl3,或f)由seqidnos:18、24、29标识的cdrh1、cdrh2和cdrh3以及由seqidno:6、10和12标识的cdrl1、cdrl2和cdrl3。实施方案八.结合cd30l的分离的抗原结合蛋白,其选自:a)分离的抗原结合蛋白,其包含选自seqidnos:48、50、52、54、56、58、60和62的重链可变区和seqidno:36的轻链可变区;b)分离的抗原结合蛋白,其包含seqidno:64的重链可变区和seqidno:38的轻链可变区;c)分离的抗原结合蛋白,其包含seqidno:66的重链可变区和seqidno:40的轻链可变区;d)分离的抗原结合蛋白,其包含seqidno:68的重链可变区和seqidno:42的轻链可变区;e)分离的抗原结合蛋白,其包含seqidno:70的重链可变区和seqidno:44的轻链可变区;和f)分离的抗原结合蛋白,其包含seqidno:72的重链可变区和seqidno:46的轻链可变区。实施方案九.实施方案一、五或八的分离的抗原结合蛋白,其中所述抗原结合蛋白为抗体。实施方案十.实施方案九的分离的抗原结合蛋白,其中所述抗原结合蛋白为iggl型、igg2型、igg3型或igg4型。实施方案十一.药物组合物,其包含实施方案一、五或八的至少一种抗原结合蛋白和药学上可接受的赋形剂。实施方案十二.治疗或预防患者中与cd30l相关的病况的方法,其包括向有其需要的患者施用有效量的实施方案一、五或八的至少一种分离的抗原结合蛋白。实施方案十三.降低患者中cd30l活性的方法,其包括施用有效量的实施方案一、五或八的至少一种抗原结合蛋白。实施方案十四.分离的核酸分子,其编码实施方案一、五或八的抗原结合蛋白。实施方案十五.宿主细胞,其包含实施方案十四的核酸分子。实施例实施例1产生人cd30l抗体使用xenomousetm技术(amgen,thousandoaks,ca)开发识别和抑制重组人cd30l活性的人单克隆抗体。所选抗体与人和食蟹猴cd30l交叉反应,但不与小鼠cd30l交叉反应。通过荧光微量测定法技术(fmat)针对与表达于293t细胞上的重组人cd30l的结合筛选杂交瘤上清液以及通过荧光活化细胞分选(facs)分析针对与ramos细胞上天然人cd30l的结合筛选杂交瘤上清液。在fmat测定法中,用表达cd30l的293t细胞包被板,添加杂交瘤上清液且然后添加二级抗人ig抗体以经由标准elisa技术进行检测。阴性对照为相应未经转染的293t细胞,其不表达cd30l。纯化上清液且重组抗体表达为iggl和igg2构建体。再次关于与天然人和食蟹猴cd30l的结合筛选抗体。简而言之,人伯基特氏淋巴瘤(burkitt’slymphoma)ramos细胞(3x105个/孔)在圆底96孔微量滴定板(96孔板(corning;acton,ma))中与滴定量(最终浓度为10μg/ml至3.2ng/ml)的抗cd30ligg抗体一起于封闭缓冲液(含有0.02%叠氮化钠、2%正常山羊血清和1%正常家兔血清的pbs)中孵育。包括人cd30.fc融合蛋白作为结合的阳性对照。细胞在4℃下孵育30分钟,然后用pbs洗涤2次,且再在4℃下与30μl/孔抗huigg-生物素(1:50于封闭缓冲液中;jacksonimmunoresearch,westgrove,pa)一起孵育30分钟。在用pbs洗涤2次后,细胞与30μl/孔(pbs中的1:50稀释)链霉抗生物素蛋白-藻红蛋白(pe;molecularprobes,eugene,or)一起在4℃下孵育30分钟。细胞用pbs洗涤2次且准备用于facs分析。结果可见于表5中。通过对isolymph进行密度离心(2000rpm,20分钟)从肝素化食蟹猴血液分离外周血单核细胞(pbmc)来制备食蟹猴活化t细胞。pbmc再悬浮于25mlpbs中,添加至300μl50%经2-氨基乙基异硫脲溴化物(aet)处理的绵羊红细胞溶液中且在4℃下于约700rpm下离心10分钟。沉淀细胞在4℃下再孵育20分钟,温和再悬浮且对isolymph离心。上清液下移至t细胞/红细胞沉淀中。然后将沉淀再悬浮于25ml裂解缓冲液(含0.85%氯化铵的水)中且在37℃下孵育10分钟。将所得t细胞沉淀且在培养基(rpmi-1640培养基+10%热失活胎牛血清)中洗涤2次,且然后在37℃下于10ng/ml佛波醇十四酸酯乙酸酯(phorbolmyristateacetate)(pma;sigmachemicals,stlouis,mo)和500ng/ml离子霉素(ionomycin)(calbiochem,sanfrancisco,ca)存在的情况下培养(1x106/ml)18小时。在培养期结束时,对食蟹猴t细胞进行计数且用pbs洗涤1次,且与2%山羊血清、1%兔血清和0.1%人血清一起于pbs中在4℃下孵育30分钟。然后细胞用如上文关于人ramos细胞所述的抗hucd30l抗体染色。结果可见于表5中。还关于阻断人cd30l与可溶性人cd30.fc分子的结合的能力筛选抗体。简而言之,人ramos细胞或活化的食蟹猴t细胞与50μg/ml抗cd30ligg一起在封闭缓冲液中于4℃下孵育30分钟。然后添加可溶性hucd30.fc-his,最终浓度为2.5μg/ml(30μl/孔)且在4℃下孵育30分钟。细胞用pbs洗涤2次且与5μg/ml小鼠抗his单克隆抗体(30μl/孔于封闭缓冲液中)一起孵育且在4℃下孵育30分钟。在用pbs洗涤2次后,细胞与抗小鼠igg-pe(1:50于pbs中;bdpharmingen,sandiego,ca)一起在4℃下再孵育30分钟。然后细胞用pbs洗涤2次且准备用于facs分析。结果可见于表5中。实施例2cd30l抗体功能性筛选使用两种il-8释放测定法针对其阻断cd30l/cd30相互作用的能力表征抗体。这些测定法使用人间变性大细胞淋巴瘤(alcl)细胞系karpas-299(k299),其表达内源cd30且响应于cd30l而释放il-8。简而言之,纯化的抗人cd30ligg抗体与重组cd30l(单细胞测定法)或表达天然cd30l的ramos细胞(双细胞测定法)一起孵育且与k299细胞一起培养。在预定孵育期后,收集细胞上清液且使用夹心elisa分析il-8含量以确定抗体候选物对从k299细胞中响应于cd30l释放il-8的抑制。单细胞测定法将抗-cd30ligg抗体滴定至培养物稀释物(rpmi-1640培养基+10%热失活胎牛血清)中且置于圆底96孔微量滴定板(96孔板(corning;acton,ma))中使最终浓度范围为1μg/ml至10pg/ml。如美国专利号5,480,981中所述制备小鼠抗人cd30l单克隆抗体作为阳性对照。稀释物和cd30ligg的最终体积为100μl/孔。然后向各孔中添加50μl重组人cd30l异亮氨酸拉链(hucd30llz)。hucd30llz构建体由人cd30l的胞外结构域(参见美国专利号5,480,981)组成,所述人cd30l的胞外结构域在其n末端连接至通过用异亮氨酸残基置换亮氨酸残基而修饰的异亮氨酸拉链基序。使用食蟹猴cd30llz替代hucd30llz,还使用单细胞测定法确定食蟹猴交叉反应性。如关于人lz分子所述制备食蟹猴cd30llz。板在室温下孵育45分钟。向各孔中添加50μlk299细胞(4xl05个细胞/ml)。然后板在37℃和5%co2下孵育24小时。根据制造商说明书(r&dsystems,minneapolis,mn)使用cdcl8/il-8elisaduoset试剂盒通过夹心elisa测定细胞上清液中il-8的量。使用deltasoft3软件(版本2.2)(deltasoft,inc.hillsborough,nj)从elisa标准曲线由内插法获得il-8水平。所有结果均表示为3份复制培养物的由graphpadprism软件v.4.01(graphpadsoftwareinc.,sandiego,ca)计算的平均值±平均值标准误差(sem),ic50值也是如此。使用hucd30llz获得的抗体a1的ic50值为2700pm。使用食蟹猴cd30llz的结果可见于表5中。双细胞测定法如上所述,将抗cd30ligg抗体滴定至培养物稀释物中且置于圆底96孔微量滴定板中使最终浓度范围为1μg/ml至10pg/ml。稀释物和cd30ligg的最终体积为100μl/孔。向各孔中添加50μl经照射(5000rads)的cd30l+ramos细胞(4x106/ml,atcc)。使ramos细胞经facs分选以选择具有最高细胞表面cd30l表达水平的细胞。板在室温下孵育45分钟。向各孔中添加50μlk299细胞(4xl05个细胞/ml)。板在37℃和5%co2下孵育24小时。根据制造商说明书(r&dsystems,minneapolis,mn)使用cdcl8/il-8elisaduoset试剂盒通过夹心elisa测定培养物上清液中il-8的量。il-8量和ic50值如上所述计算,参见表5。基于与小鼠抗人cd30l单克隆抗体对照相比其抑制cd30l诱导的il-8诱导作用的能力选择抗体前导物(antibodyleads)。表5各种功能性测定法中cd30l抗体的平均ic50(pm)和%抑制的表实施例3通过结合竞争对cd30l抗体进行分级(binning)使用结合竞争测定法进行分级,其中1种标记的cd30l抗体与过量的其他未标记的cd30l抗体针对与rhcd30l的结合进行竞争。彼此竞争的抗体分类为相同等级。抗体a-f彼此针对与rhcd30l的结合进行竞争。实施例4测定cd30l抗体的细胞上平衡解离常数(kd)通过facskd方法测定cd30l抗体与表达于ramos细胞上的cd30l的结合亲和力。ramos细胞于rmpi1640培养基+10%fbs+l-glut+0.05%叠氮化物中培养。建立两个平衡反应,其中使用细胞培养基以1:3将抗体从60nm滴定至338fm,且在两种不同恒定细胞浓度(25000个和250000个细胞)下孵育。板用parafilm密封且在37℃下于摇动下孵育20小时。将平衡板离心且细胞沉淀用冰冷的facs缓冲液(1xd-pbs+2%fbs)洗涤两次。然后细胞与二级抗体山羊抗人fccy5(jacksonimmunoresearch,westgrove,pa,)一起和与7aad(bd-biosciences,rockville,md)一起在黑暗中于冰上孵育1小时。在孵育后,细胞用冰冷的facs缓冲液洗涤两次,随后进行流式细胞术分析。门控于活细胞群体上fl4位移的几何平均值测量结合[ab]。然后计算几何平均值的倒数,其反映平衡溶液中的理论自由(theoreticalfree)[ag]。在kinexa软件中使用几何平均读数的倒数值进行各抗体的分析和kd计算。绘制自由[ag]测量值与滴定组分的起始浓度的曲线且使用kinexatmpro软件中的n-曲线分析通过曲线拟合从这些曲线在两种不同细胞浓度下获得kd。提供95%置信区间作为kd下限值和kd上限值。如表6所示,抗体对表达于ramos细胞上的cd30l具有高亲和力。所有抗体均具有低pm范围内的kd值。表6.kd(pm)比率的表抗体kd(pm)kd下限值(pm)kd上限值(pm)b7.434.5811.70a25.4618.1533.10d11.908.4416.14e52.0838.2969.56f35.7526.9246.64c43.9934.1556.02。实施例5adcc测定法将a1的可变结构域连接至人iggl恒定结构域(a1igg1)。在fut-8敲除cho细胞系中表达此抗体,产生无岩藻糖基化抗体a1igg1f。在抗体依赖性细胞毒性(adcc)测定法中评估cd30l抗体介导的目标细胞的杀死作用。收集目标细胞ramos(高cd30l表达水平)、jd38(中等cd30l表达水平)、ds179(低cd30l表达水平)和ew36(无cd30l表达),且以2x106个细胞/ml再悬浮于crpmi-10培养基(rpmi(lifetechnologies,carlsberg,ca)+10%胎牛血清)中。添加calcein-am(4mm于无水dmso中)(sigma-aldrich,st.louis,mo)至最终浓度达到10μm(1∶400稀释物)。细胞在37℃下孵育30分钟,然后在pbs中洗涤两次(每次均为1500rpm,5分钟,4℃)。将沉淀再悬浮于crpmi-10中且调节至0.2x106个细胞/ml的浓度,置于冰上以用于下一步骤。首先向u型底96孔板(bd,franklinlakes,nj)中从10μg/ml开始以10倍连续滴定添加抗体a1igg1和抗体a1igg1f。使用利妥昔单抗(rituximab)(genentech,southsanfrancisco,ca)作为阳性抗体对照。添加抗体a1(igg2)作为阴性对照。然后向各孔中添加如上所述的calcein-am标记的目标细胞(10,000个细胞/孔)且与抗体一起在37℃下孵育20分钟。在孵育后,向各孔中添加50μlnk细胞(浓度为4x106个细胞/ml)且在37℃下孵育4小时。将nk细胞沉淀(1500rpm,5分钟,4℃)且再悬浮于crpmi-10中,将细胞浓度调节至4x106个细胞/ml。在孵育后,通过添加20μl/孔9%np-40(igepalca630,sigma-aldrich)以刺激100%裂解来制备对照孔。所有其他孔仅接收20μl/孔crpmi-10培养基。板在4℃下于800rpm下旋转4分钟。移除上清液(150μl)且转移至透明底部黑色96孔板(corning,lowell,ma)中且在板读取器(moleculardevices,spectramaxgemini)上读取荧光读数(激发485,发射535)。最大裂解百分比计算为(样本值-自发性裂解)/(100%裂解-自发性裂解)*l00。cd30l抗体介导的4种目标细胞的杀死作用的结果显示于图1(a-d)中。抗体a1igg1在任一种cd30l表达细胞上均不介导细胞杀死作用(参见图1a-d)。抗体a1igg1f在具有高cd30l表达的目标细胞(参见图1a)和具有中等cd30l表达的目标细胞(参见图1b)上诱导细胞死亡。与具有中等cd30l水平的目标细胞相比,抗体a1igg1f在具有较高cd30l表达的目标细胞上介导更大水平消耗(参见图1a和1b)。抗体a1igg1f未杀死具有低(c)cd30l表达或无(d)cd30l表达的目标细胞。实施例6通过抗cd30lmab的hx-ms进行表位定位通过hx-ms评估抗cd30l抗体的cd30l结合区以鉴定人cd30l中参与与本文所述的抗体a-f的分子相互作用的一个或多个区域。材料hcd30l:使用hcd30l的胞外结构域的两种不同版本,his-hcd30l-ec含有hcd30l的残基63-234(如由seqidno:74标识和如名称所示),产生具有n末端his标签(rndsystems)的蛋白。flag-hcd30l-ec含有seqidno:74的残基66-234且从具有n末端flag-his标签的哺乳动物细胞获得。人cd30l的胞外结构域的cdna购自origene。通过两步骤延伸pcr使flag-his6标签和tev蛋白酶裂解位点与氨基酸66-234的编码序列的n末端融合,且与cd33信号肽在框内(inframe)在pjsv001质粒的ecori与bamhi位点之间进行克隆。下文中所用flag-hcd30l-ec包括n153q点突变,其消除n-糖基化作用。用qiagen快速变化点诱变试剂盒(qiagen)产生n153q突变体。使用hek2936e细胞进行蛋白生产。细胞与补充有25μg/ml遗传霉素418(geneticin418(gibco))和0.1%f-68(gibco)的freestyletm培养基(gibco)一起培养。在转染当天,保持细胞密度为1x106个细胞/ml,且根据制造商说明书用293fectin(invitrogen)转染。在转染后24小时,向培养物中添加蛋白胨(promega)至最终浓度为0.5%。细胞继续生长5天,随后收集上清液。通过离心(15,000rpm×20min,4℃)收集培养物上清液,且然后通过用0.22μm硝酸纤维素膜过滤来使其澄清。将澄清上清液施用于ni-螯合琼脂糖凝胶xk60柱(20ml)(gehealthcare),然后为用20mmnah2po4ph7.4,0.5mnacl的10倍柱体积洗涤。然后蛋白用5倍柱体积的20mmnah2po4ph7.4,0.5mnacl,0.5m咪唑洗脱。合并洗脱的蛋白,通过amiconultra15离心单元(10,000damwco,millipore)浓缩至约5ml且上样至hiload26/60superdex200318ml柱(gehealthcare)上以移除聚集体且将缓冲液更换为pbs。在浓缩后,通过用nanodropuv光谱仪测量280nm吸光度来确定最终蛋白浓度。通过sds-page评估蛋白纯度。每5μghcd30l使用1upngasef(roche)在37℃下进行去糖基化作用约16小时。去糖基化蛋白在4℃下储存且在1周内用于实验。在进行hx-ms实验前,将所有蛋白缓冲液均更换为pbs(ph7.4)。hx-ms实验仪器和数据记录在具有耦合至synaptg2质谱仪(watersinc.)的hdxtechnology(watersinc.)的nanoacquityuplc系统上进行hx实验。watershdx系统含有由leapshell软件(leaptechnologiesinc/watersinc.)操作的leap机器人(h/d-xpal;watersinc.),其进行起始氘交换反应、进行反应时间控制、猝灭反应、对uplc系统的注射和消化时间控制。leap机器人配备有两个温度控制型堆栈,其分别保持于20℃以用于缓冲液储存和hx反应且保持于2℃以用于储存蛋白和猝灭溶液。watershdx系统此外含有温度控制室,其将预柱和分析柱以及lc管道和开关阀保持为1℃。独立温度控制室将胃蛋白酶柱保持为25℃。对于管线内胃蛋白酶消化,上样100μl含有300pmolhcd30l的猝灭样品且使用100μl/min(0.1%甲酸:ch3cn95:5)的等度流动速率使其通过置于25℃下的固定的胃蛋白酶滤筒(2.1×30mm(appliedbiosystems))。捕获所得肽且在vanguard预柱behc181.7μm(2.1×5mm(watersinc.))上脱盐。然后,切换阀门以将预柱与分析柱uplc-behc181.7μm(1×100mm(watersinc.))连线,且使用9分钟的10-50%b(以40μl/min从nanoaquityuplc系统(watersinc.)递送)的梯度分离肽。移动相由a:0.1%甲酸和b:含0.1%甲酸的ch3cn组成。使用synaptg2质谱仪(watersinc.)以阳离子模式获得esims数据和进行独立高能量(mse)实验。使用亮氨酸-脑啡肽作为锁定物质(lockmass)([m+h]+离子,m/z556.2771)且以连续模式收集数据(关于进一步描述,参见andersen和faber,int.j.massspec.,302,139–148(2011))。数据分析在独立实验中使用标准mse方法鉴定胃蛋白酶肽,其中利用synaptg2(watersinc.)的离子迁移性将肽和片段进一步比对。使用proteinlynxglobalserver版本版本2.5(watersinc.)处理mse数据。用dynamx2.0软件(watersinc.)处理hx-ms原始数据文件。dynamx自动进行锁定物质校正和氘并入测定,即氘化肽的质心测定。此外,人工检查所有肽以确保由软件产生的正确峰值和氘化作用分配。表位定位实验在maba、b、c、d、e或f存在或不存在的情况下通过hcd30l的6倍稀释物起始酰胺氢/氘交换(hx),交换至相应氘化缓冲液(即于d2o中制备的pbs,最终96%d2o,ph7.4(未校正值))中。所有hx反应均在6.6μmmab不存在或存在的情况下在20℃下进行且含有6μmhcd30l(所用单体mw),因此使mab摩尔过量2.2倍。在0.25、0.5、1、3和10分钟时间间隔,通过50μl冰冷的猝灭缓冲液(1.35mtcep)猝灭hx反应的50μl等分试样,导致最终ph值为2.5(未校正值)。结果hcd30l蛋白hcd30l中存在糖基化作用将阻碍hxms分析。由于未知物质和蛋白糖基化作用的常见非均匀性,无法在ms中鉴定和分析所得胃蛋白酶肽。然而,从hcd30l去除糖基化作用可产生适用于hxms的界定良好的氨基酸序列,因为其可在ms中鉴定和分析。hcd30l胞外结构域含有5个潜在n-糖基化位点,如下表7的第一栏中所列举。尝试通过用pngasef处理和通过点突变去除糖基化以获得更适用于hxms分析的蛋白。his-hcd30l-ec的ms和sec-mals分析显示5个潜在n-糖基化位点中的4个位点实际上是糖基化的(表7;数据未显示)。在天然条件下用pngasef处理此蛋白后,仅两个糖基化可由pngasef酶促去除,且因此两个n-糖基化保留在蛋白上。在天然条件下用pngasef处理flag-hcd30l-ec后,ms和sec-mals两者均表明此蛋白可完全去糖基化。总之,n153q突变消除无法从his-hcd30l-ec酶促去除的n-糖基化位点,且认为此蛋白对hxms而言是最佳的。表7中包括糖基化位点评估的概述。表7:hcd30l蛋白的不同版本中的糖基化状态d、n、q表示序列位置处存在未经修饰的氨基酸。glyc表示存在n-糖基化。hx-ms分析在氘交换反应后,用胃蛋白酶消化hcd30l-ec,产生表8中描述的胃蛋白酶肽区域。hcd30l残基的编号遵循seqidno74,然而n末端flag-his标签dykddddkhhhhhhenlyfqg不是hcd30l序列的部分。在maba、b、c、d、e或f不存在或存在的情况下监测40个胃蛋白酶肽(覆盖flag-hcd30l-ec的一级结构的83%)的hx时程且数据包括于表8中。本研究中未分析的剩余序列由胃蛋白酶肽覆盖;然而信号强度不足以进行数据分析。在maba1、b、c、d、e或f存在或不存在的情况下在早期时间点(<10分钟)观察到的交换模式可分为两个不同组:一组hcd30l-ec胃蛋白酶肽显示不受mab结合影响的交换模式。相反,另一组hcd30l中的肽显示mab结合后受保护免于交换(表8)。在重叠胃蛋白酶肽情况下,尝试将交换保护信息亚定位至肽内的特定残基或延伸,假设肽n末端和第一肽键的完全回交换(back-exchange)。肽中的交换保护表示此区域参与mab结合。因此,在由特定肽界定的区域内部分或完全定位表位。然而,因为hx-ms的分辨率基于氘化蛋白的胃蛋白酶消化,所以给定区域内的交换保护并非暗示由胃蛋白酶肽界定的区域内的每一残基均必然参与mab结合。maba1的表位定位在4个不同实验中(三次使用flag-hcd30l-ec和一次使用his-hcd30l-ec)定位mabal的表位。在hx-ms实验前,两种蛋白均用pngasef处理。这些研究的结果均高度类似独立于所用hcd30l蛋白且均产生相同表位信息。然而,由于糖基化区域中缺乏可检测肽,所以his-hcd30l-ec实验中的序列覆盖率明显较低。在hcd30l的n末端区域中观察到mabal的表位信号(表8)直至残基cys88。肽从起点(残基45、62或66)延伸的长度越长,则交换保护变得越强,由此表明肽的更c末端区域和残基88中也存在交换保护。相反,肽45-65、45-81和66-81未显示交换保护。此外,残基d81为糖基化位点,其中糖基化n在pngasef作用后变为d。因此,n/d81可能不参与mab结合。因此,表位信号似乎由区域82-88csedllc内的残基产生。也可在覆盖区域f211至s226的六个不同肽中的hcd30l的c末端区域(表8)中观察到mabal的表位信号。基于所观察到的交换保护水平,该区域的所有部分似乎均或多或少地参与maba的结合或受maba的结合影响。表8中由抗体结合的区域标记为粗体。总之,检测到hcd30l中参与结合maba的区域为区域82-88csedllc和区域211-226fqyidtstfplenvls。mabb、c、d、e和f的表位定位在hx-ms实验之前,用pngasef处理的flag-hcd30l-ec定位mabb、c、d、e和f的表位。这些研究的表位结果与maba高度类似(表8)(同样就交换保护的幅度而言)。mabe上的表位定位进行两次,而a、b、c和d各进行一次定位。总之,hcd30l中参与结合mabb、c、d、e和f的区域与参与maba1的结合的区域类似且检测为区域82-88csedllc和区域211-226fqyidtstfplenvls。实施例7使用固定的抗cd30la-fab对cd30l抗体分级将抗人cd30l单克隆抗体使用经典夹心方法在biacoret200(gehealthcare28-9750-01)上表位分级。为了降低位阻,使用单价形式的固定的抗体。为了确定抗hcd30l抗体的抗原结合区域是否结合重叠表位,测试抗体a-f结合已由抗体a1的fab结合的cd30l的能力。fab片段可通过用木瓜蛋白酶(其裂解铰链区的半胱氨酸的上游)消化完整抗体或通过重链和轻链可变区的重组表达而获得。在半胱氨酸存在的情况下使用固定的木瓜蛋白酶以酶促裂解铰链区正上方的完整igg,每个抗体分子生成两个fab片段和1个fc片段,从而制备抗hcd30la1(a1-fab)的fab片段。所述fab使用蛋白a亲和层析从fc分离,然后缓冲液交换为pbs。根据制造商说明书(piercefab制备试剂盒#44985,us)进行程序。将抗人cd30lfab(抗体a1的fab)固定化,并在其上捕获人cd30l-his10三聚体(r&dsystems1028-cl)。然后,注射可溶性抗hcd30la-f。二级抗体的结合意味着两种抗体处于不同的表位分级。将抗hcd30la1-fab在10mm乙酸盐缓冲液ph5.0中稀释至40μg/ml,且使用标准程序胺偶联至cm5芯片(gehealthcarebr-1000-12,br-1000-50)至3566ru的水平。将人cd30l-his10三聚体(r&dsystems1028-cl)在hbs-p+(gehealthcarebr-1006-71)中稀释至10nm,并注射至a-fab表面以捕获约175ru的cd30l。将二级抗体以75nm注射至捕获的hcd30l上。对照包括空捕获(仅缓冲液)且注射缓冲液,而不是可溶性抗体。所有实验均在25℃下进行。用a-fab包被hcd30l阻断抗体a-f的亚组的结合。使用a-fab和a的对照,其中两者都如预期阻断。此外,抗体f和b也被阻止与捕获的hcd30l的结合,而抗体e、c和d能够结合hcd30l,表明这些结合表位可以与a、b和f的结合表位区分。总之,抗体a、f和b与抗体a1的fab针对与hcd30l的结合进行竞争。序列表<110>诺和诺德股份有限公司安姆根有限公司<120>人cd30配体抗原结合蛋白<130>8679.204-wo<160>75<170>patentin版本3.5<210>1<211>14<212>prt<213>智人(homosapiens)<400>1thrglythrserseraspvalglyvaltyrasptyrvalser1510<210>2<211>14<212>prt<213>智人<400>2thrglythrserseraspvalglyleutyrasntyrvalser1510<210>3<211>14<212>prt<213>智人<400>3thrglythrserseraspileglyleutyrasptyrvalser1510<210>4<211>14<212>prt<213>智人<400>4thrglythrserseraspileglyleutyrasntyrvalser1510<210>5<211>14<212>prt<213>智人<400>5thrglyserserseraspileglythrtyrasntyrvalser1510<210>6<211>14<212>prt<213>智人<400>6thrglythrserseraspvalglyleutyrasntyrvalser1510<210>7<211>7<212>prt<213>智人<400>7gluvalserasnargproser15<210>8<211>7<212>prt<213>智人<400>8gluvalasnasnargproser15<210>9<211>7<212>prt<213>智人<400>9gluvalileasnargproser15<210>10<211>7<212>prt<213>智人<400>10gluvalserlysargproser15<210>11<211>10<212>prt<213>智人<400>11sersertyrthrserargserthrtrpval1510<210>12<211>10<212>prt<213>智人<400>12sersertyrthrserserserthrtrpval1510<210>13<211>10<212>prt<213>智人<400>13sersertyrserserserserthrtrpval1510<210>14<211>5<212>prt<213>智人<400>14sertyriletrpser15<210>15<211>5<212>prt<213>智人<400>15sertyrtyrtrpthr15<210>16<211>5<212>prt<213>智人<400>16sertyrsertrpser15<210>17<211>5<212>prt<213>智人<400>17asnasntyrtrpser15<210>18<211>5<212>prt<213>智人<400>18sertyrtyrtrpser15<210>19<211>16<212>prt<213>智人<400>19argiletyralaserglyasnthrasntyrasnproserleulysser151015<210>20<211>16<212>prt<213>智人<400>20argiletyralaserglyglnthrasntyrasnproserleulysser151015<210>21<211>16<212>prt<213>智人<400>21argiletyrthrserglyilethrasntyrasnproserleulysser151015<210>22<211>16<212>prt<213>智人<400>22argthrserthrserglyargasnasntyrasnproserleulysser151015<210>23<211>16<212>prt<213>智人<400>23argvaltyrserserglyleuthrasntyrlysproserleulysser151015<210>24<211>16<212>prt<213>智人<400>24argilephealaserglyserthrasntyrasnproserleuargser151015<210>25<211>16<212>prt<213>智人<400>25asptyrargvalalaglythrtyrtyrtyrtyrtyrglyleuaspval151015<210>26<211>16<212>prt<213>智人<400>26gluargvalvalglyalaserargtyrtyrtyrtyrglyvalaspval151015<210>27<211>16<212>prt<213>智人<400>27aspphethrilealaalaargargtyrtyrtyrtyrglymetaspval151015<210>28<211>16<212>prt<213>智人<400>28gluargalathrvalthrthrargtyrhistyraspglymetaspval151015<210>29<211>16<212>prt<213>智人<400>29gluargvalglyvalglnasptyrtyrhistyrserglymetaspval151015<210>30<211>14<212>prt<213>人工序列<220><223>共有序列<220><221>尚未归类的特征<222>(3)..(3)<223>xaa可以是thr或ser<220><221>尚未归类的特征<222>(7)..(7)<223>xaa可以是val或ile<220><221>尚未归类的特征<222>(9)..(9)<223>xaa可以是val、thr或leu<220><221>尚未归类的特征<222>(11)..(11)<223>xaa可以是asp或asn<400>30thrglyxaaserseraspxaaglyxaatyrxaatyrvalser1510<210>31<211>7<212>prt<213>人工序列<220><223>共有序列<220><221>尚未归类的特征<222>(3)..(3)<223>xaa可以是ser、asn或ile<220><221>尚未归类的特征<222>(4)..(4)<223>xaa可以是asn或lys<400>31gluvalxaaxaaargproser15<210>32<211>10<212>prt<213>人工序列<220><223>共有序列<220><221>尚未归类的特征<222>(4)..(4)<223>xaa可以是thr或ser<220><221>尚未归类的特征<222>(6)..(6)<223>xaa可以是arg或ser<400>32sersertyrxaaserxaaserthrtrpval1510<210>33<211>5<212>prt<213>人工序列<220><223>共有序列<220><221>尚未归类的特征<222>(1)..(1)<223>xaa可以是ser或asn<220><221>尚未归类的特征<222>(2)..(2)<223>xaa可以是tyr或asn<220><221>尚未归类的特征<222>(3)..(3)<223>xaa可以是ile、tyr或ser<220><221>尚未归类的特征<222>(5)..(5)<223>xaa可以是thr或ser<400>33xaaxaaxaatrpxaa15<210>34<211>16<212>prt<213>人工序列<220><223>共有序列<220><221>尚未归类的特征<222>(2)..(2)<223>xaa可以是ile、val或thr<220><221>尚未归类的特征<222>(3)..(3)<223>xaa可以是tyr、phe或ser<220><221>尚未归类的特征<222>(4)..(4)<223>xaa可以是thr、ser或ala<220><221>尚未归类的特征<222>(7)..(7)<223>xaa可以是ile、leu、asn、ser、arg或gln<220><221>尚未归类的特征<222>(8)..(8)<223>xaa可以是thr或asn<220><221>尚未归类的特征<222>(11)..(11)<223>xaa可以是asn或lys<220><221>尚未归类的特征<222>(15)..(15)<223>xaa可以是lys或arg<400>34argxaaxaaxaaserglyxaaxaaasntyrxaaproserleuxaaser151015<210>35<211>16<212>prt<213>人工序列<220><223>共有序列<220><221>尚未归类的特征<222>(1)..(1)<223>xaa可以是glu或asp<220><221>尚未归类的特征<222>(2)..(2)<223>xaa可以是arg、thr或phe<220><221>尚未归类的特征<222>(3)..(3)<223>xaa可以是val、ala、arg或thr<220><221>尚未归类的特征<222>(4)..(4)<223>xaa可以是val、thr、gly或ile<220><221>尚未归类的特征<222>(5)..(5)<223>xaa可以是val、ala或gly<220><221>尚未归类的特征<222>(6)..(6)<223>xaa可以是ala、thr,gly或gln<220><221>尚未归类的特征<222>(7)..(7)<223>xaa可以是thr、asp、arg或ser<220><221>尚未归类的特征<222>(8)..(8)<223>xaa可以是arg或tyr<220><221>尚未归类的特征<222>(10)..(10)<223>xaa可以是thr或his<220><221>尚未归类的特征<222>(12)..(12)<223>xaa可以是thrasp或ser<220><221>尚未归类的特征<222>(14)..(14)<223>xaa可以是met、leu或val<400>35xaaxaaxaaxaaxaaxaaxaaxaatyrxaatyrxaaglyxaaaspval151015<210>36<211>110<212>prt<213>智人<400>36glnseralaleuthrglnproalaservalserglyserproglygln151015serilethrilesercysthrglythrserseraspvalglyvaltyr202530asptyrvalsertrptyrglnglnhisproglylysalaprolysleu354045metiletyrgluvalserasnargproserglyvalserasnargphe505560serglyserlysserglyasnthralaserleuthrileserglyleu65707580glnthrgluaspglualaasptyrtyrcyssersertyrthrserarg859095serthrtrpvalpheglyglyglythrlysleuthrvalleu100105110<210>37<211>326<212>dna<213>智人<400>37cagtctgccctgactcagcctgcctccgtgtctgggtctcctggacagtcgatcaccatc60tcctgcactggaaccagcagtgacgttggtgtttatgactatgtctcctggtatcaacag120cacccaggcaaagcccccaaactcatgatttatgaggtcagtaatcggccctcaggggtt180tctaatcgcttctctggctccaagtctggcaacacggcctccctgaccatctctgggctc240caaactgaggacgaggctgattattactgcagctcatatacaagcaggagcacttgggtg300ttcggcggagggaccaagctgaccgt326<210>38<211>110<212>prt<213>智人<400>38glnseralaleuthrglnproalaservalserglyserproglygln151015serilethrilesercysthrglythrserseraspvalglyleutyr202530asntyrvalsertrptyrglnglnhisproasplysalaprolysleu354045metilephegluvalasnasnargproserglyvalserasnargphe505560serglyserasnserglyasnthralaserleuthrileserglyleu65707580glnalagluaspglualaasptyrtyrcyssersertyrthrserser859095serthrtrpvalpheglyglyglythrlysleuthrvalleu100105110<210>39<211>330<212>dna<213>智人<400>39cagtctgccctgactcagcctgcctccgtgtctgggtctcctggacagtcgatcaccatc60tcctgcactggaaccagcagtgacgttggtctttataactatgtctcctggtaccaacag120cacccagacaaagcccccaaactcatgatttttgaggtcaataatcggccctcaggggtt180tctaatcgcttctctggctccaactctggcaacacggcctccctgaccatctctgggctc240caggctgaggacgaggctgattattactgcagctcatatacaagcagcagcacttgggtg300ttcggcggagggaccaagttgaccgtccta330<210>40<211>110<212>prt<213>智人<400>40glnseralaleuthrglnproalaservalserglyserproglygln151015serilethrilesercysthrglythrserseraspileglyleutyr202530asptyrvalsertrptyrglnglnhisproaspargalaprolysleu354045ileilephegluvalasnasnargproserglyvalsertyrargphe505560serglyserasnserglyasnthralaserleuthrileserglyleu65707580glnalagluaspglualaasptyrtyrcyssersertyrthrserser859095serthrtrpvalpheglyglyglythrlysleuthrvalleu100105110<210>41<211>326<212>dna<213>智人<400>41cagtctgccctgactcagcctgcctccgtgtctgggtctcctggacagtcgatcaccatc60tcctgcactggaaccagcagtgacattggtctttatgactatgtctcctggtaccaacag120cacccagacagagcccccaaactcataatttttgaggtcaataatcggccctcaggggtt180tcttatcgcttctctggctccaactctggcaacacggcctccctgaccatctctgggctc240caggctgaggacgaggctgattattactgcagctcatatacaagcagcagcacttgggtg300ttcggcggagggaccaagttgaccgt326<210>42<211>110<212>prt<213>智人<400>42glnseralaleuthrglnproalaservalserglyserproglygln151015serilethrilesercysthrglythrserseraspileglyleutyr202530asntyrvalsertrptyrglnglnhisproglylysalaprolysleu354045ileiletyrgluvalileasnargproserglyvalserasnargphe505560serglysergluserglyasnthralaserleuthrileserglyleu65707580glnalagluaspglualaasntyrtyrcyssersertyrthrserser859095serthrtrpvalpheglyglyglythrlysleuthrvalleu100105110<210>43<211>330<212>dna<213>智人<400>43cagtctgccctgactcagcctgcctccgtgtctgggtctcctggacagtcgatcaccatc60tcctgcactggaaccagcagtgacattggtctttataactatgtctcctggtaccaacag120cacccaggcaaagcccccaaactcataatttatgaggtcattaatcggccctcaggggtt180tctaatcgcttctctggctccgagtctggcaacacggcctccctgaccatctctggactc240caggctgaggacgaggctaattattactgcagttcatatacaagcagcagcacttgggtg300ttcggcggagggaccaagctgaccgtcctg330<210>44<211>110<212>prt<213>智人<400>44glnseralaleuthrglnproalaservalserglyserproglygln151015serilethrilesercysthrglyserserseraspileglythrtyr202530asntyrvalsertrptyrglnglntyrproglylysalaprogluleu354045metiletyrgluvalasnasnargproserglyvalseraspargphe505560serglyserthrserglyasnthralaserleuthrileserglyleu65707580glnalaasnaspglualaasptyrtyrcyssersertyrserserser859095serthrtrpvalpheglyglyglythrlysleuthrvalleu100105110<210>45<211>326<212>dna<213>智人<400>45cagtctgccctgactcagcctgcctccgtgtctgggtctcctggacagtcgatcaccatc60tcctgcactggaagcagcagtgacattggtacttataactatgtctcctggtaccaacag120tacccaggcaaagcccccgaactcatgatttatgaggtcaataatcggccctcaggggtt180tctgatcgcttctctggctccacgtctggcaatacggcctccctgaccatctctgggctc240caggctaacgacgaggctgattattactgcagctcatattcaagcagcagcacttgggtg300ttcggcggagggactaagctgaccgt326<210>46<211>110<212>prt<213>智人<400>46glnseralaleuthrglnproalaservalserglyserproglygln151015serilethrilesercysthrglythrserseraspvalglyleutyr202530asntyrvalsertrptyrglnglnglnproglylysalaprolysleu354045metiletyrgluvalserlysargproserglyvalserasnargphe505560serglyserthrserglyasnthralaserleuthrileserglyleu65707580glnalaaspaspglualaasptyrsercyssersertyrthrserser859095serthrtrpvalpheglyglyglythrlysleuthrvalleu100105110<210>47<211>322<212>dna<213>智人<400>47cagtctgccctgactcagcctgcctccgtgtctgggtctcctggacagtcgatcaccatc60tcctgcactggaactagcagtgacgttggtctttataactatgtctcctggtaccaacag120cagccaggcaaagcccccaaactcatgatttatgaggtcagtaagcggccctcaggagtt180tctaatcgcttctctggctccacgtctggcaacacggcctccctgaccatctctgggctc240caggctgacgacgaggctgattattcctgcagctcatatacaagcagcagcacttgggtc300ttcggcggagggaccaagctga322<210>48<211>124<212>prt<213>智人<400>48glnvalglnleuglngluserglyproglyleuvallysproserglu151015thrleuserleuthrcysthrvalserglyglyserilesersertyr202530iletrpsertrpileargglnproalaglylysglyleuglutrpile354045glyargiletyralaserglyasnthrasntyrasnproserleulys505560serargvalthrileservalaspthrserlysasnglnpheserleu65707580lysleusersermetthralaalaaspthralavaltyrtyrcysala859095argasptyrargvalalaglythrtyrtyrtyrtyrtyrglyleuasp100105110valtrpglyglnglythrthrvalthrvalserser115120<210>49<211>372<212>dna<213>智人<400>49caggtgcagctgcaggagtcgggcccaggactggtgaagccttcggagaccctgtccctc60acctgcactgtctctggtggctccatcagtagttacatctggagctggatccggcagccc120gccggaaagggactggagtggattgggcgtatctatgccagtgggaacaccaactacaac180ccctccctcaagagtcgagtcaccatatcagtagacacgtccaagaaccagttctccctg240aagctgagctctatgaccgccgcggacacggccgtatattactgtgcgagagattatagg300gtggctggcacttactactactactacggtttggacgtctggggccaagggaccacggtc360accgtctcctca372<210>50<211>124<212>prt<213>智人<400>50glnvalglnleuglngluserglyproglyleuvallysproserglu151015thrleuserleuthrcysthrvalserglyglyserilesersertyr202530iletrpsertrpileargglnproalaglylysglyleuglutrpile354045glyargiletyralaserglyasnthrasntyrasnproserleulys505560serargvalthrmetservalaspthrserlysasnglnpheserleu65707580lysleusersermetthralaalaaspthralavaltyrtyrcysala859095argasptyrargvalalaglythrtyrtyrtyrtyrtyrglyleuasp100105110valtrpglyglnglythrthrvalthrvalserser115120<210>51<211>372<212>dna<213>智人<400>51caggtgcagctgcaggagtcgggcccaggactggtgaagccttcggagaccctgtccctc60acctgcactgtctctggtggctccatcagtagttacatctggagctggatccggcagccc120gccggaaagggactggagtggattgggcgtatctatgccagtgggaacaccaactacaac180ccctccctcaagagtcgagtcaccatgtcagtagacacgtccaagaaccagttctccctg240aagctgagctctatgaccgccgcggacacggccgtatattactgtgcgagagattatagg300gtggctggcacttactactactactacggtttggacgtctggggccaagggaccacggtc360accgtctcctca372<210>52<211>124<212>prt<213>智人<400>52glnvalglnleuglngluserglyproglyleuvallysproserglu151015thrleuserleuthrcysthrvalserglyglyserilesersertyr202530iletrpsertrpileargglnproalaglylysglyleuglutrpile354045glyargiletyralaserglyasnthrasntyrasnproserleulys505560serargvalthrmetservalaspthrserlysasnglnpheserleu65707580lysleuserservalthralaalaaspthralavaltyrtyrcysala859095argasptyrargvalalaglythrtyrtyrtyrtyrtyrglyleuasp100105110valtrpglyglnglythrthrvalthrvalserser115120<210>53<211>372<212>dna<213>智人<400>53caggtgcagctgcaggagtcgggcccaggactggtgaagccttcggagaccctgtccctc60acctgcactgtctctggtggctccatcagtagttacatctggagctggatccggcagccc120gccggaaagggactggagtggattgggcgtatctatgccagtgggaacaccaactacaac180ccctccctcaagagtcgagtcaccatgtcagtagacacgtccaagaaccagttctccctg240aagctgagctctgtaaccgccgcggacacggccgtatattactgtgcgagagattatagg300gtggctggcacttactactactactacggtttggacgtctggggccaagggaccacggtc360accgtctcctca372<210>54<211>124<212>prt<213>智人<400>54glnvalglnleuglngluserglyproglyleuvallysproserglu151015thrleuserleuthrcysthrvalserglyglyserilesersertyr202530iletrpsertrpileargglnproalaglylysglyleuglutrpile354045glyargiletyralaserglyglnthrasntyrasnproserleulys505560serargvalthrmetservalaspthrserlysasnglnpheserleu65707580lysleusersermetthralaalaaspthralavaltyrtyrcysala859095argasptyrargvalalaglythrtyrtyrtyrtyrtyrglyleuasp100105110valtrpglyglnglythrthrvalthrvalserser115120<210>55<211>366<212>dna<213>智人<400>55cagctgcaggagtcgggcccaggactggtgaagccttcggagaccctgtccctcacctgc60actgtctctggtggctccatcagtagttacatctggagctggatccggcagcccgccgga120aagggactggagtggattgggcgtatctatgccagtgggcaaaccaactacaacccctcc180ctcaagagtcgagtcaccatgtcagtagacacgtccaagaaccagttctccctgaagctg240agctctatgaccgccgcggacacggccgtatattactgtgcgagagattatagggtggct300ggcacttactactactactacggtttggacgtctggggccaagggaccacggtcaccgtc360tcctca366<210>56<211>124<212>prt<213>智人<400>56glnvalglnleuglngluserglyproglyleuvallysproserglu151015thrleuserleuthrcysthrvalserglyglyserilesersertyr202530iletrpsertrpileargglnproalaglylysglyleuglutrpile354045glyargiletyralaserglyglnthrasntyrasnproserleulys505560serargvalthrileservalaspthrserlysasnglnpheserleu65707580lysleuserservalthralaalaaspthralavaltyrtyrcysala859095argasptyrargvalalaglythrtyrtyrtyrtyrtyrglyleuasp100105110valtrpglyglnglythrthrvalthrvalserser115120<210>57<211>366<212>dna<213>智人<400>57cagctgcaggagtcgggcccaggactggtgaagccttcggagaccctgtccctcacctgc60actgtctctggtggctccatcagtagttacatctggagctggatccggcagcccgccgga120aagggactggagtggattgggcgtatctatgccagtgggcaaaccaactacaacccctcc180ctcaagagtcgagtcaccatatcagtagacacgtccaagaaccagttctccctgaagctg240agctctgtaaccgccgcggacacggccgtatattactgtgcgagagattatagggtggct300ggcacttactactactactacggtttggacgtctggggccaagggaccacggtcaccgtc360tcctca366<210>58<211>124<212>prt<213>智人<400>58glnvalglnleuglngluserglyproglyleuvallysproserglu151015thrleuserleuthrcysthrvalserglyglyserilesersertyr202530iletrpsertrpileargglnproalaglylysglyleuglutrpile354045glyargiletyralaserglyasnthrasntyrasnproserleulys505560serargvalthrileservalaspthrserlysasnglnpheserleu65707580lysleuserservalthralaalaaspthralavaltyrtyrcysala859095argasptyrargvalalaglythrtyrtyrtyrtyrtyrglyleuasp100105110valtrpglyglnglythrthrvalthrvalserser115120<210>59<211>372<212>dna<213>智人<400>59caggtgcagctgcaggagtcgggcccaggactggtgaagccttcggagaccctgtccctc60acctgcactgtctctggtggctccatcagtagttacatctggagctggatccggcagccc120gccggaaagggactggagtggattgggcgtatctatgccagtgggaacaccaactacaac180ccctccctcaagagtcgagtcaccatatcagtagacacgtccaagaaccagttctccctg240aagctgagctctgtaaccgccgcggacacggccgtatattactgtgcgagagattatagg300gtggctggcacttactactactactacggtttggacgtctggggccaagggaccacggtc360accgtctcctca372<210>60<211>124<212>prt<213>智人<400>60glnvalglnleuglngluserglyproglyleuvallysproserglu151015thrleuserleuthrcysthrvalserglyglyserilesersertyr202530iletrpsertrpileargglnproalaglylysglyleuglutrpile354045glyargiletyralaserglyglnthrasntyrasnproserleulys505560serargvalthrileservalaspthrserlysasnglnpheserleu65707580lysleusersermetthralaalaaspthralavaltyrtyrcysala859095argasptyrargvalalaglythrtyrtyrtyrtyrtyrglyleuasp100105110valtrpglyglnglythrthrvalthrvalserser115120<210>61<211>379<212>dna<213>智人<400>61cagatgtcaggtgcagctgcaggagtcgggcccaggactggtgaagccttcggagaccct60gtccctcacctgcactgtctctggtggctccatcagtagttacatctggagctggatccg120gcagcccgccggaaagggactggagtggattgggcgtatctatgccagtgggcaaaccaa180ctacaacccctccctcaagagtcgagtcaccatatcagtagacacgtccaagaaccagtt240ctccctgaagctgagctctatgaccgccgcggacacggccgtatattactgtgcgagaga300ttatagggtggctggcacttactactactactacggtttggacgtctggggccaagggac360cacggtcaccgtctcctca379<210>62<211>124<212>prt<213>智人<400>62glnvalglnleuglngluserglyproglyleuvallysproserglu151015thrleuserleuthrcysthrvalserglyglyserilesersertyr202530iletrpsertrpileargglnproalaglylysglyleuglutrpile354045glyargiletyralaserglyglnthrasntyrasnproserleulys505560serargvalthrmetservalaspthrserlysasnglnpheserleu65707580lysleuserservalthralaalaaspthralavaltyrtyrcysala859095argasptyrargvalalaglythrtyrtyrtyrtyrtyrglyleuasp100105110valtrpglyglnglythrthrvalthrvalserser115120<210>63<211>379<212>dna<213>智人<400>63cagatgtcaggtgcagctgcaggagtcgggcccaggactggtgaagccttcggagaccct60gtccctcacctgcactgtctctggtggctccatcagtagttacatctggagctggatccg120gcagcccgccggaaagggactggagtggattgggcgtatctatgccagtgggcaaaccaa180ctacaacccctccctcaagagtcgagtcaccatgtcagtagacacgtccaagaaccagtt240ctccctgaagctgagctctgtaaccgccgcggacacggccgtatattactgtgcgagaga300ttatagggtggctggcacttactactactactacggtttggacgtctggggccaagggac360cacggtcaccgtctcctca379<210>64<211>124<212>prt<213>智人<400>64glnvalglnleuglngluserglyproglyleuvallysproserglu151015thrleuserleuthrcysthrvalserglyglyserilesersertyr202530tyrtrpthrtrpileargglnproalaglylysglyleuglutrpile354045glyargiletyrthrserglyilethrasntyrasnproserleulys505560serargvalthrmetservalaspthrserlysasnglnpheserleu65707580lysleuserservalthralaalaaspthralavaltyrtyrcysala859095arggluargvalvalglyalaserargtyrtyrtyrtyrglyvalasp100105110valtrpglyglnglythrthrvalthrvalserser115120<210>65<211>372<212>dna<213>智人<400>65caggtgcagctgcaggagtcgggcccaggactggtgaagccttcggagaccctgtccctc60acctgcactgtctctggtggctccatcagtagttactactggacctggatccggcagccc120gccgggaagggactggagtggattgggcgtatctataccagtggaatcaccaactacaat180ccctccctcaagagtcgcgtcaccatgtcagtagacacgtccaagaaccagttctccctg240aagctgagctctgtgaccgccgcggacacggccgtgtattactgtgcgagagagcgggta300gtgggagctagtaggtactactactacggtgtggacgtctggggccaagggaccacggtc360accgtctcctcc372<210>66<211>124<212>prt<213>智人<400>66glnvalglnleuglngluserglyproglyleuvallysproserglu151015thrleuserleuthrcysthrvalserglyglyserilesersertyr202530tyrtrpthrtrpileargglnproalaglylysglyleuglutrpile354045glyargiletyrthrserglyilethrasntyrasnproserleulys505560serargvalthrmetservalaspthrserlysasnglnpheserleu65707580lysleuserservalthralaalaaspthralavaltyrtyrcysala859095arggluargvalvalglyalaserargtyrtyrtyrtyrglyvalasp100105110valtrpglyglnglythrthrvalthrvalserser115120<210>67<211>372<212>dna<213>智人<400>67caggtgcagctgcaggagtcgggcccaggactggtgaagccttcggagaccctgtccctc60acctgcactgtctctggtggctccatcagtagttactactggacctggatccggcagccc120gccgggaagggactggagtggattgggcgtatctataccagtggaatcaccaactacaat180ccctccctcaagagtcgcgtcaccatgtcagtagacacgtccaagaaccagttctccctg240aagctgagctctgtgaccgccgcggacacggccgtgtattactgtgcgagagagcgggta300gtgggagctagtaggtactactactacggtgtggacgtctggggccaagggaccacggtc360accgtctcctcc372<210>68<211>124<212>prt<213>智人<400>68glnvalglnleuglngluserglyproglyleuvallysproserglu151015thrleuserleuthrcysthrvalserglyglyserilesersertyr202530sertrpsertrpileargglnproalaglylysglyleuglutrpile354045glyargthrserthrserglyargasnasntyrasnproserleulys505560serargvalthrmetservalaspthrserlysasnglnpheserleu65707580lysleuasnservalthralaalaaspthralavaltyrtyrcysala859095argaspphethrilealaalaargargtyrtyrtyrtyrglymetasp100105110valtrpglyglnglythrthrvalthrvalserser115120<210>69<211>372<212>dna<213>智人<400>69caggtgcagttgcaggagtcgggcccaggactggtgaagccttcggagaccctgtccctc60acctgcactgtctctggtggctccatcagtagttactcctggagctggatccggcagccc120gccgggaagggactggagtggattgggcgtaccagtaccagtgggagaaacaactacaac180ccctccctcaagagtcgagtcaccatgtcagttgacacgtccaagaaccagttctccctg240aagctgaactctgtgaccgccgcggacacggccgtgtattactgtgcgagagatttcact300atagcagctcgtcgctactactactacggtatggacgtctggggccaagggaccacggtc360accgtctcctca372<210>70<211>124<212>prt<213>智人<400>70glnvalglnleuglngluserglyproargleuvallysproserglu151015thrleuserleuthrcysthrvalserglyglyserilethrasnasn202530tyrtrpsertrpileargglnproalaglylysglyleuglutrpile354045glyargvaltyrserserglyleuthrasntyrlysproserleulys505560serargvalthrmetservalaspthrserlysasnglnpheserleu65707580argleuasnservalthralaalaaspthralavaltyrtyrcysala859095arggluargalathrvalthrthrargtyrhistyraspglymetasp100105110valtrpglyglnglythrservalthrvalserser115120<210>71<211>372<212>dna<213>智人<400>71caggtgcagctgcaggagtcgggcccaagactggtgaagccttcggagaccctgtccctc60acctgcactgtctctggtggctccatcactaataactactggagctggatccggcagccc120gccgggaaggggctggagtggattgggcgtgtctatagtagtggactcaccaactacaag180ccctccctcaagagtcgagtcaccatgtcagtagacacgtccaagaaccaattctccctg240aggttgaactctgtgaccgccgcggacacggccgtgtattactgtgcgagagagagggca300acagtaactacgaggtaccactacgacggtatggacgtctggggccaagggacctcggtc360accgtctcctca372<210>72<211>124<212>prt<213>智人<400>72glnvalglnleuglngluserglyproglyleuvallysproserglu151015thrleuserleuthrcysthrvalserglyglyserilesersertyr202530tyrtrpsertrpileargglnproalaglylysglyleuglutrpile354045glyargilephealaserglyserthrasntyrasnproserleuarg505560serargvalthrmetserargaspthrserlysasnglnpheserleu65707580lysleuserservalthralaalaaspthralavaltyrtyrcysala859095lysgluargvalglyvalglnasptyrtyrhistyrserglymetasp100105110valtrpglyglnglythrthrvalthrvalserser115120<210>73<211>372<212>dna<213>智人<400>73caggtgcagctgcaggagtcgggcccaggactggtgaagccttcggagaccctgtccctc60acttgcactgtctctggtggctccatcagtagttactactggagctggatccggcagccc120gccgggaagggactggagtggattgggcgcatctttgccagtgggagcaccaactacaac180ccctccctcaggagtcgagtcaccatgtcaagagacacgtccaagaaccagttctccctg240aagctgagttctgtgaccgccgcggacacggccgtttattactgtgcgaaagaaagggtg300ggagtacaggattactaccactattccggtatggacgtctggggccaagggaccacggtc360accgtctcctca372<210>74<211>234<212>prt<213>智人<220><221>尚未归类的特征<222>(1)..(37)<223>细胞质的<220><221>尚未归类的特征<222>(38)..(62)<223>跨膜<220><221>尚未归类的特征<222>(63)..(234)<223>细胞外的<400>74metaspproglyleuglnglnalaleuasnglymetalaproprogly151015aspthralamethisvalproalaglyservalalaserhisleugly202530thrthrserargsertyrphetyrleuthrthralathrleualaleu354045cysleuvalphethrvalalathrilemetvalleuvalvalglnarg505560thraspserileproasnserproaspasnvalproleulysglygly65707580asncyssergluaspleuleucysileleulysargalaprophelys859095lyssertrpalatyrleuglnvalalalyshisleuasnlysthrlys100105110leusertrpasnlysaspglyileleuhisglyvalargtyrglnasp115120125glyasnleuvalileglnpheproglyleutyrpheileilecysgln130135140leuglnpheleuvalglncysproasnasnservalaspleulysleu145150155160gluleuleuileasnlyshisilelyslysglnalaleuvalthrval165170175cysgluserglymetglnthrlyshisvaltyrglnasnleusergln180185190pheleuleuasptyrleuglnvalasnthrthrileservalasnval195200205aspthrpheglntyrileaspthrserthrpheproleugluasnval210215220leuserilepheleutyrserasnserasp225230<210>75<211>5<212>prt<213>合成序列<220><221>尚未归类的特征<222>(3)..(3)<223>其中x是i、s或y。<220><221>尚未归类的特征<222>(5)..(5)<223>其中x是t或s。<400>75sertyrxaatrpxaa15当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1