一种DEHP降解菌剂制备及其有效降低蔬菜生产中DEHP污染的方法与流程
本发明涉及环境污染物生物处理技术领域,更具体地,涉及一种dehp降解菌剂制备及其有效降低蔬菜生产中dehp污染的方法。
背景技术:
邻苯二甲酸酯(paes)在工业中常被用作增塑剂广泛应用于塑料或高分子材料中,以提高塑料制品的柔韧性和耐久性。由于与塑料分子之间并非通过化学键连接,随着时间的推移,paes可脱离塑料主体进入外界,造成环境污染。目前,paes已经成为人们日常接触的最常见的化学物质之一,并可通过饮食和皮肤接触等多种途径进入人体,对人类健康造成威胁。有研究表明,邻苯二甲酸二(2-乙基己基)酯(dehp)是环境中含量最多的paes化合物,并被美国环境保护局和中国国家环境监测中心列为优先污染物加以控制。据报道,dehp属于环境内分泌干扰物,对人体具有较强的毒性,包括肝/肾毒性、神经毒性、生殖发育毒性,甚至有致癌效应。在我国的农业生产中,塑料薄膜、废水灌溉、肥料等通常含有paes的物质的广泛及不当应用,使得农业土壤中dehp污染严重。而土壤中的dehp可以被作物吸收和积累,特别是叶菜类作物。有数据调查表明,在华南珠江三角洲地区的11种调查蔬菜中,花椰菜积累的dehp可高达9.3mg/kg(干重)。作物中的dehp通过食物链进入人体,对人体健康构成潜在危害。因此,消除农业土壤中的paes,并降低作物中的dehp累积量,是保证农产品的安全是当务之急。自然环境中dehp的物理化学降解非常困难,微生物介导的生物降解是dehp的主要降解途径,是修复dehp污染环境的首选和最有前途的方法。虽然目前已从土壤、活性污泥、水、沉积物等中分离出大量的dehp降解菌,但对这些菌的进一步应用潜力分析研究较少,考虑到实际环境中营养物质含量低、种间竞争激烈、生存条件差(如高温或低温、ph值等),这些分离株很少表现出良好的环境适应性和应用潜力。
专利cn201510066083.9和cn201510066129.7公开了一株可同时降解多种邻苯二甲酸酯的红球菌rhodococcussp.2g及其在降解邻苯二甲酸酯中的应用,利用多种paes作为唯一碳源和能源进行生长繁殖,在纯培养条件下该菌7天可将无机盐培养基中200mg/kg的混合paes(分别包含200mg/kgdmp、dep、dbp和dehp)几乎降解完全,降解率均超过97%,但是对于该菌株的应用研究仅仅局限在实验室内进行摇瓶降解研究,没有应用到实际污染农田土壤的治理中,同时如何将红球菌rhodococcussp.2g制备成可在生产上推广应用的菌剂,还有待进一步研究。
技术实现要素:
本发明所要解决的技术问题是克服上述现有技术的缺陷和不足,利用之前筛选到的dehp高效降解菌rhodococcussp.2g,通过发酵获得该菌株的大量菌体,并通过冷冻干燥法制备出高活性的dehp菌剂。菌剂使用时按一定比例稀释于水中,采用滴灌的方式将菌剂滴灌于种植蔬菜的根部土壤。菌剂施用结果表明该降解菌能够定殖于蔬菜根际土壤中,可有效去除污染土壤中dehp含量,降低种植蔬菜体内dehp累积量,同时不影响蔬菜的生物量。
本发明的第一个目的是提供一种dehp降解菌剂的制备方法。
本发明的第二个目的是提供上述方法制备得到的dehp降解菌剂。
本发明的第三个目的是提供所述dehp降解菌剂的应用。
本发明的上述目的是通过以下技术方案给予实现的:
一种dehp降解菌剂的制备方法,包括如下步骤:
s1.菌悬液制备:将红球菌rhodococcussp.2g种子液接种于发酵培养基中,控制发酵温度为26~29℃,ph为7.0~7.5,接种量od600=0.5~0.7,发酵培养10h~15h;再于4℃,6000~7000r/min离心10~12min收集菌体,弃去上清液,无菌水洗涤后,再次离心去上清,获得菌泥;将菌泥与冻干保护剂按照体积比为1:1~3进行混合,制备成菌悬液;
s2.冻干菌剂的制备:将制备好的菌悬液按照12~14ml装液量分装于无菌的75mm的培养皿中,放入-20℃的冰箱中进行预冻,冻结完全后将其放入温度为-75℃的冷阱中继续预冻,3h后取出进行冻干,冻干时间为16~18h,即得dehp降解菌剂;
其中,步骤s1所述冻干保护剂由以下体积百分比的各组分组成:甘油10%,脱脂乳10%,山梨醇15%,无菌水65%。
本发明使用一种已筛选获得的dehp高效降解菌,即红球菌(rhodococcussp.2g)菌株。该菌株于2015年1月22日被保藏在武汉市武昌区珞珈山武汉大学中国典型培养物保藏中心保藏,保藏号为cctccm2015056。在本发明dehp降解菌剂的制备过程中,保护剂的选择是关键因素,保护剂可以改变样品冷冻时的物理、化学环境,减轻或防止冷冻或复水对菌丝体的损害,尽可能保持原有的生物活性并非每种保护剂对所有的微生物在冷冻干燥过程都有保护作用,由于细胞结构和大小的差异,对于不同的微生物,即使采用相同的保护剂所取得的效果也可能是不同的,本发明通过大量研究发现,当使用上述组分含量的保护剂时,菌体的存活率最高;再通过优化发酵条件,冻干时间,离心速率及装液量,制备得到高活性的dehp菌剂。
优选地,步骤s1所述红球菌rhodococcussp.2g降解菌和冻干保护剂的体积比为1:1;虽然随着冻干保护剂配比的加大,菌体的存活率不断上升,但是考虑到冻干保护剂中含有脱脂乳,成本较高,单位质量的菌粉中含菌量少,不利于以后的生产应用,因此选择菌体与保护剂配比为1:1较为合理。
优选地,所述发酵温度为29℃,ph为7.1,接种量od600=0.6,按此发酵条件进行菌体发酵,可获得大量菌体。
优选地,步骤s1所述离心速度为7000r/min,时间为10min;过低的离心速率会使复水后的有效菌数降低,而过高的离心速率会使细胞造成损伤甚至破碎,从而菌体存活率下降,通过综合考虑离心速率对红球菌rhodococcussp.2g存活率的影响,选择离心速度为7000r/min。
优选地,步骤s2所述冻干时间为18h;此时,样品中含水量低,有利于保持细胞的活性及菌粉的稳定性。
优选地,步骤s2所述菌悬液按照12ml装液量进行装液,此装液量下的菌悬液冻干后厚度适宜,存活率高,且干燥时间短。
本发明还请求保护上述方法制备得到的dehp降解菌剂。
本发明研究发现,将红球菌rhodococcussp.2g接种于栽种在dehp污染土壤中的种植蔬菜的根部。结果显示该降解菌能够定殖于蔬菜根际土壤中,不仅可有效去除污染土壤中dehp含量,还降低种植蔬菜体内dehp累积量,同时不影响蔬菜的生物量,与单独将红球菌rhodococcussp.2g接种于受dehp污染土壤相比,可有效促进土壤中dehp去除,表明红球菌rhodococcussp.2g可与蔬菜发生协同作用使得土壤中dehp去除效率更高。
因此,本发明还请求保护所述红球菌rhodococcussp.2g在dehp污染土壤修复及减少种植蔬菜dehp累积量中的应用;即红球菌rhodococcussp.2g与种植蔬菜联用在dehp污染土壤修复中的应用。
所述应用具体为将种植蔬菜载种在受dehp污染的土壤中,然后将红球菌rhodococcussp.2g接种于种植蔬菜的根部。
本发明还保护一种进行dehp污染土壤修复的方法,是在dehp污染土壤中栽种菜心,然后将上述的dehp降解菌剂复水,滴灌于菜心的根部土壤中。
一种同时进行dehp污染土壤修复和减少蔬菜dehp累积量的方法,是向栽种在dehp污染土壤中的种植蔬菜的根部滴灌本发明上述制备得到的dehp降解菌剂。
优选地,上述种植蔬菜为dehp高累积菜心,具体品种可以为华冠油青。
与现有技术相比,本发明具有以下有益效果:
(1)本发明提供了一种dehp降解菌剂及其制备方法,所述降解菌剂为红球菌rhodococcussp.2g冻干菌剂,菌粉稳定性好,具有较高的细胞活性;通过与无菌水混匀,充分溶解后即实现复水,将复水后的菌剂施用于dehp污染土壤,即可进行土壤修复。
(2)本发明提供的一种利用降解菌剂进行dehp污染土壤修复和减少蔬菜dehp累积量的方法,通过向受dehp污染土壤的农田中投加一定比例的红球菌rhodococcussp.2g,实现土壤中dehp的去除同时减少种植蔬菜中dehp的累积量,通过投加dehp降解菌剂并实现降解菌在蔬菜根际定殖,可有效降低污染土壤及种植蔬菜中的dehp残留量,该方法可在进行农田dehp污染土壤修复的同时进行农产品安全生产,即“边生产边修复”的理念,具有处理效率高、成本低和无二次污染等优点,在农田土壤有机污染防治中具有重要的应用前景。
附图说明
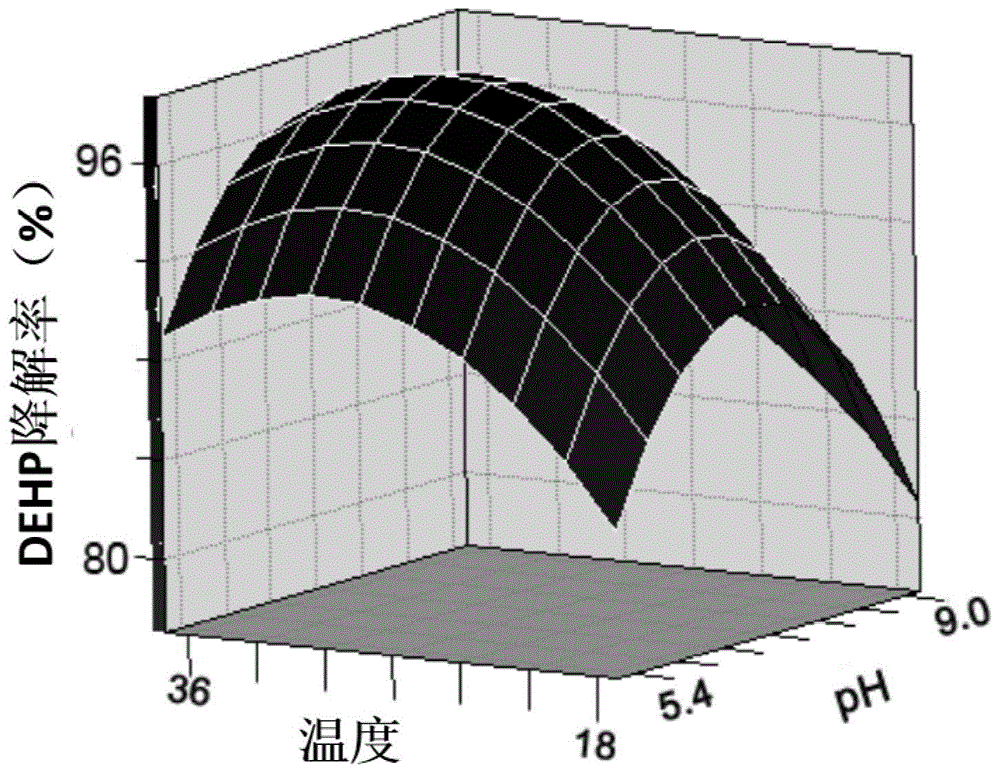
图1为发酵条件(温度、ph和接种量)对dehp降解效果的模型方程响应面3d分析。
图2为不同冻干保护剂对菌体存活率的影响。
图3为不同冻干时间对菌体存活率的影响。
图4为菌体与保护剂配比对菌体存活率的影响。
图5为离心速度对菌体存活率的影响。
图6为装液量对菌体存活率的影响。
图7为不同处理下的土壤中dehp残留(a)和蔬菜中dehp累积量(b)变化。
图8为利用dgge检测不同处理下的土壤中接种菌株2g在接种后7,21和35天的变化图;(图中箭头所指为菌株2g的dna条带;条带1-3,4-6,7-9和10-12分别为对照、接种菌株、种植菜心和种植菜心+接种菌株的土壤在接种后7,21和35天的微生物群落dna条带变化;条带13为菌株2g的dna条带)。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
实施例1rhodococcussp.2g降解菌的发酵条件优化与冻干菌剂的制备
1、培养基配方:
种子液培养基:即牛肉膏蛋白胨培养基(lb):牛肉膏5.0g,蛋白胨10.0g,氯化钠10.0g,加超纯水至1l,调节ph=7.0;121℃灭菌20分钟。
液体发酵培养基:酵母粉5.0g,蛋白胨10.0g,氯化钠10.0g,无机盐溶液1.0ml(含k2hpo4:5.8;kh2po4:4.5;(nh4)2so4:2.0;mgcl2:0.16;cacl2:0.02;na2moo4·2h2o:0.0024;fecl3:0.0018;mncl2·2h2o:0.0015,单位g/l),土壤浸液100ml,加超纯水至1l,调节ph=7.0。121℃灭菌20分钟。
2、发酵条件优化
(1)将菌株接于种子液培养基中,于30℃、180rpm下恒温震荡培养24h进行活化,经4600×g离心10min,并用0.9%的无菌生理盐水清洗三遍后再重悬,使其od600=0.8,作为后续实验的种子悬液。将种子悬液接种于100ml的液体发酵培养基中(含200mg/ldehp),于30℃、180rpm下培养5d,对菌株活化条件初始ph(6~10)、温度(20~40℃)、接种量(0.2~1.0)进行响应曲面(rsm)优化。采用box-behnken实验设计,对上述三个因素采用高、中、低三个水平,见表1。
表1采用box-behnken实验设计参数水平
(2)采用spss统计学软件,以显著因素为自变量,以dehp降解菌为响应值采用3因素3水平15组试验进行响应面优化(见表2),以确定最佳降解发酵条件。
表2rsm实验设计及结果
(3)方差分析结果见表3,回归项模型p<0.001,说明回归效果显著。
表3各因素显著性及效应评价
(4)对各试验因子进行,回归方程拟合,拟合结果如下:
y2g=98.3-3x1+2.238x2-10.252x12-5.777x22
回归方程相关系数r2=0.9698。进一步说明回归方程拟合度较好。综合响应曲面分析和回归方程绘制相应曲面图形(见图1),获得最佳发酵条件温度为29℃,ph为7.1,接种量od600=0.6。按此最佳发酵条件进行菌体发酵,获得大量菌体。
3、冻干菌剂的制备
(1)冻干菌剂的制备流程
菌悬液的制备:将1%活化后的菌接种于lb液体培养基中,在上述得到的最佳发酵条件下进行发酵12h。之后采用平板稀释涂布法对培养到对数生长期的菌计数,即冻干前菌落计数,并置于30℃恒温培养箱培养36~48h。将菌液置于离心管中,在最佳转速下保持4℃条件下离心10min收集菌体,弃去上清液,无菌水洗涤后,再次离心去上清,获得菌泥。将最佳的保护剂与菌体按照最佳的配比进行混合,制备成菌悬液。
冻干菌粉的制备:将制备好的菌悬液按照最佳的装液量分装于无菌的75mm的培养皿中。放入-20℃的冰箱中进行预冻,冻结完全后将其放入温度为-75℃的冷阱中继续预冻,3h后取出放入冻干机中,在最佳的冻干时间下进行冻干。
冻干菌粉的复水处理:将冻干后的菌粉称重,复溶至与菌体来源完全相等的无菌水中,摇匀使其充分溶解,30℃水浴30min,采用平板稀释涂布法对其进行冻干后有效活菌计数,置于30℃恒温培养箱中,培养时间与冻干前计数平板的培养时间相同,来计算菌体的存活率。
菌体存活率=n0/n1×n存活率
其中n0为冻干前有效活菌数,n1为冻干后有效活菌数。
(2)最佳保护剂的确定
通过前期的大量工作筛选出了3种冻干保护剂的配方:(1)甘油为8ml/l,蔗糖为10%,脂乳为15%,(2)甘油10%,脱脂乳10%,山梨醇15%,(3)脱脂乳15.0g/l,蔗糖20.0g/l,麦芽糊精25.0g/l,甘油3.0ml/l。进行冻干预试验,以菌体存活率为指标来确定适用于此菌的最佳保护剂。结果如图2所示,使用第2种冻干保护剂配方,菌体的存活率最高,可达64.3%,因此选用甘油10%,脱脂乳10%,山梨醇15%为此菌的最佳冻干保护剂配方。
(3)冻干时间的选择
收集一定量的菌体,使用上述结果中最佳冻干保护剂,离心速度5000r/min、菌体与冻干保护剂配比1:1、装液量12ml,制备菌悬液冻干并复水处理,具体按照菌种冻干剂制备流程,测定冻干时间为10、12、14、16、18h的条件下菌体的存活率。结果如图3所示,菌体存活率在12~16h的范围内不断上升,16h~18h变化不大,18h以后有下降的趋势,这是由于冻干时间的长短会影响菌粉中的含水量的大小,研究表明,最佳的水分含量有利于保持细胞的活性及菌粉的稳定性。而超过18h后,菌粉中残留水分含量低于最佳水平,细胞表面的亲水基团失水,与氧结合使细胞破裂死亡,导致菌体存活率下降。同时测得冻干时间为18h的样品中含水量为1.6%,而12h、14h和16h的样品中含水量均大于1.6%,因此确定冻干时间为18h较为合理。
(4)菌体与保护剂配比的选择
收集一定量的菌体,选择上述结果中最佳的冻干保护剂和冻干时间,离心速度5000r/min、装液量12ml,制备菌悬液冻干并复水处理,测定菌体与保护剂配比为1:3、1:2、1:1、2:1、3:1的条件下菌体的存活率。结果如图3所示,随着冻干保护剂配比的加大,菌体的存活率不断上升。这是由于冻干保护剂中的大分子保护剂,脱脂乳和山梨醇通过包裹在菌体外面进行保护,同时促进甘油小分子保护剂发挥作用。而小分子甘油的亲水性较强,能够透过细胞膜,分子结构中含有羟基,在冻干过程中可与菌体细胞膜磷脂中的磷酸基团或与菌体蛋白质极性基团形成氢键,从而保护细胞膜和蛋白质结构和功能的完整性。但是由于冻干保护剂中含有脱脂乳,成本较高,单位质量的菌粉中含菌量少,不利于以后的生产应用,因此选择菌体与保护剂配比为1:1较为合理。
(5)离心速度对冻干菌体存活率的影响
收集一定量的菌体,选择上述结果中最佳的冻干保护剂、冻干时间、菌体与保护剂配比,装液量12ml,制备菌悬液冻干并复水处理,测定离心速度为4000、5000、6000、7000、8000r/min的条件下菌体的存活率。结果如图4所示,随着菌体离心速度的增加,冻干后菌体的存活率先增大后减小。这可能是由于当离心速度小于7000r/min时,细胞大部分置于上清液中,导致复水后有效菌数极低,随着转速加大,菌体大部分离心下来甚至完全离心至菌泥中,使存活率呈上升趋势,而到8000r/min的转速会使细胞造成损伤甚至破碎,从而菌体存活率稍有下降,因此选择离心速度为7000r/min较为合理。
(6)装液量对冻干菌体存活率的影响
收集一定量的菌体,选择上述结果中最佳的冻干保护剂、冻干时间、菌体与保护剂配比、离心速度,制备菌悬液冻干并复水处理,测定装液量为8、10、12、14、16ml的条件下菌体的存活率。结果如图5所示,冻干过程中随着装液量的增大,菌体的存活率逐渐上升,这是由于当装液量少时,菌悬液冻干后厚度较小,预冻后刚放入抽真空的环境中容易溶化,之后再次冻结会对细胞造成不同程度的损伤,而装液量多时,冻结较厚不易溶化使菌体损伤较少,菌体存活率较高。同时冻干厚度越厚,单位体积的细胞越多,使结合水不易失去而影响冻干过程中解析干燥的时间,综合考虑选择装液量为12ml较为合理。
最终确定制备冻干菌剂的最佳工序为选用甘油10%,脱脂乳10%,山梨醇15%为此菌的最佳冻干保护剂配方,最佳菌体与保护剂配比、冻干时间、离心转速、装液量分别为1:1、18h、7000r/min、12ml。
实施例2rhodococcussp.2g降解菌对污染土壤中dehp降解效果和种植蔬菜体内dehp含量影响的实验
1、盆栽试验
本试验所用土取自华南农业大学农场,经测定,该土壤ph值为6.9,并未检测到dehp。使用前使其自然风干并过2mm筛,后向其中加入dehp,使其浓度达到50mg/l,并加双蒸水调至田间持水量(约30%),避光老化2周。我们选择前期筛选的dehp高累积菜心(brassicaparachinensisl.)品种华冠油青为供试蔬菜。试验过程中共设置四个土壤处理,分别是:空白污染土壤(ck)、接菌的污染土壤(接种菌株)、种植菜心污染土壤(种植菜心)、同时接菌和种植菜心的污染土壤(种植菜心+接种菌株)。采用温室盆栽方法,每个陶盆装3kg污染土壤,添加6g的化肥。菜心经育苗至3-4片真叶后,移栽到盆内,每盆5棵。菌剂按每盆10mg经复水后滴灌于污染土壤或菜心根际土壤中,每隔3天滴灌一次,共滴灌3次。每个处理设置三个重复,随机排列。温室温度为25-32℃,浇灌自来水维持土壤自然湿度,共培育35天。分别于接菌后7、21和35收集四个处理的土样,储存于-80度冰箱待检测dehp含量;于接菌后35天收获菜心,洗净擦干后分别称重地上部和根,然后冻干保存于-20度冰箱,待检测dehp含量。
2、土壤及菜心样品中dehp抽提
称取1g风干磨碎的土壤或菜心样品于35ml玻璃离心管中,加入20ml的二氯甲烷并超声萃取10min,然后经3500rpm离心收集上清液。土样沉淀中再加入20ml的二氯甲烷相同方法超声萃取3次,合并上清液。然后经旋转蒸发浓缩上清液,用二氯甲烷超声清洗后过柱子(1.0cm液。然后经旋,填料自上而下为无水na2so4,硅胶和氧化铝),用鸡心瓶收集滤液经n2吹干后,用色谱纯二氯甲烷重新溶解并定容至1ml,待gc/ms测定。
3、样品检测
采用岛津公司qp2010plus型gc/ms串联质谱仪。色谱柱为安捷伦hp-5柱子(0.25μm×0.25mm×30m),进样温度为250℃,离子源(ei)温度为220℃,采用不分流进样1μl,载气为高纯氦气。升温程序为:初始温度为100℃,保持2min,15℃/min梯度上升至129℃,然后以40℃/min升温至280℃,保持5min。
质量控制:采用外标法和六点校正标准物质制作标准曲线。土壤样品中dehp回收率为97.7%~104.7%,菜心样品中dehp回收率为87.4%~107.2%。
4、结果与分析
结果如图7(a)所示,相比于对照处理(ck)土壤,接种有rhodococcussp.2g菌的土壤处理组中土壤dehp的去除率高达80%,显著高于对照组(20%)。另外,当接种rhodococcussp.2g菌时,种植有b.parachinensis菜心的土壤处理组中dehp的去除率高达95%,而只种植b.parachinensis菜心的土壤处理组中土壤dehp的去除率却只有59%。这表明rhodococcussp.2g具有高效去除土壤中dehp的能力,且可与蔬菜发生协同作用使得土壤中dehp去除效率更高。从图7b可以看出,接种rhodococcussp.2g后,dehp高累积型菜心b.parachinensis的茎部和根部的dehp积累量分别减少了75%和86%。综上,将rhodococcussp.2g接种于蔬菜的根际土中,可极大促进土壤中dehp去除率的同时还能极大降低植物对dehp的生物积累。
另外,为了检测接种菌株2g在土壤中的存活能力,利用pcr-dgge方法检测菌株dna条带变化。如图8所示,将菌株2g接种于污染土壤中7天后条带依然清晰明亮(条带7),说明菌株2g在接种早期具有与本地微生物竞争生长的优势。然而,接种21天后dna条带模糊(条带8),第35天条带消失不见(条带9),说明菌株2g在土壤中接种21天后,可能由于土壤中dehp等碳源耗尽而缺乏养分或无法与土著微生物竞争,最终无法生存。然而,当菌株接种于菜心根际,其dna条带在第35天仍然存在(条带10-12),说明菜心种植有利于菌株2g的存活,可能是由于菜心根系环境为菌株2g提供了可利用的有机质,使接种的菌株可以长期存活于菜心根际土壤中,这也合理地解释了将菌株2g接种于菜心根际土壤中,土壤中的dehp去除率得到了明显提升这一现象。
综上,将菌株2g接种于蔬菜根际,在修复dehp污染土壤的同时还可保障农产品的质量安全,能够实现农田土壤边生产边修复的目的,因此具有很好的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!