提高嵌合抗原受体T细胞疗效和作用持久性的细胞培养方法与流程
本发明属于免疫学和细胞治疗研究领域,涉及一种提高嵌合抗原受体t细胞疗效和作用持久性的细胞培养方法,是应用络氨酸激酶抑制药物提高car-t细胞中初始t细胞和中心记忆t细胞,减少car-t细胞耗竭的培养方法。
背景技术:
嵌合抗原受体t(chimericantigenreceptormodifiedt,car-t)细胞免疫疗法近年成为免疫靶向治疗中最具发展前途的一种治疗手段,其作用原理是利用基因工程技术,将能识别某种肿瘤抗原的特异性单链单克隆抗体的抗原结合部与t细胞受体的酪氨酸活化基序及共刺激分子在体外偶联为一个嵌合蛋白,通过病毒载体等方法转染t细胞,使t细胞能够特异性识别肿瘤细胞并将信号传递至胞内,引起t细胞的增殖活化从而通过释放穿孔素/颗粒酶靶向杀伤肿瘤细胞,且不受主要组织相容性复合体(majorhistocompatibilitycomplex,mhc)的限制。近年来car-t治疗已应用于白血病、淋巴瘤、多发性骨髓瘤、脑胶质瘤、黑色素瘤、肺癌、前列腺癌、胰腺癌及卵巢癌等肿瘤。其中在血液系统恶性肿瘤中的研究取得的成绩最为瞩目。目前已开展针对如cd19、cd22、cd20、cd33、cd30、cd38、bcma、cd138、cd123等靶点的car-t细胞临床治疗研究。其中最显著的疗效主要体现在b细胞来源恶性肿瘤性疾病中的应用,如急性b淋巴细胞白血病(b-all),慢性淋巴细胞白血病(cll),多发性骨髓瘤(mm),b细胞淋巴瘤(b-nhl)等。国际上报道的靶向cd19的car-t(cart19)细胞治疗难治/复发b-all,完全缓解率(cr)达到90%。car-t细胞疗法在血液肿瘤治疗上的突破性进展给该研究领域带来了新的希望,尤其是传统治疗后无效或复发,在临床治疗决策者束手无策的情况下,car-t细胞免疫治疗成为最好的治疗选择。
但在接受靶向cd19的car-t细胞治疗患者中,复发成了car-t细胞治疗的主要障碍,约30-50%的患者在接受car-t细胞治疗后复发,且复发大多发生在接受car-t细胞治疗1年内;而大多数实体瘤予靶向car-t细胞治疗疗效欠佳。目前认为靶向cd19的car-t细胞治疗后原发病复发主要的原因是car-t细胞在体内的丢失,也即不能在体内长期维持;证据显示,car-t细胞治疗后患者的长期无病生存与car-t细胞在体内的维持时间高度相关。而car-t细胞耗竭不仅是靶向cd19的car-t细胞治疗血液系统肿瘤性疾病后肿瘤复发的重要因素,同时也是治疗实体瘤疗效欠佳的重要原因。因此开发提高car-t细胞疗效,延长car-t细胞在体内维持的方法,对提高car-t细胞治疗肿瘤性疾病的疗效、防止疾病复发和提高患者长期无病生存率至关重要。
car-t细胞在体内的疗效和持久性与其在体外培养过程中获得细胞制品的分化阶段和耗竭状态显著相关。体外培养过程中,因car-t细胞表面car分子的相互聚集而产生自发持续的活化信号,不仅可使car-t细胞向终末阶段分化,且可发生耗竭现象,尤其是使用cd28共刺激结构域的car-t细胞。car-t细胞的分化阶段分为:初始t细胞,干性中心记忆t细胞,中心记忆t细胞,效应记忆t细胞,效应t细胞。car-t细胞制品中初始t细胞和中心记忆t细胞显示出在体内的长期存活能力,而向终末阶段如效应记忆阶段和效应分化的car-t细胞在体内作用不能持久;同时耗竭car-t细胞持续表达高水平的抑制性受体如pd1、tim3、lag3,增殖能力低、低细胞因子释放能力减弱,易发生凋亡,严重限制了car-t在体内持久地发挥效应功能。但目前国内外并没有解决体外培养过程中car-t细胞的终末分化和耗竭倾向的方法。
技术实现要素:
本发明的目的是提供一种提高嵌合抗原受体t细胞疗效和作用持久性的细胞培养方法,通过以下具体步骤实现:
1.外周血单个核细胞制备
取外周血标本,肝素抗凝,应用人淋巴细胞分离液分离制备外周血单个核细胞。
2.cd3(+)t细胞富集及t细胞激活
使用anti-cd3/cd28磁珠,与外周血单个核细胞充分混匀并结合于cd3(+)t细胞后,予磁力架富集cd3(+)t细胞,并同时利用结合在磁珠表面的anti-cd3/cd28抗体激活cd3(+)t细胞。
3.携带靶向cd19的car慢病毒转染t细胞
将已制备好的携带靶向cd19的car的慢病毒按照moi=10转染anti-cd3/cd28磁珠活化的cd3(+)t细胞。
4.添加络氨酸激酶抑制剂达沙替尼扩大培养car-t细胞
取培养3-5天的gfp+car-t细胞,流式检测car分子的表达,确认car-t细胞制备成功后,将car-t细胞分2组分别连续培养9天:分别使用添加与不添加络氨酸激酶抑制剂达沙替尼的培养液培养car-t细胞。分实验组和对照组2组,达沙替尼30nmol/l实验组
(rpmi1640+10%fbs+il-2200u/ml+达沙替尼30nm),对照组:等体积dmso对照组
(rpmi1640+10%fbs+il-2200u/ml+等体积dmso)。
5.car-t细胞亚群检测
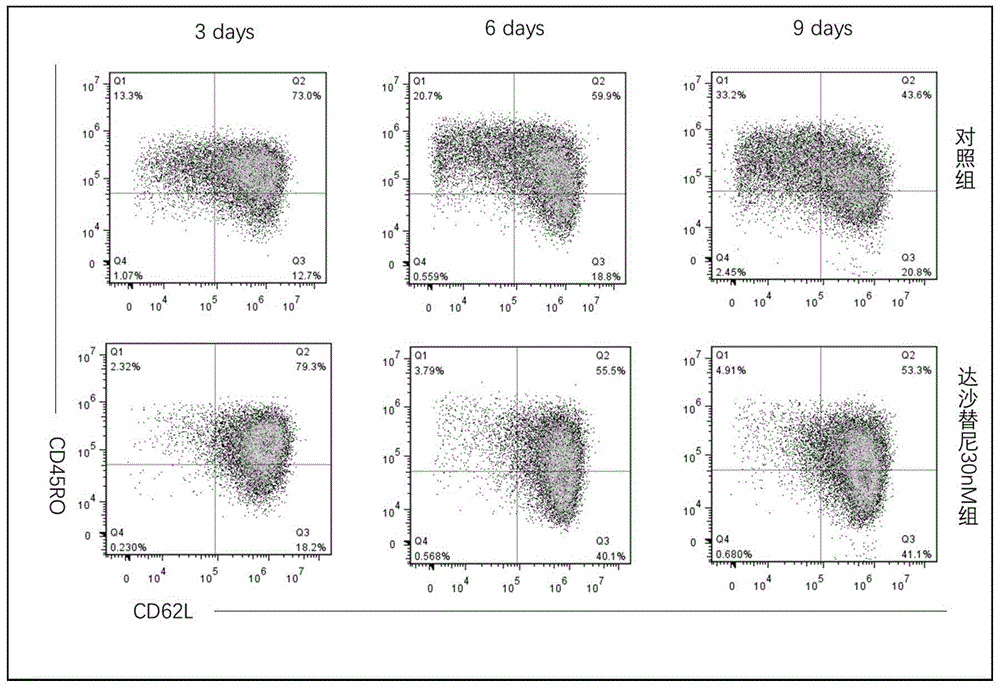
培养第9天取样本标记荧光抗体cd45ro、cd62l,流式细胞仪检测car-t细胞亚群;经步骤(4)培养的car-t细胞,细胞分化能够持续保持在初始t细胞和中央记忆t细胞阶段,有效地抑制了car-t细胞向下游及终末阶段分化。
6.car-t细胞耗竭相关表面分子的检测
培养第9天取样本标记荧光抗体pd1、tim3、lag3,流式细胞仪检测car-t细胞耗竭相关表面分子;经步骤(4)培养的car-t细胞,低表达t细胞耗竭相关抑制性受体pd1、tim3、lag3,有效地抑制了car-t细胞的耗竭倾向。
7.评估经达沙替尼处理的car-t细胞疗效及持久性
准备all-nsg小鼠模型,按照以下分组:①对照组(尾静脉注射dmso处理的car-t细胞),②实验组(尾静脉注射达沙替尼30nm培养的car-t细胞)进行试验;每周使用小动物活体成像仪给小鼠成像,比较两组肿瘤负荷差异;每周流式细胞术检测car-t细胞比例;记录各组小鼠死亡时间,绘制生存曲线。经步骤(4)培养的car-t细胞,治疗急性淋巴细胞白血病小鼠,可获得更好的疗效和生存期。
本发明方法解决了体外培养过程中car-t细胞的终末分化和耗竭倾向的难题,通过添加络氨酸激酶抑制剂达沙替尼(dasatinib)减少car-t细胞活化信号传递,抑制了car-t细胞的终末分化,提高了car-t细胞制品中的初始t细胞和中心记忆t细胞的比例,同时抑制car-t细胞的耗竭倾向,获得了疗效更显著、体内维持时间更长的car-t细胞制品。本发明建立的方法解决了体外培养过程中car-t细胞的终末分化和耗竭倾向的难题,通过添加络氨酸激酶抑制剂达沙替尼减少car-t细胞活化信号传递,抑制了car-t细胞的终末分化,提高了car-t细胞制品中的初始t细胞和中心记忆t细胞的比例,同时抑制car-t细胞的耗竭倾向,获得了疗效更显著、体内维持时间更长的car-t细胞制品。发明方法具有以下特点:(1)培养过程简单易行,成本低廉,临床应用安全可靠;(2)培养得到的car-t细胞初始t细胞和中心记忆t细胞比例高,并避免了car-t细胞的耗竭倾向,重复性好;(3)培养得到的car-t细胞在白血病小鼠模型中展现出更好的治疗疗效和体内维持持久性,具有广泛的应用推广价值。本发明旨在建立一种方法体系,阻止car-t细胞在培养过程中向终末分化,抑制car-t细胞耗竭,获得高质量,高初始t细胞和中心记忆t细胞含量的car-t细胞制品,不仅可提高car-t细胞的治疗疗效,更可减少car-t治疗后的复发,提高患者长期无病生存率。
附图说明
图1.car-t细胞在体外培养过程中,由于car分子相互聚集,导致car-t细胞持续活化,使得部分car-t细胞向效应阶段分化,限制了其在体内的持久性;培养过程中添加达沙替尼可显著减少car-t细胞向下游分化,保持细胞在初始和中心记忆阶段。
图2.由于car分子相互聚集,导致car-t细胞持续活化,使得部分car-t细胞发生耗竭,限制了car-t细胞的临床疗效;培养过程中添加达沙替尼可逆转car-t细胞的耗竭倾向,保持细胞低水平表达pd1、tim3、lag3,获得了高质量的car-t细胞制品。
图3.使用达沙替尼30nmol/l培养的car-t细胞尾静脉注射治疗急性淋巴细胞白血病小鼠后,与对照组相比,小鼠肿瘤负荷明显低于对照组。
图4.达沙替尼30nmol/l培养的car-t细胞治疗的急性淋巴细胞白血病小鼠,中位生存55天,而对照组中位生存43天,提示添加达沙替尼培养的car-t细胞可显著延长急性淋巴细胞白血病小鼠的生存期。
图5.在car-t细胞注射小鼠一周后,流式细胞仪检测两组car-t细胞在小鼠外周血有核细胞中的比例,结果显示达沙替尼30nmol/l培养的car-t细胞比例显著高于对照组,提示达沙替尼30nmol/l处理的car-t细胞在体内的维持更加持久。
具体实施方式
本发明结合附图和实施例,作进一步的说明。
实施例1
1.单个核细胞的分离
(1)采集外周血10-20ml;
(2)使用等体积的pbs将外周血进行稀释;
(3)取15ml离心管,加入5ml淋巴细胞分离液,使用移液枪将稀释后的血样10ml沿管壁缓慢添加至分离试剂的上层,避免分离试剂与血样的混合;
(4)将离心机设置为400g,转速上升设为4档,转速下降速度设为0档,室温离心30分钟;
(5)离心结束后,轻轻将处于血清与分离试剂界面的单个核细胞层吸取并转移至一个新的离心管中,pbs洗涤细胞2次。
2.cd3(+)t细胞富集及t细胞激活
(1)计数获取的单个核细胞,rpmi1640完全培养基重悬,调整细胞浓度至107/ml;
(2)用0.1%bsa/pbs溶液洗涤anti-cd3/cd28磁珠2遍;洗涤方法:取5-10ml0.1%bsa/pbs溶液置于15ml离心管中,加入计算后所需要的anti-cd3/cd28磁珠,充分混匀后置于磁力架上静置1分钟,磁珠贴于两侧离心管壁,吸取弃去0.1%bsa/pbs溶液。重复洗涤1次;
(3)按照磁珠:cd3(+)t细胞=3:1,将洗涤后的anti-cd3/cd28磁珠与单个核细胞充分混匀,移至培养瓶(视液体量选择培养瓶规格),置摇床轻轻摇晃20分钟,使磁珠与cd3(+)t细胞充分结合;
(4)将磁珠与pbmc的细胞混悬液转移至离心管,置于磁力架上静置1分钟,结合磁珠的cd3(+)t细胞贴于两侧离心管壁,吸取弃去离心管中未结合磁珠的细胞悬液;
(5)用含il-2(200iu/ml)的rpmi1640完全培养基重悬结合磁珠的cd3(+)t细胞,调整细胞浓度至1×106/ml,37℃、5%co2饱和湿度培养箱中培养24小时。
3.携带car慢病毒转染t细胞
(1)离心并计数结合磁珠的cd3(+)t细胞,含il-2(200iu/ml)的rpmi1640完全培养基重悬,调整细胞浓度至4×106/ml,按500ul/孔接种于12孔板;
(2)该实验使用携带gfp/mcherry和car目的基因的慢病毒,按照moi=10,计算所需要的病毒量。计算公式如下:所需病毒量=(moi×细胞数量)/病毒滴度;
(3)从-80℃冰箱取出病毒后,迅速在37℃水浴锅中融化。在12孔板中加入上述计算所得的病毒量,添加终浓度为5μg/ml的polybrene,充分混匀后置于37℃,5%co2的培养箱中,6-8小时后补充含il-2(200iu/ml)的rpmi1640完全培养基至2ml,继续培养24小时;
(4)800rpm离心8分钟,去掉含有病毒的培养基上清,用新鲜培养基重悬细胞沉淀,将细胞转移至六孔板或培养瓶中,继续培养3-5天;
(5)使用5ml移液枪吹打培养瓶中car-t细胞,并将细胞移入50ml离心管中,置于磁力架上静置1min,磁珠吸附于管壁,将细胞混悬液转移至新的离心管中,离心并添加新鲜含il-2(200iu/ml)的rpmi1640完全培养基继续扩大培养。
4.添加络氨酸激酶抑制剂达沙替尼扩大培养car-t细胞
(1)取培养3-5天的car-t细胞,用含人il-2200iu/ml的rpmil640完全培养基重悬细胞并使用全自动细胞计数仪进行计数,并按5×105/孔接种至12孔板中;
(2)实验分组处理:实验分组为达沙替尼30nmol/l组、等体积dmso对照组;37℃、5%co2饱和湿度培养箱中培养,每3天离心换液,重新添加达沙替尼和dmso。
5.car-t细胞培养过程中的细胞分化检测
(1)培养第9天取样本流式检测;
①样本采集及处理:混匀六孔板中各组car-t细胞,各吸取适量细胞悬液离心洗涤后按照0.5-1×106个细胞/管加入流式管中,使用100ulpbs缓冲液重悬胞;
②标记抗体:向相应流式样品管中加入2.5ul相应荧光标记的cd45ro、cd62l抗体,4℃避光孵育30min;
③洗涤:每管加入2mlpbs缓冲液,混匀后常温下离心5min,弃上清。重复2次;
④检测与分析:使用500ulpbs缓冲液重悬标记后的细胞,流式细胞仪上机检测,使用flowj7.6软件分析,以gfp阳性car-t为分析对象设门,分析各亚群的比例。
(2)细胞各亚群定义为:杀伤性t细胞cd8+,辅助性t细胞cd4+,初始t细胞cd45ro-cd62l+,中心记忆t细胞cd45ro+cd62l+,效应记忆t细cd45ro+cd62l-,效应t细胞cd45ro+cd62l-,均以比例表示。
(3)与常规培养方法(对照组)对比,本培养方法可显著减少car-t细胞向下游分化,保持细胞在初始和中心记忆阶段,结果见图1。
6.car-t细胞培养过程中细胞耗竭相关表面分子的检测
(1)培养第9天取样本流式检测;
(2)按前述方法收集样本,标记pd1、tim3、lag3的荧光标记抗体和同型对照抗体,洗涤后重悬,流式细胞仪检测;
(3)数据分析:使用flowjo7.6软件分析数据,以gfp阳性car-t为分析对象设门,结果以阳性细胞比例表示;
(4)耗竭相关标记以pd1、tim3、lag3阳性比例表示。与常规培养方法(对照组)对比,本培养方法可逆转car-t细胞的耗竭倾向,保持细胞低水平表达pd1、tim3、lag3,结果见图2。
7.all-nsg小鼠体内评估经达沙替尼处理的car-t细胞疗效及持久性
(1)car-t细胞准备:制备携带mcherry的car-t细胞,取培养3-5天的car-t细胞,流式细胞仪检测car-t细胞的比例。分2组进行培养①对照组(加入等体积dmso)②实验组(加入达沙替尼30nm),每3天更换培养基并重新添加药物,连续培养9天。
(2)all-nsg小鼠模型准备:4-5周龄nsg小鼠饲养于spf级动物研究中心。取对数生长期luciferase(+)nalm6细胞株,配制细胞浓度至1×106/200ul,按1×106/鼠尾静脉注射,每只鼠注射总体积200ul。5天后小动物活体成像仪检测肿瘤负荷,按荧光强度随机分为2组,调整2组平均荧光强度无显著差异,次日尾静脉注射不同处理的car-t细胞。
(3)实验分组:实验分成2组,每组5只小鼠,分别为①对照组(尾静脉注射dmso处理的car-t细胞),②实验组(尾静脉注射达沙替尼30nm处理的car-t细胞)。
(4)car-t细胞尾静脉注射:按照1×106car-t细胞/鼠并根据car-t细胞比例计算每只鼠所需要的总细胞量,收集培养的car-t细胞离心后pbs重悬,配置浓度为1×106car-t细胞/200ul;将制备好的对照组和实验组car-t细胞悬液以尾静脉注射的方式接种至nsg小鼠体内,注射体积为200ul/鼠。
(5)疗效及生存观察:
①每周使用小动物活体成像仪给小鼠成像,比较两组肿瘤负荷差异;
②每周流式细胞术检测小鼠体内mcherry(+)car-t细胞比例;
③记录各组小鼠死亡时间,绘制生存曲线;
(6)采用本培养方法获得的car-t细胞与对照组相比,小鼠肿瘤负荷明显低于对照组,结果见图3。本法培养的car-t细胞可显著延长急性淋巴细胞白血病小鼠的生存期,结果见图4。
在car-t细胞注射小鼠一周后,流式细胞仪检测两组car-t细胞在小鼠外周血有核细胞中的比例,达沙替尼30nmol/l培养的car-t细胞比例显著高于对照组,结果见图5。
- 还没有人留言评论。精彩留言会获得点赞!