一种基于FBXW11甲基化评价公牛精子活力的方法及应用与流程
本公开属于家畜分子遗传生物技术领域,具体涉及一种通过检测fbxw11基因序列中的11个位点甲基化率对公牛精子活力进行评价的方法以及相应的试剂、引物在制备试剂盒中的应用。
背景技术:
公开该背景技术部分的信息仅仅旨在增加对本公开的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
优化繁殖效率是提高奶牛生产效率和经济效益的重要途径。人工授精技术是至今在奶业中唯一得到广泛成功应用的繁殖技术,已对奶牛生产效率产生深远的影响。通过优秀公牛的使用,公牛的遗传优势得到快速的扩散,并大大节省了饲养公牛的成本和人力。一头公牛可生产冻精多达30万剂。近30-40年来,世界奶牛的平均单产持续上升,但繁殖力却呈下降趋势(lucy2001;oltenacu和broom2010)。由于一头公牛与成千上万头的母牛息息相关,因此,选择优秀公牛的遗传潜能至关重要。至今,对于优秀种公牛的选择包括育种价值的评估和精液品质特性的选择。尽管一头种公牛符合现有的选择标准,然而其精液在人工授精的实践中,母牛受胎率处在20%-45%的范围内波动,存在很大的变异(kastelic和thundathil2008)。出现这种现象的原因是,现有的精液品质评价技术手段还不能准确地检测、预测精子的异常。伴随着牛精液人工授精技术的广泛应用,有关精液质量评价的技术和方法受到持续的关注,但目前还没单一的高度可靠的方法能在实践中应用。在牛精液生产环节,我国对于精液品质的评定主要包括的指标有:采精量、鲜精密度、鲜精活力、冻后活力、精子畸形率。其中精子活力是评估精液品质的主要指标,直接决定鲜精是否能够用于冻精生产。《gb4143-2008牛冷冻精液》国家标准规定牛鲜精活力不得低于60%,其精子活力的检测依靠镜检的常规方法,检测结果的主观性较强。
目前已有从遗传学的水平鉴定与精液品质相关的基因和标记,相关研究还处于初期阶段,尚未有成熟的技术应用于生产。在种公牛的生产实践当中,发明人发现全同胞的公牛虽然具有相似的遗传背景,其精液品质的表型却存在显著的差异,发明人推测这可能是由于表观遗传修饰引起的。因此,发明人认为,提供一种可用于评价精子活力的基因及该基因在公牛表观遗传修饰中存在的差异,通过对差异化修饰情况的分析筛选出具有理想遗传性状的精液样本,对于筛选种公牛和提高母牛的繁殖效率具有重要意义,有效提高经济效益。
fbxw11基因f-box蛋白家族成员之一,是scf型泛素连接酶e3的构成成分。泛素连接酶e3是机体内泛素蛋白酶体通路的关键组分,用于对体内蛋白的特异性识别,也是泛素蛋白酶体通路的核心功能。已被证明的是在机体的所有器官中,睾丸器官内的蛋白物质,受泛素蛋白酶体通路调节的比例约是其他器官的4倍。morohoshi等人研究发现,小鼠颗粒细胞泛素连接酶亚基β-trcp(fbxw11)对小鼠的精子生成至关重要。颗粒细胞缺失β-trcp基因会引起成熟精子减少,导致不育。
技术实现要素:
针对上述研究背景,发明人对9头全同胞配对的公牛精液样品进行分组分析,依据《gb4143-2008牛冷冻精液》国家标准,将样本分为高活力组及低活力组。两组通过转录测序,结果显示fbxw11基因在高活力组与低活力组样品中表达差异显著,在低活力组的表达高于在高活力组的表达。进一步的,通过分析fbxw11基因在高、低活力组的dna甲基化差异,筛选获得了11个甲基化位点,所述位点在低活力组的甲基化水平明显高于高活力组。据此,本公开提供了一种基于fbxw11基因甲基化位点评价公牛精子活力高低的方法,通过整合数据得出,低活力精子样品甲基化率≥70%,高活力精子样品甲基化率<55%,可实现对种公牛进行繁殖性能遗传评估以及精子活力评价。
为了实现上述技术效果,本公开提供以下技术方案:
本公开第一方面,提供fbxw11基因或fbxw11基因-99、-92、-86、-77、-71、-68、-65、-56、-52、-47、-43位点作为公牛精子活力判定标志物的应用。
所述位点命名规则如下:将fbxw11基因(ncbi:xm_003587498.5)第一个atg(翻译起始密码子)的a碱基命名为+1,下游方向依次为+2、+3……,上游方向依次为-1、-2……,所述位点分别位于fbxw11基因上游游方向-99、-92、-86、-77、-71、-68、-65、-56、-52、-47、-43处。
tadashinakagawa等人研究表明β-trcp(fbxw11)缺陷的雄性生殖细胞无法进入减数分裂而是直接凋亡。本公开研究则进一步提供了fbxw11基因在低活力的精子样品中具有更高的表达。另外,本领域公知,表观遗传修饰包括dna的修饰及组蛋白的修饰,常见的dna修饰又包括甲基化、乙酰化、磷酸化等,因此针对种公牛性状相关的基因及修饰方式进行筛选对于本领域技术人员来说并非有限的工作量内就可以筛选得到。本公开提供了用于种公牛精子活力筛选的基因,并且进一步提供了可用于精子活力判断的位点,并且通过位点组合甲基化概率的检测方式,为精液品质的鉴定提供了简便可行的方法,具有显著的技术进步。
本公开第二方面,提供检测fbxw11基因表达含量的试剂和/或第一方面所述位点甲基化率的试剂在制备公牛精子活力检测试剂盒中的应用。
通过上述基因及位点的确认,通过检测该基因的表达含量及位点的甲基化概率对于本领域技术人员不具有难度。将检测试剂用于公牛精子活力检测试剂盒的制备,对于本领域技术人员而言也不具有难度,且能够为家畜繁殖企业带来便利。
本公开第三方面,提供检测第一方面所述位点甲基化的引物在制备公牛精子活力检测试剂盒中的应用。
本公开第四方面,提供一种评判公牛精子活力高低的方法,所述方法包括检测公牛精子样品fbxw11基因-99、-92、-86、-77、-71、-68、-65、-56、-52、-47、-43位点的甲基化概率。
优选的,所述位点的甲基化率≥70%判定为低精子活力样品,甲基化率<55%判定为高精子活力样品。
本公开第五方面,提供一种提高种公牛和母牛的繁殖效率的方法,所述方法包括采用第四方面所述判断公牛精子活力高低的方法对种公牛精子活力进行评价。
与现有技术相比,本公开的有益效果是:
1.本公开提供了fbxw11基因中与精子活力的11个甲基化位点,通过检测所述11个位点的甲基化概率,可以方便的对精液样品的质量进行评价,为母牛的繁育提供有效的评价依据,有效提高后代质量,为家畜养殖企业带来经济效益。
2.基于上述基因及位点表达差异的确认,用于检测fbxw11基因的试剂、用于检测fbxw11基因甲基化位点的试剂及引物可用于制备公牛精液质量检测的试剂盒,为公牛与母牛繁育提供使用便利的产品。
附图说明
构成本公开的一部分的说明书附图用来提供对本公开的进一步理解,本公开的示意性实施例及其说明用于解释本公开,并不构成对本公开的不当限定。
图1为实施例1中位点筛选方法流程图;
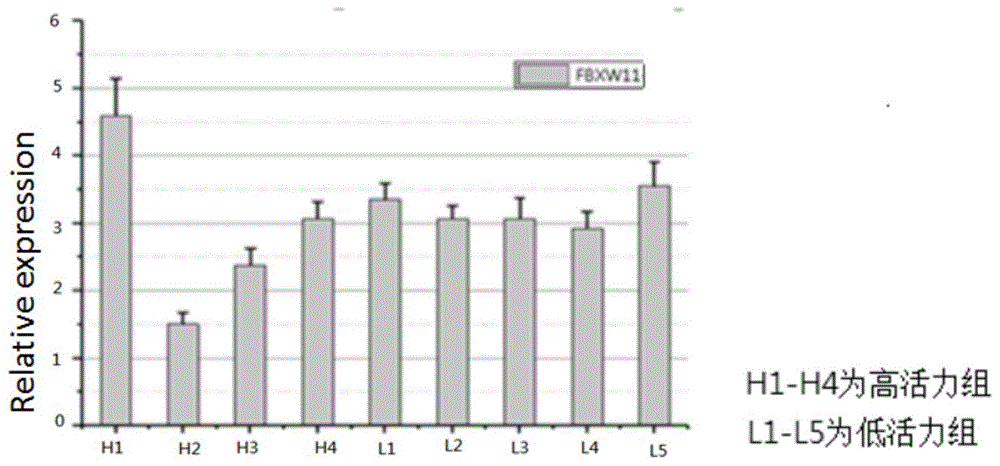
图2为实施例2中通过qpcr分析fbxw11基因的表达结果图;
图3为实施例2中通过蛋白免疫印迹检测fbxw11基因的表达结果图;
图4为实施例2中11个甲基化位点fbxw11基因序列上的位置标注;
图5为实施例2中高精子活力样品与低精子活力样品中甲基化位点差异;
图6为实施例2中对甲基化结果进行皮尔森系数相关性分析。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本公开提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本公开所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本公开的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
正如背景技术所介绍的,发明人在研究中发现全同胞的公牛虽然具有相似的遗传背景,其精液品质的表型却存在显著的差异,推测其性状差异可能与基因的表面修饰相关。通过对高活力及低活力精液样品进行分析,本公开提供了fbxw11基因及fbxw11基因-99、-92、-86、-77、-71、-68、-65、-56、-52、-47、-43位点在公牛精子活力高低判定中的应用。
本公开第一方面,提供fbxw11基因或fbxw11基因-99、-92、-86、-77、-71、-68、-65、-56、-52、-47、-43位点作为公牛精子活力判定标志物的应用。
所述位点命名规则如下:将fbxw11基因(ncbi:xm_003587498.5)上第一个atg的a碱基命名为+1,下游方向依次为+2、+3……,上游方向依次为-1、-2……,所述位点分别位于fbxw11基因上游方向-99、-92、-86、-77、-71、-68、-65、-56、-52、-47、-43处。
本公开第二方面,提供检测fbxw11基因表达含量的试剂和/或第一方面所述位点甲基化率的试剂在制备公牛精子活力检测试剂盒中的应用。
在一些实施例中,所述fbxw11基因表达含量的试剂包括通过qpcr方法或westernblot方法检测公牛精液中fbxw11基因表达含量的试剂。
在一些实施例中,所述检测位点甲基化率的试剂为bisulfitesequencingpcr方法检测甲基化位点的试剂。
本公开第三方面,提供检测第一方面所述位点甲基化率的引物在制备公牛精子活力检测试剂盒中的应用。
在一些实施例中,所述引物包括巢式pcr引物nested1、nested2,所述nested1序列如下:
nested1f:gtttgtygggagttgtagttt
nested1r:actcrataatcttatcctcaatca;
所述nested2序列如下:
nested2f:gtttgtygggagttgtagtttt
nested2r:taatcttatcctcaatcaccraat。
本公开第四方面,提供一种评判公牛精子活力高低的方法,所述方法包括检测公牛精子样品fbxw11基因-99、-92、-86、-77、-71、-68、-65、-56、-52、-47、-43位点的甲基化概率。
优选的,所述位点的甲基化率≥70%判定为低精子活力样品,甲基化率<55%判定为高精子活力样品。
在一些实施例中,所述甲基化概率检测方法为亚硫酸氢盐测序法(bisulfitesequencingpcr)。
在一些实施例中,所述评判方法包括以下步骤:亚硫酸氢盐处理精液样品dna,通过巢式pcr、降落pcr、bisulfitesequencingpcr扩增甲基化位点。
本公开第五方面,提供一种提高种公牛和母牛的繁殖效率的方法,所述方法包括采用第四方面所述判断公牛精子活力高低的方法对种公牛精子活力进行评价。
为了使得本领域技术人员能够更加清楚地了解本公开的技术方案,以下将结合具体的实施例与对比例详细说明本公开的技术方案。
实施例1
本实施例中,针对的fbxw11基因甲基化位点的检测方法进行说明,所述方法包括:
s1.精液样品的采集与储存;
s2.dna提取与浓度测定;
s3.亚硫酸氢盐处理基因组dna;
s4.巢式pcr、降落pcr、bisulfitesequencingpcr扩增甲基化位点;
s5.甲基化位点比对鉴定。
其中,步骤s1中,所述具体方法包括:
s1.1对待测种公牛进行精液的采集,记录相应精液品质参数,根据生产记录对精液样品进行编号处理;
s1.2收集每头种公牛的新鲜精液并立即放入液氮保存。
步骤s2中,所述方法具体包括:
s2.1从每个精液样品中提取基因组dna;
s2.2将基因组dna进行浓度、纯度鉴定;
s2.3将基因组dna进行稀释处理,放入冰箱-20℃保存备用。
其中,
步骤s2.1中,对精子基因组dna提取的方法如下:
1)取2ml离心管,放入一支冻精(0.25ml),加入500μl生理盐水,涡旋混匀,12000rpm离心1min,弃去上清液,保留沉淀(注意:透明的冻精可离心2min);
2)继续加入500μl生理盐水,是沉淀悬浮后,12000rpm离心1min;
3)向沉淀中加入400μl牛冻精裂解液,再加入100μl20%的十二烷基硫酸钠(sds),静止3-5min;然后涡旋,使沉淀完全悬浮于裂解液中,再加入20μl蛋白酶k,颠倒混匀。
4)将装有混合液的离心管放入56℃的分子杂交炉中,消化10h;
5)取出消化好的样品,向离心管中加入300μl饱和食盐水,颠倒2-3min,12000rpm离心10min,将离心后的上清液转移至新的离心管中,弃沉淀。
6)向上清中加入1ml预冷无水乙醇,颠倒1-2min,12000rpm离心1min。弃去上清液,保留沉淀(注意观察,勿将沉淀倒出);
7)向离心管中加入500μl75%乙醇,轻轻混匀,12000rpm离心1min,弃上清液,保留沉淀;
8)重复步骤7,然后开盖放置2-3min,令残留乙醇挥发(时间太长,dna太干,不易溶解);
9)向离心管中加入100μlte溶液(tris和edta配制而成,主要用于溶解核酸),在56℃烘箱中开盖散尽乙醇,并促溶10min,4℃过夜,沉淀溶解;-20℃保存备用。
步骤s2.2中,使用nanodropnd-2000分光光度计(nano-drop,wilmington,de,usa)进行rna质量评估;要求浓度大于200ng/μl,od260/280值为1.8-2.0;
步骤s2.3中,将获得的基因组dna稀释为100ng/μl;
步骤s3中,所述方法具体包括:
s3.1使用bisulflashtmdnamodificationkit对稀释后的全基因dna样品进行亚硫酸氢盐处理;
s3.2对于亚硫酸氢盐处理完成的样品进行-20℃保存,备用。
步骤s4中,所述方法具体包括:
s4.1以甲基化位点为序列模版,设计巢式pcr引物(nested1、nested2),使用降落pcr技术,以亚硫酸氢盐处理后的全基因dna样品为模版,nested1引物对包含甲基化位点序列进行扩增。
表1巢式pcr引物(nested1、nested2)
s4.2以nested1引物扩增的pcr产物为模版,以nested2引物,使用降落pcr技术继续对包含甲基化位点序列进行扩增。
s4.3将包含甲基化位点的序列连接载体,并导入感受态细胞中,平板培养,挑取菌落。
步骤s5中,所述方法具体包括:
s5.1对挑菌的菌落过夜培养,对菌液进行测序。
s5.2测序结果进行鉴定,使用biq_analyzer软件对测序结果上甲基化位点进行鉴定。
实施例2
对9头全同胞配对的公牛精液样品进行分组分析,根据精子活力确定实验分组。具体如下:9头中国荷斯坦公牛具有完整的精液品质生产记录。公牛采精频率为1周/1次,数据记录的内容包括:采精量、精子活力、精子密度、畸形率。根据《gb4143-2008牛冷冻精液》国家标准,将样本分为两组:高精子活力组(≥65%)、低精子活力组(<60%),如表2,其中h1-h4为高活力组,l1-l5为低活力组。
表29头种公牛精液品质生产记录表
通过荧光实时定量pcr技术分析上述9组精液样品测序结果表明fbxw11在高活力组和低活力组样品中的表达存在差异,验证结果如图2所示,fbxw11在h2-h4组的表达含量低于低活力组。
通过westernblot对9组精液样品中fbxw11含量进行检索,结果如图3所示,fbxw11蛋白水平在高活力组及低活力组中存在差异,差异表现与qpcr检测结果表现一致,fbxw11在h1-h4组中的含量表达平均低于低活力组。综合qpcr及westernblot结果可以确定,fbxw11在高活力组中的含量表达低于低活力组。
进一步,利用分子生物学技术,对fbxw11基因在高、低活力组的dna甲基化差异进行分析-。本实施例中采用登记号为ncbi:xm_003587498.5的fbxw11基因序列。将fbxw11基因上第一个atg的a碱基命名为+1,下游方向依次为+2、+3……,上游方向依次为-1、-2……、发现fbxw11基因-321~+140处的一个cpg岛,而在cpg岛中-99~-43处的11个甲基化位点的甲基化水平在两组精液样品中存在明显差异,11个甲基化位点分别位于fbxw11基因-99、-92、-86、-77、-71、-68、-65、-56、-52、-47、-43处,如图4所示。通过实施例1中的方法对上述11个位点的甲基化概率进行检测,检测结果表明上述位点在低活力组的甲基化水平明显高于高活力组。高活力的精液样品甲基化率为h1-35.0%,h2-38.9%,h3-53.2%,h4-46.7%,低精子活力的精液样品甲基化率为l1-74.0%,l2-70.1%,l3-68.8%,l4-70.1%,l5-75.3%,检测结果如图5所示。并且对甲基化结果进行了皮尔森系数相关性分析如图6,显示甲基化位点与精子活力呈负相关。高精子活力的精液样品甲基化率平均为43.45%,其中最大值为53.2%(p<0.05),因此定义精液样品中fbxw11基因甲基化率≤55%为高活力精液,在高精子活力的精液样品甲基化率平均为71.66%,最低甲基化率为68.8%。因此定义精液样品中fbxw11基因甲基化率≥70%(p<0.05)为低活力精液。
以上所述仅为本公开的优选实施例而已,并不用于限制本公开,对于本领域的技术人员来说,本公开可以有各种更改和变化。凡在本公开的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本公开的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!