NCD-2菌株自组成型启动子及其制备方法和应用与流程
本发明属于生物技术领域,尤其涉及一种枯草芽胞杆菌ncd-2菌株自组成型启动子及其制备方法和应用。
背景技术:
枯草芽胞杆菌耐逆性强,对营养要求不严格,适合作为表达载体进行外源基因的表达。但由于枯草芽胞杆菌中存在严格的限制性修饰系统,因此,一些表达载体虽然可以成功转化到枯草芽胞杆菌中,但并非所有基因都能在枯草芽胞杆菌菌株中成功表达,主要是由于没有合适的启动子。
利用菌株自身组成型表达的启动子可以有效的克服启动子不能被调控基因表达的难题。因此,克隆枯草芽胞杆菌自身组成型、高活性的启动子具有重要的理论和应用价值。穿梭载体pad123质粒含有绿色荧光蛋白编码基因(gfp基因),但gfp基因缺少上游启动子,因此,该载体可用于筛选强表达的启动子。另外,ncd-2菌株在植物根部的定殖特性并不明确,需要我们对菌株进行有效标记,进而对其进一步观察与研究。
技术实现要素:
为了解决现有技术存在的问题,本发明提供了一种枯草芽胞杆菌ncd-2菌株自组成型启动子,本发明利用穿梭载体pad123筛选ncd-2菌株中组成型表达的启动子序列,按照所得启动子序列人工合成ncd-2菌株中组成型表达的启动子;利用此启动子可以构建表达载体,并可将构建好的表达载体导入宿主细胞中,以此来构建重组菌株。
本发明所述枯草芽孢杆菌ncd-2于2003年10月15日,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmccno.1019;拉丁学名为:bacillussubtilisncd-2(以下简称ncd-2)。
本发明所采用的技术方案为:
一种枯草芽胞杆菌ncd-2菌株自组成型启动子的核苷酸序列如seqidno:1所示:
tctttttcttgtaactggaacggaggataaaagcgcttgggtatatgggtgaagcgggttgtcataaagctcatgcttgccggtcagctccatcattttgccaagatacattactccgactctgtcgctgatatggcgtacgacactcagatcaaagtagacatcatggcggtcctcctcgtcctttttccttataaggatatgagtgaatgcacttcgttatgttttgtgacaaaaatatgaacattaagcatagaggttgtcaaaagtcgacatcttttgttatcataaggatgtgaaattgatcc(seqidno:1)。
一种制备枯草芽胞杆菌ncd-2菌株自组成型启动子的方法,包括以下步骤:
(1)从枯草芽胞杆菌ncd-2菌株提取ncd-2基因组dna,之后对所述ncd-2基因组dna进行单酶切,再对所述酶切后dna片段进行纯化回收,得到纯化后dna片段;
(2)取pad123质粒进行单酶切,将酶切所得pad123质粒片段进行纯化回收,得到纯化后pad123质粒;
(3)将纯化后dna片段和纯化后pad123质粒混匀,加入连接酶进行连接,得到连接产物;
(4)将连接产物加入到dh5α感受态细胞中进行热激转化,挑取能够发出绿色荧光的菌落并提取所述菌落的质粒pc-1,使用引物对所述pc-1质粒进行pcr扩增和凝胶成像分析,得到目的条带,对所得目的条带进行测序验证,得到所述启动子序列;
(5)利用步骤(4)所得启动子序列人工合成本发明所述自组成型启动子。
进一步地,步骤(1)和步骤(2)中,所述单酶切使用的均为限制性内切酶sacⅰ。
进一步地,步骤(2)中,所述pad123质粒为氨苄青霉素和氯霉素抗性。
进一步地,步骤(3)中,纯化后pad123质粒和纯化后dna片段按照质量比1:(5-7)进行混合,所述连接酶为t4连接酶,所述连接温度为15-17℃。
进一步地,步骤(4)中,所述连接产物与dh5α感受态细胞的比例为1:(9-11),所述引物的核苷酸序列如seqidno:2所示:
5'-cgaaaagtgccacctga-3'。
进一步地,步骤(5)中,委托宝生物工程(大连)有限公司合成。
进一步地,步骤(5)中,人工合成自组成型启动子过程中可在启动子序列一端加入ecori和xbali限制性酶切位点,核苷酸序列如seqidno:3所示。
一种包括所述枯草芽胞杆菌ncd-2菌株自组成型启动子的表达载体。
进一步地,所述表达载体还包括绿色荧光蛋白编码基因。
进一步地,使用质粒pgfp4412与加入ecori和xbali限制性酶切位点的启动子构建表达载体。
进一步地,将质粒pgfp4412采用ecori/xbali进行双酶切,酶切产物采用胶回收技术回收较大片段(约8kb片段);同时将人工合成的加入ecori和xbali限制性酶切位点的ncd-2组成型表达启动子采用ecori/xbali进行双酶切,采用dna回收试剂盒回收dna片段;将质粒胶回收片段与酶切的启动子片段按照1:3比例混匀,同t4连接酶16℃连接过夜;连接产物热击转化大肠杆菌dh5α,转化产物涂布在含有50μg/ml氨苄青霉素的lb培养基上,37℃培养24h;在凝胶成像仪中观察并挑选荧光信号强的菌落进行培养并提取质粒,并命名为pgfpncd。
一种包含所述枯草芽胞杆菌ncd-2菌株自组成型启动子的重组菌株。
进一步地,所述重组菌株还包括绿色荧光蛋白编码基因。
一种制备所述重组菌株的方法为:将所述枯草芽胞杆菌ncd-2菌株自组成型启动子引入宿主细胞中,加入培养基中培养,得到所述重组菌株。
另一种制备所述重组菌株的方法为:将质粒pc-1引入宿主细胞中,在荧光显微镜下观察,挑选能够发出绿色荧光的单菌落即为gfp标记成功的ncd-2菌株,简称gfp标记的ncd-2菌株。
进一步地,所述宿主细胞为枯草芽胞杆菌ncd-2菌株;所述引入为利用电击转化的方法进行的,电击缓冲液组份包括0.5mol/l山梨醇、0.5mol/l甘露醇和10%甘油。
另一种制备所述重组菌株的方法为:将质粒pgfpncd引入宿主细胞中,在荧光显微镜下观察,挑选能够发出绿色荧光的单菌落即为gfp标记的ncd-2菌株。
进一步地,所述宿主细胞为枯草芽胞杆菌ncd-2菌株;所述引入为利用电击转化的方法进行的,电击缓冲液组份包括0.5mol/l山梨醇、0.5mol/l甘露醇和10%甘油。
gfp标记的ncd-2菌株在观察枯草芽胞杆菌ncd-2菌株在植物根部定殖情况中的应用。
本发明的有益效果为:
本发明利用枯草芽胞杆菌ncd-2菌株自身组成型表达的启动子可以有效的克服启动子在枯草芽胞杆菌ncd-2菌株中不能被调控基因表达的难题。本发明所述枯草芽胞杆菌ncd-2菌株自组成型启动子的序列如序列表seqidno:1所示。本发明利用穿梭载体pad123筛选ncd-2菌株中组成型表达的启动子序列;按照所得启动子序列人工合成ncd-2菌株中组成型表达的启动子;利用此启动子可以构建表达载体,并可将构建好的表达载体导入宿主细胞中,以此来构建重组菌株;此菌株可以形成具有三维立体结构的相互连接且相对较固定的生物膜结构,利用所述gfp标记的ncd-2菌株可用于观察枯草芽胞杆菌ncd-2菌株在植物根部的定殖情况。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
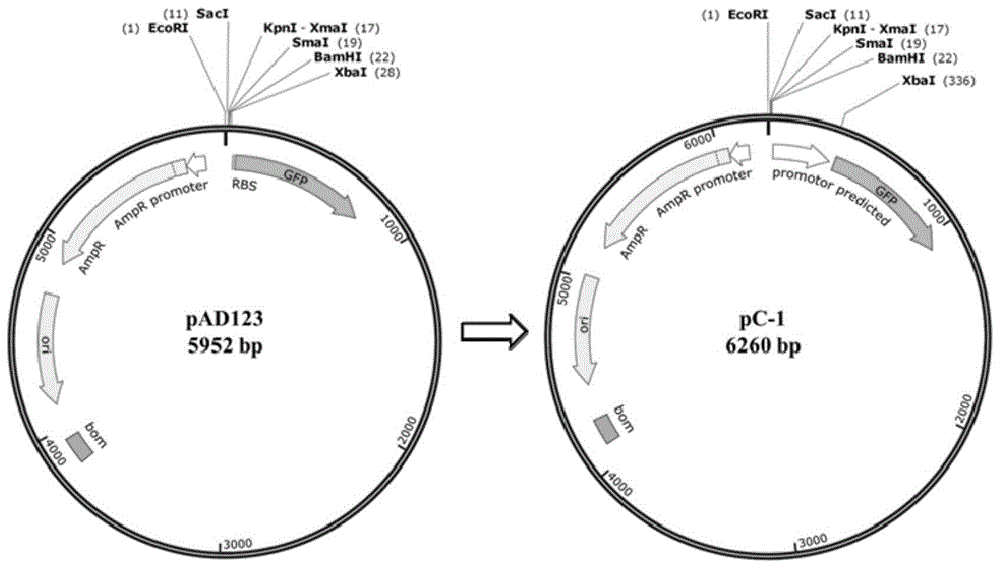
图1是由pad123质粒重组后形成pc-1的过程图;
图2是构建的启动子区域序列分析图;
图3是扩增产物的凝胶成像分析结果图;
图4是gfp标记的ncd-2菌株在棉花根部的定殖情况图;
图5是共聚焦显微镜检测gfp标记的ncd-2菌株的菌体及生物膜形态图;
图6是ncd-2野生型菌株与gfp标记的ncd-2菌株的生长曲线对比图;
图7是ncd-2野生型菌株与gfp标记的ncd-2菌株的生物膜形成能力比较。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的技术方案进行详细的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。
实施例1
本实施例提供一种枯草芽胞杆菌ncd-2菌株自组成型启动子,核苷酸序列如seqidno:1所示。
本实施例还提供一种制备上述自组成型启动子、包含有上述自组成型启动子的表达载体和重组菌株的方法,包括以下步骤:
(1)从枯草芽胞杆菌ncd-2菌株提取ncd-2基因组dna,之后利用限制性内切酶sacⅰ对所述ncd-2基因组dna进行单酶切,再对所述酶切后dna片段进行纯化回收,得到纯化后dna片段;
(2)利用限制性内切酶sacⅰ对pad123质粒进行单酶切,将酶切所得pad123质粒片段进行纯化回收,得到纯化后pad123质粒;
(3)纯化后pad123质粒和纯化后dna片段按照质量比为1:5的比例进行混合,使用t4连接酶在15℃下进行连接,得到连接产物;
(4)将连接产物和dh5α感受态细胞按照质量比为1:9的比例进行热激转化,挑取能够发出绿色荧光的菌落并提取其质粒,得到所述表达载体pc-1;使用序列为seqidno:2的引物对表达载体pc-1进行pcr扩增和凝胶成像分析,得到目的条带,对所得目的条带进行测序验证,得到所述自组成型启动子;
(5)将步骤(4)中所得表达载体pc-1利用电击转化的方法引入枯草芽胞杆菌ncd-2菌株中得到ncd-2菌株的转化子,电击缓冲液组份包括0.5mol/l山梨醇、0.5mol/l甘露醇和10%甘油,将上述转化子挑取单菌落重新转移到新的含有氯霉素的lb平板上,37℃培养过夜,将单菌落轻轻挑到载玻片上,加一滴灭菌水,混匀,在荧光显微镜下观察,挑选能够发出绿色荧光的单菌落,得到所述重组菌株,即gfp标记成功的ncd-2菌株。
实施例2
本实施例提供一种枯草芽胞杆菌ncd-2菌株自组成型启动子,核苷酸序列如seqidno:1所示。
本实施例还提供一种制备上述自组成型启动子、包含有上述自组成型启动子的表达载体和重组菌株的方法,包括以下步骤:
(1)从枯草芽胞杆菌ncd-2菌株提取ncd-2基因组dna,之后利用限制性内切酶sacⅰ对所述ncd-2基因组dna进行单酶切,再对所述酶切后dna片段进行纯化回收,得到纯化后dna片段;
(2)利用限制性内切酶sacⅰ对pad123质粒进行单酶切,将酶切所得pad123质粒片段进行纯化回收,得到纯化后pad123质粒;
(3)纯化后pad123质粒和纯化后dna片段按照质量比为1:7的比例进行混合,使用t4连接酶在17℃进行连接,得到连接产物;
(4)将连接产物和dh5α感受态细胞按照质量比为1:11的比例进行热激转化,挑取能够发出绿色荧光的菌落并提取其质粒,得到所述表达载体pc-1;使用序列为seqidno:2的引物对表达载体pc-1进行pcr扩增和凝胶成像分析,得到目的条带,对所得目的条带进行测序验证,得到所述自组成型启动子序列;
(5)委托宝生物工程(大连)有限公司按照步骤(4)中所得的自组成型启动子序列合成启动子,合成过程中在启动子片段2侧分别加入ecori和xbali限制性酶切位点;将质粒pgfp4412采用ecori/xbali进行双酶切,酶切产物采用胶回收技术回收较大片段(约8kb片段);同时将人工合成的加入ecori和xbali限制性酶切位点的ncd-2组成型表达启动子采用ecori/xbali进行双酶切,采用dna回收试剂盒回收dna片段;将质粒胶回收片段与酶切的启动子片段按照1:3比例混匀,同t4连接酶16℃连接过夜;连接产物热击转化大肠杆菌dh5α,转化产物涂布在含有50μg/ml氨苄青霉素的lb培养基上,37℃培养24h;在凝胶成像仪中观察并挑选荧光信号强的菌落进行培养并提取质粒,并命名为pgfpncd,得到所述含有枯草芽胞杆菌ncd-2菌株自组成型启动子的表达载体;
(6)将质粒pgfpncd利用电击转化的方式引入ncd-2菌株中,电击缓冲液组份包括0.5mol/l山梨醇、0.5mol/l甘露醇和10%甘油,在荧光显微镜下观察,挑选能够发出绿色荧光的单菌落即为gfp标记的ncd-2菌株。
实施例3
本实施例提供一种枯草芽胞杆菌ncd-2菌株自组成型启动子,核苷酸序列如seqidno:1所示。
本实施例还提供一种制备上述自组成型启动子、包含有上述自组成型启动子的表达载体和重组菌株的方法,包括以下步骤:
(1)从枯草芽胞杆菌ncd-2菌株提取ncd-2基因组dna,之后利用限制性内切酶sacⅰ对所述ncd-2基因组dna进行单酶切,再对所述酶切后dna片段进行纯化回收,得到纯化后dna片段;
(2)利用限制性内切酶sacⅰ对pad123质粒进行单酶切,将酶切所得pad123质粒片段进行纯化回收,得到纯化后pad123质粒;
(3)纯化后pad123质粒和纯化后dna片段按照质量比为1:6的比例进行混合,使用t4连接酶进行连接,得到连接产物;
(4)将连接产物和dh5α感受态细胞按照质量比为1:10的比例进行热激转化,挑取能够发出绿色荧光的菌落并提取其质粒,得到所述表达载体pc-1,由pad123质粒重组后形成pc-1的过程如图1所示;对所述质粒pc-1进行测序分析,结果表明,在gfp基因的上游片段插入了2个ncd-2基因组片段,其中一个片段为154bp,序列对比发现与ncd-2基因组中的appf基因的第657bp到810bp的片段100%同源,appf基因与转录起始位点编码的寡肽abc转运体相关,另外一个片段为159bp,与ncd-2基因组中的gms-01216基因(ncbi登录号为cp023755.1)的类似启动子序列100%同源,如图2所示;使用序列为seqidno:2的引物对表达载体pc-1进行pcr扩增,随后对扩增产物进行凝胶成像分析,对所得扩增产物平行做三组检测,凝胶成像分析结果如图3所示,m列为dl2000maker,1-3列是平行三组检测的条带,进而取得目的条带,将所得目的条带进行测序验证,得到所述自组成型启动子序列;
(5)委托宝生物工程(大连)有限公司按照步骤(4)中所得的自组成型启动子序列合成所述自组成型启动子,合成过程中在自组成型启动子片段2侧分别加入ecori和xbali限制性酶切位点;将质粒pgfp4412采用ecori/xbali进行双酶切,酶切产物采用胶回收技术回收较大片段(约8kb片段);同时将人工合成的加入ecori和xbali限制性酶切位点的ncd-2组成型表达启动子采用ecori/xbali进行双酶切,采用dna回收试剂盒回收dna片段;将质粒胶回收片段与酶切的启动子片段按照1:3比例混匀,同t4连接酶16℃连接过夜;连接产物热击转化大肠杆菌dh5α,转化产物涂布在含有50μg/ml氨苄青霉素的lb培养基上,37℃培养24h;在凝胶成像仪中观察并挑选荧光信号强的菌落进行培养并提取质粒,并命名为pgfpncd,得到所述含有枯草芽胞杆菌ncd-2菌株自组成型启动子的表达载体;
(6)将质粒pgfpncd利用电击转化的方式引入ncd-2菌株中,电击缓冲液组份包括0.5mol/l山梨醇、0.5mol/l甘露醇和10%甘油,在荧光显微镜下观察,挑选能够发出绿色荧光的单菌落即为gfp标记的ncd-2菌株。
dh5α菌株和ncd-2菌株长期保存在-80℃冰箱中,需要时在lb固体培养基中进行活化,菌液培养条件为:挑取单菌落于lb液体培养基中,在摇床中180rpm,37℃下摇培12h;按需添加抗生素,种类及浓度为:氨苄青霉素在dh5α菌株中终浓度为50μg/ml,氯霉素在ncd-2菌株中浓度为5μg/ml。其中lb液体培养基:在1000ml水中加入5g酵母提取物、10g胰蛋白胨、5gnacl;lb固体培养基:在1llb液体培养基中加入15g琼脂。
限制性内切酶、t4连接酶、pcr扩增、纯化及回收相关试剂(试剂盒)、ecori/xbali均购自takara宝生物工程有限公司;质粒小提试剂盒购于天根生化科技(北京)有限公司;培养基配方所用药品、dna测序列和所用抗生素皆购自生工生物工程(上海)股份有限公司。
实施例4
本实施例提供了gfp标记成功的ncd-2菌株在植物根部定殖情况中的应用:
(1)具体操作:取1mlgfp标记的ncd-2菌液接种于100ml含有氯霉素的lb液体培养基中继续培养24h,收集菌体并用pbs缓冲液中悬浮菌体至od600=1.6;冀棉11的棉花种子用70%的乙醇处理30s,无菌水冲洗干净后,用5%的次氯酸处理棉花种子15min,再用无菌水彻底冲洗5遍;将表面消毒的棉花种子置于灭菌的纱布上25℃催芽过夜,将催芽的种子播种于装有灭菌土(蛭石∶细土为3∶1,120℃,灭菌2h)的高25cm直径为20cm的圆筒形育苗盒中,生长条件为28℃白天16h,夜间8h,共培养10d;将幼苗根部土壤轻轻抖掉,将棉苗根部浸于配置好的含有gfp标记的ncd-2菌株的pbs缓冲液中,浸泡30min后将幼苗转移到含有200ml霍格兰营养液中,幼苗继续水培,生长条件为28℃白天16h,夜间8h。分别在水培后的第6h、12h、24h和48h取苗;取棉苗根部,将棉苗根部切成长度为1-2cm的根片段,置于载玻片上,用共聚焦显微镜观察生物膜的形成情况;激发波长为488nm,收集波长为500-550nm。图像由leicaconfocal(2.6.0版本)软件处理,试验设五个重复;
pbs缓冲液(ph=6.98):取5ml浓度为0.1mol/l的磷酸二氢钾和6ml浓度为0.1mol/l磷酸氢二钠混合(现配现用);霍格兰营养液的组份包括:在1l水中加入825mgca(no3)2·4h2o、316mgkno3、170mgkh2po4、513mgmgso4·7h2o、1.40mgh3bo3、0.90mgmncl2·4h2o、0.10mgznso4·7h2o、0.05mgcuso4·5h2o、0.02mgnamoo4·2h2o、5.20mgedta·2na、3.90mgfeso4·7h2o。
(2)结果观察:在共聚焦显微镜下检测接种gfp标记的ncd-2菌株后不同时间点在棉花幼苗根部的定殖特点,结果显示,接种6h后,ncd-2菌株开始在棉花根表定殖(图4a);接种12h后,ncd-2菌株主要定殖在表皮层的细胞间隙(图4b);接种24h后,ncd-2菌株在根尖的伸长区和分生区部位形成生物膜结构而在根冠部位未检测到ncd-2菌株(图4c-e),并且ncd-2菌株可定殖到根毛区(图4f);接种48h后,可在棉花根部检测到大量ncd-2菌株,且主要定殖在伸长区(图4g);此外,ncd-2菌株可进入根组织内部定殖到根部微管组织(图4h);另外,虽然在棉花根部的根冠组织中未检测到ncd-2菌株,但在根冠下部的根部边缘细胞可检测到绿色荧光标记的ncd-2菌株(图4i)(比例尺为50μm)。从而说明,利用gfp标记成功的ncd-2菌株能够准确得到ncd-2菌株在植物根部定殖情况。
实验例
一、实施例3所得gfp标记成功的ncd-2菌株的菌体形态和生物膜形成能力观察
1、具体操作:用lb液体培养基将gfp标记的ncd-2菌液稀释为od600=0.3;将菌液按照1:100的比例加入到msgg培养基中混匀,在24孔细胞培养板中提前放置一片灭菌的盖玻片,37℃静置培养24h,待生物膜形成后用镊子轻轻取出带有一层生物膜的盖玻片置于载玻片上,用共聚焦显微镜观察生物膜的形成情况;激发波长为488nm,收集波长为500-550nm。图像由leicaconfocal(2.6.0版本)软件处理,试验设三个重复;
msgg培养基组成包括:2mmmgcl2、5mmk3po4、700μmcacl2、50μmmncl2、50μmfecl3、1μmzncl2、50μg/ml色氨酸、50μg/ml苯丙氨酸、50μg/ml谷氨酸、2μm硫胺素、0.5%甘油、10mm3-(n-吗啡啉)丙磺酸。
2、结果观察:共聚焦显微镜下观察gfp标记的ncd-2菌株的菌体形态,结果显示,gfp标记的ncd-2菌株能够发出强烈的绿色荧光信号(图5a),这表明gfp蛋白可以在ncd-2菌株中表达,荧光标记成功,可用于后续试验;共聚焦显微镜下观察gfp标记的ncd-2菌株的生物膜形态,结果表明,gfp标记的ncd-2菌株可以形成具有三维立体结构的相互连接且相对较固定的生物膜结构(图5b)。
二、野生型枯草芽胞杆菌ncd-2菌株与实施例3所得gfp标记的ncd-2菌株生长曲线比较
1、试验过程:将活化的ncd-2野生型菌株和gfp标记的ncd-2菌株分别接种于装有5mllb培养液的试管中,37℃、180rpm培养12h,再以1%的接种量分别接入到装有200mllb液体培养基中的三角瓶中,37℃、180rpm摇培,每隔2h用酶标仪测定od600值,共检测到48h。
2、结果分析:分别检测ncd-2野生型菌株与gfp标记的ncd-2菌株的生长曲线,结果如图6所示,曲线1为gfp标记的ncd-2菌株的生长曲线,曲线2为ncd-2野生型菌株的生长曲线,gfp标记的ncd-2菌株与野生型菌株的生长曲线基本一致,表明标记的gfp蛋白并不影响ncd-2菌株自身的生长。
三、野生型枯草芽胞杆菌ncd-2菌株及实施例3所得gfp标记的ncd-2菌株的生物膜形成能力比较
1、试验过程:用lb液体培养基将新活化的野生型ncd-2和gfp标记的ncd-2菌液稀释为od600=0.3。将菌液分别按照1:100的比例加入到含有msgg培养基的24孔细胞培养板中用移液枪吹打混匀,置于培养箱中37℃静置培养,24h后观察比较野生型ncd-2和gfp标记的ncd-2菌株的生物膜形成。
2、结果分析:分别检测ncd-2野生型菌株与gfp标记的ncd-2菌株的生物膜形成能力,结果如图7所示,图7a为ncd-2野生型菌株形成的生物膜,图7b为gfp标记的ncd-2菌株形成的生物膜,可以看到gfp标记的ncd-2菌株可以形成较强的生物膜,与野生型菌株相比生物膜形成没有显著差异,表明标记的gfp蛋白并不影响ncd-2菌株生物膜的形成。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
sequencelisting
<110>河北省农林科学院植物保护研究所
<120>ncd-2菌株自组成型启动子及其制备方法和应用
<130>2010
<160>2
<170>patentinversion3.3
<210>1
<211>308
<212>dna
<213>人工序列
<400>1
tctttttcttgtaactggaacggaggataaaagcgcttgggtatatgggtgaagcgggtt60
gtcataaagctcatgcttgccggtcagctccatcattttgccaagatacattactccgac120
tctgtcgctgatatggcgtacgacactcagatcaaagtagacatcatggcggtcctcctc180
gtcctttttccttataaggatatgagtgaatgcacttcgttatgttttgtgacaaaaata240
tgaacattaagcatagaggttgtcaaaagtcgacatcttttgttatcataaggatgtgaa300
attgatcc308
<210>2
<211>17
<212>dna
<213>人工序列
<400>2
cgaaaagtgccacctga17
<210>3
<211>320
<212>dna
<213>人工序列
<400>3
gaattctctttttcttgtaactggaacggaggataaaagcgcttgggtatatgggtgaag60
cgggttgtcataaagctcatgcttgccggtcagctccatcattttgccaagatacattac120
tccgactctgtcgctgatatggcgtacgacactcagatcaaagtagacatcatggcggtc180
ctcctcgtcctttttccttataaggatatgagtgaatgcacttcgttatgttttgtgaca240
aaaatatgaacattaagcatagaggttgtcaaaagtcgacatcttttgttatcataagga300
tgtgaaattgatccagatct320
- 还没有人留言评论。精彩留言会获得点赞!