柯萨奇病毒A10型假病毒的包装及血清中和抗体检测方法与流程
本发明涉及生物技术领域,具体为柯萨奇病毒a10型假病毒的包装及血清中和抗体检测方法。
背景技术:
手足口病(hand,footandmouthdisease,hfmd)是由多种肠道病毒感染引起的,以发热和手、足、口腔出现皮疹、疱疹为临床表现的传染性疾病。肠道病毒71型(enterovirus71,ev71)和柯萨奇病毒a组16型(coxsackievirusa16,ca16)是最主要病原体,但近年来,有研究显示ev71和ca16的感染率呈逐年下降的趋势,而柯萨奇病毒a组6型(coxsackievirusa6,ca6)和柯萨奇病毒a组10型(coxsackievirusa10,ca10)等其他血清型肠道病毒的感染率却在逐年上升。ca10在部分地区已成为仅次于ev71和ca16的hfmd病原体。
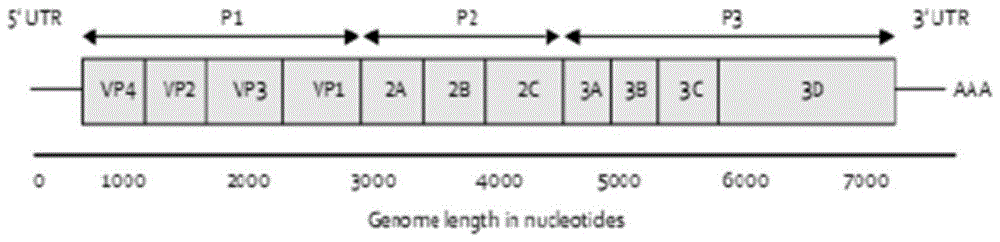
柯萨奇病毒a组10型属小核糖核酸病毒科(picornaviridae),肠道病毒属(enterovirus)a组。ca10病毒结构相对简单,由60个结构蛋白构成的二十面体,直径23-30nm,无包膜。基因组为单股正链rna,约7400bp,该rna通过和内部核糖体结合进行翻译。核酸rna主要分为四部分:5’非编码区,多聚蛋白编码区,可分为p1,p2和p3三部分,p1为结构蛋白编码区,p2和p3为功能性蛋白编码区,3’非编码区。ca10多导致轻症感染,包括hfmd、疱疹性咽峡炎(herpangina,ha)和脱甲症(onychomadesis)等,具体表现为手、足、口腔等部位皮疹、溃疡,发热,咽痛和指甲脱落。中和抗体的检测对ca10流行病学调查研究以及疫苗研发评价有很重要意义。
如果开发一种检测ca10的血清中和抗体检测方法,对手足口病的ca10特异性检测具有重要的意义。
技术实现要素:
为解决以上现有问题,本发明提供柯萨奇病毒a10型假病毒的包装及血清中和抗体检测方法。本发明通过以下技术方案实现。
一种用于包装柯萨奇病毒a10型假病毒的重组表达质粒,所述重组表达质粒命名为ca10-egfp-capsid质粒,所述重组表达质粒具有序列表中seqidno:1所示的核苷酸序列。
进一步的,所述重组质粒使用绿色荧光蛋白报告基因(egfp),在绿色荧光蛋白基因和2a酶切位点后为ca10所有结构蛋白的编码基因(p1基因)。
进一步的,在egfp和p1基因片段之间添加蛋白酶切位点(2a酶切位点,-aittl-)。
更进一步的,一种表达ca10-egfp-capsid重组质粒的方法,包括以下步骤:1)将绿色荧光蛋白的基因序列与ca10所有结构蛋白的基因序列拼接;2)并将2a蛋白酶的酶切位点插入绿色荧光蛋白基因的前段;3)设计引物;
所述引物序列为:
ca10-egfp-facccaagctggctagcgccaccatggtgagcaagggcg
ca10-egfp-rgacttgagctccaagggtagtaatggccttgtac
ca10-p1-fgccattactacccttggagctcaagtctcgacgcaaaaatcc
ca10-p1-rggtgatgatgaccggttaacatattagcttgcttgatactggatcg。
一种假病毒,由ca10-egfp-capsid质粒表达的柯萨奇病毒a10结构蛋白和ev71-luc-replicon复制子转录的ev71亚基因组rna组装而成。
一种包含权利要求5所述假病毒的中和抗体的检测方法,用于体外检测肠道柯萨奇病毒a10的中和抗体。
一种检测柯萨奇病毒a10中和抗体的检测方法,包含以下步骤:1)将所述假病毒与系列稀释的待测抗体样品混合,得到混合物;2)用所述混合物感染肠道柯萨奇病毒b5敏感的细胞,根据敏感的细胞中报告基因的表达物所产生的信号定性或定量检测待测样品中柯萨奇病毒b5特异性中和抗体的效价。
基于以上方案,本发明提供了安全、灵敏、快速、特异、简便且成本低廉的检测ca10中和抗体的方法。由于采用了单周期感染的假病毒,所以没有使用活病毒时的安全问题。中和试验的病毒残余量则对应于进入细胞内的病毒rna亚基因组(删除了结构基因,而代替以荧光素酶基因的病毒基因组)在细胞内表达得到荧光素酶的量。向细胞裂解液加入荧光素酶的底物发生化学发光反应后,荧光素酶的量可由化学发光仪精确定量。荧光素酶化学发光反应读数的对数在较大范围内和残留的病毒量有良好的线性关系,试验过程操作简便,对技术人员要求不高。从成本来说,该方法也比较低廉,可以在96孔细胞内进行大规模的筛选试验。
基于以上特点,该假病毒检测系统非常适合于快速,大规模地检测中和抗体的试验,对于病毒疫苗的研制及检测患者个体及人群手足口病、ca10特异性中和抗体水平有着重要的应用价值。
附图说明
图1为肠道病毒基因组示意图;
图2为单周期感染假病毒示意图;
图3为定量检测待测血浆中和抗体滴度的结果;
图4为ca10假病毒系统的线性范围
图5为ca10假病毒做中和试验特异性结果分析;
图6为ca10假病毒做中和试验重复性结果分析;
图7为假病毒检测和传统cpe检测方法结果相关性;
图8为假病毒检测和传统cpe检测方法结果一致性。
具体实施方式
下面结合实施例和附图对本发明的技术方案作更为详细、完整的说明。实施例中所使用的实验方法如无特殊说明,均为常规方法。所用的材料、试剂等,如无特殊说明,均为市售。
1.实验材料:rd细胞(来源于人横纹肌肉瘤)(购自atcc)和293t细胞(来源于人胚胎肾细胞)(购自atcc)在10%fbs(胎牛血清,购自gibco)的dmem中培养。rd细胞为用于检测中和抗体试验的敏感细胞系。293t细胞被用来包装ca10的假病毒。
2.柯萨奇病毒a组10型表达子质粒构建方法:利用ca10活病毒株(ca10virusstrainca10-2,genbankaccessionno.ky012321,厦门大学夏宁邵教授惠赠),通过病毒rna抽提试剂盒获得ca10病毒株的全基因组(图1所示),并通过特异性引物进行rt-pcr(reversetranscriptionpcr)扩增编码病毒衣壳蛋白基因p1(图2所示)。利用含egfp基因的表达载体pcdna6.0-ca6-egfp-capsid为模板通过pcr扩增获得能够进行无缝连接的egfp片段,为了避免egfp绿色荧光蛋白对衣壳蛋白切割折叠和假病毒颗粒包装的影响,在egfp和p1基因片段之间添加蛋白酶切位点(2a酶切位点,-aittl-),该酶切位点在2a蛋白酶作用下切割将egfp和衣壳蛋白p1分开;为了增强衣壳蛋白在293t中的表达量,在构建衣壳蛋白表达载体的时候通过引物在egfp基因片段前方添加了kozak序列(gccacc)和起始密码子(atg),kozak序列是真核mrna上起始密码子前的最优设计序列,核糖体能够识别该段序列从而提高真核基因的翻译启动效率。通过引物在目的片段结尾添加终止密码子(taa)以结束目的基因的表达。选用选优最优的真核细胞表达载体pcdna6.0同样为了增强衣壳蛋白表达效率;同时,通过限制性内切酶agei,nhei对真核细胞表达载体pcdna6.0进行双酶切。将pcr扩增获得的p1片段和egfp片段及双酶切后的pcdna6.0载体一起进行无缝连接反应。将获得的产物进行转化,挑取单克隆菌落,抽提质粒。利用双酶切法对连接后的质粒进行初步鉴定,琼脂糖凝胶电泳图见图,酶切后条带分子量大小符合预期。测序验证结果显示匹配率100%,ca10衣壳蛋白表达质粒构建正确。将构建的ca10衣壳蛋白表达质粒转染293t细胞,由于在质粒构建时将荧光蛋白egfp和p1融合表达,因此可以通过荧光倒置显微镜观察egfp的亮度来判断p1的表达情况。通过和转染表达egfp质粒的阳性对照进行比较,发光效率>80%,可确定构建的衣壳蛋白表达质粒能够正常表达。
所用引物如下表:
3.转染和假病毒包装
转染前12-14小时在10cm2的细胞培养板上铺293t细胞。转染当天,293t的密度应该达到80-90%。转染前一小时,用10%fbs-dmem培养293t细胞。用购自polyplus,产品目录号为114-15转染10μg三种质粒混合物ca10-egfp-capsid,ev71-luc-replicon,pcdna-t7-polymerase(三种质粒等质量混合),在37℃细胞培养箱内培养。24h后在荧光显微镜下观察egfp荧光蛋白从而判断结构蛋白的表达水平。48h后,将细胞上清收集到15ml管中,在细胞表面留下约500μl的培养基。用剩余培养基将293t细胞重悬起来,并用干冰反复快速冻融两次。将之前收集的培养基上清和冻融过的沉淀混匀,然后再用离心机2,500g离心15分钟,弃沉淀,收集上清,并分装到i.5ml的ep管中,贮存在-80℃冰箱备用。
4.ca10假病毒血清中和实验
在96孔细胞培养板中2-8行中加入培养基,每孔50μl,第1行加入8倍稀释的待测血清样本及已知效价标准血清,每孔100μl,每个血清样品设2个复孔;2倍系列稀释,待测血清样本设8个稀释梯度,标准血清设6个稀释梯度。在细胞空白对照孔中加入100μl培养基,设2个复孔。假病毒阳性对照孔中加入50μl培养基,设2个复孔。按108.5copies/50ul的假病毒使用量稀释假病毒,混匀后4℃冰箱备用。除细胞空白对照孔外,加入ca10假病毒,每孔50μl,轻轻拍打混匀后放置于37℃孵箱中培养孵育2h。中和反应结束后,在96孔细胞培养板中加入2×105个/孔的最佳细胞密度的rd细胞悬液,每孔100μl,放置于37℃孵箱中培养8小时。培养结束,弃上清,加入1×的细胞裂解液,每孔50μl。反复冻融2次,转移冻融后裂解液至96孔白色检测板中,每孔30μl。通过化学发光成像系统检测ca10假病毒感染不同细胞系的化学发光信号强度(relativelightunit,rlu)。结果计算:待测血清效价=待测血清在标准曲线范围内的rlu值对应的标准血清效价×待测血清稀释度。结果见图3所示。
实验相对简便:假病毒的中和试验可以在96孔细胞培养板上进行,每种血清的不同稀释梯度可以做多个复孔,从统计学的角度来讲可以消除孔间差异。假病毒和检测样品的混合物加入细胞培养板后8小时,即可将用裂解液裂解细胞,并用排枪取10ul-30ul裂解样品用于化学发光仪的读数。获取数据时,只需要用化学发光仪自动读取荧光素酶化学发光反应的读数即可。化学发光反应所需要的试剂包括裂解液,荧光素酶的底物,荧光素酶的反应缓冲液,成本低廉。因此假病毒系统检测中和抗体方法快速简便而且数据可靠,成本低廉。结果见图4所示。
单周期感染的优点:假病毒颗粒的包装系统由两部分组成。一个质粒上构建了病毒的结构蛋白基因,另一个质粒上构建了病毒的rna复制子。ca10的假病毒进入细胞时将脱衣壳,并把病毒的复制子rna释放到细胞内部。复制子的5’末端为核糖体内部进入位点(ires)。因此,该元件后的荧光素酶以及非结构蛋白基因都可以被细胞内的核糖体直接翻译。非结构蛋白被翻译后可帮助复制子在细胞内进行复制。假病毒颗粒内的单链正义rna基因组的结构蛋白基因被删除了,并且为荧光素酶基因所代替。因此,假病毒在单次侵入细胞之后,不能够翻译出结构蛋白,所以无法组装出新的感染性病毒颗粒。假病毒感染系统消除了活病毒首次感染后,重复进入细胞的问题。在同一种细胞系上进行感染试验时,假病毒最终感染细胞所得的荧光素酶化学发光反应的读数只受到病毒颗粒在侵入细胞时受到干扰因素(如中和抗体)的影响。
5.ca10假病毒血清中和实验验证
构建的ca10假病毒的主要应用是建立基于假病毒的血清中和评价试验方法(pnt),该部分将从特异性,重复性,与传统微量细胞病变血清中和抗体评价试验方法(cnt)的相关性及一致性方面评价该新方法,从而判断ca10假病毒血清中和试验的可行性。
为了检验ca10假病毒系统的特异性,使用小鼠来源的针对ca10的特异性抗血清(来自用ca10-2灭活病毒免疫过的spf级balb/c小鼠的血清),小鼠来源的针对ev-a71(fy)的特异性抗血清(来自用ev-a71(fy)灭活病毒免疫过的spf级balb/c小鼠的血清),小鼠来源的针对ca16的特异性抗血清(来自用ca16-g10灭活病毒免疫过的spf级balb/c小鼠的血清),小鼠来源的针对ca6-tw的特异性抗血清(来自用ca6-tw灭活病毒免疫过的spf级balb/c小鼠的血清),小鼠来源的针对evd68的特异性抗血清(来自用evd68-bch895a灭活病毒免疫过的spf级balb/c小鼠的血清。对spf级balb/c小鼠的眼眶采血所得到的血清,此为常规制法;spf级balb/c小鼠购自北京维通利华实验动物技术有限公司)对ca10假病毒做中和试验。结果如图5所示。
为检测ca10假病毒血清中和试验方法的重复性,选择高中低各1份血清进行假病毒血清中和试验,每块96孔细胞培养板上重复检测2次,共由2个试验人员操作,重复做3天,即每份血清共检测12次。3份血清的血清效价结果见图,分析可知,每份血清在重复12次试验的条件下,血清效价变化控制在三个稀释度内,说明用ca10假病毒进行血清中和效价评价的试验方法具有良好的重复性。结果见图6所示。
为了检测ca10基于假病毒的血清中和评价试验方法(pnt)与传统微量细胞病变血清中和抗体评价试验方法(cnt)的相关性,本试验用pnt方法对70份ca10阳性人源血清及阴性血清20份进行了血清中和效价评价,该血清来自于华兰生物,cnt试验数据来自于中国食品药品检定研究院试验室检测结果。使用的假病毒批次是20180913,病毒拷贝数是2.2×107/ml。将评价结果(pnt)和传统的基于真病毒的血清效价评价试验的结果(cnt)进行了比较;阴性血清pnt试验和cnt试验检测结果一致,检测血清效价均小于等于8;阳性血清通过graphpadprism5软件对血清试验结果进行统计学spearman相关性分析,比较结果见图。分析可知,两种方法血清检测结果的相关系数是0.78,根据软件判定原则,相关系数小于0.3是弱相关,介于0.3到0.7是相关,大于0.8是强相关;统计显示说明假病毒血清效价检测结果和传统方法具有强相关性,用本课题构建的假病毒通过血清中和试验评价血清效价是可行的。结果见图7所示。
为了检测ca10基于假病毒的血清中和评价试验方法(pnt)与传统微量细胞病变血清中和抗体评价试验方法(cnt)的一致性,本试验进行方法学验证用的是华兰生物70份ca10阳性人源血清,cnt检测结果来自于中国食品药品检定研究院试验室检测结果,cnt试验和pnt试验在同一试验室进行,因此可以对两种方法检测的血清效价进行比较,可以对两种方法的一致性进行分析。通过比较70份血清pnt血清效价和cnt血清效价进行统计学bland-altma一致性性分析,比较结果见图。分析可知,pnt试验和cnt试验两种方法血清检测结果具有较高的一致性。详细分析可知:两种检测方法结果差异的均值为0.14,2倍标准差范围为-0.37-0.65,所有点均在2倍标准差范围内。通过pnt试验检测血清效价均高于cnt试验血清效价,说明pnt试验比cnt试验更加灵敏,考虑到两种方法结果判定标准不同,pnt试验检测结果总体还是与cnt试验检测结果具有较高一致性。结果见图8所示。
基于上述实施例,本发明提供了安全,灵敏,快速,特异,简便且成本低廉的检测中和抗体的方法,可以在96孔细胞内进行大规模的筛选试验。产假病毒时,只需要先对293t细胞转染包含了假病毒的结构基因的质粒,然后再转染病毒的rna复制子。病毒的结构蛋白基因被构建在质粒上,可以在-20℃稳定地贮存。假病毒克服活病毒在传代过程中易发生抗原漂移和操作安全性低等缺点。并且假病毒对于检测中和抗体有很高的灵敏度,仅需少量的血清便检测血清中特异的中和抗体。对于病毒疫苗的研制及检测患者个体及人群cv-b5特异性中和抗体水平有着重要的应用价值。
以上所述仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在没有做出创造性劳动前提下所获得的变化或替换,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!