荧光素生物合成酶及其用途的制作方法
荧光素生物合成酶及其用途
发明领域
1.本发明涉及生物技术和基因工程领域。特别地,本发明涉及真菌生物发光系统的酶。
2.发明背景
3.可以催化荧光素低分子量化合物的氧化并伴随发光或生物发光的酶被称为“荧光素酶”。荧光素的氧化导致氧化荧光素从与荧光素酶的复合物中释放出来。
4.荧光素酶在许多生物医学应用和生物技术中被广泛用作报告基因。例如,在动物模型的致癌研究中,在用于检测介质中微生物或有毒物质的方法中,荧光素酶用于确定细胞的存活力和启动子或生命系统其他组成部分的活性,作为确定各种物质浓度的指标,以可视化信号级联的传递等。[scott等人,分析化学年度综述,2011,4:297
‑
319;badr和tannous,生物技术趋势2011,29:624
‑
33;andreu等人,fems微生物学综述2011,35:360
‑
94]。荧光素酶的许多应用在综述中有描述[kaskova等人,化学学会综述,2016,45:6048
‑
6077;scott等人,分析化学年度综述,2011,4:297
‑
319;widder和falls,ieee量子电子学选刊,2014,20:232
‑
241]。荧光素酶的所有主要应用都是基于取决于所研究的现象或信号的对发射光的检测。通常,这种检测是使用光度计或改进的光学显微镜进行的。
[0005]
已知有成千上万种具有生物发光能力的物种,其中已经描述了约十二种具有各种结构的荧光素和数十种相应的荧光素酶。已经显示出生物发光系统于各种生物中独立地进化了超过四十次[herring,生物发光与化学发光杂志,1987,1:147
‑
63;haddock等人,海洋科学年度综述,2010年;2:443
‑
93]。
[0006]
已经描述了一组催化d
‑
荧光素氧化的昆虫荧光素酶[de wet等人,美国国家科学院院刊,1985,82:7870
‑
3;de wet等人,美国国家科学院院刊,1987,7:725
‑
37]。已经描述了一组催化腔肠素氧化的荧光素酶[o.shimomura,生物发光:化学原理和方法,世界科技出版有限公司,新加坡,2006年,第470页]。已知了海荧(cypridina)属的介形亚纲动物(ostracod)的生物发光系统,其特征在于具有高化学活性的荧光素和高度稳定的荧光素酶[shimomura等人,科学,1969,164:1299
‑
300]。也已知鞭毛藻类和磷虾类的生物发光系统。目前,克隆了编码该组三种荧光素酶的基因[o.shimomura,生物发光:化学原理和方法,世界科技出版有限公司,新加坡,2006年]。然而,该系统仍然研究不足,特别是尚未建立完整的荧光素酶序列。
[0007]
最近几年,已经描述了真菌生物发光系统的一组荧光素酶和荧光素。已经了解真菌生物发光数百年,但直到2015年才鉴定出真菌荧光素:它是3
‑
羟基牛奶树碱(3
‑
hydroxyhispidin),一种能够穿透细胞膜的代谢产物[purtov等人,angewandte chemie,2015,54:8124
‑
28]。同一出版物证实了在真菌裂解物中存在一种能够羟化牛奶树碱(hispidin)而形成荧光素的酶,但是所述酶未进行鉴定。2017年1月30日的专利申请2017102986描述了来自几种真菌的荧光素酶基因,其包含具有如下结构的3
‑
羟基牛奶树碱形式的荧光素:
[0008][0009]
已经表明,真菌荧光素酶也可以催化具有表1所示结构的其他化学化合物的发光氧化反应[kaskova等人,科学进展,2017;3:e1602847]。所有这些化合物是真菌荧光素,包括3
‑
羟基牛奶树碱,属于6
‑
(2
‑
芳基乙烯基)
‑
3,4
‑
二羟基
‑
2h
‑
吡喃
‑2‑
酮类,其通式为:
[0010]
其中r是芳基或杂芳基。
[0011]
表1.真菌荧光素的例子
[0012]
[0013]
[0014][0015]
在绝大多数情况下,促进生物体中荧光素的合成或氧化荧光素还原成荧光素的酶是未知的。因此,荧光素的大多数生物发光应用包括将含外源荧光素酶的荧光素(例如细胞培养物或生物体)引入系统。结果,由于多种原因而限制了生物发光系统的使用,这些原因包括,特别地,许多荧光素透过细胞膜的渗透能力差,荧光素的化学不稳定性以及荧光素合成的过程复杂、多步骤且昂贵。
[0016]
促进荧光素合成的酶被认为是在海洋细菌中描述的唯一的生物发光系统。然而,该系统与其他生物发光系统明显不同。在反应过程中细菌荧光素(肉豆蔻醛)被氧化,但不发光[o.shimomura,《生物发光:化学原理和方法》,世界科技出版有限公司,新加坡,2006年,第470页]。除了荧光素以外,发光反应的关键组成部分还包括nad(烟酰胺腺嘌呤二核苷酸)和fmn
‑
h2(黄素单核苷酸)。fmn
‑
h2的氧化衍生物作为真正的光源。海洋细菌的生物发光系统是目前唯一可以在异源表达系统中被完全编码并且被认为是本发明的最接近现有技术的系统。然而,该系统通常仅适用于原核生物。为了获得自主的生物发光,使用了luxcdabe操纵子,其编码荧光素酶(luxa和luxb异二聚体)和用作生物发光基质的luxcde荧光素的生物合成蛋白(meighen 1991)。2010年,该系统用于实现人类细胞的自主发光。然而,低的生物发光强度水平,仅比非生物发光细胞发出的信号高12倍使其无法用于已开发的系统来解决大多数应用问题[close等人,plos one,2010,5(8):e12441)。由于细菌系统成分对真核细胞的毒性,因此对增加发射光强度的尝试未成功[hollis等人欧洲生化学会联合会快报,2001,506(2):140
‑
42]。
[0017]
在此观点中,从细胞中稳定和/或丰富的前体化合物促进荧光素合成以及将氧化荧光素还原到荧光素的酶的鉴定是一个迫切的问题。鉴定此类酶将使合成荧光素的方法更简单、更便宜,并为创建自主生物发光系统开辟道路。其中,对真核细胞无毒的生物发光系统特别令人关注。
[0018]
发明概述
[0019]
申请人已经对真菌的生物发光系统中的荧光素生物合成阶段进行了解码,并鉴定了涉及真菌荧光素循环的酶以及编码它们的核酸序列。
[0020]
下面的流程图显示了真菌荧光素转化的步骤:
[0021][0022]
因此,本发明首先提供了分离的真菌荧光素生物合成蛋白以及编码它们的核酸。
[0023]
在优选的实施方式中,本发明提供了牛奶树碱羟化酶,其特征在于选自以下seq id no组:2、4、6、8、10、12、14、16、18、20、22、24、26、28的氨基酸序列;以及与这些牛奶树碱羟化酶基本相似的蛋白质、同源物、突变体和衍生物。
[0024]
在一些实施方式中,本发明的牛奶树碱羟化酶的特征在于氨基酸序列与选自以下seq id no组:2、4、6、8、10、12、14、16、18、20、22、24、26、28的氨基酸序列在至少350个氨基酸内具有至少60%同一性、或至少65%同一性、或至少70%同一性、或至少75%同一性,例如,至少80%同一性、至少85%同一性、至少90%同一性(例如,至少90%、91%、92%、93%、94%、95%、96%、97%、98%、98%或99%同一性)。
[0025]
在一些实施方式中,本发明的牛奶树碱羟化酶的氨基酸序列的特征在于存在以如下seq id no:29
‑
33为特征的由非保守氨基酸插入区段分隔的一些共有序列。
[0026]
本发明的牛奶树碱羟化酶催化具有以下结构的6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮
[0027][0028]
转化为6
‑
(2
‑
芳基乙烯基)
‑
3,4
‑
二羟基
‑
2h
‑
吡喃
‑2‑
酮的反应,其具有结构
[0029]
其中r是芳基或杂芳基。
[0030]
本发明还提供了牛奶树碱合酶,其特征在于氨基酸序列选自以下seq id no组:
35、37、39、41、43、45、47、49、51、53、55;以及与这些牛奶树碱合酶基本相似的蛋白质、同源物、突变体和衍生物。
[0031]
在一些实施方式中,本发明的牛奶树碱合酶的氨基酸序列的特征在于存在以下面的seq id no:56
‑
63为特征的由非保守氨基酸插入区段分隔的一些共有序列。
[0032]
在一些实施方式中,本发明的牛奶树碱合酶的特征在于氨基酸序列与选自以下seq id no组:35、37、39、41、43、45、47、49、51、53、55的氨基酸序列具有至少40%同一性,例如,至少45%同一性、或至少50%同一性、或至少55%同一性、或至少60%同一性、或至少65%同一性、或至少70%同一性、或至少75%同一性,例如,至少80%同一性、至少85%同一性、至少90%同一性(例如,至少90%、91%、92%、93%、94%、95%、96%、97%、98%、98%或99%的同一性)。
[0033]
本发明的牛奶树碱合酶催化具有以下结构式的3
‑
芳基丙烯酸
[0034]
其中r选自芳基或杂芳基
[0035]
转化为6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮的反应,其具有结构式
[0036]
其中r是芳基或杂芳基。
[0037]
此外,本发明提供了咖啡酰丙酮酸水解酶,其特征在于选自以下seq id no组:65、67、69、71、73、75的氨基酸序列;以及与这些咖啡酰丙酮酸水解酶基本相似的蛋白质、同源物、突变体和衍生物。
[0038]
在一些实施方式中,本发明的咖啡酰丙酮酸水解酶的氨基酸序列的特征在于存在以如下seq id no:76
‑
78为特征的由非保守氨基酸插入区段分隔的一些共有序列。
[0039]
在一些实施方式中,本发明的咖啡酰丙酮酸水解酶的特征在于氨基酸序列与选自以下seq id no组:65、67、69、71、73、75的氨基酸序列具有至少60%同一性、或至少65%同一性、或至少70%同一性或至少75%同一性,例如,至少80%同一性、至少85%同一性、至少90%同一性(例如,至少90%、91%、92%、93%、94%、95%、96%、97%、98%、98%或99%的同一性)。
[0040]
本发明的咖啡酰丙酮酸水解酶催化具有以下结构式的6
‑
芳基
‑2‑
羟基
‑4‑
氧代己
‑
2,5
‑
二烯酸
[0041]
其中r是芳基或杂芳基
[0042]
转化为3
‑
芳基丙烯酸的反应,其具有结构式
[0043]
[0044]
在优选的实施方式中,本发明的牛奶树碱羟化酶催化前荧光素(preluciferin)转化为真菌荧光素的反应,例如,牛奶树碱转化为3
‑
羟基牛奶树碱。
[0045]
在优选的实施方式中,本发明的牛奶树碱合酶催化前荧光素前体转化为前荧光素,例如,将咖啡酸转化为牛奶树碱。
[0046]
在优选的实施方式中,本发明的咖啡酰丙酮酸水解酶催化真菌氧化荧光素转化为前荧光素的前体,例如,将咖啡酰丙酮酸酯转化为咖啡酸。
[0047]
本发明还提供了具有以下氨基酸序列的蛋白质的应用,该氨基酸序列与选自以下seq id no组:2、4、6、8、10、12、14、16、18、20、22、24、26、28的氨基酸序列在至少350个氨基酸内具有至少60%同一性、或至少65%同一性、或至少70%同一性、或至少75%同一性,例如,至少80%同一性、至少85%同一性、至少90%同一性(例如,至少90%、91%、92%、93%、94%、95%、96%、97%、98%、98%或99%的同一性),和/或包含被非保守氨基酸插入区段分隔的seq id no 29
‑
33所示的共有序列,作为牛奶树碱羟化酶催化具有结构式的6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮转化为具有结构式其中r是芳基或杂芳基的6
‑
(2
‑
芳基乙烯基)
‑
3,4
‑
二羟基
‑
2h
‑
吡喃
‑2‑
酮的体外或体内反应。
[0048]
本发明还提供了具有以下氨基酸序列的蛋白质的应用,该氨基酸序列与选自以下seq id no组:35、37、39、41、43、45、47、49、51、53、55的氨基酸序列具有至少45%同一性、或至少50%同一性、或至少55%同一性、或至少60%同一性或至少65%同一性、或至少70%同一性、或至少75%同一性,例如,至少80%同一性,至少85%同一性,至少90%同一性(例如,至少90%,91%,92%,93%,94%,95%,96%,97%,98%,98%或99%的同一性),和/或包含被非保守氨基酸插入区段分隔的seq id no 56
‑
63所示的共有序列,作为牛奶树碱合酶来催化具有结构式的3
‑
芳基丙烯酸转化为具有结构式其中r为芳基或杂芳基的6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮的体外或体内反应。
[0049]
本发明还提供了具有如下氨基酸序列的蛋白质的应用,该氨基酸序列与选自以下seq id no组:65、67、69、71、73、75的氨基酸序列具有至少60%同一性、或至少65%同一性、或至少70%同一性、或至少75%同一性,例如,至少80%同一性、至少85%同一性、至少90%同一性(例如,至少90%、91%、92%、93%、94%、95%、96%、97%、98%、98%或99%的同一性),和/或包含被非保守氨基酸插入区段分隔的seq id no 76
‑
78所示的共有序列,作为咖
啡酰丙酮酸水解酶催化具有结构式其中r为芳基或杂芳基的6
‑
芳基
‑2‑
羟基
‑4‑
氧代己
‑
2,5
‑
二烯酸,转化为具有结构式的3
‑
芳基丙烯酸的体外或体内反应。
[0050]
本发明还提供了编码所述牛奶树碱羟化酶、牛奶树碱合酶和咖啡酰丙酮酸水解酶的核酸。
[0051]
在一些实施方式中,提供了编码牛奶树碱羟化酶的核酸,具有选自下组的氨基酸序列:
[0052]
(a)如下列seq id no:2、4、6、8、10、12、14、16、18、20、22、24、26、28所示的氨基酸序列;
[0053]
(b)与选自以下seq id no组:2、4、6、8、10、12、14、16、18、20、22、24、26、28的氨基酸序列在至少350个氨基酸中具有至少60%同一性,或至少65%同一性,或至少70%同一性,或至少75%同一性,例如,至少80%同一性、至少85%同一性、至少90%同一性(例如,至少90%、91%、92%、93%、94%、95%、96%、97%、98%、98%或99%的同一性)的氨基酸序列;
[0054]
(c)包含如下seq id no:29
‑
33所示的共有序列的氨基酸序列。
[0055]
在一些实施方式中,提供了编码牛奶树碱合酶的核酸,具有选自下组的氨基酸序列:
[0056]
(a)如下列seq id no:35、37、39、41、43、45、47、49、51、53、55所示的氨基酸序列;
[0057]
(b)与选自以下seq id no组:35、37、39、41、43、45、47、49、51、53、55的氨基酸序列具有至少40%同一性,例如,具有至少45%同一性、或至少50%同一性、或至少55%同一性、或至少60%同一性、或至少65%同一性、或至少70%同一性、或至少75%同一性,例如,至少80%同一性、至少85%同一性、至少90%同一性(例如,至少90%、91%、92%、93%、94%、95%、96%、97%、98%、98%或99%的同一性)的氨基酸序列;
[0058]
(c)包含如下列seq id no:56
‑
63所示的共有序列的氨基酸序列。
[0059]
在一些实施方式中,提供编码咖啡酰丙酮酸水解酶的核酸,具有选自下组的氨基酸序列:
[0060]
(a)如下列seq id no:65、67、69、71、73、75所示的氨基酸序列;
[0061]
(b)与选自以下seq id no组:65、67、69、71、73、75的氨基酸序列具有至少60%同一性,或至少65%同一性,或至少70%同一性,或至少75%同一性,例如,至少80%同一性、至少85%同一性、至少90%同一性(例如,至少90%、91%、92%、93%、94%、95%、96%、97%、98%、98%或99%的同一性)的额氨基酸;
[0062]
(c)包含被非保守氨基酸插入区段分隔的seq id no:76
‑
78所示的共有序列的氨基酸序列。
[0063]
本发明还提供了编码蛋白质的核酸的应用,该蛋白质的氨基酸序列与选自以下seq id no组:2、4、6、8、10、12、14、16、18、20、22、24、26、28的氨基酸序列在至少350个氨基
酸内具有至少60%同一性、或至少65%同一性、或至少70%同一性、或至少75%同一性,例如,至少80%同一性、至少85%同一性、至少90%同一性(例如,至少90%、91%、92%、93%、94%、95%、96%、97%、98%、98%或99%的同一性),和/或包含被非保守氨基酸插入区段分隔的seq id no 29
‑
33所示的共有序列,用于在体外或体内体系中产生牛奶树碱羟化酶来催化具有结构式的6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮转化为具有结构式其中r是芳基或杂芳基的6
‑
(2
‑
芳基乙烯基)
‑
3,4
‑
二羟基
‑
2h
‑
吡喃
‑2‑
酮。
[0064]
本发明还提供了编码蛋白质的核酸的应用,该蛋白质的氨基酸序列与选自以下seq id no组:35、37、39、41、43、45、47、49、51、53、55的氨基酸序列具有至少45%同一性、或至少50%同一性、或至少55%同一性、或至少60%同一性或至少65%同一性、或至少70%同一性、或至少75%同一性,例如,至少80%同一性,至少85%同一性,至少90%同一性(例如,至少90%,91%,92%,93%,94%,95%,96%,97%,98%,98%或99%的同一性),和/或包含被非保守氨基酸插入区段分隔的seq id no 56
‑
63所示的共有序列,用于在体外或体内体系中产生牛奶树碱合酶来催化具有结构式的3
‑
芳基丙烯酸转化为具有结构式其中r为芳基或杂芳基的6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮。
[0065]
本发明还提供了编码蛋白质的核酸的应用,该蛋白质的氨基酸序列与选自以下seq id no组:65、67、69、71、73、75的氨基酸序列具有至少60%同一性、或至少65%同一性、或至少70%同一性、或至少75%同一性,例如,至少80%同一性、至少85%同一性、至少90%同一性(例如,至少90%、91%、92%、93%、94%、95%、96%、97%、98%、98%或99%的同一性),和/或包含被非保守氨基酸插入区段分隔的seq id no 76
‑
78所示的共有序列,用于在体外或体内体系中产生咖啡酰丙酮酸水解酶来催化具有结构式其中r为芳基或杂芳基的6
‑
芳基
‑2‑
羟基
‑4‑
氧代己
‑
2,5
‑
二烯酸,转化为具有结构式的3
‑
芳基丙烯酸。
[0066]
本发明还提供了一种融合蛋白,包括可操作地、直接地或通过氨基酸接头交联至
少一种本发明的牛奶树碱羟化酶,和/或至少一种本发明的牛奶树碱合酶,和/或至少一种本发明的咖啡酰丙酮酸水解酶,和细胞内定位信号,和/或信号肽,和/或能够氧化真菌荧光素同时发光的荧光素酶。
[0067]
能够氧化真菌荧光素同时发光的荧光素酶是本领域已知的。在优选的实施方式中,它具有与选自以下seq id no组:80、82、84、86、88、90、92、94、96、98的氨基酸序列基本相似或相同的氨基酸序列。例如,它可能具有与选自以下seq id no组:80、82、84、86、88、90、92、94、96、98的氨基酸序列具有至少40%同一性,例如,至少45%同一性,或至少50%同一性,或至少55%同一性,或至少60%同一性,或至少70%同一性,或至少75%同一性,或至少80%同一性,或至少85%同一性的氨基酸序列。在许多实施方式中,所述荧光素酶的氨基酸序列与选自以下seq id no组:80、82、84、86、88、90、92、94、96、98的氨基酸序列具有至少90%同一性,或至少95%同一性(例如,至少96%、97%、98%、98%或99%的同一性)。
[0068]
在一些实施方式中,融合蛋白具有seq id no 101所示的氨基酸序列。
[0069]
本发明还提供了编码所述融合蛋白的核酸。
[0070]
本发明还提供了一种表达盒,包括:(a)在宿主细胞中起作用的转录起始结构域;(b)编码真菌荧光素生物合成酶,即牛奶树碱合酶、牛奶树碱羟化酶或咖啡酰丙酮酸水解酶,或根据本发明的融合蛋白的核酸;(c)在宿主细胞中起作用的转录终止结构域。
[0071]
本发明还提供了一种用于将核酸转移到宿主细胞中的载体,包括编码本发明的真菌荧光素生物合成酶(即牛奶树碱合酶、牛奶树碱羟化酶或咖啡酰丙酮酸水解酶)或本发明的融合蛋白的核酸。
[0072]
本发明还提供了一种宿主细胞,其包括作为染色体外元件的一部分或由于将所述盒引入所述细胞而被整合到细胞基因组中,该表达盒包含编码本发明的牛奶树碱合酶和/或牛奶树碱羟化酶和/或咖啡酰丙酮酸水解酶的核酸。由于所述引入核酸的表达,这种细胞产生至少一种所述真菌荧光素生物合成酶。
[0073]
本发明还提供了一种使用本发明的蛋白质获得的抗体。
[0074]
本发明还提供了一种在体外或体内的体系中产生化学式为6
‑
(
‑2‑
芳基乙烯基)
‑
3,4
‑
二羟基
‑
2h
‑
吡喃
‑2‑
酮,结构式为其中r是芳基或杂芳基的真菌荧光素的方法,其包括在生理条件下将至少一个根据本发明的牛奶树碱羟化酶分子与至少一个具有结构式的6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
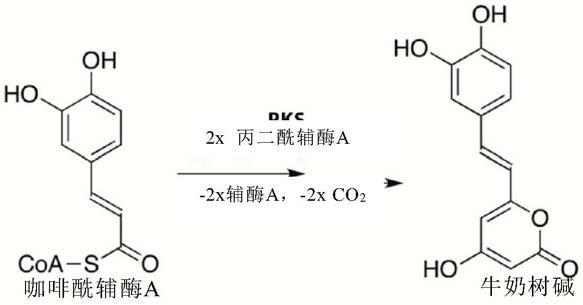
‑
2h
‑
吡喃
‑2‑
酮分子、至少一个nad(p)h分子和至少一个分子氧分子结合。
[0075]
本发明还提供了一种在体外或体内的体系中产生化学式为6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮,结构式为其中r是芳基或杂芳基的真菌前荧光素的
方法,其包括在生理条件下将至少一个结构式为的3
‑
芳基丙烯酸分子与至少一个根据本发明的牛奶树碱合酶分子、至少一个辅酶a(coa)分子、至少一个atp分子和至少两个丙二酰辅酶a分子结合。
[0076]
本发明还提供了一种用于体外或体内产生真菌荧光素的方法,包括在生理条件下将至少一个根据本发明的牛奶树碱羟化酶分子与至少一个3
‑
芳基丙烯酸分子、至少一个根据本发明的牛奶树碱合酶、至少一个辅酶a分子、至少一个atp分子、至少两个丙二酰辅酶a分子、至少一个nad(p)h分子和至少一个分子氧分子结合。
[0077]
产生真菌荧光素和前荧光素的方法可以在细胞或生物体中实施。在这种情况下,所述方法包括将能够在细胞或生物体中表达所述酶的编码相应的荧光素生物合成酶(牛奶树碱合酶和/或牛奶树碱羟化酶)的核酸引入细胞。在优选的实施方式中,核酸作为本发明的表达盒或载体的一部分被引入细胞或生物体中。
[0078]
在一些实施方式中,额外将编码4'
‑
磷酸泛酰巯基乙胺基转移酶(能够在聚酮化合物合酶的酰基转移域中,将4'
‑
磷酸泛酰巯基乙胺基从辅酶a转移到丝氨酸)的核酸引入细胞或生物体中。在一些实施方式中,4'
‑
磷酸泛酰巯基乙胺基转移酶具有与seq id no 105基本相似或相同的氨基酸序列。
[0079]
本发明还提供了聚酮化合物合酶(polyketide synthase,pks)的应用来在体外或体内系统中产生牛奶树碱,该酶的氨基酸序列与选自以下seq id no组:119、121、123、125、127、129、131、133、135、137、139的序列具有至少40%、或至少45%、或至少50%、或至少55%、或至少60%、至少65%、或至少70%、或至少80%、或至少85%、或至少90%、或至少91%、或至少92%、或至少93%、或至少94%、或至少95%、或至少96%、或至少96%、或至少98%、或至少99%的同一性。
[0080]
在一些实施方式中,用于制备牛奶树碱的方法包括在生理条件下将至少一个pks分子与至少两个丙二酰辅酶a分子和至少一个咖啡酰辅酶a分子结合。在一些实施方式中,所述方法包括在生理条件下将至少一个pks分子与至少两个丙二酰辅酶a分子、至少一个咖啡酸分子、至少一个辅酶a分子、至少一个香豆酸辅酶a连接酶分子和至少一个atp分子结合。
[0081]
出于本发明的目的,任何香豆酸辅酶a连接酶可以被用于催化咖啡酸转化为咖啡酰辅酶a。例如,香豆酸辅酶a连接酶可以具有与seq id no 141所示的序列至少40%、或至少45%、或至少50%、或至少55%、或至少60%、或至少65%、或至少70%、或至少80%、或至少85%、或至少90%、或至少91%、或至少92%、或至少93%、或至少94%、或至少95%、或至少96%、或至少97%、或至少98%、或至少99%相同的氨基酸序列。
[0082]
所述反应可用于任何所述方法中,而不是使用本发明的牛奶树碱合酶由前荧光素的前体产生真菌前荧光素的反应。例如,该反应可通过将具有编码pks的核酸的表达盒引入细胞或生物体中在细胞或生物体中进行。如果需要,可以将香豆酸辅酶a连接酶编码核酸额外引入细胞或生物体中。
[0083]
在一些实施方式中,将3
‑
芳基丙烯酸生物合成酶编码核酸进一步引入同一细胞或生物体中。例如,这些可以是编码酪氨酸解氨酶的核酸,其氨基酸序列基本相似或相同于具
有seq id no:107的荚膜红球菌的酪氨酸解氨酶的氨基酸序列,或者是编码4
‑
羟苯乙酸酯3
‑
单加氧酶还原酶的hpab和hpac组分的核酸,其氨基酸序列基本上类似于具有seq id nos 109和111的大肠杆菌的4
‑
羟基苯基乙酸酯3
‑
单加氧酶还原酶的hpab和hpac组分的序列。在一些实施方式中,使用了苯丙氨酸解氨酶编码核酸,其氨基酸序列基本类似于具有seq id no 117的氨基酸序列。
[0084]
本发明还提供了产生转基因生物发光细胞或生物体的方法,其包括植物、动物、细菌或真菌的细胞或生物体。
[0085]
在优选的实施方式中,用于产生转基因生物发光细胞或生物体的方法包括将至少一种本发明的核酸与编码能够氧化真菌荧光素同时发光的荧光素酶的核酸一起引入细胞或生物体中。将核酸以使其能够表达和产生功能性蛋白质产物的形式引入细胞或生物体中。例如,核酸可以被包含在表达盒中。由于表达盒插入到所述细胞中,因此核酸可以作为染色体外元件的一部分或整合进细胞的基因组中存在于细胞中。
[0086]
在优选的实施方式中,用于产生转基因生物发光细胞或生物体的方法包括将编码本发明的牛奶树碱羟化酶的核酸和编码能够氧化真菌荧光素同时发光的荧光素酶的核酸引入细胞或生物体。结果,所述细胞或生物体在化学式为6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮且结构式为其中r为芳基或杂芳基的真菌前荧光素的存在下获得了生物发光的能力。
[0087]
在一些实施方式中,牛奶树碱羟化酶和荧光素酶融合蛋白编码核酸替代编码牛奶树碱合酶和荧光素酶的核酸被引入细胞。
[0088]
在一些实施方式中,用于产生转基因生物发光细胞或生物的方法还包括将本发明的牛奶树碱合酶编码核酸引入细胞或生物体中。所述细胞或生物体在以结构式其中r是芳基或杂芳基的3
‑
芳基丙烯酸的形式的真菌前荧光素前体的存在下获得生物发光的能力。
[0089]
在一些实施方式中,pks编码核酸替代牛奶树碱合酶编码核酸被引入细胞。
[0090]
在一些实施方式中,用于产生转基因生物发光细胞或生物体的方法还包括将本发明的咖啡酰丙酮酸水解酶编码核酸引入细胞或生物体中以增加生物发光的强度。
[0091]
在一些实施方式中,用于产生转基因生物发光细胞或生物体的方法还包括将4'
‑
磷酸泛酰巯基乙胺基转移酶编码核酸引入细胞或生物体中。
[0092]
在一些实施方式中,用于产生转基因生物发光细胞或生物体的方法还包括将香豆酸辅酶a连接酶编码核酸引入细胞或生物体中。
[0093]
在一些实施方式中,用于产生转基因生物发光细胞或生物体的方法还包括将3
‑
芳基丙烯酸生物合成酶编码核酸引入细胞或生物体中。
[0094]
本发明还提供了通过所述方法得到的转基因生物发光细胞和生物体,其包含一种或多种本发明的核酸作为染色体外元件的一部分或整合到细胞的基因组中。
[0095]
在一些实施方式中,本发明的转基因生物发光细胞和生物体能够自主生物发光而无需外源添加荧光素、前荧光素和前荧光素的前体。
[0096]
本发明还提供了本发明的蛋白质和核酸的组合,以及包含本发明的蛋白质和核酸的产品和试剂盒。例如,提供了核酸的组合用于产生自主发光的细胞、细胞系或转基因生物;测定启动子的活性或标记细胞。
[0097]
在一些实施方式中,提供了用于产生真菌荧光素和/或真菌前荧光素的试剂盒,包括所述牛奶树碱羟化酶,和/或牛奶树碱合酶和/或pks,或编码它们的核酸。
[0098]
在一些实施方式中,提供了用于产生包含牛奶树碱羟化酶编码核酸和荧光素酶编码核酸的生物发光细胞或生物发光转基因生物体的试剂盒,所述荧光素酶能够氧化真菌荧光素同时发光。该试剂盒还可包含咖啡酰丙酮酸水解酶编码核酸。该试剂盒还可包含牛奶树碱合酶或pks编码核酸。该试剂盒还包含4'
‑
磷酸泛酰巯基乙胺基转移酶编码核酸和/或香豆酸辅酶a连接酶编码核酸和/或3
‑
芳基丙烯酸生物合成酶编码核酸。该试剂盒还可包含其他组分,例如缓冲液、抗体、真菌荧光素、真菌前荧光素、真菌前荧光素的前体等。该试剂盒还可包含试剂盒应用指南。在一些实施方式中,在表达盒或载体中提供了核酸用于引入细胞或生物体中。
[0099]
在优选的实施方式中,本发明的细胞或转基因生物能够从前体中产生真菌荧光素。在一些实施方式中,本发明的细胞和转基因生物能够在真菌荧光素的前体存在下进行生物发光。在一些实施方式中,本发明的细胞或转基因生物体能够自主生物发光。
[0100]
在以上公开的方法和应用的优选实施方式中,使用化学式为6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮的选自下组的前荧光素:
[0101]
(e)
‑6‑
(3,4
‑
二羟基苯乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮(牛奶树碱),
[0102]
(e)
‑4‑
羟基
‑6‑
苯乙烯基
‑
2h
‑
吡喃
‑2‑
酮,
[0103]
(e)
‑4‑
羟基
‑6‑
(4
‑
羟基苯乙烯基)
‑
2h
‑
吡喃
‑2‑
酮(双去甲洋蒿宁,bisnoryangonin),
[0104]
(e)
‑4‑
羟基
‑6‑
(2
‑
羟基苯乙烯基)
‑
2h
‑
吡喃
‑2‑
酮,
[0105]
(e)
‑4‑
羟基
‑6‑
(2,4
‑
二羟基苯乙烯基)
‑
2h
‑
吡喃
‑2‑
酮,
[0106]
(e)
‑4‑
羟基
‑6‑
(4
‑
羟基
‑
3,5
‑
二甲氧基苯乙烯基)
‑
2h
‑
吡喃
‑2‑
酮,
[0107]
(e)
‑4‑
羟基
‑6‑
(4
‑
羟基
‑3‑
甲氧基苯乙烯基)
‑
2h
‑
吡喃
‑2‑
酮,
[0108]
(e)
‑4‑
羟基
‑6‑
(2
‑
(6
‑
羟基萘
‑2‑
基)乙烯基)
‑
2h
‑
吡喃
‑2‑
酮,
[0109]
(e)
‑6‑
(4
‑
氨基苯乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮,
[0110]
(e)
‑6‑
(4
‑
(二乙氨基)苯乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮,
[0111]
(e)
‑6‑
(2
‑
(1h
‑
吲哚
‑3‑
基)乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮,
[0112]
(e)
‑4‑
羟基
‑6‑
(2,3,6,7
‑
四氢
‑
1h,5h
‑
吡啶并[3,2,1
‑
ij]喹啉
‑9‑
基)乙烯基)
‑
2h
‑
吡喃
‑2‑
酮。
[0113]
在优选的实施方式中,选自包括咖啡酸、肉桂酸、对香豆酸、香豆酸、伞形酸、芥子酸和阿魏酸的组的3
‑
芳基丙烯酸适合于本发明的目的。
[0114]
在优选的实施方式中,3
‑
羟基牛奶树碱用作荧光素,牛奶树碱用作前荧光素,和咖啡酸用作前荧光素的前体。
[0115]
本发明的一个目的是提供一种用于产生具有可见发光的自主生物发光系统的有
效方法,包括基于真核非发光细胞和生物体的那些。
[0116]
本发明的另一个目的是提供一种用于合成牛奶树碱或其功能类似物的新的有效方法。
[0117]
本发明的另一个目的是提供一种用于合成真菌荧光素或其功能类似物的新的有效方法。
[0118]
本发明的另一个目的是提供自主发光的细胞或生物体。
[0119]
本发明的目的是通过鉴定生物发光真菌中的荧光素转化的阶段以及鉴定参与荧光素生物合成的蛋白质的氨基酸和核苷酸序列来实现的。所有蛋白质的功能首次得到证明。
[0120]
附图的简要说明
[0121]
图1显示了牛奶树碱羟化酶的多个氨基酸序列比对。fad/nad(p)结合域带有下划线。共有序列在比对下显示。
[0122]
图2显示了牛奶树碱合酶的多个氨基酸序列比对。共有序列在比对下显示。
[0123]
图3显示了咖啡酰丙酮酸水解酶的多个氨基酸序列比对。共有序列在比对下显示。
[0124]
图4显示了当用3
‑
羟基牛奶树碱(荧光素,左图)或牛奶树碱(前荧光素,右图)喷洒菌落时,表达牛奶树碱羟化酶和荧光素酶(a)或仅荧光素酶(b)的巴斯德毕赤酵母细胞(pichia pastoris cells)的发光强度,以及野生型酵母(c)的发光强度。
[0125]
图5显示了表达牛奶树碱羟化酶和荧光素酶的hek293nt细胞与添加牛奶树碱时仅表达荧光素酶的hek293nt细胞相比的发光强度。
[0126]
图6显示了hek293t细胞的发光曲线:(1)当添加牛奶树碱时,分别表达牛奶树碱羟化酶和荧光素酶基因;(2)当添加牛奶树碱时,表达牛奶树碱羟化酶和荧光素酶嵌合蛋白基因;(3)当添加3
‑
羟基牛奶树碱时,表达牛奶树碱羟化酶和荧光素酶嵌合蛋白基因。
[0127]
图7说明了与野生型细胞相比,转染的巴斯德毕赤酵母细胞的自主生物发光能力。左侧:日光下培养皿上的细胞,右侧:黑暗中的细胞。
[0128]
图8显示了在黑暗中的转染巴斯德毕赤酵母细胞的培养物的发光。
[0129]
图9显示了自主生物发光的转基因植物本氏烟草(nicoatiana benthamiana)。左边的照片是在环境光下拍摄的,右边的照片是在黑暗中拍摄的。
[0130]
发明的实施
[0131]
定义
[0132]
上文以及说明书和下文的权利要求书中使用了与本发明的目的相关的各种术语。在本发明的描述中,术语“包括”和“包含”被解释为“包括,但不限于”。所述术语不旨在解释为“仅由...组成”。
[0133]
出于本发明的目的,术语“发光”和“生物发光”是可互换的,是指在荧光素酶催化的化学反应过程中的发光现象。
[0134]
与蛋白质活性相关的术语“能够反应”,“促进反应”等是指所述蛋白质是催化指定反应的酶。
[0135]
出于本发明的目的,术语“荧光素酶”是指一种蛋白质,其具有催化化合物(荧光素)被分子氧氧化的能力,使得氧化反应伴随着发光(发光或生物发光)和氧化萤光素形成。
[0136]
出于本发明的目的,术语“真菌荧光素”是指选自具有结构式其中r是芳基或杂芳基的6
‑
(2
‑
芳基乙烯基)
‑
3,4
‑
二羟基
‑
2h
‑
吡喃
‑2‑
酮的化合物。
[0137]
真菌荧光素被一组荧光素酶氧化,下文称之为“能够氧化真菌荧光素同时发光的荧光素酶”等。在生物发光真菌中发现了这样的荧光素酶,例如,在日期为30.01.2017的申请ru2017102986/10(005203)中描述了它们。用于本发明的方法和组合的荧光素酶的氨基酸序列与选自以下seq id no组:80、82、84、86、88、90、92、94、96、98的氨基酸序列基本相似或相同。在本发明的许多实施方式中,用于本发明的目的的荧光素酶的特征在于其氨基酸序列与选自以下seq id no组:80、82、84、86、88、90、92、94、96、98的氨基酸序列具有至少40%同一性,例如,至少45%同一性、或至少50%同一性、至少55%同一性、或至少60%同一性、或至少70%同一性、或至少75%同一性、或至少80%同一性、或至少85%同一性。在许多情况下,荧光素酶的特征在于氨基酸序列与选自以下seq id no组:80、82、84、86、88、90、92、94、96、98的氨基酸序列具有至少90%同一性(例如,至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%同一性或100%的同一性)。
[0138]
真菌荧光素的氧化产生“真菌氧化荧光素”,一种化学式为6
‑
芳基
‑2‑
羟基
‑4‑
氧代己
‑
2,5
‑
二烯酸和结构式为
[0139]
的产品。
[0140]
本文所用的术语“真菌前荧光素”或简称“前荧光素”是指具有以下结构式其中r是芳基或杂芳基的6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮类的化合物。在由本发明的酶催化的化学反应中,前荧光素被转化为真菌荧光素。
[0141]
本文所用的术语“前荧光素的前体”是指属于3
‑
芳基丙烯酸类的化合物,其结构式为
[0142]
其中r是芳基或杂芳基。在由本发明的酶催化的化学反应过程中,由3
‑
芳基丙烯酸形成前荧光素。
[0143]
表1展示了真菌荧光素的实施例。表2显示了与真菌荧光素相关的前荧光素、氧化荧光素和前荧光素的实例。
[0144]
表2.与真菌荧光素相关的前荧光素、氧化荧光素和前荧光素的实例(化合物名称根据iupac命名法展示;传统名称在结构式下以粗体显示)。
[0145]
[0146]
[0147][0148]
术语“芳基”或“芳基取代基”是指在包含五至十四个环原子的单个或稠合的碳环体系中的芳香族基团。在一个优选的实施方式中,环体系包含六至十个环原子。另外,一个或多个氢原子可以被选自下组的取代基取代:酰基、酰氨基、酰氧基、烯基、烷氧基、烷基、炔基、氨基、芳基、芳氧基、叠氮基、氨基甲酰基、烷氧羰基、羧基、羧酰胺基、羧氨基、氰基、二取代氨基、甲酰基、胍基、卤素、杂芳基、杂环基、羟基、亚氨基、单取代氨基、硝基、氧代、膦氨基、亚磺酰基、磺氨基、磺酰基、硫代、硫代酰氨基、硫脲基或脲基。芳基的例子包括,但不限于苯基、萘基、联苯和三联苯。此外,如本文所用,术语“芳基”是指与一个或多个非芳环连接的具有芳环的基团。
[0149]
术语“杂环芳族取代基”、“杂芳基取代基”或“杂芳基”是指在包含五至十五个环原子的单个或稠合杂环体系中包含1个至4个选自o、n、s或so的杂原子或杂基的芳香基团。在一个优选的实施方式中,杂芳环体系包含六至十个环原子。另外,一个或多个氢原子可以被选自下组的取代基取代:酰基、酰氨基、酰氧基、烯基、烷氧基、烷基、炔基、氨基、芳基、芳氧基、氨基甲酰基、烷氧羰基、羧基、羧酰胺基、羧氨基、氰基、二取代氨基、甲酰基、胍基、卤素、杂芳基、杂环基、羟基、亚氨基、单取代氨基、硝基、氧代、膦氨基、亚磺酰基、磺氨基、磺酰基、硫代、硫代酰氨基、硫脲基或脲基。杂芳基的例子包括,但不限于吡啶基、噻唑基、噻二唑基、异喹啉基、吡唑基、恶唑基、恶二唑基、三唑基和吡咯基。此外,如本文所用,术语“杂芳基”是指与一个或多个非芳环连接的具有杂芳环的基团。
[0150]
在本发明中根据国际iupac命名法使用化合物的名称。也会显示传统名称(如果
有)。
[0151]
术语“荧光素生物合成酶”或“荧光素转化的循环转换中涉及的酶”等是指在体外和/或体内体系中催化前荧光素前体转化为前荧光素,和/或前荧光素转化为真菌荧光素,和/或氧化荧光素转化为前荧光素前体的酶。除非另有说明,术语“真菌荧光素生物合成酶”不包括荧光素酶。
[0152]
术语“牛奶树碱羟化酶”在本文中用于描述催化前荧光素转化为真菌荧光素的反应的酶,例如,由牛奶树碱合成3
‑
羟基牛奶树碱。
[0153]
术语“牛奶树碱合酶”在本文中用于描述能够催化由前荧光素的前体合成真菌前荧光素的酶,例如,由咖啡酸合成牛奶树碱。
[0154]
术语“pks”在本文中用于描述属于能够催化由咖啡酰辅酶a合成牛奶树碱的iii型聚酮化合物合酶的组的酶。
[0155]
术语“咖啡酰丙酮酸水解酶”在本文中用于描述能够催化真菌氧化荧光素分解成更简单的化合物的酶,例如形成前荧光素的前体。例如,它可以催化咖啡酰丙酮酸向咖啡酸转化。
[0156]
术语“功能类似物”在本发明中用于描述执行相同功能和/或可用于相同目的的化合物或蛋白质。例如,表1中列出的所有真菌荧光素彼此都是功能类似物。
[0157]
术语“atp”是指三磷酸腺苷,它是细胞中能量的主要载体,并具有结构式:
[0158][0159]
术语“nad(p)h”在本文中是指还原的烟酰胺腺嘌呤二核苷酸磷酸(nadph)基团或还原的烟酰胺腺嘌呤二核苷酸(nadh)基团。术语“nad(p)”是指烟酰胺腺嘌呤二核苷酸磷酸(nadp)或烟酰胺腺嘌呤二核苷酸(nad)的氧化形式。烟酰胺腺嘌呤二核苷酸:
[0160][0161]
和烟酰胺腺嘌呤二核苷酸磷酸:
[0162][0163]
是由烟酰胺和腺嘌呤通过由两个d
‑
核糖残基和两个磷酸残基组成的链连接构筑而成的二核苷酸。nadp与nad的不同之处在于存在附着到d
‑
核糖残基的羟基的额外的磷酸残基。这两个化合物均在自然界中广泛分布并参与许多氧化还原反应,充当电子和氢的载流子的功能,其从氧化的物质中接受电子和氢。还原形式将接受的电子和氢转移到其他物质上。
[0164]
术语“辅酶a(coenzyme a)”或“辅酶a(coa)”是指现有技术众所周知的辅酶,其参与脂肪酸的氧化或合成、脂肪的生物合成、碳水化合物分解产物的氧化转化,并且具有结构式:
[0165][0166]
术语“丙二酰辅酶a”是指在脂肪酸合成过程中形成的并含有丙二酸残基的辅酶a的衍生物:
[0167][0168]
术语“香豆酰辅酶a”是指辅酶a和香豆酸的硫酯:
[0169][0170]
术语“咖啡酰辅酶a”是指辅酶a和咖啡酸的硫酯:
[0171][0172]
如本文所用,术语“突变体”或“衍生物”是指本发明中公开的蛋白质,其中一个或多个氨基酸被添加、和/或被取代、和/或被去除(被删除)、和/或合并(插入)到本发明蛋白质内的n末端、和/或c末端、和/或天然氨基酸序列中。如本文所用,术语“突变体”是指编码突变蛋白的核酸部分。此外,如本文所用,术语“突变体”是指比本发明中公开的蛋白质或核酸更短或更长的任何变异体。
[0173]
术语“同源性”用于描述核苷酸或氨基酸序列之间的关系,该关系由所述序列之间经比较的同一性和/或相似性的程度决定。
[0174]
如本文所用,如果氨基酸或核苷酸序列与参考域内所选序列有至少40%的同一性,则该氨基酸或核苷酸序列与参考序列“基本上同一”或“基本上相同”。因此,基本相似的序列包括具有例如至少40%同一性、或至少50%同一性、或至少55%同一性、或至少60%同一性、或至少62%同一性、或至少65%同一性、或至少70%同一性、或至少75%同一性,例如,至少80%同一性、至少85%同一性、至少90%同一性(例如,90%、91%、92%、93%、94%、95%、96%、97%、98%、98%或99%同一性)的那些序列。彼此相同的两个序列也基本相似。出于本发明的目的,要比较的序列的长度必须为至少100或更多个氨基酸,优选至少200个氨基酸,例如,300个氨基酸或更多。特别地,可以比较蛋白质的全长氨基酸序列。对于核酸,要比较的序列长度必须为至少300或更多个核苷酸;优选至少600个核苷酸,包括900或更多个核苷酸。
[0175]
适用于确定序列同一性的百分比和序列相似性的算法的一个示例是由altschul等人,分子生物学杂志215:403
‑
410(1990)描述的blast算法。可通过国家生物技术信息中心(http://www.ncbi.nlm.nih.gov/)获得用于blast分析的软件。首先,该算法包括通过识别测试序列中长度为w的短单词来搜索高分片段对(hsp),当在数据库序列中与相同长度的单词比对时,这些短单词完全重合或满足某个正值阈值t。t被称为邻域单词分数阈值(altschul等人,1990)。这些最初的邻域单词匹配作为种子用于启动搜索包含它们的更长的hsp。然后这些单词匹配沿每个序列在两个方向延伸,直至可以增加累积比对得分。对于核苷酸序列,使用参数m(匹配残基对设置的奖励分数;始终>0)和n(错配残基对设置的惩罚分数;始终<0)计算累积分数。为了计算氨基酸序列的累积值,使用得分矩阵。当累积比对得分从其最大实现值下降了数值x;由于一个或多个负得分残基比对的累积,累积得分变为零或更低;或到达任一序列的末尾时,将停止向每个方向延伸单词匹配。blast算法参数w、t和x决定比对的灵敏度和速度。在blastn程序中(对于核苷酸序列),默认字长(w)为11,期望值(e)为10,下降(临界)值为100,m=5,n=
‑
4,并且在两个线上进行比较。在blastp程
序(对于氨基酸序列)中,默认字长(w)为3,期望值(e)为10,使用blosum62评分矩阵(参见henikoff和henikoff,美国国家科学院院刊89:10915(1989))。
[0176]
除了计算序列同一性百分比之外,blast算法还执行两个序列之间的统计相似性分析(参见,例如,karlin和altschul,美国国家科学院院刊90:5873
‑
5787(1993))。blast算法提供的用于确定相似性的参数之一是最低累积概率(p(n)),其表示两个核苷酸或氨基酸序列之间随机重合的概率。例如,如果在比较测试核酸序列与参考核酸序列时最低累积概率小于0.1,更优选小于0.01,最优选小于0.001,则认为测试核酸序列与参考序列相似。
[0177]
术语“共有序列”是指用于比较特定蛋白质或目的序列的所有变体的作为参考的所用的原型氨基酸序列。共有序列和确定它们的方法是本领域技术人员众所周知的。例如,可以通过识别整个相关序列集合中给定位置上最频繁出现的氨基酸,从已知同源蛋白质的多次比较中确定共有序列。
[0178]
术语“保守序列”用于指定在不同生物体中的进化过程中完全或实际上保持不变的核酸中的核苷酸序列或多肽链中的氨基酸序列。因此,“非保守序列”是在相比较的生物体中差异很大的序列。
[0179]
术语“氨基酸插入区段”是指在所考虑的蛋白质片段(蛋白质结构域、接头、共有序列)之间的多肽链内的一个或多个氨基酸。对于本领域技术人员而言显而易见的是,所考虑的氨基酸插入区段和片段可操作地连接并形成单个多肽链。
[0180]
可以使用本领域已知的任何合适的软件来确定蛋白质的结构域结构。例如,在网络http://smart.embl
‑
heidelberg.de可用的单模块构架搜索工具(smart)软件可以用于该目的[schultz等人,美国国家科学院院刊1998;95:5857
‑
5864;letunic i,doerks t,bork p,核酸研究2014;doi:10.1093/nar/gku949]。
[0181]
在融合蛋白的描述中,术语“可操作地连接”等是指彼此以物理和功能关系存在的多肽序列。在最优选的实施方式中,与分离的多肽组分的功能性质相比,嵌合分子的多肽组分的功能没有改变。例如,本发明的牛奶树碱羟化酶可以可操作地连接到目的融合伴侣,例如荧光素酶。在这种情况下,融合蛋白保留了牛奶树碱羟化酶的性质,而目的多肽保留了其原始的生物活性,例如,氧化荧光素同时发光的能力。在本发明的一些实施方式中,与分离的蛋白的活性相比,融合伴侣的活性可能降低。这样的融合蛋白也可以在本发明的范围内找到应用。
[0182]
在核酸的描述中,术语“可操作地连接”等是指核酸以这种方式共价连接,使得在它们的连接处没有阅读框和终止密码子。对本领域技术人员显而易见的是,编码具有“可操作地连接”的组分(蛋白质、多肽、接头序列、氨基酸插入片段、蛋白质结构域等)的融合蛋白的核苷酸序列由编码所述组分的片段构成,这些片段以这种方式共价连接,使得在核苷酸序列的转录和翻译过程中产生全长融合蛋白。
[0183]
在描述核酸与调节性编码序列(启动子、增强子、转录终止子)的关系时,术语“可操作地连接”是指序列以这种方式定位和连接,使得调节序列将影响编码核酸或核酸序列的表达水平。
[0184]
在本发明的上下文中,核酸的“连接”是指使用本领域已知的任何方式将两个或更多个核酸连接在一起。作为非限制性实施例,可在退火过程中使用dna连接酶或聚合酶链反应(pcr)将核酸连接在一起。也可以使用两个或更多个分离的核酸序列通过化学合成核酸
来连接核酸。
[0185]
术语“调节元件”或“调节序列”是指涉及编码核酸表达调节的序列。调节元件包括启动子、终止信号和其他影响核酸表达的序列。它们通常还包含正确翻译核苷酸序列所需的序列。
[0186]
术语“启动子”用于描述编码区上游的未翻译和未转录的dna序列,其包含rna聚合酶结合位点和转录起始dna结合位点。启动子区域也可以包括另一种基因表达调节元件。
[0187]
如本文所用,术语“功能性”是指可以在特定测试或任务中起作用的核苷酸或氨基酸序列。如果用于描述荧光素酶,则术语“功能性”是指该蛋白质具有进行荧光素氧化反应并伴有发光的能力。如果用于描述牛奶树碱羟化酶,则相同的术语“功能性”是指该蛋白质具有催化将表2中所示的至少一种前荧光素转化为相应的荧光素的反应的能力。如果用于描述牛奶树碱合酶,则相同的术语“功能性”是指该蛋白质具有催化将至少一种前荧光素前体转化为前荧光素的反应的能力,例如,将咖啡酸转化为牛奶树碱。如果用于描述咖啡酰丙酮酸水解酶,则相同的术语“功能性”是指该蛋白质具有催化将至少一种氧化荧光素转化为前荧光素前体(例如,将咖啡酰丙酮酸转化为咖啡酸)的反应的能力。
[0188]
如本文所用,术语“酶学性质”是指蛋白质催化给定化学反应的能力。
[0189]
如本文所用,术语“生化性质”是指蛋白质折叠,包括成熟速率、半衰期、催化速率、ph和温度稳定性以及其他类似的性质。
[0190]
如本文所用,术语“光谱性质”是指光谱、量子产率、发光强度和其他类似性质。
[0191]“编码”多肽的核苷酸序列的引用是指多肽是根据核苷酸序列在mrna转录和翻译过程中产生的。该处均可以表示与mrna相同且通常用于序列表的两条编码链,和用作转录模板的互补链。对本领域技术人员显而易见的是,该术语还涵盖编码相同氨基酸序列的任何简并核苷酸序列。编码多肽的核苷酸序列包括含有内含子的序列。
[0192]
本文所用的术语“表达盒”或“表达的盒子”在某种意义上是在合适的宿主细胞中能够调节特定核苷酸序列的表达的核酸序列。通常,“表达盒”包含编码与启动子和终止信号可操作性地连接的蛋白质或其功能片段的异源核酸。通常,它也包含正确翻译重要核苷酸序列所需的序列。表达盒可以是天然存在的表达盒(包括宿主细胞),但是已经可以以用于异源核酸表达的重组形式产生。然而,在许多情况下,“表达盒”相对于宿主是异源的,即表达盒的特定核酸序列不是在宿主细胞中天然存在的,必须通过转化的方式引入宿主细胞或宿主的祖细胞中。核苷酸序列的表达可以由组成型启动子或诱导型启动子调节,这种诱导型启动子仅在宿主细胞对特定外部刺激开放时才开始转录。在多细胞生物体的情况下,启动子还可以对特定的组织、器官或发育阶段具有特异性。
[0193]“异源”或“外源”核酸是指从未在野生型宿主细胞中出现的核酸。
[0194]
术语“内源的”是指在生物体基因组内处于其天然位置的天然蛋白质或核酸。
[0195]
如本文所用,术语“特异性杂交”是指两个单链核酸分子或足够互补的序列之间的结合,例如允许在本领域通常使用的预定条件下杂交(有时会使用“基本上互补”)。
[0196]“分离的”核酸分子或分离的蛋白质是因为人类活动由其天然环境分离出来的核酸分子或蛋白质,因此不是自然产物。分离的核酸分子或分离的蛋白质可以以纯化形式或在非天然环境中存在,例如(但不限于)重组原核细胞、植物细胞、动物细胞、非生物发光真菌细胞、转基因生物(真菌、植物、动物)等
[0197]“转化”是将异源核酸引入宿主细胞或生物体的过程。特别地,“转化”是指将dna分子稳定地整合到目标靶生物体的基因组中。
[0198]
术语“转化的/转基因的/重组的”是指通过引入异源核酸分子进行修饰的宿主生物,例如细菌、植物、真菌或动物。该核酸分子可以稳定地整合到宿主基因组中,或作为染色体外分子存在。这种染色体外分子能够自我复制。应当理解的是转基因或稳定转化的细胞、组织或生物体既包括转化过程的终产物,又包括转基因后代。术语“非转化的”、“非转基因的”、“非重组的”或“野生型的”是指不包含异源核酸分子的天然宿主生物体或宿主细胞,例如细菌或植物。
[0199]
术语“自主发光”或“自主生物发光”是指能够生物发光而无需外源添加荧光素、前荧光素或前荧光素前体的转基因生物体或宿主细胞。
[0200]
术语“4'
‑
磷酸泛酰巯基乙胺基转移酶”在本文中是指在聚酮化合物合酶的酰基转移域中将4'
‑
磷酸泛酰巯基乙胺基从辅酶a转移至丝氨酸的酶。本领域已知4'
‑
磷酸泛酰巯基乙胺基转移酶在许多植物和真菌天然表达[gao menghao等人,微生物细胞工厂2013,12:77]。对于本领域技术人员而言显而易见的是,可以将4'
‑
磷酸泛酰巯基乙胺基转移酶的任何功能变体用于本发明的目的。例如,在[gao menghao等人,微生物细胞工厂2013,12:77]中描述的构巢曲霉(aspergillus nidulans)的npga 4'
‑
磷酸泛酰巯基乙胺基转移酶(seq id no 104、105),或其同系物或突变体,即与seq id no 105的序列基本相似或相同的氨基酸序列的蛋白质。另一个例子是与以seq id no 105为特征的序列有至少40%同一性、包括至少50%同一性、或至少55%同一性、或至少60%同一性、或至少62%同一性、或至少65%同一性、或至少70%同一性、或至少75%同一性,例如至少80%同一性、或至少85%同一性、或至少90%同一性(例如,90%、91%、92%、93%、94%、95%、96%、97%、98%、98%或99%的同一性)的4'
‑
磷酸泛酰巯基乙胺基转移酶。
[0201]
使用以下标准缩写根据核苷酸的碱基来命名核苷酸:腺嘌呤(a)、胞嘧啶(c)、胸腺嘧啶(t)和鸟嘌呤(g)。同样地,用以下标准缩写命名氨基酸:丙氨酸(ala;a)、精氨酸(arg;r)、天冬酰胺(asn;n)、天冬氨酸(asp;d)、半胱氨酸(cys;c)、谷氨酰胺(gln;q)、谷氨酸(glu;e)、甘氨酸(gly;g)、组氨酸(his;h)、异亮氨酸(he;1)、亮氨酸(leu;l)、赖氨酸(lys;k)、蛋氨酸(met;m)、苯丙氨酸(phe;f)、脯氨酸(pro;p)、丝氨酸(ser;s)、苏氨酸(thr;t)、色氨酸(trp;w)、酪氨酸(tyr;y)和缬氨酸(val;v)。
[0202]
本发明旨在鉴定新的真菌荧光素生物合成酶、能够编码这些酶的核酸以及能够催化真菌荧光素生物合成的某些阶段的蛋白质。本发明还提供了核酸在细胞或生物体中产生所述酶的应用。还提供了用于体外或体内制备与真菌荧光素和前荧光素相同的化合物的方法。还提供了包含本发明所述的核酸的载体。另外,本发明提供了包括本发明的核酸和核酸在所选宿主细胞中表达所必需的调控元件的表达盒。此外,还提供了细胞、稳定的细胞系、包括本发明的核酸、载体或表达盒的转基因生物体(例如植物、动物、真菌或微生物)。本发明还提供了核酸的组合以获得自主发光的细胞、细胞系或转基因生物。在优选的实施方式中,细胞或转基因生物体能够从前体产生真菌荧光素。在一些实施方式中,细胞或转基因生物体能够从前体产生真菌前荧光素。在一些实施方式中,细胞或转基因生物体能够在真菌荧光素前体存在下进行生物发光。在一些实施方式中,细胞或转基因生物体能够自主生物发光。还提供了用于从更简单的化合物生产荧光素或其前体的蛋白质组合。本发明还提供
了一种试剂盒,其包含用于产生发光细胞、细胞系或转基因生物体的本发明的核酸、载体或表达盒。
[0203]
蛋白质
[0204]
如前所述,本发明提供了参与真菌荧光素生物合成(转化的循环系统)的蛋白质作为酶。
[0205]
本发明的蛋白质可以从天然来源或通过重组技术获得。例如,可以从生物发光真菌中分离出野生型蛋白质,例如担子菌型的真菌,主要是担子菌类的真菌,尤其是伞菌目。例如,可以从如下真菌中分离野生型蛋白,例如新诺托帕纳斯南比菌(neonothopanus nambi)、黑足鳞毛蕨蜜环菌(amillaria fuscipes)、蜜环菌(amillaria mellea)、圭亚那加氏菌(guyanagaster necrorhiza)、咖啡美洲叶斑病菌(mycena citricolor)、新诺托帕纳斯戈氏菌(neonothopanus gardneri)、奥尔类脐菇(omphalotus olearius)、鳞皮扇菇(panellus stipticus)、高卢蜜环菌(amyillaria gallica)、荧光小菇(mycena chlorophos)等。如在“核酸”部分中所述,还可以通过在相应的宿主中或在无细胞表达系统中表达编码蛋白序列的重组核酸来获得本发明的蛋白质。在一些实施方式中蛋白质用于宿主细胞内,能够表达的核酸引入其中以编码所述蛋白质。
[0206]
在优选的实施方式中,要求保护的蛋白在宿主细胞中表达后快速折叠。“快速折叠”应理解为蛋白质达到其三级结构,确保在短时间内的酶促性质。在这些实施方式中,蛋白质在通常不超过约3天、通常不超过约2天且普遍不超过约12
‑
24小时的时间段内会折叠。
[0207]
在一些实施方式中,蛋白质以分离的形式使用。蛋白纯化指南(deuthser ed.,美国学术出版社,1990)中描述的合适的蛋白纯化方法的任何常用技术都可以用于蛋白纯化。例如,溶菌产物可以从初始来源制备,并使用hplc、置换色谱、凝胶电泳、亲和色谱等纯化。
[0208]
如果本发明的蛋白质是分离的形式,则意味着该蛋白质基本上不含其他蛋白质或其他天然生物分子,例如寡糖、核酸及其片段等,其中术语“基本上不含”在这种情况下是指低于70%、通常低于60%、普遍低于50%的包括分离的蛋白质的所述组成物是其他天然生物分子。在一些实施方式中,所述蛋白质基本上是纯化的形式,其中术语“基本纯化的形式”是指纯度至少为95%、通常至少为97%并且普遍至少为99%。
[0209]
本发明的蛋白质在低于50℃的温度下保持活性,普遍在最高45℃的温度下保持活性,即它们在20
‑
42℃的温度下保持活性,并且可以在体外和体内用于异源表达系统中。
[0210]
所要求保护的蛋白质在4
‑
10的范围内具有ph稳定性,普遍地在6.5
‑
9.5的范围内。所要求保护的蛋白质的最佳的ph稳定性是在6.8至8.5的范围内,例如在7.3
‑
8.3之间。
[0211]
所要求保护的蛋白质在生理条件下是有活性的。本发明中的术语“生理条件”是指温度在20至42℃范围内,ph在6.8至8.5范围内,盐水和渗透压为300
‑
400mosm/l的介质。特别地,术语“生理条件”包括细胞内培养基、无细胞制剂和从活生物体提取的液体,例如血浆。可以人为地创建“生理条件”。例如,可以通过结合已知的化合物来产生确保“生理条件”的反应混合物。现有技术中众所周知这种介质的创建方法。非限制性实施例包括:
[0212]
1)与哺乳动物血浆等渗的林格林格氏液。
[0213]
林格氏液包括6.5g的nacl、0.42g的kcl和0.25g的cacl2,溶解在一升的双蒸水中。制备溶液时,依次添加盐,仅在溶解前一种盐后才添加后续的各种盐。为了防止碳酸钙沉淀,建议将二氧化碳通过碳酸氢钠溶液。用新制的蒸馏水制备溶液。
[0214]
2)维尔烯(versene)溶液
[0215]
维尔烯溶液是溶解在蒸馏水或的注射用水中的edta和无机盐的混合物,通过使用最终孔径为0.22μm的过滤器的膜过滤来灭菌。1升维尔烯溶液包含8.0g的nacl、0.2g的kcl、1.45g的十二水合磷酸二钠、0.2g的磷酸二氢钾、0.2g的乙二胺四乙酸钠、双蒸水——直到1升。维尔烯溶液的缓冲容量应至少为1.4ml。氯离子含量——从4.4至5.4g/l,edta——最低0.6mmol/l。
[0216]
3)磷酸盐缓冲盐水(pbs,磷酸钠缓冲液)
[0217]
磷酸钠缓冲液由137mm的nacl、10mm的na2hpo4、1.76mm的kh2po4组成。缓冲液还可以包含浓度至多为2.7mm的kcl。以下用于制备1升标准强度的磷酸钠缓冲液:8.00g的nacl,1.44g的na2hpo4、0.24g的kh2po4、0.20g的kcl(可选地),溶于800毫升蒸馏水中。使用盐酸或氢氧化钠调节到所需的ph。然后添加蒸馏水至1升的总体积。
[0218]
目标特定蛋白质是参与循环真菌荧光素生物合成的酶、其突变体、同源物和衍生物。每一种这些特定类型的目标多肽结构将被更详细地单独分析。
[0219]
牛奶树碱羟化酶
[0220]
本发明的牛奶树碱羟化酶是能够催化由前荧光素合成荧光素的蛋白质。换句话说,这些是催化6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮,其具有结构式
[0221][0222]
转化为6
‑
(2
‑
芳基乙烯基)
‑
3,4
‑
二羟基
‑
2h
‑
吡喃
‑2‑
酮,其具有结构式
[0223]
其中r
‑
芳基或杂芳基的酶。
[0224]
该反应在体内和体外的生理条件下,在每一分子的6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮存在至少一个nad(p)h分子和至少一个分子氧(o2)分子的条件下进行反应:
[0225][0226]
目的牛奶树碱羟化酶包括来自生物发光真菌新诺托帕纳斯南比菌、黑足鳞毛蕨蜜环菌、蜜环菌、圭亚那加氏菌、咖啡美洲叶斑病菌、新诺托帕纳斯戈氏菌、奥尔类脐菇、鳞皮扇菇、高卢蜜环菌、奥氏蜜环菌(armillaria ostoyae)、荧光小菇的蛋白质及其功能性突变体,同源物和衍生物,其中的氨基酸序列如seq id no:2、4、6、8、10、12、14、16、18、20、22、24、26、28所示。
[0227]
在优选的实施方式中,本发明的牛奶树碱羟化酶的特征在于存在fad/nad(p)结合
结构域,ipr002938
‑
interpro公共数据库的代码,可在互联网上从http://www.ebi.ac.uk/interpro网站中获得)。所述结构域涉及在多种酶中结合黄素腺嘌呤二核苷酸(fad)和烟酰胺腺嘌呤二核苷酸(nad),以及将羟基添加至底物和在代谢途径中发现的多种有机组织。本发明的牛奶树碱羟化酶包含所述结构域,其长度为350
‑
385个氨基酸,通常为360
‑
380个氨基酸,例如364
‑
377个氨基酸,n和c端的非保守氨基酸序列彼此具有较低的同一性百分比。fad/nad结合域在要求保护的牛奶树碱羟化酶中的位置在图1中单个蛋白质氨基酸序列的多重比对中进行说明。
[0228]
还提供了牛奶树碱羟化酶的同源物或突变体,其序列与本发明要求保护的上述特定的氨基酸序列,即seq id no:2、4、6、8 10、12、14、16、18、20、22、24、26、28不同。目标同源物或突变体与蛋白质,其氨基酸序列选自seq id no:2、4、6、8、10、12、14、16、18、20、22、24、26、28,在至少350个氨基酸中具有至少最低40%的同一性,例如最低45%的同一性、或最低50%的同一性、或最低55%的同一性、或最低60%的同一性、或最低65%的同一性、或最低70%的同一性、或最低75%的同一性,例如最低80%的同一性、最低85%的同一性、最低90%的同一性(例如,至少90%、91%、92%、93%、94%、95%、96%、97%、98%、98%或99%的同一性)。特别地,它涉及提供蛋白质功能位点的氨基酸序列,即作为牛奶树碱羟化酶一部分的fad/nad结合结构域的序列。
[0229]
在优选的实施方式中,本发明的牛奶树碱羟化酶氨基酸序列的特征在于该酶基团仅存在典型的几个保守氨基酸基序(共有序列)。这些共有序列如seq id no:29
‑
33所示。牛奶树碱羟化酶氨基酸序列内部的共有位点通过较低插入的氨基酸插入片段可操作地连接。
[0230]
牛奶树碱合酶
[0231]
本发明的牛奶树碱合酶是能够催化前荧光素从其前体合成的蛋白质。换句话说,这些是催化3
‑
芳基丙烯酸转化的酶,其具有结构式
[0232]
其中r
‑
具有以下结构式的6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮中的芳基或杂芳基,
[0233]
其中r
‑
芳基或杂芳基。
[0234]
作为前荧光素的前体3
‑
芳基丙烯酸的实例在表2中给出。
[0235]
在至少一分子的辅酶a、至少一分子的atp和至少两分子的丙二酰辅酶a的存在下,在生理条件下在体外和体内进行反应:
[0236][0237]
目标牛奶树碱
‑
合酶包括来自生物发光真菌新诺托帕纳斯南比菌、黑足鳞毛蕨蜜环菌、蜜环菌、圭亚那加氏菌)、咖啡美洲叶斑病菌、新诺托帕纳斯戈氏菌、奥尔类脐菇、鳞皮扇菇、高卢蜜环菌、奥氏蜜环菌、荧光小菇的蛋白质及其功能性突变体、同源物和衍生物,其中的氨基酸序列如seq id no:35、37、39、41、43、45、47、49、51、53、55所示。
[0238]
在优选的实施方式中,本发明的牛奶树碱合酶氨基酸序列的特征在于该酶基团仅存在典型的几个保守氨基酸基序(共有序列)。这些共有序列如seq id no:56
‑
63所示。牛奶树碱合酶氨基酸序列内部的共有位点通过较低插入的氨基酸插入片段可操作地连接。
[0239]
在本发明的许多实施方式中,特定牛奶树碱合酶的同源物和突变体的相关氨基酸序列的特征在于与seq id no:35、37、39、41、43、45、47、49、51、53、55所示的序列在全部蛋白质氨基酸序列中基本相同,例如,至少最低40%的同一性,例如最低45%的同一性、或最低50%的同一性、或最低55%的同一性、或最低60%的同一性、或最低65%的同一性、或最低70%的同一性、或最低75%的同一性,例如最低80%的同一性、最低85%的同一性、最低90%的同一性(例如,至少90%、91%、92%、93%、94%、95%、96%、97%、98%、98%或99%的同一性)。
[0240]
在优选的实施方式中,本发明的牛奶树碱
‑
合酶是与聚酮化合物合酶超家族有关的多结构域蛋白。在优选的实施方式中,对本发明的牛奶树碱
‑
合酶进行翻译后修饰,即,在他们的成熟过程中需要在聚酮化合物合酶的酰基载体结构域中将4'
‑
磷酸泛酰巯基乙胺基从辅酶a转移到丝氨酸上。进行这种修饰的酶
‑
4'
‑
磷酸泛酰巯基乙胺基转移酶是现有技术中已知的[gao menghao等人,微生物细胞工厂2013,12:77]。自然界中的许多植物和真菌都表达4'
‑
磷酸泛酰巯基乙胺基转移酶,它们的细胞中本发明的功能性牛奶树碱
‑
合酶成熟,不需要引入其他酶或编码它们的核酸。同时,在一些低级真菌(例如酵母)和动物的细胞中,牛奶树碱
‑
合酶的成熟需要向宿主细胞引入4'
‑
磷酸泛酰巯基乙胺基转移酶编码序列。对于本领域技术人员而言显而易见的是,现有技术中已知的任何4'
‑
磷酸泛酰巯基乙胺基转移酶的功能变体都可以用于本发明的目的。例如,可使用[gao menghao等人,微生物细胞工厂2013,12:77]中所述的构巢曲霉的4'
‑
磷酸泛酰巯基乙胺基转移酶npga(seq id no 104,105),以及确认活性的任何同源物或突变体。
[0241]
咖啡酰丙酮酸水解酶
[0242]
本发明的咖啡酰丙酮酸水解酶是能够催化氧化荧光素转化的蛋白质,所述氧化荧光素是6
‑
芳基
‑2‑
羟基
‑4‑
氧代己
‑
2,5
‑
二烯酸,其具有结构式
[0243]
其中r为芳基或杂芳基,转化为3
‑
芳基丙烯酸,其具有结构式
[0244]
其中r
‑
芳基或杂芳基。
[0245]
氧化荧光素的实例在表2中给出。
[0246]
反应在生理条件下体外和体内进行:
[0247][0248]
在优选的实施方式中,本发明的咖啡酰丙酮酸水解酶将咖啡酰丙酮酸酯转化为咖啡酸。在优选的实施方式中,它们将表2中所示的氧化荧光素转化为前荧光素前体。
[0249]
目标咖啡酰丙酮酸水解酶包括来自生物发光真菌新诺托帕纳斯南比菌、黑足鳞毛蕨蜜环菌、蜜环菌、圭亚那加氏菌、咖啡美洲叶斑病菌、新诺托帕纳斯戈氏菌、奥尔类脐菇、鳞皮扇菇、高卢蜜环菌、奥氏蜜环菌、荧光小菇的蛋白质及其功能性突变体、同源物和衍生物,其中的氨基酸序列如seq id nos:65、67、69、71、73、75所示。
[0250]
在优选的实施方式中,本发明的咖啡酰丙酮酸水解酶氨基酸序列(包括目标同源物和突变体)的特征在于该酶基团仅存在典型的几种保守氨基酸基序(共有序列)。这些共有序列如seq id no:76
‑
78所示。咖啡酸丙酮酸水解酶氨基酸序列内部的共有位点通过较低插入的氨基酸插入片段可操作地连接。
[0251]
在本发明的许多实施方式中,咖啡酰丙酮酸水解酶的相关氨基酸序列的特征在于与seq id no:65、67、69、71、73、75中所示的序列在全部蛋白质氨基酸序列中基本相同,例如,至少最低40%的同一性,例如最低45%的同一性、或最低50%的同一性、或最低55%的同一性、或最低60%的同一性、或最低65%的同一性、或最低70%的同一性、或最低75%的同一性,例如最低80%的同一性、最低85%的同一性、最低90%的同一性(例如,至少90%、91%、92%、93%、94%、95%、96%、97%、98%、98%或99%的同一性)。
[0252]
上述特定蛋白质(即具有氨基酸序列seq id no:2、4、6、8、10、12、14、16、18、20、22、24、26、28、35、37、39、41、43、45、47、49、51、53、55、65、67、69、71、73、75的蛋白质)的同源物可以从自然来源中分离。在许多生物体(真菌、植物、微生物、动物)中都可以找到同源物。特别地,可以在不同种类的生物发光真菌中找到同源物,例如,担子菌型的真菌,主要是担子菌类的真菌,尤其是伞菌(agaricales)目。另外,产生牛奶树碱的非生物发光真菌和植物,作为本发明蛋白质同源物的来源非常令人关注,例如剑叶凤尾蕨(pteris ensiformis)[yung
‑
husan chen等人,《来自剑蕨的酚类抗氧化剂的鉴定(剑叶凤尾蕨)》,食品化学,第105卷,2007年第1期,第48
‑
56页],褐黄纤孔菌(inonotus xeranticus)[in
‑
kyoung lee等
人,《来自褐黄纤孔菌的牛奶树碱衍生物及其抗氧化活性》,天然产物杂志,2006,69(2),第299
‑
301页],木层孔菌属(phellinus sp.)[in
‑
kyoung lee等人,《在药用菌纤孔菌和木层孔菌中提供多种牛奶树碱类抗氧化剂的高含氧量和不饱和代谢物,生物有机与药物化学。15(10):3309
–
14],问荆(equisetum arvense)[markus herderich等人,《通过高效液相色谱
‑
串联质谱法建立从问荆的配子体中获得的无细胞提取物中苯乙烯基吡喃酮合酶的活性》.植物化学分析,8:194
‑
197.]。
[0253]
还提供了作为天然存在的上述蛋白质的衍生物或突变体的蛋白质。突变体和衍生物可以保留野生型蛋白(例如天然存在)的生物学特性,或者可以具有不同于野生型蛋白的生物学特性。突变包括一种或多种氨基酸的替换,一种或多种氨基酸的缺失或插入,n端替换或截短、或延伸,c端替换或截短、或延伸等。可以使用如“核酸”部分中详细描述的分子生物学标准方法获得突变体和衍生物。突变体与野生型蛋白基本相同,即在所选用于比较的区域内与它们具有至少40%的同一性。因此,基本相似的序列包括在所选用于比较的区域内具有,例如至少40%的同一性、或至少50%的同一性、或至少55%的同一性、或至少60%的同一性、或至少62%的同一性、或至少65%的同一性、或至少70%的同一性、或至少75%的同一性,例如至少80%的同一性、至少85%的同一性、至少90%的同一性(例如,至少90%、91%、92%、93%、94%、95%、96%、97%、98%、98%或99%的同一性)的序列。在许多实施方式中,目标同源物具有更高的序列同一性,例如70%、75%、80%、85%、90%(例如92%、93%、94%)或更高,例如95%、96%、97%、98%、99%、99.5%,特别是对于提供蛋白质功能区的氨基酸序列。
[0254]
衍生物也可以使用标准方法获得,包括通过rna、化学修饰、翻译后和转录后的修饰等方法进行改变。例如,衍生物可以通过修饰的磷酸化或糖基化、或乙酰化、或脂化、或在成熟时通过不同类型的分离等方法获得。
[0255]
本领域技术人员众所周知的方法可用于搜索功能性突变体、同源物和衍生物。例如,对包含变体(例如,蛋白质突变体形式或同源蛋白质、或蛋白质衍生物)的表达文库进行功能性筛选。表达文库通过将编码蛋白质的测试变体的核酸克隆到表达载体中并将其进入合适的宿主细胞中获得。用核酸操作的方法在“核酸”部分中详细描述。为了鉴定本发明的功能性酶,将适当的底物加入到表达被测核酸的细胞中。由功能酶催化的预期反应产物的形成可以通过hplc方法使用预期反应产物的合成变体作为标准品进行检测。例如,表2中所示的牛奶树碱或其他前荧光素可以用作鉴定功能性牛奶树碱羟化酶的底物。预期的反应产物是真菌荧光素。前荧光素前体(例如咖啡酸)可以用作鉴定牛奶树碱
‑
合酶的底物,并且相应的真菌荧光素是反应产物。应当注意的是,宿主细胞应表达4'
‑
磷酸泛酰巯基乙胺基转移酶,促进蛋白质的翻译后修饰,以筛选功能性牛奶树碱
‑
合酶。
[0256]
氧化荧光素(表2)用作搜索功能性咖啡酰丙酮酸水解酶的底物,并且测试的反应产物是前荧光素前体——3
‑
芳基丙烯酸。
[0257]
在本发明的许多实施方式中,生物发光反应可用于搜索本发明的功能性酶。在这种情况下,出于制备表达文库的目的,使用产生能够氧化真菌荧光素同时发射光的荧光素酶的细胞,和由测试蛋白质所进行的酶促反应的产物促进产生真菌荧光素的功能性酶。
[0258]
因此,产生底物是真菌荧光素的功能性荧光素酶的宿主细胞被用作筛选功能性牛奶树碱羟化酶。当将前荧光素添加到包括牛奶树碱羟化酶功能性变体的细胞中时,形成了
真菌荧光素,并且由于真菌荧光素被荧光素酶氧化而发光。
[0259]
另外产生功能性荧光素酶(其底物是真菌荧光素)和功能性牛奶树碱羟化酶的宿主细胞被用作筛选功能性牛奶树碱合酶。当将前荧光素前体添加到此类细胞中时,形成了真菌荧光素,并且由于真菌荧光素被荧光素酶氧化而发光。
[0260]
产生功能性荧光素酶(其底物是真菌荧光素)、功能性牛奶树碱羟化酶和功能性牛奶树碱合酶的宿主细胞被用作筛选功能性咖啡酰丙酮酸水解酶。当将氧化荧光素添加到此类细胞中时,形成了真菌荧光素,并且由于真菌荧光素被荧光素酶氧化而发光。
[0261]
任何能够氧化荧光素同时发射光的荧光素酶,选自6
‑
(2
‑
芳基乙烯基)
‑
3,4
‑
二羟基
‑
2h
‑
吡喃
‑2‑
酮组,具有以下通式其中r
‑
芳基或杂芳基,可用于筛选。荧光素的非限制性实例在表1中给出。合适的荧光素酶的非限制性实例在下面的“应用、组合和使用方法”部分中描述。
[0262]
荧光素酶氧化荧光素伴随着检测到的光发射。氧化过程中发出的光可以通过标准方法进行检测(例如,目视观察、借助夜视仪进行观察、分光光度法、荧光分光光度法、使用图像摄影记录、使用用于检测发光和荧光的专用设备、例如,例如ivis体内光谱成像系统(铂金埃尔默)等。所记录的发光可以在从一个光子到容易被眼睛感知的发光的强度范围内发射,例如,1cd的强度和强度例如100cd及以上的明亮发光。3
‑
羟基牛奶树碱氧化时发射的光在400至700nm的范围内,通常在450至650nm的范围内,最大发射在520
‑
590nm。其他6
‑
(2
‑
芳基乙烯基)
‑
3,4
‑
二羟基
‑
2h
‑
吡喃
‑2‑
酮氧化时发射的光可能具有的最大发射位移(表3)。
[0263]
表3.一系列真菌荧光素的最大发射
[0264][0265]
在下面的实验部分中描述了使用生物发光功能性筛选的实例。
[0266]
本发明还涵盖融合蛋白,包括本发明的蛋白。其同系物、突变体,包括缩短或延长形式。本发明的蛋白质可以与细胞内定位信号(例如,核定位信号,线粒体、或过氧化物酶体、或溶酶体、或高尔基体、或其他细胞器中的定位信号)、促进蛋白质分离进入细胞间空间的信号肽、跨膜结构域或任何感兴趣的蛋白质或多肽(融合伴侣)可操作地融合。融合蛋白可以包括可操作地交联的,例如,本发明要求保护的牛奶树碱羟化酶,和/或牛奶树碱合酶,
和/或咖啡酰丙酮酸水解酶,具有连接至c
‑
或n
‑
末端的融合伴侣。融合伴侣的非限制性实例可包括具有其他酶功能的本发明的蛋白质,抗体或其连接片段、配体或受体,能够将菌类荧光素用作生物发光反应中的底物的荧光素酶。在一些实施方式中,本发明的融合伴侣和蛋白质通过促进独立的融合蛋白折叠和功能化的连接序列(肽接头)可操作地交联。融合蛋白的生产方法是本领域技术人员众所周知的。
[0267]
在一些实施方式中,融合蛋白包括本发明的牛奶树碱羟化酶和能够氧化真菌荧光素同时发射光的荧光素酶,它们通过短肽接头可操作地交联。此类融合蛋白可用于在前荧光素存在下(例如在牛奶树碱存在下)在体外和体内获得生物发光。对于本领域技术人员显而易见的是,上述任何功能性牛奶树碱羟化酶可用于与任何功能性荧光素酶产生融合蛋白。融合蛋白的具体实例在下面的实验部分中描述。下文“应用、组合和使用方法”部分描述了可用于生产融合蛋白的荧光素酶的实例。
[0268]
核酸
[0269]
本发明提供了编码真菌荧光素生物合成的酶,这些蛋白质的突变体和同源物(包括缩短和延长形式)的核酸。
[0270]
如本文所用,核酸是分离的dna分子,例如基因组dna分子或cdna分子、或rna分子,例如mrna分子。特别地,所述核酸是具有开放阅读框的cdna分子,其编码本发明的荧光素生物合成酶,并且能够在适当条件下确保本发明的酶表达。
[0271]
术语“cdna”用于描述核酸,其反映了位于天然、成熟的mrna中的序列元件的排列,其中序列元件是外显子以及5
‑
'和3'
‑
非编码区。未成熟的mrna可能会有被介入的内含子分隔的外显子,如果存在,则在翻译后rna加标过程中会去除这种外显子,形成具有开放阅读框的成熟mrna。
[0272]
目的基因组序列可以包括存在于起始密码子和终止密码子之间的核酸,如在所述序列中确定的,包括通常存在于天然染色体中的所有内含子。目的基因组序列还可以额外包括在成熟的mrna中的5'
‑
和3'
‑
非翻译区,以及特定的转录和翻译调控序列,例如启动子、增强子等,包括大小约为1kbp的侧翼基因组dna,但可能更多,位于转录区的5'
‑
或3'
‑
末端。
[0273]
本发明还涵盖了与编码本发明蛋白质的核酸同源、基本相似、相同、或是其衍生物或模拟物的核酸。
[0274]
要求保护的核酸存在于不同于其天然培养基的环境中,例如,它们是分离的,以富集的量存在的,或在体外或细胞内、或有机体中存在或表达的,而不是在它们天然存在的环境中。
[0275]
目的特定核酸包括编码上述“蛋白质”部分中描述的牛奶树碱羟化酶或牛奶树碱合酶、或咖啡酰丙酮酸水解酶的核酸。这些目的特定核酸中的每一个都会单独更详细地公开。
[0276]
编码牛奶树碱羟化酶的核酸
[0277]
在优选的实施方式中,本发明的核酸编码能够催化6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮(前荧光素),其具有结构式
[0278][0279]
转化为6
‑
(2
‑
芳基乙烯基)
‑
3,4
‑
二羟基
‑
2h
‑
吡喃
‑2‑
酮(真菌荧光素),其具有结构式
[0280][0281]
其中r
‑
芳基或杂芳基的反应的蛋白质。
[0282]
在优选的实施方式中,核酸编码牛奶树碱羟化酶,其氨基酸序列的特征在于存在seq id no:29
‑
33中所示的一些保守氨基酸基序(共有序列)。
[0283]
核酸的具体实例包括编码牛奶树碱羟化酶的核酸,其氨基酸序列如seq id no:2、4、6、8、10、12、14、16、18、20、22、24、26、28中所示。编码所述蛋白质的核酸的实例在seq id no:1、3、5、7、9、11、13、15、17、19、21、23、25、27中给出。同样,上述特定核酸的功能性突变体、同源物和衍生物也令人关注。
[0284]
在优选的实施方式中,本发明的核酸编码蛋白质,其氨基酸序列与seq id no:2、4、6、8、10、12、14、16、18、20、22、24、26、28所示的序列在至少350个氨基酸中具有至少60%、或至少65%、或至少70%、或至少80%、或至少85%、或至少90%、或至少91%、或至少92%、或至少93%、或至少94%、或至少95%、或至少96%、或至少97%、或至少98%、或至少99%的同一性。
[0285]
编码牛奶树碱
‑
合酶的核酸
[0286]
在优选的实施方式中,本发明的核酸编码能够催化3
‑
芳基丙烯酸,其具有结构式其中r
‑
芳基或杂芳基,转化为6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮,其具有结构式
[0287]
其中r
‑
芳基或杂芳基的反应的蛋白质。
[0288]
在优选的实施方式中,核酸编码牛奶树碱
‑
合酶,其氨基酸序列的特征在于存在seq id no:56
‑
63中所示的一些保守氨基酸基序(共有序列)。
[0289]
核酸的具体实例包括编码本发明的牛奶树碱
‑
合酶的核酸,其氨基酸序列如seq id no:35、37、39、41、43、45、47、49、51、53、55中所示。编码所述蛋白质的核酸的实例在seq id no:34、36、38、40、42、44、46、48、50、52、54中给出。
[0290]
同样,上述特定核酸的功能性突变体、同源物和衍生物也令人关注。
[0291]
在优选的实施方式中,本发明的核酸编码蛋白质,其氨基酸序列与seq id no:35、37、39、41、43、45、47、49、51、53、55所示的序列在全部蛋白质多肽链中具有至少45%,通常至少50%,例如至少55%、或至少60%、或至少65%、或至少70%、或至少80%、或至少85%、
或至少90%、或至少91%、或至少92%、或至少93%、或至少94%、或至少95%、或至少96%、或至少97%、或至少98%、或至少99%的同一性。
[0292]
编码咖啡酰丙酮酸水解酶的核酸
[0293]
在优选的实施方式中,本发明的核酸编码能够催化氧化荧光素,其具有结构式
[0294]
其中r为芳基或杂芳基,转化为3
‑
芳基丙烯酸,其具有结构式
[0295]
其中r选自芳基、杂芳基的反应的蛋白质。
[0296]
在优选的实施方式中,核酸编码咖啡酰丙酮酸水解酶,其氨基酸序列的特征在于存在seq id no:76
‑
78中所示的一些保守氨基酸基序(共有序列)。核酸的具体实例包括编码咖啡酰丙酮酸水解酶的核酸,其氨基酸序列如seq id no:65、67、69、71、73、75中所示。编码所述蛋白质的核酸的实例在seq id no:64、66、68、70、72、74中给出。
[0297]
同样,上述蛋白质的功能性突变体、同源物和衍生物也令人关注。
[0298]
在优选的实施方式中,本发明的核酸编码蛋白质,其氨基酸序列与seq id no:65、67、69、71、73、75中所示的序列在全部蛋白质多肽链中具有至少60%、或至少65%、或至少70%、或至少80%、或至少85%、或至少90%、或至少91%、或至少92%、或至少93%、或至少94%、或至少95%、或至少96%、或至少97%、或至少98%或至少99%的同一性。
[0299]
目的核酸(例如,编码以如seq id no:2、4、6、8、10、12、14、16、18、20、22、24、26、28、35、37、39、41、43、45、47、49、51、53、55、65、67、69、71、73、75所示的氨基酸序列为特征的蛋白质的同源物的核酸),可以从任何生物体(真菌、植物、微生物、动物)中分离出来,特别是来自不同种类的生物发光真菌,例如担子菌型的真菌,主要是担子菌类的真菌,特别是伞菌(agaricales)目,例如来自生物发光真菌新诺托帕纳斯南比菌黑足鳞毛蕨蜜环菌、蜜环菌、圭亚那加氏菌、咖啡美洲叶斑病菌、新诺托帕纳斯戈氏菌、奥尔类脐菇、鳞皮扇菇、高卢蜜环菌、奥氏蜜环菌、荧光小菇等。产生牛奶树碱的非生物发光真菌和植物,作为本发明蛋白质同源物的来源非常令人关注,例如剑叶凤尾蕨(pteris ensiformis)[yung
‑
husan chen等人,《来自剑蕨的酚类抗氧化剂的鉴定(剑叶凤尾蕨)》,食品化学,第105卷,2007年第1期,第48
‑
56页],褐黄纤孔菌(inonotus xeranticus)[in
‑
kyoung lee等人,《来自褐黄纤孔菌的牛奶树碱衍生物及其抗氧化活性》,天然产物杂志,2006,69(2),第299
‑
301页],木层孔菌属(phellinus sp.)[in
‑
kyoung lee等人,《在药用菌纤孔菌和木层孔菌中提供多种牛奶树碱类抗氧化剂的高含氧量和不饱和代谢物,生物有机与药物化学。15(10):3309
–
14],问荆(equisetum arvense)[markus herderich等人,《通过高效液相色谱
‑
串联质谱法建立从问荆的配子体中获得的无细胞提取物中苯乙烯基吡喃酮合酶的活性》.植物化学分析,8:194
‑
197.]。
[0300]
可以通过多种方法中的任何一种来鉴定同源物。在低严格条件下,本发明的cdna片段可用作来自目标生物体的cdna文库的杂交探针。该探针可以是大片段或一种或更短的简并引物。具有序列相似性的核酸可以在低严格条件下,例如在50℃和6
×
ssc(0.9m氯化
钠/0.09m柠檬酸钠)下,然后在1
×
ssc(01.15m氯化钠/0.015m柠檬酸钠)中在55
×
c下洗涤的条件下通过杂交检测。序列同一性可以通过在高严格条件下,例如在50℃或更高温度和0.1
×
ssc(15mm氯化钠/1.5mm柠檬酸钠)中杂交来确定。具有与所示序列基本相同的区域的核酸,例如等位基因变体、核酸的遗传修饰变体等,在高严格杂交条件下与所示序列结合。使用探针,特别是dna序列的标记探针,能够回收同源或相似基因。
[0301]
同源物可以通过来自基因组或cdna文库的聚合酶链反应来鉴定。代表特定核酸已知序列的片段的寡核苷酸引物可用作pcr的引物。在优选的方面,寡核苷酸引物具有简并结构并对应于编码蛋白质氨基酸序列的保守区的核酸片段。例如共有序列如seq id no:29
‑
33、56
‑
63、76
‑
78所示。然后全长编码序列可以通过现有技术中众所周知的3'
‑
和5'
‑
race方法来检测。
[0302]
还可以通过比较基于测序推导的氨基酸序列和氨基酸序列seq id no:2、4、6、8、10、12、14、16、18、20、22、24、26、28、35、37、39、41、43、45、47、49、51、53、55、65、67、69、71、73、75在生物体的全基因组测序的结果中鉴定同源物。根据参考序列确定同一性。用于序列分析的算法在本领域中是已知的,例如blast,在altschul等人,分子生物学杂志,215:第403
‑
10页(1990)中描述。出于本发明的目的,为了确定核苷酸序列和氨基酸序列之间的同一性和相似性水平,可以通过由美国国家生物技术信息中心(http://www.ncbi.nlm.nih.gov/blast)提供的blast软件包使用带有标准参数的刻痕对齐对核苷酸序列和氨基酸序列进行比较。
[0303]
还提供了在严格条件下,优选在高严格条件下与上述核酸杂交(即与前述核酸互补)的核酸。在高严格条件下杂交的例子是在50℃或更高温度和0.1
×
ssc(15mm氯化钠/1.5mm柠檬酸钠)下杂交。在高严格条件下杂交的另一个例子是在42℃下于50%甲酰胺、5
×
ssc(150mm nacl、15mm柠檬酸三钠)、50mm磷酸钠(рн7.6)、5
×
denhardt溶液、10%硫酸右旋糖酐和20μg/ml鲑鱼精子变性的切割dna中过夜孵育,事先在约65℃下于0.1xssc中洗涤。杂交的其他高严格条件是本领域已知的,并且也可以用于鉴定本发明的核酸。
[0304]
还提供了编码本发明蛋白质的变体、突变体或衍生物的核酸。可以从选自上述核酸的核酸模板,通过在模板序列或其组合中修饰、删除或添加一个或多个核苷酸以获得核酸模板的变体得到突变体或衍生物。可以通过本领域已知的任何方法进行修饰、添加或删除(参见,例如,gustin等人,生物科技(1993)14:22;barany,基因(1985)37:111
‑
123;和colicelli等人,分子遗传学和普通遗传学(1985)199:537
‑
539,sambrook等人,分子克隆:实验室手册,(1989),csh出版社,第15.3
‑
15.108页),包括易错pcr、重排、寡核苷酸定向诱变、组装pcr、配对pcr诱变、体内诱变、盒式诱变、递归整体诱变、指数整体诱变、寡核苷酸定向诱变、随机诱变、基因重组、基因位点饱和诱变(gssm)、合成结扎重组(slr)或其组合。修饰、添加或删除也可以通过包括重组、递归序列重组、硫代磷酸酯修饰的dna诱变、尿嘧啶模板诱变、双跳诱变、减点错配诱变、恢复缺陷菌株诱变、化学诱变、放射诱变、缺失诱变、限制性选择诱变、纯化限制诱变、人工基因合成、多重诱变、嵌合多核酸的产生及其组合的方法进行。编码所述荧光素酶的缩短和延长变体的核酸也在本发明的范围内。如本文所用,这些蛋白质变体包括具有多肽链的修饰的c
‑
、n
‑
或两个末端的氨基酸序列。
[0305]
在优选的实施方式中,所讨论的同源物和突变体是能够进行真菌的荧光素生物合成的功能性酶,例如真菌荧光素。目的同源物和突变体可能具有变化的特性,例如宿主细胞
中的成熟速率、聚集性或二聚性、半衰期或其他生化特性,包括底物结合常数、热稳定性、ph稳定性、最适温度活性、最适ph活性值、米氏(michaelis
‑
menten)常数、底物特异性、副产物范围。在一些实施方式中,同源物和突变体具有与要求保护的蛋白质相同的特性。
[0306]
编码本发明的功能性同源物和突变体的核酸可以在功能测试期间鉴定,例如,在“蛋白质”部分中所描述的表达文库功能性筛选中。
[0307]
此外,还提供了编码本发明蛋白质的核酸的简并变体。核酸的简并变体包括用编码相同氨基酸的其他密码子代替核酸密码子。特别地,产生核酸的简并变体用以增强在宿主细胞中的表达。在该实施方式中,在宿主细胞基因中不优选或不太优选的核酸密码子被过量存在于宿主细胞基因的编码序列中的密码子替换,其中所述替换的密码子编码相同的氨基酸。特别地,本发明的核酸的人源化形式令人关注。如本文所用,术语“人源化”是指在核酸序列中进行的替换以优化为在哺乳动物细胞中表达蛋白质的密码子(yang等人,核酸研究(1996)24:4592
‑
4593)。参见描述蛋白质人源化的美国专利第5795737号,其公开内容通过引用并入本文。为在植物细胞中表达而优化的核酸变体特别令人关注。此类编码本发明的蛋白质的核酸的示例在seq id no:103、113和114中给出。
[0308]
可以分离要求保护的核酸并基本上以纯化形式获得。原则上,纯化形式是指核酸的纯度至少约为50%纯、通常至少约为90%纯并且通常是“重组”的,即侧翼为一种或多种核苷酸,这种核苷酸通常在其天然宿主生物体的天然染色体中不与之结合。
[0309]
要求保护的核酸可以人工合成。生产核酸的方法是现有技术众所周知的。例如,可获得关于氨基酸序列的信息或关于核苷酸序列的信息使得能够通过寡核苷酸合成来产生分离的本发明的核酸的分子。在可获得关于氨基酸序列的信息的情况下,由于遗传密码的简并性可以合成几个彼此不同的核酸。选择所需宿主的密码子变体的方法是本领域众所周知的。
[0310]
合成的寡核苷酸可以通过亚磷酰胺方法生产,并且可以通过本领域众所周知的方法,诸如高效液相色谱法(hplc)或如在sambrook等人,分子克隆:实验室手册,第二版,(1989年),冷泉港出版社,纽约州冷泉港中所述的其他方法,并根据例如hhs的美国部门,美国国家卫生研究院(nih)指南中对重组dna研究所述的说明纯化获得的构建体。可以如下合成本发明的长双链dna分子:可以用所需的互补性合成几个较小的片段,其包含能够与相邻片段结合的合适末端。相邻的片段可以通过dna裂解酶,基于重组的方法或基于pcr的方法进行交联。
[0311]
还提供了编码融合蛋白,包括本发明蛋白质的核酸。此类蛋白质的实例在以上“蛋白质”部分中给出。编码融合蛋白的核酸可以如上所述人工合成。
[0312]
还提供了表达盒或系统,尤其用于获得要求保护的蛋白质(即牛奶树碱羟化酶、牛奶树碱合酶和咖啡酰丙酮酸水解酶)或基于它们的融合蛋白或要求保护的核酸分子的复制体。表达盒可以作为染色体外元件存在,或者可以包含于由于将所述表达盒引入细胞的细胞基因组中。当将表达盒引入细胞中时,形成了由本发明的核酸编码的蛋白质产物;在这种情况下,可以称蛋白质是由细胞“产生”或“表达”的。任何表达系统,包括例如细菌系统、酵母、植物、昆虫、两栖动物或哺乳动物细胞都是适用的。表达盒中的靶核酸与调节序列可操作地结合,所述调节序列可包括启动子、增强子、终止子序列、操纵子、阻遏物和诱导子。通常,表达盒包括至少(a)在宿主细胞中起作用的转录起始区;(b)本发明的核酸和(c)在宿主
细胞中起作用的转录终止区。获得能够表达目标产物的表达盒或系统的方法是本领域技术人员已知的。
[0313]
还提供了包含要求保护的核酸的载体和其他核酸结构。合适的载体包括病毒和非病毒载体、质粒、粘粒、噬菌体等,并且用于将本发明的核酸序列克隆、扩增、表达、转移等到合适的宿主中。选择合适的载体对本领域技术人员是显而易见的。全长的核酸或其一部分通常通过dna裂解酶连接到被载体中的限制性酶分割的位点引入载体中。或者,可以通过体内同源重组来插入所需的核苷酸序列,通常是通过将同源区域从所需核苷酸序列的侧翼连接到载体。同源区域使用引物通过寡核苷酸连接或通过聚合酶链反应添加,包括例如作为同源区域、作为所需核苷酸序列的一部分。通常,该载体具有复制起点,由于其作为染色体外元件引入细胞而促进了其在宿主细胞中的增殖。该载体还可以包括促进核酸在宿主细胞中表达并获得重组功能蛋白的调控元件。在表达载体中,所述核酸与调节序列功能性结合,其可以包括启动子、增强子、终止子、操纵子、阻遏子、沉默子、绝缘子和诱导子。出于表达功能蛋白或其缩短形式的目的,将编码核酸可操作地交联到至少包括调节序列和转录起始位点的核酸。同样,这些核酸可以包括编码组氨酸标签(6his标签)、信号肽或功能性蛋白结构域的序列。在许多实施方式中,载体促进与调节元件可操作地结合的核酸整合到宿主细胞基因组中。载体可以包括针对选择标记的表达盒,例如荧光蛋白(例如gfp),抗生素抗性基因(例如氨苄青霉素、或卡那霉素、或新霉素、或潮霉素等抗性基因),调节对除草剂抗性的基因,例如调节对草丁膦和磺酰胺除草剂抗性的基因,或现有技术已知的其他的选择标记。
[0314]
载体可以包括另外的表达盒,包括编码4'
‑
磷酸泛酰巯基乙胺基转移酶、3
‑
芳基丙烯酸合成蛋白(例如,在“应用、组合和使用方法”部分中描述的)、荧光素酶等的核酸。
[0315]
以上的表达系统可用于原核或真核宿主。为了获得蛋白质,可以使用诸如大肠杆菌,枯草芽孢杆菌,酿酒酵母,昆虫细胞或非人类胚胎细胞的高级生物细胞,例如酵母,植物(例如拟南芥(arabidopsis thaliana)、本氏烟草、小立碗藓(physcomitrella patens)),脊椎动物,例如cos 7细胞、hek 293、cho、非洲爪蟾卵母细胞等的宿主细胞。
[0316]
稳定产生本发明蛋白质的细胞系可以通过本领域已知的方法进行选择(例如与选择标记,例如dhfr、gpt,抗生素抗性基因(氨苄青霉素、或卡那霉素、或新霉素、或潮霉素等)共转染),使其能够鉴定和分离转染的细胞,这些转染的细胞包括基因组中包含的或染色体外元件中整合的基因。
[0317]
如果使用上述宿主细胞中或适合本发明核酸的复制和/或表达的其他宿主细胞或生物体中的任何一种,则所获得的复制的核酸、表达的蛋白质或多肽均在本发明的范围内作为宿主细胞或生物体的产物。可以通过本领域已知的适合的方法分离产物。
[0318]
在本发明的许多实施方式中,细胞与包括编码真菌荧光素生物合成的不同酶的本发明的核酸的几个表达盒共转染。在一些实施方式中,将包括编码能够氧化真菌荧光素同时发射光的荧光素酶的核酸的表达盒另外引入细胞。在某些情况下,表达盒被组合在一种用于细胞转化的载体中。在一些实施方式中,将编码4'
‑
磷酸泛酰巯基乙胺基转移酶和/或3
‑
芳基丙烯酸合成蛋白的核酸另外引入细胞。
[0319]
还提供了被用作pcr引物、滚环扩增、杂交筛选探针等的要求保护的核酸的短dna片段。如上所述,长dna片段用于获得编码的多肽。但是,对于几何扩增反应,例如pcr,使用一对短dna片段,即引物。确切的引物序列对于本发明不是关键的,然而,对于大多数应用而
言,如本领域中已知的,引物将在严格条件下与要求保护的序列杂交。优选选择一对引物,其从至少约50个核苷酸,优选从至少约100个核苷酸产生扩增产物,并且延伸整个核酸序列。引物序列选择的算法通常是已知的且可以在商业软件包中获得。扩增引物与互补dna链杂交,将播种扩增逆反应。
[0320]
本发明的核酸分子也可以用于确定生物样品中的基因表达。检查细胞中特定核苷酸序列如基因组dna或rna的存在的方法是本领域众所周知的。简而言之,从细胞样品中分离出dna或mrna。mrna可以通过rt
‑
pcr扩增,使用逆转录酶形成互补的dna链,然后通过聚合酶链反应进行扩增,使用要求保护的dna序列的特异性引物。或者,通过凝胶电泳分离mrna样品,将其转移至合适的载体中,例如硝酸纤维素、尼龙等,然后用要求保护的dna片段作为探针进行测试。也可以使用其他方法,例如寡核苷酸连接分析、原位杂交和与固定在固体芯片上的dna
‑
探针杂交。与要求保护的序列杂交的mrna的检测指示样品中的基因表达。
[0321]
转基因生物体
[0322]
还提供了表达本发明核酸的转基因生物体、转基因细胞和转基因细胞系。本发明的转基因细胞包括在本发明中被检查的一种或几种核酸,它们以转基因的形式存在。出于本发明的目的,可以使用任何合适的宿主细胞,包括原核细胞(例如大肠杆菌、链霉菌属、枯草芽孢杆菌、嗜酸乳杆菌等)或非人胚胎细胞的真核宿主细胞。本发明的转基因生物体可以是原核或真核生物体,包括细菌、蓝藻细菌、真菌、植物和动物,其中包括本发明的异源核酸的一种或多种的生物体细胞由于人为操作通过与之结合而被引入其中,例如,与本领域已知的转基因技术一致。
[0323]
在本发明的一个实施方式中,转基因生物体可以是原核生物体。转化原核宿主细胞的方法在本领域中是众所周知的(参见,例如,sambrook等人(分子克隆:实验室手册,第二版,(1989)冷泉港实验室出版社和ausubel等人,现代分子生物学实验指南(1995)约翰威利父子公司)。
[0324]
在本发明的另一个实施方式中,所述转基因生物体可以是真菌,例如酵母。酵母被广泛用作异源基因表达的载体(参见,例如,goodey等人,酵母生物技术,dr berry等人,编辑,(1987)allen和unwin,伦敦,第401
‑
429页,和kong等人,酵母的分子和细胞生物学,e.f.walton和g.t.yarronton,编辑,blackie,glasgow(1989),第107
‑
133页)。有几种可用的酵母载体,包括需要与宿主基因组重组才能维持的整合载体和自主复制的质粒载体。
[0325]
另一宿主生物体是动物生物体。可以使用本领域已知的和标准手册中描述的转基因技术获得转基因动物(例如:pinkert,转基因动物技术:实验室手册,第二版(2003年),圣地亚哥:学术出版社;gersenstein和vinterstein,操纵小鼠胚胎:实验室手册,第3版,(2002年),nagy a.(编辑),冷泉港实验室;blau等人,实验室动物医学,第2版,(2002年),fox j.g.、anderson l.c.、loew f.m.、quimby f.w.(编辑),美国医学会,美国心理学会;基因靶向:一种战术方法由alexandra l.joyner(编辑),牛津大学出版社;第二版(2000))。例如,可以通过在内源基因座改变的框架内进行同源重组来获得转基因动物。或者,将核酸结构以随机模式整合到基因组中。稳定整合的载体包括质粒、逆转录病毒和其他动物病毒、yac等。
[0326]
由于通过谨慎的基因操作的方法,例如显微注射、或通过重组病毒感染或使用重组病毒载体、转染、转化、基因枪递送、或转共轭而引入到细胞前体中,因此核酸可以直接或
部分所述,目的抗体与抗原多肽或蛋白质、或蛋白质片段结合。本发明的抗体可以固定在载体上,并用于免疫筛选或亲和层析柱以检测和/或分离多肽、蛋白质或蛋白质片段,或包括此类多肽、蛋白质或蛋白质片段的细胞。或者,可以以这种方式固定这些多肽、蛋白质或蛋白质片段来检测能够特异性连接它们的抗体。
[0337]
对本发明蛋白质特异的抗体,如单克隆抗体如多克隆抗体,可以使用标准方法获得。通常,首先,蛋白质用于免疫合适的哺乳动物,优选小鼠、大鼠、兔或山羊。兔和山羊是获得多克隆血清的优选对象,由于能够获得大量的血清并且标记的抗兔和抗山羊抗体具有高可用性。通常,通过在生理盐水中混合或乳化特定蛋白质,优选带有佐剂,例如弗氏(freund)佐剂,然后胃肠外引入得到的混合物或乳剂(通常通过皮下注射或肌内注射)进行免疫。通常,足够的剂量为每次注射50
‑
200μg。
[0338]
在本发明的不同实施方式中,重组或天然蛋白以天然或变性的形式用于免疫。包含本发明的部分蛋白质氨基酸序列的蛋白质片段或合成多肽也可用于免疫。
[0339]
通常通过在2
‑
6周内进行一次或几次额外的生理盐水中的蛋白质注射,优选带有不完全弗氏佐剂,来增强免疫。或者,也可以使用本领域已知的方法通过体外免疫获得抗体,从本发明目的的角度来看这些方法等同于体外免疫。通过将免疫动物的血液采样到玻璃或塑料容器中,然后在25℃下进行血液孵育1小时,再在4℃下孵育2
‑
18小时,即可获得多克隆抗血清。通过离心(例如,在1000g离心10分钟)提取血清。一次可以从兔身上获得20
‑
50ml血液。
[0340]
使用标准的kohler
‑
milstein技术(kohler和milstein,1975,自然,256,495
‑
496)或其改进获得单克隆抗体。通常,根据上述信息对小鼠或大鼠进行免疫。然而,与从动物身上采集血液以获取血清不同,该技术涉及脾切除术(以及,不必要的一些大淋巴结的提取)和组织浸润以分离独立的细胞。如果需要的话,可以通过将细胞悬浮液施加在板或被蛋白
‑
抗原包覆的单独的板孔上来筛选脾细胞(提取非特异性粘附细胞后)。b淋巴细胞,表达对被测抗原具有特异性的膜结合免疫球蛋白,以不会从它与悬浮液残留物中冲走的方式结合在板上。然后,将所得的b淋巴细胞或所有浸渍的脾细胞与骨髓瘤细胞融合,形成杂交瘤:然后将它们在选择培养基(例如,在包括次黄嘌呤、氨基蝶呤和胸苷的hat培养基)中孵育。将得到的杂交瘤在限制孵育条件中铺板并测试与用于免疫的抗原特异性结合(且不与外源试剂结合)的抗体的应答。然后,将选择的分泌单克隆抗体(mab)的杂交瘤在体外(例如,呈中空纤维束形式的发酵罐中或用于组织培养的玻璃容器中)或体内(小鼠腹水中)孵育。
[0341]
可以使用标准方法标记抗体(如单克隆抗体如多克隆抗体)。合适的标签是荧光团、发色团、放射性核素(特别是32p和125i)、电子致密试剂、酶和配体,其中其特异性结合伴侣已知。通常通过其催化活性来检测酶。例如,辣根过氧化物酶通常通过其将3,3’,5,5
’‑
四甲基联苯胺(тмв)转化为蓝色颜料的能力(在分光光度计上定量评估)进行检测。术语“特异性结合伴侣”是指能够以高特异性水平结合分子
‑
配体的蛋白质,例如,在具有抗原和对其特异性的单克隆抗体的情况下。本领域已知的特异性结合伴侣的其他实例是生物素和抗生物素蛋白(或链霉亲和素),免疫球蛋白
‑
g和蛋白
‑
a,以及多对受体及其配体。其他变体和能力对于本领域技术人员而言是显而易见的,并且在本发明的范围内视为等同。
[0342]
本发明的抗原、免疫原、多肽、蛋白质或蛋白质片段引起特异性结合伴侣
‑
抗体的形成。本发明的所述抗原、免疫原、多肽、蛋白质或蛋白质片段包括本发明的免疫原性组合
物。这样的免疫原性组合物可以另外包括或包含佐剂、载体或其他组合物,它们刺激或增强、或稳定本发明的抗原、多肽、蛋白质或蛋白质片段。这样的佐剂和载体对本领域技术人员是显而易见的。
[0343]
应用,组合和使用方法
[0344]
本发明提供了真菌荧光素生物合成蛋白的应用作为酶催化以下反应:(1)从前荧光素(即6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮,其具有结构式
[0345]
合成荧光素(即6
‑
(2
‑
芳基乙烯基)
‑
3,4
‑
二羟基
‑
2h
‑
吡喃
‑2‑
酮(真菌荧光素),其具有结构式
[0346]
其中r
‑
芳基或杂芳基);
[0347]
或从3
‑
芳基丙烯酸(前荧光素前体),其具有结构式
[0348]
其中r选自芳基或杂芳基,合成前荧光素;
[0349]
或从6
‑
芳基
‑2‑
羟基
‑4‑
氧代己
‑
2,5
‑
二烯酸(氧化荧光素),其具有结构式合成3
‑
芳基丙烯酸。
[0350]
真菌荧光素生物合成蛋白被用于本发明的许多实施方式中,并且它们的非限制性实施例在下面的这一章中给出。
[0351]
本发明确保了其应用的真菌荧光素生物合成蛋白可以从不同的天然来源或通过重组技术获得。例如,可以从生物发光真菌中分离野生型蛋白质,例如担子菌型的真菌,主要是担子菌类的真菌,尤其是伞菌(agaricales)目。例如,可以从生物发光真菌新诺托帕纳斯南比菌、黑足鳞毛蕨蜜环菌、蜜环菌、圭亚那加氏菌、咖啡美洲叶斑病菌、新诺托帕纳斯戈氏菌、奥尔类脐菇、鳞皮扇菇、高卢蜜环菌、奥氏蜜环菌、荧光小菇等中分离野生型蛋白质。也可以通过在各自的宿主中或在无细胞的表达系统中表达编码蛋白序列的重组核酸获得。
[0352]
在一些实施方式中,蛋白质应用于宿主细胞内,在宿主细胞中表达并进行真菌荧光素循环转化。在其他实施方式中,可以使用分离的重组或天然蛋白质或包含本申请蛋白质的提取物。
[0353]
真菌荧光素生物合成蛋白在生理条件下是有活性的。
[0354]
在一些实施方式的蛋白质中——牛奶树碱羟化酶在体外和体内应用以获得荧光素,其被生物发光真菌荧光素酶、其同源物和突变体氧化同时发射光。因此,本发明提供了本发明的牛奶树碱羟化酶的应用来催化6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮(前荧光素),其具有结构式
[0355][0356]
转化为6
‑
(2
‑
芳基乙烯基)
‑
3,4
‑
二羟基
‑
2h
‑
吡喃
‑2‑
酮(真菌荧光素),其具有结构式
[0357][0358]
其中r
‑
芳基或杂芳基。
[0359]
从前荧光素获得真菌荧光素的方法包括将至少一个分子的牛奶树碱羟化酶与至少一个分子的6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮、至少一个nad(p)h分子和至少一个分子的分子氧(o2)结合。该反应在20至42℃的温度下在生理条件下体外和体内进行,并且该反应也可以在表达牛奶树碱羟化酶的细胞、组织和宿主生物体中进行。在优选的实施方式中,所述细胞、组织和生物体包括足够量的nad(p)h和分子氧以进行反应。外源递送的6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮或在细胞、组织和生物体内产生的内源性的6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮均用于反应中。
[0360]
在优选的实施方式中,本发明的牛奶树碱羟化酶由牛奶树碱合成3
‑
羟基牛奶树碱。在优选的实施方式中,它们从表2所示的相应的前荧光素合成至少一种3
‑
羟基牛奶树碱的功能类似物。在一些实施方式中,本发明的牛奶树碱羟化酶从任何相应的6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮,具有结构式其中r
‑
芳基或杂芳基合成6
‑
(2
‑
芳基乙烯基)
‑
3,4
‑
二羟基
‑
2h
‑
吡喃
‑2‑
酮。
[0361]
将获得的6
‑
(2
‑
芳基乙烯基)
‑
3,4
‑
二羟基
‑
2h
‑
吡喃
‑2‑
酮应用于包括功能性荧光素酶的体外和体内发光,鉴定真菌荧光素为底物。
[0362]
出于本发明的目的,氨基酸序列如seq id no:2、4、6、8、10、12、14、16、18、20、22、24、26、28中所示的蛋白质及其突变体、同系物和衍生物均可用作牛奶树碱羟化酶。例如,可以使用功能性牛奶树碱羟化酶(与seq id no:)2、4、6、8、10、12、14、16、18、20、22、24、26、28在至少350个氨基酸中具有或至少60%,或至少65%、或至少70%、或至少80%、或至少85%、或至少90%、或至少91%、或至少92%、或至少93%、或至少94%、或至少95%、或至少96%、或至少97%、或至少98%或至少99%的同一性。例如,它们可能在所有蛋白质多肽链中具有至少60%,或至少65%、或至少70%、或至少80%、或至少85%、或至少90%、或至少91%、或至少92%、或至少93%、或至少94%、或至少95%、或至少96%、或至少97%、或至少98%或至少99%的同一性。
[0363]
在出于本发明目的的优选实施方式中,氨基酸序列的特征在于存在seq id nos:29
‑
33中所示的几个保守氨基酸基序(共有序列)的蛋白质,可用作牛奶树碱
‑
羟化酶。牛奶树碱羟化酶氨基酸序列内部的共有位点通过较低插入的氨基酸插入片段可操作地连接(图
1)。
[0364]
在一些实施方式中,在体外和体内应用牛奶树碱合酶蛋白以从其前体中产生真菌荧光素,即,用于催化3
‑
芳基丙烯酸,其具有结构式
[0365]
其中r选自芳基、杂芳基基团,转化为6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮,其具有结构式
[0366]
其中r
‑
芳基或杂芳基。
[0367]
获得前荧光素的方法包括将至少一分子的牛奶树碱合酶与至少一分子的3
‑
芳基丙烯酸、至少一分子的辅酶a、至少一分子的amp和至少两分子的丙二酰辅酶a结合。
[0368]
反应在20至42℃的温度下在生理条件下进行,并且该反应也可以在表达牛奶树碱合酶的细胞、组织和宿主生物中进行。在优选的实施方式中,所述细胞、组织和生物体包括足够量的辅酶a、丙二酰辅酶a和amp以进行反应。
[0369]
外源递送的3
‑
芳基丙烯酸或在细胞、组织和生物体中产生的3
‑
芳基丙烯酸均可用于反应中。
[0370]
例如,本发明的牛奶树碱合酶可用于由咖啡酸生产牛奶树碱。在优选的实施方式中,它们从表2所示的3
‑
芳基丙烯酸合成牛奶树碱(6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮)的功能类似物。
[0371]
在本发明的牛奶树碱羟化酶存在下,将获得的6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮用于生产真菌荧光素。由于牛奶树碱及其功能类似物具有抗氧化和抗肿瘤特性,因此也被用于医学领域。有一些证据表明,牛奶树碱可以预防肥胖症[be tu等人,药物的发现与治疗2015年6月;9(3):197
‑
204;nguyen等人,药物的发现与治疗2014年12月;8(6):238
‑
44;yousfi等人,植物疗法研究2009年9月;23(9):1237
‑
42]。
[0372]
出于本发明的目的,氨基酸序列如seq id no:35、37、39、41、43、45、47、49、51、53、55中所示的蛋白质及其突变体、同源物和衍生物可用作牛奶树碱合酶。例如,可以使用氨基酸序列与选自seq id no:35、37、39、41、43、45、47、49、51、53、55的序列相同、具有至少40%、普遍至少45%、通常至少50%,例如至少55%、或至少60%,或至少65%、或至少70%、或至少80%、或至少85%、或至少90%、或至少91%、或至少92%、或至少93%、或至少94%、或至少95%、或至少96%、或至少97%、或至少98%或至少99%同一性的功能性牛奶树碱合酶。
[0373]
在出于本发明目的的优选实施方式中,氨基酸序列的特征在于存在seq id no:56
‑
63中所示的几个保守氨基酸基序(共有序列)的蛋白质可用作牛奶树碱合酶。牛奶树碱合酶氨基酸序列内部的共有位点通过具有较低插入的氨基酸插入片段可操作地连接(图2)。
[0374]
在一些实施方式中,在体外和体内应用咖啡酰丙酮酸水解酶蛋白以从结构式为
其中r
‑
芳基或杂芳基的6
‑
芳基
‑2‑
羟基
‑4‑
氧代己
‑
2,5
‑
二烯酸生产3
‑
芳基丙烯酸,其具有结构式其中r选自芳基、杂芳基。该反应在体外和体内的生理条件下进行。本发明的咖啡酰丙酮酸水解酶用于下文详细描述的自主生物发光系统。
[0375]
出于本发明的目的,氨基酸序列如seq id no:65、67、69、71、73、75所示的蛋白质及其功能性突变体、同源物和衍生物可用作咖啡酰丙酮酸水解酶。例如,可以使用氨基酸序列与选自seq id no:65、67、69、71、73、75的序列相同、至少60%、至少65%、至少70%、至少80%、至少85%、至少90%、或至少91%、或至少92%、或至少93%、或至少94%、或至少95%、或至少96%、或至少97%、或至少98%、或至少99%相同的功能性咖啡酰丙酮酸水解酶。
[0376]
在出于本发明目的的优选实施方式中,氨基酸序列的特征在于存在seq id no:76
‑
78中所示的几个保守氨基酸基序(共有序列)的蛋白质可用作咖啡酰丙酮酸水解酶。咖啡酰丙酮酸水解酶氨基酸序列内部的共有位点通过具有较低插入的氨基酸插入片段可操作地连接(图3)。
[0377]
还提供了可用于本发明方法的蛋白质组合。在优选的实施方式中,该组合包括功能性牛奶树碱羟化酶和功能性牛奶树碱合酶。该组合适用于由从3
‑
芳基丙烯酸,具有结构式
[0378]
其中r是芳基或杂芳基来制备6
‑
(2
‑
芳基乙烯基)
‑
3,4
‑
二羟基
‑
2h
‑
吡喃
‑2‑
酮。例如,该组合可用于生产咖啡酸羟基牛奶树碱。该反应在生理条件下在至少一分子牛奶树碱羟化酶、至少一分子牛奶树碱合酶、至少一分子3
‑
芳基丙烯酸、至少一分子辅酶a、至少一分子amp、至少两分子丙二酰辅酶a、至少一分子nad(p)h和至少一分子的分子氧(o2)的存在下进行。
[0379]
在一些实施方式中,该组合还包括能够利用6
‑
(2
‑
芳基乙烯基)
‑
3,4
‑
二羟基
‑
2h
‑
吡喃
‑2‑
酮,其具有结构式
[0380]
其中r
‑
芳基或杂芳基作为荧光素的荧光素酶。所述6
‑
(2
‑
芳基乙烯基)
‑
3,4
‑
二羟基
‑
2h
‑
吡喃
‑2‑
酮的通过这种荧光素酶的氧化伴随着生物发光和氧化荧光素(6
‑
芳基
‑2‑
羟基
‑4‑
氧代己
‑
2,5
‑
二烯酸)的形成。
[0381]
以上述活性为特征的任何蛋白质都可以用作荧光素酶。例如,来自生物发光真菌的已知荧光素酶,包括在申请号为2017102986/10(005203)dd 30.01.201的俄罗斯申请中
描述的那些,及其具有荧光素酶活性的同系物、突变体和融合蛋白。
[0382]
在本发明的许多实施方式中,适用于本发明目的的荧光素酶的特征在于氨基酸序列,其与选自seq id no:80、82、84、86、88、90、92、94、96、98的氨基酸序列至少40%相同,例如,至少45%相同、或至少50%相同、或至少55%相同、或至少60%相同、或至少70%相同、或至少75%相同、或至少80%相同、或至少85%相同。荧光素酶通常的特征在于氨基酸序列,其与选自seq id no:80、82、84、86、88、90、92、94、96、98的氨基酸序列具有如下的同一性,最低90%的同一性(例如最低91%、最低92%、最低93%、最低94%、最低95%、最低96%、最低97%、最低98%、最低99%的同一性或100%的同一性)。
[0383]
突变体可以保留从其获得的野生型荧光素酶的生物学特性,或者可以具有不同于野生型蛋白质的生物学特性。术语本发明的荧光素酶的“生物学特性”是指,但不限于,氧化不同荧光素的能力;生化特性,例如体内和/或体外稳定性(例如半衰期);成熟率;聚集或低聚的趋势,以及其他类似的性质。突变包括一种或多种氨基酸的改变、一种或多种氨基酸的缺失或插入、置换或截短、或n末端截短或延伸、c末端截短或延伸等。
[0384]
在本发明的一些实施方式中,荧光素酶以分离的形式使用,即它们基本上不含其他蛋白质或其他天然生物分子,例如寡糖、核酸及其片段等,其中术语“基本上不含”在这种情况下,是指小于70%、通常小于60%并且普遍小于50%的包含分离的蛋白质的所述组合物是其他的天然生物分子。在一些实施方式中,所述蛋白质是基本上纯化的形式,其中术语“基本上纯化的形式”是指纯度等于至少95%、通常等于至少97%且普遍等于至少99%。
[0385]
在一些实施方式中,荧光素酶作为从生物发光真菌中或从包括编码重组荧光素酶的核酸的宿主细胞中获得的提取物的一部分。
[0386]
在许多实施方式中,荧光素酶在包括编码重组荧光素酶的核酸的异源表达系统中(在本发明的细胞或生物体中)。
[0387]
以分离的形式、或作为提取物的一部分、或在异源表达系统中生产重牛奶树碱,特别是荧光素酶的方法是本领域众所周知的,并在“核酸”部分中描述。蛋白质纯化方法在“蛋白质”部分中描述。
[0388]
在优选的实施方式中,荧光素酶在低于50℃的温度下保留活性,普遍在最大45℃的温度下保留活性,即它们在20
‑
42℃的温度下保留活性,并且可以在体外和体内用于异源表达系统中。通常,所述的荧光素酶具有4
‑
10的范围内的ph稳定性,普遍地在6.5
‑
9.5的范围内。所要求保护的蛋白质最佳的ph稳定性是在7.0至8.5的范围内,例如在7.3
‑
8.0之间。在优选的实施方式中,所述荧光素酶在生理条件下是有活性的。
[0389]
氧化真菌荧光素同时发射光的牛奶树碱羟化酶和荧光素酶的组合被用于在生物对象:细胞、组织或生物体中的牛奶树碱及其功能类似物的鉴定方法中。该方法包括在创造生理条件并包括进行反应所需的组分的适当的反应缓冲液中将从中获得的提取物或测试生物对象与分离的牛奶树碱羟化酶和所述荧光素酶的组合接触。本领域技术人员可以制备满足该条件的各种反应缓冲液。反应缓冲液的非限制性实例可以是0.2m磷酸钠缓冲液(ph 7.0
‑
8.0)补充有0.5m的na2so4、0.1%的十二烷基麦芽糖苷(ddm)、1mm的nadph。
[0390]
牛奶树碱或其功能类似物的存在通过出现可检测的发光
‑
生物发光来确定。当描述功能筛选方法时,在上面“蛋白质”部分中描述了用于检测可检测的发光的方法。
[0391]
牛奶树碱羟化酶、牛奶树碱合酶和氧化真菌荧光素同时发射光的荧光素酶的组合
用于鉴定生物对象中3
‑
芳基丙烯酸的方法,其具有结构式
[0392]
其中r为芳基或杂芳基。该方法包括与创造生理条件并包括进行反应所需的组分的分离的牛奶树碱羟化酶、牛奶树碱合酶和荧光素酶的组合与测试生物对象或从中获得的提取物接触。本领域技术人员可以制备满足该条件的各种反应缓冲液。反应缓冲液的非限制性实例可以是0.2m磷酸钠缓冲液(ph 7.0
‑
8.0)补充有0.5m的na2so4、0.1%的十二烷基麦芽糖苷(ddm)、1mm的nadph、10mm的atp、1mm的辅酶a、1mm的丙二酰辅酶a。
[0393]3‑
芳基丙烯酸的存在通过出现可检测的发光
‑
生物发光来确定。当描述功能筛选方法时,在上面“蛋白质”部分中描述了用于检测可检测的发光的方法。
[0394]
在一些实施方式中,可以使用上面“蛋白质”部分中描述的融合蛋白来代替牛奶树碱羟化酶和氧化真菌荧光素同时发射光的荧光素酶的组合。融合蛋白同时表现出牛奶树碱羟化酶的活性和荧光素酶的活性,并且可以以任何方法代替所述酶的组合来使用。
[0395]
在一些实施方式中,代替上述牛奶树碱合酶,使用iii型聚酮化合物合酶,其特征在于氨基酸序列与选自seq id no:119、121、123、125、127、129、131、133、135、137、139的氨基酸序列相同。出于本发明的目的,可以使用具有的氨基酸序列与选自seq id no:119、121、123、125、127、129、131、133、135、137、139的序列相同、至少40%,普遍至少45%,通常至少50%,例如至少55%、或至少60%、或至少65%、或至少70%、或至少80%、或至少85%、或至少90%、或至少91%、或至少92%、或至少93%、或至少94%、或至少95%、或至少96%、或至少97%、或至少98%、或至少99%相同的iii型聚酮化合物合酶。
[0396]
在许多植物生物体中鉴定出代表性的所述聚酮化合物合酶(pks);在本领域中已知它们和/或它们的突变体催化香豆素辅酶a合成双去甲洋蒿宁的能力[lim等人,分子,2016年6月22日;21(6)]。申请人已经证明,所述酶还能够在体外和体内催化咖啡酰辅酶a合成牛奶树碱。
[0397][0398]
因此,所述蛋白质用于牛奶树碱的合成也在本发明的范围内。
[0399]
在本发明的一些实施方式中,pks以分离的形式使用,即它们基本上不含其他蛋白质或其他天然生物分子,例如寡糖、核酸及其片段等,其中术语“基本上不含”在这种情况下,是指小于70%、通常小于60%并且普遍小于50%的包含分离的蛋白质的所述组合物是其他的天然生物分子。在一些实施方式中,所述蛋白质是基本上纯化的形式,其中术语“基
本上纯化的形式”是指纯度等于至少95%、通常等于至少97%且普遍等于至少99%。
[0400]
在许多实施方式中,pks在包括编码重组酶的核酸的异源表达系统中(在本发明的细胞或生物体中)。
[0401]
以分离的形式、或作为提取物的一部分、或在异源表达系统中生产重组牛奶树碱的方法是本领域众所周知的,并在“核酸”部分中描述。蛋白质纯化方法在“蛋白质”部分中描述。
[0402]
在优选的实施方式中,pks在低于50℃的温度下保留活性,普遍在最大45℃的温度下保留活性,即它们在20
‑
42℃的温度下保留活性,并且可以在体外和体内用于异源表达系统中。通常,所述的pks在4
‑
10的范围内具有ph稳定性,普遍地在6.0
‑
9.0的范围内。所要求保护的蛋白质最佳的ph稳定性是在6.5至8.5的范围内,例如在7.0
‑
7.5之间。在优选的实施方式中,所述pks在生理条件下是有活性的。
[0403]
获得牛奶树碱的方法包括将上述至少一分子的iii型聚酮化合物合酶,与至少两分子的丙二酰辅酶a和至少一分子的咖啡酰辅酶a组合。
[0404]
在一些实施方式中,该方法包括在由香豆酸辅酶a连接酶催化的酶反应期间由咖啡酸产生咖啡酰辅酶a。在这种情况下,该方法包括将上述iii型聚酮化合物合酶,与至少一分子咖啡酸、至少一分子辅酶a、至少一分子香豆酸辅酶a连接酶、至少一分子atp和至少两分子丙二酰辅酶a组合。
[0405]
出于本发明的目的,可以使用本领域中已知的任何香豆酸辅酶a连接酶,其进行辅酶a添加到咖啡酸形成咖啡酰辅酶a的反应:
[0406][0407]
特别地,可以使用来自拟南芥(arabidopsis thaliana)的香豆酸辅酶a连接酶1,其具有seq id no:141所示的氨基酸和核酸序列,以及其功能性突变体和同源物。例如,出于本发明的目的,可使用功能性香豆酸辅酶a连接酶,其氨基酸序列与seq id no:141所示的氨基酸序列具有最低40%的同一性,例如最低45%的同一性、或最低50%的同一性、或最低55%的同一性、或最低60%的同一性、或最低65%的同一性、或最低70%的同一性、或最低75%的同一性,例如最低80%的同一性、最低85%的同一性、最低90%的同一性(例如,至少90%、91%、92%、93%、94%、95%、96%、97%、98%、98%、99%的同一性)。
[0408]
所有上述反应均在生理条件下在20至50℃的温度下进行,并且反应也可在表达功能酶的细胞、组织和宿主生物体中进行。
[0409]
pks和香豆酸辅酶a连接酶与本发明的牛奶树碱羟化酶结合可以用于从咖啡酸生产3
‑
羟基牛奶树碱。该反应在生理条件下在至少一分子牛奶树碱羟化酶、至少一分子pks、至少一分子香豆酸辅酶a连接酶、至少一分子咖啡酸或咖啡酰辅酶a、至少一分子辅酶a、至
少一分子atp、至少一分子nad(p)h、至少一分子氧和至少两分子丙二酰辅酶a的存在下进行。
[0410]
另外,本发明提供了编码真菌荧光素生物合成的酶的核酸、这些蛋白质的突变体和同源物(包括缩短和延长的形式)和融合蛋白的应用,用于在体外和/或体内获得参与真菌荧光素生物合成的酶。
[0411]
在优选的实施方式中,提供了编码本发明的牛奶树碱羟化酶的核酸的应用,即以如seq id no:2、4、6、8、10、12、14、16、18、20、22、24、26、28中所示的氨基酸序列为特征的蛋白质,以及它们的功能性同源物、突变体和衍生物。在优选的实施方式中,核酸编码蛋白质,其氨基酸序列在至少350个氨基酸中与seq id no:2、4、6、8、10、12、14、16、18、20、22、24、26、28所示序列至少40%、普遍至少45%、通常至少50%,例如至少55%、或至少60%、或至少65%、或至少70%、或至少80%、或至少85%、或至少90%、或至少91%、或至少92%、或至少93%、或至少94%、或至少95%、或至少96%、或至少97%、或至少98%、或至少99%相同。在优选的实施方式中,核酸编码蛋白质,其氨基酸序列的特征在于存在seq id no:29
‑
33所示的几个保守氨基酸基序(共有序列)。
[0412]
还提供了编码牛奶树碱
‑
合酶的核酸的应用,即以seq id no:35、37、39、41、43、45、47、49、51、53、55所示的氨基酸序列为特征的蛋白质,以及它们的功能同源物、突变体和衍生物。在优选的实施方式中,本发明的核酸编码蛋白质,其氨基酸序列与seq id no:35、37、39、41、43、45、47、49、51、53、55所示序列对于所有蛋白质多肽链至少40%,普遍至少45%,通常至少50%,例如至少55%、或至少60%、或至少65%、或至少70%、或至少80%、或至少85%、或至少90%、或至少91%、或至少92%、或至少93%、或至少94%、或至少95%、或至少96%、或至少97%、或至少98%、或至少99%相同。在优选的实施方式中,核酸编码蛋白质,其氨基酸序列的特征在于存在seq id no:56
‑
63所示的几个保守氨基酸基序(共有序列)。
[0413]
还提供了编码咖啡酰丙酮酸水解酶的核酸的应用,即以seq id no:65、67、69、71、73、75所示的氨基酸序列为特征的蛋白质,以及它们的功能同源物、突变体和衍生物。在优选的实施方式中,本发明的核酸编码蛋白质,其氨基酸序列与seq id no:65、67、69、71、73、75所示序列对于所有蛋白质多肽链有至少40%,普遍至少45%,通常至少50%,例如至少55%、或至少60%、或至少65%、或至少70%、或至少80%、或至少85%、或至少90%、或至少91%、或至少92%、或至少93%、或至少94%、或至少95%、或至少96%、或至少97%、或至少98%、或至少99%相同。在优选的实施方式中,核酸编码蛋白质,其氨基酸序列的特征在于存在seq id no:76
‑
78所示的几个保守氨基酸基序(共有序列)。
[0414]
上述核酸组被用于产生牛奶树碱羟化酶、牛奶树碱合酶和咖啡酰丙酮酸水解酶的重组蛋白,并且还用于在异源表达系统中表达这些蛋白。
[0415]
特别地,将编码牛奶树碱羟化酶的核酸应用于从来自外源或内源的6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮,其具有结构式
[0416]
其中r
‑
芳基或杂芳基获得6
‑
(2
‑
芳基乙烯基)
‑
3,4
‑
二羟基
‑
2h
‑
吡喃
‑2‑
酮,其具有结构式
[0417]
的生产细胞。
[0418]
编码咖啡酰丙酮酸水解酶的核酸被用于获得能够将氧化荧光素转化为前荧光素前体的细胞和生物体。
[0419]
将编码牛奶树碱
‑
合酶的核酸应用于从相应的3
‑
芳基丙烯酸获得上述6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮的生产细胞。例如,将表达牛奶树碱
‑
合酶的细胞用于从咖啡酸生产牛奶树碱。
[0420]
在一些实施方式中,编码牛奶树碱
‑
合酶的核酸被用于从酪氨酸产生牛奶树碱。在所述实施方式中,将编码促进酪氨酸合成咖啡酸的酶的核酸另外引入细胞中。这样的酶是本领域已知的。例如,可以使用编码荚膜红细菌(rhodobacter capsulatus)酪氨酸解氨酶与大肠杆菌的4
‑
乙酸羟苯酯3
‑
单加氧酶
‑
还原酶的hpab和hpac组分的核酸组合,其如[lin和yan.微生物细胞工厂2012,4;11:42]中所述。对于本领域技术人员显而易见的是或者可以使用本领域中任何其他已知的将酪氨酸转化成咖啡酸的酶,例如,氨基酸序列与荚膜红细菌酪氨酸解氨酶和大肠杆菌的4
‑
乙酸羟苯酯3
‑
单加氧酶
‑
还原酶的hpab和hpac组分的氨基酸序列,如seq id no:107、109和111所示,基本相同的酶。例如,所述酶的氨基酸序列可以分别与seq id no:107、109和111所示的氨基酸序列具有最低40%的同一性,例如最低45%的同一性、或最低50%的同一性、或最低55%的同一性、或最低60%的同一性、或最低65%的同一性、或最低70%的同一性、或最低75%的同一性,例如最低80%的同一性、最低85%的同一性、最低90%的同一性(例如,至少90%、91%、92%、93%、94%、95%、96%、97%、98%、98%、99%的同一性)。
[0421]
在一些实施方式中,将编码牛奶树碱
‑
合酶的核酸应用于从包括芳族氨基酸及其衍生物的芳香族化合物获得牛奶树碱功能类似物的生产细胞。在所述实施方式中,将编码促进从其生物合成牛奶树碱功能类似物的3
‑
芳基丙烯酸的合成的酶的核酸另外引入细胞中。这样的酶是本领域已知的。例如,对于肉桂酸的生物合成,可以使用如[bang,h.b.,lee,y.h.,kim,s.c.等人,微生物细胞工厂(2016)15:16.https://doi.org/10.1186/s12934
‑
016
‑
0415
‑
9]中所述的编码海洋链霉菌(streptomyces maritimus)苯丙氨酸解氨酶的核酸[bang,h.b.,lee,y.h.,kim,s.c.等人.microb cell fact(2016)15:16.https://doi.org/10.1186/s12934
‑
016
‑
0415
‑
9]。对于本领域技术人员显而易见的是或者可以使用本领域中任何其他已知将芳香族氨基酸和其他芳香族化合物转化为3
‑
芳基丙烯酸的酶。例如,对于肉桂酸的生物合成,可以是任何功能性的苯丙氨酸解氨酶,例如氨基酸序列与seq id no:117中所示的序列基本相似的苯丙氨酸解氨酶,例如序列与seq id no:117的序列相同、具有至少40%,包括最低45%的同一性、或最低50%的同一性、或最低55%的同一性、或最低60%的同一性、或最低65%的同一性、或最低70%的同一性、或最低75%的同一性,例如最低80%的同一性、最低85%的同一性、最低90%的同一性(例如,至少90%、91%、92%、93%、94%、95%、96%、97%、98%、98%、99%的同一性)的苯丙氨酸解氨酶。
[0422]
在一些实施方式中,为了获得表达功能性牛奶树碱
‑
合酶的宿主细胞,需要通过编码本发明的牛奶树碱
‑
合酶的核酸和通过编码4
’‑
磷酸泛酰巯基乙胺基转移酶的核酸来共
转染它们,4
’‑
磷酸泛酰巯基乙胺基转移酶能够在聚酮化合物合酶的酰基载体结构域中从辅酶a转移4'
‑
磷酸邻苯二甲酰基到丝氨酸。在其他实施方式中,所选择的宿主细胞,例如植物细胞或某些低级真菌(例如曲霉属真菌(aspergillus))的细胞,包括内源性4
’‑
磷酸泛酰巯基乙胺基转移酶,并且不需要共转染。
[0423]
还提供了本发明的核酸组合的应用。因此,编码牛奶树碱羟化酶和牛奶树碱合酶的核酸组合被用于从3
‑
芳基丙烯酸获得6
‑
(2
‑
芳基乙烯基)
‑
3,4
‑
二羟基
‑
2h
‑
吡喃
‑2‑
酮的生产细胞,例如,用于从咖啡酸和/或酪氨酸生产3
‑
羟基牛奶树碱。在其他实施方式中,核酸的组合包括编码4
’‑
磷酸泛酰巯基乙胺基转移酶的核酸。在一些实施方式中,核酸的组合包括编码促进从细胞代谢物中合成3
‑
芳基丙烯酸的酶的核酸,例如促进酪氨酸合成咖啡酸或苯丙氨酸合成肉桂酸的酶。
[0424]
在一些实施方式中,编码pks和香豆酸辅酶a连接酶的核酸的组合用于从咖啡酸获得牛奶树碱生产细胞。出于本发明的目的,可使用编码功能性pks的核酸,其氨基酸序列与选自seq id no:119、121、123、125、127、129、131,133、135、137、139的序列基本相似或相同;例如pks,其氨基酸序列与选自seq id nos:119、121、123、125、127、129、131、133、135、137、139的序列相同、有至少40%、普遍至少45%、通常至少50%,例如至少55%、或至少60%、或至少65%、或至少70%、或至少80%、或至少85%、或至少90%、或至少91%、或至少92%、或至少93%、或至少94%、或至少95%、或至少96%、或至少97%、或至少98%、或至少99%的同一性。编码催化辅酶a的添加到咖啡酸形成咖啡酰辅酶a的反应的功能性香豆酸辅酶a连接酶的核酸也可用于本发明的目的。例如,可以使用编码功能性香豆酸辅酶a连接酶的核酸,其氨基酸序列与seq id no:141所示的序列相同,或具有最低40%的同一性,例如最低45%的同一性、或最低50%的同一性、或最低55%的同一性、或最低60%的同一性、或最低65%的同一性、或最低70%的同一性、或最低75%的同一性,例如最低80%的同一性、最低85%的同一性、最低90%的同一性(例如,至少90%、91%、92%、93%、94%、95%、96%、97%、98%、98%或99%的同一性)。
[0425]
在一些实施方式中,使用了编码本发明的牛奶树碱羟化酶的核酸和编码pks的核酸的组合。在优选的实施方式中,组合还包括编码香豆酸辅酶a连接酶的核酸。该组合用于从咖啡酸和/或咖啡酰辅酶a获得3
‑
羟基牛奶树碱生产细胞。
[0426]
在一些实施方式中,核酸的组合包括编码促进从酪氨酸合成咖啡酸的酶的核酸。
[0427]
特别令人关注的是,本发明的核酸组合与编码能够氧化真菌荧光素同时发射光的荧光素酶的核酸一起使用。出于本发明目的的编码荧光素酶的核酸分子可以从生物学来源克隆,例如,从担子菌型真菌,主要是担子菌类,特别是伞菌目,或通过遗传修饰技术获得。具有荧光素酶活性的荧光素酶突变体可以使用分子生物学的标准技术获得,例如以上在“核酸”部分中详细描述的。突变包括一种或多种氨基酸的改变、一种或多种氨基酸的缺失、或插入、置换或截短、或n末端截短或延伸、c末端截短或延伸等。在优选的实施方式中,这些核酸编码荧光素酶,其氨基酸序列与选自seq id no:80、82、84、86、88、90、92、94、96、98的氨基酸序列至少40%相同,例如至少45%相同、或至少50%相同、或至少55%相同、或至少60%相同、或至少70%相同、或至少75%相同或至少80%相同或至少85%相同。例如,它们可以具有与选自seq id no:80、82、84、86、88、90、92、94、96、98的氨基酸序列有最低90%的同一性(例如,最低91%、最低92%、最低93%、最低94%、最低95%、最低96%、最低97%、最
低98%、最低99%或100%的同一性)的氨基酸序列。编码荧光素酶的核酸的非限制性实例在seq id no:79、81、83、85、87、89、91、93和95中给出。
[0428]
在一些实施方式中,使用了编码本发明的牛奶树碱羟化酶的核酸和编码以上荧光素酶的核酸的组合。当通过生物发光标记生物体、组织、细胞、细胞器或蛋白质时,该组合可广泛应用。用荧光素酶标记生物体、组织、细胞、细胞器或蛋白质的方法是本领域众所周知的,并且预先将编码荧光素酶的核酸引入宿主细胞,例如是促进在所述细胞、组织或生物体中荧光素酶表达的表达盒的一部分。当向细胞、组织或生物体中添加合适的荧光素时,表达荧光素酶,可检测到的发光现象发生。当标记细胞器或蛋白质时,编码荧光素酶的核酸与分别编码受试细胞器或受试蛋白质中的定位信号的核酸可操作地结合。在本发明的荧光素酶和牛奶树碱
‑
合酶的细胞中共表达时,生物学对象(细胞、组织、生物体、细胞器或蛋白质)在不仅真菌荧光素而且也在前荧光素(后者大多数情况下在环境氧气存在下更稳定)的存在下也获得发光的能力。
[0429]
同样,核酸的组合可用于研究异源表达系统中的两个启动子活性依赖性。在这种情况下,将与编码荧光素酶的启动子a可操作地结合的核酸和与编码牛奶树碱羟化酶的启动子b可操作地结合的核酸引入宿主细胞。向细胞(或细胞提取物)的等分试样中加入荧光素或前荧光素、或前荧光素和荧光素酶混合物,可能通过发生发光发射来检测启动子a(仅在存在荧光素时才检测到发光)、启动子b(在存在前荧光素和荧光素酶混合物时检测到发光)或两种启动子(在所有情况下都检测到发光)的活性。
[0430]
在一些实施方式中,组合还包括一种编码牛奶树碱
‑
合酶的核酸。在一些实施方式中,组合另外包括一种编码4
’‑
磷酸泛酰巯基乙胺基转移酶的核酸。
[0431]
在一些实施方式中,组合包括一种编码牛奶树碱
‑
合酶的核酸、一种编码荧光素酶的核酸、一种编码pks的核酸、一种编码香豆酸辅酶a连接酶的核酸。
[0432]
当通过生物发光标记生物体、组织、细胞、细胞器或蛋白质时,组合可广泛应用。在该实施方式中,为了获得发光发射,合适的前荧光素前体,例如咖啡酸或香豆酸,添加到表达牛奶树碱羟化酶、荧光素酶和牛奶树碱合酶或牛奶树碱羟化酶、荧光素酶、pks和香豆酸辅酶a连接酶的生物对象中。
[0433]
组合也可用于研究异源表达系统中三种启动子活性依赖性的方法。该方法预先引入在启动子a控制下的编码荧光素酶的核酸、在启动子b控制下的编码牛奶树碱羟化酶的核酸和在启动子b控制下的编码牛奶树碱蛋白合酶(或pks)的核酸到宿主细胞中。如果功能性牛奶树碱
‑
合酶的成熟需要共表达4
’‑
磷酸泛酰巯基乙胺基转移酶,它也可以在任何合适的组成型或诱导型启动子的控制下引入细胞中。当向细胞(或其提取物)中添加合适的前荧光素前体时,就会出现可检测的发光,这表明所有三种启动子同时激活。
[0434]
所述组合也可用于产生转基因发光生物体。在优选的实施方式中,转基因生物体来自其野生型不能进行生物发光的生物体。将编码靶蛋白的核酸作为表达盒或载体的一部分引入转基因生物体,所述表达盒或载体如上文“转基因生物体”部分所述,作为染色体外元件存在于生物体中,或整合到生物体基因组中,并且促进靶蛋白的表达。本发明的转基因生物体的不同之处在于它们至少表达牛奶树碱羟化酶,除了荧光素酶,其底物是真菌荧光素。在优选的实施方式中,它们还表达牛奶树碱
‑
合酶。在其他优选的实施方式中,它们也表达pks。在其他优选的实施方式中,它们也表达pks。在一些实施方式中,它们还表达香豆酸
辅酶a连接酶。已知内源性香豆酸辅酶a连接酶存在于许多植物生物体中,因此,当没有内源性香豆酸辅酶a连接酶的情况下,进行额外引入。
[0435]
在一些实施方式中,它们还表达咖啡酰丙酮酸水解酶。与仅表达荧光素酶的生物不同,使用本发明的核酸获得的转基因生物体在前荧光素和/或前荧光素前体——3
‑
芳基丙烯酸(普遍为咖啡酸)存在下获得发光能力,它们是获得生物发光的最便宜最稳定的底物,其可以添加到水中用于植物浇水、或微生物培养基、或饲料或动物(例如鱼)的栖息地。生物发光转基因生物体(植物、或动物、或真菌)可用作发光源,也可用于装饰目的。生物发光转基因生物体、细胞和细胞培养物也可以用于不同的筛选中,其中生物发光强度根据外部影响而变化。例如,它们可用于分析不同因素对控制外源核酸表达的启动子活性的影响。
[0436]
也由本发明提供的自主生物发光转基因生物体特别令人关注。
[0437]
在一些实施方式中,所述生物体具有至少一种3
‑
芳基丙烯酸作为代谢物,其结构式为
[0438]
其中r是芳基或杂芳基。
[0439]
高级和低级植物,包括开花植物和苔藓可以作为非限制性实例被提及。为了获得自主产生发光的转基因植物,将编码牛奶树碱羟化酶、牛奶树碱合酶和能够氧化真菌荧光素同时发射光的荧光素酶并且能够表达相应酶的核酸引入这些植物中。由于植物通常包括内源性的4
’‑
磷酸泛酰巯基乙胺基转移酶,因此通常不需要额外引入编码该酶的核酸以获得自主产生发光的植物。
[0440]
在一些实施方式中,不天然产生3
‑
芳基丙烯酸的生物体被用于得到自主生物发光的转基因生物体。这类生物体的例子是动物和多种微生物,例如酵母和细菌。在这种情况下,将能够表达、编码促进从细胞代谢物中生物合成3
‑
芳基丙烯酸(例如从酪氨酸合成咖啡酸)的酶的核酸额外引入生物中以获得自主的生物发光。如果需要的话,还将编码4
’‑
磷酸泛酰巯基乙胺基转移酶的核酸引入生物体中。
[0441]
在一些实施方式中,为了获得自主产生发光的生物体,将能够表达相应的酶(编码pks、牛奶树碱羟化酶和能够氧化真菌荧光素同时发射光的荧光素酶)的核酸引入到这些生物体中。在优选的实施方式中,所述细胞、组织和生物体包括足够量的咖啡酰辅酶a和丙二酰辅酶a以进行牛奶树碱的合成。
[0442]
在某些情况下,当转基因生物体在正常代谢过程中不能产生足够量的咖啡酰辅酶a时,将编码香豆酸辅酶a连接酶的核酸,以及,如果必要的话,将从酪氨酸生物合成咖啡酸的酶引入所述细胞或生物体中。
[0443]
在优选的实施方式中,用于获得自主生物发光细胞或转基因生物体的核酸组合还包括编码咖啡酰丙酮酸水解酶的核酸。如以下实验部分所示,咖啡酰丙酮酸水解酶表达导致自主生物发光细胞或转基因生物体的生物发光强度增强。在优选的实施方式中,生物发光强度增加至少1.5倍,普遍至少2倍,通常至少5倍,例如7
‑
9倍,例如8倍或更多倍。
[0444]
自主生物发光的转基因生物体(植物、动物或真菌)以及细胞和细胞结构体不同于仅表达荧光素酶的转基因生物体、细胞和细胞培养物,并且在本领域中是已知的,因为没有外源添加发光所需的荧光素或其前体。
[0445]
在一些实施方式中,使用编码牛奶树碱羟化酶和荧光素酶的融合蛋白的核酸代替了编码这两种酶的核酸的组合。对本领域技术人员显而易见的是,所述融合蛋白和编码牛奶树碱羟化酶和荧光素酶的核酸的组合在所有使用方法中都是可互换的对象。同样显而易见的是,基于本发明的核酸可以产生其它融合蛋白,其将保留融合伴侣的特性;这种融合蛋白和编码它们的核酸可以无限制地使用,而不是单个蛋白质和核酸的组合。
[0446]
在上述所有应用和方法中,核酸可以是表达盒的形式,其可用于促进宿主细胞中的编码序列表达。核酸可作为载体的一部分引入宿主细胞以在合适的宿主细胞中表达或不包括在载体中,例如,它可以整合到脂质体或病毒颗粒中。或者,纯化的核酸分子可以使用合适的方法直接整合到宿主细胞中,例如通过直接内吞摄取。基因构建体可以通过转染、感染、显微注射、细胞融合、原生质体融合、使用微粒轰击或借助“基因枪”(携带基因构建体的微粒射击枪)直接导入宿主生物体的细胞(如植物)。
[0447]
还提供了本发明的多克隆和单克隆抗体的应用。它们可用于染色组织、细胞或生物体以定位本发明表达的或天然的牛奶树碱羟化酶、牛奶树碱合酶和咖啡酰丙酮酸水解酶。借助特异性抗体的染色方法是本领域众所周知的并且有所描述,例如在[v.l.bykov细胞学和一般组织学]。直接免疫组织化学技术基于特异性结合的标记抗体直接与可检测物质的反应,间接免疫组织化学技术基于未标记的一抗与可检测物质结合,然后通过第二标记抗体对其进行检测,前提是一抗是二抗的抗原。抗体也可用于终止酶促反应。抗体与特异性结合伴侣的接触导致抑制酶促反应。抗体也可用于通过亲和色谱法纯化本发明的重组和天然蛋白的方法中。亲和色谱技术是本领域已知的且有所描述,例如ninfa等人(2009).生物化学和生物技术基础实验室方法(第2版).wiley第133页;cuatrecasas(1970).乳腺癌杂志2017年11月22日检索]。
[0448]
装置和产品
[0449]
本发明的下一个实施方式是一种产品,其包括上述的牛奶树碱羟化酶、或牛奶树碱合酶、或咖啡酰丙酮酸水解酶、或编码上述酶的核酸,优选具有在宿主细胞中促进靶蛋白表达的元件,例如包括编码靶蛋白的核酸的表达载体或盒。或者,核酸可包括侧翼序列以用于其掺入靶载体中。核酸可包括在无启动子的载体中,其旨在容易克隆靶标调控元件。重组蛋白可以冻干或溶解在缓冲溶液中。核酸可冻干或在酒精溶液中沉淀或溶解在水或缓冲溶液中。
[0450]
在一些实施方式中,该产品包括表达一种或几种上述核酸的细胞。
[0451]
在一些实施方式中,该产品包括表达一种或几种上述核酸的转基因生物体。
[0452]
在一些实施方式中,该产品包括用于以上酶的染色和/或抑制和/或亲和层析的抗体。
[0453]
产品是附有标签和使用说明的容器。可接受的容器是例如瓶、安瓿瓶、玻璃管、注射器、细胞板、培养皿等。容器可以由不同的材料制成,例如玻璃或聚合物材料。合适的容器的选择对于本领域技术人员是显而易见的。
[0454]
此外,产品可以包括商业上或从消费者的角度所需的其他产品,例如:反应缓冲液或制备其的组分、用于蛋白质和核酸的稀释和/或溶解和/或储存的缓冲液或制备其的组分、去离子水、本发明特异性抗体的二抗、细胞培养基或其制备组分、转基因生物的营养补给。
[0455]
产品还包括用于实施所提出的方法的说明。说明可以是不同的形式,前提是可以将一种或几种此类形式附加到产品中,例如说明可以是电子格式和/或纸质的文件。
[0456]
本发明还涉及可用于不同目的的试剂盒。该试剂盒可以包括本发明的蛋白质组合或本发明的核酸组合,优选具有用于在宿主细胞中促进靶蛋白表达的元件,例如包括编码靶蛋白核酸的表达载体或盒。在一些实施方式中,试剂盒还可包括编码能够氧化真菌荧光素同时发射光的荧光素酶的核酸。在一些实施方式中,试剂盒还可包括编码涉及从酪氨酸中生物合成咖啡酸的酶的核酸。在一些实施方式中,试剂盒还可以包括编码4
’‑
磷酸泛酰巯基乙胺基转移酶的核酸。在一些实施方式中,试剂盒还可包括编码pks的核酸。在一些实施方式中,试剂盒还可包括编码香豆酸辅酶a连接酶的核酸。
[0457]
在一些实施方式中,试剂盒还可包括用于纯化重组蛋白或用于染色宿主细胞中表达的蛋白的抗体。在一些实施方式中,试剂盒还可包括与所述核酸的区域互补,用于扩增核酸或其片段的引物。在一些实施方式中,试剂盒还可包括一种或几种真菌荧光素和/或前荧光素和/或前荧光素前体。所述化合物可以是干粉形式、有机溶剂溶液形式、水溶液形式。在一些实施方式中,试剂盒可包括包含一种或几种上述核酸的细胞。在一些实施方式中,试剂盒可包括本发明的转基因生物体,例如,生产菌株或转基因自主生物发光植物。所有的试剂盒组件均放置在合适的容器中。通常,试剂盒还包括使用说明。
[0458]
给出以下实施例以更好地理解本发明。给出这些实施例仅出于说明目的,并且不应以任何方式解释为限制本发明的范围。
[0459]
本说明书中提及的所有出版物、专利和专利申请均通过引用并入本文。尽管出于清楚的目的通过图示和实施例对上述发明进行了相当详细的描述,但是对于本领域技术人员显而易见的是,基于本发明公开的思想,在不脱离本发明的主旨和范围的前提下可以进行一些变更和修改。
[0460]
实验部分(实施例)
[0461]
实施例1.牛奶树碱羟化酶序列的分离
[0462]
根据[chomczynski和sacchi,分析生物化学,1987,162,156
‑
159]中描述的方法,分离了来自新诺托帕纳斯南比菌菌丝体的总rna。根据制造商的方案,通过smart pcr cdna合成试剂盒(clontech,美国)扩增cdna。将获得的cdna用于荧光素酶的编码序列的扩增,其核苷酸和氨基酸序列如seq id no:79、80中所示。根据制造商的方案将编码序列克隆到pgapz载体(英杰,美国)中,并转化入大肠杆菌xl1 blue(蓝)菌株的感受态细胞。在抗生素博来霉素(zeocin)存在下,在培养皿上培养细菌。在16小时内,从培养皿上冲洗菌落,充分混合,并通过质粒dna分离试剂盒(evrogen,俄罗斯)从其中分离出质粒dna。分离的质粒dna在限制性位点avrii处线性化,并用于巴斯德毕赤酵母gs115细胞的转化。根据描述于[wu和letchworth,生物技术,2004,36:152
‑
4]的方法,使用乙酸锂和二硫苏糖醇进行电穿孔。将电穿孔的细胞分散在带有rdb培养基的培养皿中,该培养基包含1m的山梨糖醇、2%(重量/体积)的葡萄糖、1.34%(重量/体积)的酵母氮源(ynb)、0.005%(重量/体积)的氨基酸混合物、0.00004%(重量/体积)的生物素和2%(重量/体积)的琼脂。用3
‑
羟基牛奶树碱溶液喷洒获得的菌落,通过出现发光检测细胞中荧光素酶的存在。通过ivis光谱(spectrum)ct(珀金埃尔默,美国)检测菌落的发光。选择响应了3
‑
羟基牛奶树碱添加而检测到发光的菌落,以进行进一步工作。
[0463]
然后,将来自新诺托帕纳斯南比菌的扩增的总cdna克隆到pgapz载体中,并转化到大肠杆菌xl1 blue(蓝)菌株的感受态细胞中。在抗生素博来霉素存在下,在培养皿上培养细菌。在16小时内,从培养皿上冲洗菌落,充分混合,并通过质粒dna分离试剂盒(evrogen,俄罗斯)从其中分离出质粒dna。分离的质粒dna在限制性位点avrii处线性化,并用于转化表达组成型表达新诺托帕纳斯南比菌荧光素酶的巴斯德毕赤酵母gs115酵母细胞。如上所述,通过电结合技术进行转化。将细胞分散在具有rdb培养基的培养皿中,该培养基包含1m的山梨糖醇、2%(重量/体积)的葡萄糖、1.34%(重量/体积)的酵母氮源(ynb)、0.005%(重量/体积)的氨基酸混合物、0.00004%(重量/体积)的生物素和2%(重量/体积)的琼脂。酵母中新诺托帕纳斯南比菌cdna得到的文库的多样性约为一百万个克隆体。用牛奶树碱溶液喷洒获得的菌落,通过出现发光检测细胞中牛奶树碱羟化酶的存在。通过ivis光谱ct(珀金埃尔默,美国)检测菌落的发光。仅表达荧光素酶的细胞和野生酵母细胞用作阴性对照。在筛选文库时,选择检测到发光的菌落并将其用作具有标准质粒引物的基质进行pcr。通过sanger方法对pcr产物进行测序以确定表达的基因的序列。所得的牛奶树碱羟化酶核酸序列如seq id no:1所示。由其编码的氨基酸序列如seq id no:2所示。
[0464]
图4显示出当用3
‑
羟基牛奶树碱(荧光素)和牛奶树碱(前荧光素)喷洒菌落时,表达牛奶树碱羟化酶和荧光素酶、或仅荧光素酶的巴斯德毕赤酵母细胞、或野生酵母的发光。数据表明,在牛奶树碱羟化酶存在下细胞中产生了荧光素。
[0465]
下一步,从黑足鳞毛蕨蜜环菌、高卢蜜环菌、奥氏蜜环菌、蜜环菌、圭亚那加氏菌、咖啡美洲叶斑病菌、荧光小菇、新诺托帕纳斯南比菌、新诺托帕纳斯戈登菌(neonothopanus gardns)、奥尔类脐菇、鳞皮扇菇分离基因组dna,并根据制造商的推荐,通过illumina hiseq技术(因美纳,美国)进行全基因组测序。测序结果用于预测假设的蛋白质氨基酸序列,并从新诺托帕纳斯南比菌中搜索牛奶树碱羟化酶同源物。通过国家生物技术信息中心提供的软件进行同源物搜索。在ncbi基因库(genbank)数据库的真菌基因组测序数据中搜索氨基酸序列。在搜索时使用标准搜索参数blastp。结果,鉴定出了来自新诺托帕纳斯南比菌的牛奶树碱羟化酶同源物序列
–
从黑足鳞毛蕨蜜环菌、蜜环菌、圭亚那加氏菌、咖啡美洲叶斑病菌、新诺托帕纳斯戈氏菌、奥尔类脐菇、鳞皮扇菇、高卢蜜环菌、奥氏蜜环菌、荧光小菇中。
[0466]
seq id no:3
‑
28中显示了新诺托帕纳斯南比菌的牛奶树碱
‑
合酶同源物的核苷酸和氨基酸序列。
[0467]
所有鉴定的酶彼此基本相同。氨基酸序列的同一性程度如表4所示。
[0468]
表4.牛奶树碱羟化酶全长天然蛋白氨基酸序列的同一性百分比。
[0469][0470]
从鳞皮扇菇和咖啡美洲叶斑病菌中,分离出几个具有单个氨基酸取代特征的高度同源的牛奶树碱羟化酶氨基酸序列。它们的核苷酸和氨基酸序列显示在seq id no:7
‑
13(鳞皮扇菇)和seq id no:15
‑
18(咖啡美洲叶斑病菌)中。对所述蛋白质性质的进一步研究并未发现这些取代对酶性质的影响。
[0471]
将检测到的同源物的编码序列(seq id no:3
‑
28)克隆并根据上述方案转化到巴斯德毕赤酵母gs115细胞中,其组成性表达新诺托帕纳斯南比菌荧光素酶。用牛奶树碱溶液喷洒获得的菌落,通过出现发光检测细胞中牛奶树碱羟化酶的存在。通过ivis光谱ct(珀金埃尔默,美国)检测菌落的发光。表达测试基因(seq id no:3、5、7、9、11、13、15、17、19、21、23、25、27)的所有菌落在用牛奶树碱喷洒时产生的发光量与对照细胞相比增加了1000
‑
100000000倍,其证实了测试基因编码的酶具有催化牛奶树碱转化为3
‑
羟基牛奶树碱(真菌荧光素)的能力。
[0472]
完成了对检测到的酶的氨基酸序列的结构分析,借助软件smart(简单模块化体系结构研究工具)进行分析,其可以从因特网上的网站http://smart.embl
‑
heidelberg.de获得[schultz等人,美国科学院院刊1998;95:5857
‑
5864;letunic i,doerks t,bork p核酸研究2014;doi:10.1093/nar/gku949],揭示了所有检测到的蛋白质均包括fad/nad(p)结合域(ipr002938
‑
interpro公共数据库代码,可在因特网上的网站http://www.ebi.ac.uk/interpro获得)。该结构域参与了某些酶,特别是单加氧酶
‑
大酶家族的代表,中fad和nad的结合,添加羟基到底物并在代谢途径中发现多种有机体。检测到的牛奶树碱羟化酶除fad/nad(p)结合域外还包括与其可操作地结合的n和c末端氨基酸序列(图1)。使用检测到的牛奶树碱羟化酶的氨基酸序列的多重比对和比较(图1)发现它们仅包括该酶组典型的几个保守氨基酸基序(共有序列)(seq id no:29
‑
33)。氨基酸序列内部的共有位点通过氨基酸插入可操作地结合。
[0473]
实施例2.牛奶树碱羟化酶和真菌荧光素酶在哺乳动物细胞中的表达及其在细胞标记的组合使用
[0474]
优化(人源化)根据实施例1得到的来自新诺托帕纳斯南比菌的牛奶树碱羟化酶和荧光素酶的编码序列以在哺乳动物细胞中表达。合成获得了优化的核酸(seq id no:99和100)。使用限制位点nhei和noti代替编码融合蛋白mkate2
‑
角蛋白(keratin)的序列将牛奶树碱羟化酶的编码序列克隆到pmkate2
‑
角蛋白载体(evrogen,俄罗斯)中。通过pcr扩增荧光素酶序列,用限制性核酸内切酶nhei和ecorv(纽英伦生物技术,伊普斯威奇,马萨诸塞州)处理,并连接到慢病毒载体prrlsin.cppt.ef1中。质粒dna通过质粒dna纯化试剂盒(evrogen)纯化。包括荧光素酶基因的质粒dna被用于开发稳定表达的hek293nt细胞系。根据制造商网站上提供的方案,通过helk293t细胞的磷酸钙转染(英杰,卡尔斯巴德,加利福尼亚州)获得载体颗粒。转染前24小时,将1,500,000个细胞放入60mm培养皿中。转染使用约4和1.2μg包装质粒pr8.91和pmd.g,以及5μg包含荧光素酶序列的转移质粒。转染后24小时收获病毒颗粒,浓缩10倍,用于转导hek293nt细胞。大约100%的hek293nt细胞稳定表达新诺托帕纳斯南比菌荧光素酶。
[0475]
根据制造商的方案,使用转染试剂fugene hd(普洛麦格,美国)通过包括牛奶树碱羟化酶编码序列的载体对获得的细胞进行再转染。转染后24小时,将浓度为800μg/ml的牛奶树碱添加到培养基中,并通过ivis光谱ct(珀金埃尔默)检测细胞发光。得到的细胞发出的光强度比未转染的对照细胞发出的信号高两个数量级以上(图5)。
[0476]
在绿色发光检测频道中在透射光下观察细胞。在牛奶树碱存在下,人细胞中新诺托帕纳斯南比菌牛奶树碱羟化酶的表达导致出现了绿色光谱中的明显的发光信号,从而能够将转染的细胞与未转染的细胞区分开。
[0477]
实施例3.牛奶树碱羟化酶与牛奶树碱类似物在细胞裂解物中的用途
[0478]
从实施例2获得的表达新诺托帕纳斯南比菌的荧光素酶和牛奶树碱羟化酶的hek293nt细胞用补充有0.025%胰蛋白酶的维尔烯溶液转染,24小时后从培养皿中漂洗,通过离心用ph为8.0的磷酸盐缓冲盐水代替培养介质,重悬细胞,然后在制造商推荐的条件下在bioruptor中(diagenode,比利时)0℃下于7分钟内用超声裂解,并将1mm nadph(西格玛奥德里奇,美国)和牛奶树碱或其类似物之一以660μg/ml的浓度添加到培养基中:
[0479]
(e)
‑4‑
羟基
‑6‑
(4
‑
羟基苯乙烯基)
‑
2h
‑
吡喃
‑2‑
酮、(e)
‑6‑
(2
‑
(1h
‑
吲哚
‑3‑
基)乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮、(e)
‑6‑
(2
‑
(1,2,3,5,6,7
‑
六氢吡啶并[3,2,1
‑
ij]喹啉
‑9‑
基)乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮、e)
‑6‑
(4
‑
(二乙氨基)苯乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮、或(e)
‑4‑
羟基
‑6‑
(2
‑
(6
‑
羟基萘
‑2‑
基)乙烯基)
‑
2h
‑
吡喃
‑2‑
酮。通过荧光分光光度计瓦里安(varian)cary eclipse检测生物发光光谱。加入所有所述的牛奶树碱功能类似物后观察到裂解物的发光。根据所使用的荧光素观察预期的发光峰位移。
[0480]
实施例4.获得重组牛奶树碱羟化酶
[0481]
将多组氨酸序列(his标签)可操作地连接至根据实施例1和2获得的编码来自新诺托帕纳斯南比菌的牛奶树碱3
‑
羟化酶和荧光素酶的核酸的5'
‑
末端。将所得的结构通过限制性核酸内切酶bamhi和hindiii克隆到pet
‑
23载体。该载体用于转化大肠杆菌bl21
‑
de3菌株的细胞。将细胞分散在含有1.5%琼脂、100μg/ml氨苄青霉素的lb培养基的培养皿中,并在37℃下孵育过夜。然后,将大肠杆菌菌落转移至装有氨苄青霉素的4ml液体lb培养基中,
在37℃下震荡孵育过夜。将1ml的过夜培养物转移到预先添加了氨苄青霉素的100ml的过夜表达自诱导培养基(novagen)中。培养物在37℃下生长2.5小时直到达到600nm处0.6oe的光密度,然后在室温下生长16小时。然后,将细胞在埃普多夫5810r离心机中以4500rpm的转速在20分钟内沉淀,在35ml的缓冲液(50mm的tris hcl ph 8.0,150mm的nacl)中重悬。将细胞超声处理并再次沉淀。使用talon树脂金属亲和层析(clontech,美国)纯化重组蛋白。通过电泳确认了预期的重组产物的存在。
[0482]
将分离的重组牛奶树碱羟化酶的等分试样用于测试功能性和稳定性。为了确定功能性,将15μl分离的重组蛋白溶液放入玻璃管中,玻璃管中包括100μl缓冲液(0.2m磷酸钠缓冲液,0.5m na2so4、0.1%十二烷基麦芽糖苷(ddm)ph 8.0)、0.5μl纯化的新诺托帕纳斯南比菌重组荧光素酶、1mm nadph和0.2μm的牛奶树碱。将玻璃管放入光度计中。分离的重组蛋白的活性导致在新诺托帕纳斯南比菌荧光素酶的存在下,在与实施例3中描述的牛奶树碱及其类似物组合时会发光。在所有情况下,使用牛奶树碱时的发光强度在使用新诺托帕纳斯南比菌牛奶树碱羟化酶时最高,而在使用蜜环菌牛奶树碱羟化酶时最低。
[0483]
实施例5.使用重组牛奶树碱羟化酶获得3
‑
羟基牛奶树碱、(e)
‑
3,4
‑
二羟基
‑6‑
苯乙烯基
‑
2h
‑
吡喃
‑2‑
酮和(e)
‑
3,4
‑
二羟基
‑6‑
(4
‑
羟基苯乙烯基)
‑
2h
‑
吡喃
‑2‑
酮
[0484]
将根据实施例4获得的分离的新诺托帕纳斯南比菌重组牛奶树碱羟化酶添加至反应混合物中,其包括1mm nadph和0.2μm牛奶树碱、(e)
‑4‑
羟基
‑6‑
苯乙烯基
‑
2h
‑
吡喃
‑2‑
酮或(e)
‑4‑
羟基
‑6‑
(4
‑
羟基苯乙烯基)
‑
2h
‑
吡喃
‑2‑
酮在100μl缓冲液(0.2m磷酸钠缓冲液,0.5m na2so4、0.1%十二烷基麦芽糖苷(ddm)ph 8.0)中。在30分钟内,通过hplc分析反应混合物,使用合成荧光素作为标准品。色谱表明出现了与3d位羟基化衍生物对应的峰:3
‑
羟基牛奶树碱、(e)
‑
3,4
‑
二羟基
‑6‑
苯乙烯基
‑
2h
‑
吡喃
‑2‑
酮和(e)
‑
3,4
‑
二羟基
‑6‑
(4
‑
羟基苯乙烯基)
‑
2h
‑
吡喃
‑2‑
酮。
[0485]
实施例6.通过牛奶树碱羟化酶和荧光素酶融合蛋白进行生物发光检测
[0486]
将根据实施例2获得的编码新诺托帕纳斯南比菌的牛奶树碱羟化酶和荧光素酶的人源化dna序列通过具有氨基酸序列ggsggsggs(seq id no:115)的柔性短肽接头可操作地彼此交联。所获得的融合蛋白的核苷酸和氨基酸序列如seq id no 101和102所示。在巨细胞病毒启动子控制下,将编码融合蛋白的核酸克隆到pegfp
‑
n1载体(clontech,美国)代替egfp基因。将获得的结构转染到hek293t细胞中。包含牛奶树碱羟化酶和荧光素酶的单个基因的类似载体也被共转染。转染通过转染剂fugene hd(普洛麦格,美国)根据制造商的方案进行。转染后24小时,将100万个细胞重悬于0.5ml pbs中,并通过光度计记录未添加牛奶树碱和添加牛奶树碱(每100万个细胞10μg)的发光情况。牛奶树碱的添加引起绿色光谱中的细胞发光(图6)。3
‑
羟基牛奶树碱的添加也引起生物发光信号。牛奶树碱羟化酶和荧光素酶融合蛋白的表达可以使用更稳定的荧光素前体(牛奶树碱,双去甲洋蒿宁和其他)代替一种荧光素酶进行细胞生物发光标记,并且不需要将两个核酸共转染到细胞中。
[0487]
实施例7.多克隆抗体的制备
[0488]
合成获得线性双链dna形式的新诺托帕纳斯南比菌(seq id no:1)和蜜环菌(seq id no:19)的牛奶树碱羟化酶的编码序列,并以使得重组蛋白在n端包含组氨酸标签的方式将其克隆入表达载体pqe
‑
30(凯杰,德国)。在大肠杆菌中表达后,重组蛋白在变性条件下利用金属亲和力树脂talon(clontech,美国)纯化。在弗氏佐剂(freund adjuvant)中乳化的
纯化蛋白产物以每月的间隔进行四次兔免疫。免疫后在第十天或第十一天取兔血样。通过elisa和western免疫印迹法在根据实施例4获得的纯化的一组重组牛奶树碱羟化酶上测试获得的多克隆抗血清的活性。
[0489]
在兔免疫中用来自新诺托帕纳斯南比菌的蛋白获得的抗体表现出针对新诺托帕纳斯南比菌的变性和非变性牛奶树碱羟化酶的活性,以及针对新诺托帕纳斯戈氏菌变性牛奶树碱羟化酶的活性。
[0490]
在兔免疫中用来自蜜环菌的蛋白获得的抗体具有针对蜜环菌、高卢蜜环菌、奥氏蜜环菌和黑足鳞毛蕨蜜环菌的变性和非变性牛奶树碱羟化酶的活性。
[0491]
实施例8.获得表达新诺托帕纳斯南比菌牛奶树碱羟化酶和荧光素酶的转基因植物
[0492]
优化了新诺托帕纳斯南比菌牛奶树碱羟化酶和荧光素酶的编码序列以用于在小立碗藓(physcomitrella patens)苔藓细胞中的表达。然后,在计算机上创建了一个表达盒,其包括水稻akti基因的启动子、人巨细胞病毒5'非翻译区、为在植物细胞中表达而优化的牛奶树碱羟化酶编码序列(seq id no 103)、终止密码子、农杆菌osc基因终止子序列、水稻泛素启动子、为在苔藓细胞中表达而优化的新诺托帕纳斯南比菌荧光素酶的编码序列(seq id no 112)、根癌农杆菌(agrobacterium tumefaciens)nos基因终止子。
[0493]
以这种方式合成所得序列,使得所有所述片段均可可操作地互相交联并通过gibson组装技术克隆[gibson等人,自然方法,2009,6:343
‑
5]到表达载体pland#1(让皮埃尔布尔森研究所institut jean
‑
pierre bourgin,法国)中,在与在高表达的苔藓基因pp3c16_6440v3.1和pp3c16_6460v3.1的序列之间的小立碗藓苔藓基因组dna基因座一致的dna片段之间。载体pland#1还包含cas9核酸酶的向导rna(sgrna)序列,其与相同dna基因座的区域互补。
[0494]
根据在[cove等人,冷泉港实验室方案,2009,2]中描述的聚乙二醇转化方案,在拟南芥(arabidopsis thaliana)泛素启动子下将质粒dna产物与包括cas9核酸酶序列的表达载体共转化入小立碗藓苔藓原生质体。然后将原生质体在暗室条件下于bcd培养基中孵育两天,并以50rpm的速度震荡以再生细胞壁。然后将原生质体转移至包含琼脂和bcd培养基的培养皿中,并在一周内光照16小时下生长。通过pcr从外部基因组引物中筛选转化的苔藓菌落,以确定基因构建体整合到基因组中的进程,转移到新鲜的培养皿中并在相同光照条件下生长30天。
[0495]
将获得的苔藓配子体浸入含900μg/ml浓度的牛奶树碱的bcd培养基中,并通过ivis体内光谱成像系统(珀金埃尔默)进行分析。所有分析的转基因植物均表现出生物发光,其强度比仅表达荧光素酶并与牛奶树碱在同样的溶液中孵育的对照植物的信号强度高至少两个数量级。
[0496]
实施例9.牛奶树碱
‑
合酶和咖啡酰丙酮酸水解酶的鉴定
[0497]
真菌荧光素前体,例如牛奶树碱,与一大类化合物
‑
聚酮化合物衍生物有关。这种化合物理论上可以从3
‑
芳基丙烯酸获得,其中芳基取代基,包括芳基或杂芳基是3d位取代基。本领域中已知参与聚酮化合物及其衍生物合成的酶是与聚酮化合物合酶蛋白质超家族有关的多域复合物。同时,本领域已知还没有能够催化3
‑
芳基丙烯酸转化为取代的4
‑
羟基
‑
2h
‑
吡喃
‑2‑
酮的聚酮化合物合酶。筛选新诺托帕纳斯南比菌cdna文库以寻找目标聚酮化合
物合酶。
[0498]
已知为了在异源表达酵母系统中获得功能性聚酮化合物合酶,需要向培养物中另外引入表达4
’‑
磷酸泛酰巯基乙胺基转移酶——在聚酮化合物合酶的酰基载体结构域中将4'
‑
磷酸泛酰巯基乙胺基从辅酶a转移到丝氨酸的酶
‑
的基因[gao menghao等人,微生物细胞工厂,2013,12:77]。本领域已知的来自构巢曲霉(aspergillus nidulans)的4
’‑
磷酸泛酰巯基乙胺基转移酶的npga基因(seq id no 104、105)通过合成获得并将其克隆到pgapz载体中。质粒在限制性位点avrii处线性化,并用于转化巴斯德毕赤酵母gs115酵母系,其组成性表达根据实施例1获得的新诺托帕纳斯南比菌荧光素酶和牛奶树碱羟化酶。在酵母中得到的新诺托帕纳斯南比菌cdna文库中的多样性约为一百万个克隆体。
[0499]
根据实施例1中给出的方案,得到在所述巴斯德毕赤酵母系中表达的新诺托帕纳斯南比菌cdna文库,并用于鉴定牛奶树碱
‑
合酶和咖啡酰丙酮酸水解酶。将细胞分散在具有rdb培养基的培养皿中,该培养基包含1m的山梨糖醇、2%(重量/体积)的葡萄糖、1.34%(重量/体积)的酵母氮源(ynb)、0.005%(重量/体积)的氨基酸混合物、0.00004%(重量/体积)的生物素和2%(重量/体积)的琼脂。
[0500]
用咖啡酸(潜在的牛奶树碱前体)溶液喷洒获得的菌落,通过出现发光检测细胞中牛奶树碱
‑
合酶的存在。通过ivis光谱ct(珀金埃尔默,美国)检测菌落的发光。仅表达荧光素酶和牛奶树碱羟化酶的细胞以及野生酵母细胞用作阴性对照。在筛选文库时,选择检测到发光的菌落,并将其用作具有标准质粒引物的基质进行pcr。通过sanger方法对pcr产物进行测序以确定表达基因的序列。所获得的牛奶树碱
‑
合酶核酸序列如seq id no:34所示。由其编码的氨基酸序列如seq id no:35所示。
[0501]
然后,使用得到的巴斯德毕赤酵母酵母系,其包含整合到基因组中的新诺托帕纳斯南比菌荧光素酶、牛奶树碱羟化酶和牛奶树碱合酶基因,以及来自构巢曲霉的4
’‑
磷酸泛酰巯基乙胺基转移酶的npga基因,来鉴定催化氧化荧光素((2e,5e)
‑6‑
(3,4
‑
二羟基苯基)
‑2‑
羟基
‑4‑
氧代己
‑
2,5
‑
二烯酸)转化为咖啡酸的酶。该细胞系再次由新诺托帕纳斯南比菌基因的线性化质粒文库转化,该文库是在第一步工作中获得的。用咖啡酰丙酮酸溶液喷洒菌落,通过出现发光检测细胞中靶酶的存在。通过ivis光谱ct(珀金埃尔默,美国)检测菌落的发光。仅表达荧光素酶和牛奶树碱羟化酶的细胞以及野生酵母细胞用作阴性对照。在筛选文库时,选择检测到发光的菌落,并将其用作具有标准质粒引物的基质进行pcr。通过sanger方法对pcr产物进行测序以确定表达基因的序列。获得的分离的酶核酸的序列如seq id no:64所示。由其编码的氨基酸序列如seq id no:65所示。所鉴定的酶称为咖啡酰丙酮酸水解酶。
[0502]
实施例10.新诺托帕纳斯南比菌牛奶树碱
‑
合酶和新诺托帕纳斯南比菌咖啡酰丙酮酸水解酶同源物的鉴定
[0503]
根据实施例1获得的来自生物发光真菌的全基因组测序数据被用于搜索新诺托帕纳斯南比菌牛奶树碱
‑
合酶和咖啡酰丙酮酸水解酶的同源物。通过国家生物技术信息中心(national center for biotechnology information)提供的软件进行同源物搜索。在ncbi基因库数据库的真菌基因组测序数据中搜索氨基酸序列。在搜索时使用标准搜索参数blastp。
[0504]
已经鉴定了来自新诺托帕纳斯南比菌的牛奶树碱
‑
合酶同源物的序列
‑
从黑足鳞
毛蕨蜜环菌、蜜环菌、圭亚那加氏菌、咖啡美洲叶斑病菌、新诺托帕纳斯戈氏菌、奥尔类脐菇、鳞皮扇菇、高卢蜜环菌、奥氏蜜环菌、荧光小菇中。它们的核苷酸和氨基酸序列示于seq id no 36
‑
55。所有鉴定出的酶彼此基本相同。氨基酸序列同一性的程度如表5所示。
[0505]
表5.牛奶树碱
‑
合酶全长天然蛋白氨基酸序列的同一性百分比。
[0506][0507][0508]
从鳞皮扇菇中分离出两个高度同源的牛奶树碱
‑
合酶氨基酸序列,其特征在于单个氨基酸取代。它们的核苷酸和氨基酸序列如seq id no 36
‑
39所示。
[0509]
使用实施例9中描述的技术测试鉴定出的酶将咖啡酸转化为牛奶树碱的能力。
[0510]
所鉴定的蛋白质氨基酸序列的多重比对使得能够鉴定该酶组典型的氨基酸序列的几个高度同源的片段。这些片段的共有序列如seq id no:70
‑
77所示。所述序列被长氨基酸序列隔开,如图2所示。
[0511]
在新诺托帕纳斯戈氏菌、蜜环菌、黑足鳞毛蕨蜜环菌、高卢蜜环菌、奥氏蜜环菌中鉴定出新诺托帕纳斯南比菌咖啡酰丙酮酸水解酶同源序列。所鉴定的同源物的核苷酸和氨基酸序列显示在seq id no:66
‑
75中。使用实施例9中描述的技术测试鉴定出的酶将咖啡酰丙酮酸转化为咖啡酸的能力。
[0512]
所有鉴定的酶基本上彼此相同,并且具有长度为280
‑
320个氨基酸。氨基酸序列同一性的程度如表6所示。
[0513]
表6.咖啡酰丙酮酸水解酶全长天然蛋白氨基酸序列的同一性百分比。
[0514][0515]
通过软件smart(简单模块化体系结构研究工具)进行分析,其可从因特网上的网站http://smart.embl
‑
heidelberg.de获得[schultz等人,美国科学院院刊1998;95:5857
‑
5864;letunic i,doerks t,bork p核酸研究2014;doi:10.1093/nar/gku949],揭示了所有检测到的蛋白质均包括位于c端附近的长约200个氨基酸的延胡索酸乙酰乙酸酶结构域(ec 3.7.1.2),但是根据新诺托帕纳斯南比菌咖啡酰丙酮酸水解酶氨基酸的编号,保守区大约从8个氨基酸开始。多重比对使得能够鉴定该蛋白组典型的共有序列(seq id nos 76
‑
78),该序列被具有较低同一性的氨基酸插入物隔开。共有序列的位置示于(图3)。
[0516]
实施例11.重组牛奶树碱
‑
合酶和咖啡酰丙酮酸水解酶的获得及其在获得生物发光中的用途
[0517]
将多组氨酸(his标签)编码序列可操作地连接到根据实施例9获得的编码新诺托帕纳斯南比菌牛奶树碱
‑
合酶和咖啡酰丙酮酸水解酶的核酸的5'
‑
末端,且所得的结构借助限制性核酸内切酶noti和saci克隆到pet
‑
23载体中。载体用于通过电穿孔转化大肠杆菌bl21
‑
de3
‑
密码子(codon)+菌株的细胞。将转化的细胞分散在含有1.5%琼脂、100μg/ml氨苄青霉素的lb培养基的培养皿中,并于37℃孵育过夜。然后,将大肠杆菌菌落转移至包括100μg/ml氨苄青霉素的4ml液体lb培养基中,在37℃下振荡孵育过夜。将1ml的过夜培养物转移到预先添加了氨苄青霉素的200ml的过夜表达自诱导培养基(novagen)中。培养物在37℃下培养3小时直到600nm的光密度达到0.6oe,然后在室温下生长16小时。然后,将细胞在埃普多夫5810r离心机中以4500rpm的转速离心20分钟获得沉淀,在20ml的缓冲液(50mm的tris hcl ph 8.0,150mm的nacl)中重悬,在制造商建议的条件下,在0℃于bioruptor(diagenode,比利时)中用超声裂解7分钟,然后再次沉淀。通过talon树脂亲和色谱法(clontech,美国)从裂解物中获得蛋白质。通过电泳确认了预期重组产物的存在,因为可获得预期长度的条带。
[0518]
将分离的重组蛋白的等分试样用于测试功能性和稳定性。
[0519]
为了确定牛奶树碱
‑
合酶的功能性,将30μl分离的重组蛋白溶液放入玻璃管中,玻璃管包括100μl缓冲液(0.2m磷酸钠缓冲液,0.5m na2so4、0.1%十二烷基麦芽糖苷(ddm)ph 8.0,全部成分
–
西格玛奥德里奇(sigma
‑
aldrich),美国)、根据实施例4获得的0.5μl纯化的重组新诺托帕纳斯南比菌荧光素酶、1mm nadph(西格玛奥德里奇,美国)、15μl根据实施例4获得的纯化的重组新诺托帕纳斯南比菌牛奶树碱羟化酶、10mm atp(赛默飞世尔科技(thermofisher scientific),美国)、1mm辅酶a(西格玛奥德里奇,美国)、1mm丙二酰辅酶a(西格玛奥德里奇,美国)。将玻璃管放入光度计glomax20/20(普洛麦格,美国)中。在向溶液中添加20μm咖啡酸(西格玛奥德里奇,美国)时,反应混合物显示出生物发光。所发射的光的最大发射为520
‑
535nm。
[0520]
为了确定咖啡酰丙酮酸水解酶的功能性,将10μl分离的重组蛋白溶液放入玻璃管中,玻璃管包括100μl缓冲液(0.2m磷酸钠缓冲液、0.5m na2so4、0.1%十二烷基麦芽糖苷(ddm)ph 8.0)、0.5μl新诺托帕纳斯南比菌荧光素酶、1mm nadph(西格玛奥德里奇,美国)、15μl牛奶树碱羟化酶、10mm atp(赛默飞世尔科技,美国)、1mm辅酶a(西格玛奥德里奇,美国)、1mm丙二酰辅酶a(西格玛奥德里奇,美国)、30μl纯化的重组牛奶树碱合酶。将玻璃管放入光度计glomax 20/20(普洛麦格,美国)中,在向溶液中加入25μm的咖啡酰丙酮酸时,检测到反应混合物的生物发光,表明测试酶具有将咖啡酰丙酮酸分解为咖啡酸的能力。所发射的光的最大发射为520
‑
535nm。
[0521]
所获得的酶用于与根据实施例4获得的新诺托帕纳斯南比菌荧光素酶和牛奶树碱羟化酶反应而获得发光(生物发光)。将5μl每种分离的重组蛋白溶液放入玻璃管中,玻璃管包括100μl缓冲液(0.2m磷酸钠缓冲液、0.5m na2so4、0.1%十二烷基麦芽糖苷(ddm)ph 8.0)、1mm nadph(西格玛奥德里奇,美国)、10mm atp(赛默飞世尔科技,美国)、1mm辅酶a(西格玛奥德里奇,美国)、1mm丙二酰辅酶a(西格玛奥德里奇,美国)和0.2μm的以下3
‑
芳基丙烯酸之一:对香豆酸(西格玛奥德里奇,美国)、肉桂酸(西格玛奥德里奇,美国)或阿魏酸(艾博抗,美国)。在另一个实验中,代替取代的3
‑
芳基丙烯酸,将真菌氧化荧光素的类似物——(2e,5e)
‑2‑
羟基
‑6‑
(4
‑
羟基苯基)
‑4‑
氧己
‑
2,5
‑
二烯、(2e,5e)
‑2‑
羟基
‑4‑
氧代
‑6‑
苯基己
‑
2,5
‑
二烯、或(2e,5e)
‑2‑
羟基
‑6‑
(4
‑
羟基
‑3‑
甲氧基苯基)
‑4‑
氧己
‑
2,5
‑
二烯酸也以0.2μm的浓度放入玻璃管中。将玻璃管放入光度计中。分离的重组蛋白的活性导致每个所述反应均发光。
[0522]
实施例13.从咖啡酸中获得牛奶树碱
[0523]
包括编码新诺托帕纳斯南比菌牛奶树碱
‑
合酶的核酸(seq id no 34、35)的在j23100启动子的控制下的表达盒,和包括来自构巢曲霉的4
’‑
磷酸泛酰巯基乙胺基转移酶的npga基因(seq id no 104、105)的在arabad启动子的控制下的表达盒,侧翼为ss9位点同源区域,通过合成得到并将其克隆到包含博来霉素抗性盒的细菌表达载体中。如bassalo等人[acs合成生物学2016年7月15日;5(7):561
‑
8]中所述,通过λ噬菌体蛋白介导的重组使用博来霉素抗性的选择将获得的结构用于转化和整合到大肠杆菌bw25113基因组中。通过pcr从对ss9同源性区域特异的引物确认了全长结构的整合,然后通过sanger法对基因组dna pcr产物进行测序,验证了整合结构的正确性。
[0524]
将获得的大肠杆菌菌株用于生产牛奶树碱。第一步,在37℃,细菌在五个50ml塑料管中在lb培养基内以200rpm振荡培养10小时。将250ml所得的培养物添加至3.3升发酵培养基中,到发酵罐biostat b5(博朗(braun),德国)中,以使初始培养物的光密度在600nm约0.35。发酵培养基包括10g/l的蛋白胨,5g/l的咖啡酸,5g/l的酵母提取物,10g/l的nacl,25g/l的葡萄糖,15g/l的(nh4)2so4、2g/l的kh2po4、2g/l的mgso4·
7h2o、14.7mg/l的cacl2、0.1mg/l的硫胺素、1.8mg/l和0.1%的由edta 8mg/l、cocl2·
6h2o2.5mg/l、mncl2·
4h2o 15mg/l、cucl2·
2h2o 1.5mg/l、h3bo
3 3mg/l、na2moo4·
2h2o2.5mg/l、zn(ch3coo)2·
2h2o 13mg/l、柠檬酸铁(iii)100mg/l、盐酸硫胺素4.5mg/l构成的溶液。在37℃,3l/min的通气量和200rpm混合的条件下进行发酵。培养25小时后,将阿拉伯糖添加至培养物中,直至终浓度为0.1mm。通过添加nh4oh自动控制ph,将ph降至7.0。当每次ph升高至7.1时,将包括500g/l的葡萄糖,5g/l的咖啡酸,2g/l的阿拉伯糖,25g/l的胰蛋白胨,50g/l的酵母提取物,17.2g/
l的mgso4·
7h2o,7.5/l的(nh4)so4、18g/l的抗坏血酸的溶液添加到发酵罐中以维持葡萄糖水平。培养56小时后,培养基中牛奶树碱的浓度为1.23g/l。发酵罐培养基以及通过hplc从中纯化的牛奶树碱在与新诺托帕纳斯南比菌牛奶树碱羟化酶和荧光素酶的生物发光反应中具有活性。
[0525]
实施例13.从咖啡酸中获得3
‑
羟基牛奶树碱
[0526]
合成得到了在j23100启动子的控制下包括编码新诺托帕纳斯南比菌牛奶树碱羟化酶的核酸(seq id no 1、2)的表达盒,并克隆到包含奇霉素抗性基因的细菌表达载体中。将获得的载体转化到表达根据实施例12获得的新诺托帕纳斯南比菌牛奶树碱合酶、博来霉素抗性基因和npga基因的大肠杆菌细胞中。根据实施例12中所述的方案,通过发酵将获得的细菌用于生产3
‑
羟基牛奶树碱。然而在所有用于培养的培养基中加入浓度为50mg/ml的奇霉素。培养48小时后,培养基中的3
‑
羟基牛奶树碱浓度为2.3g/l。发酵罐培养基以及通过hplc从其中纯化的3
‑
羟基牛奶树碱在与新诺托帕纳斯南比菌荧光素酶的生物发光反应中具有活性。
[0527]
实施例14:从细胞代谢物和酪氨酸中获得牛奶树碱
[0528]
获得了有效产生酪氨酸和咖啡酸的大肠杆菌菌株用于从酪氨酸中产生生物合成的牛奶树碱。如[lin和yan。微生物细胞工厂2012年4月4日;11:42]中所述获得大肠杆菌菌株。提供细菌细胞对阿拉伯糖的均匀消耗的大肠杆菌bw25113系在attb位点具有acy(lacy a177c)通透酶的整合突变基因,作为菌株开发的基础。表达盒,其包含荚膜红细菌酪氨酸解氨酶基因(seq id no:106、107)以及大肠杆菌4
‑
乙酸羟苯酯3
‑
单加氧酶还原酶的组分hpab和hpac(seq id no:108
‑
111)的编码序列,均在组成型j23100启动子控制下,通过合成获得,并如实施例12中所述整合到大肠杆菌菌株的基因组中。在下一步中,根据实施例12获得的质粒和包括在组成型j23100启动子的控制下的新诺托帕纳斯南比菌牛奶树碱
‑
合酶的编码序列、来自pgap
‑
z载体的博来霉素抗性盒以及npga基因整合到大肠杆菌基因组中。根据来自[bassalo等人,acs合成生物2016;5(7):561
‑
568]的技术通过λ噬菌体蛋白介导的重组整合到大肠杆菌基因组中。从对ss9同源区域特异的引物(5'
‑
cggagcattttgcatg
‑
3'和5'
‑
tgtaggatcaagctcag
‑
3')通过pcr证实全长结构的整合,然后通过sanger方法利用基因组dna的pcr产物测序验证整合结构的正确性。所获得的细菌菌株用于在发酵罐中生产生物合成的牛奶树碱。
[0529]
如实施例12中所述,将细菌在发酵罐中培养,唯一的区别是——未将咖啡酸添加到细菌培养基中。通过hplc从培养基中分离出生物合成的牛奶树碱。所获得的菌株每50小时的发酵能够产生1.20mg/l的牛奶树碱。所得产品纯度为97.3%。向培养基中添加浓度为10μg/ml的酪氨酸可将牛奶树碱的产量增加至108.3mg/ml。
[0530]
实施例15.自主生物发光酵母巴斯德毕赤酵母的开发
[0531]
出于开发自主生物发光酵母巴斯德毕赤酵母的目的,合成了表达盒,该表达盒包括在gap启动子和taox1终止子的控制下的以下酶的编码序列:新诺托帕纳斯南比菌荧光素酶(seq id no:79、80)、新诺托帕纳斯南比菌牛奶树碱羟化酶(seq id nos:1、2)、新诺托帕纳斯南比菌牛奶树碱
‑
合酶(seq id no:34、35)、新诺托帕纳斯南比菌咖啡酰丙酮酸水解酶(seq id nos:64、65)、构巢曲霉npga蛋白(seq id nos:104、105)、荚膜红细菌酪氨酸解氨酶(seq id no:106、107)和大肠杆菌4
‑
乙酸羟苯酯3
‑
单加氧酶还原酶的hpab和hpac组分
(seq id no:108
‑
111)。每个表达盒侧翼为bsmbi限制酶识别序列。还合成获得了侧翼为bsmbi限制性酶切位点的met6巴斯德毕赤酵母基因(uniprot f2qtu9)的同源性区域。合成dna用bsmbi限制性酶处理,并根据如[iverson等人,acs合成生物学2016年1月15日;5(1):99
‑
103]中描述的金门克隆方案(golden gate cloning protocol)组合入一个质粒。将10fmol的每种dna片段混合到在总体积为10μl的反应中,其中包括dna裂解酶的正常强度缓冲液(普洛麦格,美国)、20单位的dna裂解酶活性(普洛麦格,美国)、10单位的dna限制性核酸内切酶活性。将获得的反应混合物放入放大器中,并根据以下方案在16℃和37℃下孵育:在37℃下1.5分钟和16℃
‑
3分钟孵育25个循环,然后在50℃下孵育5分钟一次,然后在80℃下孵育10分钟一次。将5μl反应混合物转化到大肠杆菌化学感受态细胞中。通过sanger法确认质粒dna组装的正确性,并将纯化的质粒dna产物通过电穿孔用于转化巴斯德毕赤酵母gs11细胞。根据描述于[wu和letchworth,生物技术,2004,36:152
‑
4]的方法,使用乙酸锂和二硫苏糖醇进行电穿孔。将电穿孔的细胞分散在含有rdb培养基的培养皿中,该培养基包括含1m的山梨糖醇、2%(w/v)的葡萄糖、1.34%(w/v)的酵母氮源(ynb)、0.005%(w/v)的氨基酸混合物、0.00004%(w/v)的生物素和2%(w/v)的琼脂。通过pcr从同源区退火的引物证实基因盒整合入基因组。与野生酵母菌株相反,得到的包括正确基因组插入物的酵母菌株能够自主发光(图7、8)。
[0532]
实施例16.自主生物发光的开花植物的开发
[0533]
出于开发自主生物发光的开花植物的目的,基于pbi121载体(clontech,美国)创建了用于农杆菌转化的双运载体,其包括为在植物中表达而优化的以下项的编码序列:新诺托帕纳斯南比菌荧光素酶(seq id no:112)、新诺托帕纳斯南比菌牛奶树碱羟化酶(seq id no:103)、新诺托帕纳斯南比菌牛奶树碱
‑
合酶(seq id no:113)、新诺托帕纳斯南比菌咖啡酰丙酮酸水解酶(seq id no:114)以及卡那霉素抗性基因,每个基因均在来自花椰菜花叶病毒的35s启动子的控制下。用于表达盒组装的序列是合成获得的,该载体根据[iverson等人,acs合成生物学2016年1月15日;5(1):99
‑
103]描述的金门克隆方案进行组装。
[0534]
通过将植物组织与根癌农杆菌(agrobacterium tumefaciens)细菌的agl0菌株共同培养来转化拟南芥[lazo等人,生物技术,1991年10月;9(10):963
‑
7],包括创建的双运载体。如[valvekens等人,1988,美国科学院院刊85,5536
‑
5540]中所述,使用拟南芥根段(c24生态型)的共培养进行转化。将拟南芥根在带有20g/l的葡萄糖、0.5g/l的2,4
‑
二氯苯氧基乙酸和0.05g/l的激动素的琼脂糖化的gamborg培养基b
‑
5中培养3天。然后,将根切成0.5cm长的片,并转移到10ml的带有20g/l的葡萄糖、0.5g/l的2,4
‑
二氯苯氧基乙酸和0.05g/l的激动素的液体gamborg培养基b
‑
5中,并且加入1.0ml农杆菌过夜培养基。将具有农杆菌的外植体共培养2
‑
3分钟。然后,将外植体放在含有相同组成的琼脂培养基的培养皿中的无菌过滤器上。在25℃的恒温槽中孵育48小时后,将外植体转移到含有500mg/l头孢噻肟和50mg/l卡那霉素的新鲜培养基中。在三周内,开始在包括50mg/l卡那霉素的选择培养基上再生植物。转基因植物生根并转移到发芽培养基或土壤中。通过ivis光谱体内成像系统(ivis spectrum in vivo imaging system)(珀金埃尔默)看到了生物发光。超过90%的转基因植物的发光至少比野生型植物的信号高两个数量级。
[0535]
通过将植物组织与根癌农杆菌细菌的agl0菌株共培养来转化本氏烟草[lazo等
人,生物技术,1991年10月;9(10):963
‑
7],包括创建的双运载体。使用本氏烟草片段的共培养进行转化。然后,将叶子切成0.5cm长的碎片,并转移到10ml的带有20g/l的葡萄糖、0.5g/l的2,4
‑
二氯苯氧基乙酸和0.05g/l的激动素的液体gamborg培养基b
‑
5中,并且加入1.0ml农杆菌过夜培养基。将具有农杆菌的外植体共培养2
‑
3分钟。然后,将外植体放在含有相同组成的琼脂培养基的培养皿中的无菌过滤器上。在25℃的恒温槽中孵育48小时后,将外植体转移到含有500mg/l头孢噻肟和50mg/l卡那霉素的新鲜培养基中。在三周内,开始在包括50mg/l卡那霉素的选择培养基上再生植物。转基因植物生根并转移到发芽培养基或土壤中。通过ivis光谱体内成像系统(珀金埃尔默)看到了生物发光。超过90%的转基因植物的发光至少比野生型植物的信号高两个数量级。图9给出了自主发光的本氏烟草的照片。
[0536]
出于开发自主发光的匍匐翦股颖(agrostis stolonifera l.)的目的,将为在植物中表达而优化的且侧翼为bsai限制性内切核酸酶位点的以下项的真菌荧光素代谢级联基因的编码序列克隆到pbi121载体(clontech,usa):新诺托帕纳斯南比菌荧光素酶(seq id no:126)、新诺托帕纳斯南比菌牛奶树碱羟化酶(seq id no:117)、新诺托帕纳斯南比菌牛奶树碱合酶(seq id no:127)、新诺托帕纳斯南比菌咖啡酰丙酮酸水解酶(seq id no:128)和除草剂草甘膦抗性基因(bar基因)。每个序列都在cmylcv启动子的控制下[stavolone等人,植物分子生物学2003年11月;53(5):663
‑
73]。根据标准技术合成序列。根据金门克隆方案组装载体。通过胚性愈伤组织农杆菌转化的方法进行转化。根癌农杆菌细菌agl0菌株的过夜培养物[lazo等人,生物技术,1991年10月;9(10):963
‑
7],包括创建的双运载体,加入到液体培养基中。在琼脂化的murashige和skoog培养基中共培养两天后,将植物转移到含有500mg/l头孢噻肟和10mg/l草丁膦的新鲜培养基中。植物再生在三周内开始。将转基因植物重新种植到含一半murashige和skoog盐含量以及8mg/l草丁膦的培养基中进行生根。生根的植物放置于温室中。约有25%的正确地和完全地整合进代谢级联基因组中的所得植物的生物发光超过了对照野生型植物的生物发光。
[0537]
能够在某些组织中或一天中的某些时间发光的生物体特别令人关注。这样的生物体更有效地消耗发光所需的资源。为了开发仅在花瓣中发射光的自主生物发光玫瑰,选择了几种具有白色花瓣的玫瑰品种。在pbi121载体(clontech,美国)的基础上,创建了两个用于农杆菌转化的双运载体,其包括来自新诺托帕纳斯南比菌荧光素酶、新诺托帕纳斯南比菌牛奶树碱羟化酶、新诺托帕纳斯南比菌牛奶树碱合酶、新诺托帕纳斯南比菌咖啡酰丙酮酸水解酶的编码序列的代谢级联和新霉素抗性基因,它们为在植物中表达而进行了优化。除荧光素酶基因外,所有基因都置于花椰菜花叶病毒35s启动子的控制下。在其中一个载体中,荧光素酶基因置于玫瑰查尔酮合酶启动子的控制下,在另一个载体中——处于菊花查尔酮uep1启动子的控制下。使用了组装载体所需的合成核酸,侧翼为bsai限制酶识别位点,并根据金门克隆方案组装载体。丰花月季t(rosa hybrida l.cv.tinike)转基因植物通过将胚性愈伤组织与根癌农杆菌细菌agl0菌株共同培养而获得[lazo等人,生物技术,1991年10月;9(10):963
‑
7],其包括上述双运载体中的一个。在包括murashige和skoog大盐和微盐,并在其中添加1
‑
2mg/l的激动素、3mg/l的2,4
‑
二氯苯氧基乙酸和1mg/l的6
‑
苄基氨基嘌呤的液体培养基中进行40分钟培养。将愈合组织转移至相同组成的琼脂培养基中。在两天内,将外植体转移到含有500mg/l头孢噻肟和50mg/l卡那霉素的新鲜murashige和skoog培养基中。在5
‑
8周内芽形成和再生。将芽转移到繁殖或生根培养基中。将有根的芽放在温室
的泥炭混合物中。在8周内观察到开花。在ivis光谱体内成像系统(珀金埃尔默)中观察具有成熟花的植物。每个具有测试结构的所有测试植物均自主发光,其发射的光比野生型植物的信号至少高三个数量级。仅从花瓣组织发光,证实了启动子的组织特异性功能。
[0538]
为了开发生物发光受昼夜节律控制并在夜间激活的自主生物发光的植物,先使用了用于农杆菌转化的双运载体,其包含以下项的编码序列:新诺托帕纳斯南比菌荧光素酶、新诺托帕纳斯南比菌牛奶树碱羟化酶、新诺托帕纳斯南比菌牛奶树碱合酶、新诺托帕纳斯南比菌咖啡酰丙酮酸水解酶以及新霉素抗性基因,每个基因在花椰菜花叶病毒35s启动子的控制下。新诺托帕纳斯南比菌荧光素酶表达的启动子被拟南芥cat3基因的启动子代替。cat3基因启动子的转录受昼夜节律控制,并在夜间激活。cat3启动子序列在本领域是已知的[michael和mcclung,植物生理学杂志2002年10月;130(2):627
‑
38]。通过将植物组织与包括创建的双运载体的根癌农杆菌细菌的agl0菌株共同培养来转化拟南芥[lazo等人,生物技术,1991年10月;9(10):963
‑
7]。如[valvekens等人,1988,美国科学院院刊85,5536
‑
5540]中所述,使用拟南芥根段(c24生态型)的共培养进行转化。将拟南芥根在带有20g/l的葡萄糖、0.5g/l的2,4
‑
二氯苯氧基乙酸和0.05g/l的激动素的琼脂糖化gamborg培养基b
‑
5中培养3天。然后,将根切成0.5cm长的片,并转移到10ml的带有20g/l的葡萄糖、0.5g/l的2,4
‑
二氯苯氧基乙酸和0.05g/l的激动素的液体gamborg培养基b
‑
5中,并且加入1.0ml农杆菌过夜培养基。在2
‑
3分钟内将具有农杆菌的外植体共培养。然后,将外植体放在含有相同组成的琼脂培养基的培养皿中的无菌过滤器上。在25℃的恒温槽中孵育48小时后,将外植体转移到含有500mg/l头孢噻肟和50mg/l卡那霉素的新鲜培养基中。在三周内,开始在包括50mg/l卡那霉素的选择培养基上再生植物。转基因植物生根并转移到发芽培养基中,在自然的昼夜循环条件下生长。通过ivis光谱体内成像系统(珀金埃尔默)看到了生物发光,将植物放在设备中24小时并每半小时记录生物发光强度。植物在24小时内发光,但是生物发光强度受到昼夜节律的显著调节:对于85%的测试植物,夜间的整体发光强度比白天的整体发光度高1000倍以上。
[0539]
实施例17.转基因自主生物发光的低等植物的开发
[0540]
使用实施例8中所述的方法,通过原生质体与质粒共转化,开发了自主生物发光的苔藓小立碗藓。合成获得表达盒,其包括为在植物中表达而优化的以下项的编码序列:新诺托帕纳斯南比菌荧光素酶(seq id no:112)、新诺托帕纳斯南比菌牛奶树碱羟化酶(seq id no:103)、新诺托帕纳斯南比菌牛奶树碱
‑
合酶(seq id no:113)、新诺托帕纳斯南比菌咖啡酰丙酮酸水解酶(seq id no:114)和卡那霉素抗性基因,每一个均在水稻肌动蛋白2启动子的控制下。表达盒在pbi121载体(clontech,美国)中以这种方式可操作地交联,即使得包括完整的代谢级联和卡那霉素抗性基因的结构侧翼为与苔藓基因组靶基因座序列一致的序列。载体根据金门克隆方案组装[iverson等人,acs合成生物学2016年1月15日;5(1):99
‑
103]。与苔藓基因组中的靶区域互补的向导rna基因也被克隆到载体中。根据如[cove等人,冷泉港实验室方案,2009,2]中所述的聚乙烯乙二醇转化方案将具有特定基因的质粒与用于组成型表达cas9核酸酶的质粒共转化。将所得的转化的原生质体在黑暗条件下在bg
‑
11培养基中孵育24小时,然后将其转移到含有bg
‑
11培养基和8.5%琼脂的培养皿中。在连续光照下在培养皿中生长一个月后,在ivis光谱体内成像系统(珀金埃尔默)中观察。70%的测试植物的发光比野生型植物发出的信号至少高一个数量级。
[0541]
实施例18.转基因发光动物的开发
[0542]
根据[hisano等人,科学报道,2015,5:8841]中所述的技术,创造了包括新诺托帕纳斯南比菌牛奶树碱羟化酶基因的转基因鱼斑马鱼(danio rerio)。该技术包括表达向导rna和cas9核酸酶,以在与向导rna序列同源的区域中产生一个断点。为了开发转基因动物,订购了在噬菌体聚合酶t7启动子控制下的包括来自px330的向导rna序列、addgene#42230和cas9核酸酶的mrna的合成dna片段。所获得的片段通过来自maxiscript t7试剂盒(生命技术(life technologies),美国)的试剂用于体外转录,并通过dna分离试剂盒(evrogen,俄罗斯)纯化合成的rna。
[0543]
通过合成获得了[hisano等人,科学报道,2015,5:8841]中描述的侧翼为krtt1c19e斑马鱼基因的50个核苷酸序列的新诺托帕纳斯南比菌牛奶树碱羟化酶的编码序列,并将其克隆到包括puc来源和卡那霉素抗性盒的pegfp/c1的质粒碱基中。将获得的载体、cas9核酸酶mrna和向导rna溶解在注射缓冲液(40mm hepes(ph 7.4),加入0.5%酚红的240mm kcl)中,并注射到较早获得的稳定表达新诺托帕纳斯南比菌荧光素酶的斑马鱼的1
‑
2个细胞胚胎中,体积约为1
‑
2nl。从48个胚胎中大约有12个在注射后存活,并在受精后的第四天表现出正常发育。
[0544]
根据[cosentino等人,j vis exp.2010;(42):2079]中描述的技术,将牛奶树碱溶液静脉内注射到斑马鱼幼虫中以记录生物发光信号。通过ivis光谱体内成像系统(珀金埃尔默)记录生物发光。记录后,从幼虫中分离基因组dna以确认牛奶树碱羟化酶整合到基因组中。正确地整合新诺托帕纳斯南比菌牛奶树碱羟化酶基因到基因组的所有幼虫证实其生物发光强度比从注射牛奶树碱溶液后的野生型鱼发出的信号高至少两个数量级。
[0545]
实施例19.咖啡酰丙酮酸水解酶对自主生物发光生物体发光的影响的研究
[0546]
为了研究咖啡酰丙酮酸水解酶对自主生物发光生物发光的作用,使用了用于根据实施例16获得的农杆菌转化的双运载体,其包括以下项的编码序列:新诺托帕纳斯南比菌荧光素酶,新诺托帕纳斯南比菌牛奶树碱羟化酶,新诺托帕纳斯南比菌牛奶树碱合酶,新诺托帕纳斯南比菌咖啡酰丙酮酸水解酶以及卡那霉素抗性基因,并且每个基因都处于来自花椰菜花叶病毒35s启动子的控制下,控制载体的特征在于咖啡酰丙酮酸水解酶序列从其中去除。根据实施例16中所述的方案,将载体用于在相同条件下转化拟南芥。通过ivis光谱体内成像系统(珀金埃尔默)观察生物发光。表达新诺托帕纳斯南比菌生物发光系统的所有四个基因的植物与仅表达荧光素酶、牛奶树碱羟化酶和牛奶树碱合酶的植物的生物发光强度的比较表明:额外表达咖啡酰丙酮酸水解酶的植物具有平均高8.3倍的生物发光强度。提供的数据表明咖啡酰丙酮酸水解酶的表达能够提高生物发光级联效率,从而导致植物发光的强度增加。
[0547]
实施例20.外部添加咖啡酸对转基因生物体生物发光的影响
[0548]
将根据实施例16获得的自主生物发光的转基因植物本氏烟草转移到土壤中并培养八周。然后,切下植物茎并将其放置在水中两个小时,之后,通过ivis光谱体内成像系统(珀金埃尔默)测量生物发光强度。然后,将植物转移到咖啡酸浓度为0.4g/l、0.8g/l、1.6g/l、3.2g/l或6.4g/l五种水溶液之一中,并将对照植物置于水中。在咖啡酸溶液或水中孵育两个小时后,再次测量生物发光强度。在所有情况下,与置于咖啡酸溶液前的强度相比,在咖啡酸溶液中孵育的植物的生物发光强度均增加,并且在浓度为6.4g/l的溶液中孵育的植
物中观察到最大变化。在孵育开始后的四个小时内,在水中孵育的对照植物没有显示出生物发光强度的显著变化。
[0549]
实施例21.真菌生物发光系统基因用于启动子活性分析和外部信号的细胞内逻辑整合的用途。
[0550]
新诺托帕纳斯南比菌牛奶树碱羟化酶、牛奶树碱合酶和荧光素酶的编码序列用于监测几个启动子的同时激活。合成表达盒,其包含由阿拉伯糖诱导的在大肠杆菌arabad启动子控制下的新诺托帕纳斯南比菌牛奶树碱
‑
合酶的编码序列(seq id no:34、35)、在由iptg诱导的t7/laco启动子的控制下的牛奶树碱羟化酶的编码序列(seq id no 1、2)和由鼠李糖诱导的prha启动子控制下的荧光素酶基因(seq id no:79、80)以及在组成型j23100启动子控制的npga基因(seq id no:104、105)(标准生物组件登记册,part:bba_j23100)。将获得的合成核酸使用bpii限制性核酸内切酶克隆到moclo_level2载体中[weber等人,plos one 2011年2月18;6(2):e16765]代替包括lacz基因的插入片段。将获得的载体转化到包括t7噬菌体聚合酶的基因组拷贝的大肠杆菌bl21(neb,美国)菌株感受态细胞中。
[0551]
为了确定记录几个启动子同时激活的可能性,将在前面的步骤中获得的细胞在装有100ml lb培养基的烧瓶中过夜培养,并添加100mg/l的氨苄西林。第二天,将细胞培养液等分试样在24℃下200rpm放置120分钟,并在以下一种培养基中于200rpm下进行振荡:
[0552]
1.加入1%阿拉伯糖的lb培养基,
[0553]
2.加入0.2%鼠李糖的lb培养基,
[0554]
3.加入0.5%iptg的lb培养基,
[0555]
4.加入1%阿拉伯糖和0.2%鼠李糖的lb培养基,
[0556]
5.加入1%阿拉伯糖和0.5%iptg的lb培养基,
[0557]
6.加入0.2%鼠李糖和0.5%iptg的lb培养基,
[0558]
7.加入1%阿拉伯糖、0.2%鼠李糖和0.5%iptg的lb培养基,
[0559]
8.lb培养基(对照)。
[0560]
培养后,沉淀细胞,将培养基用ph 7.4的磷酸盐缓冲盐水(西格玛奥德里奇,美国)替换,并添加浓度为1g/l的咖啡酸(西格玛奥德里奇,美国),通过移液将细胞重悬。在半小时内通过光度计glomax 20/20(普洛麦格,美国)分析细胞的生物发光。一式三份地重复该实验。在八个测试样本中,仅在7号培养基(添加1%阿拉伯糖、0.2%鼠李糖和0.5%iptg)孵育的细菌的生物发光强度与在lb培养基(8号培养基)中孵育的细菌的生物发光强度显著不同。因此,细菌发光表明将细菌放入培养基中确保同时激活三种不同的启动子。在该实验中,细菌细胞整合了有关物质存在的信息,从而诱导了启动子活性。在外部培养基中,仅当所有三种物质同时存在于培养基中时才发光发出信号,在细胞内执行逻辑“与(and)”操作。
[0561]
合成表达盒,其包括(1)根据[pletz等人,生物化学与生物物理学2013年6月;1833(6):1338
‑
46]在odf2启动子的控制下的牛奶树碱羟化酶的编码序列(seq id no:1、2);(2)在细胞周期蛋白(cycline)依赖性激酶cdk7启动子的控制下的牛奶树碱
‑
合酶的编码序列(seq id no:34、35);(3)在ccnh基因启动子控制下的荧光素酶(seq id no:79、80),被克隆到pmkate2
‑
角蛋白载体(evrogen,俄罗斯)中,替代巨细胞病毒启动子abd mkate2
‑
角蛋白插入片段的序列。同样,将npga基因的编码序列(seq id no:104、105)克隆到pmkate2
‑
角蛋白载体中,替代mkate2
‑
角蛋白插入序列。根据生产商的方案,通过转染剂fugene hd(普洛
麦格,美国)将所有获得的载体共转染到hek293t细胞。转染后24小时,将浓度为5mg/ml的咖啡酸加入培养基中,并通过leica tcs sp8显微镜检测细胞发光。发光能够鉴定odf2、ccnh和cdk7启动子的同时激活,其发光强度与细胞周期阶段有关。
[0562]
所获得的数据表明真菌生物发光系统基因可用于监测几种启动子的同时激活,用于检测培养基中不同物质及其组合的存在,以及还可用于外部信号的细胞内逻辑整合。
[0563]
实施例22.植物提取物中牛奶树碱的鉴定
[0564]
将根据实施例1获得的新诺托帕纳斯南比菌牛奶树碱羟化酶和荧光素酶的编码序列在t7启动子控制下克隆到pet23载体中。通过purexpress体外蛋白质合成试剂盒(neb,美国),将纯化的质粒dna产物用于体外蛋白质转录和翻译。通过将2μl裂解物添加到100μl的反应混合物中并用光度计glomax(普洛麦格,美国)记录发光强度,将所获得的反应混合物用于分析牛奶树碱及其功能类似物在约19种不同植物(菊属、凤梨、矮牵牛、欧洲云杉、大荨麻、番茄、本氏烟草、烟草、拟南芥、粉绿叶蔷薇、锈红蔷薇、问荆、木贼、远志、玫瑰、铁线莲、伽蓝菜属、小麦、康乃馨(chrysanthemum sp.,ananas comosus,petunia atkinsiana,picea abies,urtica dioica,solanum lycopersicum,nicotiana benthamiana,nicotiana tobacum,arabidopsis thaliana,rosa glauca,rosa rubiginosa,equisetum arvense,equisetum telmateia,polygala sabulosa,rosa rugosa,clematis tashiroi,kalanchoe sp.,triticum aestivum,dianthus caryophyllus))的裂解物中的存在和浓度。确定了牛奶树碱及其功能类似物的最大浓度是在问荆和木贼的裂解物中。牛奶树碱或其功能类似物也已在远志,玫瑰和铁线莲的裂解物中鉴定出。
[0565]
实施例23.能够催化牛奶树碱合成的pks的鉴定及其在体外和体内产生牛奶树碱的应用。
[0566]
真菌荧光素前体,例如牛奶树碱,与一组聚酮化合物衍生物相关。在本领域中已知植物中参与聚酮化合物合成的酶与聚酮化合物合酶蛋白超家族相关。与真菌聚酮化合物合酶相比,植物聚酮化合物合酶是使用包括3
‑
芳基丙烯酸的酸的辅酶a醚的相对致密的蛋白质。在本领域中已知还没有能够催化咖啡酸辅酶a醚转化为牛奶树碱的聚酮化合物合酶,但是,牛奶树碱存在于许多植物生物体中。
[0567]
使用生物信息学分析,从以下来源中选择了11种可能能够催化牛奶树碱合成的聚酮化合物合酶:
[0568]
土沉香(aquilaria sinensis 2种酶),
[0569]
八仙花(hydrangea macrophylla),
[0570]
拟南芥
[0571]
小立碗藓,
[0572]
虎杖(polygonum cuspidatum)
[0573]
掌叶大黄(rheum palmatum)
[0574]
圆叶大黄(rheum tataricum)
[0575]
折扇草t(wachendorfia thyrsiflora),
[0576]
卡瓦胡椒(piper methysticum,2种酶)。
[0577]
优化了用于在巴斯德毕赤酵母酵母细胞和本氏烟草植物细胞中表达的所选核苷酸序列。通过合成获得核酸并将其克隆到pgapz载体中,并用于验证表达的蛋白质合成牛奶
树碱的能力。
[0578]
出于此目的,在组成型表达根据实施例1获得的新诺托帕纳斯南比菌荧光素酶和牛奶树碱羟化酶的巴斯德毕赤酵母gs115酵母系基因组中,还引入了pgapz质粒,其包含拟南芥香豆酸辅酶a连接酶1的基因(其核苷酸和氨基酸序列如seq id no:140、141所示),且通过寡核苷酸合成获得。该质粒在限制性位点avrii处线性化,并用于转化到巴斯德毕赤酵母gs115细胞中。
[0579]
将获得的组成型表达新诺托帕纳斯南比菌荧光素酶和牛奶树碱羟化酶和拟南芥香豆酸辅酶a连接酶1的酵母细胞通过包含编码pks序列的质粒线性化、并分散在包括1m的山梨糖醇、2%(重量/体积)的葡萄糖、1.34%(重量/体积)的酵母氮源(ynb)、0.005%(重量/体积)的氨基酸混合物、0.00004%(重量/体积)的生物素和2%(重量/体积)的琼脂的rdb培养基的培养皿中。为了鉴定具有牛奶树碱
‑
合酶活性的酶,用咖啡酸溶液喷洒获得的菌落,通过出现发光检测细胞中牛奶树碱
‑
合酶的存在。通过ivis光谱ct(珀金埃尔默,美国)检测菌落的发光。组成型表达荧光素酶、牛奶树碱羟化酶和香豆酸辅酶a连接酶1的酵母系以及野生酵母细胞用作阴性对照。在测试的基因中,有11种酶具有牛奶树碱
‑
合酶活性,他们的序列如seq id no:118、120、122、124、126、128、130、132、134、136、138中所示。由他们编码的氨基酸序列分别在seq id no:119、121、123、125、127、129、131、133、135、137、139中显示。来自土沉香的pks1和pks2(seq id no:119、121)、来自拟南芥的pks(seq id no:123)和来自八仙花的pks(seq id no:125)的酶具有最高的活性。
[0580]
根据实施例4中所述的技术,使用来自八仙花的pks的编码核酸(seq id no:124、125)来生产重组蛋白。由于可获得预期长度的条带,通过电泳确认了预期的重组产物的存在。将分离的重组蛋白的等分试样用于验证以下功能:将30μl的分离的重牛奶树碱溶液放入玻璃管中,玻璃管包括100μl缓冲液(0.2m磷酸钠缓冲液,0.5m na2so4、0.1%十二烷基麦芽糖苷(ddm)ph 8.0,全部成分
–
西格玛奥德里奇(sigma
‑
aldrich),美国)、根据实施例4获得的0.5μl纯化的重组新诺托帕纳斯南比菌荧光素酶、1mm nadph(西格玛奥德里奇,美国)、15μl根据实施例4获得的纯化的重组新诺托帕纳斯南比菌牛奶树碱羟化酶、10mm atp(赛默飞世尔科技,美国)、1mm辅酶a(西格玛奥德里奇,美国)、1mm丙二酰辅酶a(西格玛奥德里奇,美国)。将玻璃管放入光度计glomax 20/20(普洛麦格,美国)中。在向溶液中添加20μm咖啡酰辅酶a时,反应混合物显示出生物发光。所发射的发光的最大发射为520
‑
535nm。
[0581]
来自土沉香的pks2的编码核酸(seq id no:120、121)被用于产生牛奶树碱生产菌株。出于此目的,合成了包含在组成型j23100启动子的控制下的核酸seq id no:120的表达盒,和包含在arabad启动子的控制下编码拟南芥的4
‑
香豆酸辅酶a连接酶1的核酸seq id no:140的表达盒;两个表达盒均以与ss9位点的同源性区域为侧翼。将表达盒克隆到包含博来霉素抗性盒的细菌表达载体中,然后如bassalo等人[acs合成生物学2016年7月15日;5(7):561
‑
8]中所述,通过λ噬菌体蛋白介导的重组使用博来霉素抗性的选择转化和整合到大肠杆菌bw25113基因组中。通过pcr从与ss9同源区域特异的引物确认了全长结构的整合,然后通过sanger法对基因组dna pcr产物的测序验证了整合结构的正确性。
[0582]
将获得的大肠杆菌菌株用于生产牛奶树碱。第一步,在37℃,200rpm振荡下,在五个50ml塑料管中在lb培养基内孵育细菌10小时。将250ml所得的培养物添加至3.3升发酵培养基中,到发酵罐biostat b5(博朗(braun),德国)中,以使初始培养物的光密度在600nm为
约0.35。发酵培养基包括10g/l的蛋白胨,5g/l的咖啡酸,5g/l的酵母提取物,10g/l的nacl,25g/l的葡萄糖,15g/l的(nh4)2so4、2g/l的kh2po4、2g/l的mgso4·
7h2o、14.7mg/l的cacl2、0.1mg/l的硫胺素、1.8mg/l和0.1%的由edta 8mg/l、cocl2·
6h2o 2.5mg/l、mncl2·
4h2o 15mg/l、cucl2·
2h2o 1.5mg/l、h3bo
3 3mg/l、na2moo4·
2h2o 2.5mg/l、zn(ch3coo)2·
2h2o 13mg/l、柠檬酸铁(iii)100mg/l、盐酸硫胺素4.5mg/l构成的溶液。在37℃,3l/min的通气量和200rpm混合的条件下进行发酵。培养25小时后,将阿拉伯糖添加至培养物中,直至终浓度为0.1mm。通过添加nh4oh自动控制ph,将ph降至7.0。当每次ph升高至7.1时,将包括500g/l的葡萄糖,5g/l的咖啡酸,2g/l的阿拉伯糖,25g/l的胰蛋白胨,50g/l的酵母提取物,17.2g/l的mgso4·
7h2o,7.5/l的(nh4)so4、18g/l的抗坏血酸的溶液添加到发酵罐中以维持葡萄糖水平。培养56小时后,培养基中牛奶树碱的浓度为3.48g/l。发酵罐培养基以及通过hplc从其中纯化的牛奶树碱在与根据实施例4获得的新诺托帕纳斯南比菌牛奶树碱羟化酶和荧光素酶的生物发光反应中具有活性。
[0583]
为了开发自主生物发光酵母巴斯德毕赤酵母,使用了表达盒,其包括在gap启动子和taox1终止子的控制下,新诺托帕纳斯南比菌荧光素酶(seq id no:79、80)、新诺托帕纳斯南比菌牛奶树碱羟化酶(seq id nos:1、2)、新诺托帕纳斯南比菌牛奶树碱
‑
合酶(seq id nos:34、35)、新诺托帕纳斯南比菌咖啡酰丙酮酸水解酶(seq id nos:64、65)、荚膜红细菌酪氨酸解氨酶(seq id nos:106、107),以及根据实施例15获得的大肠杆菌4
‑
乙酸羟苯酯3
‑
单加氧酶
‑
还原酶(seq id no:108
‑
111)的组分hpab和hpac的编码序列,还合成了类似的表达盒,其包括编码来自拟南芥的4
‑
香豆酸辅酶a连接酶1(seq id no:140、141)和三种pks:来自沉香的(seq id nos:120、121),来自拟南芥的pks(seq id nos:122、123)和八仙花的pks(seq id no:124、125)的编码序列。每个表达盒都以bsmbi限制酶识别序列为侧翼。还合成获得了侧翼为bsmbi限制性酶切位点的met6巴斯德毕赤酵母基因(uniprot f2qtu9)的同源性区域。合成的dna用bsmbi限制性酶处理,并根据[iverson等,acs合成生物学2016年1月15日;5(1):99
‑
103]中描述的金门克隆方案组合成一个质粒。产生了三种pks组成不同的质粒。根据实施例15中所述的技术,将获得的质粒用于生产转基因酵母巴斯德毕赤酵母。通过pcr从同源区退火的引物证实基因盒整合到基因组中。与野生酵母菌株相比,所有三个包含正确基因组插入片段的所得酵母菌株都能够自主发光。
[0584]
为了开发自主生物发光的开花植物,基于pbi121载体(clontech,美国)创建了一组用于农杆菌转化的双运载体,其包含为在植物中表达而优化的新诺托帕纳斯南比菌荧光素酶(seq id no:112)、新诺托帕纳斯南比菌牛奶树碱羟化酶(seq id no:103)、新诺托帕纳斯南比菌咖啡酰丙酮酸水解酶(seq id no:114),卡那霉素抗性基因和pks的编码序列(seq id nos:122、123),每个基因均在花椰菜花叶病毒35s启动子的控制下。表达盒组装的序列是合成获得的,载体根据[iverson等人,acs合成生物学2016年1月15日;5(1):99
‑
103]中描述的金门克隆方案进行组装。通过将植物组织与包括创建的双运载体的根癌农杆菌细菌agl0菌株的共同培养来转化烟草[lazo等人,生物技术,1991年10月;9(10):963
‑
7]。使用烟草的叶段的共培养进行转化。然后,将叶子切成0.5厘米长的片,并转移到10ml的带有20g/l的葡萄糖、0.5g/l的2,4
‑
二氯苯氧基乙酸和0.05g/l的激动素的液体gamborg培养基b
‑
5中,并且加入1.0ml农杆菌过夜培养基。将具有农杆菌的外植体共培养2
‑
3分钟。然后,将外植体放在含有相同组成的琼脂培养基的培养皿中的无菌过滤器上。在25℃的恒温槽中孵
育48小时后,将外植体转移到含有500mg/l头孢噻肟和50mg/l卡那霉素的新鲜培养基中。在三周内,开始在包括50mg/l卡那霉素的选择培养基上再生植物。转基因植物生根并转移到发芽培养基或土壤中。通过ivis光谱体内成像系统(珀金埃尔默)观察生物发光。转基因植物的发光比野生型植物发出的信号高至少三个数量级。
[0585]
实施例24.核酸组合
[0586]
组合1:
[0587]
组成:(a)编码牛奶树碱羟化酶的核酸,其氨基酸序列选自seq id no:2、4、6、8、10、12、14、16、18、20、22、24、26,28;和(b)编码荧光素酶的核酸,其氨基酸序列选自:80、82、84、86、88、90、92、94、96、98。
[0588]
该组合可用于在物质存在下在体外或体内表达系统中获得生物发光,该物质选自具有结构式
[0589]
的6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮类,
[0590]
其中6位取代基是2
‑
芳基乙烯基或2
‑
杂芳基乙烯基取代基(r
‑
ch=ch
‑
),包括2
‑
(3,4
‑
二羟基苯乙烯基)、2
‑
(4
‑
羟基苯乙烯基)、2
‑
(4
‑
(二乙基氨基)苯乙烯基)、2
‑
(2
‑
(2
‑
(1h
‑
吲哚
‑3‑
基)乙烯基)、2
‑
(2
‑
(1,2,3,5,6,7
‑
六氢吡啶并[3,2,1
‑
ij]喹啉
‑9‑
基)乙烯基)、2
‑
(6
‑
羟基萘
‑2‑
基)乙烯基。
[0591]
所述组合还可以用于研究异源表达系统中的两个启动子依赖性。
[0592]
所述组合还可以用于鉴定生物对象中的牛奶树碱及其类似物。
[0593]
所述组合还可以用于通过在牛奶树碱及其功能类似物的存在下发生的生物发光进行细胞标记。
[0594]
组合2:
[0595]
组成:(a)编码牛奶树碱羟化酶的核酸,其氨基酸序列选自seq id no:2、4、6、8、10、12、14、16、18、20、22、24、26、28;和(b)编码牛奶树碱
‑
合酶的核酸,其氨基酸序列选自seq id no:35、37、39、41、43、45、47、49、51、53、55。
[0596]
该组合可用于在体外或体内表达系统中从选自具有结构式
[0597]
的取代丙烯酸的物质产生真菌荧光素,其中r是芳基或杂芳基(例如来自咖啡酸)。
[0598]
组合3:
[0599]
包括组合2中指定的所有组分,还包括编码荧光素酶的核酸,其氨基酸序列选自:80、82、84、86、88、90、92、94、96、98。
[0600]
该组合可用于在物质的存在下在体外或体内表达系统中获得生物发光,该物质选自具有结构式
[0601]
的取代丙烯酸,其中r是芳基或杂芳基。
[0602]
该组合可用于产生生物发光细胞和转基因生物体。所述组合还可用于研究异源表
达系统中的三个启动子依赖性。
[0603]
组合4:
[0604]
包括组合3中指定的所有组分,还包括编码咖啡酰丙酮酸水解酶的核酸,其氨基酸序列选自seq id no:65、67、69、71、73、75。
[0605]
该组合可用于产生生物发光细胞和转基因生物体。
[0606]
组合5:
[0607]
组成:(a)编码牛奶树碱
‑
合酶的核酸,其氨基酸序列选自seq id no:35、37、39、41、43、45、47、49、51、53、55;和(b)4
’‑
磷酸泛酰巯基乙胺基转移酶的核酸编码基因,其氨基酸序列如seq id no:105所示
[0608]
该组合可用于在体外和体内表达系统中由咖啡酸生产牛奶树碱。
[0609]
组合6:
[0610]
组成:(a)编码牛奶树碱
‑
合酶的核酸,其氨基酸序列选自seq id no:35、37、39、41、43、45、47、49、51、53、55;(b)4
’‑
磷酸泛酰巯基乙胺基转移酶的核酸编码基因,其氨基酸序列如seq id no:105所示;和(c)编码由细胞代谢产物生物合成具有结构式
[0611]
的3
‑
芳基丙烯酸的酶的核酸,其中r是芳基或杂芳基(例如,4
‑
乙酸羟苯酯3
‑
单加氧酶
‑
还原酶的组分hpab和hpac以及酪氨酸解氨酶的编码核酸)。
[0612]
该组合可用于在体外和体内表达系统中从酪氨酸生产牛奶树碱。
[0613]
组合2
‑
4还可以包括4
’‑
磷酸泛酰巯基乙胺基转移酶npga基因的编码序列(seq id no:104、105)或表现出相同活性的其他酶。
[0614]
组合7:
[0615]
组成:(a)编码牛奶树碱羟化酶的核酸,其氨基酸序列选自seq id nos:2、4、6、8、10、12、14、16、18、20、22、24、26、28;和(b)编码pks的核酸,其氨基酸序列选自seq id no:119、121、123、125、127、129、131、133、135、137、139。
[0616]
该组合可用于在体外或体内表达系统中从咖啡酰辅酶a产生3
‑
羟基牛奶树碱。
[0617]
组合8:
[0618]
包括组合7中指定的所有组分,以及编码荧光素酶的核酸,其氨基酸序列选自:80、82、84、86、88、90、92、94、96、98。在咖啡酰辅酶a的存在下,该组合可用于获得体外或体内的生物发光。
[0619]
组合9:
[0620]
包括组合8中指定的所有组分,还包括编码咖啡酰丙酮酸水解酶的核酸,其氨基酸序列选自seq id nos:65、67、69、71、73、75。
[0621]
该组合可以用于产生生物发光细胞和转基因生物体。
[0622]
组合10:
[0623]
组成:(a)编码pks的核酸,其氨基酸序列选自seq id no:119、121、123、125、127、129、131、133、135、137、139;和(b)编码来自拟南芥的4
‑
香豆酸辅酶a连接酶1的核酸,其氨基酸序列如seq id no:141所示。
[0624]
该组合可用于在体外和体内表达系统中从咖啡酸生产牛奶树碱。
[0625]
组合11:
[0626]
包括组合10中指定的所有组分,还包括编码咖啡酸生物合成的酶的核酸(例如,4
‑
乙酸羟苯酯3
‑
单加氧酶
‑
还原酶的组分hpab和hpac以及酪氨酸解氨酶的编码核酸)。
[0627]
该组合可用于在体外和体内表达系统中从酪氨酸生产牛奶树碱。
[0628]
实施例25.重组蛋白的组合
[0629]
组合1:
[0630]
组成:(a)牛奶树碱羟化酶,其氨基酸序列选自seq id no:2、4、6、8、10、12、14、16、18、20、22、24、26、28;和(b)牛奶树碱
‑
合酶,其氨基酸序列选自seq id no:35、37、39、41、43、45、47、49、51、53、55。
[0631]
该组合可用于从选自具有结构式
[0632]
的3
‑
芳基丙烯酸的物质中产生真菌荧光素,其中r是芳基或杂芳基(例如从咖啡酸)。
[0633]
组合2:
[0634]
包括组合1中指定的所有组分,还包括荧光素酶,其氨基酸序列选自:80、82、84、86、88、90、92、94、96、98。
[0635]
该组合可用于检测样本中3
‑
芳基丙烯酸,其具有结构式
[0636]
的存在,其中r是芳基或杂芳基(例如从咖啡酸)。
[0637]
组合3:
[0638]
组成:(a)牛奶树碱羟化酶,其氨基酸序列选自seq id nos:2、4、6、8、10、12、14、16、18、20、22、24、26、28;和(b)pks,其氨基酸序列选自seq id no:119、121、123、125、127、129、131、133、135、137、139;(c)来自拟南芥的4
‑
香豆酸辅酶a连接酶1,其氨基酸序列如seq id no:141所示。该组合可用于由咖啡酸生产真菌荧光素。
[0639]
实施例25.试剂盒
[0640]
在下面的实施例中,核酸可以包括在表达盒或载体中,并且可操作地交联到调节元件以使其在宿主细胞中表达。或者,核酸可包括侧翼序列以用于其掺入靶载体中。核酸可包含在无启动子的载体中,旨在容易克隆靶标调控元件。
[0641]
试剂盒#1包括本发明的牛奶树碱
‑
合酶的纯化产物,并且可以用于由咖啡酸产生牛奶树碱。该试剂盒还可用于由相应的3
‑
芳基丙烯酸,其具有结构式
[0642]
其中r是芳基或杂芳基制备其他6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮,具有结构式
[0643]
[0644]
试剂盒还可以包括反应缓冲液。例如,0.2m磷酸钠缓冲液(ph 8.0)与0.5m na2so4、0.1%十二烷基麦芽糖苷(ddm)、1mm nadph、10mm atp、1mm辅酶a、1mm丙二酰辅酶a,或用于反应缓冲液制备的组分混合。
[0645]
试剂盒还可以包括去离子水。
[0646]
试剂盒还可以包括使用说明。
[0647]
试剂盒#2包括本发明的牛奶树碱
‑
合酶的纯化产物和本发明的牛奶树碱羟化酶的纯化产物,可用于由选自具有结构式
[0648]
的3
‑
芳基丙烯酸的物质生产真菌荧光素,其中r是芳基或杂芳基(例如由咖啡酸)。
[0649]
试剂盒也可以包括反应缓冲液:0.2m磷酸钠缓冲液(ph 8.0)与0.5m na2so4、0.1%十二烷基麦芽糖苷(ddm)、1mm nadph、10mm atp、1mm辅酶a、1mm丙二酰辅酶a,或用于反应缓冲液制备的组分混合。
[0650]
试剂盒也可以包括去离子水。
[0651]
试剂盒还可以包括使用说明。
[0652]
试剂盒#3包括本发明的牛奶树碱羟化酶的纯化产物,可以用于由6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮,具有结构式其中r是芳基或杂芳基来生产真菌荧光素。例如,该试剂盒可用于从牛奶树碱生产3
‑
羟基牛奶树碱。
[0653]
试剂盒还可以包括反应缓冲液。例如,0.2m磷酸钠缓冲液(ph 8.0)与0.5m na2so4、0.1%十二烷基麦芽糖苷(ddm)、1mm nadph混合。
[0654]
试剂盒也可以包括去离子水。
[0655]
试剂盒还可以包括使用说明。
[0656]
试剂盒#4和试剂盒#5与试剂盒#2和试剂盒#3不同之处在于它们包括纯化的荧光素酶,其底物是6
‑
(2
‑
芳基乙烯基)
‑
3,4
‑
二羟基
‑
2h
‑
吡喃
‑2‑
酮,具有结构式r为芳基或杂芳基。
[0657]
试剂盒可用于在生物标本中,例如在植物提取物、真菌提取物和微生物中鉴定3
‑
芳基丙烯酸,具有结构式其中r是芳基或杂芳基(例如从咖啡酸),和/或6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮,具有结构式
[0658]
其中r是芳基或杂芳基(例如牛奶树碱)。
[0659]
试剂盒还可以包括用于反应的反应缓冲液(参见试剂盒#2和#3的描述),或用于制备反应缓冲液的组分。
[0660]
试剂盒还可以包括去离子水。
[0661]
试剂盒还可以包括使用说明。
[0662]
试剂盒还可以包括咖啡酸。例如,咖啡酸的水溶液或用于溶解在水中的残留物。
[0663]
试剂盒也可以包括牛奶树碱。
[0664]
试剂盒的应用
[0665]
为了鉴定测试样品中咖啡酸的存在,需要将5μl的酶混合物添加到比色杯中的95μl的冰冷反应缓冲液中,小心混合,添加5μl的测试样品,再次小心地混合,并放入光度计。在最高30℃在两分钟内整合生物发光信号。在相同条件下添加5μl咖啡酸溶液或5μl水以代替测试样品等分试样进行对照实验。可以说,如果测试样品发出的光超过了使用水的样本所记录的背景信号,则咖啡酸以可检测的量存在于样品中。
[0666]
灵敏度:该试剂盒能够确定培养基中浓度超过1nm的咖啡酸的存在。
[0667]
储存条件:所有试剂盒组分应在不超过
‑
20℃的温度下储存。
[0668]
为了鉴定测试样品中牛奶树碱的存在,需要将5μl的酶混合物添加到比色杯中的95μl的冰冷反应缓冲液中,小心混合,添加5μl的测试样品,再次小心混合,并放入光度计。在最高30℃在两分钟内整合生物发光信号。在相同条件下添加5μl牛奶树碱或5μl水以代替测试样品等分试样进行对照实验。可以说,如果测试样品发出的光超过了使用水的样本所记录的背景信号,则牛奶树碱以可检测的量存在于样品中。
[0669]
灵敏度:该试剂盒能够确定培养基中浓度超过100pm的牛奶树碱的存在。
[0670]
储存条件:所有试剂盒组分应在不超过
‑
20℃的温度下储存。
[0671]
试剂盒#6包括编码本发明的牛奶树碱羟化酶的核酸。例如,牛奶树碱羟化酶,其氨基酸序列选自seq id no:2、4、6、8、10、12、14、16、18、20、22、24、26、28。
[0672]
试剂盒还可包括核酸的使用说明。
[0673]
试剂盒还可以包括去离子水或用于溶解冻干的核酸和/或稀释核酸溶液的缓冲液。
[0674]
试剂盒还可包括与所述核酸区域互补的引物用于扩增核酸或其片段。
[0675]
试剂盒可用于产生本发明的重组牛奶树碱羟化酶或在细胞和/或细胞系和/或生物体中表达牛奶树碱羟化酶。核酸在细胞、细胞系和/或生物体中表达后,这些细胞、细胞系和/或生物体获得催化外源或内源的6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮,其具有结构式
[0676]
[0677]
转化为6
‑
(2
‑
芳基乙烯基)
‑
3,4
‑
二羟基
‑
2h
‑
吡喃
‑2‑
酮,其具有结构式
[0678]
其中r是芳基或杂芳基的能力。例如,他们获得了催化牛奶树碱转化为3
‑
羟基牛奶树碱的能力。
[0679]
试剂盒#7包括编码本发明的牛奶树碱
‑
合酶的核酸。例如,牛奶树碱
‑
合酶,其氨基酸序列选自seq id no:35、37、39、41、43、45、47、49、51、53、55。
[0680]
试剂盒还可包括核酸的使用说明。
[0681]
试剂盒还可以包括去离子水或用于溶解冻干的核酸和/或稀释核酸溶液的缓冲液。
[0682]
试剂盒还可包括与所述核酸的区域互补的引物,用于扩增核酸或其片段。
[0683]
试剂盒还可以包括编码4'
‑
磷酸泛酰巯基乙胺基转移酶的核酸,例如具有氨基酸序列如seq id no 105中所示的4
’‑
磷酸泛酰巯基乙胺基转移酶。
[0684]
试剂盒可用于产生本发明的重组牛奶树碱合酶或在细胞和/或细胞系和/或生物体中表达牛奶树碱羟化酶。
[0685]
核酸在细胞、细胞系和/或生物体中表达后,这些细胞、细胞系和/或生物体获得催化3
‑
芳基丙烯酸,其具有结构式
[0686]
其中r为芳基或杂芳基,转化为6
‑
(2
‑
芳基乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮,其具有结构式
[0687]
的能力。
[0688]
例如,它们获得催化将咖啡酸转化为牛奶树碱、和/或肉桂酸转化为(e)
‑4‑
羟基
‑6‑
苯乙烯基
‑
2h
‑
吡喃
‑2‑
酮、和/或对香豆酸转化为双去甲洋蒿宁、和/或(e)
‑3‑
(6
‑
羟基萘
‑2‑
基)丙酸转化为(e)
‑4‑
羟基
‑6‑
(2
‑
(6
‑
羟基萘
‑2‑
基)乙烯基)
‑
2h
‑
吡喃
‑2‑
酮、和/或(e)
‑3‑
(1h
‑
吲哚
‑3‑
基)丙酸转化为(e)
‑6‑
(2
‑
(1h
‑
吲哚
‑3‑
基)乙烯基)
‑4‑
羟基
‑
2h
‑
吡喃
‑2‑
酮的能力。
[0689]
试剂盒还可以包括4
‑
乙酸羟苯酯3
‑
单加氧酶
‑
还原酶的组分hpab和hpac以及酪氨酸解氨酶的编码核酸。具有这种组分的试剂盒可用于在体外和体内表达系统中从酪氨酸产生牛奶树碱。
[0690]
试剂盒#8包括编码本发明的牛奶树碱合酶的核酸和编码本发明的牛奶树碱羟化酶的核酸。例如,牛奶树碱
‑
合酶,其氨基酸序列选自seq id no:35、37、39、41、43、45、47、49、51、53、55;和牛奶树碱羟化酶,其氨基酸序列选自seq id no:2、4、6、8、10、12、14、16、18、20、22、24、26、28。
[0691]
试剂盒还可包括核酸的使用说明。
[0692]
试剂盒还可以包含去离子水或用于溶解冻干的核酸和/或稀释核酸溶液的缓冲
液。
[0693]
试剂盒还可以包含与试剂盒中包括的核酸区域互补的引物,用于扩增这些核酸或其片段。
[0694]
试剂盒还可以包含编码4
’‑
磷酸泛酰巯基乙胺基转移酶的核酸,例如,具有氨基酸序列如seq id no 105所示的4
’‑
磷酸泛酰巯基乙胺基转移酶。
[0695]
试剂盒还可以包含编码从细胞代谢物中生物合成3
‑
芳基丙烯酸的酶的核酸。例如4
‑
乙酸羟苯酯3
‑
单加氧酶
‑
还原酶的组分hpab和hpac以及酪氨酸解氨酶的编码核酸。
[0696]
该试剂盒可用于试剂盒#6和#7所述的任何目的。该试剂盒可用于在细胞和/或细胞系和/或生物体中表达牛奶树碱羟化酶和牛奶树碱合酶。核酸在细胞、细胞系和/或生物中表达后,这些细胞、细胞系和/或生物获得从结构式的3
‑
芳基丙烯酸产生相应的6
‑
(2
‑
芳基乙烯基)
‑
3,4
‑
二羟基
‑
2h
‑
吡喃
‑2‑
酮,具有结构式其中r为芳基或杂芳基的能力。
[0697]
该试剂盒可用于在细胞和/或细胞系和/或生物体中表达牛奶树碱羟化酶和牛奶树碱合酶以及酪氨酸解氨酶和4
‑
乙酸羟苯酯3
‑
单加氧酶
‑
还原酶的组分hpab和hpac。核酸在细胞、细胞系和/或生物体中表达后,这些细胞、细胞系和/或生物体获得从酪氨酸和细胞代谢产物产生牛奶树碱的能力。
[0698]
试剂盒#9包括编码本发明的牛奶树碱羟化酶的核酸。例如,牛奶树碱羟化酶,其氨基酸序列选自seq id no:2、4、6、8、10、12、14、16、18、20、22、24、26、28和编码能够氧化至少一种真菌荧光素同时发射光的荧光素酶的核酸。例如,可以选择的荧光素酶,其氨基酸序列选自seq id no:80、82、84、86、88、90、92、94、96、98。
[0699]
试剂盒还可以包括核酸的使用说明。
[0700]
试剂盒还可以包含去离子水或用于溶解冻干的核酸和/或稀释核酸溶液的缓冲液。
[0701]
试剂盒也可以包含与试剂盒中包括的核酸区域互补的引物用于扩增这些核酸或其片段。
[0702]
该试剂盒可用于标记细胞和/或细胞系和/或生物体,其中所述细胞、细胞系和/或生物体在外源或内源真菌前荧光素的存在下由于所述核酸的表达获得生物发光能力。例如,它们在牛奶树碱的存在下获得生物发光的能力。
[0703]
该试剂盒还可用于研究靶基因启动子的共激活。
[0704]
该试剂盒还可以包括编码本发明的牛奶树碱
‑
合酶的核酸,例如牛奶树碱
‑
合酶,其氨基酸序列选自seq id no:35、37、39、41、43、45、47、49、51、53、55。在这种情况下,该试剂盒可用于生产在外源或内源的3
‑
芳基丙烯酸存在下能够发光的细胞、细胞系和转基因生物体,3
‑
芳基丙烯酸结构式为
[0705]
其中r是芳基或杂芳基。例如,在选自下组的3
‑
芳基丙烯酸存在下:咖啡酸或肉桂酸、或对香豆酸、或香豆酸、或伞形酸、或芥子酸、或阿魏酸。特别地,该试剂盒可用于产生自主生物发光的转基因生物体,例如。植物或真菌。
[0706]
试剂盒还可以包括编码4
’‑
磷酸泛酰巯基乙胺基转移酶的核酸。例如,具有氨基酸序列如seq id no 105所示的4
’‑
磷酸泛酰巯基乙胺基转移酶或类似物。
[0707]
试剂盒还可以包含编码从细胞代谢物生物合成3
‑
芳基丙烯酸的酶的核酸。
[0708]
试剂盒还可以包含编码本发明的咖啡酰丙酮酸水解酶的核酸,例如咖啡因丙酮酸水解酶,其氨基酸序列选自seq id no:65、67、69、71、73、75。
[0709]
试剂盒还可以用于为试剂盒#6和#7所述的任何目的。
[0710]
该试剂盒还可用于产生细胞系,从而能够鉴定测试样品中咖啡酸的存在。
[0711]
试剂盒#10包括根癌农杆菌agl0菌株的细胞,其携带在合适的启动子,例如花椰菜花叶病毒的35s启动子的控制下的牛奶树碱羟化酶、牛奶树碱合酶、荧光素酶、磷酸泛酰巯基乙胺基转移酶npga基因和抗生素抗性基因(例如卡那霉素)的编码序列的质粒。
[0712]
试剂盒还可包括用于确定表达盒整合到双子叶开花植物细胞中的正确性的引物。
[0713]
试剂盒可用于生长自主生物发光的双子叶植物。
[0714]
试剂盒还可以包括使用说明。
[0715]
应用方法:根据完全适合于该植物物种的方案,使用试剂盒中的农杆菌细胞转化双子叶植物。在抗生素培养基(例如卡那霉素)中选择植物。使用带有试剂盒引物通过pcr进行表达盒的全长整合的正确性。
[0716]
储存条件:感受态农杆菌细胞应在不超过
‑
70℃的温度下储存,允许咖啡酸溶液在不超过
‑
20℃的温度下储存。
[0717]
试剂盒#11
[0718]
该试剂盒包括本发明的牛奶树碱羟化酶的纯化产物和pks的纯化产物,并且可以用于从咖啡酰辅酶a生产真菌荧光素。试剂盒还可包括反应缓冲液:0.2m磷酸钠缓冲液(ph 8.0)与0.5m na2so4、0.1%十二烷基麦芽糖苷(ddm)、1mm nadph、10mm atp、1mm辅酶a、1mm丙二酰辅酶a,或用于制备反应缓冲液的组分混合。试剂盒也可能包括去离子水。试剂盒也可能包括使用说明。
[0719]
试剂盒#12
[0720]
试剂盒包括编码本发明的pks的核酸和编码牛奶树碱羟化酶的核酸。例如,pks,其氨基酸序列选自seq id nos:119、121、123、125、127、129、131、133、135、137、139和牛奶树碱羟化酶,其氨基酸序列选自seq id no:2、4、6、8 10、12、14、16、18、20、22、24、26、28。
[0721]
试剂盒还可包括核酸的使用说明。试剂盒还可以包含去离子水或用于溶解冻干的核酸和/或稀释核酸溶液的缓冲液。试剂盒还可以包含与试剂盒中包括的核酸区域互补的引物用于扩增这些核酸或其片段。
[0722]
试剂盒还可以包含编码香豆酸辅酶a连接酶的核酸,例如香豆酸辅酶a连接酶,其具有seq id no 141所示的氨基酸序列。
[0723]
试剂盒还可以包含编码由细胞代谢产物生物合成咖啡酸的酶的核酸。例如编码酪
氨酸解氨酶,以及4
‑
乙酸羟苯酯3
‑
单加氧酶
‑
还原酶的组分hpab和hpac的核酸。试剂盒还可包含编码本发明的咖啡酰丙酮酸水解酶的核酸。
[0724]
试剂盒可用于在细胞和/或细胞系和/或生物体中表达牛奶树碱羟化酶和pks。核酸在细胞、细胞系和/或生物中表达后,这些细胞、细胞系和/或生物获得从咖啡酸产生3
‑
羟基牛奶树碱的能力。该试剂盒还可以用于在细胞和/或细胞系和/或生物体中表达牛奶树碱羟化酶和pks以及香豆酸辅酶a连接酶、咖啡酰丙酮酸水解酶和/或酪氨酸解氨酶和4
‑
乙酸羟苯酯3
‑
单加氧酶
‑
还原酶的组分hpab和hpac的组合。核酸在细胞、细胞系和/或生物中表达后,这些细胞、细胞系和/或生物获得从酪氨酸和细胞代谢物中产生3
‑
羟基牛奶树碱的能力。
[0725]
该试剂盒还可以包括编码能够氧化3
‑
羟基牛奶树碱同时发射光的荧光素酶的核酸。在这种情况下,该试剂盒可用于标记细胞和/或细胞系和/或生物体,其中所述细胞、细胞系和/或生物体由于核酸表达在外源或内源的牛奶树碱和/或咖啡酰辅酶a,和/或咖啡酸存在下获得生物发光能力。例如,细胞、细胞系和/或生物体获得自主的生物发光能力。
[0726]
[0727]
[0728]
[0729]
[0730]
[0731]
[0732]
[0733]
[0734]
[0735]
[0736]
[0737]
[0738]
[0739]
[0740]
[0741]
[0742]
[0743]
[0744]
[0745]
[0746]
[0747]
[0748]
[0749]
[0750]
[0751]
[0752]
[0753]
[0754]
[0755]
[0756]
[0757]
[0758]
[0759]
[0760]
[0761]
[0762]
[0763]
[0764]
[0765]
[0766]
[0767]
[0768]
[0769]
[0770]
[0771]
[0772]
[0773]
[0774]
[0775]
[0776]
[0777]
[0778]
[0779]
[0780]
[0781]
[0782]
[0783]
[0784]
[0785]
[0786]
[0787]
[0788]
[0789]
[0790]
[0791]
[0792]
[0793]
[0794]
[0795]
[0796]
[0797]
[0798]
[0799]
[0800]
[0801]
[0802]
[0803]
[0804]
[0805]
[0806]
[0807]
[0808]
[0809]
[0810]
[0811]
[0812]
[0813]
[0814]
[0815]
[0816]
[0817]
[0818]
[0819]
[0820]
[0821]
[0822]
[0823]
[0824]
[0825]
[0826]
[0827]
[0828]
[0829]
[0830]
[0831]
[0832]
[0833]
[0834]
[0835]
[0836]
[0837]
[0838]
[0839]
[0840]
[0841]
[0842]
[0843]
[0844]
[0845]
[0846]
[0847]
[0848]
[0849]
[0850]
[0851]
[0852]
[0853]
[0854]
[0855]
[0856]
[0857]
[0858]
[0859]
[0860]
[0861]
[0862]
[0863]
[0864]
[0865]
[0866]
[0867]
[0868]
[0869]
[0870]
[0871]
[0872]
[0873]
[0874]
[0875]
[0876]
[0877]
[0878]
[0879]
[0880]
[0881]
[0882]
[0883]
[0884]
[0885]
[0886]
[0887]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1