一种总胆固醇检测试剂盒及其生产工艺的制作方法
本发明涉及总胆固醇检测技术领域,尤其涉及一种总胆固醇检测试剂盒及其生产工艺。
背景技术:
总胆固醇(tc)是指血液中所有脂蛋白所含胆固醇之总和,人群总胆固醇水平主要取决于遗传因素和生活方式,总胆固醇包括游离胆固醇和胆固醇酯,肝脏是合成和贮存的主要器官。胆固醇是合成肾上腺皮质激素、性激素、胆汁酸及维生素d等生理活性物质的重要原料,也是构成细胞膜的主要成分,其血清浓度可作为脂代谢的指标。高tc血症是冠心病的主要危险因素。血总胆固醇检测是临床检验的一项常规项目。
由于总胆固醇(tc)测定方法需要较高的灵敏度和特异性。化学法曾于很长一段时间用于常规检查,一般包括:①抽提;②皂化;②毛地黄皂苷沉淀纯化;④显色比色四个阶段。其操作复杂,干扰因素多,现多已不用。现临床应用胆固醇酯酶和胆固醇氧化酶及过氧化物酶的方法,快速准确,标本用量小,可完全在自动生化分析仪上操作,适于大批量标本的检查。目前,胆固醇酯酶和胆固醇氧化酶及过氧化物酶的方法是最为普遍通用的方法,但是胆固醇氧化法存在灵敏度,精密度、准确性、线性范围等方面的问题,在临床应用上存在着差异性。
基于上述问题,我们设计出了在精密度、准确性、线性范围等方面提高产品性能指标的一种总胆固醇检测试剂盒及其生产工艺来解决以上问题。
技术实现要素:
本发明的目的是为了解决现有技术中存在的缺点,而提出的一种总胆固醇检测试剂盒及其生产工艺。
为了实现上述目的,本发明采用了如下技术方案:
一种总胆固醇检测试剂盒,包括试剂r1和试剂r2,其中,
所述试剂r1包括量为50mmol/l的pipes、量为0.35ml/l的甘露醇、量为150g/l的聚乙二醇、量为0.75mmol/l的adps、量为3000u/l的胆固醇酯酶、量为1000u/l的抗坏血酸氧化酶以及量为6ml/l的庆大霉素;
所述试剂r2包括量为50mmol/l的pipes、量为0.35ml/l的甘露醇、量为1.476mmol/l的4-氨基安替比林、量为0.1mmol/l的吐温80、量为6000u/l的过氧化物酶、量为1200u/l的胆固醇氧化酶、量为0.5g/l的叠氮钠以及量为1ml/l的庆大霉素。
进一步的,所述试剂r1与所述试剂r2的存放要求为在2℃-8℃条件下存放至有效期末检测。
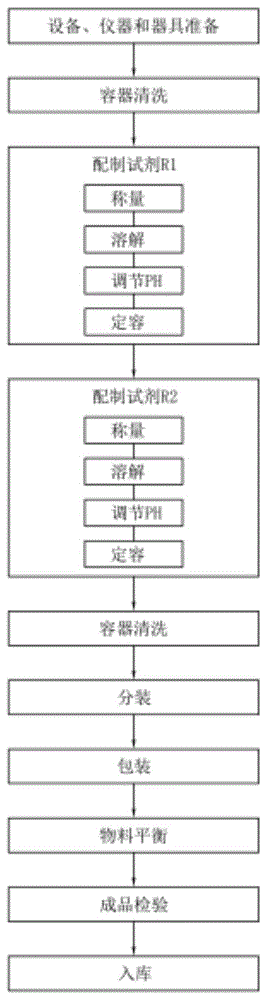
进一步的,一种总胆固醇检测试剂盒中所述试剂r1和所述试剂r2的生产工艺,所述生产工艺包括如下步骤:(1)设备、仪器和器具准备:准备好al104型精密电子天平、tc30k型精密电子天平、t1000y型电子天平、磁力搅拌器、精密酸度计、电子秤、玻璃器皿、定量加量器以及移液管;
(2)容器清洗:将所述步骤(1)中所述的玻璃器皿进行清洗;
(3)配制试剂r1:包括如下步骤:
(a1)称量:称量50mmol/l的pipes、0.35ml/l的甘露醇、150g/l的聚乙二醇、0.75mmol/l的adps、3000u/l的胆固醇酯酶、1000u/l的抗坏血酸氧化酶以及6ml/l的庆大霉素;
(b1)溶解:于1升容器内加水约0.8l,加入50mmol/l的pipes,用磁力搅拌搅拌至溶解;加入0.35ml/l的甘露醇,用磁力搅拌器搅拌至溶解,
(c1)调节ph:调ph值至7.0,搅拌加入150g/l的聚乙二醇,用磁力搅拌器搅拌至溶解;加入0.75mmol/l的adps,用磁力搅拌器档搅拌至溶解;加入3000u/l的胆固醇酯酶,用磁力搅拌器搅拌至溶解;加入1000u/l的抗坏血酸氧化酶,用磁力搅拌器搅拌至溶解;加入6ml/l的庆大霉素,用磁力搅拌器搅拌至溶解;
(d1)定容:用工艺用水稀释至1l,用磁力搅拌器2-3档搅拌2h;
(4)配制试剂r2:包括如下步骤:
(a2)称量:称量50mmol/l的pipes、0.35ml/l的甘露醇、1.476mmol/l的4-氨基安替比林、0.1mmol/l的吐温80、6000u/l的过氧化物酶、1200u/l的胆固醇氧化酶、0.5g/l的叠氮钠以及1ml/l的庆大霉素;
(b2)溶解:于1l容器内加水约0.8l,加入50mmol/l的pipes,用磁力搅拌器搅拌至溶解;加入0.35ml/l的甘露醇,用磁力搅拌器搅拌至溶解;
(c2)调节ph:调ph值7.0,加入1.476mmol/l的4-氨基安替比林,用磁力搅拌器搅拌至溶解;加入0.1mmol/l的吐温80,用磁力搅拌器搅拌至溶解;加入6000u/l的过氧化物酶,用磁力搅拌器搅拌至溶解;加入1200u/l的胆固醇氧化酶,用磁力搅拌器搅拌至溶解;加入0.5g/l的叠氮钠,用磁力搅拌器搅拌至溶解;加入1ml/l的庆大霉素,用磁力搅拌器搅拌至溶解;
(d2)定容:用工艺用水稀释至1l,用磁力搅拌器搅拌2h,确认ph值在7.0;
(5)容器清洗;将所述步骤(3)与步骤(4)中使用过的容器进行清洗;
(6)分装:将步骤(3)中制备好的试剂r1和步骤(4)中制备好的试剂r2进行分装;
(7)包装:将步骤(5)中分装好的试剂r1和试剂r2进行包装;
(8)物料平衡;
(9)成品检验;
(10)入库。
进一步的,所述步骤(1)-所述步骤(5)均在净化厂房内完成。
进一步的,所述定量加量器的规格包括1ml、100-1000ul、20-200ul;
所述移液管的规格包括10ml、5ml。
进一步的,所述试剂r1与所述试剂r2的称量误差控制在0.5%范围内。
与现有技术相比,本发明的有益效果是:本发明在试剂盒的精密度、准确性、线性范围等方面进行改进,使得试剂的灵敏度、重复性以及线性都有了很大的提高,同时本试剂盒使用方便,操作简单,参加偶联反应的成分都很稳定,不会引起内外源物质的干扰,稳定性好,可以长时间使用。
附图说明
图1为本发明中试剂的生产工艺流程图;
图2为本发明中试剂盒的生产工艺流程图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。
参照图1-2,一种总胆固醇检测试剂盒,包括试剂r1和试剂r2,其中,试剂r1包括量为50mmol/l的pipes、量为0.35ml/l的甘露醇、量为150g/l的聚乙二醇、量为0.75mmol/l的adps、量为3000u/l的胆固醇酯酶、量为1000u/l的抗坏血酸氧化酶以及量为6ml/l的庆大霉素;试剂r2包括量为50mmol/l的pipes、量为0.35ml/l的甘露醇、量为1.476mmol/l的4-氨基安替比林、量为0.1mmol/l的吐温80、量为6000u/l的过氧化物酶、量为1200u/l的胆固醇氧化酶、量为0.5g/l的叠氮钠以及量为1ml/l的庆大霉素。
检验原理为1、ce:胆固醇酯+h2o——→游离胆固醇+脂肪酸;
2、co:游离胆固醇+o2——→胆甾烯酮+h2o2;
3、pod:2h2o2+4-aap+4-氯酚————→醌亚胺化合物。
本试剂盒的性能指标包括:1.外观:试剂盒外观应整洁,文字符号标识清晰;试剂r1和r2为透明液体,不得有沉淀和絮状物;
2.装量:各规格试剂瓶装量应不少于标示量;
3.试剂空白吸光度:a546nm(1cm)≤0.08;
4.分析灵敏度:测定理论浓度5.17mmol/l样品,吸光度变化要求>0.3a;
5.线性区间:在0mmol/l-12.9mmol/l线性区间内,r≥0.9900;
6.准确度:使用具有溯源性的标准品进行测定,实测值与标示值的相对偏差应在±10%内;
7.重复性:批内精密度cv≤4.0%;批间差≤6.0%;
8.稳定性:产品在2℃-8℃条件下存放至有效期末检测,指标符合以上1-7的指标要求。
试剂r1与试剂r2的存放要求为在2℃-8℃条件下存放至有效期末检测。
制备例
一种总胆固醇检测试剂盒中试剂r1和试剂r2的生产工艺,生产工艺包括如下步骤:(1)设备、仪器和器具准备:准备好al104型精密电子天平、tc30k型精密电子天平、t1000y型电子天平、磁力搅拌器、精密酸度计、电子秤、玻璃器皿、定量加量器以及移液管;
(2)容器清洗:将步骤(1)中的玻璃器皿进行清洗;
(3)配制试剂r1:包括如下步骤:
(a1)称量:称量50mmol/l的pipes、0.35ml/l的甘露醇、150g/l的聚乙二醇、0.75mmol/l的adps、3000u/l的胆固醇酯酶、1000u/l的抗坏血酸氧化酶以及6ml/l的庆大霉素;
(b1)溶解:于1升容器内加水约0.8l,加入50mmol/l的pipes,用磁力搅拌搅拌至溶解;加入0.35ml/l的甘露醇,用磁力搅拌器搅拌至溶解,
(c1)调节ph:调ph值至7.0,搅拌加入150g/l的聚乙二醇,用磁力搅拌器搅拌至溶解;加入0.75mmol/l的adps,用磁力搅拌器档搅拌至溶解;加入3000u/l的胆固醇酯酶,用磁力搅拌器搅拌至溶解;加入1000u/l的抗坏血酸氧化酶,用磁力搅拌器搅拌至溶解;加入6ml/l的庆大霉素,用磁力搅拌器搅拌至溶解;
(d1)定容:用工艺用水稀释至1l,用磁力搅拌器2-3档搅拌2h;
(4)配制试剂r2:包括如下步骤:
(a2)称量:称量50mmol/l的pipes、0.35ml/l的甘露醇、1.476mmol/l的4-氨基安替比林、0.1mmol/l的吐温80、6000u/l的过氧化物酶、1200u/l的胆固醇氧化酶、0.5g/l的叠氮钠以及1ml/l的庆大霉素;
(b2)溶解:于1l容器内加水约0.8l,加入50mmol/l的pipes,用磁力搅拌器搅拌至溶解;加入0.35ml/l的甘露醇,用磁力搅拌器搅拌至溶解;
(c2)调节ph:调ph值7.0,加入1.476mmol/l的4-氨基安替比林,用磁力搅拌器搅拌至溶解;加入0.1mmol/l的吐温80,用磁力搅拌器搅拌至溶解;加入6000u/l的过氧化物酶,用磁力搅拌器搅拌至溶解;加入1200u/l的胆固醇氧化酶,用磁力搅拌器搅拌至溶解;加入0.5g/l的叠氮钠,用磁力搅拌器搅拌至溶解;加入1ml/l的庆大霉素,用磁力搅拌器搅拌至溶解;
(d2)定容:用工艺用水稀释至1l,用磁力搅拌器搅拌2h,确认ph值在7.0;
(5)容器清洗;将步骤(3)与步骤(4)中使用过的容器进行清洗;
(6)分装:将步骤(3)中制备好的试剂r1和步骤(4)中制备好的试剂r2进行分装;
(7)包装:将步骤(5)中分装好的试剂r1和试剂r2进行包装;
(8)物料平衡;
(9)成品检验;
(10)入库。
其中,试剂r1与试剂r2均以配制1l计。
步骤(1)中al104型精密电子天平:灵敏度0.1mg,用于称量工序;tc30k型精密电子天平:灵敏度10mg,用于称量工序;t1000y型电子天平:灵敏度10mg,用于称量工序;磁力搅拌器:型号为99-1,用于溶解工序;精密酸度计:型号为fe20,用于调节ph工序;电子秤:灵敏度20g,用于定容工序。
步骤(1)中的玻璃器皿包括玻璃烧杯等,在使用玻璃烧杯等玻璃器皿时其已经按照《配制用容器清洗规程》处理完毕。
步骤(1)-步骤(5)均在净化厂房内完成。
定量加量器的规格包括1ml、100-1000ul、20-200ul;
移液管的规格包括10ml、5ml。
试剂r1与试剂r2的称量误差控制在0.5%范围内。
步骤(8)中领料单出料领出料配制后的重量之和与成品的重量之和的差值应该在领料的15%范围之内。
试剂r1和试剂r2在经过上述改进后,在试剂的灵敏度、重复性和线性、稳定性都有了很大的提高。
实施例
为了验证上述试剂r1和试剂r2经过改进后的指标,取了3批试剂进行试剂性能验证,验证过程和结果如下:
总胆固醇(tc)检测试剂盒的性能分析,对试剂盒涉及的性能指标分别进行检测,说明性能指标是如何建立的。将所有的实验进行了总结,具体数据及结论如下:
1)tc试剂盒及相关信息:
1.1)tc试剂盒批号和规格
60ml(r1:1×40ml,r2:1×20ml);
150ml(r1:2×50ml,r2:1×50ml);
210ml(r1:2×70ml,r2:1×70ml);
240ml(r1:2×80ml,r2:1×80ml);
250ml(r1:4×50ml,r2:1×50ml);
280ml(r1:3×70ml,r2:1×70ml);
780ml(r1:12×65ml);
200ml;
2×300test
1500ml;
分别制作不同批次的前述的制备例中的试剂盒,根据批次命名分别为样品1、样品2和样品3,本产品设计了10种包装规格,只是大小包装不同,对性能评估结果没有影响。因此只对其中一种最常用规格进行了测定,规格为:60ml(r1:1×40ml,r2:1×20ml)。
1.2)校准品和质控品
用于性能评估的校准品:randoxcalibratorserumcal2,lot:900un,标示值:4.2mmol/l;
用于准确度性能评估的参考物质:cobas公司的calibratorforautomatedsystems,lot:171650,标示值:4.46mmol/l;
质控品为:randox-humasycontrol,lot:844un,target:4.02mmol/l,range:3.50-4.54mmol/l;lot:578ue,target:7.52mmol/l,range:6.54-8.50mmol/l。
2)规范性引用文件:本报告参照gb/t26124-2011《中华人民共和国国家标准-临床化学体外诊断试剂(盒)》要求执行。
3)试验方法
3.1)试验仪器:用于性能评估的仪器为西门子1200型全自动生化分析仪。
3.2)外观:试剂盒外观整洁,文字符号标识清晰;试剂r1和试剂r2为透明液体,不得有沉淀和絮状物。
3.3)净含量:用量筒量取试剂r1和r2,净含量不少于:r1:40ml;r2:20ml。
3.4)试剂空白。
3.4.1)产品技术要求:试剂空白吸光度:a546nm(1cm)≤0.08。
3.4.2)实验方法:用纯水测试试剂(盒),在测试主波长546nm下,记录测试启动时的吸光度(a1)和约5分钟(t)后的吸光度(a2),a2测试结果即为试剂空白吸光度测定值。
3.4.3)实验结果:
3.4.4)结论:三个批号的tc试剂盒分别在西门子1200生化仪测定,实验结果符合试剂空白吸光度:a546nm(1cm)≤0.08。
3.5)分析灵敏度。
3.5.1)产品技术要求:用已知浓度的样品测试试剂盒,记录在试剂盒规定参数下产生的吸光度变化;本试验测定5.17mmol/l样品,吸光度变化要求>0.3a。
3.5.2)实验方法:测定理论浓度约5.17mmol/l样本。
3.5.3)实验结果:
3.5.4)结论:三个批号的tc试剂盒分别在西门子1200生化仪测定,实验结果表明测定理论值在5.17mmol/l样品,吸光度变化要求>0.3a。
3.6)线性范围。
3.6.1)要求及制备方法:
用接近线性范围上限的高浓度样品和接近线性范围下限的低浓度样品,混合成6个稀释浓度(xi)。分别测试试剂盒,每个稀释度测试3次,分别求测定均值(yi)。以稀释浓度(xi)为自变量,以测定均值(yi)为因变量求出线性回归方程及相关系数(r)。按公式(1)计算相关系数(r)。
用上述方法中稀释浓度xi代入线性回归方程,计算yi的估算值与yi的线性偏差,应符合产品技术要求的规定。
3.6.2)产品技术要求:要求试剂盒在样本浓度0mmol/l-12.9mmol/l范围内,整个反应呈线性,r≥0.990,线性相对偏差<±15%。
3.6.3)实验结果:
3.6.4)结论:三个批号的tc试剂盒分别在西门子1200生化仪测定,实验结果表明在0mmol/l-12.9mmol/l测定范围内,线性误差均未出现线性异常状况,所有r2值均大于行业普遍认可的0.990的标准,线性相对偏差均<±15%。
3.7)测量精密度。
3.7.1)重复性:在重现性条件下,用质控品测试试剂盒。测试10次,分别计算测量值的平均值和标准差,按公式(2)计算变异系数(cv),应符合产品技术要求。
3.7.2)产品技术要求:
批内精密度:cv≤3.0%
3.7.3)实验结果:
3.7.4)结论:在高低两个不同浓度水平的质控血清测试下,使用西门子1200生化分析仪测得的批内不精密度均小于3%,属于可接受范畴。
3.7.5)批间差:用质控品分别测试3个不同批号的试剂盒。每个批号测试3次,分别计算每批3次检测的均值
3.7.6)产品技术要求:批间相对偏差≤5.0%
3.7.7)实验结果:
3.7.8)结论:用质控品分别测试3个不同批号的试剂盒,使用西门子1200生化分析仪测得的批间相对偏差小于5%,属于可接受范畴。
3.8)准确度。
3.8.1)产品技术要求:与有证参考物质的相对偏差不超过±15%。
3.8.2)实验方法:
测定tccobas公司的calibratorforautomatedsystems3次,计算3次结果平均值,按公式(5)计算相对偏差,结果应符合产品技术要求:
式中:
3.8.3)实验结果
3.8.4)结论:使用西门子1200生化分析仪测得的相对偏差均小于±15%,属于可接受范畴。
3.9)稳定性:产品配方工艺与此次进行性能分析的试剂无改变。
4)总结:总胆固醇(tc)检测试剂盒(酶法)在西门子1200型全自动生化仪上检测试剂空白、分析灵敏度、线性范围、重复性、批间差、准确度等各项指标,符合该产品拟定的产品技术要求,能够满足临床实际需要。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!