一种抑制AKT与STAT3活性的小分子化合物及其应用的制作方法
本发明属于药物领域,具体地,本发明提供了一种抑制akt与stat3活性的小分子化合物及其应用。
背景技术:
胶质母细胞瘤是中枢神经系统中恶性程度最高的成人原发性恶性脑肿瘤。目前的手术方式无法完全切除肿瘤,具有复发率高、致死率高等特征。胶质母细胞瘤患者的预后非常差,患者的中位生存期仅为12-15个月。目前主要的治疗药物为替莫唑胺,但是它的治疗效果并未能大幅度的提高胶质母细胞瘤患者的生存期。缺少其他有效治疗药物,尤其是靶向治疗小分子药物。寻找胶质母细胞瘤新的治疗药物或手段,延长患者生存期,是亟待解决的难题。因此,根据胶质母细胞瘤形成的关键调控因子,开发分子靶向药物,可为其治疗提供新的治疗策略。
akt是egfr/pi3k信号通路里的重要调控因子,其在肿瘤增殖和放射敏感性中起重要调控作用。众多通过基因敲除的功能实验证实akt信号通路的各致癌调控子在胶质母细胞瘤增殖、凋亡等方面具有重要作用。可知,akt是胶质母细胞瘤的潜在治疗靶点。akt抑制剂临床前试验具有较好的作用效果,但是多数处于临床i期试验,临床效果还未报道。较早研发的akt抑制剂perifosine由于不是靶向激酶活性区,药效交弱、临床试验结果不理想。
胶质瘤干细胞被认为是肿瘤发生的起源。胶质瘤干细胞对化疗和放疗不敏感,也是造成治疗失败、复发的重要因素。stat3信号在胶质母细胞瘤中过度激活,而且其活性是维持胶质瘤干细胞干性必须的。激活型stat3高表达的胶质母细胞瘤预后非常差。在胶质母细胞瘤中使stat3基因沉默,可以诱导细胞分化。这说明stat3在抑制胶质母细胞瘤分化中具有重要作用。表明,stat3的活性是维持胶质母细胞瘤干性的重要调控子,也是靶向治疗的良好分子靶点。stat3为转录因子,设计抑制剂的难度较大,进展较慢。目前进展最快的stat3靶向药物napabucasin,于2016年获得fda孤儿药物地位用于治疗胰腺癌。napabucasin作用机制是通过抑制stat3,靶向肿瘤干细胞。其在胶质母细胞瘤的临床试验正在进行,还没有结果报道。
技术实现要素:
为了克服上述现有技术的不足,本发明提供了一种既可以抑制akt又可以抑制stat3的药物,是可以抑制胶质母细胞瘤恶性增殖,以及清除其肿瘤干细胞的有效策略,对依赖于akt与stat3通路的肿瘤治疗具有潜在的应用价值。
本发明是通过以下技术方案实现的,一种抑制akt与stat3活性的小分子化合物,其特征在于:该抑制akt与stat3活性的小分子化合物,其化学结构式为:
所述的一种抑制akt与stat3活性的小分子化合物用于在治疗胶质母细胞瘤的肿瘤药物中的应用。
所述的一种抑制akt与stat3活性的小分子化合物用于依赖于akt与stat3的肿瘤药物的应用。
本发明有益技术效果:本发明提供了一种同时抑制akt与stat3活性的小分子化合物,既可以抑制肿瘤细胞增殖,又可以清除肿瘤干细胞,对依赖于akt与stat3通路的肿瘤治疗具有潜在的应用价值。
附图说明
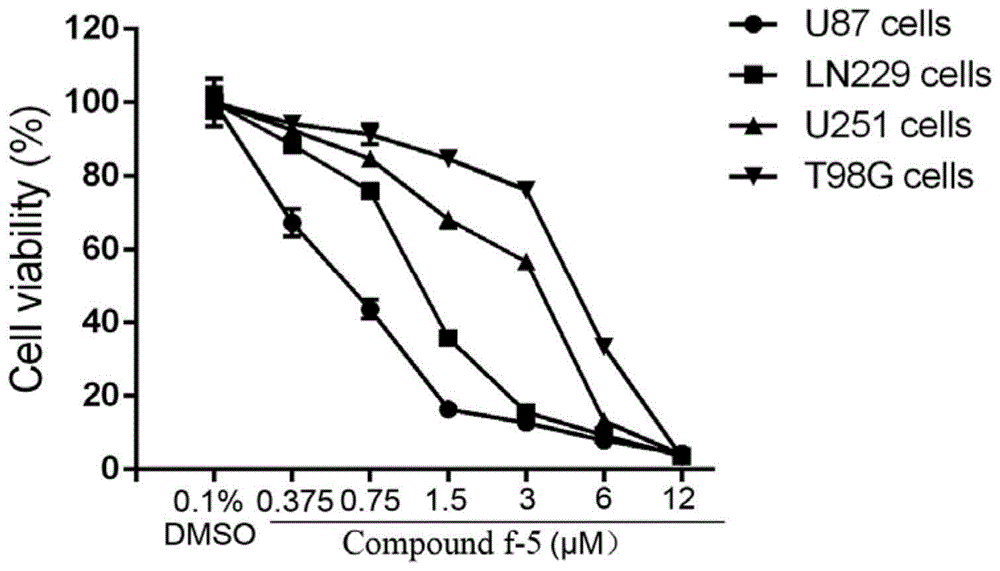
图1显示了化合物f-5能有效抑制胶质母细胞瘤细胞生存。
图2显示了化合物f-5能有效抑制胶质母细胞瘤细胞增殖。
图3显示了化合物f-5能有效抑制胶质母细胞瘤细胞的克隆形成能力。
图4显示了化合物f-5能够抑制胶质瘤干细胞神经球的形成。其中a图表示化合物f-5处理后干细胞神经球的形成数目统计;b图表示化合物f-5处理后干细胞神经球的直径大小统计。
图5显示了化合物f-5治疗后显著延长了荷瘤鼠的中位生存时间。
图6显示了化合物f-5能够抑制胶质母细胞瘤中akt蛋白的磷酸化,对总akt蛋白表达无影响。
图7显示了化合物f-5能够抑制胶质瘤干细胞中stat3蛋白的磷酸化,对总stat3蛋白表达无影响。
具体实施方式
本发明开发的可同时抑制akt与stat3活性的小分子化合物f-5能同时抑制akt与stat3的活性,进而抑制胶质母细胞瘤细胞增殖,克隆形成等能力。同时发现化合物f-5能够抑制胶质瘤干细胞神经球的形成,抑制干细胞的干性维持。体内动物实验再次证实,与未治疗组相比,经化合物f-5治疗后的荷瘤鼠能显著增加生存时间。下面结合实施例对本发明做进一步的详细说明。
本发明所用的胶质母细胞瘤细胞株u87、u251购买于中科院上海细胞库,t98g购自湖南丰晖生物科技有限公司,ln229购自南京科佰生物科技有限公司。
胶质瘤干细胞gsc2由本发明人从临床胶质母细胞瘤病人肿瘤组织中分离并培养。
balb/c裸鼠购自北京维通利华实验动物技术有限公司。
实施例1、(e)-1-(3-(1-甲苯磺酰基-1h-吡咯并[2,3-b]吡啶-5-基)-5,6-二氢吡啶-2(1h)的制备
步骤一:5-溴-1-甲苯-1h-吡咯并[2,3-b]吡啶(f-1)的合成
在-50℃下,将1.5g氢化钠(60mmol)溶于含有10g5-溴-1h-吡咯并[2,3-b]吡啶(50mmol)的250ml四氢呋喃中。在-50℃搅拌30min,然后再加入12g溶解在50ml四氢呋喃中的对甲苯磺酰氯(60mmol),在-50℃继续搅拌1.5h;萃取合并有机层在真空中浓缩,用硫酸钠干燥,柱层析纯化,得到5-溴-1-甲苯-1h-吡咯并[2,3-b]吡啶(即化合物f-1),白色固体15g,收率为80%。
步骤二:(e)-3-(1-甲苯磺酰基-1h-吡咯并[2,3-b]吡啶-5-基)丙烯酸乙酯(f-2)的合成
将5g化合物f-1,1.56g丙烯酸乙酯,4.16g乙酸钯,以及4.32g三(邻甲苯基)膦混合溶解于130ml二甲基甲酰胺中,120℃搅拌过夜。萃取合并有机层在真空中浓缩,用硫酸钠干燥,进行柱层析纯化,得到(e)-3-(1-甲苯磺酰基-1h-吡咯并[2,3-b]吡啶-5-基)丙烯酸乙酯(即化合物f-2),白色固体2.3mg,收率为46%。
步骤三:(e)-3-(1-甲苯磺酰基-1h-吡咯并[2,3-b]吡啶-5-基)丙烯酸(f-3)的合成
在含有2.3g化合物f-2(6.2mmol)的30ml四氢呋喃中添加100ml盐酸(12m),在50℃搅拌过夜。用乙酸乙酯萃取合并有机层,用硫酸钠干燥。柱层析纯化,得到(e)-3-(1-甲苯磺酰基-1h-吡咯并[2,3-b]吡啶-5-基)丙烯酸(即化合物f-3),黄色固体15g,收率为71%。
步骤四:(e)-3-(1-甲苯磺酰基-1h-吡咯并[2,3-b]吡啶-5-基)丙烯酰氯(f-4)的合成
将500mg、(e)-3-(3,4,5-三甲氧苯基)-丙烯酸(1.5mmol),350mg、氯化亚砜(3mmol)及3mg、二甲基甲酰胺(0.03mmol)混合溶解于100ml二氯甲烷中,45℃搅拌3h;得到(e)-3-(1-甲苯磺酰基-1h-吡咯并[2,3-b]吡啶-5-基)丙烯酰氯(即化合物f-4),黄色固体500mg,收率为90%。
步骤五:(e)-1-(3-(1-甲苯磺酰基-1h-吡咯并[2,3-b]吡啶-5-基)-5,6-二氢吡啶-2(1h)(f-5)的合成
在温度-78℃下,在含有156mg5,6-二氢-2(1h)(1.6mmol)的40ml四氢呋喃中逐滴添加0.8ml,1.95mmol的丁基锂;在-78℃下搅拌20min,然后加入15ml含有500mg化合物f-4(1.5mmol)的四氢呋喃。混合物在-78℃下搅拌20min后放入室温继续搅拌30min;萃取合并有机层,用硫酸钠干燥;柱层析纯化,得到目标产物(e)-1-(3-(1-甲苯磺酰基-1h-吡咯并[2,3-b]吡啶-5-基)-5,6-二氢吡啶-2(1h)(即化合物f-5),黄色固体200mg,收率为35%。
实施例2、cck-8法检测化合物f-5对胶质母细胞瘤细胞的作用活性
实验方法:
将胶质母细胞瘤细胞一式三份铺于96孔板(每孔3000个细胞),过夜培养后,对照组加入0.1%dmso,实验组分别加入0.375μμ,0.75μμ,1.5μμ,3μμ,6μμ和12μμ的化合物f-5继续培养72小时。每孔中加入10μl的cck-8溶液,孵育2小时后用酶标仪检测波长450nm处的吸光值。
实验结果如图1所示:化合物f-5对4种胶质母细胞瘤细胞株均具有生长抑制作用,且呈浓度依赖性抑制,4种细胞株的ic50值范围在0.5~5.0μμ之间。
实施例3、edu掺入试验检测化合物f-5对胶质母细胞瘤细胞增殖的抑制作用
实验方法:
用cell-lighttmeducellproliferationdetectionkit试剂盒根据说明书检测细胞增殖。u87细胞接种于96孔板,待细胞贴壁后,用0.1%dmso或0.5和1.0μμ的化合物f-5处理细胞。24小时后,用50μμ的edu继续孵育4小时,随后用4%的多聚甲醛固定15分钟,用0.5%的tritonx-100处理20分钟。细胞用1×apollo®reactioncocktail孵育30分钟后用dpai染色15分钟。pbs清洗三次后,在荧光倒置显微镜下拍照,试验重复三次。
数值表示相对于对照组,在化合物f-5不同浓度处理下细胞中edu阳性细胞相对百分比。
实验结果如图2所示:与对照组相比,在u87细胞中化合物f-5处理显著降低了增殖细胞的平均百分比。在化合物f-50.5μμ作用浓度下,u87细胞中的edu阳性细胞平均百分比减少到62.91%。而在化合物f-51.0μμ作用浓度下,u87细胞中的edu阳性细胞平均百分比减少到35.34%。以上数据表明化合物f-5可显著抑制胶质母细胞瘤细胞增殖,且呈剂量依赖性。
实施例4、集落形成试验检测化合物f-5对胶质母细胞瘤细胞克隆形成能力的影响
实验方法:
u87细胞以500个细胞/孔的细胞数接种于6孔板,每组重复3个复孔。细胞贴壁后实验组加入0.5或1.0μμ的化合物f-5,对照组加入0.1%dmso。处理24小时后,更换新鲜不含化合物f-5的培养基继续孵育10-14天,至肉眼可观察到细胞克隆时停止培养。pbs洗涤细胞并加入甲醇固定,然后用结晶紫工作液染色,冲洗染液,观察克隆并拍照、计数。
数值表示相对于对照组,化合物f-5处理组细胞克隆形成数目的相对百分比。
实验结果如图3所示:化合物f-5显著抑制u87细胞克隆形成的能力。与对照组相比,在化合物f-50.5μμ作用浓度下,u87细胞的克隆形成平均数目明显下降了43.42%;在化合物f-51μμ作用浓度下,u87细胞的克隆形成平均数目下降了71%。综上,这些数据表明化合物f-5能够显著抑制胶质母细胞瘤的克隆形成能力。
实施例5、干细胞克隆球形成实验检测化合物f-5对gsc2干性维持的影响
实验方法:
gsc2成球实验
将胶质瘤干细胞gsc2以每孔500个单细胞铺于96孔板,每组重复3个复孔。对照组用含0.1%dmso的培养基培养,试验组用含终浓度为100nm或200nm的化合物f-5的培养基培养细胞。14-18天后在显微镜下观察干细胞成球情况,镜下记录每孔中干细胞形成克隆球的数目,根据3个复孔克隆球的数目,进行统计分析。在高倍镜下每孔随机挑选5个克隆球,进行直径测量,对复孔中5个克隆球的直径进行统计学分析。
图4a数值表示与对照组相比,化合物f-5处理组干细胞成球数目的相对值。
图4b数值表示与在不同处理条件下,干细胞球的平均直径大小。
实验结果图图4所示:化合物f-5处理gsc2细胞后,克隆球形成能力显著下降。图4a显示与对照组相比,在200nm作用浓度下,gsc2形成的克隆球数目平均减少了67.58%。同样地,在相同处理浓度下,gsc2形成的克隆球的直径平均减少了50.09%(图4b)。综上可知,化合物f-5能够显著抑制gsc细胞克隆球的形成。
实施例6、动物实验评价化合物f-5对裸鼠原位pdx胶质母细胞瘤模型的治疗效果
实验方法:
6.1裸鼠原位pdx胶质母细胞瘤模型的构建
将裸鼠麻醉后固定于立体定位仪上,在额顶部沿正中线切开头皮,在右侧纹状体处标记钻点,用颅钻在标记点处钻孔。用微量注射器吸取gsc2细胞悬液,在钻孔处垂直于颅骨表面缓慢射入脑组织中,每只小鼠注射5×105个细胞。注射后,给小鼠进行头皮缝合,观察小鼠状态。
6.2实验分组
肿瘤干细胞注射5天后,对小鼠进行随机分组。分为2组,分别为对照组,11只老鼠;化合物f-5治疗组,11只老鼠。
6.3给药剂量与给药方式
每周连续腹腔给药5天,停药2天,给药浓度为25mg/kg。
6.4生存分析
当荷瘤鼠出现神经症状时采用安乐死处死小鼠,记录小鼠生存时间。用graphpadprism6.0软件进行生存分析。
数值表示荷瘤鼠在不同治疗条件下,不同时间的存活百分比。
结果图图5所示:化合物f-5治疗一段时间后可显著抑制小鼠体内gsc2细胞的生长,与未经化合物f-5治疗组相比,荷瘤鼠经25mg/kg化合物f-5治疗后显著延长了生存时间,中位生存期延长了14天(p<0.001)。表明化合物f-5可在体内抑制胶质母细胞瘤的增殖,延长荷瘤鼠的生存。
实施例7、westernblot实验检测化合物f-5对胶质母细胞瘤细胞中akt表达水平的影响
实验方法:
用不同浓度的化合物f-5处理u87细胞。48小时后,收集总蛋白。对收集的总蛋白进行蛋白定量分析,上样,进行sds-page电泳,转膜,用3%bsa封闭液封闭2小时。用特异性抗体检测akt总蛋白的表达水平以及akt蛋白的磷酸化水平,用β-actin做对照。二抗孵育后,进行洗膜,最后用化学发光试剂盒进行曝光,检测蛋白表达水平。
实验结果如图6所示:u87细胞经不同浓度的化合物f-5处理后,总的akt蛋白表达水平没有改变,但磷酸化的akt表达量随着化合物f-5浓度的增加表达逐渐减少。表明化合物f-5能够抑制akt的活性,且呈浓度依赖性抑制。
实施例8、westernblot实验检测化合物f-5对干细胞中stat3表达水平的影响
实验方法:
用不同浓度的化合物f-5处理gsc2细胞。48小时后,收集总蛋白并对蛋白进行定量分析。蛋白上样,进行sds-page电泳,转膜,用3%bsa封闭液封闭2小时。用stat3、p-stat3抗体检测stat3总蛋白的表达水平以及stat3蛋白的磷酸化水平,用β-actin做对照。二抗孵育后,进行洗膜,最后用化学发光试剂盒进行曝光,检测蛋白表达水平。
实验结果如图7所示:gsc2细胞经化合物f-5处理后,总的stat3蛋白表达水平没有改变,但磷酸化的stat3表达量随着化合物f-5浓度的增加表达水平逐渐减少。以上表明化合物f-5能够抑制胶质瘤干细胞中stat3的活性,且呈浓度依赖性抑制。
- 还没有人留言评论。精彩留言会获得点赞!