一种能特异性识别别藻蓝蛋白的人工结合蛋白及获取方法与流程
本发明涉及人工结合蛋白技术领域,尤其是一种能特异性识别别藻蓝蛋白的人工结合蛋白及获取方法。
背景技术:
藻胆蛋白是存在于蓝藻(cyanophyceae)、红藻(phodophyceae)、隐藻(cryptophyceae)和少数甲藻(pyrrophyceae)中的一种重要的捕光色素蛋白。据文献记载,藻胆蛋白一般分为三类:藻蓝蛋白(phycocyanin,简称pc,最大吸收峰为620nm,呈湛蓝色)、藻红蛋白(phycoerythrin,简称pe,最大吸收峰为562nm,呈紫红色)和别藻蓝蛋白(allophycocyanin,简称apc,最大吸收峰为652nm,呈天蓝色)。这些蛋白不仅可以作为天然色素,应用于食品、化妆品和染料等领域,而且因其还具有特定的生物活性,对癌症、糖尿病、心血管疾病以及炎症等多种疾病具有特殊疗效,因而在医疗、保健和饲料行业也具有很大的应用前景。
别藻蓝蛋白位于藻胆体的中心位置,它的基本结构单位是α亚基和β亚基,以及连接它们的一段多肽,通常以(αβ)3或(αβ)6的聚合体形式存在。
在别藻蓝蛋白的检测和纯化过程中,通常需要用到能够特异性识别别藻蓝蛋白的抗体。但是由于别藻蓝蛋白与藻蓝蛋白结构非常相似,而且在抗原制备纯化过程中很难完全分开,因此用传统的抗原免疫动物,从而制备的多克隆抗血清或杂交瘤单克隆抗体,很难获得较高的特异性。目前商业化的别藻蓝蛋白抗体特异性都不高,与藻蓝蛋白或多或少具有一定的交叉反应。另外,抗体分子本身具有分子量大、对酸碱以及温度的耐受能力较差,因此大大限制了它在抗原分子的检测和纯化中的应用。
技术实现要素:
(一)要解决的技术问题
为了解决现有技术的上述问题,本发明提供一种能够特异性识别别藻蓝蛋白的人工结合蛋白,该蛋白具有特异性强、亲和力高、热稳定性强、酸碱耐受能力强等特征,可以应用在别藻蓝蛋白的检测和纯化等领域。
此外,本发明还涉及用于编码上述人工结合蛋白的dna片段及该人工结合蛋白的获取方法。
(二)技术方案
为了达到上述目的,本发明采用的主要技术方案包括:一种能特异性识别别藻蓝蛋白的人工结合蛋白,该人工结合蛋白的氨基酸序列为:hmvdnkfnkeivnaiteihhlpnlnleqrwafifslfddpsqsanllaeakklndaqapksggggsggggigvdnkfnkewqnahneiiwlpnlnweqkwafinslyddpsqsanllaeakklndaqapkaaasdykddddklehhhhhh。
另一方面,本发明还提供一种用于编码能特异性识别别藻蓝蛋白的人工结合蛋白的dna片段,该dna片段的序列为:
catatggtagacaacaaattcaacaaagaaatcgttaacgcgatcactgagatccatcatttacctaacttaaacctggaacaacgttgggccttcatcttcagtttattcgatgacccaagccaaagcgctaaccttttagcagaagctaaaaagctaaatgatgctcaggcgccgaaatctggtggtggcggtagtggaggtggtggaattggcgtggacaataaatttaacaaggagtggcagaacgctcataacgaaatcatctggctgccgaacctgaactgggaacagaaatgggcgttcattaactctctgtacgacgacccgtcgcagtctgccaacctgctggctgaagccaagaaactgaacgatgcgcaggccccgaaagcggccgcaagcgactacaaggacgacgacgacaagctcgagcaccaccaccaccaccactga。
再一方面,本发明还提供了一种能特异性识别别藻蓝蛋白的人工结合蛋白的获取方法,该方法包括如下步骤:
s1:噬菌体展示蛋白a二聚体突变体库的噬菌体制备,以获得表达在噬菌体表面的蛋白a二聚体突变体库;
s2:用纯化的螺旋藻别藻蓝蛋白对蛋白a二聚体突变体库进行筛选;
s3:用elisa方法鉴定可特异性识别别藻蓝蛋白的阳性克隆噬菌体;
s4:对上述步骤s3获得的阳性克隆噬菌体进行蛋白表达和纯化,得到阳性克隆蛋白集合;
s5:将步骤s4得到的阳性克隆蛋白集合中的各蛋白,分别进行其与别藻蓝蛋白结合的特异性和亲和力检测,剔除并非apc特异性结合的蛋白;
s6:对步骤s5保留的蛋白,进行热稳定性和/或酸碱耐受度检测和分析,保留热稳定性和/或耐酸碱性能最优的蛋白,为筛选的目标蛋白。
根据本发明较佳实施例,其中:步骤s1的方法为:
s11:在2×yt-a培养基中加入蛋白a二聚体突变体大肠杆菌库,使细胞密度达到od600nm=0.05,在37±0.5℃振荡培养直至细胞密度达到od600nm=0.6,得到大肠杆菌液;
s12:在大肠杆菌液中加入1012个辅助噬菌体m13k07,在30±0.5℃下振荡培养25-35分钟;
s13:加入卡那霉素至终浓度为50±2mg/l,在30±0.5℃下振荡培养30分钟;
s14:离心分离沉淀,重悬于2×yt-ak培养基中,在30±0.5℃下振荡培养15-20小时;
s15:离心分离沉淀并丢弃,上清用0.45微米孔径的滤膜过滤后,加入1/4体积peg/nacl溶液,混匀并冰浴50-70分钟,以沉淀噬菌体;
s16:离心收集沉淀,将噬菌体重悬于预冷的pbs缓冲液中,在冰上保持26-34分钟后离心分层,得上清液;
s17:向上清液加入1/4体积的peg/nacl溶液,并冰浴30分钟再次沉淀噬菌体;
s18:离心沉淀,再次将噬菌体重悬于预冷的pbs缓冲液中,在冰上保持26-33分钟并离心分层,得上清液;
s19:上清液与pbs-b以1:1混合,置于旋转混匀器上,室温下保温8-12分钟,得到噬菌体展示蛋白a二聚体突变体库,直接提供筛选。
根据本发明较佳实施例,其中:步骤s2的方法为:
s21:将纯化的别藻蓝蛋白用pbs缓冲液稀释后,在免疫管中0-4℃包被过夜;
s22:第二天弃上清后,加入pbs-b并在室温下保温80-90分钟,从而封闭免疫管内表面上的未被别藻蓝蛋白占据的结合位点;
s23:将上述步骤s1制备的噬菌体悬液加到免疫管中,并在室温下保温1.5-2.5小时;
s24:分别用pbst和pbs洗涤,每种洗涤至少10次,以除去未固定结合的噬菌体,保留与固定在免疫管上的别藻蓝蛋白结合的噬菌体;
s25:用甘氨酸-盐酸在室温下保温4-8分钟,将与固定在免疫管上的别藻蓝蛋白结合的噬菌体洗脱下来,并加入1m的tris溶液进行中和;
s26:将洗脱下来的噬菌体悬液与细胞密度od600nm=0.6的大肠杆菌xl1blue培养物混合,并在37±0.5℃静置培养25-35分钟;
s27:将这些细胞悬浊液铺到2×yt-a固体培养基平皿上,经37±0.5℃过夜培养平皿,并计数梯度稀释后的生长菌落;用2×yt培养基从平皿上刮下菌落,加入甘油使终浓度为20%(v/v),分成每管1ml,保存于-20℃,得到若干管单菌落样品。
根据本发明较佳实施例,其中:步骤s3的方法为:使用singlephageelisa方法鉴定与对应靶分子的结合情况,具体步骤为:
s31:将上述步骤s2得到的每个单菌落样品接种到加有2×yt-a培养基的96孔深孔板中,在37±0.5℃下振荡培养15-18小时,得到培养物;
s32:次日各取一定量培养物,接种到新鲜的2×yt-a培养基,在新的96孔深孔板中,在37±0.5℃下振荡培养2-3小时;
s33:每孔加入109个m13k07辅助噬菌体,在37±0.5℃下振荡培养20-40分钟;
s34:加入卡那霉素至终浓度为50mg/升,然后继续在37±0.5℃下振荡培养15-18小时;
s35:离心沉淀细菌,取上清转移到新的预先加入了等体积20%(w/v)peg/nacl溶液的96孔培养板,在冰上保温60-65分钟沉淀上清中的噬菌体颗粒,再次离心沉淀,将沉淀重悬于pbs缓冲液中,用于后续的噬菌体elisa实验;
s36:噬菌体elisa实验,包括如下步骤:
s361:将别藻蓝蛋白和牛血清白蛋白包被在96孔板上,并使用封闭液进行封闭,使塑料表面的剩余结合位点饱和;用pbst洗涤2-4次后,取步骤s35制备好的噬菌体样品加到elisa板的各孔;
s362:室温下保温2-2.5h后,用pbst洗涤2-4次;每孔加入以1:5000稀释的抗m13噬菌体的抗体-过氧化物酶偶联物,室温下保温50-70分钟后,用pbst和pbs分别洗涤2-4次;
s363:最后吸取一定量的tmb底物加入到孔中,并在室温下显色8-12分钟,随后每孔加入2mh2so4终止显色反应;
s364:用酶标仪bio-rad在450nm测量吸收值;将与别藻蓝蛋白结合显阳性,而与牛血清白蛋白结合显阴性的克隆定义为阳性克隆噬菌体;其中与别藻蓝蛋白结合显阳性是指od450nm大于0.10,而牛血清白蛋白结合显阴性是指od450nm小于0.05。
根据本发明较佳实施例,其中:步骤s4的方法为:
s40:将上述步骤s3筛选获得的阳性克隆噬菌体的蛋白a二聚体突变体用常规的分子克隆手段,克隆到pet22b(+)质粒中,并将质粒转入到大肠杆菌bl21(de3);
s41:挑取单菌落接种到2×yt-a培养基中,在37±0.5℃下震荡培养15-18小时;
s42:将步骤s41的培养物以1:100转接到2×yt-a培养基,并在37±0.5℃下震荡培养,直至细胞密度达到约od600nm=0.6;
s43:加入微量异丙基-β-d-硫代吡喃半乳糖苷iptg诱导外源基因表达,在30±0.5℃下震荡培养5-8小时,得诱导菌液;
s44:将步骤s43的诱导菌液分别留样20微升,将其余诱导菌液离心收集细胞沉淀,并重悬于npi-20溶液;
s45:加入溶菌酶和核酸酶在室温下混匀20-35分钟,随后使用超声破碎细胞,在冰水浴中超声波每开启14-16秒停30秒,共重复4-6次;
s46:离心,取上清液,用尿素缓冲液重悬细胞碎片沉淀,此为不可溶性蛋白;上清液中为可溶性目标蛋白,以备用于后续的固定化金属亲和层析;
s47:将s44留取的诱导菌液留样、步骤s46得到的可溶性蛋白和不可溶性蛋白,分别进行sds聚丙烯酰胺凝胶电泳分析,选择出可溶性蛋白表达量最高的突变体,以便进行后续纯化和分析测试;
s48:使用5倍柱体积的npi-20缓冲液,预先平衡5毫升histraphp纯化柱,然后使上述步骤s46的上清液流过纯化柱;用8倍柱体积的npi-50缓冲液洗去未结合的杂蛋白,随后用npi-250缓冲液洗脱结合的蛋白;
s49:将蛋白样品透析到pbs缓冲液,通过sds聚丙烯酰胺凝胶电泳分析纯化后蛋白的组分和纯度,并用bca法测定蛋白浓度。
根据本发明较佳实施例,其中:步骤s5的方法为:用elisa法检测步骤s47纯化得到的可溶性蛋白表达量最高的突变体与别藻蓝蛋白结合的特异性,剔除非apc特异性结合的蛋白,其具体步骤为:
s51:将别藻蓝蛋白(apc)、藻蓝蛋白(pc)、牛血清白蛋白(bsa)和溶菌酶(lysozyme)用pbs稀释,以100纳克/100微升/孔加入到酶标板,0-4℃放置过夜;
s52:倾掉包被液后,以pbs洗2-4次,用4%的pbsm封闭50-70分钟;
s53:倾掉pbsm,用pbs洗2-4次,将可溶性蛋白表达量最高的突变体分别用4%的pbsm稀释,并分别以200纳克/100微升/孔加入到酶标板对应的孔中,37±0.5℃保温50-80分钟;
s54:用pbs和pbst各洗2-4次,加入100微升/孔4%pbsm稀释的hrp/anti-his抗体,37±0.5℃保温50-80分钟;
s55:再用pbst和pbs各洗3-5次,加入tmb底物溶液,显色8-12分钟,再加入h2so4硫酸终止反应,酶标仪测定450nm吸收值;通过吸收值判断非apc特异性结合蛋白,将其筛选范围中剔除。
根据本发明较佳实施例,其中:步骤s6的方法为:用nanodsc测定经步骤s5剔除非apc特异性结合蛋白后的剩余蛋白和野生型蛋白a二聚体的热稳定性以及tm值,以选出具有最佳热稳定性的目标蛋白,具体操作如下:
s61:用500毫升超纯水分别清洗nanodsc样品及参比细胞;其中nanodsc样品是指所述剩余蛋白和野生型蛋白a二聚体;
s62:用100毫升pbs缓冲液分别清洗nanodsc样品及参比细胞;
s63:使用3毫升脱气pbs缓冲液分别清洗nanodsc样品及参比细胞;
s64:将样品及参比细胞都上样脱气后pbs缓冲液,运行如下程序:从25℃升温至100℃,1℃/分钟,3个大气压,平衡600秒,信号采集时间1秒;再从100℃降温至25℃,1℃/分钟,3个大气压,平衡600秒,信号采集时间1秒;以上升温和降温程序运行10个循环;
s65:保留参比细胞缓冲液,用3毫升脱气pbs缓冲液清洗样品,加入新的脱气pbs缓冲液,进行升温程序:从25℃升温至100℃,1℃/分钟,3个大气压,平衡600秒,信号采集时间1秒;
s66:保留参比细胞缓冲液,3毫升脱气pbs缓冲液清洗样品,加入脱气蛋白质样品,输入浓度和分子量,蛋白质经验psv值:0.73,进行升温程序:从25℃升温至100℃,1℃/分钟,3个大气压,平衡600秒,信号采集时间1秒;由仪器程序计算出各蛋白的tm值,根据tm值确定具有最佳热稳定性的蛋白。
根据本发明较佳实施例,其中:重复上述步骤s1-s2至少4轮;为增加筛选体系中结合蛋白的富集程度,并从第二轮筛选开始,每次在100毫升培养基中进行培养和噬菌体援救,并使用更苛刻的洗涤条件,即第二轮筛选中分别用pbst和pbs洗涤15次和10次,第三轮和第四轮分别洗涤20次和10次。
(三)有益效果
本发明的有益效果是:
本发明通过选取高稳定性的、高可溶性的蛋白a二聚体作为骨架蛋白,在保证骨架蛋白的主体结构不变的基础上,运用基因工程技术对8-24个暴露于分子表面的氨基酸位点进行随机化突变,在分子表面形成一个可变的蛋白结合区域,从而构建骨架蛋白库。然后通过表面展示技术从该蛋白库中筛选得到能与靶分子特异性结合的克隆。蛋白a二聚体为结构稳定的天然蛋白,在其基础上,经过基因工程改造、构建突变体库、亲和筛选等过程,最终获得的一类具有抗原结合活性的蛋白质。
据实验证明,本发明筛选的蛋白特异性强,对于与别藻蓝蛋白具有较高同源性和类似结构的藻蓝蛋白无结合,而与别藻蓝蛋白的结合强度高,elisa检测信号强,因此十分适合应用在别藻蓝蛋白检测领域。该蛋白十分稳定,tm值高达83℃,可在室温下长期保存,应用价值高。除此之外,该蛋白的酸碱耐受能力强,范围广,在ph值2-12范围内处理24小时后,仍然具有结合别藻蓝蛋白的活性,并且结合强度没有改变。由于蛋白质的亲和纯化的过程中,通常会用到酸性或碱性洗脱液对蛋白进行洗脱,常规的抗体分子酸碱耐受力较差,所以亲和纯化柱的使用次数超过5-10次后,抗体分子结构破坏,结合抗原的能力大大降低,纯化效果就非常差了。鉴于本发明中筛选的能够特异性识别别藻蓝蛋白的蛋白具有较强的酸碱耐受能力,非常适合作为配体分子开发成纯化别藻蓝蛋白的亲和纯化试剂盒。
附图说明
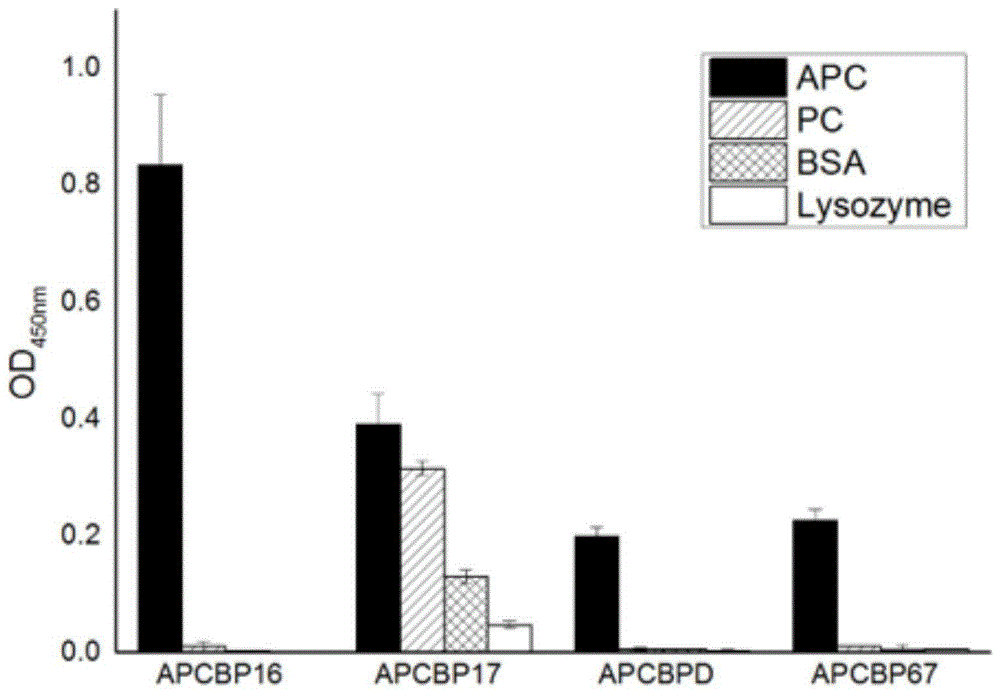
图1为本发明步骤四选出的四种(apcbp16、apcbp17、apcbp67、apcbpd)可溶性蛋白表达量最高的突变体与别藻蓝蛋白apc、藻蓝蛋白pc、对照蛋白bsa、lysozyme的识别/结合实验结果,采用酶标仪测定450nm测定的吸收值。
图2为本发明步骤五剔除了非apc特异性结合蛋白后的剩余3种蛋白(apcbp16、apcbp67、apcbpd)及wt蛋白与别藻蓝蛋白结合的特异性和亲和力测定结果。
图3为本发明步骤六选出的具有最佳热稳定性的apcbp16蛋白在ph2-12,室温环境下处理24小时与别藻蓝蛋白apc的结合能力测试。
具体实施方式
为了更好的解释本发明,以便于理解,下面结合附图,通过具体实施方式,对本发明作详细描述。
本发明的整体构思是选取高稳定性的、高可溶性的蛋白a二聚体作为骨架蛋白,在保证骨架蛋白的主体结构不变的基础上,运用基因工程技术对8-24个暴露于分子表面的氨基酸位点进行随机化突变,在分子表面形成一个可变的蛋白结合区域,从而构建骨架蛋白库。然后通过表面展示技术从该蛋白库中筛选得到能与靶分子特异性结合的克隆。
进一步地,本发明的方法分为如下步骤:
s1:噬菌体展示蛋白a二聚体突变体库的噬菌体制备,以获得表达在噬菌体表面的蛋白a二聚体突变体库;
s2:用纯化的螺旋藻别藻蓝蛋白对蛋白a二聚体突变体库进行筛选;
s3:用elisa方法鉴定可特异性识别别藻蓝蛋白的阳性克隆噬菌体;
s4:对上述步骤s3获得的阳性克隆噬菌体进行蛋白表达和纯化,得到阳性克隆蛋白集合;
s5:将步骤s4得到的阳性克隆蛋白集合中的各蛋白,分别进行其与别藻蓝蛋白结合的特异性和亲和力检测,剔除并非apc特异性结合的蛋白;
s6:对步骤s5保留的蛋白,进行热稳定性和/或酸碱耐受度检测和分析,保留热稳定性和/或耐酸碱性能最优的蛋白,为筛选的目标蛋白。
按照上述方法,本发明最终筛选得到一种能够特异性识别别藻蓝蛋白的人工结合蛋白,其氨基酸序列为:
hmvdnkfnkeivnaiteihhlpnlnleqrwafifslfddpsqsanllaeakklndaqapksggggsggggigvdnkfnkewqnahneiiwlpnlnweqkwafinslyddpsqsanllaeakklndaqapkaaasdykddddklehhhhhh。
其不仅具有高强特异性识别别藻蓝蛋白的能力,同时还具有很强的热稳定性和耐酸性稳定性,在ph值2-12范围内处理24小时后,仍然具有结合别藻蓝蛋白的活性,并且结合强度无改变,非常适合作为配体分子开发成纯化别藻蓝蛋白的亲和纯化试剂盒。
以下结合具体实施例,用以更清楚地说明本发明的技术方案。
实验材料
纯化的螺旋藻别藻蓝蛋白:从螺旋藻干粉(购自江苏赐百年生物工程有限公司)中,提取水溶性蛋白,经过硫酸铵沉淀,再用bio-scalemini羟基磷灰石预装柱(购自biorad公司)进行分离纯化,获得纯度(od652nm/od280nm)大于4的别藻蓝蛋白。
蛋白a二聚体突变体大肠杆菌库:来源于武汉海沙百得生物技术有限公司。
本实施例的具体实现方法分为如下六个步骤:
(一)、制备用于噬菌体展示蛋白a二聚体突变体库的噬菌体
(1)在400毫升2×yt-a培养基中加入蛋白a二聚体突变体大肠杆菌库,使细胞密度达到od600nm=0.05,在37℃和200转/分钟条件下振荡培养直至细胞密度达到od600nm=0.6;
其中:2yt培养基的配方为:酵母膏10克,蛋白胨17克,氯化钠5克,加水至总体积为1升。a表示在原培养基的基础上,加入终浓度为100微克/毫升的氨苄青霉素。
(2)在上述步骤制备的大肠杆菌液中加入1012个辅助噬菌体m13k07(美国invitrogen公司),在30℃和50转/分钟条件下培养30分钟;
(3)加入卡那霉素至终浓度为50毫克/升,在30℃和200转/分钟条件下振荡培养30分钟;
(4)离心(15分钟,1600×g,4℃)分离沉淀,重悬于400毫升2×yt-ak培养基中,在30℃和200转/分钟条件下振荡培养16小时;
其中:ak表示在2yt培养液中加入100微克/毫升的氨苄青霉素(amp),和50微克/毫升的卡那霉素(kana)
(5)通过离心(20分钟,8000×g,4℃)分离沉淀并丢弃,上清用0.45微米孔径的滤膜过滤后,加入1/4体积peg/nacl溶液,混匀并冰浴1小时,以沉淀噬菌体;
其中:peg/nacl溶液的配方为:质量体积比为20%的聚乙二醇8000,2.5摩尔/升的氯化钠,其余为水。
(6)离心收集沉淀(20分钟,12000×g,4℃),将噬菌体重悬于25毫升预冷pbs缓冲液中,在冰上保持30分钟后离心(5分钟,20000×g,4℃);其中:pbs缓冲液配方为:1升水中溶解8克氯化钠,0.2克kcl,3.7克na2hpo4·12h2o,0.24克kh2po4,用naoh调节ph值为7.4。
(7)向上清液加入1/4体积的peg/nacl溶液,并冰浴30分钟再次沉淀噬菌体;
(8)离心沉淀(30分钟,20000×g,4℃),再次将噬菌体沉淀重悬于4毫升预冷pbs缓冲液中,在冰上保持30分钟并离心(30分钟,17000×g,4℃);
(9)将上清液与pbs-b以1:1混合,置于旋转混匀器上,室温下保温10分钟,得到噬菌体展示蛋白a二聚体突变体库,直接提供筛选。
其中,pbs-b表示向pbs缓冲液中加入封闭缓冲液(德国sigma-aldrich公司产品)
(二)用纯化的螺旋藻别藻蓝蛋白对噬菌体展示蛋白a二聚体突变体库进行筛选,以找可与别藻蓝蛋白结合的克隆株。具体操作如下:
(1)将纯化的别藻蓝蛋白用pbs缓冲液稀释后,在免疫管(丹麦nunc品牌产品)中4℃包被过夜。
(2)第二天弃上清后,加入5毫升pbs-b并在室温下保温90分钟,从而封闭免疫管内表面上的未被别藻蓝蛋白占据的结合位点;别藻蓝蛋白固定到免疫管上。
(3)吸取4毫升步骤(一)的第(9)步所制备的噬菌体悬液,加到免疫管中,并在室温下保温2小时。
(4)分别用pbst和pbs各洗涤10次,以除去未结合的噬菌体;
其中:pbst表示向pbs缓冲液中加入终浓度为0.1%的吐温-20。
(5)用2毫升甘氨酸-盐酸在室温下保温5分钟,将与固定在免疫管上的别藻蓝蛋白结合的噬菌体洗脱下来,并加入300微升浓度为1m的tris溶液进行中和。
(6)将洗脱下来的噬菌体悬液与10毫升细胞密度od600nm=0.6的大肠杆菌xl1blue培养物混合,并在37℃静置培养30分钟。
(7)将这些细胞悬浊液铺到2×yt-a固体培养基平皿上,经37℃过夜培养平皿,并计数梯度稀释后的生长菌落。用2×yt培养基从平皿上刮下菌落,加入甘油使终浓度为20%(v/v),分成每管1ml,保存于-20℃,得到若干管单菌落样品。
重复上述步骤(一)-(二)的体外亲和筛选过程三次,共筛选4轮。
其中,为增加筛选体系中结合蛋白的富集程度,从第二轮筛选开始,每次在100毫升培养基中进行培养和噬菌体援救,并使用更苛刻的洗涤条件,即第二轮筛选中分别用pbst和pbs洗涤15次和10次,第三轮和第四轮分别洗涤20次和10次。
(三)使用singlephageelisa方法鉴定与对应靶分子的结合情况,选出可特异性识别别藻蓝蛋白的阳性噬菌体
经过4轮体外亲和筛选后,从得到的克隆中随机挑取96个克隆,使用singlephageelisa方法鉴定与对应靶分子的结合情况。具体操作步骤如下:
(1)把管单菌落样品接种到加有600微升2×yt-a培养基的96孔深孔板中,在37℃220转/分钟培养16小时;
(2)次日各取30微升培养物,接种到新鲜的800微升2×yt-a培养基,于新的96孔板,在37℃220转/分钟培养2小时;
(3)每孔加入109个m13k07辅助噬菌体,在37℃200转/分钟培养30分钟;
(4)加入卡那霉素至终浓度为50毫克/升,然后继续在37℃220转/分钟培养16小时;
(5)离心30分钟(3000×g,4℃)沉淀细菌,取上清转移到新的预先加入了等体积20%(w/v)peg/nacl溶液的96孔培养板,在冰上保温1小时沉淀上清中的噬菌体颗粒,再次离心沉淀(5000×g,4℃,30分钟),将沉淀重悬于200微升pbs缓冲液中,用于后续的噬菌体elisa实验。
(6)噬菌体elisa实验,其包括
(a)将别藻蓝蛋白和牛血清白蛋白包被在96孔板上,并使用封闭液进行封闭,使塑料表面的剩余结合位点饱和。用pbst洗涤三次后,取上述制备好的噬菌体样品加到elisa板的各孔。室温下保温2小时后,用pbst洗涤三次。
(b)为了检测结合的噬菌体,每孔加入100微升以1:5000稀释的抗m13噬菌体的抗体-过氧化物酶偶联物(美国gehealthcare公司),室温下保温1小时后,用pbst和pbs分别洗涤三次。最后吸取100微升tmb底物加入到孔中,并在室温下显色10分钟,随后每孔加入25微升的2mh2so4终止显色反应。
(c)用酶标仪(bio-rad)在450nm测量吸收值。将与别藻蓝蛋白结合显阳性(od450nm大于0.10),而与牛血清白蛋白结合显阴性(od450nm小于0.05)的克隆定义为阳性克隆。本发明共获得33个不同dna序列的阳性克隆。
(四)对上述(三)获得的33个不同dna序列的阳性克隆株进行蛋白表达和纯化
(1)将上述步骤(三)筛选获得的33个阳性克隆株的蛋白a二聚体突变体用常规的分子克隆手段,克隆到pet22b(+)质粒中,并将质粒转入到大肠杆菌bl21(de3)。
(2)挑取单菌落接种到5毫升2×yt-a培养基中,在37℃、220转/分钟震荡培养16小时。
(3)将过夜培养物以1:100转接到200毫升2×yt-a培养基,并在37℃220转/分钟震荡培养,直至细胞密度达到约od600nm=0.6;
(4)加入1mm异丙基-β-d-硫代吡喃半乳糖苷(iptg)诱导外源基因表达,在30℃、220转/分钟震荡培养6小时;
(5)将诱导菌液每种留样20微升,将其余诱导菌液离心(4000×g,4℃,15分钟)收集细胞沉淀,并重悬于15mlnpi-20溶液;
其中,npi-20溶液的配方为50mmmah2po4,150mmnacl,20mm咪唑,ph8.0
(6)加入200微克/毫升溶菌酶和80ubenzonase在室温下混匀30分钟,随后使用超声破碎细胞,在冰水浴中每工作15秒间隔30秒,共重复5次;
(7)离心(15000×g,4℃,30分钟),取上清液(可溶性目标蛋白存在于上清液中,可直接用于接下来的固定化金属亲和层析),沉淀部分,并用15ml尿素缓冲液重悬细胞碎片沉淀,此为不可溶性蛋白样品;
其中,尿素缓冲液的配方为:8m尿素,100mmtris,1mmedta,ph=8.0。
(8)分别将33个克隆株表达的诱导菌液(第5步的留样)、可溶性蛋白(第7步的上清液)和不可溶性蛋白(第7步重悬的细胞碎片沉淀)进行sds聚丙烯酰胺凝胶电泳分析,选择可溶性蛋白表达量最高的4个突变体(apcbp16、apcbp17、apcbp67、apcbpd)进行后续纯化和分析测试。
(9)使用5倍柱体积的npi-20缓冲液,预先平衡5毫升histraphp纯化柱,然后使上述步骤4.4.7的细胞裂解上清液流过纯化柱;
(10)用8倍柱体积的npi-50缓冲液洗去未结合的杂蛋白,随后用npi-250缓冲液洗脱结合的目的蛋白;
其中,npi-50缓冲液的配方为:50mmmah2po4,500mmnacl,50mm咪唑,ph8.0;npi-250缓冲液的配方为:50mmmah2po4,150mmnacl,250mm咪唑,ph8.0
(11)将蛋白样品透析到pbs缓冲液,通过sds聚丙烯酰胺凝胶电泳分析纯化后蛋白的组分和纯度,并用bca法测定蛋白浓度。
结果表明,所得4个突变体蛋白的纯度均高于95%,纯化蛋白的得率(纯化蛋白质量/大肠杆菌培养物体积)分别为:apcbp16:193.6毫克/升、apcbp17:52毫克/升、apcbp67:153.7毫克/升、apcbpd:188.8毫克/升。
(五)用elisa法检测步骤s47纯化得到的可溶性蛋白表达量最高的突变体与别藻蓝蛋白结合的特异性,剔除非apc特异性结合的蛋白,缩小选择范围。
用elisa法检测4个蛋白质突变体(apcbp16、apcbp17、apcbp67、apcbpd)与别藻蓝蛋白结合的特异性,具体操作如下:
(1)将别藻蓝蛋白(apc)、藻蓝蛋白(pc)、牛血清白蛋白(bsa)和溶菌酶(lysozyme)用pbs稀释,以100纳克/100微升/孔加入到酶标板(广州biofil公司),4℃放置过夜。
(2)倾掉包被液后,以pbs洗3次,用4%的pbsm封闭1小时;
其中:4%的pbsm表示,在pbs缓冲液中加入质量体积分数为4%的脱脂奶粉
(3)倾掉4%的pbsm,用pbs洗3次,将apcbp16、apcbp17、apcbp67、apcbpd用4%的pbsm稀释,并分别以200纳克/100微升/孔加入到酶标板对应的孔中,37℃保温1小时;
(4)用pbs和pbst各洗3次,加入100微升/孔4%pbsm稀释的hrp/anti-his抗体,37℃保温1小时;
(5)再用pbst和pbs各洗3次,加入100微升tmb底物溶液,显色10分钟,再加入25微升2mh2so4硫酸,终止反应,酶标仪测定450nm吸收值。
结果如图1所示,apcbp16、apcbp67和apcbpd都只与别藻蓝蛋白apc结合,是特异性识别apc的结合蛋白。而apcbp17与藻蓝蛋白pc也具有明显的结合,与另外两种对照蛋白bsa和lysozyme也都有一定程度的结合,显示该蛋白并非apc特异性结合蛋白,弃之不用。
(6)再用浓度梯度elisa法检测3个蛋白质突变体(apcbp16、apcbp67、apcbpd)与别藻蓝蛋白结合的亲和力,具体操作基本同上述步骤(1)-(5),区别在于,在步骤(1)中,只包被别藻蓝蛋白;在(3)中,向96孔板中分别加入浓度为0、0.076、0.305、1.220、4.880、19.530、78.125nm的突变体蛋白。
结果如图2所示,根据亲和力计算公式算得3个蛋白质突变体的亲和力为:apcbp16:0.45nm、apcbp67:1.44nm、apcbpd:0.60nm。
(六)用nanodsc测定经步骤s5剔除非apc特异性结合蛋白后的剩余蛋白和野生型蛋白a二聚体的热稳定性以及tm值,以选出具有最佳热稳定性的目标蛋白,或进一步测定其耐酸碱性。
用nanodsc(美国tainstruments公司)测定apcbp16、apcbp67、apcbpd和wt(野生型)二聚体蛋白a的热稳定性以及tm值,具体操作如下
(1)用500毫升超纯水分别清洗nanodsc样品及参比cell;
(2)用100毫升pbs缓冲液分别清洗nanodsc样品及参比较cell;
(3)用3毫升脱气pbs缓冲液分别清洗nanodsc样品及参比较cell;
(4)将每个样品及参比cell都上样脱气后pbs缓冲液,运行如下程序:从25℃升温至100℃,1℃/分钟,3个大气压,平衡600秒,信号采集时间1秒;再从100℃降温至25℃,1℃/分钟,3个大气压,平衡600秒,信号采集时间1秒;以上升温和降温程序运行10个循环;
保留参比cell缓冲液,用3毫升脱气pbs缓冲液清洗样品cell,加入新的脱气pbs缓冲液,进行升温程序:从25℃升温至100℃,1℃/分钟,3个大气压,平衡600秒,信号采集时间1秒;
(4)保留参比cell缓冲液,3毫升脱气pbs缓冲液清洗样品cell,加入脱气蛋白质样品(浓度为1毫克/毫升),输入浓度和分子量,蛋白质经验psv值:0.73,进行升温程序:从25℃升温至100℃,1℃/分钟,3个大气压,平衡600秒,信号采集时间1秒;
仪器程序计算出蛋白tm值:apcbp16:83℃、apcbpd:64℃、野生型二聚体蛋白a(wt):77.2℃,apcbp67没有测出tm值。
根据上述蛋白热稳定性实验结果,apcbp16热稳定性最高,甚至比天然蛋白a二聚体的热稳定性还高6℃。
(5)针对该蛋白进行酸碱耐受实验,具体操作如下:
将上述步骤(四)所纯化的apcbp16蛋白用预先配置好的ph值分别为2-12的缓冲液稀释到5微摩尔/升,于室温下放置24小时后,分别取5微升加入到1280微升pbs缓冲液中进行中和,用elisa实验检测它们与别藻蓝蛋白的结合能力(关于结合的亲和力检测,参见上文)。具体操作基本同上述步骤(五)的第(1)-(5)步操作过程,区别在于,只是在步骤(五)的第(1)步中,只包被别藻蓝蛋白;在步骤(五)的第(3)步中,向96孔板中加入上述在不同ph下处理24小时,并用pbs缓冲液中和后的apcbp16蛋白质样品。
由结果如图3所示,apcbp16蛋白在ph2-12,室温环境下处理24小时后,均不影响它与别藻蓝蛋白apc的结合。
对该apcbp16蛋白进行氨基酸序列测定,其序列为:hmvdnkfnkeivnaiteihhlpnlnleqrwafifslfddpsqsanllaeakklndaqapksggggsggggigvdnkfnkewqnahneiiwlpnlnweqkwafinslyddpsqsanllaeakklndaqapkaaasdykddddklehhhhhh。
对应地,可编码该apcbp16蛋白的dna片段,其具有如下基因序列:
catatggtagacaacaaattcaacaaagaaatcgttaacgcgatcactgagatccatcatttacctaacttaaacctggaacaacgttgggccttcatcttcagtttattcgatgacccaagccaaagcgctaaccttttagcagaagctaaaaagctaaatgatgctcaggcgccgaaatctggtggtggcggtagtggaggtggtggaattggcgtggacaataaatttaacaaggagtggcagaacgctcataacgaaatcatctggctgccgaacctgaactgggaacagaaatgggcgttcattaactctctgtacgacgacccgtcgcagtctgccaacctgctggctgaagccaagaaactgaacgatgcgcaggccccgaaagcggccgcaagcgactacaaggacgacgacgacaagctcgagcaccaccaccaccaccactga。
本发明筛选得到的apcbp16蛋白,是一种具有高亲和力、高特异性、高酸碱耐受度、高热稳定性、可溶性高、大肠杆菌表达量高的人工结合蛋白,非常适合作为配体分子开发成纯化别藻蓝蛋白的亲和纯化试剂盒。
序列表
<110>中国科学院(武汉)水生生物研究所
<120>一种能特异性识别别藻蓝蛋白的人工结合蛋白及获取方法
<141>2020-07-15
<160>2
<170>siposequencelisting1.0
<210>1
<211>150
<212>prt
<213>2ambystomalateralexambystomajeffersonianum
<400>1
hismetvalaspasnlyspheasnlysgluilevalasnalailethr
151015
gluilehishisleuproasnleuasnleugluglnargtrpalaphe
202530
ilepheserleupheaspaspproserglnseralaasnleuleuala
354045
glualalyslysleuasnaspalaglnalaprolysserglyglygly
505560
glyserglyglyglyglyileglyvalaspasnlyspheasnlysglu
65707580
trpglnasnalahisasngluileiletrpleuproasnleuasntrp
859095
gluglnlystrpalapheileasnserleutyraspaspprosergln
100105110
seralaasnleuleualaglualalyslysleuasnaspalaglnala
115120125
prolysalaalaalaserasptyrlysaspaspaspasplysleuglu
130135140
hishishishishishis
145150
<210>2
<211>453
<212>dna
<213>人工序列(artificialsequence)
<400>2
catatggtagacaacaaattcaacaaagaaatcgttaacgcgatcactgagatccatcat60
ttacctaacttaaacctggaacaacgttgggccttcatcttcagtttattcgatgaccca120
agccaaagcgctaaccttttagcagaagctaaaaagctaaatgatgctcaggcgccgaaa180
tctggtggtggcggtagtggaggtggtggaattggcgtggacaataaatttaacaaggag240
tggcagaacgctcataacgaaatcatctggctgccgaacctgaactgggaacagaaatgg300
gcgttcattaactctctgtacgacgacccgtcgcagtctgccaacctgctggctgaagcc360
aagaaactgaacgatgcgcaggccccgaaagcggccgcaagcgactacaaggacgacgac420
gacaagctcgagcaccaccaccaccaccactga453
- 还没有人留言评论。精彩留言会获得点赞!