梨质子泵基因PbrVHA-c4及其在调控果肉柠檬酸含量中的应用的制作方法
本发明属于植物基因工程
技术领域:
,具体涉及一个梨质子泵基因pbrvha-c4及其在调控果肉柠檬酸含量中的应用,具体涉及从白梨(pyrusbretschneideri)中克隆得到一个编码v-atpase(vacuolarh+-atpase)c亚基的基因pbrvha-c4,然后将该基因导入番茄中,获得的转基因番茄果实的柠檬酸含量明显提高。
背景技术:
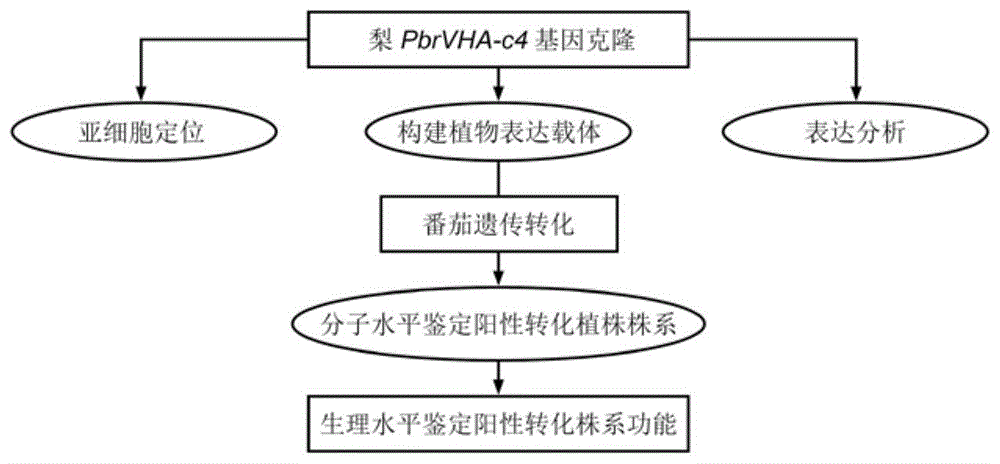
:有机酸在植物生长发育过程中发挥着关键的作用,他们参与植物体内的多种代谢,并能响应各类胁迫。不同的植物中,有机酸组分和含量也各不相同。在果树中,有机酸的种类和含量主导着果实的风味,而风味又是果实重要的品质性状之一。霍月清等(2009)对70个砂梨品种进行测定,结果显示,砂梨品种中存在苹果酸型和柠檬酸型两种类型。柠檬酸作为梨果实中主要的有机酸之一,对梨果实的风味品质的形成起非常重要的作用。在果树的生长发育过程中,有机酸通常在幼果期积累,随着果实的发育,呈现降低的趋势(chenetal.,2009)。在果实早期发育过程中,柠檬酸在细胞质中合成后,除了部分参与细胞的代谢进程之外,大多贮藏在液泡中(baldwinetal.,1993;maetal.,2019);当果实逐渐成熟时,代谢进程和呼吸作用逐渐增强,液泡中的柠檬酸又被释放出来,参与果实成熟过程中的代谢作用(cercósetal.,2006)。液泡作为植物细胞中一个非常重要的细胞器,是有机酸等次生代谢物的贮藏场所。在植物生长发育过程中,大量的有机酸合成后被运送到液泡中贮存。液泡膜上存在着多种运输蛋白或通道,负责有机酸的跨膜运输,但这些转运蛋白或通道是如何将有机酸输送到液泡中的,其机理仍不清楚。有学者认为有机酸跨液泡膜运输的主要方式之一是由液泡膜上的质子泵驱动的(gaxiolaetal.,2007)。液泡膜上存在h+-atp酶(v-atpase)和h+-焦磷酸化酶(v-ppase)两种类型的质子泵。质子泵通过水解atp释放能量,将h+泵入到液泡中,从而形成电化学势梯度,驱动大量的离子和代谢物质流入液泡。前人做了大量的关于液泡质子泵与果实酸度的研究。比如,terrier等(2001)在葡萄发育过程中发现液泡膜质子泵的主动运输与果实酸度的变化相关;yang等(2011)在不同酸度的枇杷果实中鉴定出6个与有机酸积累相关的质子泵基因;yao等(2011)在苹果上分别鉴定出一个v-atpase和一个v-ppase的编码基因,mdvhp1和mdvha-a,发现这两个基因都与苹果中有机酸的积累相关;hu等(2016)也报道了两个苹果质子泵基因mdvha-b1和mdvha-b2能够促进花青苷和苹果酸的积累。另外,müller等(1997)在研究酸柠檬的h+-atpase时发现,柠檬果实中柠檬酸的积累伴随着由v-atpase驱动的大量的质子流入到液泡中。在2002年,他们又发现了相似的结果(mülleretal.,2002)。li等(2016)在柑橘中也发现了液泡膜质子泵编码基因citvha-c4,并鉴定出其与柑橘果实柠檬酸积累相关。以上这些研究都证明了,质子泵与果实有机酸积累相关,尤其是柠檬酸。尽管与果实有机酸积累相关的质子泵编码基因已经在多个植物中被克隆出来,然而,在梨中却少有关于质子泵调控有机酸代谢的报道。技术实现要素:本发明的目的在于提供一个从梨(pyrusbretschneideri)果实中分离克隆出质子泵基因pbrvha-c4。本发明的另一目的是提供该基因在调控植物果实果肉柠檬酸含量中的应用。为实现上述发明目的,本发明通过以下技术方案实现:申请人从梨(pyrusbretschneideri)果实中克隆得到一个质子泵基因pbrvha-c4,其核苷酸序列如序列表seqidno.1所示,其编码的氨基酸序列如序列表seqidno.2所示,它包含501bp的开放阅读框,编码166个氨基酸,等电点为8.62,预测的分子量为16.76kda,含有4个跨膜区域。克隆本发明所述基因pbrvha-c4的cdna序列的引物对,其核苷酸序列如下所示:正向引物(f1):5’-atgtcttcttcaaccttcagcggc-3’(seqidno.3);反向引物(r1):5’-gtcagctcttgactgccccgat-3’(seqidno.4)。含有本发明所述基因pbrvha-c4的重组表达载体;优选的,该重组表达载体是以pbi121为出发载体,将所述质子泵基因pbrvha-c4与载体pbi121连接得到的。含有本发明所述的质子泵基因pbrvha-c4的转基因重组菌;优选的,该转基因重组菌是以根癌农杆菌为宿主菌,将上述的重组表达载体转入根癌农杆菌中得到的。本发明所述质子泵基因pbrvha-c4或所述基因pbrvha-c4编码的蛋白质在提高植物果实果肉柠檬酸含量中的应用。优选的,所述果肉为梨果肉或番茄果肉。本发明还提供了所述的重组表达载体或转基因重组菌在提高植物果实果肉柠檬酸含量中的应用。一种提高果肉柠檬酸含量的方法,该方法包括以下步骤:1)克隆所述质子泵基因pbrvha-c4;2)将所述质子泵基因pbrvha-c4与载体连接获得重组表达载体;3)将所述重组表达载体转入根癌农杆菌中获得重组根癌农杆菌;4)用所述重组根癌农杆菌侵染目标植物(例如番茄或梨)获得稳定遗传过表达梨质子泵基因pbrvha-c4的转基因植物,能够促进目标植物果实果肉中柠檬酸的显著积累。本发明的有益效果:本发明提供的梨质子泵基因pbrvha-c4,具有提高果实柠檬酸含量的功能,能够应用于提高果肉柠檬酸含量。该质子泵基因能够提高柠檬酸含量的机理为利用水解atp酶释放的能量,将h+泵入到液泡中,从而形成电化学势梯度,驱动细胞质中的柠檬酸等次生代谢物质流入液泡贮存,从而增加梨果肉中柠檬酸的含量。根据实施例部分的记载,所述梨质子泵基因pbrvha-c4转入到番茄植株中获得的两个超表达系番茄果肉中柠檬酸含量均明显高于野生型,并且两个超表达系番茄果肉中pbrvha-c4基因的表达模式与柠檬酸含量的变化趋势一致。本发明从分子生物学角度为调控果实有机酸含量提供了新的解决策略。附图说明图1为本发明梨质子泵基因pbrvha-c4功能鉴定的技术流程图;图2为pbrvha-c4基因在梨果实发育过程中基因表达模式与果实中柠檬酸含量变化趋势的关系图;图3为pbrvha-c4基因亚细胞定位示意图;图4为pbrvha-c4基因过表达载体构建示意图;图5为pbrvha-c4基因转化番茄过程示意图;图6为pbrvha-c4基因转化番茄后得到的再生植株pcr鉴定图;其中图6a,为t0代转基因植株的pcr鉴定图;图6b,为t1代转基因植株的pcr鉴定图。图7为t1代转基因株系中pbrvha-c4基因的半定量分析结果图及选定的野生型(wt)和两个超表达株系(oe5-2-3和oe12-4-3);图8为pbrvha-c4基因在野生型(wt)和t1代超表达株系(oe5-2-3和oe12-4-3)番茄果实动态发育过程中表达量分析图;图9为野生型(wt)和t1代超表达株系(oe5-2-3和oe12-4-3)番茄果实发育过程中柠檬酸含量的变化图;图10为在野生型(wt)和t1代超表达株系(oe5-2-3和oe12-4-3)番茄果实动态发育过程中,柠檬酸合成途径中关键酶柠檬酸合成酶(cs)的活性分析图;图11为在野生型(wt)和t1代超表达株系(oe5-2-3和oe12-4-3)番茄果实动态发育过程中,柠檬酸合成途径中关键酶的编码基因cs的表达量分析图。具体实施方式本发明提供了一个梨质子泵基因pbrvha-c4,所述梨质子泵基因pbrvha-c4的序列如seqidno.1所示。本发明中所述的梨质子泵基因pbrvha-c4优选的来源于“砀山酥梨”(pyrusbretschneiderirehdcv.‘dangshansuli’)。本发明中所述的梨质子泵基因pbrvha-c4通过以下方法获得:从砀山酥梨果肉中提取获得砀山酥梨的rna并反转录,以获得第一链cdna;以所述cdna为模板,用正向引物(f1)和反向引物(r1)扩增获得所述梨质子泵基因pbrvha-c4。本发明中所述砀山酥梨的果肉中rna的提取采用本领域常规的植物组织rna提取方法即可,无其他特殊限定,在本发明具体实施过程中采用planttotalrnaisolationkitplus(购自福际生物技术有限公司,成都)进行砀山酥梨果肉的ran提取,按照试剂盒说明书操作。本发明在获得砀山酥梨rna后,反转录获得cdna;在本发明中所述反转录采用本领域常规的方法即可,具体的参照全式金公司的transscriptone-stepgdnaremovalandcdnasynthesissupermix反转录试剂盒说明书进行反转录操作。本发明在获得所述cnda后,以获得的cdna为模板,用正向引物(f1)和反向引物(r1)扩增获得所述梨质子泵基因pbrvha-c4。本发明中所述正向引物(f1)的序列如seqidno.3所示;所述反向引物(r1)的序列如seqidno.4所示。本发明具体实施过程中,所述扩增体系优选的为50μl体系,所述扩增体系包括100ng模板dna,5×q5反应缓冲液(q5reactionbuffer),10mmdntps,1uq5高保真聚合酶(q5high-fidelitydnapolymerase),1.0μm正向引物和1.0μm的反向引物。本发明中所述的5×q5缓冲液和q5高保真聚合酶优选的购自newenglandbiolabs公司。本发明中所述扩增反应优选的在roche480(appliedbiosystem)扩增仪中完成。本发明在扩增获得所述梨质子泵基因pbrvha-c4后,扩增产物经琼脂糖凝胶电泳、回收,经测序确认无误后,获得的序列为所述梨质子泵基因pbrvha-c4的核苷酸序列。本发明还提供了所述梨质子泵基因pbrvha-c4编码的蛋白质;所述蛋白质的氨基酸序列如seqidno.2所示,本发明中所述蛋白为膜定位蛋白,能够提高果肉柠檬酸的含量。本发明还提供了所述的梨质子泵基因pbrvha-c4在提高果肉柠檬酸含量中的应用。所述果肉优选的为梨果肉和番茄果肉。本发明中,当所述梨质子泵基因pbrvha-c4应用于提高番茄果肉中柠檬酸含量时,优选的包括以下步骤:1)以梨果肉cdna为模板,进行扩增获得梨质子泵基因pbrvha-c4;2)将所述梨质子泵基因pbrvha-c4与表达载体连接获得重组表达载体;3)将所述重组表达载体转入根癌农杆菌中获得重组根癌农杆菌;4)将所述重组根癌农杆菌侵染番茄获得过表达梨质子泵基因pbrvha-c4的转基因番茄。在本发明中,步骤1)所述的扩增获得梨质子泵基因pbrvha-c4的具体方法和步骤参见上述获得梨质子泵基因pbrvha-c4的方法,在此不再赘述。本发明在获得所述梨质子泵基因pbrvha-c4后,将所述梨质子泵基因pbrvha-c4与酶切后表达载体连接获得重组表达载体。在本发明中所述表达载体优选的为pbi121载体。在本发明具体实施过程中,所述重组载体的构建方法优选包括以下步骤:以所述梨质子泵基因pbrvha-c4扩增产物为模板进行二次pcr扩增;将所述二次pcr扩增的产物与克隆载体连接,获得重组克隆载体;将所述重组克隆载体进行双酶切,将得到的酶切片段与酶切表达载体连接,获得重组表达载体。在本发明中所述二次pcr扩增的引物优选的包括正向引物(f4)和反向引物(r4);所述正向引物(f4)的序列如seqidno.9所示;所述反向引物(r4)的序列如seqidno.10所示;本发明中所述二次pcr扩增的体系和程序与前述扩增获得梨质子泵基因pbrvha-c4的体系和程序一致。本发明在二次pcr扩增结束后,将所述二次pcr扩增获得的产物与克隆载体连接获得重组克隆载体。在本发明中所述克隆载体优选的为peasy-bluntzero载体;在本发明中所述二次pcr扩增产物与克隆载体连接的方法和参数采用本领域常规的方法和参数即可,无其他特殊要求;在本发明具体实施过程中,可参照全式金公司peasy-bluntzerocloningkit试剂盒说明书进行连接操作。本发明在获得重组克隆载体后,将所述重组克隆载体进行双酶切后获得的酶切片段与酶切表达载体连接获得重组表达载体。在本发明中,所述双酶切所用的内切酶优选的为xbai和kpni;所述双酶切的温度优选的为37℃,所述双酶切的时间优选的为3小时。在本发明中,所述双酶切的体系总体积优选的为50μl,包括克隆重组载体10μl、10×缓冲液5μl、xbai和kpni各2μl、双蒸水21μl。本发明中,所述酶切表达载体由表达载体进行双酶切后获得,所述表达载体的双酶切体系和参数与重组克隆载体一致。本发明中,所述表达载体优选的为pbi121载体。本发明中所述酶切片段与酶切表达载体连接反应体系的总体积优选的为10μl,包括酶切片段6μl、酶切表达载体2μl、10×t4连接缓冲液1μl、t4连接酶1μl;本发明中所述连接的温度优选的为16℃;所述连接的时间优选的为14小时。本发明在获得重组表达载体后,优选的将所述重组表达载体转化大肠杆菌菌株dh5α,并进行菌落pcr测序以验证所述重组表达载体是否构建成功;在本发明中所述菌落pcr测序验证的方法采用本领域常规的菌落pcr测序验证方法。本发明在获得重组表达载体后,将所述重组表达载体转入根癌农杆菌中获得重组根癌农杆菌;在本发明中,所述重组表达载体转入根癌农杆菌的方法优选的为冻融法。本发明中,所述根癌农杆菌优选的为根癌农杆菌gv3101。本发明在获得所述重组根癌农杆菌后,将所述重组根癌农杆菌侵染番茄获得过表达梨质子泵基因pbrvha-c4的番茄。在本发明中,所述重组根癌农杆菌侵染番茄的方法为:用所述重组根癌农杆菌的菌液浸泡侵染番茄子叶后进行共培养,筛选获得过表达梨质子泵基因pbrvha-c4的转基因番茄。本发明将所述重组根癌农杆菌经液体扩大培养后获得菌液,所述菌液的浓度优选的为od600=0.5-1.0。在本发明中所述浸泡侵染的时间优选的为10分钟,所述浸泡侵染过程中伴随震荡;所述震荡的转速或频率为60转/分钟。本发明中所述浸泡侵染时菌液的量优选的为能够完全浸泡番茄子叶。在本发明中,所述共培养的培养基优选的为添加玉米素和as的ms培养基;本发明中所述共培养培养基中as的添加量优选的为80~120mg/l,所述玉米素的添加的量优选的为1.5~2.5mg/l。本发明中所述共培养的时间优选的为2天,所述共培养的温度25℃,所述共培养优选的为暗培养。本发明在所述共培养结束后,优选的进行过表达梨质子泵基因pbrvha-c4的番茄筛选。在本发明中所述筛选优选的利用添加卡那霉素和头孢霉素的固体培养基进行,能够在添加卡那霉素和头孢霉素的固体培养基中生长的番茄即为过表达梨质子泵基因pbrvha-c4的番茄。本发明在获得所述过表达梨质子泵基因pbrvha-c4的番茄后优选的进行所述过表达梨质子泵基因pbrvha-c4番茄的生根培养和移栽。本发明中所述生根培养和移栽采用本领域常规的方法即可。本发明梨质子泵基因pbrvha-c4功能鉴定的技术流程图如图1所示。下面结合实施例对本发明提供的梨质子泵基因pbrvha-c4及其在调控果肉柠檬酸含量中的应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所使用的材料和试剂等,如无特殊说明,均可从商业途径获得。实施例1梨质子泵基因pbrvha-c4克隆及表达分析从“砀山酥梨”果肉中抽提rna并反转录,所得第一链cdna用于扩增pbrvha-c4基因的全长。扩增基因所用引物对为:正向引物(f1):5’-atgtcttcttcaaccttcagcggc-3’(seqidno.3;反向引物(r1):5’-gtcagctcttgactgccccgat-3’(seqidno.4)。50μl的扩增反应体系中包括100ngtemplatedna,5×q5反应缓冲液(q5reactionbuffer),10mmdntps,1uq5高保真聚合酶(q5high-fidelitydnapolymerase),1.0μm正向引物f1,1.0μm反向引物r1,上述缓冲液和q5高保真聚合酶均购自newenglandbiolabs公司。pcr反应在roche480(appliedbiosystem)扩增仪上按以下程序完成:98℃,预变性15秒;98℃,变性10秒、62℃,退火30秒、72℃,延伸1分钟,30个循环;循环完成后,72℃,延伸5分钟。pcr扩增产物,经1%的琼脂糖凝胶电泳后,产生的一条单一的pcr条带,用axyprepdna凝胶回收试剂盒(购自axygen公司,美国)回收特异条带,提取步骤参照使用说明。回收纯化的dna溶液与peasy-bluntzero载体(购自trans公司)进行连接反应(参照使用说明操作),连接反应体系中pbrvha-c4基因回收产物与peasy-bluntzero载体的摩尔比为4:1。连接反应总体积为5μl,包括4μl纯化的pcr回收产物和1μl的peasy-bluntzero载体。室温(20℃~37℃)反应5分钟,反应结束后,将连接产物置于冰上3分钟,然后将5μl连接产物,用热激法(参照《分子克隆实验指南》第三版,科学出版社,2005)转化大肠杆菌dh5α,在含有50mg/l卡那霉素的lb固体平板中筛选阳性克隆,挑取3个单克隆测序。获得如seqidno.1所示的梨质子泵基因pbrvha-c4的核苷酸序列。blastx分析该基因序列与已知的vha-c4(所有已发表的文献)序列,发现克隆出的pbrvha-c4基因的氨基酸序列与多个物种的pbrvha-c4基因同源(包括:拟南芥atvha-c4和番茄slvha-c4)。为分析pbrvha-c4基因是否与梨果肉内柠檬酸代谢相关。测定了梨果实动态发育过程中5个时期的苹果酸含量,并采用实时荧光定量pcr,引物对为正向引物(f2):5’-cggacttatcatcgccgtcat-3’(seqidno:5);反向引物(r2):5’-tcagaccgtacagagcaagc-3’(seqidno:6)分析了pbrvha-c4基因在对应时期的表达。实时荧光定量pcr在roche480ⅱpcr仪上进行。20μl实时荧光定量pcr体系如下:syrb荧光染料10μl(购自roche公司)、300ngcdna1μl、上述上/下游引物各1μl和rnase-free水7μl;反应程序如下:95℃,预变性5分钟,95℃,变性10秒、60℃,10秒、72℃,延伸30秒、40个循环,循环完成后,72℃,再延伸10分钟。结果如图2所示,在梨果实发育过程中的15daf(盛花期后)至90daf时期,梨果实果肉的柠檬酸含量先降再升,在90daf时期达到最大值,在90daf至120daf成熟前时柠檬酸含量又呈下降趋势。在梨果实发育过程中,梨质子泵基因pbrvha-c4的表达模式与果肉内柠檬酸含量的变化趋势一致,因此说明pbrvha-c4基因与柠檬酸代谢具有相关性。实施例2梨质子泵基因pbrvha-c4基因亚细胞定位本实施例利用拟南芥原生质体来研究pbrvha-c4基因的亚细胞定位。利用pcr扩增出pbrvha-c4基因整个开放阅读框序列。在其扩增引物两端分别加上xbai和bamhi两个酶切位点,扩增引物对为,正向引物(f3):5’-gctctagaatgtcttcttcaaccttcagcggc-3’(seqidno:7);反向引物(r3):5’-ggggatccgtcagctcttgactgccccgat-3’(seqidno:8)。50μl的扩增体系中包括100ngtemplatedna,5×q5反应缓冲液(q5reactionbuffer),10mmdntps,1uq5高保真聚合酶(q5high-fidelitydnapolymerase)(上述缓冲液和q5高保真聚合酶均购自newenglandbiolabs公司),1.0μm上述引物。pcr反应在roche480(appliedbiosystem)扩增仪上按以下程序完成:98℃,预变性15秒;98℃,变性10秒、60℃,退火30秒、72℃,延伸1分钟,30个循环;循环完成后,72℃,再延伸5分钟。首先将扩增产物装在peasy-bluntzero载体上,从而得到一个peasy-bluntzero-pbrvha-c4重组载体。同时用xbai和bamhi双酶切peasy-bluntzero-pbrvha-c4和35s-yfp载体,回收产物并连接,从而得到35s-pbrvha-c4-yfp重组载体;同时利用同样的方法构建拟南芥液泡膜内在通道蛋白(tip)(isayenkovetal.,2011)与35s-cfp的重组载体35s-tip-cfp,并将35s-pbrvha-c4-yfp、35s-tip-cfp及空载对照35s-cfp和35s-yfp分别转入农杆菌gv3101。利用拟南芥原生质体进行亚细胞定位的步骤如下:(1)划平板,挑单克隆(含有重组质粒的农杆菌)于5mlyeb培养基(含卡那霉素40μg/ml,利福平25mg/l),28℃震荡培养24小时以上,至od600约为0.6。(2)按体积比为1:1000比例,接种100μl上述农杆菌菌液于100mlyeb培养基(含卡那霉素40μg/ml,利福平25mg/l)中,28℃震荡培养12-24小时。(3)利用质粒大量提取纯化试剂盒(购自威格拉斯生物技术有限公司,北京)大提质粒并纯化,提取步骤参照使用说明。提取完成的高浓度质粒调整浓度约1μg/μl,保存于-80℃超低温冰箱。(4)用刀片将短日照条件下生长3-4周的拟南芥叶片沿主叶脉垂直方向一次性切割成1-1.5mm左右的条状,并立即置于10ml酶解液(含1.5%g/ml纤维素酶、0.4%g/ml果胶酶、0.1%g/mlbsa、20mmmes、10mmcacl2、20mmkcl、0.4m甘露醇)中,然后避光条件下酶解4-5小时。用干净的75μm孔隙的尼龙过滤网过滤酶解液中的叶片残渣,收集原生质体于10ml的圆底无菌管中。(5)室温,80-100转/分钟,离心10分钟(离心机的加/减速均为1)。(6)弃上清,加入5ml现配的w5溶液(含2mmmes、154mmnacl、125mmcacl2、5mmkcl),轻轻混匀。(7)室温,80-100转/分钟,离心3分钟(离心机的加/减速均为1)。(8)弃上清,加入2mlmamg溶液(含0.4m甘露醇、100mmmgcl2、4mmmes)。(9)重复步骤(7)。(10)弃上清,加入1mlmamg溶液悬浮沉淀,轻轻地摇匀,避光置于冰上30分钟。(11)重复步骤(7)。(12)弃上清,加入1mlmamg溶液悬浮沉淀,轻轻地摇匀,并将原生质体分装至10ml离心管中(每管100μl)。(13)将10μl的35s-pbrvha-c4-yfp和10μl35s-tip-cfp高浓度质粒混合加入到分装的原生质体中,并加入等体积的40%(m/v,g/ml)peg4000,充分混匀,室温放置20分钟。(14)加入3mlw5溶液,将(13)中混合液悬浮,混匀,室温,80-100转/分钟,离心10分钟(离心机的加/减速均为1)。(15)弃上清,加入1mlw5溶液悬浮沉淀,25℃,暗培养16小时后,用激光共聚焦显微镜(zeiss,lsm-800)观察报告基因定位情况。结果如图3所示,其中图3a-c,分别为cfp基因(空载对照)分别在暗场(a)、明场(b)、叶绿体(c)下的成像,d图为三者叠加后的成像;图3e-g,分别为yfp基因(空载对照)分别在暗场(e)、明场(f)、叶绿体(g)下的成像,h图为三者叠加后的成像;图3i-l是混合质粒在激光共聚焦显微镜下的图像,其中i是pbrvha-c4在暗场下的图像、j是混合质粒在明场下的图像、k是液泡膜内在通道蛋白在暗场下的成像,l图为三者叠加后的成像。由图3可知,空载对照载体整个细胞中均有荧光(图3a-h),而重组载体35s-pbrvha-c4-yfp转化的细胞中只能在液泡膜上检测到荧光(图3i),并与液泡膜内在通道蛋白发出的荧光位置重合(图3k),说明梨质子泵基因pbrvha-c4编码的蛋白是一个定位于液泡膜上的蛋白。实施例3构建梨质子泵基因pbrvha-c4的植物超表达载体根据pbi121载体的多克隆位点和pbrvha-c4基因的编码区序列上的酶切位点分析,选择xbai和kpni作为内切酶。首先将以pbrvha-c4基因的克隆子为模板进行pcr扩增,扩增引物对为,正向引物(f4):5’-gctctagaatgtcttcttcaaccttcagcggc-3’(seqidno:9);反向引物(r4):5’-ggggtaccgtcagctcttgactgccccgat-3’(seqidno:10),再将pcr产物连接到peasy-bluntzero载体上,从而构建一个重组载体peasy-bluntzero-pbrvha-c4。将上述重组载体在37℃下进行双酶切,双酶切体系总体积为40μl,其中含有peasy-bluntzero-pbrvha-c4质粒10μl、10×缓冲液5μl、xbai和kpni各2μl、双蒸水21μl,酶切3~4小时后纯化回收。pbi121载体双酶切体系同上。连接反应体系总体积为10μl,其中pbrvha-c4基因与载体pbi121体积分别为6μl和2μl、10×t4连接缓冲液1μl、t4连接酶1μl,16℃连接14-16小时。连接产物转化大肠杆菌菌株dh5α,在含有100mg/l卡那霉素的lb固体平板上筛选,挑单克隆进行pcr检测,pcr检测体系为20μl,包括pcrmastermix(2x)(购自thermo公司)10μl,正向引物(f4)/反向引物(r4)各1μl,菌液模板1μl,无菌水7μl;反应程序为98℃,预变性15秒;98℃,变性10秒、60℃,退火30秒、72℃,延伸1分钟,30个循环;循环完成后,72℃,再延伸5分钟。呈阳性的单克隆抽提质粒进行双酶切并测序,用axyprep质粒提取试剂盒(购自axygen公司,美国)抽提质粒,操作步骤按照试剂盒使用说明书。测序确定阅读框碱基无突变后,即表示pbi121-pbrvha-c4超表达载体构建成功。构建载体过程示意图见图4。应用冻融法将pbi121-pbrvha-c4重组载体导入到根癌农杆菌gv3101中并保存。实施例4番茄遗传转化及转基因植株的阳性鉴定根癌农杆菌介导番茄的遗传转化过程参照王保全博士毕业论文(2012),如图5所示,具体步骤如下:a)播种番茄种子:先用70%乙醇处理番茄种子30秒,然后用无菌水洗涤3遍,再用2.5%次氯酸钠处理5分钟,最后用无菌水洗涤4遍,将种子置于萌发培养基上。b)预培养:取在萌发培养基上播种10-15天后的番茄苗,将子叶切下并四周划伤,切好的子叶置于预培养培养基上(子叶正面朝上),25℃暗培养24小时。c)根癌农杆菌培养:取超低温冰箱中保存的根癌农杆菌菌液,在含有50mg/l卡那霉素和100mg/l利福平的lb固体平板上划线。d)菌液的制备:刮取步骤c)中的划线菌落,加入ms液体培养基中,28℃,200转/分钟振荡培养,待菌液浓度od600介于0.6-1.0时则可进行侵染。e)侵染:将预培养后的子叶置于步骤d)中的根癌农杆菌菌液中,浸泡侵染10分钟,期间不断轻微震荡。f)共培养:将侵染后的番茄子叶,在无菌滤纸上吸干表面的菌液,然后接种于共培养基上(子叶正面朝上),25℃暗培养2天。g)筛选培养:经共培养2天后的番茄子叶,用含有500mg/l的头孢霉素溶液洗1遍,然后无菌水清洗3-5次,再转移到添加了100mg/l卡那霉素和500mg/l头孢霉素的固体培养基上进行愈伤生长。h)生根培养:待筛选培养基上的不定芽长到1-2cm时,切下并转入添加了100mg/l卡那霉素和500mg/l头孢霉素的生根培养基上。i)番茄苗移栽入土:待生根后的转化苗长满培养瓶后,开盖炼苗3天,然后从生根培养基取出,移栽到灭菌后营养土中。j)转基因番茄阳性苗的分子鉴定:将得到的番茄抗性植株,取适量叶片提取dna,用植物基因组dna提取试剂盒(购自天根生化科技有限公司,北京)提取。操作步骤参照试剂盒说明书。然后以上述提取的dna为模板,用引物对(正向引物(f2),反向引物(r2))进行pcr扩增鉴定阳性苗(图6a)。鉴定为可能的阳性植株独立收获种子(t0代)。将收获的种子再次播种并鉴定阳性苗(t1代)(图6b)。收获t1代阳性转基因番茄的果实作为后续试验的样品。同时收取野生型的番茄果实作为样品保存。从盛花期后,每隔10天采一次样,直至果实变红成熟。番茄遗传转化所用培养基见表1。表1番茄遗传转化所用固体培养基配方培养基名称组分及含量(均含有30g/l蔗糖+8g/l琼脂粉,ph=5.8)萌发培养基1/2ms培养基预培养培养基ms基本培养基+2.0mg/l玉米素共培养培养基预培养培养基+100mg/las筛选培养基预培养培养基+100mg/l卡那霉素+500mg/l头孢霉素生根培养基1/2ms培养基+2.0mg/liba+100mg/l卡那霉素+200mg/l头孢霉素实施例5半定量rt-pcr检测pbrvha-c4基因的超表达1.将实施例4得到的转化番茄和野生番茄果实的rna,使用trizol试剂盒进行提取,其步骤如下:(1)研钵预冷:研钵用0.5mnaoh浸泡10分钟,再用灭菌depc水洗3-4次,加液氮预冷;(2)称重1g果实于预冷的研钵中,液氮研磨后,加1mltrizol混匀。(3)4℃,12000转/分钟,离心15分钟,取上清,加200μl氯仿,用力摇15秒,孵育2分钟,4℃,12000转/分钟,离心15分钟。(4)取上清,加500μl异丙醇,孵育10分钟。4℃,12000转/分钟,离心10分钟。(5)弃上清,加1ml75%的酒精(用灭菌depc水配),轻轻摇晃混匀。4℃,7200转/分钟,离心5分钟。(6)弃上清,风干,沉淀用30-50μldepc水溶解,取1-2μl检测rna的浓度和质量。-80℃保存。2.将rna反转录成cdna,转基因番茄外源基因表达量采用半定量pcr分析,所用引物对为特异引物(正向引物(f2),反向引物(r2)),反应程序为98℃,预变性30秒;94℃,变性10秒、62℃,退火30秒、72℃,延伸1分钟,30个循环;72℃,再延伸5分钟。用actin做内参基因,引物序列为:正向引物actin-f:5'-caatgtgcctgccatgtatg-3’(seqidno:11)';反向引物actin-r:5'-ccagcagcttccattccaat-3'(seqidno:12)。结果如图7所示,在筛选出的8个t1代转基因株系中,综合考虑转基因植株的生长表型与pbrvha-c4基因的表达水平,最终选择超表达株系oe5-2-3和oe12-4-3这两个转基因株系用于进一步生理功能评价。实施例6转基因番茄果实的生理功能评价采用实时荧光定量方法,对两个超表达株系oe5-2-3、oe12-4-3以及野生型(wt)番茄果实动态发育过程中pbrvha-c4基因的表达模式进行分析(图8),同时测定各对应时期番茄果实中柠檬酸的含量(图9)。结果表明,在番茄果实动态发育过程中,oe5-2-3和oe12-4-3这两个超表达株系的pbrvha-c4基因的表达水平都显著高于野生型,同时两个超表达系番茄果实中柠檬酸含量也明显高于野生型,并且pbrvha-c4基因的表达模式与苹果酸含量的变化趋势一致。可见,超表达pbrvha-c4基因可能能够促进果实中柠檬酸的积累。为了进一步证明pbrvha-c4基因与果实中柠檬酸的积累的关系。本实施例测定了番茄果实动态发育过程中,与柠檬酸合成密切相关的酶柠檬酸合成酶(citratesynthase,cs)的酶活(图10),并对编码柠檬酸合成酶的关键基因(cs)进行了表达模式分析(图11)。结果显示,尽管在转基因番茄果实中,柠檬酸合成酶的活性比野生型高;但结合其对应编码基因的表达模式可知,在番茄果实动态发育过程中,柠檬酸合成酶的活性并非由其编码基因所调控。综合以上结论可知,在转基因番茄果实动态发育过程中,cs基因与番茄果实中柠檬酸的积累无相关性,从而验证了超表达pbrvha-c4基因能够促进果实中柠檬酸的积累的结论。由上述实施例可知,本发明提供的梨质子泵基因pbrvha-c4,具有提高果实柠檬酸含量的功能,能够应用于提高果肉柠檬酸含量。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。参考文献[1]霍月清,胡红菊,彭抒昂等.砂梨品种资源有机酸含量及发育期变化[j].中国农业大学,2009,42(1):216–223.[2]黄培堂.分子克隆实验指南(第三版).科学出版社,2005.[3]王保全.桃ppers1、ppadc基因克隆、鉴定及ptadc转基因功能分析[d].华中农业大学,2012.[4]baldwine.a.citrusfruit.in:seymourg.b.,taylorj.e.,tuckerg.a.(eds).biochemistryoffruitripening,1993,pp:107–149.[5]cercósm.,solerg.,iglesiasd.,gadeaj.,formentj.,talónm.globalanalysisofgeneexpressionduringdevelopmentandripeningofcitrusfruitflesh.aproposedmechanismforcitricacidutilization[j].plantmolecularbiology,2006,62:513–527.[6]chenf.x.,liux.h.,chenl.s.developmentalchangesinpulporganicacidconcentrationandactivitiesofacid-metabolizingenzymesduringthefruitdevelopmentoftwoloquat(eriobotryajaponicalindl.)cultivarsdifferinginfruitacidity[j].foodchemistry,2009,114:657–664.[7]gaxiolar.a.,palmgrenm.g.,karins.plantprotonpumps[j].febsletters,2007,581(12):2204–2214.[8]hud.g.,sunc.h.,maq.j.,youc.x.,chengl.,haoy.j.mdmyb1regulatesanthocyaninandmalateaccumulationbydirectlyfacilitatingtheirtransportintovacuolesinapples[j].plantphysiology,2016,170:1315–1330.[9]isayenkovs.,isnerj.c.,maathuisf.j.ricetwo-porek+channelsareexpressedindifferenttypesofvacuoles.theplantcell,2011,23,756–768.[10]lis.j.,yinx.r.,xiex.l.,allana.c.,geh.,shens.l.,chenk.s.thecitrustranscriptionfactor,citerf13,regulatescitricacidaccumulationviaaprotein-proteininteractionwiththevacuolarprotonpump,citvha-c4[j].scientificreport,2016,6,20151.[11]mab.q.,liaol.,fangt.,pengq.,ogutuc.,zhouh.,maf.w.,hany.p.ama10geneencodingp-typeatpaseisinvolvedinfruitorganicacidaccumulationinapple[j].plantbiotechnologyjournal,2019,17:674-686.[12]müllerm.l.,irkenskieseckeru.,kramerd.,taizl.purificationandreconstitutionofthevacuolarh+-atpasesfromlemonfruitsandepicotyls[j].journalofmembranebiology,1997,272:12762–12770.[13]mullerm.l.,taizl.regulationofthelemon-fruitv-atpasebyvariablestoichiometryandorganicacids[j].journalofmembranebiology,2002,185(3):209–220。[14]terriern.,sauvagef.x.,ageoragesa.etal.changesinacidityandinprotontransportatthetonoplastofgrapeberriesduringdevelopment[j].planta,2001,213(1):20–28.[15]yaoy.x.,dongq.l.,youc.x.etal.expressionanalysisandfunctionalcharacterizationofapplemdvhp1generevealsitsinvolvementinna+,malateandsolublesugaraccumulation[j].plantphysiologyandbiochemistry,2011,49(10):1201–1208.[16]yangl.t.,xiec.y.,jiangh.x.etal.expressionofsixmalate-relatedgenesinpulpduringthefruitdevelopmentoftwoloquats(eriobotryajaponica)cultivarsdifferinginfruitacidity[j].africanjournalofbiotechnology,2011,10(13):2414–2422.序列表<110>南京农业大学<120>梨质子泵基因pbrvha-c4及其在调控果肉柠檬酸含量中的应用<160>12<170>siposequencelisting1.0<210>1<211>501<212>dna<213>砀山酥梨(pyrusbretschneiderirehdcv.‘dangshansuli’)<400>1atgtcttcttcaaccttcagcggcgatgaaacggcaccgttcttcgggttccttggcgcc60gccgcggccctcgttttctcctgcatgggagctgcgtacgggacggcgaagagcggagta120ggagtggcgtcgatgggtgtgatgaggccggagctggtgatgaagtcgatcgtgccggtg180gttatggcgggagtgttgggtatttacggacttatcatcgccgtcatcatcagtaccggt240atcaaccccaaggccaaaccctattaccttttcgatggctatgctcatctttcctctggt300ctagcttgtggccttgctggtctttctgccggtatggctatcggcattgtcggtgatgcc360ggtgttagagccaatgcacaacagccaaagcttttcgttgggatgatcctcattctcatt420ttcgccgaagcgcttgctctgtacggtctgattgttggtatcattctctcttcccgatcg480gggcagtcaagagctgactag501<210>2<211>166<212>prt<213>砀山酥梨(pyrusbretschneiderirehdcv.‘dangshansuli’)<400>2metserserserthrpheserglyaspgluthralaprophephegly151015pheleuglyalaalaalaalaleuvalphesercysmetglyalaala202530tyrglythralalysserglyvalglyvalalasermetglyvalmet354045argprogluleuvalmetlysserilevalprovalvalmetalagly505560valleuglyiletyrglyleuileilealavalileileserthrgly65707580ileasnprolysalalysprotyrtyrleupheaspglytyralahis859095leuserserglyleualacysglyleualaglyleuseralaglymet100105110alaileglyilevalglyaspalaglyvalargalaasnalaglngln115120125prolysleuphevalglymetileleuileleuilephealagluala130135140leualaleutyrglyleuilevalglyileileleuserserargser145150155160glyglnserargalaasp165<210>3<211>24<212>dna<213>人工序列(artificialsequence)<400>3atgtcttcttcaaccttcagcggc24<210>4<211>22<212>dna<213>人工序列(artificialsequence)<400>4gtcagctcttgactgccccgat22<210>5<211>21<212>dna<213>人工序列(artificialsequence)<400>5cggacttatcatcgccgtcat21<210>6<211>20<212>dna<213>人工序列(artificialsequence)<400>6tcagaccgtacagagcaagc20<210>7<211>32<212>dna<213>人工序列(artificialsequence)<400>7gctctagaatgtcttcttcaaccttcagcggc32<210>8<211>30<212>dna<213>人工序列(artificialsequence)<400>8ggggatccgtcagctcttgactgccccgat30<210>9<211>32<212>dna<213>人工序列(artificialsequence)<400>9gctctagaatgtcttcttcaaccttcagcggc32<210>10<211>30<212>dna<213>人工序列(artificialsequence)<400>10ggggtaccgtcagctcttgactgccccgat30<210>11<211>20<212>dna<213>人工序列(artificialsequence)<400>11caatgtgcctgccatgtatg20<210>12<211>20<212>dna<213>人工序列(artificialsequence)<400>12ccagcagcttccattccaat20当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1