一种多功能近红外荧光探针及其制备方法和应用与流程
本发明涉及有机探针分子技术领域,具体涉及一种多功能近红外荧光探针及其制备方法和应用。
背景技术:
硫醇(即,含巯基的化合物)在生命系统中起到非常重要的作用,例如,谷胱甘肽(gsh)可以维持细胞内的氧化还原、细胞内的信号转换等,半胱氨酸(cys)可以作为细胞外的还原剂,合成蛋白质的决定性底物等。某些硫醇的水平与许多疾病(如牛皮癣、肝脏损伤、艾滋病)和癌症有直接关联。
细胞内的ph在酶活性、细胞增殖和调亡、抗药性、离子传输、细胞内吞作用以及肌肉收缩等一系列组织活动中起着至关重要的作用。例如,肿瘤发生时细胞内ph会发生变化。细胞功能和ph值的这种微妙关系意味着只要能掌握细胞内ph值的变化就可以为相关的生理和病理过程研究提供重要的信息。
相对于其他检测方法,使用荧光探针法进行ph检测或硫醇的检测具有灵敏度高、选择性好等优点,但目前大部分ph探针或硫醇的波长较短,不能避开组织自吸收和自荧光,背景干扰较强,部分stocks位移小,紫外吸收波谱和荧光光谱重叠较大,信噪比低,毒性较大,不能用于细胞和活体ph检测。而近红外荧光探针的最大吸收波长和发射波长为600~900nm,可避免背景干扰。因此,近红外荧光检测在生物样品分析中有明显的优越性。
目前既可以检测硫醇,又可检测ph的近红外荧光探针的报道非常少。因此,设计合成具有大的stokes位移、背景干扰少的多功能荧光探针具有非常重要的意义。
技术实现要素:
有鉴于此,本发明提供了一种多功能近红外荧光探针及其制备方法和应用。该探针的最大发射波长在765nm,能有效避开组织的自吸收和自发荧光,最大激发为540nm,stocks位移高达225nm,背景干扰少、信噪比较高,该探针对硫醇有较高的灵敏度、高选择性,另外,该探针还可在两个不同激发波长下测定荧光强度比率,可以减少或消除其他测试参数或系统误差对硫醇的荧光检测准确度的干扰。同时,该探针的pka为6.4,探针的毒性低,对细胞和活体伤害较小,很适合用来进行肿瘤细胞的ph检测,所述多功能近红外荧光探针为双响应型探针,能同时实现对ph值和硫醇的检测。
本发明第一方面提供了一种多功能近红外荧光探针,其化学结构式如式(ⅰ)所示:
式(ⅰ)中,x1为-s-或-se-,r'为c1-12的亚烷基,x2为-c(ch3)2-、-o-、-s-或-se-,r1和r2分别独立地选自h原子、c1-18烷基或如so3r9所示的基团,其中,r9为c1-18烷基或苄基,r3和r4分别独立地选自c1-18烷基或苄基,r5、r6、r7和r8分别独立地选自c1-18烷基或含有f、cl、br、i、o和s中的至少一种的c1-18烷基,y1和y2分别独立地选自f、cl、br或i。
本发明中,所述y1与所述y2可以相同,也可以不同。
优选地,所述x1为-s-。
优选地,所述r'为-ch2ch2-。
优选地,所述x2为-c(ch3)2-。
优选地,所述y1为i。
优选地,所述r1和所述r2均为h原子。
优选地,所述r3和所述r4均为乙基。
优选地,所述r5、r6、r7和r8均为乙基。
优选地,所述y2为cl。
进一步优选地,所述x1为-s-,所述r'为-ch2ch2-,所述x2为-c(ch3)2-,所述y1为i,所述r1和所述r2均为h原子,所述r3、所述r4、所述r5、所述r6、所述r7和所述r8均为乙基。
本发明中所述多功能近红外荧光探针,基于fret(荧光共振能量转移)机理,将吸收光谱和发射光谱有一定重叠的花菁类荧光染料
该探针中的二硫键或二硒键可以作为硫醇分子的反应位点,当在硫醇分子存在下,硫醇会与之发生基团交换反应导致二硫键或二硒键断裂导致fret过程终断,从而使该探针分子的荧光光谱发生改变,以实现选择性地检测硫醇。另外,在硫醇分子存在下,该探针在最大荧光发射波长765nm和荧光发射波长为575nm左右的两处荧光强度发生改变,可以作为一个比率型探针以实现检测硫醇,并能减少以及消除几种决定因素的变化对测量荧光强度的影响,包括探针浓度、激发光的光路长度、激发强度等;可消除的人工假象包括光漂白、探针渗漏、细胞厚度、探针在细胞内(区室化作用引起)或不同细胞群之间(负载效率差异造成)的不均匀分布等,提高检测的准确度。
此外,所述探针在碱性条件下,该探针分子内与花菁类荧光染料相连的连接体上的n原子未被质子化,相应氮原子上存在的孤对电子可以发生光致电子转移(pet)而猝灭花菁荧光团的荧光,该探针没有荧光或显示很弱的荧光,当ph降低时,所述氮原子逐渐被质子化,pet逐渐被阻断,对花菁荧光团的荧光猝灭作用逐渐减弱,该探针逐渐表现出花菁类染料的荧光。在ph为6-8,在花菁类染料的激发波长下,探针的荧光强度随着ph的降低而逐渐增强,以实现对ph的检测。另外,所述近红外荧光探针pka为6.4,很适合用来进行肿瘤的检测。
本发明第一方面提供的所述多功能近红外荧光探针的最大发射波长在765nm,能有效避开组织的自吸收和自发荧光,最大激发为540nm,stocks位移高达225nm,背景干扰少、信噪比较高,该探针对硫醇有较高的灵敏度、高选择性,另外,该探针还可在两个不同激发波长下测定荧光强度比率,可以减少或消除其他测试参数或系统误差对硫醇的荧光检测准确度的干扰。同时,该探针的pka为6.4,探针的毒性低,对细胞和活体伤害较小,很适合用来进行肿瘤细胞的ph检测。所述多功能近红外荧光探针为双响应型探针,能同时实现对ph值和硫醇的检测。该探针还可进行光声成像和光动力治疗,是一个集多模态成像、诊断-治疗为一体的多功能探针。
本发明第二方面提供了一种多功能近红外荧光探针的制备方法,包括以下步骤:
(1)取化学结构式如式(ⅱ)所示的化合物,以及如式(ⅲ)所示化合物的盐酸盐或其硫酸盐,
将如式(ⅱ)所示的化合物与如式(ⅲ)所示化合物的盐酸盐或其硫酸盐按照摩尔比为1:(1-3)的比例溶解在第一溶剂中,再加入缚酸剂,保护气体氛围下,在30-75℃下反应4-10h,提纯后得到第一化合物,所述第一化合物的化学结构式如式(ⅰ)所示:
式(ⅰ)、式(ⅲ)和式(ⅰ)中,x1为-s-或-se-,r'为c1-12的亚烷基,x2为-c(ch3)2-、-o-、-s-或-se-,r1和r2分别独立地选自h原子、c1-18烷基或如so3r9所示的基团,其中,r9为c1-18烷基或苄基,r3和r4分别独立地选自c1-18烷基或苄基,y1为f、cl、br或i;
(2)提供化学结构式如式(ⅳ)所示的化合物,
取所述第一化合物溶于第二溶剂,并加入活化剂、缩合剂,并加入如式(ⅳ)所示的化合物,在30-80℃下进行酰胺化反应4-10h,提纯后得到多功能近红外荧光探针,其中,所述第一化合物与所述式(ⅳ)所示的化合物的摩尔比为1:(1-2),所述多功能近红外荧光探针的化学结构式如式(ⅰ)所示:
式(ⅰ)中,x1为-s-或-se-,r'为c1-12的亚烷基,x2为-c(ch3)2-、-o-、-s-或-se-,r1和r2分别独立地选自h原子、c1-18烷基或如so3r9所示的基团,其中,r9为c1-18烷基或苄基,r3和r4分别独立地选自c1-18烷基或苄基,r5、r6、r7和r8分别独立地选自c1-18烷基或含有f、cl、br、i、o和s中的至少一种的c1-18烷基,y1和y2分别独立地选自f、cl、br或i。
优选地,所述x1为-s-。
优选地,所述r'为-ch2ch2-。
优选地,所述x2为-c(ch3)2-。
优选地,所述y1为i。
优选地,所述r1和所述r2均为h原子。
优选地,所述r3和所述r4均为乙基。
优选地,所述r5、r6、r7和r8均为乙基。
优选地,所述y2为cl。
进一步优选地,所述x1为-s-,所述r'为-ch2ch2-,所述x2为-c(ch3)2-,所述y1为i,所述r1和所述r2均为h原子,所述r3、所述r4、所述r5、所述r6、所述r7和所述r8均为乙基。
本发明中,所述如式(ⅲ)所示化合物的盐酸盐或其硫酸盐,为如式(ⅲ)所示化合物的盐酸盐形式,或如式(ⅲ)所示化合物的硫酸盐形式。举例来说,当式(ⅲ)中,所述x1为-s-,所述r'为-ch2ch2-时,式(ⅲ)所示化合物的盐酸盐形式为
优选地,所述将如式(ⅱ)所示的化合物与如式(ⅲ)所示化合物的盐酸盐或其硫酸盐按照摩尔比为1:(1-3)的比例溶解在第一溶剂中,再加入缚酸剂,具体为:
将所述式(ⅲ)所示化合物的盐酸盐或其硫酸盐和缚酸剂溶解在第一溶剂中,得到第一混合溶液,将所述式(ⅱ)所示的化合物溶解在第一溶剂中,得到第二混合溶液,然后将所述第二混合溶液逐滴加入到第一混合溶液中。
优选地,所述第一溶剂为n,n-二甲基甲酰胺(dmf)、乙腈和甲醇的一种或多种。
优选地,所述缚酸剂为三乙胺、n,n-二异丙基乙胺(dipea)或吡啶。
优选地,步骤(1)中,所述缚酸剂与所述化学结构式如式(ⅱ)的化合物的摩尔比为(2-6):1。
优选地,所述保护气体为氮气、氩气或氦气。
优选地,所述提纯的方法为:反应结束后,将反应后的反应液旋蒸除去溶剂,并再加入二氯甲烷,采用湿法过硅胶柱,用二氯甲烷和甲醇的混合溶液进行梯度洗脱,除去溶剂,即得所述多功能近红外荧光探针。
优选地,步骤(2)中,所述活化剂包括n-羟基琥珀酰亚胺(简称为nhs)、n-羟基硫代琥珀酰亚胺和1-羟基苯并三氮唑(hobt)中的任意一种。
优选地,步骤(2)中,所述缩合剂包括n,n-二环己基碳二酰亚胺(简称dcc)、n,n-二异丙基碳二亚胺(简称dic)和1-乙基-(3-二甲基氨基丙基)碳二酰亚胺盐酸盐(简称edc)中的任意一种。
如本发明所述的,所述活化剂又可称为催化剂,常与所述缩合剂联用,用于酰胺的合成。羧酸化合物与碳二亚胺类缩合剂的加成中间体并不稳定,若不用酰化催化剂转化为相应的活化酯或活性酰胺,则会通过自身重排形成副产物。
更优选地,所述活化剂包括n-羟基琥珀酰亚胺(简称为nhs)。
更优选地,所述缩合剂包括n,n-二环己基碳二酰亚胺(简称dcc)。
优选地,所述第二溶剂包括二氯甲烷、乙腈和甲醇中的一种或多种。
本发明第二方面提供的一种多功能近红外荧光探针的制备方法,该制备方法简单易操作,可以得到集荧光成像、光声成像为一体、对ph和硫醇分子均有响应的多功能近红外探针。
本发明第三方面提供了第一方面所述的多功能近红外荧光探针在检测硫醇和检测ph中的应用。
所述多功能近红外荧光探针内存在fret效应而表现出荧光,其最大发射波长在765nm,能有效避开组织的自吸收和自发荧光,最大激发为540nm,stocks位移高达225nm,在荧光成像和光声成像模式下的背景干扰少、信噪比较高。
在硫醇分子存在下,该探针内的fret效应被破坏,导致探针的荧光光谱发生改变,可以作为比率型探针实现对硫醇的选择性检测。
本发明中,所述硫醇包括含巯基的化合物,如谷胱甘肽,半胱氨酸,二硫苏糖醇和苯硫酚中的一种或多种,但不限于此。
另外,该探针的pka为6.4,对ph也有响应,很适合用来进行肿瘤细胞的ph检测。
所述多功能近红外荧光探针的毒性低,对细胞和活体伤害较小,可以制备成检测硫醇和检测ph的药物,以用于细胞内硫醇和ph的检测。
本发明第四方面提供了第一方面所述的多功能近红外荧光探针制备肿瘤光动力治疗药物中的应用。
所述多功能近红外荧光探针还具有光声和光动力效果,可以对小鼠体内肿瘤进行光声成像和光动力治疗,是一个集多模态成像、诊断-治疗为一体的多功能探针。
综上,本发明所述的多功能近红外荧光探针可用于制备肿瘤检测、诊断、治疗或诊疗的药物。所述药物中,除包括所述多功能近红外荧光探针外,还可以包括其他能用于肿瘤检测、治疗或诊疗的药物。
综上,本发明提供的一种多功能近红外荧光探针及其制备方法和应用的有益效果包括以下几个方面:
(1)所述多功能近红外荧光探针的激发、发射波长均在近红外区,对细胞或组织的穿透力强,样本损伤小,该探针的stocks位移大,对硫醇和ph均有响应,在成像应用中的背景干扰小,信噪比较高;
(2)所述多功能近红外荧光探针的制备方法简单易操作;
(3)所述多功能近红外荧光探针在用于检测硫醇和ph时,为一比率型探针,可以消除减少或消除其他测试参数或系统误差对荧光检测准确度的干扰;
(4)所述多功能近红外荧光探针在用于制备肿瘤光动力治疗药物时,能有效减小肿瘤体积。
附图说明
图1为实施例1制得的第一化合物s1的高分辨质谱图;
图2为实施例1制得的多功能近红外荧光探针的高分辨质谱图;
图3为实施例1制得的多功能近红外荧光探针的核磁共振氢谱图;
图4为实施例1制得的探针的荧光强度随谷胱甘肽(gsh)浓度的变化曲线图;
图5为实施例1制得的探针在发射波长765nm、576nm处的荧光强度比值i765nm/i576nm与gsh浓度的关系图,其中,图5中的内图为相应的线性关系图;
图6为在浓度为5μm的实施例1制得的探针的溶液中加入不同的活性分子后,探针在i765nm/i576nm值的变化;
图7为实施例1制得的探针的荧光强度随ph的变化曲线图;
图8为实施例1制得的探针在发射波长为765nm处的荧光强度与不同ph的荧光强度图;
图9为实施例1制得的探针对ph的可逆性测试结果图;
图10为实施例1制得的探针的细胞毒性测试结果图;
图11为实施例1制得的探针对hela细胞内硫醇的荧光成像图;
图12为实施例1制得的探针对荷瘤老鼠的荧光成像图;
图13为实施例1制得的探针对荷瘤老鼠的光声成像图;
图14为实施例1制得的探针对荷瘤老鼠的光动力治疗效果图。
具体实施方式
以下所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明的保护范围。
实施例1:
一种多功能近红外荧光探针的制备方法,包括以下步骤:
(1)第一化合物s1的合成:
s1的合成路线:
s1的合成步骤如下:
室温下,在25ml圆底烧瓶中加入胱胺二盐酸盐(162mg,0.72mmol)、1.5ml甲醇、416μl三乙胺(3mmol),再加入2ml乙腈,快速搅拌约0.5小时后,溶液变透明,胱胺二盐酸盐全部溶解,得到第一混合溶液;
然后把
对实施例1的该步骤制得的第一化合物s1进行质谱测试,测试结果如图1所示,图1为实施例1制得的第一化合物s1的高分辨质谱图。从图1中可以看出,通过质谱测出的分子离子峰m+为627.3551,符合c38h51n4s2+的理论分子量(627.3550)。
(2)第二化合物s2的合成:
s2的合成路线:
s2的合成步骤如下:
将偏苯三酸酐(2.46g,12.8mmol)和3-羟基-n,n-二乙基苯胺(1.86g,11.3mmol)加入到100ml的圆底烧瓶中,加热至180℃,反应3小时,然后冷却至室温,再加入3-羟基-n,n-二乙基苯胺(1.86g,11.3mmol)和5ml的浓磷酸,继续加热,在180℃下再反应3小时后,停止反应,待反应体系冷却至室温后,将反应后的物料直接倒进150ml的饱和食盐水中并剧烈搅拌,加入氢氧化钠溶液调至中性后,再用二氯甲烷萃取,合并有机相,旋去溶剂,得到暗红色固体粉末,该暗红色固体粉末为第二化合物s2(4.1g,8.13mmol),产率:72%,该第二化合物s2的化学结构式为
(3)多功能近红外探针rhosscy的合成:
具体合成步骤如下:
在25ml的圆底烧瓶中加入第一化合物s1(25.18mg,0.05mmol),并加入2ml的二氯甲烷、28μl的三乙胺、12.36mg的dcc、6.9mg的nhs,在室温下快速搅拌至第一化合物s1完全溶解,得到第三混合溶液;
然后把第二化合物s2(75.48mg,0.1mmol)用4ml的二氯甲烷溶解,加入到上述第三混合溶液中,于35℃下反应,6小时后停止反应,将反应后的反应液旋蒸除去溶剂,得到粗产品,用硅胶柱纯化,将粗产品用二氯甲烷溶解,采用湿法上样,洗脱剂用二氯甲烷:甲醇从200:1到10:1的体积比进行梯度洗脱,旋去溶剂浓缩后,得到蓝色粉末状固体,该蓝色粉末状固体即为多功能近红外探针rhosscy(10.4mg,0.0085mmol),产率:17%。
该探针rhosscy的合成路线为:
对实施例1得到的多功能近红外荧光探针(rhosscy)进行uplc-tof-ms质谱(超高压液相色谱-飞行时间质谱仪)测试,测试结果如图2所示,图2为实施例1制得的探针的高分辨质谱hrms(ei)图。从图2中可以看出,通过质谱测出该探针rhosscy的分子离子峰m+为1095.5600,符合c67h79n6o4s2+的理论分子量1095.5604。
图3为实施例1制得的多功能近红外荧光探针rhosscy的核磁共振氢谱图;从图3中可以看出1hnmr(400mhz,cd3od,tms)δ8.58(s,1h),δ8.08(d,j=6.87,1h),δ7.92(d,j=12.98,2h),δ7.38(d,j=5.50,2h),δ7.32(t,j=14.35,2h),δ7.19(d,j=9.16,2h),δ7.10(t,j=14.12hz,4h),δ6.98(s,2h),δ6.96(s,2h),δ5.91(d,j=12.59hz,2h),δ4.15(t,j=10.15hz,2h),δ4.03(q,j=10.46hz,4h),δ3.80(t,j=11.04hz,2h),δ3.68(d,j=6.47hz,8h),δ3.19(t,j=10.69hz,2h),δ3.04(t,j=11.85hz,2h),δ2.58(t,j=10.81hz,4h),δ1.88(t,j=10.46hz,2h),δ1.70(s,12h),δ1.33(t,j=7.05hz,18h)。图3的核磁谱图结果表明,本实施例成功地制备得到多功能近红外荧光探针。
实施例2:
一种多功能近红外荧光探针的制备方法,包括以下步骤:
(1)第一化合物s1的合成:
s1的合成步骤如下:
室温下,在25ml圆底烧瓶中加入胱胺二盐酸盐(135mg,0.6mmol)、1.5ml甲醇、166.4μl三乙胺(1.2mmol),再加入2ml乙腈,快速搅拌约0.5小时后,溶液变透明,胱胺二盐酸盐全部溶解,得到第一混合溶液;
然后把
(2)第二化合物s2的合成:
s2的合成步骤如下:
将偏苯三酸酐(2.46g,12.8mmol)和3-羟基-n,n-二乙基苯胺(1.86g,11.3mmol)加入到100ml的圆底烧瓶中,加热至180℃,反应3小时,然后冷却至室温,再加入3-羟基-n,n-二乙基苯胺(1.86g,11.3mmol)和5ml的浓磷酸,继续加热,在180℃下再反应6小时后,停止反应,待反应体系冷却至室温后,将反应后的物料直接倒进100ml的饱和食盐水中并剧烈搅拌,加入氢氧化钠溶液调至中性后,再用二氯甲烷萃取,合并有机相,旋去溶剂,得到暗红色固体粉末,该暗红色固体粉末为第二化合物s2(4.6g,9.15mmol),产率:81%,该第二化合物s2的化学结构式为
(3)多功能近红外探针rhosscy的合成:
具体合成步骤如下:
在25ml的圆底烧瓶中加入第一化合物s1(25.18mg,0.05mmol),并加入2ml的二氯甲烷、28μl的三乙胺、12.36mg的dcc、6.9mg的nhs,在室温下快速搅拌至第一化合物s1完全溶解,得到第三混合溶液;
然后把第二化合物s2(18.87mg,0.05mmol)用4ml的二氯甲烷溶解,加入到上述第三混合溶液中,于80℃下回流反应,6小时后停止反应,将反应后的反应液旋蒸除去溶剂,得到粗产品,用硅胶柱纯化,将粗产品用二氯甲烷溶解,采用湿法上样,洗脱剂用二氯甲烷:甲醇从200:1到10:1的体积比进行梯度洗脱,旋去溶剂浓缩后,得到蓝色粉末状固体,该蓝色粉末状固体即为多功能近红外探针rhosscy(5.2mg,0.00425mmol),产率:17%。
实施例3:
一种多功能近红外荧光探针的制备方法,包括以下步骤:
(1)第一化合物s1的合成:
s1的合成步骤如下:
室温下,在25ml圆底烧瓶中加入胱胺二盐酸盐(135mg,0.6mmol)、1.5ml甲醇、332.8μl三乙胺(2.4mmol),再加入2ml乙腈,快速搅拌约0.5小时后,溶液变透明,胱胺二盐酸盐全部溶解,得到第一混合溶液;
然后把
(2)第二化合物s2的合成同实施例1;
(3)多功能近红外探针rhosscy的合成:
在25ml的圆底烧瓶中加入第一化合物s1(25.18mg,0.05mmol),并加入2ml的二氯甲烷、28μl的三乙胺、12.36mg的dcc、6.9mg的nhs,在室温下快速搅拌至第一化合物s1完全溶解,得到第三混合溶液;
然后把第二化合物s2(56.61mg,0.075mmol)用4ml的二氯甲烷溶解,加入到上述第三混合溶液中,于40℃下反应,6小时后停止反应,将反应后的反应液旋蒸除去溶剂,得到粗产品,用硅胶柱纯化,将粗产品用二氯甲烷溶解,采用湿法上样,洗脱剂用二氯甲烷:甲醇从200:1到10:1的体积比进行梯度洗脱,旋去溶剂浓缩后,得到蓝色粉末状固体,该蓝色粉末状固体即为多功能近红外探针rhosscy(7.0mg,0.00575mmol),产率:23%。
实施例4:
一种多功能近红外荧光探针的制备方法,包括以下步骤:
(1)第一化合物s1的合成:
s1的合成步骤如下:
室温下,在25ml圆底烧瓶中加入胱胺二盐酸盐(135mg,0.6mmol)、1.5ml甲醇、499.2μl三乙胺(3.6mmol),再加入2ml乙腈,快速搅拌约0.5小时后,溶液变透明,胱胺二盐酸盐全部溶解,得到第一混合溶液;
然后把
(2)第二化合物s2的合成同实施例2;
(3)多功能近红外探针rhosscy的合成:
在25ml的圆底烧瓶中加入第一化合物s1(25.18mg,0.05mmol),并加入2ml的二氯甲烷、28μl的三乙胺、12.36mg的dcc、6.9mg的nhs,在室温下快速搅拌至第一化合物s1完全溶解,得到第三混合溶液;
然后把第二化合物s2(75.48mg,0.1mmol)用4ml的二氯甲烷溶解,加入到上述第三混合溶液中,于30℃下反应,4小时后停止反应,将反应后的反应液旋蒸除去溶剂,得到粗产品,用硅胶柱纯化,将粗产品用二氯甲烷溶解,采用湿法上样,洗脱剂用二氯甲烷:甲醇从200:1到10:1的体积比进行梯度洗脱,旋去溶剂浓缩后,得到蓝色粉末状固体,该蓝色粉末状固体即为多功能近红外探针rhosscy(6.4mg,0.00525mmol),产率:21%。
效果实施例
探针对谷胱甘肽(gsh)溶液的荧光响应
将实施例1制得的多功能近红外荧光探针(rhosscy)配置成浓度为20μm的dmso/pbs(20mm,ph=7.4,v/v=9:l)的测试溶液100ml,每次取0.5ml加入已配好的不同浓度的谷胱甘肽(gsh)溶液,使探针rbsscy分子的终浓度为10μm,谷胱甘肽终浓度分别为0μm,1μm,2μm,3μm,4μm,5μm,6μm,7μm,8μm,9μm,10μm,11μm,12μm,13μm,14μm,15μm,16μm,17μm,18μm,19μm,20μm,40μm,60μm,80μm,100μm,200μm,500μm测试探针的荧光强度与谷胱甘肽浓度的变化关系,结果如图4-5所示。图4为实施例1制得的探针在540nm的激发波长下,其荧光强度随谷胱甘肽(gsh)浓度的变化曲线图;图5为实施例1制得的探针在540nm的激发波长下,发射波长765nm、576nm处的荧光强度比值i765nm/i576nm与gsh浓度的关系图,其中,图5中的内图为相应的线性关系图。
从图4-图5可以看出,随着gsh的加入,探针rhosscy在最大发射波长765nm的荧光强度逐渐降低,其在576nm处的荧光强度逐渐增强;并且,该探针在发射波长765nm、576nm处的荧光强度比值i765nm/i576nm的值随着gsh浓度的增加而逐渐渐变,经拟合发现,在gsh的浓度为0-10μm时,探针rhosscy的荧光强度随gsh浓度有规律的变化,经过拟合,发现探针rhosscy的浓度为5μm,gsh浓度在0.1-8μm时,探针的i765nm/i576nm的比值与gsh的浓度有很好的线性关系,相关系数r为0.99729,经计算得,gsh的检测下限是0.1μm。
探针对硫醇分子的选择性
图6为在浓度为5μm的探针rhosscy分子溶液中分别加入了不同的活性小分子(浓度为1mm)后的荧光强度在i765nm/i576nm值的变化,所述活性分子包括ser(丝氨酸)、gly(甘氨酸)、ala(丙氨酸)、leu(亮氨酸)、phe(苯丙氨酸)、glu(谷氨酸)、lys(赖氨酸)、arg(精氨酸)、tyr(酪氨酸)、glc(葡萄糖)、cys(半胱氨酸)、hcy(同型半胱氨酸)、gsh(谷胱甘肽)。
从图6可以看出,该探针对含有巯基的硫醇分子,如cys、hcy、gsh均有良好的响应型,加入硫醇分子均能使该探针的i765nm/i576nm值降低。
探针对ph的响应性
将实施例1制得的多功能近红外荧光探针配置于ph为5~10的hepes缓冲液(含10%的二甲基亚砜(dmso))中,探针的浓度为5μm,在640nm的激发波长下测试其荧光强度,结果如图7、8所示,其中,图7为实施例1制得的探针在640nm的激发波长下的荧光强度随ph的变化曲线图;图8为实施例1制得的探针在640nm的激发波长下、发射波长为765nm处的荧光强度与不同ph的荧光强度图。从图中可以看出,在ph为5-6,探针在最大发射波长765nm处的荧光强度略有下降,但变化不明显,但ph从6-8,探针在765nm处的荧光强度剧烈下降,以上说明,本发明实施例制得的多功能近红外探针对ph具有明显的响应。
由于细胞内ph值往往发生振荡变化,并且非均匀分布,因此检测ph的探针具有可逆响应能力十分重要。因此我们还对本发明制得的具有ph响应的恢复型近红外荧光探针对ph响应的可逆性进行了测试。实验中循环调节测试溶液的ph,使其ph在5和10之间振荡,并反复测试其荧光光谱。结果如图9所示,图9为实施例1制得的探针对ph的可逆性测试结果图。结果表明,本发明实施例制得的多功能近红外探针的荧光至少在6个循环内在相同的ph下保持稳定,表明该探针具有较好的可逆响应ph的能力,可以实现对细胞内ph振荡变化的有效响应。
细胞毒性实验
以hela细胞为例,考察不同浓度的实施例1制得的多功能近红外荧光探针的细胞毒性,具体操作如下:
将实施例1制得的多功能近红外荧光探针配置在牛血清溶液中,分别配成浓度为0.1μm、1μm、10μm、30μm、60μm、90μm的各组,通过mtt法进行细胞毒性实验,细胞毒性的结果如图10所示,从图10可以看出,探针在浓度0.1-10μm时,细胞存活率高达85%以上,这说明该探针的毒性很低,可以用于细胞内硫醇和ph的检测。
体外肿瘤细胞内的硫醇检测
采用实施例1制得的多功能近红外荧光探针对hela细胞内的硫醇进行检测,将该探针配制在牛血清中,控制探针的最终浓度为5μm,使用leicatcssp5共聚焦显微镜进行荧光成像,收集576±25mn和756±25nm波长范围内的荧光,得到白光和荧光图像,细胞成像过程中所用激发光波长为543nm。结果如图11所示。图11中,a组图(a1-a4)为在hela细胞内加入硫醇清除剂除去细胞内硫醇分子后的荧光成像图片,b组图(b1-b4)为在hela细胞内没有加硫醇清除剂即细胞内存在硫醇分子时的荧光成像图片。a1列和b1列是罗丹明的红光通道,a2列和b2列是七甲川菁染料的蓝光通道,a3列和b3列分别是a组、b组在明场视野下观察到的细胞形态,说明给药后的细胞形态是否完整、状态是否良好;a4列和b4分别是a1-a3,b1-b3的叠加,可以实现对完整细胞的定位。
从a1列可以看出虽然细胞内ph发生了变化,但是探针分子中罗丹明的荧光强度并没有发生改变,而从a2列我们可以看出随着细胞内ph的降低,探针分子中七甲川菁染料部分(cy.7)的荧光逐渐增强,这与在溶液中的荧光实验结果(图8)是一致的,说明探针可以应用于检测细胞中的ph变化探针。b组中,随着ph的变化,b1和b2也出现同样的效果。此外,还说明硫醇分子的存在与否,几乎不干扰该探针用于测试ph。
由于b组在hela细胞内没有加硫醇清除剂,即细胞内存在硫醇分子,所以探针rhosscy与硫醇分子反应,fret效应被破坏,罗丹明的荧光增强,七甲川菁染料的荧光减弱,所以从11图中看到b1列细胞的荧光要比a1列的荧光强很多,而b2列细胞的荧光则相对于a2列的荧光较弱。
以上对比说明,该探针对hela细胞内的硫醇分子有很好的检测效果,为其应用于生物活体内硫醇的检测奠定了基础。
动物活体内ph的检测
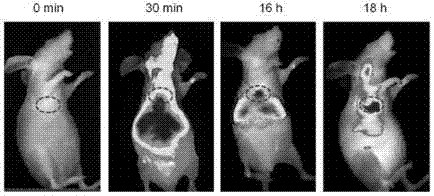
将实施例1制得的多功能近红外荧光探针配制成浓度0.04mg/ml的pbs溶液,采用裸鼠作为研究对象,对荷瘤老鼠进行0.2mg/kg剂量的探针尾椎静脉注射,将探针注入荷瘤老鼠体内,并对注射0min、30min、16h、18h内的肿瘤部位的成像效果如图12所示,红光激发,采集700-900nm的荧光信号。从如图12可以看出,注射该探针溶液之后,探针rhosscy分子在老鼠体内经由血液循环进行分布,首先到达心脏和肝脏,30min时,在心脏部位的荧光强度达到最大,已经可以通过体内成像系统清晰地观察到老鼠体内很强的荧光,随着血液的循环,探针rhosscy分子在老鼠体内非常迅速地进行分布,心脏部位的荧光逐渐减弱,肿瘤部位的荧光逐渐增强,在注射18小时时,肿瘤部位发射出的荧光强度远远高于其他部位,而且非常清晰,成功检测出小鼠肿瘤部位。可以看出,虽然裸鼠体内的荧光强度在注射后30min达到最大,但是即使在注射后18小时仍然可以看到清晰的荧光,也说明了探针rhosscy分子在体内具有长时间的成像性能,有力地改善了花菁染料在体内溶液中易光漂白的缺点。从体内成像照片也可以看出,探针rhosscy分子的吸收光和荧光发射都在近红外区域使得它在进行体内荧光成像时完全不受生物体内的背景荧光干扰,并且对组织的穿透也非常好。结果表明,该近红外探针rhosscy在肿瘤的检测中具有巨大的价值,另外,小动物活体成像具有较高的灵敏度,能够客观地评价荧光探针rhosscy的靶向显象过程以及检测效果。
图13为实施例1制得的探针对荷瘤老鼠的光声成像图,将实施例1制得的多功能近红外荧光探针配制成浓度0.04mg/ml的pbs溶液,采用裸鼠作为研究对象,对荷瘤老鼠进行0.2mg/kg剂量的探针尾椎静脉注射,将探针注入荷瘤老鼠体内,并对注射0h、0.5h、4h、17h、24h内的肿瘤部位进行成像,采集近红外区域(690,740,760,780,800和900nm)的光声信号,结果如图13所示。a组图为0-24小时内对荷瘤老鼠的光声成像图,b图为相应时间点的光声信号强度。从两图中均可以看出,在注射该探针后第17小时,肿瘤部位的光声信号强度达到最大,成像效果显著。
图14为实施例1制得的探针对荷瘤老鼠的光动力治疗效果图。图中“圆点”代表的光照组是仅对荷瘤老鼠进行光照(未加探针);“正三角形”组为加探针但未进行光照组;“倒三角形”为加探针并光照组,具体为将该探针配制成浓度为5μm的pbs溶液,在荷瘤老鼠的肿瘤进行原位注射,并采用功率30mw·cm2、波长为660nm的激光照射5分钟,总共进行一次光照,然后测试15天内的肿瘤的大小变化。
从图14可以明显看出,给荷瘤小鼠注射所述探针并光照后,肿瘤逐渐减小,治疗9天后肿瘤明显减小,而其他三组的肿瘤均持续增大。对比说明,本探针对荷瘤老鼠有显著的光动力治疗效果。当所述探针受到660nm的激光照射时,吸收光子能量,由基态变成激发态,处于激发态的光敏物质很不稳定,迅速经过化学退激过程释放出能量而返回基态,其化学退激过程可以生成活性氧物种,其中最主要的是单线态氧(1o2),活性氧作为主要细胞毒剂能与多种生物大分子相互作用,损伤病变细胞结构或影响其功能,因而所述探针能对肿瘤产生治疗作用。
以上表征说明,本发明提供的多功能近红外荧光探针既可以用于检测细胞内ph,又可检测硫醇分子,还可进行光声成像和光动力治疗,是一个集多模态成像、诊断-治疗为一体的多功能探针。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!