用于无标识高内涵药物筛选的微流控芯片及其制作方法与流程
本发明属于微流控芯片的技术领域,具体涉及一种用于无标识高内涵药物筛选的微流控芯片及其制作方法。
背景技术:
高内涵筛选主要是在保持细胞结构和功能完整的前提下,同时检测被筛选样品对细胞形态、细胞生长、信号通路以及细胞毒性等方面的影响,并加以综合分析。传统的高内涵筛选一般是在微孔板上进行细胞培养,施加药物刺激,并辅以自动化装置和高分辨光学测试系统进行检测。
常用的光学检测基于荧光显微镜,其结合激光共聚焦扫描技术可以实现高分辨的单细胞细胞器成像。但是该技术需要使用荧光染料对亚细胞单元(细胞核、线粒体)进行标记,而荧光染料的生物毒性严重影响细胞的长时间观测与研究,此外,非特异性结合的荧光染料分子会引入背景噪音,降低检测灵敏度。不同于荧光方法,SERS技术无需染料分子标识,可以同时对多个分子官能团进行检测,对细胞、药物的结构信息以及药物在代谢过程中分子结构所发生的变化,进行单分子量级的研究。此外,微流控芯片相对于微孔板,具有生物试剂与细胞用量少、大规模筛选效率高的特点,对于降低药物开发成本具有重要意义。因此,将SERS技术与微流控技术相结合是进行无标识高内涵药物筛选的有效途径。
崔一平(62,2014,BIOSENSORS & BIOELECTRONICS)使用液滴微流控芯片,获得了人类血清和唾液中硫氰酸盐的表面增强拉曼光谱。光信号作为整体平均值被收集,实验可以获得很好的定量可重复性。但是,这种方法由于不能对细胞进行很好的捕获、定位与培养,依然面临细胞外基质环境变化的难题,液滴内的细胞模型,缺少细胞和基质之间的相互作用,这可能会阻断细胞信号通路,抑制特异蛋白和相关基因表达。
技术实现要素:
本发明克服现有技术存在的不足,所要解决的技术问题为:提供一种能够对细胞进行捕获、定位,够进行免标记、高内涵药物筛选的微流控芯片及其制作方法。
为了解决上述技术问题,本发明采用的技术方案为:用于无标识高内涵药物筛选的微流控芯片,所述微流控芯片上设有检测池和多条微流道,所述多条微流道均与所述检测池相连通,且多条微流道之间彼此不相连通,所述检测池内设有多个结构单元,所述多个结构单元组成阵列型结构,所述结构单元包括:至少两个用于定位细胞的定位电极和至少一对用于生长纳米枝晶结构的生长电极。
优选地,所述结构单元为三圆环形状,三个圆环为直径各不相同的同心圆环,在内圆环上设有至少两个尖端电极;在中圆环上设有至少两个圆形电极,以上述圆形电极为等分点,中圆环被均分为多等份,每一圆形电极上均设有尖端部;在外圆环上设有多个尖端电极,外圆环上的尖端电极与中圆环上的圆形电极一一对应;所述内圆环上的尖端电极两两之间形成一对生长电极,所述外圆环上的尖端电极与对应的中圆环上的圆形电极的尖端部形成一对生长电极,所述圆形电极的非尖端部均为定位电极。
优选地,所述结构单元为双圆环结构,两个圆环为直径各不相同的同心圆环,在内圆环上设有至少两个尖端电极,在外圆环上设有至少两个圆形电极,以上述圆形电极为等分点,外圆环被均分为多等份,所述内圆环上的尖端电极两两之间形成一对生长电极,所述圆形电极均为定位电极。
优选地,所述结构单元为双圆环结构,两个圆环为直径各不相同的同心圆环,在内圆环上设有至少两个圆形电极,以上述圆形电极为等分点,外圆环被均分为多等份,每一圆形电极上均设有尖端部,在外圆环上设有多个尖端电极,外圆环上的尖端电极与内圆环上的圆形电极一一对应;所述外圆环上的尖端电极与对应的内圆环上的圆形电极的尖端部形成一对生长电极,所述圆形电极的非尖端部均为定位电极。
优选地,所述微流控芯片包括:依次键合在一起的基底、基片和透明盖片,所述结构单元设置于所述基底上,所述检测池和多条微流道均设置于所述基片上,且所述检测池的顶盖为所述透明盖片,所述透明盖片上设有多个溶液出入口,所述多个溶液出入口与所述多条微流道一一对应连通。
优选地,所述的多条微流道包括:细胞液微流道、培养基微流道、药物微流道、镀液微流道、去离子水微流道和废液微流道,上述微流道内均设有单向导通阀。
优选地,包括以下步骤:S10、利用MEMS工艺,在基底上制作包括定位电极和生长电极的阵列式结构单元,在基片上制作检测池和多条微流道,在透明盖片上制作多个溶液出入口,将基底、基片和透明盖片依次键合在一起;S20、将含有贵金属的电解液通过透明盖片上的一个溶液出入口,流经微流道,通入检测池中;S30、在每两个生长电极之间通交流电,以在两个生长电极距离最近的尖端上生长形成贵金属的纳米枝晶结构;S40、贵金属纳米枝晶结构形成后,向检测池内通入去离子水,以冲洗检测池和微流道。
优选地,步骤S10中,所述的利用MEMS工艺,在基底上制作包括定位电极和生长电极的阵列式结构单元,具体包括:S101、在基底上沉积第一层金属层并刻蚀,形成生长电极的电气连接线;S102、沉积第一层绝缘层并刻蚀,露出电极窗口;S103、沉积第二层金属层并刻蚀,形成定位电极的电气连接线;S104、沉积第二层绝缘层并刻蚀,露出电极窗口;S105、沉积第三层金属层并刻蚀,形成生长电极和定位电极。
优选地,完成一次药物筛选后,在每两个生长有纳米枝晶结构的生长电极之间,施加大幅值的交流电,熔断纳米枝晶结构,通入去离子水冲洗。
优选地,含有贵金属的电解液为离子溶液或者络合物溶液,每一对生长电极之间施加的交流电的幅值大于3V,频率值位于1kHz和10MHz之间。
本发明与现有技术相比具有以下有益效果:
1、本发明中的微流控芯片上的检测池内设置的多个结构单元,呈阵列型结构,可以实现高通量的药物筛选。结构单元包括用于定位细胞的定位电极和用于生长纳米枝晶结构的生长电极。利用生长电极,可以在细胞捕获的位置上预制SERS基底,实现细胞及其药物反应的SERS原位检测。利用定位电极,可以对细胞进行捕获、定位和贴壁培养。最终实现了单细胞、高内涵、与SERS结合的药物的无标识及自动化筛选分析。
2、本发明中,完成一次药物筛选后,在每两个生长有纳米枝晶结构的生长电极之间,施加大幅值的交流电,熔断纳米枝晶结构,然后通入去离子水冲洗,使芯片恢复到原来未生长纳米枝晶结构的状态,以备下一次使用,使芯片达到可重复使用的目的。
附图说明
下面结合附图对本发明做进一步详细的说明。
图1为本发明实施例一提供的用于无标识高内涵药物筛选的微流控芯片的结构示意图;
图2为本发明实施例一提供的用于无标识高内涵药物筛选的微流控芯片中结构单元的结构示意图;
图3为本发明实施例二提供的用于无标识高内涵药物筛选的微流控芯片中结构单元的结构示意图;
图4为本发明实施例三提供的用于无标识高内涵药物筛选的微流控芯片中结构单元的结构示意图;
图5为本发明实施例一提供的用于无标识高内涵药物筛选的微流控芯片中电极的连线示意图;
图6至图10为本发明实施例一提供的用于无标识高内涵药物筛选的微流控芯片中结构单元的制作工艺流程图;
图11为本发明实施例一提供的细胞药物筛选系统的结构示意图;
图中:1为检测池,2为微流道,3为结构单元,4为基底,5为基片,6为透明盖片,7为溶液出入口,8为外接焊盘,9为细胞测控芯片,10为芯片测控系统,11为拉曼测试系统,12为荧光测试系统,13为液体给进系统,31为定位电极,32为生长电极,41为第一层金属层,42为第一层绝缘层,43为第二层金属层,44为第二层绝缘层,45为第三层金属层。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例;基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
图1为本发明实施例一提供的用于无标识高内涵药物筛选的微流控芯片的结构示意图,如图1所示,用于无标识高内涵药物筛选的微流控芯片,所述微流控芯片上设有检测池1和多条微流道2,所述多条微流道2均与所述检测池1相连通,且多条微流道2之间彼此不相连通,所述检测池1内设有多个结构单元3,所述多个结构单元3组成阵列型结构,所述结构单元3包括:至少两个用于定位细胞的定位电极31和至少一对用于生长纳米枝晶结构的生长电极32。
当定位细胞时,定位电极31加行波电压,相邻定位电极31之间的相位差为:360度/所有定位电极个数,比如定位电极31的数量为两个,那么相邻定位电极31之间相差180度,定位电极31的数量为三个,则相邻定位电极31之间相差120度,如果定位电极31的数量为六个,则相邻定位电极31之间相差60度。
具体地,所述微流控芯片可包括:依次键合在一起的基底4、基片5和透明盖片6,所述结构单元3设置于所述基底4上,所述检测池1和多条微流道2均设置于所述基片5上,且所述检测池1的顶盖为所述透明盖片6,所述透明盖片6上设有多个溶液出入口7,所述多个溶液出入口7与所述多条微流道2一一对应连通。
更具体地,所述基底4为绝缘材料,或为其上覆有绝缘层的硅材料。
更具体地,所述基片5为固化型聚合物,或为热塑性聚合物,或为溶剂挥发型聚合物。
具体地,所述的多条微流道2可包括:细胞液微流道、培养基微流道、药物微流道、镀液微流道、去离子水微流道和废液微流道,上述微流道2内均可设有单向导通阀,即废液微流道用于单向流出,其他微流道用于单向流入检测池1。
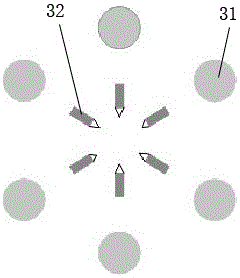
图2为本发明实施例一提供的用于无标识高内涵药物筛选的微流控芯片中结构单元的结构示意图,如图2所示,所述结构单元3为双圆环结构,两个圆环为直径各不相同的同心圆环,在内圆环上设有至少两个尖端电极,在外圆环上设有至少两个圆形电极,以上述圆形电极为等分点,外圆环被均分为多等份,所述内圆环上的尖端电极两两之间形成一对生长电极32,所述圆形电极均为定位电极31。
所述圆环的数量、所述定位电极31和所述生长电极32的数量以及设置位置可根据实际需要进行设定,本实施例中,所述定位电极31和所述生长电极32的数量均为六个。所述基片5以玻璃、硅、聚甲基丙烯酸甲酯PMMA或聚二甲基硅氧烷PSMS为基材,刻蚀有六个微流道2和一个检测池1;此外,在制作结构单元3时,每一圆环对应一层电极连线层,相邻的电极连线层之间设置有一层绝缘层。
图5为本发明实施例一提供的用于无标识高内涵药物筛选的微流控芯片中电极的连线示意图,如图5所示,本实施例中的结构单元3的电极连线层由横向连线层和纵向连线层构成,其中横向连线层用于将外圆环六个定位电极31分别与相邻检测单元的相对应的定位电极31连接,纵向连线层用于将内圆环六个生长电极32分别与相邻检测单元的相对应的生长电极32连接,最后连接线的一端均接至芯片边缘的外接焊盘8上。
本实施例中的微流控芯片上的检测池1内设置的多个结构单元3,呈阵列型结构,可以实现高通量的药物筛选,而结构单元3包括用于定位细胞的定位电极31和用于生长纳米枝晶结构的生长电极32,利用生长电极32,可以在细胞捕获的位置上预制SERS基底,实现细胞及其药物反映的SERS原位检测,利用定位电极31,可以对细胞进行捕获、定位和贴壁培养,最终实现了单细胞、高通量、与SERS结合的药物的多模式、自动化筛选分析。
图3为本发明实施例二提供的用于无标识高内涵药物筛选的微流控芯片中结构单元的结构示意图,如图3所示,本实施例与实施例一的区别在于,所述结构单元3可为双圆环结构,两个圆环为直径各不相同的同心圆环,在内圆环上设有至少两个圆形电极,以上述圆形电极为等分点,外圆环被均分为多等份,每一圆形电极上均设有尖端部,在外圆环上设有多个尖端电极,外圆环上的尖端电极与内圆环上的圆形电极一一对应;所述外圆环上的尖端电极与对应的内圆环上的圆形电极的尖端部形成一对生长电极32,所述圆形电极的非尖端部均为定位电极31。
图4为本发明实施例三提供的用于无标识高内涵药物筛选的微流控芯片中结构单元的结构示意图,如图4所示,本实施例与实施例一、二的区别在于,所述结构单元3可为三圆环形状,三个圆环为直径各不相同的同心圆环,在内圆环上设有至少两个尖端电极;在中圆环上设有至少两个圆形电极,以上述圆形电极为等分点,中圆环被均分为多等份,每一圆形电极上均设有尖端部;在外圆环上设有多个尖端电极,外圆环上的尖端电极与中圆环上的圆形电极一一对应;所述内圆环上的尖端电极两两之间形成一对生长电极32,所述外圆环上的尖端电极与对应的中圆环上的圆形电极的尖端部形成一对生长电极32,所述圆形电极的非尖端部均为定位电极31。
对于实施例一、二、三中的结构单元3的具体结构,可根据实际需要进行设计,其中,定位电极31所在的圆环的直径根据被被检测细胞的直径大小来设计,用于生长纳米枝晶结构的两个生长电极32距离最近的尖端之间的距离∈(0μm,40μm],且两个上述尖端相对设置。
对于一个细胞来说,当被定位完毕后,通过实施例一的结构单元3能够对细胞的中部结构及其药物反应进行较好的检测观察,通过实施例二的结构单元3能够对细胞的外围结构及其药物反应进行较好的检测观察,通过实施例三的结构单元3能够对细胞的中部结构及其药物反应和外围结构及其药物反应进行较好的检测观察,即可通过调整定位电极31和生长电极32的设置位置,来对细胞的不同部位进行检测观察。
相应地,用于无标识高内涵药物筛选的微流控芯片的制作方法,可包括以下步骤:
S10、利用MEMS工艺,在基底4上制作包括定位电极31和生长电极32的阵列式结构单元3,在基片5上制作检测池1和多条微流道2,在透明盖片6上制作多个溶液出入口7,将基底4、基片5和透明盖片6依次键合在一起。
S20、将含有贵金属的电解液通过透明盖片6上的一个溶液出入口7,流经微流道2,通入检测池1中。
S30、在每一对生长电极32之间通交流电,以在两个生长电极32距离最近的尖端上生长形成贵金属的纳米枝晶结构。
S40、贵金属纳米枝晶结构形成后,向检测池1内通入去离子水,以冲洗检测池1和微流道2。
具体地,以实施例一中呈双环六电极结构的结构单元3为例,步骤S10中,所述的利用MEMS工艺,在基底4上制作包括定位电极31和生长电极32的阵列式结构单元3,具体可包括:
S101、在基底4上沉积第一层金属层41并刻蚀,形成生长电极32的电气连接线,如图6所示。
具体地,在进行步骤S101之前,先选用石英玻璃作为基底,分别用丙酮、酒精、去离子水进行清洗,并烘干备用;然后再利用光刻和lift-off工艺加工第一层金属层41。
首先,在玻璃片上匀胶并烘干,使用掩膜版进行光刻显影;然后,溅射厚度为30nm的钛(Ti)作为玻璃片与金属的粘附层,再溅射厚度为200nm的金(Au);最后,将晶圆放在装有丙酮的超声槽内30min,完成lift-off,实现第一层金属层41的图形化。
S102、沉积第一层绝缘层42并刻蚀,露出电极窗口,如图7所示。
具体地,采用PECVD再在基底上生长厚度为300nm的SiO2绝缘层,并使用光刻版进行曝光,并用氢氟酸溶液腐蚀绝缘层,使其漏出电极。
S103、沉积第二层金属层43并刻蚀,形成定位电极31的电气连接线,如图8所示。
具体地,采用光刻和lift-off工艺进行第二层金属层43的加工制作,此层金属层为Ti/Au层,厚度为(30nm/200nm),图像化出横向电极引线。
S104、沉积第二层绝缘层44并刻蚀,露出电极窗口,如图9所示;
具体地,采用PECVD的方法生成另一层300nm厚的SiO2绝缘层,通过湿法腐蚀刻蚀出连接定位电极31和生长电极32的电极孔。
S105、沉积第三层金属层45并刻蚀,形成生长电极32和定位电极31,如图10所示。
具体地,采用光刻和lift-off工艺加工出定位电极31和生长电极32,此Ti/Au层厚度为30nm/300nm。
更具体地,步骤S10中,在基片5上制作检测池1和多条微流道2,所采用的工艺包括软光刻、模塑法、热压法、LIGA工艺以及激光烧蚀工艺等技术。
初步制作完成芯片后,还要进行芯片的封装,封装时:先设计、制作PCB电路板,其上设置有与芯片一一对应的沉金焊盘和与外部控制设备连接的金属排针;然后将芯片用胶粘接在PCB上,利用金丝球焊工艺将芯片上的焊盘和电路板上的焊盘进行连接,电路板金属排针再通过导线与外部控制设备连接。
完整的芯片制作出来后,进行SERS基底的制备:将含有贵金属的电解液通入检测池1中,通过控制交流与直流偏置电压的幅值和交流电压的频率,可以控制纳米枝晶结构的形貌、位置以及生长方向,在每一对生长电极32尖端上就会形成贵金属的纳米枝晶结构;贵金属纳米枝晶结构形成后,往检测池1内通入去离子水,以冲洗检测池1及微流道2,以备后续的芯片正常工作。
具体地,在生长电极32之间施加的交流电可以为正弦波电压、方波电压、三角波电压,也可为偏置电压,其幅值大于3V,频率位于1KHz和10MHz之间;通入的电解液可以为离子溶液或者络合物溶液,更具体地,可为AuCl3·HCl·3H2O、Pd(acetate)2、In(CH3COO)3、HauCl4·3H2O、H2PtCl6·6H2O、K2PtCl4以及Cu(NO3)2等溶液。
细胞定位时,在相对定位电极31上施加相同的正弦信号,在相邻定位电极32上施加相位相差为(360度/所有定位电极个数)的正弦信号,细胞在负的介电力的作用下向电场中场强较低的位置运动。
完成一次药物筛选后,在每两个生长有纳米枝晶结构的生长电极32之间,施加大幅值的交流电,熔断纳米枝晶结构,通入去离子水冲洗,使芯片恢复到原来未生长纳米枝晶结构的状态,以备下一次使用,使芯片达到可重复使用的目的。
相应地,图11为本发明实施例一提供的细胞药物筛选系统的结构示意图,如图11所示,所述细胞药物筛选系统包括:细胞测控芯片9(即本发明中的微流控芯片)、芯片测控系统10、拉曼测试系统11、荧光测试系统12和液体给进系统13。其中,芯片测控系统10是由任意波形信号发生器组成,主要有以下功能:SERS基底制备所需过电位和细胞定位信号的产生;拉曼测试系统11,主要用来实现针对心脑血管,肿瘤,病毒,神经精神系统等重大疾病防治的药物筛选以及相互作用的拉曼谱峰原位检测;荧光测试系统12,用来在试验阶段对细胞形态进行实时观察和记录,并与拉曼测试结果进行对比,当对药物进行正式筛选后,可不使用荧光测试系统12;液体给进系统13主要由注射泵和流路组成,用于实现对微芯片中各种流体进行控制,同时也可以实现自动、定量地注入相应试剂。
工作时,先制备SERS基底,用去离子水冲洗;然后依次通入细胞液、培养液、药物;最后观察检测;结束后,熔断SERS,并冲洗干净;当需要进行新一轮的药物筛选时,再在原来的微流控芯片上重新制备SERA基底,重复以上步骤。
本发明通过巧妙的多微流道和大检测池的设计,实现了高通量、高效率的细胞检测分析与药物筛选;通过特殊的圆形定位电极和尖端生长电极设计,利用电化学技术,实现了单细胞固定以及SERS基底原位制备及检测;电极独立的连线方式使本发明可以通过外部多样化和自动化的电极控制,最终实现高内涵、无标记的针对心脑血管、肿瘤、病毒、神经精神系统等重大疾病防治药物的多模式、自动化筛选分析。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!