使用质子转移反应的蛋白质或多肽的混合物的质谱法的方法与流程
本发明涉及质谱法,并且更确切地说涉及用于通过从蛋白质、多肽和其它生物相关多电荷物质产生的质子转移反应产物离子的质谱法来分析蛋白质或多肽的复杂混合物的方法以及将这些方法应用于微生物的识别和表征。
背景技术:
近年来,质谱法由于其在与传统的用于识别微生物的方法相比时增加的准确性和缩短的得到结果的时间,已经作为用于识别微生物的工具而获得普及。到目前为止,用于微生物识别的最常见质谱法方法是基质辅助激光解吸电离飞行时间(MALDI-TOF)质谱法。在MALDI-TOF中,未知微生物的细胞与合适的紫外光吸收基质溶液混合且允许在样本板上干燥。替代地,使用微生物细胞的提取而不是完整细胞。在转移到质谱仪的离子源之后,使激光束指向样本以用于蛋白质的解吸附和电离,且收集时间相依性质谱数据。
由MALDI-TOF方法产生的微生物的质谱揭露了来自完整的肽、蛋白质、蛋白质片段以及其它分子的若干个峰,其构成微生物的“指纹”。此方法依赖于未知微生物的质谱中的峰分布与参考数据库的图案匹配,所述参考数据库包括使用基本上相同实验条件获得的已知微生物的质谱的收集。隔离的微生物的谱与参考数据库中的谱之间的匹配越好,在种属、物质或在一些情况下亚种水平下对生物的识别的置信度水平越高。因为所述方法依赖于匹配MALDI-TOF质谱中的峰的图案,所以不要求识别或另外表征所述未知微生物的谱中表示的蛋白质以便对其进行识别。
虽然MALDI-TOF方法是快速且经济的,但它们具有的局限是限制了对病原体表征和识别的应用范围,包含但不限于毒性检测和定量、抗性标记确定、菌株匹配以及抗生素易感性测试(仅举几例)。MALDI质谱内的信息内容反映了在所使用实验条件下一般受限于核糖体蛋白质的大多数充足且可电离的蛋白质。因为核糖体蛋白质在原核细胞当中是高度守恒的,所以通过MALDI-TOF对接近相关的微生物的区分受到限制。在此情况下,跨越接近相关的物质的许多核糖体蛋白质含有相同或稍微不同的氨基酸序列(即,单氨基酸取代),这无法以低分辨率质谱仪有效地区分。此外,菌株和/或血清变型类型、抗生素抗性、抗生素易感性、毒性或其它重要特性的确定依赖于除核糖体蛋白质外的蛋白质标记的检测,这进一步限制MALDI-TOF用于微生物分析的应用。使用MALDI-TOF用于微生物识别的实验室必须使用其它方法来进一步表征经识别的微生物。另外,MALDI-TOF方法对匹配谱图案的依赖要求纯的培养基以得到高质量结果,且因此一般不适合于直接测试、混合培养基、血培养基或含有不同微生物的其它复杂样本。
已经使用用于微生物检测的若干其它质谱法方法。举例来说,已经描述基于质谱法的蛋白质定序方法,其中液相层析与串连质谱法结合(LC-MS/MS),且根据从微生物样本导出的蛋白质的酶消化获得序列信息。被称为“从下到上”蛋白质组研究的此方法是用于蛋白质识别的广泛实践的方法。所述方法可提供对亚种或菌株层级的识别,因为层析分离允许除仅核糖体蛋白质外的额外蛋白质的检测,包含可用于抗生素抗性标记和毒性因数的表征的那些。
与“从下到上”蛋白质组研究相比,“从上到下”蛋白质组研究指代其中将蛋白质样本完整地引入质谱仪而无需酶、化学品或其它解离方式的分析方法。从上到下的分析实现完整蛋白质的研究,从而允许直接在蛋白质层级的识别、主要结构确定以及转译后修饰(PTM)的局部化。从上到下的蛋白质组分析通常包括将完整蛋白质引入质谱仪的电离源中,使蛋白质离子断裂,且测量如此产生的各种片段的质荷比和丰度。所得分段比肽分段复杂得多,这在无本文教示的方法存在下可能必须要使用具有极高质量准确性和分辨率能力的质谱仪以便以可接受的确定性解译分段图案。所述解译一般包含将观测的分段图案与包含从已知样本产生的经编译实验分段结果的蛋白质序列数据库进行比较,或替代地与理论上预测分段图案进行比较。举例来说,Liu等(《经由四极/飞行时间串连质谱仪中的离子阱碰撞引起的解离和离子/离子反应对先验未知蛋白质的从上到下的蛋白质识别/表征(Top-Down Protein Identification/Characterization of a Priori Unknown Proteins via Ion Trap Collision-Induced Dissociation and Ion/Ion Reactions in a Quadrupole/Time-of-Flight Tandem Mass Spectrometer)》,《分析化学(Anal.Chem.)》,2009,81,1433-1441)已经描述对具有多达[1]28kDa的质量的经改质和未改质的未知蛋白质的从上到下的蛋白质识别和表征。
从上到下的分析优于从下到上的分析的优点在于可直接识别蛋白质,而不是如从下到上的分析中肽的情况那样进行推断。另一优点在于可以识别蛋白质的替代形式,例如转译后修饰和拼接变体。然而,从上到下的分析当与从下到上的分析相比时具有的缺点在于许多蛋白质会难以隔离和纯化。因此,不完全分离混合物中的每一蛋白质可在质谱分析后即刻产生多个离子物质,每一物质对应于不同相应质子化程度和不同相应电荷态,且每一此类离子物质可带来多个同位素变体。因此,需要用于解译所得高度复杂的质谱的方法。
离子-离子反应在近十年来已经在生物质谱法领域中得到较大实用性,主要使用电子转移解离(ETD)来解离肽/蛋白质且确定主要序列信息和表征转译后修饰。
作为另一类型的离子-离子反应的质子转移也已经在生物应用中充分使用。以实验方式,通过致使来自样本的多正电荷蛋白质离子(即,蛋白质阳离子)与单电荷反应剂阴离子反应以便减少个别蛋白质阳离子的电荷态以及蛋白质阳离子的此些电荷态的数目而实现质子转移。当反应剂阴离子大量超过蛋白质阳离子群体而存在时,这些反应以伪一级反应动力学继续。反应的速率与蛋白质阳离子(或其它多电荷阳离子)的电荷的平方乘以反应剂阴离子上的电荷成正比。同一关系也适用于相反极性的反应,此处经界定为单电荷反应剂阳离子与从蛋白质样本导出的多电荷阴离子的群体之间的反应。这产生一系列伪一级连续反应曲线,如由起始的多电荷蛋白质阳离子群体界定。这产生一系列伪一级连续反应曲线,如由起始的多电荷蛋白质阳离子群体界定。碰撞气体用以在微秒时间尺度(108碰撞每秒)上移除过量能量,因此防止所得产物离子群体的分段。
质子转移反应(PTR)已经成功地用以识别蛋白质混合物中的蛋白质。此混合物简化过程已用于确定高质量蛋白质的电荷态和分子量。PTR也已经用于简化从多电荷前驱体蛋白质离子的碰撞激活导出的产物离子谱。虽然PTR减少了从多电荷蛋白质离子导出的总体信号,但这由所得PTR产物离子的信噪比的显著增益更多地补偿。PTR过程是100%高效的,其产生仅单一系列的反应产物,且不产生需要特殊解译和数据分析的副反应产品。
PTR对肽、多肽和蛋白质的分析的应用的各种方面已经在以下文献中描述:在发明人Hunt等的名义下的第McLuckey号美国专利、在发明人Hartmer等的名义下的第2012/0156707 A1号美国专利预授权公开案、在发明人Zabrouskov的名义下的第2012/0205531 A1号美国预授权公开案;McLuckey等的《离子/离子质子转移动力学:用于从蛋白质混合物的电喷射导出的离子的分析的暗示(Ion/Ion Proton-Transfer Kinetics:Implications for Analysis of Ions Derived from Electrospray of Protein Mixtures)》,《分析化学(Anal.Chem.)》1998,70,1198-1202;Stephenson等的《涉及非共价交互的生物离子的离子-离子质子转移反应:全肌红蛋白(Ion-ion Proton Transfer Reactions of Bio-ions Involving Noncovalent Interactions:Holomyoglobin)》,《美国质谱学会期刊(J.Am.Soc.Mass Spectrom.)》,1998,8,637-644;Stephenson等的《气相中的离子/离子反应:涉及多电荷蛋白质的质子转移反应(Ion/Ion Reactions in the Gas Phase:Proton Transfer Reactions Involving Multiply-Charged Proteins)》,《美国化学学会期刊(J.Am.Chem.Soc.)》,1996,118,7390-7397;McLuckey等的《用于电喷射质谱法中改进的有效质量分辨率的离子/分子反应(Ion/Molecule Reactions for Improved Effective Mass Resolution in Electrospray Mass Spectrometry)》,《分析化学(Anal.Chem.)》,1995,67,2493-2497;Stephenson等的《用于蛋白质混合物分析的离子/离子质子转移反应(Ion/Ion Proton Transfer Reactions for Protein Mixture Analysis)》,《分析化学(Anal.Chem.)》,1996,68,4026-4032;Stephenson等的《用于寡肽混合物分析的离子/离子反应:对由0.5-100kDa组分构成的混合物的应用(Ion/Ion Reactions for Oligopeptide Mixture Analysis:Application to Mixtures Comprised of 0.5-100kDa Components)》,1998,9,585-596;Stephenson等的《用于通过电喷射质谱法的高质量物质和混合物组分的改进质量确定的电荷操纵(Charge Manipulation for Improved Mass Determination of High-mass Species and Mixture Components by Electrospray Mass Spectrometry)》,《质谱学期刊(J.Mass Spectrom.)》,1998,33,664-672;Stephenson等的《经由离子/离子化学方法从多电荷母代离子导出的产物离子谱的简化(Simplification of Product Ion Spectra Derived from Multiply Charged Parent Ions via Ion/Ion Chemistry)》,《分析化学(Anal.Chem.)》,1998,70,3533-3544,以及Scalf等的《电荷减少电喷射质谱法(Charge Reduction Electrospray Mass Spectrometry)》,《分析化学(Anal.Chem.)》,2000,72,52-60。一般离子/离子化学方法的各种方面已经在McLuckey等的《高质量多电荷离子的离子/离子化学方法(Ion/Ion Chemistry of High-Mass Multiply Charged Ions)》,《质谱学回顾(Mass Spectrom.Rev.)》,1998,17,369-407以及在发明人McLuckey等的名义下的第7,550,718B2号美国专利中描述。用于执行PTR且用于减少质谱仪中的离子电荷态的设备已经在以下各者中描述:在发明人Chen等的名义下的第2011/0114835 A1号美国预授权公开案,在发明人Brown等的名义下的第2011/0189788 A1号美国预授权公开案,在发明人Brown等的名义下的第8,283,626 B2号美国专利,以及在发明人Frey等的名义下的第7,518,108B2号美国专利。PTR电荷减少技术对生物的检测和识别的适配已由McLuckey等描述(《用于生物的检测和识别的电喷射/离子阱质谱法(Electrospray/Ion Trap Mass Spectrometry for the Detection and Identification of Organisms)》,生物质谱法的首次联合服务研讨会会刊,巴尔的摩,马里兰州,1997年7月28-30日,127-132)。
由PTR过程产生的产物离子可通过使用被称为“离子停车”的技术积聚到一个或若干电荷态中。离子停车在反应周期期间使用补充AC电压在特定质荷比(m/z)值下将由任何给定蛋白质分子的原始不同地质子化离子形成的PTR产物离子固结为特定电荷态。此技术可用以将产物离子信号集中到单个或有限数目的电荷态中(且因此集中到单个或几个相应m/z值中)以用于较高灵敏度检测或者使用碰撞激活、ETD或其它离子操纵技术的进一步操纵。离子停车的各种方面已经在以下各者中描述:在发明人McLuckey的名义下的第7,064,317 B2号美国专利;在发明人McLuckey的名义下的第7,355,169 B2号美国专利;在发明人McLuckey的名义下的第8,334,503 B2号美国专利;在发明人Le Blanc的名义下的第8,440,962 B2号美国专利;且在以下文献中描述:McLuckey等的《在电动离子阱中的离子/离子反应期间的离子停车(Ion Parking during Ion/Ion Reactions inElectrodynamic Ion Traps)》,《分析化学(Anal.Chem.)》,2002,74,336-346;Reid等的《来自复杂混合物的完整蛋白质的气相浓度、纯化和识别(Gas-Phase Concentration,Purification,and Identification of Whole Proteins from Complex Mixtures)》,《美国化学学会期刊(J.Am.Chem.Soc.)》,2002,124,7353-7362;He等的《在单个气相纯化和浓度程序之后多个蛋白质离子电荷态的解离(Dissociation of Multiple Protein Ion Charge States Following a Single Gas-Phase Purification and Concentration Procedure)》,《分析化学(Anal.Chem.)》,2002,74,4653-4661;Xia等的《混合线性离子阱中的相互存储模式离子/离子反应(Mutual Storage Mode Ion/Ion Reactions in a Hybrid Linear Ion Trap)》,《美国质谱学会期刊(J.Am.Soc.Mass Spectrom.)》,2005,16,71-81;Chrisman等的《平行离子停车:改善电子转移解离中的母代到第一代产物的转换(Parallel Ion Parking:Improving Conversion of Parents to First-Generation Products in Electron Transfer Dissociation)》,《分析化学(Anal.Chem.)》,2005,77(10),3411-3414,以及Chrisman等的《蛋白质混合物的平行离子停车(Parallel Ion Parking of Protein Mixtures)》,《分析化学(Anal.Chem.)》,2006,78,310-316。
技术实现要素:
本发明教示了离子-离子反应化学方法的应用,其中采用质子转移反应以简化从包括从微生物提取的化合物混合物的样本的电喷射电离导出的错离子群体的质谱分析。本发明人已经发现,通过使此些离子的质荷比受限子集经受PTR,所得产物离子的群体包括具有较低总电荷值的电荷态的简单得多的群体(其中词“较低”或“减少”在此上下文中指代在绝对值方面较低或减少),其可容易解析且指派给特定蛋白质或肽离子。因为PTR产物离子表示比原始前驱体离子小的从电荷态的复杂混合物导出的多电荷物质的子集,所以极大地简化质谱解译,且可对从微生物提取物导出的单个蛋白质或其它组分执行使用串连质谱法(MS/MS或MSn)的目标分析。
从给定质子转移反应产生的电荷减少的蛋白质和肽产物离子产生比原始m/z值大的质荷比(m/z)值。对于具有相同m/z值但不同质量和电荷的蛋白质离子的混合物,所述混合物可在微秒或毫秒时间尺度上分离。此外,具有不同质量和电荷的相同m/z值的这些多电荷蛋白质离子可基于反应的电荷平方相依性而与从小分子、脂质、溶剂或其它干扰物导出的低m/z值背景离子分离。多电荷离子因此及时与背景信号分离因此在高度增加的信噪比(s/n)比率下产生分离蛋白质混合物。本发明人已经发现,由于这两个因素,蛋白质/肽或任何其它分析物产物离子的谱特征可以与大多数干扰物离子的那些谱特征显著分离。另外,可执行PTR反应的多个阶段以在低分辨率仪器上分离蛋白质混合物,例如线性离子阱质谱仪,以便简化且隔离这些蛋白质和其它分析物以使得可经由MSn分析执行目标分析。本发明人已进一步发现,通过与PTR反应结合执行“离子停车”程序可甚至进一步放大简单PTR反应的有利性质,因此使得系统分析师能够至少部分地选择或控制由PTR反应产生的产物离子电荷态分布。
PTR也可用以改善质谱法中的高质量性能。在质谱法中,可对离子指派整数标称质量或质荷比或者准确或确切的质量或质荷比。准确或确切的质量或质荷比可视为包括整数分量或值以及十进制分量或值。原子和分子质量是以道尔顿(Da)的单位测得,且m/z比值一般是以每基本电荷的道尔顿或Da/e或汤姆森(Th)的单位给定。应注意,在本文档中的m/z比的描述数值的实例中,此些比率应理解为以每基本电荷的道尔顿或Th的单位提供。准确或确切(即非整数)质量或m/z比可表示为整数标称质量或质荷比值或分量以及对应的十进制分量。因此,如本文档中所使用,准确质量确定或质量分析可视为包括子整数精度,即±0.5Da或更好且优选0.1Da或更好的准确性。
替代地,准确或确切质量或m/z比可在百万分率(ppm)质量准确性方面界定。对于多肽和蛋白质的质谱确定,一般需要50ppm或更好、较优选10ppm或更好且再优选1ppm或更好的实验质量准确性,因为这些分子及其离子经常具有至少10,000Da且多达100,000Da的分子或离子量。因此,如本文档中所使用,准确质量确定或质量分析可替代地被视为包括50ppm或更好、较优选10ppm或更好且再优选1ppm或更好的准确性。
除改善此类型分析的信噪比之外,本发明人还考虑了蛋白质离子上的电荷减少造成这些大离子在气相中再折叠,如Zhao等的《离子/离子质子转移反应对气相细胞色素C离子的构形的影响(Effects of Ion/Ion Proton Transfer Reactions on Conformation of Gas-Phase Cytochrome c Ions)》,《美国质谱学会期刊(J.Am.Soc.Mass Spectrom.)》2010,21,1208-1217中描述。据相信,这带来更紧凑的配置,其减少蛋白质离子的碰撞横截面并且因此增加其稳定性而防止由于与存在于质量分析器腔室中的背景气体分子的碰撞而分段。本发明人已经发现此效应可特别有益于采用镜像电流检测的质量分析器,例如傅里叶变换离子回旋共振(FT-ICR)质量分析器或OrbitrapTM质量分析器(可购自美国马萨诸塞州的Thermo Fisher Scientific of Waltham的一类静电阱质量分析器)中所完成。改进的高质量性能的另一潜在原因是进入由PTR过程产生的给定蛋白质离子的大的能量沉积。由于PTR过程而沉积的能量超过100千卡/摩尔,且随后因碰撞能量的存在而有效地衰减。此快速加热过程使得可能经由离子-偶极子、离子-引发偶极子或偶极子-引发偶极子交互而附着到蛋白质的中性分子“沸腾”。最重要的是,用于高质量蛋白质的电荷态的减少可显著改善这些离子从其中通常执行PTR过程的离子导向器、离子存储或离子捕获装置的相对高压力传送到例如OrbitrapTM质量分析器等质量分析器的较低压力区。减少的电荷态意味着离子以较少动能传送,因此限制了离子散射、直接分段或亚稳定物质的形成。本发明人进一步考虑此后一种性质在例如OrbitrapTM型静电阱质量分析器等准确质谱仪中实现PTR产物离子的高准确性质量分析方面尤其显著,所述准确质谱仪检测在一延伸时间范围中通过循环离子运动产生的镜像电流。
本发明教示尤其可用于具有超过50kDa的分子量的完整蛋白质的分析和识别。本发明人已经发现出人意料的结果,所述结果与上文提到的各种有利因素结合在一起可实现从自然微生物样本导出的极复杂混合物中准确识别多个完整蛋白质或大的肽。此识别可在物质、亚种或甚至菌株层级上实现微生物识别。目标蛋白质或多肽离子单物质或多物质可经选择以便基于先验知识或信息个别地或组合地指示特定微生物或细胞类型或者微生物或细胞类型的特定菌株或变体或者给定毒性因数或毒素在样本中的存在,或者指示微生物或细胞抵抗抗菌剂化合物或抗生素药品的能力。
本发明在一个方面中提供对传统的从下到上蛋白质组研究方法的替代,即经由方法对从微生物细胞导出的完整蛋白质的从上到下分析,所述方法适用于大体上所有微生物,包含革兰氏阳性细菌、革兰氏阴性细菌、分枝杆菌、霉浆菌、酵母、原生动物、丝状(即,微观)真菌。本发明提供甚至在含有微生物的混合物和/或直接来自纯的和/或混合培养基及来自直接样本(例如,表面棉签、体液等)分析的微生物的样本中在种属、物质、亚种、菌株致病变型和血清变型层级对微生物的识别。另外,本文教示的方法可用于毒性因数、抗生素抗性和易感性标记或其它特性的目标检测。本发明教示的从上到下方法是简单且快速的,因为不需要样本的化学或酶分解且实时地实现数据处理。
根据本发明教示的方法可包括以下步骤中的至少一或多个:微生物细胞中断,蛋白质的溶解,样本净化(脱盐、移除不可溶组分和残渣,和/或聚集),样本灌注或流动注入,快速部分液体层析分离,标准层析分离,等电点聚焦,溶液中蛋白质的电离,离子的给定m/z范围的隔离,致使离子的隔离范围经受PTR以便形成第一代PTR产物离子,第一代PTR产物离子的m/z范围的任选隔离,MS或MS/MS模式中的任选质谱法,任选地致使第一代PTR产物离子的隔离范围经受第二PTR反应以便形成第二代PTR产物离子,MS或MS/MS模式中的质谱法,以及经由分子量分析和/或蛋白质序列分析的微生物识别,或使用任何统计分类方法。优选但不一定地,以高分辨率、高准确性质谱仪执行质谱法步骤,例如包括OrbitrapTM质量分析器的质谱仪。
因为执行使用化学反应剂的有限集合的常用方法,所以本发明教示的方法适合于在完全自动系统内使用以用于样本制备和质谱法。理想地,这些方法可从样本制备到结果报告都是自动的。结果可自动传送到医院的电子医疗记录系统,其中结果可直接链接到患者治疗策略、保险、记账或在流行病报告中使用。此集成系统促进了在医院、本地、地区和全球层级对流行病爆发的跟踪。对于高处理量实验室,多个系统可介接到中央计算机,所述中央计算机在报告之前整合来自不同仪器的数据。所述系统可导入表现型易感性数据,其中所述数据可与由本发明产生的识别、毒性、抗生素抗性和键入信息组合。
因此,在第一方面中,揭示一种用于识别液体样本内的蛋白质/多肽或其它生物相关化合物的存在或不存在的方法,所述液体样本包括化合物的混合物,所述混合物包含多种蛋白质化合物或多种多肽化合物或多种蛋白质和多肽或其它化合物,其中所述方法包括:(a)将所述液体样本的一部分或全部引入到质谱仪的电喷射电离源中;(b)通过电喷射电离形成所述液体样本的所述部分的所述化合物混合物的带正电离子,所述带正电离子包括多个离子物质;(c)隔离包括第一质荷比(m/z)比率范围的所述离子物质的第一子集,所述范围包含所述分析物化合物的多质子化分子物质的m/z比;(d)通过致使所述隔离的离子物质的第一子集在预定持续时间中与反应剂阴离子反应而从所述隔离的离子物质的第一子集产生多个第一代产物离子物质,所述反应剂阴离子在反应后从一或多个离子物质中的包括蛋白质或多肽化合物的质子化物质的每一者提取质子;(e)使用质量分析器产生所述第一代产物离子物质或从所述第一代产物离子物质产生的第二代产物离子物质的质谱;(f)进行对所述第一代或所述第二代产物离子物质的所述质谱的搜索以找到作为所述蛋白质或多肽分析物化合物的诊断的一或多个m/z比的集合;以及(g)基于在所述质谱中识别的m/z比的集合与一或多个诊断m/z比的集合之间的相似性量度而产生所述样本内的所述分析物化合物的存在或不存在的确定。所述相似性量度可包括基于发现在经识别m/z比的测得集合中发生的一或多个诊断m/z比的所确定百分比或比例而计算的度量。替代地,可通过比较所述质谱中识别的m/z比的集合与基于蛋白质、DNA或碳水化合物的数据库中包含的集合之间的相似性量度;以及(h)使用前述信息作为使用谱库、基于序列的搜索、统计分类方法(包含但不限于贝叶斯、逻辑回归和决策树分类器)积极地识别任何未知的微生物,来确定样本内的分析物化合物的存在。作为在步骤(b)中形成带正电离子的一个替代方案,实际上可产生带负电分析物离子物质。在此些情况下,选择反应剂阴离子以便将质子转移到分析物离子物质,进而减少其负电荷的绝对值。
在第二方面中,揭示一种识别样本中的微生物类型的存在或不存在的方法,其包括:(i)识别在所述样本中的同时存在是所述样本中的所述微生物类型的存在的诊断的一系列分子量;(ii)识别在所述样本中的同时存在是所述样本中的所述微生物类型的存在的诊断的分析物化合物列表,所述分析物化合物列表包括蛋白质化合物、多肽化合物或蛋白质和多肽化合物两者;(iii)从所述样本提取包括从样本导出的蛋白质和多肽的混合物的液体溶液;(iv)针对所述列表中的每一相应分析物化合物执行分析步骤的集合;以及(v)如果所述液体溶液内识别出所述分析物化合物列表的微生物特定分析物化合物的存在,那么识别所述样本内的微生物类型的存在。针对所述列表中的每一相应分析物执行的分析步骤包括:(a)将所述液体溶液的一部分引入到质谱仪的电喷射电离源中;(b)通过电喷射电离形成所述液体溶液的所述部分的所述化合物混合物的带正电离子,所述带正电离子包括多个离子物质;(c)隔离包括第一质荷比(m/z)比率范围的所述离子物质的第一子集,所述范围包含所述相应分析物化合物的随机或特定预定多质子化分子物质的m/z比;(d)通过致使所述隔离的离子物质的第一子集在预定持续时间中与反应剂阴离子反应而从所述隔离的离子物质的第一子集产生多个第一代产物离子物质,所述反应剂阴离子从一或多个离子物质中的包括蛋白质或多肽化合物的质子化物质的每一者自发地提取质子;(e)使用质量分析器产生所述第一代产物离子物质或从所述第一代产物离子物质产生的第二代产物离子物质的质谱;(f)进行所述第一代或所述第二代产物离子物质的所述质谱的搜索以找到作为所述相应分析物化合物的诊断的一或多个m/z比的集合;以及(g)基于所述质谱中识别的m/z比的集合与一或多个诊断m/z比的所述集合之间的相似性量度而识别所述液体溶液内的所述相应分析物化合物的存在。所述相似性量度可包括基于发现在经识别m/z比的测得集合中发生的一或多个诊断m/z比的所确定百分比或比例而计算的度量。可从谱库或序列数据库导出诊断m/z比。如果在步骤(c)中隔离的m/z比是随机多质子化分子物质,那么在步骤(f)中进行的搜索是基于序列的搜索。否则,如果在步骤(c)中隔离的m/z比是特定预定多质子化分子物质,那么在步骤(f)中进行谱库搜索。除使用前述信息作为使用谱库或基于序列的搜索而积极地识别未知微生物之外,还可利用统计分类方法(包含但不限于贝叶斯、逻辑回归和决策树分类器)用于微生物表征和识别。作为在步骤(b)中形成带正电离子的一个替代方案,实际上可产生带负电分析物离子物质。在此些情况下,选择反应剂阴离子或阳离子以便将质子转移到分析物阴离子物质,从而减少其负电荷的绝对值。本文所描述的PTR实验过程的控制可使用实时光谱解卷积实时地手动或自动执行。
在上文中的术语“实时谱解卷积”指代质谱数据的谱解卷积,其与产生(或已经产生)所述质谱数据的质谱实验或分析运行是同时执行的。举例来说,通过在梯度溶离期间在第一保持层析滞留时间溶离的分析物的质量分析获取的质谱数据可经解卷积,以便识别分析物,同时继续在同一梯度溶离期间在第二较晚的滞留时间溶离的额外分析物的额外质谱数据的收集。同样,可执行额外质谱数据的解卷积以便识别额外分析物,同时继续在同一梯度溶离期间在第三溶离时间溶离的分析物的质谱数据的收集。可通过使用快速计算机来促进实时光谱解卷积,例如采用并行处理或图形处理单元(GPU)执行必要计算的计算机。替代地或另外,可通过使用计算上高效或经优化算法来促进实时谱解卷积,例如至少部分以汇编语言编写或广泛利用高速缓冲存储器中查找表的算法。
更一般地,术语“实时”可理解为意味着当参考与数据获取过程相关联的事件或活动而使用时,在所述数据获取过程的一些方面或子过程在进行中的同时发生所述事件或活动。数据获取过程自身可包含以下个别子过程中的一或多个:样本纯化(例如,固相萃取、尺寸排阻层析);样本分离(例如,层析法);进入质谱仪的样本传送(例如,溶离液从层析仪的灌注或进入);离子源中的样本电离以产生第一代离子;离子的选择和隔离以用于进一步操纵;致使从样本导出的离子的分段或从样本导出的离子与反应剂离子的反应以便产生第一代产物离子;产物离子的任选选择和隔离;产物离子的任选进一步分段或产物离子的进一步反应;离子(第一代离子或第一代或后续代产物离子)到质量分析器的传送,质量分析器的检测器对离子质荷比的检测和测量;以及从检测和测量导出的数据向用于存储、数学分析等的数字处理器的传送。如此界定的可“实时”发生的事件或活动可包含但不一定限于:样本中的分析物的存在的确定或识别;样本中的微生物的存在的识别或确定;以及向用户提供样本中的分析物或微生物的存在的识别或确定的通知。
本发明教示的上述以及各种其它特征和优点将从以下描述和所附权利要求书变得更完全明了,或可通过如下文阐述的本发明的实践而习得。
附图说明
为进一步阐明本发明的以上和其它优点及特征,将参照附图中说明的其特定实施例呈现本发明的更具体描述。应了解,这些图只是描绘了本发明的所说明的实施例,且因此不应当被看作限制了本发明的范围。本发明将以额外特殊性和细节经由使用随附图式进行描述和阐述,附图中:
图1是示意性地说明用于来自至少一个微生物的可溶蛋白质的快速提取和分析以用于识别所述至少一个微生物的系统的框图;
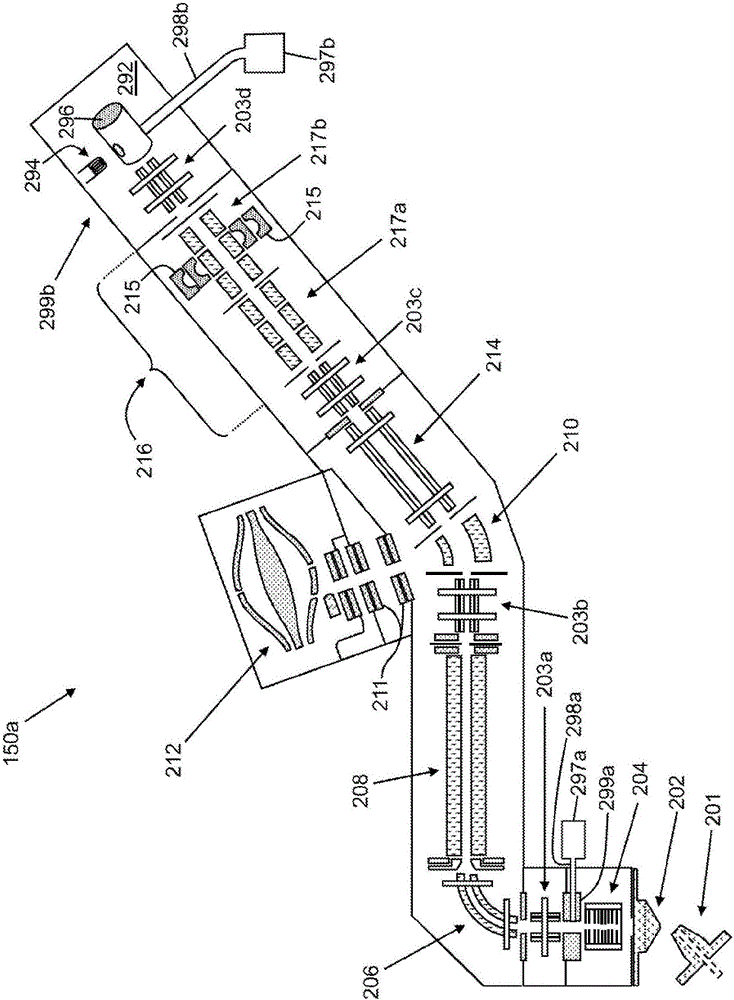
图2是适合于与根据本发明教示的方法结合采用的示范性质谱仪的示意性表示,所述质谱仪包括混合系统,所述混合系统包括四极滤质器、双压力四极离子阱质量分析器和静电阱质量分析器;
图3A是根据本发明教示的第一方法的流程图;
图3B是根据本发明教示的替代方法的流程图;
图3C是根据本发明教示的另一替代方法的流程图;
图3D和图3E说明根据本发明教示的又一替代方法的流程图;
图3F是根据本发明教示的再另一替代方法的流程图;
图4A是经由典型大肠杆菌提取物的直接输注的ESI质谱;
图4B是通过隔离以m/z=750Th为中心的2Th质量窗口内的图4A的大肠杆菌提取物的离子且使隔离的离子与PTR反应剂阴离子反应而产生的PTR产物离子质谱;
图5A是通过隔离以1200Th为中心的宽度5Th的质量窗口内的大肠杆菌提取物的离子且使隔离的离子与PTR反应剂阴离子反应而产生的第一代PTR产物离子的质谱;
图5B是通过隔离以1320Th为中心的宽度5Th的质量窗口内的图5A的第一代PTR产物离子的离子且第二次使隔离的第一代产物离子与PTR反应剂阴离子反应而产生的第二代PTR产物离子的质谱;
图6A是通过隔离以640Th为中心的宽度5Th的质量窗口内的大肠杆菌提取物的离子且使隔离的离子与PTR反应剂阴离子反应而产生的PTR产物离子的质谱;
图6B是选自图6A的产物离子集合且具有833Th的m/z比的隔离的PTR产物离子物质的质谱;
图6C是通过图6B的隔离的PTR产物离子物质的碰撞引发的解离(CID)产生的第二代产物离子的质谱;
图6D是选自图6A的产物离子集合且具有926Th的m/z比的隔离的PTR产物离子物质的质谱;
图6E是通过图6D的隔离的PTR产物离子物质的碰撞引发的解离产生的第二代产物离子的质谱;
图6F是选自图6A的产物离子集合且具有917Th的m/z比的隔离的PTR产物离子物质的质谱;
图6G是图6F的隔离的PTR产物离子物质的碰撞引发的解离产生的第二代产物离子的质谱;
图7A是根据本发明教示的通过电喷射产生的第一代前驱体离子的多个m/z范围的同时隔离和反应进行的选定分析物的离子向PTR产物离子集合的改进效率的PTR转换的方法的示意性绘图;
图7B是如离子的改进效率的PTR转换方法的初始步骤中可采用的用于PTR反应的电喷射产生的第一代前驱体离子的第一随机所选范围的隔离的示意图;
图7C是如可用作离子的改进效率的PTR转换的方法的中间步骤的对应于不同分析物分子的PTR产物离子的两个电荷态序列的辨识的示意性绘图;
图8是根据本发明教示的选定分析物的离子向PTR产物离子集合的改进效率的PTR转换的方法的流程图;
图9A是在大肠杆菌提取物的十分钟梯度反相液相层析分离的过程期间在10分钟30秒的滞留时间下从溶离液产生的第一代离子的全扫描质谱;
图9B是在以750Th为中心的10Th宽隔离窗口内使六氟化硫与图9A的样本的隔离离子群体反应10ms产生的PTR产物离子谱;
图10A是在大肠杆菌提取物的六十分钟梯度反相液相层析分离的过程期间在42分钟30秒的滞留时间下从溶离液产生的第一代离子的全扫描质谱;
图10B是通过在以750Th为中心的10Th宽隔离窗口内使六氟化硫与图10A的样本的隔离离子群体反应10ms产生的PTR产物离子谱;
图11A是在三十分钟梯度反相液相层析分离的过程期间在18分钟9秒的滞留时间下从溶离液产生的第一代离子的全扫描质谱;
图11B是通过在以750Th为中心的10Th宽隔离窗口内PTR反应剂离子与图11A的样本的隔离离子群体的反应产生的PTR产物离子谱;
图11C是在图11A中标绘了其较早溶离结果的同一三十分钟梯度反相液相层析分离的过程期间以22分钟27秒的滞留时间从溶离液产生的第一代离子的全扫描质谱;以及
图11D是通过在以750Th为中心的10Th宽隔离窗口内PTR反应剂离子与图11C的样本的隔离离子群体的反应产生的PTR产物离子谱。
具体实施方式
呈现以下描述以使所属领域的技术人员能够制作并使用本发明,并且在特定应用和其要求的情况下提供以下描述。对于本领域技术人员来说,对所描述的实施例的各种修改将是显而易见的,并且在此的一般原则可以应用到其他实施例。因此,本发明并不希望限于所示的实施例和实例,而是应被赋予根据权利要求书的最广可能的范围。参照附图1到11结合以下描述,本发明的具体特征和优点将变得更加清楚。
现参看图1,示意性地说明用于从一或多种微生物提取蛋白质、检测所述蛋白质且识别所述一或多种微生物的系统100。系统100包含样本处置装置115、可由样本处置装置115接达的样本110,以及反应剂、缓冲剂及类似物的源120,这些源通过各种管道或其它传输线流体地耦合到样本处置装置115。系统100进一步包含第一以及任选地第二样本纯化装置135(例如固相萃取盒),其经配置以用于清洁样本(例如,去盐、移除污染物、聚集蛋白质),以及任选的层析柱140,其可经配置以用于通过在质谱分析之前的液相层析而至少部分地纯化样本110。至少一个样本纯化装置135可包括直列式尺寸排阻层析柱,其可用以不仅移除盐而且还移除小分子和脂质。样本110、第一和任选的第二样本纯化装置135以及任选的层析柱140与流体处置泵130、各种反应剂、缓冲剂和其它流体120以及质谱仪150成流体连通。
样本处置装置115能够准备含有一或多种微生物的某一范围的样本类型,且将从所述微生物提取的可溶蛋白质部分递送到质谱仪150用于分析。样本110可为疑似含有一或多种微生物的任何类型,包含但不限于来自培养基板的隔离的群落、来自液体生长介质的细胞、血液、血培养基、唾液、尿、粪便、痰液、伤口和身体部位棉签、土壤、食物、饮料、水、空气以及环境表面棉签。
样本处置装置115可包含细胞中断构件、机器人液体处置构件、离心机、过滤构件、孵育箱、混合构件、真空泵、流体泵以及反应剂120中的一或多者,其可用于微生物的中断以及可溶蛋白质部分的隔离。细菌、真菌、霉浆菌细胞、病毒及类似物的中断可通过机械、化学、酶和其它方式实现,如此项技术中通常已知。机械方法包含打珠、例如French压机及类似物的压力的使用、超声处理或此项技术中已知的其它方法。化学方法包含暴露于例如尿素、硫脲或胍HCl等离液剂以使微生物细胞裂解且溶解其内含物。替代地,有机酸/溶剂混合物可用来破坏细胞。酶方法包含使用溶菌酶、溶葡球菌酶或其它裂解酶类以在细菌细胞壁中形成“孔”,其允许内含物渗出到周围溶液中。
如图1中所说明,系统100进一步包含任选的控制单元160,其可通过联动装置170a-170d链接到系统100的各种组件。举例来说,控制单元160可链接到样本110以控制样本施加,链接到反应剂120以控制各种反应剂的施加,链接到泵130以控制流体处置、流动速率等,链接到样本处置装置115以控制样本准备,且链接到质谱仪150以控制质谱法参数。在所说明的实施例中,控制单元160也可充当数据处理单元以例如处理来自质谱仪150的数据,或将数据转发到服务器以用于处理和存储(图1中未图示服务器)。控制单元160也可实时确定PTR产物离子的任何产生的分子量和电荷态以用于MS/MS、MSn或分子量确定。控制单元160也可用以将结果自动转发到医疗保健专业人士。
在一些实施例中,系统100经设计以由临床医生或一般实验室技术员使用,其不一定在样本准备、LC-MS操作、LC-MS方法开发及类似等所有方面中都有专业技能。因此,控制单元160可经设计以通过为用户提供简化应用程序接口而囊封数据系统环境,所述应用程序接口可用以起始且监视测定样本110的基本上所有方面而不需要用户与系统100的总体硬件和控制系统交互。控制单元160因此经配置以提供用户与控制着装置、数据文件和用于将数据转换为用户可读形式的算法的底层服务之间的分离程度。即,控制单元160使得用户不需要知道或控制硬件以用于分析临床样本,且提供简化接口以从质谱仪发送和接收信息。
控制单元160可经配置以内部地监视每一样本分析请求,且能够通过系统100始终跟踪分析请求。一旦系统100正在获取或已经获取样本110的数据,则控制单元160可经配置以基于由用户选择的测定类型而自动开始后处理数据。最重要的是,控制单元160可经配置以在获取过程期间实时处理数据。此处实时地将结果返回到用户,其包含微生物识别、毒性和抗性表征、菌株匹配信息,以及关于抗生素易感性测试的数据。此外,控制单元160可经配置以基于由用户选择的测定类型而自动选择后处理参数,从而一旦测定已选定且开始用于分析则进一步减少用户与系统交互的需要。控制单元160可被设计为配合于系统100与用户之间的层,以减少设置样本测定以用于获取所需的复杂性。控制系统160还可经配置以仅将最相关数据返回到用户以避免用户接收太多的额外信息。
在一个实施例中,系统100可进一步包含可操作地耦合到样本处置装置115或与其集成的样本检测装置(未图示)。所述样本检测装置可与样本处置装置115一起工作或独立于样本处置装置115而执行以下功能中的至少一者:i.识别进入系统的样本;ⅱ.识别用于进入系统的样本的测定类型;iii.基于预期测定类型和/或所关注的分析物而选择测定协议;ⅳ.引导样本处置装置和/或控制系统以起始对样本中所关注的分析物的分析;v.引导控制系统基于针对测定类型和/或所关注的分析物选定的测定协议而选择一或多种反应剂;vi.引导控制系统基于针对测定类型和/或所关注的分析物选定的测定协议而选择液相层析移动相条件,且致使液相层析系统执行测定和/或纯化所关注的分析物;vii.引导控制系统基于针对测定类型和/或所关注的分析物选定的测定协议而选择质谱仪设定,且致使质谱仪产生与选定测定类型和/或所关注的分析物相关联的质谱数据;以及viii.引导控制系统分析与选定测定类型和/或所关注的分析物相关联的质谱数据以识别所关注的分析物的存在和/或浓度。
样本或经处理样本可在质谱法的分析之前经净化和或纯化。此纯化或样本净化可指代从粗细胞提取物移除盐或脂质的程序,或使所关注的一或多种分析物相对于样本的一或多种其它组分变丰富的程序。其也可指代具有用于处置分枝杆菌或丝状真菌的生物安全三级机构的单独实验室中的样本处理和净化。在此实施例中,样本传送到系统且可如先前所描述进行分析。在一个实施例中,此纯化或样本净化可通过固相萃取装置、直列式尺寸排阻层析和/或任选的层析柱140实现。
在一个实施例中,第一和/或第二样本纯化装置135可包含固相萃取(SPE)盒。在一些实施例中,SPE盒可直接与高分辨率/高质量准确性质谱仪150成直列式。在一个实施例中,SPE盒可为具有具有小体积的二氧化硅或其它吸附剂的聚丙烯尖端,其含有固定于盒中的键合的C4、C8或C18或其它官能团,例如StageTipTM盒(Thermo FisherScientific)。在替代实施例中,可使用聚合吸附剂或螯合剂。床体积可小达1μL或更小,但也可以使用较大体积。所述设备和方法良好地适合于从微生物细胞导出的复杂样本,因为每一SPE盒仅使用一次,从而使从一个样本到另一样本的残留问题最小化。
在一个实施例中,样本纯化装置135可为直列式尺寸排阻层析柱,其经设计以从样本110移除盐、小分子和脂质。所述方法还可用以分离媒介与大分子量蛋白质。将相选择为与部分(即,少于100%)有机溶液和有机酸相容。相可适应分子量从103到108Da不同的蛋白质尺寸分布。实时经调流动速率以实现完整蛋白质从小分子的分离,其中分离流动速率通常比用以从系统移除小分子、脂质和盐的较高流动速率小得多。在此实施例中,样本纯化装置135也可以经加热以促进完整蛋白质的较快扩散速率,因此显著缩短运行时间。移动相通过样本纯化装置135的流动也可以在净化过程的一部分期间分流,以从流动的流移除某些杂质且防止其进入质谱仪150。
在一个实施例中,任选的层析柱140可包含经配置以用于样本中的蛋白质的至少部分层析分离的柱。层析柱中的固定相可为多孔或非多孔的二氧化硅或琼脂糖颗粒,或所述柱内部聚合或另外形成的单块材料。所述固定相可涂覆有适当材料,例如C18、C8、C4或另一合适的衍生物,或含有阳离子交换剂或其它材料,或以上的组合以促进蛋白质的分离,且此材料可以化学方式键合到颗粒或在所述柱内为单块的。颗粒大小通常在1.5μm到30μm的范围内变化。孔径可以在50到300埃的范围内变化。柱的内径通常在50μm到2.1mm的范围内变化,且柱长度在约0.5cm到25cm的范围内或以其它方式变化。移动相或溶离剂可为纯溶剂或者两种或更多种溶剂的混合物,且可含有添加的盐、酸和/或其它化学改质剂。蛋白质基于一或多个生理化学性质在柱上分离,包含大小、净电荷、疏水性、亲和力或其它生理化学性质。层析分离方法包含离子交换、尺寸排阻、HILIC、疏水性交互、亲和力、正常相或反向相层析法中的一或多者。
纯化样本的额外方法可包含(不限于)液相层析、HPLC、UHPLC、沉淀、固相萃取、液-液提取、透析、亲和力捕获、电泳、过滤、超过滤或此项技术中已知用于纯化的其它合适的方法。
已经描述涉及在质谱法分析之前使用HPLC用于样本净化的各种方法。所属领域的技术人员可选择适合于在本发明中使用的HPLC仪器和柱。层析柱通常包含媒介(即,填充材料)以在空间和时间上促进化学部分的分离。所述媒介可包含极小颗粒,其可具有与各种化学部分交互以促进所关注的分析物的分离的键合表面。一个合适的键合表面是疏水性键合表面,例如烷基键合表面。烷基键合表面可包含C4、C8或C18键合烷基。另外,也可以使用现有技术水平中已知的单块和其它相。层析柱包含用于接收样本的入口端口以及用于排放包含部分分离样本的流出物的出口端口。举例来说,测试样本可在入口端口处施加于柱,以溶剂或溶剂混合物溶离,且在出口端口处排放。在另一实例中,多于一个柱可循序地使用或作为二维(2D)层析法系统,其中测试样本可在入口端口处施加于第一柱,以溶剂或溶剂混合物溶离到第二柱上,且以溶剂或溶剂混合物从所述第二柱溶离到出口端口。可选择不同溶剂模式用于溶离分析物。举例来说,可使用梯度模式、等度模式或多型(即混合)模式执行液相层析。
图2是可用作图1的质谱仪150的示范性质谱仪150a的示意性绘图。在图2中说明的质谱仪是混合质谱仪,包括多于一个类型的质量分析器。具体地说,质谱仪150a包含离子阱质量分析器216以及OrbitrapTM分析器,其为一类静电阱质量分析器。如下文将描述,由于根据本发明教示的各种分析方法采用多次质量分析数据采集,因此混合质谱仪系统可有利地用以通过同时使用两个或更多个分析器而改善工作循环。OrbitrapTM质量分析器212采用镜像电荷检测,其中通过借助离子阱内的离子的运动检测电极上引起的镜像电流而间接检测离子。
在质谱仪150a的操作中,电喷射离子源201提供待分析的样本的离子到撇渣器202的孔隙,在此处离子进入第一真空腔室。在进入之后,由堆叠环离子导向器204将离子捕获且聚焦为密集束。第一离子光学传送组件203a将束传送到下游的质谱仪的高真空区。大多数剩余的中性分子和不合意的高速度离子群集(例如溶合离子)通过弯曲束导向器206从离子束分离。中性分子和离子群集跟随直线路径,而所关注的离子由曳力场引起弯曲约九十度转弯,从而产生分离。
质谱仪150a的四极滤质器208在其常规意义上用作可调谐的滤质器以便仅在选定窄的m/z范围内使离子通过。后续离子光学传送组件203b将经过滤离子递送到弯曲四极离子阱(“C阱”)组件210。C阱210能够沿着四极滤质器208与离子阱质量分析器216之间的路径传送离子。C阱210也具有临时收集且存储离子群体并且然后将离子作为脉冲或包递送到OrbitrapTM质量分析器212中的能力。离子包的传送是通过在C阱210与安置于C阱210和OrbitrapTM质量分析器212之间的一组注入电极211之间施加电位差来控制。C阱的曲率经设计以使得离子群体在空间上聚焦以便匹配OrbitrapTM质量分析器212的入口孔径的接受角。
多极离子导向器214和光学传送组件203b用来在C阱210与离子阱质量分析器216之间导引离子。多极离子导向器214提供临时离子存储能力以使得在分析方法的第一处理步骤中产生的离子可稍后被取得以用于后续步骤中的处理。多极离子导向器214也可充当分段单元。沿着C阱210与离子阱质量分析器216之间的路径的各种栅电极是可控的,以使得离子可在任一方向上传送,这取决于任何特定分析方法中所需的离子处理步骤的序列。
离子阱质量分析器216是双压力线性离子阱(即,二维阱),其包括高压线性阱单元217a和低压线性阱单元217b,所述两个单元定位成邻近于彼此,通过具有小孔隙的板透镜分隔开,所述小孔隙准许所述两个单元之间的离子传送且呈现泵送限制并允许在所述两个阱中维持不同的压力。高压单元217a的环境有利于离子冷却、通过碰撞引起的解离或电子转移解离的离子分段,或例如质子转移反应等离子-离子反应。低压单元217b的环境有利于以高分辨力和质量准确性进行分析扫描。低压单元包含双倍增极离子检测器215。
质量分析方法内的电子转移解离或质子转移反应的步骤的使用需要在质谱仪内引起受控离子-离子反应的能力。离子-离子反应又需要产生反应剂离子以及致使反应剂离子与样本离子混合的能力。如图2中所描绘的质谱仪150a说明两个替代的反应剂离子源,第一反应剂离子源299a安置于堆叠环离子导向器204与弯曲束导向器206之间,且第二反应剂离子源299b安置在仪器的相对端,邻近于线性离子阱质量分析器216的低压单元217b。大体上,任何特定系统将至多仅包含一个反应剂离子源。然而,此处为了说明性目的而描绘且论述两个不同反应剂离子源。虽然以下论述是针对用于PTR的反应剂离子源,但类似论述可应用于ETD反应剂离子源。
第一可能的反应剂离子源299a可位于堆叠环离子导向器204与弯曲束导向器206之间。反应剂离子源299a包括辉光放电单元,其包括暴露于反应剂气体导管298a的一对电极(阳极和阴极),所述反应剂气体导管从具有使反应剂化合物挥发的加热器的反应剂液体(或固体)储集器297a递送反应剂气体。当跨电极施加高电压时,起始辉光放电,其使在电极之间流动的反应剂电离。来自辉光放电源的反应剂阴离子被引入到在四极滤质器208前方的离子光学元件路径,在其内它们可进行m/z选择。反应剂离子接着可在多极离子导向器214中积聚,且随后传送到双压力线性离子阱216的高压单元217b中,在其内使得它们可用于PTR反应。反应产物可直接传送到低压力单元217a或OrbitrapTM质量分析器212用于m/z分析。
可能的替代反应剂离子源299a可邻近于低压力线性阱单元217b定位,在此其可包括额外高真空腔室292,反应剂离子可以从所述高真空腔室通过腔室292与高压单元之间的孔隙而引导到高压力单元217b中。在操作中,气态反应剂化合物从具有使反应剂化合物挥发的加热器的反应剂液体(或固体)储集器297b供应,且被引导通过反应剂气体导管298b,所述反应剂气体导管将反应剂气体递送到部分地被限制的离子产生体积296中。在操作中,从电加热长丝294供应的热离子电子通过在长丝294与加速器电极(未图示)之间施加电位而以某一预定能量引导到离子产生体积296中。供应的高能电子造成反应剂气体的电离以便产生反应剂离子。反应剂离子接着可在栅电极(未图示)的操作下由离子光学传送组件203a导引到高压单元217b中。
根据本发明教示的示范性方法在图3A到3F中所示的流程图中示意性地说明。图3A示意性地说明用于监视微生物样本中的某些特定目标分析物蛋白质或肽的存在并任选地量化的第一种此类示范性方法,方法300。方法300的初始步骤302、304和306分别是微生物中断(例如,裂解)和提取、固相净化或尺寸排阻层析以及层析分离的步骤,如上文所描述。在一些实验情形中,可在后续样本引入步骤308中将所提取样本直接灌注到质谱仪中,因此,步骤304和306由虚线展示为任选的。也可以使用离线方法制备样本,包含透析或现有技术水平中已知的其它技术。然而,在许多其它实验情形中,步骤304和306是有用的以便在质谱分析之前至少部分地纯化样本。
当必须根据时间约束完成分析时,如一些临床应用中,分析所需的时间可通过采用SPE步骤304(如发明人Enke的U.S.5,175,430中所描述的时间压缩层析法步骤)或如国际(PCT)专利申请公开案WO 2013/166169 A1中所描述的层析法步骤306中的“快速部分层析分离”(FPCS)的方法而缩短。大体上,在执行FPCS中,含有各种有机和无机分析物的复杂混合物的微生物细胞的粗提取物(小有机分子、蛋白质及其天然产生片段、脂质、核酸、多糖、脂蛋白等)加载于层析柱上且经受层析法。然而,并非允许梯度来单独地溶离每一分析物(理想地,每层析峰一种分析物),而是有意加速所述梯度以使得在例如近似八分钟或更短时间内、且优选地五分钟或更短时间内大体上不获得层析峰,而不是获得基线分离原本将需要的长得多的运行时间。在FPCS分离中,许多分析物是根据其性质以及使用的层析法的类型(反相、HILIC等)而在任何给定时间从柱有意地共溶离。部分或不完全分离也可通过所属领域的技术人员已知的其它方法实现,包含但不限于减少化合物在柱上的保持的移动相溶剂和/或改质剂的使用,减少化合物在柱上的保持的固定相媒介的选择(包含粒度、微孔尺寸等),层析系统以较高流动速率的操作,层析系统以高温的操作,或不同层析分离模式(即,反相、尺寸排阻等)的选择。FPCS技术产生很少或可能不产生跨越整个梯度的解析层析峰。因此,从层析图导出的大体上仅相关信息是从柱的溶离时间。记录的每一质谱表示共溶离分析物的“子集”,其随后经电离、在质量分析器中分离且被检测。
在步骤308(图3A)中,将样本引入到质谱仪中。所述样本可提供为从SPE盒、层析法设备或替代地通过溶离液溶液的直接输注而出现的溶离液材料。在提供到质谱仪后,通过质谱仪的电喷射电离源将样本化合物电离(步骤308)。这些电喷射产生的离子在本文称为“第一代”离子。在此时,可任选地执行完整或分段MS1扫描(步骤309)以便识别m/z空间中的富蛋白质区。(应注意在本文档中,可采用术语“扫描”来当用作名词时一般指代质谱,或替代地当用作动词时指代质谱的获取)。在优选实施例中,可在质谱仪仪器的完整质量范围上获得MS1扫描以便能够随后以数据相依或独立方式选择谱的富信息部分以用于隔离(步骤310)。然而,在目标分析的情况下,MS1扫描可能是不必要的,且方法300的执行可直接继续到步骤310,其中随后隔离离子的子集以用于进一步反应和分析。当采用目标分析时,在步骤310中执行的隔离可以使得某一预定m/z范围或可能多个预定m/z范围内的离子被保持以用于后续反应和分析,而一或多个预定m/z范围外的离子被丢弃。预定m/z范围经选择以便对应于目标分析物蛋白质或肽的优选地已知m/z比,在方法的执行中检测或监视所述目标分析物蛋白质或肽的存在或数量。
大体上,可以已知方式通过将来自离子源的离子引入到离子阱(例如三维离子阱、弯曲离子阱(有时称为“C阱”)、单片段线性离子阱、多分段线性离子阱、多极离子导向器或四极滤质器)中,并且然后通过跨离子阱的电极对施加补充AC电压或施加适当RF/DC电压比以隔离所关注的离子群体而共振地喷出m/z比在所希望范围之外的离子,来执行步骤310的隔离。在一些实施例中,补充电压的频率可扫过各种频率以使得离子根据其m/z比按顺序喷出。在此些情况下,可在离子喷出时检测离子以便产生离子的原始集合的质谱。然而,由于在此阶段可能不需要质谱,因此可替代地施加补充AC电压作为叠加频率的组合,其经选择以便造成m/z比在所希望范围之外的离子的基本上同时排出。在一些实施例中,叠加频率的组合可具备遗失频率的多个片段(即,“缺口”)以使得包括两个或更多个非邻接m/z比范围的离子在阱内同时隔离。非邻接m/z比范围中的每一个可对应于相应唯一目标分析物蛋白质或肽的优选地已知m/z比。四极滤质器的施加RF/DC电压比率也可用以隔离所关注的经界定或目标质量范围。第一代离子的特定m/z范围是通过单个或一系列固定RF/DC电压比率而选择以便选择适当的质量隔离窗口。在此情况下采用的起作用的配置可为混合质谱仪仪器,其包括四极、C阱、OrbitrapTM质量分析器以及高能量碰撞池(HCD),其中隔离的离子群体可存储在C阱或HCD池中用于PTR实验。第一代离子的隔离群体在本文称为“前驱体”离子,因为这些离子将经受后续离子-离子反应或分段。
在优选实施例中,前驱体离子群体的隔离可在分段线性离子阱的第一片段中执行。在所需离子群体的隔离之后,多电荷蛋白质离子群体可有利地移动到线性离子阱的另一片段。这些步骤可在PTR过程之前针对前驱体离子的隔离的经界定范围重复多次。
接着,使用具有化学电离的基于铼的长丝或辉光放电电离源从合适的基于高电子亲和性的气态反应剂产生阴离子。可使用氮气、甲烷、异丁烷或现有技术水平中的其它已知气体执行化学电离。阴离子反应剂可为在室温下的气体,或可为具有足够蒸气压力以产生过量阴离子的液体,所述过量阴离子将在伪一级反应条件下驱动PTR过程。阴离子随后从源区传送到分段线性阱,借此使用如上文所描述的补充AC电压使特定阴离子反应剂质量隔离。阴离子源可与电喷射源成直列式或安装在分段线性离子阱的相对端上。替代地,四极滤质器也可执行阴离子隔离,其中后续PTR过程在仪器的C阱或HCD池中发生。
在方法300(图3A)的步骤312中,在步骤310中经质量隔离的离子(即,“前驱体”离子)经受质子转移反应,其中反应剂阴离子物质在指定时间周期中与离子阱中的样本前驱体离子反应以便从前驱体阳离子提取质子。在一个实施例中,通过调整分段线性离子阱的DC电压偏移以便存储多电荷正离子与单电荷阴离子以促进PTR过程,而使多电荷前驱体离子群体与单电荷阴离子群体反应。反应剂阴离子经选择以使得在此实例中反应剂阴离子表现为碱,且使得前驱体离子表现为一或多种酸。反应剂阴离子是通过具有足够蒸气压力的合适的反应剂气体/液体的单独电离而形成,其包含(但不限于)六氟化硫、全氟-1,3-二甲基环己烷、全氟萘烷以及全氟菲烷。在允许反应继续指定时间之后,跨越离子阱的电极施加补充AC电压以便排出反应剂阴离子,从而在离子阱内留下产物离子并且可能留下一些残余前驱体离子。
在相反极性实验中,从蛋白质或其它生物分子导出的多电荷阴离子也可与单电荷阳离子反应。可采用多种源来产生单电荷阳离子,包含电子、化学和电喷射电离过程。这些反应遵循先前描述的相同反应动力学。典型反应剂阳离子包含吡啶、苯并(f)喹诺酮以及惰性气体氩和氙。另外,相反极性的多电荷蛋白质也已反应,以及来自核酸的多电荷阴离子与蛋白质的多电荷阳离子也已反应。
在方法300(图3A)的步骤314中,从在所关注的m/z比的完整范围中保持于离子阱中的来自PTR过程的产物离子获得质谱。可用已知方式通过按其m/z比次序检测从3D或线性离子阱循序地喷出的离子而获得质谱。替代地,可将离子引导到质谱仪的不同质量分析器,例如飞行时间(TOF)质量分析器或OrbitrapTM型静电阱质量分析器,以用较大准确性或质量分辨率进行分析,随后通过离子阱的顺序扫描而可用。此外,通过将产物离子引导到单独分析器,在正执行质量分析时可以对离子阱重新填充前驱体离子的新样本。如果准确质量分析器是检测由离子阱内的循环离子运动产生的镜像电流的类型,例如FT-ICR质量分析器或OrbitrapTM质量分析器,那么PTR反应步骤可有利地减少目标蛋白质或多肽分子的碰撞横截面,以使得这些分子在阱中保持稳定足够的时间长度以产生高质量质谱。并且,PTR产物离子当在其传送到OrbitrapTM质量分析器后离开高压力C阱区时将具有较少动能。由于PTR过程,所得产物离子群体将完全去溶剂化,这将改善所得质谱的质量。
在方法300的步骤316中,自动检查由在步骤314中执行的质量分析产生的质谱,以便辨识一或多个个别系列的相关m/z比,其中一系列的每一m/z比表示单个完整蛋白质或多肽分子的相应不同电荷态,即不同质子化程度。举例来说,参见图9C,其描绘两个不同系列的行,分别由包络905和包络906表示。在电离之后以及在PTR反应之后,具有质量mp的每一蛋白质或多肽分子M表示为至少一种(且可能若干不同)蛋白质或多肽阳离子物质。由特定分子M形成的相关系列的每一此类阳离子物质可由化学式(M+zH)z+表示,其中整数z是加合到原始分子的质子的数目或是在PTR步骤之后在蛋白质上剩余的质子的数目。在此实例中,仅考虑单同位素离子,质荷比(m/z)ion因此如下给出:
(m/z)ion≈(mp+z×1.007)/z≈(mp+z)/z≈mp/z(等式1)
其中最终近似是得自mp>>z的事实。因此,仅表示质子化的不同状态的此系列的离子物质可通过实时使用自动软件以确定单同位素离子而容易辨识。一旦已经辨识出此系列,便可实时辨别母代蛋白质或多肽分子的分子质量mp。也可以使用平均或单同位素质量将类似方法应用于较大分子量的分子。
由PTR过程产生的m/z值或替代地从PTR产物离子获得的分子量可随后对照含有个别病原体标准的数据库进行搜索,所述标准含有来自已知参考标准/患者样本的观测m/z值或分子量。通过匹配来自含有个别参考病原体的数据库的这些m/z值或分子量,获得可能的病原体识别的小子集。可通过确定特定质量准确性、将个别峰的强度加权和/或通过在给定评分系统中按质量计将分子量值加权来限制所述子集。图3A的步骤402中说明此情况。在某些情况下,m/z或分子量匹配可提供与特定病原体识别的直接匹配。然而,在所有概率中,m/z分子量信息将大体上减少可使用串连质谱法明确地识别的可能病原体识别的数目。在国际(PCT)专利申请公开案WO 2013/166169 A1中最初描述此过程以与步骤302、304、306和308-310结合使用。另外,可采用贝叶斯、逻辑回归或基于决策树的方法以进一步精炼病原体的识别。在优选实施例中,在数据获取期间(即,在正分析样本时)实时执行此m/z或分子量搜索。替代地,也可在获取后(即,在已分析样本)之后执行搜索。蛋白质的少量m/z值或分子量(3到10个)与参考数据库的比较将一般足以显著减少病原体识别的候选数目为五个或更少。图3A的步骤404说明此情况。
图3B示意性地说明根据本发明教示的第二示范性方法方法370的流程图。方法370(图3B)的步骤302-314相同于方法300(图3A)的类似编号的步骤,且因此此处不重复这些步骤的描述。方法370不同于方法300之处仅关于在步骤314中产生质谱之后的步骤。根据早先描述的方法300,PTR产物离子的此质谱假定足以检测或定量所关注的蛋白质和多肽。然而,在许多情况下,可能在PTR反应产物的产生之后必须执行串连质谱法(有时称为MS/MS或MSn)以便解析特定蛋白质或多肽分子的辨识中的剩余不明确性。在此些情形中,PTR反应产物可视为包括第一代反应产物,其随后分段以形成第二代产物离子。第一代反应产物的特定m/z比与片段离子的一或多个特定m/z比的组合在许多情况下可允许与给定病原体相关联的特定蛋白质或多肽分子的识别。在许多情况下,以特定病原体识别的蛋白质也可以在其它类似病原体中找到。为了正确地识别单个病原体,可能需要对以给定PTR分数或同一样本的多个PTR分数存在的一样多的蛋白质执行方法370(具体地说串连质谱法)。
因此,方法370(图3B)的步骤318-322表示应用于由PTR形成的离子的串连质谱法或选定反应监视(SRM)的技术的应用。如果特定采用的质谱法系统准许,那么PTR产物离子的一部分可能已经存储(紧接在步骤312之后)在质谱仪系统的离子存储设备中。在此些情况下,分支步骤315致使步骤317a的执行,其中检索先前存储的离子用于进一步处理。否则,如果质量分析步骤(步骤314)耗尽PTR产物离子的先前批次,那么根据替代的步骤317b,可能需要重新执行步骤308-312以便产生此些PTR产物离子的新批次。
在方法370的步骤318中,一特定m/z范围或多个特定m/z范围内的某些PTR反应产物离子(即,第一代产物离子)通过喷出m/z比不在所关注的一或多个范围内的离子而被质量隔离。在步骤320中随后将隔离的离子分段。特定所选的一或多个范围将一般响应于在步骤316的执行之前立即识别的特定经识别电荷态序列的细节,且所述选择将一般由计算机自动做出。因此,用于隔离和分段的一或多个特定m/z范围的选择是所谓的“数据相依分析”(或“数据相依获取”等)的实例。
在涉及几百到几千道尔顿的低质量分子的大多数常规MS/MS分析中,数据相依分段包括基于先前MS1数据获取的信息挑选“最高P数目的最充足的前驱体”用于串连质量分析,其中数目P是常数或可能是由用户输入的变量。已发现此常规形式的数据相依分析当在生物聚合物分析物的多组分样本的分析中使用时表现并不良好。举例来说,图7C说明分别由包络905和包络906表示的两个电荷态分布。在此实例中,每一包络对应于不同的相应分析物分子物质。因此,由包络905和906包含的行的集合可被称为“分子物质相关电荷态分布”。考虑图7C中的行(个别m/z值)表示前驱体离子,则如果P=10,那么常规数据相依分段技术将选择包络906下方的十个最左边实心垂直线用于分段。使用常规技术,将不选择对应于包络905的点线。常规程序因此将产生与对应于包络906的分子物质相关的冗余信息且不产生与对应于包络905的分子物质相关的信息。
为了克服当应用于高分子量分子时常规数据相依分段的缺点,本发明人已经开发本文使用的新颖“最高P个唯一分析物特定群集”数据相依技术以便替换先前的“最高P数目的最充足的前驱体”逻辑以应用于高分子量分子。每一分子物质相关电荷态分布是根据新颖“最高P个唯一分析物特定群集”逻辑解译为全部从单个唯一分子产生的相关质谱线(m/z值)的集合。每一分子物质相关电荷态分布将被指示为在电离之前已经从单个分子产生的各种电荷态和同位素群集分组在一起。然而,分子物质相关分布排除了在数据分析之前移除的加成物。根据所述新颖方法,仅对给定分子物质相关电荷态分布包络的一个(或可能更多)选定代表执行分段,从而避免上文与常规数据相依分段方法相关联所述的冗余。根据新颖“最高P个唯一分析物特定群集”逻辑,在已针对第一分子物质相关电荷态分布选择代表性m/z比(或多个比率)之后,任何进一步分段是针对下一所确定的分子物质相关电荷态分布的代表性m/z比,以此类推。
如先前描述,在方法370的步骤318中执行的隔离可通过以下方式实现:跨离子阱的电极对施加补充AC电压以使得m/z比不在所关注的一或多个范围内的离子从阱喷出,而m/z比在所述一或多个范围内的那些离子保持在阱内。在一些情况下,用于质量隔离的离子阱可相同于在步骤314中用以进行全扫描质量分析的质量分析器。
施加于用于质量隔离的离子阱的补充AC电压可包括叠加频率的求和以使得两个或更多个非邻接m/z范围内的离子被同时隔离。在后续步骤320中,经质量隔离的第一代产物离子通过例如碰撞诱导解离(CID)等合适的离子分段技术分段。所述分段可通过用已知方式将第一代产物离子(由原始前驱体离子的PTR形成的产物离子)传送到专用分段单元而实现,所述传送的离子在所述分段单元内分段以便产生片段离子,这些片段离子包括第二代反应产物。任选地,在任选的步骤321中可存储片段产物离子的一部分以用于可能的未来额外分段。
在方法370(图3B)的步骤322中,由质谱仪的质量分析器对步骤320中产生的片段进行质量分析。如果第二代产物离子是在具体来说专用于分段目的的分段单元内产生,那么在步骤322的执行之前所述离子必须首先传送到质量分析器。在步骤322中可采用离子阱质量分析器以分析第二代产物离子,在此情况下用于步骤322的质量分析器可相同于步骤314的用于进行全扫描质量分析的质量分析器。替代地,可采用能够以10ppm或更好的准确性测量质荷比的准确质量分析器用于步骤322,例如FT-ICR质量分析器、飞行时间(TOF)质量分析器或OrbitrapTM型静电阱质量分析器。
如所已知,经受分段的某一选定离子物质的m/z值与由分段产生的一或多个片段离子物质的m/z值(或多个值)之间的相关可足以自动确定(在步骤402b中)选定离子物质的化学身份。在此情况下,选定离子物质是在步骤318中经质量隔离的在步骤312中产生的PTR反应产物物质。少量(即,3到10种)此类蛋白质的识别将一般足以唯一地识别微生物物质(任选的步骤404b)。然而,单个阶段的分段可能不足以用于执行化学物质识别。在此类情况下,第二代产物离子可进一步分段以便形成下一代产物离子,由从步骤322返回至步骤318的任选的重复(以虚线指示)指示,其中片段产物离子的选定子集根据其m/z值而被隔离,且如此隔离的片段离子被进一步分段。更一般化地,可选择nth代产物离子的子集用于通过任何合适的离子分段方法而进一步分段,例如(但不限于)碰撞引起的分段、较高能量碰撞解离、电子转移解离、电子捕获解离、负电子转移解离、电子分离解离、源中分段、表面引起的解离或光致解离,从而形成(n+1)th代产物离子。质量分析步骤322的结果可形成关于是否需要每一额外分段以及如果需要则哪些m/z值对应于待分段的离子物质的自动决策的基础。
上文所论述的图3A中描绘的方法300提供了样本分析的相对简单且直接的方法,其可适用于相对低复杂性的样本,例如当在将层析部分引入到质谱仪中(步骤308)之前已执行高度解析层析分离(步骤306)时。然而,简单方法300可能不适合于更复杂的样本,且此些样本的分析可能存在一些挑战。首先,复杂混合物中存在的蛋白质具有广泛范围的分子量。第二,由大量离胺酸、精胺酸、组胺酸残余的存在引起的大量电荷态可导致多个重叠的峰集合,每一峰集合对应于不同化学物质。第三,如果质量分析(步骤314)具有充分高分辨率,那么任何给定电荷态的同位素分布的解析峰的存在会混淆大多数数据处理算法。最后,多个电荷态当中以及可能多个同位素状态当中可用离子的分布必定减少质量分析中的任何解析峰的信号强度。
为了解决复杂样本的分析中的上述挑战,在图3C中说明其示意性流程图的方法380提供了进行多个PTR阶段的机会。在早先描述的方法300下,假定第一代PTR反应产物(步骤312中产生)的(在步骤314中)获得的质谱展现信噪比的足够改进以及同量异位干扰的足够减少,以使得可辨识电荷态顺序且可识别蛋白质或多肽。如果质谱质量中的此改进在第一PTR反应事件之后仍不足以用于此目的,那么可执行方法380(图3C)的额外精炼步骤327-330。此外,PTR阶段中的一或多者可利用“离子停车”的已知技术以便简化电荷态分布,如先前段落中所提到。离子停车是禁止离子阱内的特定选定离子/离子反应的技术。实际上,跨离子阱的电极对、离子导向器或其它离子存储装置施加谐振激发波形,其振幅不足以造成离子排出但足以增加具有选定m/z值的离子的速度。此激发过程增加了激发离子(阳离子,出于本论述的目的)与反应剂阴离子之间的相对速度,且据信此相对速度增加造成激发阳离子与反应剂阴离子之间的反应速率的减少。
在PTR过程期间,阳离子与反应剂阴离子之间的反应速率随着各种阳离子的电荷数的平方而变化,其中反应剂离子上的阴离子电荷等于-1。因此,无离子停车存在下,PTR过程导致高度带电阳离子的数目的快速减少。在反应的过程中,从单个分子物质M(具有质量mp的蛋白质或多肽分子)导出的阳离子的电荷态的分布朝向较低电荷态移位。具有中间电荷态的每一离子物质的群体将首先随着较高带电前驱体离子失去质子而增加,并且然后随着每一相应物质丢失更多质子而减小,随后其从较高带电阳离子的递减数量得益。如果允许PTR反应前进到完成,那么最终结果是所有此些阳离子的完全中和以及所有质谱信号的全损耗。
当在PTR反应期间应用离子停车技术时,则电荷减少过程基本上停止在电荷态z1,其对应于由施加的AC波形谐振激发的离子的特定质荷比(例如,mp/z1)。从具有初始电荷态z以使得z>z1的分子物质M导出的那些前驱体阳离子将失去质子,直到其电荷态减少到z1,在此之后将禁止进一步反应和质子损失。从具有初始电荷状态z以使得z<z1的分子物质M导出的那些前驱体阳离子将被完全中和。因此,在具有离子停车的PTR反应之后,在质谱中将通过具有电荷态z1的单个离子物质表示分子M的原始质子化分子离子(即,前驱体离子)的显著部分。分子物质M的此“集中”到单个电荷态中可有利地放大与所述物质相关联的质谱信号,从而改善信噪比且降低检测下限以及任选地降低物质的定量下限。此外,从分子物质M产生的离子的许多同位素变体将具有对应于所施加AC谐振激发波形的值范围之外的m/z值。此些同位素变体将被中和以便不干扰所关注的离子的质谱识别。其它同位素变体包括在对应于所施加AC谐振激发波形的值范围内的m/z值。此些同位素变体离子的同位素分布图案将相对于原始前驱体离子中观测到的同位素分布极大地简化,因为它们将大部分涉及从分子M产生的离子的单个电荷态z1。
返回到图3C中概括的方法380的论述,应注意方法380的步骤302-310相同于方法300(图3A)的类似编号的步骤且此处不再描述。随后,在步骤328中,前驱体离子经受PTR,任选地由离子停车技术改质。如前文所述,通过跨离子阱的一对电极施加补充AC激发波形而执行步骤328,样本导出的阳离子在所述离子阱内与反应剂阴离子反应达预定时间段。如上文所描述,此“离子停车”程序的采用将使从任何特定蛋白质或多肽导出的离子的分布集中于m/z值的特定受限范围中。这将一般将从任何特定蛋白质或多肽导出的离子限制到特定电荷态中,从而简化所得质谱且增加对应于特定蛋白质或多肽的任何质谱峰的强度。离子受限于其中的m/z值的特定范围可包括从不同相应分子物质导出的不同相应电荷态的离子。在一些实施例中,用以实现离子停车的所施加AC波形可包括不同相应频率的波形的求和,以使得所求和波形致使PTR反应产生对应于两个或更多个非邻接m/z范围的PTR产物离子的最终群体。
在后续步骤330中,对在步骤328中产生的PTR产物离子的群体进行质量分析。在此质量分析之前,可存储PTR产物离子的一部分(步骤329)以准备用于可能的后续PTR反应。取决于PTR产物离子的质量分析的结果,可做出自动决策以使PTR产物离子经受此进一步PTR反应,如由图3C中所示的虚线任选路径指示。所述决策也可以基于质量分析的结果而做出以仅使PTR产物离子的选定子集经受后续PTR反应。在此些情况下,执行步骤327。如果在步骤330中采用的质量分析器是检测通过离子阱或其它离子存储装置内的循环离子运动产生的镜像电流的类型,例如FT-ICR质量分析器或OrbitrapTM质量分析器,那么PTR反应步骤可有利地减少目标蛋白质或多肽分子的碰撞分布以使得这些分子在阱中保持稳定达足够时间长度以产生高质量质谱。在足够数目的PTR反应步骤之后,接着可通过匹配于已知分子质量的数据库而快速辨别蛋白质或多肽的化学身份(在步骤402c中)。少量(3到10种)蛋白质的识别将一般足以唯一地识别微生物物质(任选的步骤404c)。识别也可经由如先前所论述使用应用于PTR数据的分类器而实现,其包含(但不限于)贝叶斯、逻辑回归或基于决策树的方法。
图3D到3E以流程图形式说明根据本发明教示的另一方法方法390。方法390的步骤302-330在图3D中所示且相同于方法380(图3C)的先前论述类似编号的步骤,因此,此处不再描述这些步骤。并非从步骤330直接前进到识别步骤402d(如图3C的方法380中),方法390(图3D到3E)的执行从步骤330前进到质量选择和隔离步骤332。在步骤332中,根据选定m/z比隔离通过PTR程序的一或多次应用而产生的PTR产物离子的子集。关于在此步骤期间将隔离的特定m/z比的决策可基于在步骤330中获得的质谱结果而自动执行。图3E中说明的步骤332-338表示离子分段程序,其可经迭代以便产生多代分段产物离子。这些步骤332-338类似于图3B中说明的方法370的步骤318-322且因此不详细论述。
在分段和质量分析步骤的执行之后,执行方法390(图3E)的肽识别步骤402d。方法300(图3A)的识别步骤402a仅利用包括质子化或多质子化分析物分子的离子物质的m/z比(或分子量),而方法390的识别步骤402d还考虑了这些离子物质的片段(可能多代)的m/z比。因此,在蛋白质或多肽的复杂混合物的情况下,较大置信度可与使用方法390进行的识别的结果相关联。根据一些实施例通过如上所述利用实时数据解卷积可实时执行对实验的控制。在步骤402d中对少量(3到10个)蛋白质物质的识别将一般足以在步骤404d中唯一地识别微生物物质。
图3F以流程图形式概略地说明根据本发明教示的另一方法方法395。方法395(图3F)中的大多数步骤类似于方法370(图3B)中类似地编号的步骤且不再详细地描述这些步骤。类似于方法370,方法395包含使原始前驱体离子经受PTR电荷减少的步骤(步骤312),随后是隔离选定PTR产物离子物质且使隔离的离子物质经受分段以便形成片段产物离子物质的步骤(步骤318和320)。方法395通过提供使片段离子经受PTR电荷减少的额外步骤步骤340而不同于方法370。由于从原始前驱体离子产生的各种PTR产物离子物质可为多电荷的且可以各种程度的质子化在物质当中分布,因此由其形成的片段离子本身可在多个质子化状态当中分布。在步骤340中碎片离子物质的PTR电荷减少可在步骤341中的其质量分析之前简化片段离子的电荷态分布。任选地,PTR步骤(步骤312和步骤340)中的任一者可采用离子停车。
实例A
图4A和4B提供由单个PTR反应步骤提供的质谱信号增强的实例(例如,如图3A中所示的方法300中)。在第一应用(图4A,4B)中,经由直接输注分析来自病原体大肠杆菌的提取物,图4A中示出第一代电喷射产生的离子的质谱。正如期望,存在以各种m/z值重叠的许多蛋白质,导致近似m/z=780与m/z=1420之间存在宽谱区域,其内检测到许多离子但在可辨别的蛋白质电荷态分布方面只有极少的可用信息。接着,具有宽度2Th且以m/z=750为中心的第一代离子的m/z“窗口”被隔离,且所得隔离的离子群体经受PTR反应。图4A中所示的m/z位置412a指示隔离窗口的中心位置。
图4B展示大肠杆菌提取物的前驱体离子的PTR反应产物的质谱。实行PTR反应,其中在递送到如图2中所说明的相同一般配置的质谱仪的离子光学元件内含有的辉光放电反应剂离子源的氮气流中从3ppm的六氟化硫(SF6)导出的反应剂阴离子。如同大多数PTR产物离子光谱,图4B中所示的质谱在原始第一代离子隔离窗口的位置(如位置412b指示)处展现相对强烈的隔离峰。在隔离窗口的位置处的这些峰一般指示在隔离的位置处偶然发生的残余单电荷第一代离子(一般不关注)的存在。图4B的谱中的其它峰表示从PTR反应产生的产物离子。这些产物离子一般包括相关离子的重叠集合,每一集合对应于包括来自原始隔离窗口内的原始多电荷前驱体离子的电荷态分布的离子。一种此类可能的电荷态分布图案由包络413近似指示。图4A和4B中所示的结果展示PTR反应过程一般显著简化谱且减少背景干扰。但是,由于许多蛋白质导出或肽导出的前驱体离子可能存在于原始隔离窗口中,因此电荷态分布图案可能重叠。可能需要数学分解(有时称为“解卷积”)来辨识个别图案。
实例B
图5A和5B说明由包含PTR反应的两个阶段的程序执行的大肠杆菌提取物的分析的实例(例如,参见图3C中的方法380的步骤327、328、329和330)。图5A说明来自以m/z=1200为中心的5Th质量窗口内的PTR产物离子谱产生的隔离第一代前驱体离子,由图5A中的位置711指示。在此实例中,初始PTR谱不包含经充分良好解析以实现样本中的任何蛋白质的识别的峰。因此,针对来自以m/z=1320为中心的5Th质量窗口内的PTR的第二阶段隔离第一代PTR产物离子的子集,由图5A中的位置712a和图5B中的位置712b指示。在图5B中以大于1320的m/z比发生的第二代PTR产物离子展示可成功地用于样本中蛋白质的识别的清楚电荷态分布图案。
图6A到6G说明由包含通过PTR反应的产物离子形成的第一阶段随后是PTR反应产物离子的CID的后续阶段的程序(例如,参见图3B中的方法370的步骤312到322)执行的大肠杆菌提取物分析的实例。图6A说明来自以m/z=640为中心的5Th质量窗口内的PTR产物离子谱产生的隔离第一代前驱体离子,由图6A中的位置811指示。PTR产物离子以比图6A中位置811指示的情况更大的m/z比发生。图6A中分别位于833、926和917的m/z比处且有质谱峰813、814和815指示的三种最强烈PTR产物离子随后被个别地隔离且单独地经受碰撞引起的解离以便产生第二代产物离子的三个集合。图6B和6C分别描绘在m/z=833处的隔离PTR产物离子以及通过隔离PTR产物离子的CID产生的第二代产物离子(片段离子)。同样,图6D和6E分别描绘在m/z=926处的隔离PTR产物离子以及通过在m/z=926处的隔离PTR产物离子的CID产生的第二代产物离子。同样,图6F和6G分别描绘在m/z=917处的隔离PTR产物离子以及通过在m/z=917处的隔离PTR产物离子的CID产生的第二代产物离子。
实例C
如从先前论述将显而易见,任何蛋白质或多肽分子的阳离子电喷射电离将由于原始分子的不同程度质子化而产生包括不同相应电荷态(即,电荷数目)的多个离子。+50或更多的电荷态或者可能的及每一电荷态将由表示不同程度的自然同位素取代的多个质谱线表示。另一并发情况从以下事实产生:对于大多数自然生物样本,多肽分子的许多不同蛋白质可在质谱中表示。又一并发情况从以下事实产生:不一定关注的许多其它分子可能存在于样本中。
在许多面向基本研究的研究中,多个分析物和多个干扰物质的上述并发因素可以通过在将每一分离化合物个别地引入质谱仪中之前执行色度分离而部分地或完全地解析。然而,临床分析常常会在紧张的时间约束下执行,这并不允许传统的耗时层析分离。临床时间约束可仅允许使用固相萃取(SPE)、尺寸排阻层析或上述快速部分层析分离(FPCS)的方法的不完全或部分分离。因此,当采用这些部分分离程序时,任何特定蛋白质或多肽的质谱特征可以扩展到宽质荷比之外,且可与其它化合物的质谱特征复杂地重叠。由于由电喷射设备提供的可用电荷将在许多不同类型的离子上扩展,因此大多数观测到的质谱线将共存且可能隐藏于一般密集群体且低强度或不良界定的谱“背景”中,这由图7A到7B中的谱包络902示意性地指示。
发明人已经实现任何特定蛋白质、多肽或其它生物相关高分子量分析物的质谱特征可通过以下方式假设地放大:同时隔离同一原始分子的多个电荷态,并且然后使多个态的集合与PTR反应剂离子反应以便将所述集合同时减少到在几个电荷态值上分布的少量电荷态,这些电荷态值相对于原始电荷态经减少。此概念由图7A中上覆于一般电荷态包络902上所示的垂直方框904a-904g说明。每一此垂直方框表示特定前驱体离子物质且表示经选择为对应于特定分析物的特定电荷态(且可能包含几个同位素变体)的m/z值的小范围。假设地,如果可排除对应于垂直方框的范围之外的所有离子且仅来自所指示范围内的离子混合在一起,那么后续PTR将基本上提供来自各种原始的多个电荷态的信号的求和。多个前驱体离子物质的此多物质隔离的使用可使分析的灵敏度增加多达N倍,其中N是经选择且同时隔离的m/z范围的数目。
当在线性离子阱(例如在图2中说明的低压线性阱单元217b)中执行时此多物质隔离相当容易实现,因为用以排出不希望的离子的谐振激发波形可构造有多个缺口。每一此缺口对应于不同的相应m/z窗口,其内将不排出离子(且因此隔离)。因此,在一些实施例中,可通过同时隔离全部多个前驱体离子物质而执行多个电喷射产生(第一代)前驱体离子物质的共同隔离。进行此的一种方式是通过将宽带谐振排出频率波形应用于从电喷射源接收的离子已经引入其中的离子阱,其中所述波形包括多个求和的正弦频率分量,其中包含的频率分量对应于希望从阱排出的离子的m/z范围且排除的频率分量对应于希望在阱内保持的离子的m/z范围。在此程序中,省略的频率界定排出频率波形中的一或多个频率缺口。可通过首先挑选所需的多缺口波形并且然后计算所需波形的傅里叶逆变换而计算所述频率分量。
替代地,可通过使用施加于离子阱的相应单缺口波形在常规意义上每次一种离子物质地隔离个别前驱体离子物质而执行所述多个前驱体离子物质的共同隔离。个别地隔离的前驱体离子物质可一次一个地传送到离子存储组件(例如在图2中说明的多极离子导向器214),其中各种选定且隔离的离子物质随时间而积聚。作为又一替代例,可通过使从电喷射源接收的多个离子通过四极滤质器,同时所述四极滤质器的带通经循序地调谐以又优先发射对应于特定前驱体离子物质的每一m/z范围而执行所述多个前驱体离子物质的共同隔离。通过四极滤质器的经过滤离子随后传递到离子存储组件,所述组件积聚来自所有优先发射的m/z范围的离子。举例来说,在图2中说明的质谱仪150a中,四极滤质器208可执行过滤步骤的序列且每一发射m/z范围的离子可发射到多极离子导向器214内且在其内积聚。积聚的前驱体离子物质接着可传送返回至低压单元217b用于PTR反应。
采用同时的多物质隔离的上述程序假定先验已知的适当隔离范围904a-904g。关于将采用的正确隔离范围的此知识在目标分析的某些例子中当待搜索的分析物的身份(和关于其的其它信息)已经已知且分析的目的是确定所述分析物存在或不存在或者确定所述分析物的数量或浓度时是可用的。然而,在其中分析物的身份可能不是事先已知的调查分析的情况下以上假设可为无效的。在后面的这些情况下,可通过如图7B中示意性地描绘隔离第一代离子的随机质量范围903并且然后使隔离的离子与PTR反应剂阴离子反应而执行初始随机调查。如先前在图4A和4B中说明,此程序可提供与一或多个分析物的电荷态分布相关的经解析、可解译的质谱线。在许多情况下,可通过相关线的m/z值与用于连续整数z的某一序列的等式1的相互一致性来辨识相关线的集合。线位置的一致性的程度可通过计算机分析自动执行以使得此些相关线的重叠集合可在数学上经分解且辨识。
作为以上类型分析的实例,通过m/z范围903内的前驱体离子的隔离和反应而产生的PTR产物离子线的数学分解可导致对如图7C中所说明由包络905和包络906描绘的两个重叠线集合的辨识。借助通过此初始调查程序提供的信息,可选择适当且一致的m/z值集合,其可用于后续同时的多物质隔离和反应程序中。举例来说,可能可以自动选择包络905下方的线的某些解析实例的m/z值。对应于这些所选m/z值的前驱体离子的后续多物质隔离和PTR反应将随后提供放大的谱,所述谱可用以确定由包络905表示的特定分子的数量或浓度。此程序可稍后使用相关联包络906重复以便确定另一分子的数量或浓度。所确定的数量或浓度在绝对意义上可能不是准确的,但所确定的数量或浓度的比率可提供与相对数量或浓度相关的有用信息。上文概述的此整个程序可使用不同随机选择的m/z范围903重复多次,从而提供若干化合物的相对数量或浓度的确定。如先前陈述,可利用实时光谱解卷积的结果以数据相依方式实现对此些实验的控制。
图8提供使用上文概括的通过PTR反应剂离子与来自多个非邻接m/z范围的第一代离子的反应的PTR信号放大进行调查分析的示范性方法方法397的一般流程图。方法397的步骤302、304、306、308、309、312、314、316、402和404相同于在图3A中说明的方法300的类似编号的步骤且因此此处不再描述。并且,新步骤311类似于方法300的先前描述的步骤310,但步骤311仅涉及第一代离子的随机m/z范围(例如图7C中所描绘的范围903)的质量隔离,而不涉及如针对先前方法300描述的“一或多个随机或预定m/z范围”。在初始调查PTR反应(步骤312)和电荷态序列的识别(步骤316)之后,执行步骤323,其中隔离且积聚第一代离子的多个非邻接m/z范围,其中所述非邻接m/z范围对应于经识别电荷态序列。可从先前存储的此些离子的批次获得第一代离子(先前步骤319a),或替代地(先前步骤319b),可能需要重复样本引入和电喷射离子产生步骤。
在第一代离子的多个非邻接m/z范围的隔离和积聚(步骤323)之后,使积聚的离子与PTR反应剂离子反应(步骤324)。所得放大的谱将一般具有高质量,从而促进例如对应于多个非邻接m/z范围的分子的准确分子量或者此分子的准确数量、浓度或相对丰度的导出(步骤325)。如果步骤316的紧邻在前的执行识别出相关m/z比的多于一个集合,那么可使用对应于不同经识别电荷态序列的非邻接m/z范围的新集合再次执行步骤319a或319b和步骤323-325(跟随步骤326的最左边“Y”分支)。如果针对可能的额外分析物的搜索将继续,那么执行可返回到步骤311(跟随步骤326的最右边“Y”分支),在此选择不同的随机m/z范围。
实例D
依据根据本发明教示的利用质子转移反应的样本复杂性减少的另一方法,采用PTR的质谱分析可与层析法直接关联以便简化且检测原本将错过的额外蛋白质。在此实施例中,采取全扫描质谱且使用实时解卷积程序计算蛋白质分子量。接着,选择具有经界定宽度的隔离窗口,且使所述窗口中的m/z值的子集经受PTR反应。
举例来说,图9A展示在大肠杆菌提取物的十分钟梯度反相液相层析分离的过程期间在10分钟30秒的滞留时间下从溶离液产生的第一代离子的全扫描质谱。如图9A中的括号指示,此全扫描质谱展现分别具有35.1和31.1kDa的近似分子量的两种蛋白质的相异光谱特征。对于下一步骤,具有10Th宽度且以750Th为中心的m/z隔离窗口510内的m/z值的离子群体被隔离。随后使隔离的离子群体经受与阴离子反应剂六氟化硫的PTR反应达10ms。图9B中所示的所得产物离子质谱展现了具有11220.07Da和24599.56Da的分子量的全扫描质谱中未见的两种额外蛋白质的质谱特征。另外,在全扫描质谱中先前观测到的35.1kDa蛋白质组分也展现PTR产物离子谱中的谱特征,其包含对应于在749的标称m/z值处的+47电荷态的线,在方框520中描绘。在749Th处的线表示35.1kDa蛋白质的甚至更高电荷态的电荷减少。在11.2和24.6kDa处观测到的蛋白质在反相层析运行的此实例中无PTR步骤存在下将不会被识别,原因是复杂的谱重叠以及来自大量单电荷背景离子的干扰噪声。
图10A和10B展示来自六十分钟梯度溶离运行的在42分钟30秒的滞留时间下从溶离液获得的类似层析法/MS实验的结果。如图10A中所示,在此溶离时间下的高背景造成识别全扫描谱中的分析物峰的困难。然而,图10B中标绘的PTR产物离子谱更容易经受解译和质谱解卷积。PTR产物离子谱展现原本将观测不到的三种相异蛋白质(具体地说具有11165.92Da、13480.28Da和18727.23Da的分子量)的质谱特征。在此实例中,从10Th宽度的以m/z 750为中心的质谱窗口(图10A中由方框610指示)产生的隔离前驱体离子产生PTR产物离子。通过对在单个实验过程期间在各种不同滞留时间下溶离的溶离液执行此类型的分析,可辨识足够数目的样本肽以便实现在物质、亚种或菌株层级的对微生物的识别。如图9A到9B中所示的结果也指示,如果存在来自隔离窗口内的全质谱的蛋白质离子的m/z重叠,那么所述蛋白质将也在PTR产物离子质谱中见到。
有趣的是,全扫描质谱和PTR产物离子质谱可提供互补信息,如图11A和11B中所说明,其表示在三十分钟层析分离的过程中从在18分钟9秒的滞留时间下溶离的溶离液获得的质谱结果。在此实例中,全扫描质谱(图11A)展现具有9534.3Da的分子量的基本上单个蛋白质的强质谱特征,然而,当PTR产物离子谱是从在以m/z 750Th为中心的10Th宽窗口(方框530)内隔离的离子产生时,质谱特征包括来自具有14965.5Da的分子量的蛋白质(由在近似1247Th处的+12电荷态的峰535最佳表示)以及具有12669.8Da、14150.0Da、14236.1Da、14965.5Da和15117.5Da的分子量的五个其它微小蛋白质的强信号。图11C是在同一层析分离期间从在22分钟27秒的滞留时间下溶离的溶离液获得的全扫描质谱。所述谱包含指示具有24961.3Da的分子量的蛋白质的存在的峰。在隔离窗口540内隔离的离子的PTR反应后,获得图11D中所示的PTR产物离子谱。PTR产物离子谱中的质谱特征包含来自具有28461.5Da的分子量的蛋白质(由在近似1294Th处的+22电荷态的峰545最佳表示)以及具有18590.5Da和20168.0Da的分子量的两个其它蛋白质的相对强信号。因此,仅从这两个滞留时间处的数据,有可能检测十一种不同蛋白质的存在和分子量。
额外实例
以下段落列出根据本发明教示的各种具体实施例的额外具体实例。
实例1.一种用于识别液体样本内的蛋白质或多肽分析物化合物的存在或不存在的方法,所述液体样本包括化合物的混合物,所述混合物包含多种蛋白质化合物或多种多肽化合物或多种蛋白质和多肽化合物,所述方法包括:
(a)将所述液体样本的一部分引入到质谱仪的电喷射电离源中;
(b)通过电喷射电离形成所述液体样本的所述部分的所述化合物混合物的带正电离子,所述带正电离子包括多个离子物质;
(c)隔离包括第一质荷比(m/z)比率范围的所述离子物质的第一子集,所述范围包含所述分析物化合物的特定预定多质子化分子物质的m/z比;
(d)通过致使所述隔离的离子物质的第一子集在预定持续时间中与反应剂阴离子反应而从所述隔离的离子物质的第一子集产生多个第一代产物离子物质,所述反应剂阴离子在反应后从一或多个离子物质中的包括蛋白质或多肽化合物的质子化分子物质的每一者提取质子;
(e)使用质量分析器产生所述第一代产物离子物质或从所述第一代产物离子物质产生的第二代产物离子物质的质谱;
(f)进行对所述第一代或所述第二代产物离子物质的所述质谱的搜索以找到作为所述蛋白质或多肽分析物化合物的诊断的一或多个m/z比的集合;以及
(g)如果在所述质谱中识别出一或多个m/z比的所述集合,那么识别所述样本内的所述分析物化合物的存在。
实例2.根据实例1所述的方法,其进一步包括第二次重复所述步骤(a)到(e),其中在所述步骤(a)到(e)的所述第二次执行期间或之前执行所述步骤(f)和(g)。
实例3.根据实例1所述的方法,其进一步包括多次重复执行步骤(a)到(g),其中步骤(a)的每一重复包括将来自对应于相应滞留时间的层析柱的溶离液引入到所述电喷射电离源中。
实例4.根据实例1所述的方法,其中所述步骤(f)包括进行对所述第一代产物离子物质的所述质谱的搜索以找到对应于所述分析物化合物的多质子化离子物质序列的一系列m/z比,所述多质子化离子物质序列相对于所述特定预定多质子化分子物质的电荷态渐进地电荷减少。
实例5.根据实例1所述的方法,其中:
所述步骤(c)包括进一步隔离所述离子物质的第二子集,所述第二子集包括第二m/z比范围,所述范围包含第二蛋白质或多肽分析物化合物的特定预定多质子化分子物质的m/z比;
所述步骤(f)包括进行对所述第一代或所述第二代产物离子物质的所述质谱的额外搜索以找到作为所述第二蛋白质或多肽分析物化合物的诊断的一或多个m/z比的第二集合;以及
所述步骤(g)包括如果在所述质谱中识别出m/z比的所述第二集合,那么识别所述样本内的所述第二分析物化合物的存在。
实例6.根据实例5所述的方法,其中所述第一m/z比范围相同于所述第二m/z比范围。
实例7.根据实例5所述的方法,其中所述步骤(c)包括同时隔离包括所述第一m/z比范围的所述离子物质的所述第一子集以及包括所述第二m/z比范围的所述离子物质的所述第二子集以使得所述第一和第二m/z比范围是非邻接的。
实例8.根据实例1所述的方法,其中产生多个第一代产物离子物质的所述步骤(d)包括致使所述隔离的离子物质的第一子集和反应剂阴离子在一持续时间中反应,所述持续时间致使在步骤(e)中的所述质谱的后续产生期间所述产物离子物质稳定而不会分解。
实例9.根据实例8所述的方法,其中所述步骤(e)包括使用质量分析器产生所述第一代产物离子物质的质谱,所述质量分析器通过检测由离子阱内所述产物离子物质的所述离子的运动造成的镜像电流来产生所述质谱。
实例10.根据实例1所述的方法,其中产生多个第一代产物离子物质的所述步骤(d)包含跨越离子阱的电极施加补充AC电压,在所述离子阱内所述隔离的离子物质的第一子集与反应剂阴离子反应,其中所述补充AC电压的频率使得禁止所述反应剂阴离子与选定的第一代产物离子物质之间的离子-离子反应。
实例11.根据实例10所述的方法,其中所述补充AC电压的所述频率使得在步骤(d)的执行之后,由所述分析物化合物形成的产物离子大体上作为具有特定电荷态的单个离子物质而存在。
实例12.根据实例11所述的方法,其中:
所述步骤(e)包括产生所述第一代产物离子物质的质谱;以及
其中所述单个离子物质的质量大于20,000Da且所述单个离子物质的电荷态充分大以使得可在所述质谱的产生期间通过四极质量分析器、傅立叶变换离子回旋共振质谱仪或静电阱质量分析器检测所述单个离子物质的离子。
实例13.根据实例1所述的方法,其中产生质谱的所述步骤(e)包括产生第二代产物离子物质的质谱,其中所述第二代产物离子物质是通过以下步骤产生:
隔离包括特定产物离子m/z比范围的所述第一代产物离子物质的子集;以及
使所述第一代产物离子物质的所述隔离的子集分段以便形成片段离子物质,其中所述片段离子物质包括所述第二代产物离子物质。
实例14.根据实例1所述的方法,其中产生质谱的所述步骤(e)包括产生第二代产物离子物质的质谱,其中所述第二代产物离子物质是通过以下步骤产生:
致使所述第一代产物离子物质在第二预定持续时间中与所述反应剂阴离子反应,其中所述第一代产物离子物质与所述反应剂阴离子之间的反应的产物包括所述第二代产物离子物质。
实例15.根据实例14所述的方法,其中跨越离子阱的电极施加补充AC电压,在所述离子阱内所述第一代产物离子物质与所述反应剂阴离子反应,其中所述补充AC电压的频率使得禁止所述反应剂阴离子与选定产物离子物质之间的离子-离子反应。
实例16.根据实例1到15中的任一者所述的方法,其进一步包括通过包括以下各项的程序产生包括所述化合物混合物的所述液体样本:
(i)培养微生物或细胞;
(ii)裂解所述经培养的微生物或细胞;以及
(iii)从经培养的微生物或细胞的所述裂解物提取蛋白质。
实例17.根据实例16所述的方法,其中从所述裂解物提取所述液体样本的所述步骤(iii)包含使所述裂解物通过固相提取设备。
实例18.一种识别样本中的微生物类型的存在或不存在的方法,其包括:
(i)识别在所述样本中的同时存在是所述样本中的所述微生物类型的存在的诊断的分析物化合物的列表,所述分析物化合物的列表包括蛋白质化合物、多肽化合物或蛋白质和多肽化合物两者;
(ii)从所述样本提取包括从样本导出的蛋白质和多肽的混合物的液体溶液;
(iii)对于所述列表中的每一相应分析物化合物,执行以下步骤:
(a)将所述液体溶液的一部分引入到质谱仪的电喷射电离源中;
(b)通过电喷射电离形成所述液体溶液的所述部分的所述化合物混合物的带正电离子,所述带正电离子包括多个离子物质;
(c)隔离包括第一质荷比(m/z)比率范围的所述离子物质的第一子集,所述范围包含所述相应分析物化合物的特定预定多质子化分子物质的m/z比;
(d)通过致使所述隔离的离子物质的第一子集在预定持续时间中与反应剂阴离子反应而从所述隔离的离子物质的第一子集产生多个第一代产物离子物质,所述反应剂阴离子在反应后从一或多个离子物质中的包括蛋白质或多肽化合物的质子化分子物质的每一者提取质子;
(e)使用质量分析器产生所述第一代产物离子物质或从所述第一代产物离子物质产生的第二代产物离子物质的质谱;
(f)进行对所述第一代或所述第二代产物离子物质的所述质谱的搜索以找到作为所述相应分析物化合物的诊断的一或多个m/z比的集合;以及
(g)如果在所述质谱中识别出一或多个m/z比的所述集合,那么识别所述液体溶液内的所述相应分析物化合物的存在;以及
(iv)如果在所述液体溶液内识别出所述分析物化合物列表的每一和每个分析物化合物的存在,那么识别所述样本内的所述微生物类型的存在。
实例19.一种识别样本中的微生物类型的存在或不存在的方法,其包括:
(i)识别在所述样本中的同时存在是所述样本中的所述微生物类型的存在的诊断的分析物化合物的列表,所述分析物化合物的列表包括蛋白质化合物、多肽化合物或蛋白质和多肽化合物两者;
(ii)从所述样本提取包括从样本导出的蛋白质和多肽的混合物的液体溶液;
(iii)将所述液体溶液的至少第一部分引入到质谱仪的电离源中;
(iv)从所述电离源处的所述液体溶液的所述至少第一部分产生所述化合物混合物的带正电离子,所述带正电离子包括多个离子物质;
(v)隔离所述多个离子物质的至少第一子集,所述至少第一隔离的子集的每一隔离的子集包括相应质荷比(m/z)比率范围;
(vi)通过使离子物质的每一所述隔离的子集在预定持续时间中与反应剂阴离子反应而从离子物质的每一隔离的子集产生多个第一代产物离子物质,所述反应剂阴离子在反应后从离子物质的所述隔离的子集的一或多个离子物质中的包括蛋白质或多肽化合物的质子化分子物质的每一者提取质子;
(vii)使用所述质谱仪的质量分析器产生第一代产物离子物质或通过所述第一代产物离子物质的进一步反应产生的第二代产物离子物质的至少一个质谱;
(viii)对于所述列表中的每一相应分析物化合物,执行以下步骤:
(a)进行对所述第一代或所述第二代产物离子物质的所述至少一个质谱的搜索以找到作为所述相应分析物化合物的诊断的一或多个m/z比的集合;以及
(b)如果在所述质谱中识别出一或多个m/z比的所述集合,那么识别所述液体溶液内的所述相应分析物化合物的存在;以及
(ix)如果在所述液体溶液内识别出所述分析物化合物列表的每一和每个分析物化合物的存在,那么识别所述样本内的所述微生物类型的存在。
实例20.根据实例19所述的方法,其中与所述步骤(iii)到(vii)中的一或多者的执行同时执行所述步骤(a)和(b)的执行。
实例21.根据实例19所述的方法,其中所述微生物类型经界定为特定细菌种类,且所述分析物化合物列表包含作为所述特定细菌种类的诊断的足够数目的分析物化合物以实现所述样本中所述特定细菌种类的存在或不存在的识别。
实例22.根据实例19所述的方法,其中所述微生物类型经界定为特定细菌物质,且所述分析物化合物列表包含作为所述特定细菌物质的诊断的足够数目的分析物化合物以实现所述样本中所述特定细菌物质的存在或不存在的识别。
实例23.根据实例19所述的方法,其中所述微生物类型经界定为特定细菌子物质,且所述分析物化合物列表包含作为所述特定细菌子物质的诊断的足够数目的分析物化合物以实现所述样本中所述特定细菌子物质的存在或不存在的识别。
实例24.根据实例19所述的方法,其中所述微生物类型经界定为特定病毒菌株,且所述分析物化合物列表包含作为所述特定病毒菌株的诊断的足够数目的分析物化合物以实现所述样本中所述特定病毒菌株的存在或不存在的识别。
实例25.根据实例19所述的方法,其中所述微生物类型经界定为特定病毒菌株,且所述分析物化合物列表包含作为所述特定病毒菌株的诊断的足够数目的分析物化合物以实现所述样本中所述特定病毒菌株的存在或不存在的识别。
实例26.一种用于识别样本内的蛋白质或多肽分析物化合物的存在或不存在的方法,所述样本包括化合物的混合物,所述混合物包含多种蛋白质化合物或多种多肽化合物或多种蛋白质和多肽化合物,所述方法包括:
(a)将所述液体样本的一部分引入到质谱仪的电喷射电离源中;
(b)通过电喷射电离形成所述液体样本的所述部分的所述化合物混合物的带正电离子,所述带正电离子包括多个第一代离子物质;
(c)隔离包括相应质荷比(m/z)比率范围的所述第一代离子物质的多个子集,其中每一m/z比范围包含包括所述分析物化合物的相应质子化状态的离子物质的m/z比;
(d)通过致使所述第一代离子物质的所述隔离的多个子集在预定持续时间中与反应剂阴离子反应而从所述第一代离子物质的所述隔离的多个子集产生多个第一代产物离子物质,所述反应剂阴离子在反应后从包括所述分析物化合物的相应质子化状态的每一离子物质提取质子;
(e)产生所述第一代产物离子物质的质谱;以及
(f)如果所述质谱包括在相应预定m/z比处的包括高于预定阈值的相应强度的一或多条线,那么识别所述样本内的所述分析物化合物的存在,或否则识别所述样本内的所述分析物化合物的不存在。
实例27.根据实例26所述的方法,其进一步包括多次重复执行步骤(a)到(f),其中步骤(a)的每一重复包括将来自对应于相应滞留时间的层析柱的溶离液引入到所述电喷射电离源中。
实例28.根据实例26所述的方法,其中所述步骤(f)进一步包括如果所述质谱包括在相应预定m/z比处的包括高于预定阈值的相应强度的一或多条线,那么基于所述一或多个强度确定所述样本内的所述分析物化合物的数量或浓度。
实例29.根据实例26所述的方法,其进一步包括在形成带正电离子的所述步骤(b)之后且在隔离所述第一代离子物质的多个子集的所述步骤(c)之前的以下步骤:
(b1)隔离包括随机选择的质荷比(m/z)比率范围的所述第一代离子物质的子集;
(b2)通过致使所述第一代离子物质的所述隔离的子集与反应剂阴离子反应而从所述第一代离子物质的所述隔离的子集产生多个产物离子物质,所述反应剂阴离子在反应后从包括所述分析物化合物的相应质子化状态或者另一蛋白质或多肽化合物的相应质子化状态的每一离子物质提取质子;
(b3)产生所述产物离子物质的质谱;以及
(b4)基于所述产物离子的所述质谱自动确定在所述后续步骤(c)中将使用的所述m/z比范围。
实例30.根据实例28所述的方法,其中所述步骤(b4)包括从所述质谱自动确定对应于另一蛋白质或多肽化合物的多质子化离子物质的m/z比的集合。
实例31.一种识别样本中的微生物的存在或不存在的方法,其包括:
制作所述样本的提取物;
重复执行根据实例26所述的方法以便在每一执行识别所述样本提取物内的不同相应蛋白质或多肽分析物化合物的存在或不存在;以及
如果所述样本提取物内每一相应蛋白质或多肽分析物化合物存在,那么识别所述样本内的所述微生物的存在,或否则识别所述样本内的所述微生物的不存在。
结论
如本文档中教示的离子-离子反应的PTR类型的使用具有若干优点用于蛋白质或多肽离子的复杂混合物的分析。通过比较图3与图4可容易观测到第一显著优点是由极大地改进的信噪比提供。即使由于PTR过程而丢失一些电荷(即,完全中和),由于多电荷蛋白质与单电荷阴离子的反应也获得显著信噪比。此反应的速率与电荷的乘积的平方成比例。因此,最初高度带电分析物离子转换为较少带电PTR产物离子,其质谱特征在显著较大质荷比处出现。相比之下,低电荷态化学背景离子在典型实验反应周期期间受PTR过程影响显著较少,原因是这些离子的反应的低速率。此过程基本上从低质量、低电荷态化学背景“噪声”移除了蛋白质和多肽的质谱特征。举例来说,如图4中所示,背景离子由在m/z≈642的“左后方”的大的单电荷峰表示。还认为仍粘附到大蛋白质的加成物或水分子由于由PTR反应沉积的发热反应热(至少125千卡/摩尔)而移除。此些离子变换为简单质子化分子可进一步增强信噪比特性。潜在地,经由此方法获得的蛋白质识别的数目可超过利用某一形式的分离技术的当前复杂的从上到下方法。
与根据本发明教示的方法相关联的第二重要优点是由极大地改进的电荷态指派提供。举例来说,本发明人已经以实验方式确定,通过采用根据本发明教示的方法可正确地指派用于个别电荷态的电荷态指派的近似75%。此改进的辨识电荷态的能力是得自显著改进的信噪比。这又提供蛋白质或多肽的分子量的较准确确定。此比较适用于经常用于实时电荷态确定的当前Patterson-FFT电荷态算法。与根据本发明教示的方法相关联的另一重要优点是由执行快速处理量分析的能力提供。当与上文应用的快速部分层析分离技术结合时,这些方法允许在一分钟或更短的时间尺度上以高处理量方式分析样本。
本申请中所包括的论述是希望充当基本描述。尽管已经根据所展示和描述的各种实施例描述了本发明,但所属领域的一般技术人员将容易认识到,可以存在对这些实施例的变化,并且那些变化将在本发明的精神和范围内。因此,读者应该知道,具体的论述可以不明确地描述所有可能的实施例;很多替代方案是隐含的。因此,在不脱离如权利要求书所描述的本发明的范围的情况下,所属领域的技术人员可做出许多修改。描述和术语均不希望限制本发明的范围。本文中提到的任何专利、专利申请案、专利申请公开案或其它文献在此被以引用的方式按其相应的全部内容并入本文中,如同在本文中被充分阐明一般。
- 还没有人留言评论。精彩留言会获得点赞!