检测癌症的方法和试剂盒与流程
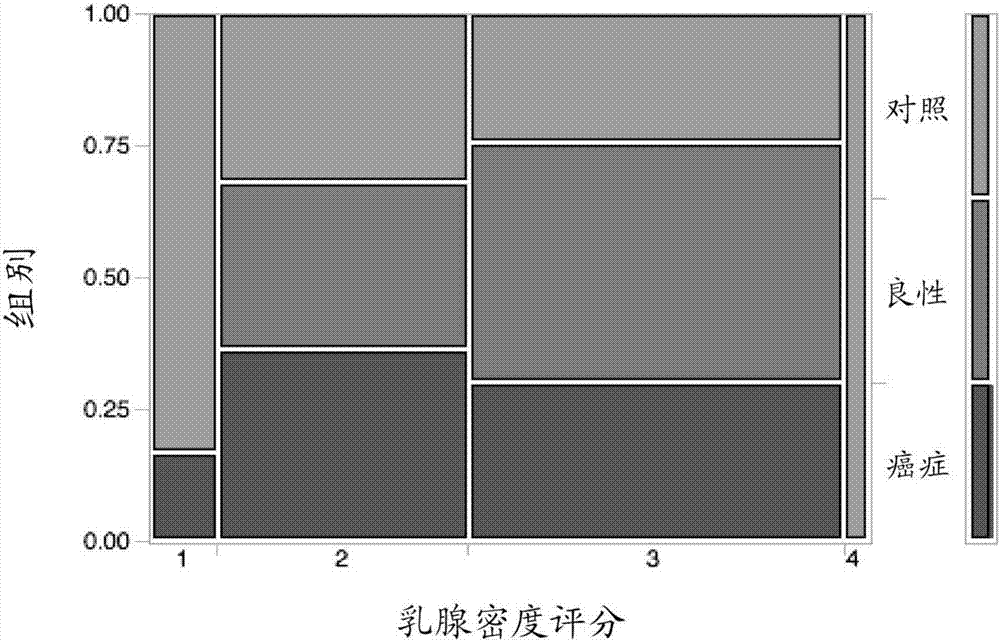
发明领域本申请涉及用于诊断个体中的癌症或用于监测个体中癌症的存在的方法和试剂盒。发明背景本申请包括蛋白以及通过所述蛋白的蛋白水解消化而产生的那些蛋白的肽片段,并且所述蛋白和肽片段都可用于个体中癌症的诊断或用于监测个体中癌症的存在。筛检性乳房x线摄影检查(mammogram)通常具有75%的灵敏度以及约98%的特异性,导致每次乳房x光检查大约有5%的假阳性率(brown,houn,sickles,&kessler,1995;kolb,lichy,&newhouse,2002;luftner&possinger,2002)。乳腺组织的类型,更具体而言乳腺组织密度也极大地影响乳房x线摄影术的效果。利用美国放射学院乳腺影像报告及数据系统(bi-rads)对乳腺密度的程度进行分类。该系统由1-4四类组成:其中类别1主要是脂肪(<25%致密);类别2为分散的纤维腺体密度(25-50%致密);类别3为不均匀致密(51-75%致密)以及类别4为极度致密(>75%致密)(bigenwald,2008;klifa,2010;scheel,2014).对于具有多脂肪的乳腺组织的女性,当患者依从每年进行一次筛查时,乳房x线摄影术可以是有效的筛查工具(tabar,2001;pisano,2005)。然而,随着乳腺密度增加,乳房x线摄影术的有效性降低,导致随访成像增加,以及更重要的是错过癌症诊断。已显示高风险患者的乳房x线摄影的敏感性,对于类别1为低至31%,对于类别2为27%,对于类别3为20%,以及对于类别4为12.5%(bigenwald,2008)。大约50%的女性群体位于被认为是致密型乳腺组织的类别3和4中(vachon,2007)。目前,对于这些女性而言最佳筛查选择是mri,其可比乳房x线摄影术贵高达10倍(beignwald,2008)。由于具有75%或更致密的组织的女性发展为乳腺癌的风险比具有较低致密组织的女性高4至6倍,因此缺乏好的筛查选择是严重的问题(boyd,2007)。评估假阳性的随访成像耗费了美国超过40亿美元,以及另外的16亿美元花费于单独的活组织检查。在2010年进行的160万例活组织检查中,仅有16%(仅261,000例)被发现患有癌症(grady,2012)。增加成像的诊断参数的答案可见于关注遗传信息和蛋白质组学信息,更具体而言关注生物标志物的成像前和成像后诊断学(armstrong,handorf,chen,&bristoldemeter,2013;li,zhang,rosenzweig,wang,&chan,2002)。组织和血清通常是开始生物标志物研究最合乎逻辑的位置,然而这两种介质的大的动态范围使得发现十分困难(schiess,wollscheid,&aebersold,2009)。答案可能在于较不复杂的生物流体,如唾液和眼泪。将眼泪用作诊断介质不是新的应用,因为之前已对眼泪的蛋白质组进行了广泛研究(etal.,2012;2011;lebrecht,boehm,schmidt,koelbl,&grus,2009a;lebrechtetal.,2009b;wu&zhang,2007)。在该申请中,公开了用于检测对癌症进行应答的一组基于眼泪的生物标志物的定量分析。根据该定量信息,将确定认证的实验室改进修正案(clia)协议的框架。发明概述本申请提供了确定对象是否患有癌症的方法。方法包括从所述对象获得样本,并进行检测选自下述以及如表1中所列的标志物中的至少一种的水平的步骤:igλ链v-iv区hil(lv403)、ig重链v-iiibro(hv305)、ig重链v-iiivh26(hv303)、β-2-微球蛋白(b2mg)、脂质运载蛋白-1(lcn1)、锌-α-2-糖蛋白(za2g)、半胱氨酸蛋白酶抑制剂b(cytb)、抗白细胞蛋白酶(slp1)、半乳凝素-3(leg3)、组氨酸三聚体核苷结合蛋白1(d6rd60)、s100a9(s10a9)、s100a8(s10a8)、半乳凝素-3结合蛋白(lg3bp)、igα-1链c区簇(igha1)、igκ链v-iii区hah簇(kv312)、vegf共调节趋化因子1(vcc1)、l-乳酸脱氢酶a链(ldha)、醛-酮还原酶家族1成员c(akr1c1)、小根蛋白(b1akd8)、l-乳酸脱氢酶b链(ldhb)、视黄醛脱氢酶1(al1a1)、未被表征的蛋白(b4e1z4)、α-1-抗胰凝乳蛋白酶(aact)、超氧化物歧化酶[cu-zn](sodc)、sparc样蛋白1(sprl1)、ig重链v-iii区til(hv304)、角蛋白(k1c9)、半胱氨酸蛋白酶抑制剂-sn(cytn)、α-辅肌动蛋白-4(actn4)、igλ-3链c区(片段)(iglc3)、免疫球蛋白λ样多肽5(igll5)、醇脱氢酶1c(adhig)、线粒体苹果酸脱氢酶(mdhm)、类钙调蛋白5(call5)、α-1-抗胰蛋白酶(a1at)、α-1b-糖蛋白(a1bg)、富亮氨酸α-2-糖蛋白(a2gl)、小泛素相关修饰物3(a8mu27)、前梯度蛋白2同系物(agr2)、抑制蛋白(profilin)-1(prof1)、igλ链v-iii区loi簇(lv302)、凝血酶原(e9pit3)、血液结合素(hemo)、igγ-2链c区(ighg2)、泛素-40s核糖体蛋白s27a(rps27a)、afamin(afam)、载脂蛋白a-i(apoa1)、载脂蛋白a-iv(apoa4)、黄素还原酶(nadph)(blvrb)、鞘脂激活蛋白原(prosaposin)(psap)、催泪蛋白(lacritin)(lacrt)、60s酸性核糖体蛋白p1(rla1)、间-α-胰蛋白酶抑制剂重链h2(itih2)、粘蛋白样蛋白1(mucl1)、s100a6(s100a6)、na(+)/h(+)交换调节辅因子nhe-rf1(nhrf1)、含硫氧还蛋白结构域蛋白17(i3l0k2)、淋巴细胞特异性蛋白(lsp1)、结合珠蛋白簇(h3bs21)、肌球蛋白调节轻链12a(j2qrs3)、核糖核酸酶抑制因子(rini)、α-烯醇化酶(enoa)、igκ链v-i区域eu簇(kv106)、醇脱氢酶4类μ/σ链(adh7)、蛋白ambp(ambp)、血管紧张素原(angt)、抗凝血酶-iii(ant3)、载脂蛋白a-ii(apoa2)、钙蛋白酶抑制蛋白(b7z574)、脑酸溶性蛋白1(basp1)、α-2-hs-糖蛋白(c9jv77)、钙网蛋白(calr)、钙蛋白酶-1催化亚基(can1)、细胞分裂调控蛋白42同系物(cdc42)、补体c3(co3)、冠蛋白-1a(cor1a)、程序性细胞死亡6相互作用蛋白(dcd)、防御素1(def1)、f盒特有蛋白50(f-boxonlyprotein)(fbx50)、γ-谷氨酰环化转移酶(ggct)、线粒体谷胱甘肽还原酶(gshr)、ii型角蛋白细胞支架1(k2c1)、ump-cmp激酶(kcy)、间皮素(msln)、n-乙酰胞壁酰-l-丙氨酸酰胺酶(pgrp2)、烟酰胺磷酸核糖基转移酶(pncb)、间-α-胰蛋白酶抑制剂重链h1(itih1)、核糖核酸酶t2(rnaset2)、线粒体超氧化物歧化酶[mn](sodm)、富含脯氨酸小蛋白3(sprr3)、src底物皮层肌动蛋白(src8)、微管蛋白β-4b链簇(tbb4b)、原肌球蛋白α-3链(tpm3)、血清铁传递蛋白(trfe)、谷胱甘肽s转移酶p(thio)、玻连蛋白(vtnc)、维生素d结合蛋白(q6ldc6)、间-α-胰蛋白酶抑制剂重链h4(itih4)、金属蛋白酶抑制剂(timp1)、热休克蛋白90(hsp90)、组织蛋白酶b(catb)、血浆铜蓝蛋白(ceru)、钙卫蛋白、14-3-3σ(1433s)、α-2-hs-糖蛋白(fetua)、α-2-巨球蛋白(a2mg)、转甲状腺素蛋白(tthy)。如果与来自没患癌症的对象的对照样本中的水平相比,这些标志物的水平改变,则对象可能患有癌症。样本最好是眼部样本,如分离的眼泪样本或眼部冲洗物,但是也可来自唾液或其它体液。眼部样本表明眼泪样本包括来自泪腺和与淋巴系统相连的其它组织的分泌物。本申请提供了用于确定对象是否患有癌症的试剂盒。所述试剂盒包含用于检测选自下述以及如表1中所列的标志物中的至少一种的水平的试剂:igλ链v-iv区hil(lv403)、ig重链v-iiibro(hv305)、ig重链v-iiivh26(hv303)、β-2-微球蛋白(b2mg)、脂质运载蛋白-1(lcn1)、锌-α-2-糖蛋白(za2g)、半胱氨酸蛋白酶抑制剂b(cytb)、抗白细胞蛋白酶(slp1)、半乳凝素-3(leg3)、组氨酸三聚体核苷结合蛋白1(d6rd60)、s100a9(s10a9)、s100a8(s10a8)、半乳凝素-3结合蛋白(lg3bp)、igα-1链c区簇(igha1)、igκ链v-iii区hah簇(kv312)、vegf共调节趋化因子1(vcc1)、l-乳酸脱氢酶a链(ldha)、醛-酮还原酶家族1成员c(akr1c1)、小根蛋白(b1akd8)、l-乳酸脱氢酶b链(ldhb)、视黄醛脱氢酶1(al1a1)、未被表征的蛋白(b4e1z4)、α-1-抗胰凝乳蛋白酶(aact)、超氧化物歧化酶[cu-zn](sodc)、sparc样蛋白1(sprl1)、ig重链v-iii区til(hv304)、角蛋白(k1c9)、半胱氨酸蛋白酶抑制剂-sn(cytn)、α-辅肌动蛋白-4(actn4)、igλ-3链c区(片段)(iglc3)、免疫球蛋白λ样多肽5(igll5)、醇脱氢酶1c(adhig)、线粒体苹果酸脱氢酶(mdhm)、类钙调蛋白5(call5)、α-1-抗胰蛋白酶(a1at)、α-1b-糖蛋白(a1bg)、富亮氨酸α-2-糖蛋白(a2gl)、小泛素相关修饰物3(a8mu27)、前梯度蛋白2同系物(agr2)、抑制蛋白-1(prof1)、igλ链v-iii区loi簇(lv302)、凝血酶原(e9pit3)、血液结合素(hemo)、igγ-2链c区(ighg2)、泛素-40s核糖体蛋白s27a(rps27a)、afamin(afam)、载脂蛋白a-i(apoa1)、载脂蛋白a-iv(apoa4)、黄素还原酶(nadph)(blvrb)、鞘脂激活蛋白原(psap)、催泪蛋白(lacrt)、60s酸性核糖体蛋白p1(rla1)、间-α-胰蛋白酶抑制剂重链h2(itih2)、粘蛋白样蛋白1(mucl1)、s100a6(s100a6)、na(+)/h(+)交换调节辅因子nhe-rf1(nhrf1)、含硫氧还蛋白结构域蛋白17(i3l0k2)、淋巴细胞特异性蛋白(lsp1)、结合珠蛋白簇(h3bs21)、肌球蛋白调节轻链12a(j2qrs3)、核糖核酸酶抑制因子(rini)、α-烯醇化酶(enoa)、igκ链v-i区域eu簇(kv106)、醇脱氢酶4类μ/σ链(adh7)、蛋白ambp(ambp)、血管紧张素原(angt)、抗凝血酶-iii(ant3)、载脂蛋白a-ii(apoa2)、钙蛋白酶抑制蛋白(b7z574)、脑酸溶性蛋白1(basp1)、α-2-hs-糖蛋白(c9jv77)、钙网蛋白(calr)、钙蛋白酶-1催化亚基(can1)、细胞分裂调控蛋白42同系物(cdc42)、补体c3(co3)、冠蛋白-1a(cor1a)、程序性细胞死亡6相互作用蛋白(dcd)、防御素1(def1)、f盒特有蛋白50(fbx50)、γ-谷氨酰环化转移酶(ggct)、线粒体谷胱甘肽还原酶(gshr)、ii型角蛋白细胞支架1(k2c1)、ump-cmp激酶(kcy)、间皮素(msln)、n-乙酰胞壁酰-l-丙氨酸酰胺酶(pgrp2)、烟酰胺磷酸核糖基转移酶(pncb)、间-α-胰蛋白酶抑制剂重链h1(itih1)、核糖核酸酶t2(rnaset2)、线粒体超氧化物歧化酶[mn](sodm)、富含脯氨酸小蛋白3(sprr3)、src底物皮层肌动蛋白(src8)、微管蛋白β-4b链簇(tbb4b)、原肌球蛋白α-3链(tpm3)、血清铁传递蛋白(trfe)、谷胱甘肽s转移酶p(thio)、玻连蛋白(vtnc)、维生素d结合蛋白(q6ldc6)、间-α-胰蛋白酶抑制剂重链h4(itih4)、金属蛋白酶抑制剂(timp1)、热休克蛋白90(hsp90)、组织蛋白酶b(catb)、血浆铜蓝蛋白(ceru)、钙卫蛋白、14-3-3σ(1433s)、α-2-hs-糖蛋白(fetua)、α-2-巨球蛋白(a2mg)、转甲状腺素蛋白(tthy)。如果与来自没患癌症的对象的对照样本中的水平相比,这些标志物的水平改变,则对象可能患有癌症。样本可以是眼部样本,或者来自唾液或其它体液的样本。在一些实施方案中,样本是眼部样本,如分离的眼泪样本或眼部冲洗物。眼泪样本包括来自泪腺和与淋巴系统相连的其它组织的分泌物。本申请还提供了用于实施本文所述的方法的试剂盒。试剂盒可以包括样本采集平台、可包含蛋白酶抑制剂或其它蛋白稳定剂的用于采集和提取的管、样本提取试剂以及测试装置。附图简要说明图1:实验1中鉴定的下述蛋白的光谱强度的anova:(a)ig重链v-iv区hil、(b)ig重链区v-iii区bro、(c)ig重链v-iii区vh26、(d)抗白细胞蛋白酶、(e)β2微球蛋白、(f)类钙调蛋白5、(g)脂质运载蛋白1、(h)半胱氨酸蛋白酶抑制剂b、(i)半乳凝素3、(j)锌-α-2糖蛋白。图2:利用ig重链v-iv区域hil、ig重链区v-iii区bro、ig重链v-iii区vh26、抗白细胞蛋白酶、β2微球蛋白、类钙调蛋白5、脂质运载蛋白1、半胱氨酸蛋白酶抑制剂b、半乳凝素3、锌-α-2糖蛋白,来自实验1的癌症、良性和对照的roc曲线。图3:实验1中测试的75例样本中66例的乳腺密度分布的马赛克图。图4:实验2中鉴定的蛋白的光谱强度的anova。显示的蛋白为:(a)14-3-3蛋白σ(b)脱羧基6-磷酸葡糖酸脱氢酶(c)α-辅肌动蛋白-4(d)视黄醛脱氢酶(e)精氨基琥珀酸合成酶(f)β-2-微球蛋白(g)钙调蛋白(h)血浆铜蓝蛋白(i)丝切蛋白(j)半胱氨酸蛋白酶抑制剂-sn(k)烯醇化酶1(l)凝溶胶蛋白(m)热休克蛋白β-1(n)igα-1链c区(o)催泪蛋白(p)溶菌酶(q)基底膜特异的硫酸肝素蛋白聚糖核心蛋白(r)多聚免疫球蛋白受体(s)抑制蛋白1(t)s100a8(u)s100a9(v)分泌球蛋白家族1d成员1(w)vegf共调节趋化因子1(x)组氨酸三聚体核苷结合蛋白1(y)防御素1(z)l-乳酸脱氢酶a链(aa)sparc样蛋白1(bb)膜联蛋白5(cc)ig重链v-iii区til(dd)间-α-胰蛋白酶抑制剂重链1(ee)α-1b-糖蛋白(ff)α-1-抗胰蛋白酶。图5:如通过elisa所测定的,比较乳腺癌和对照样本中s100a9的表达水平的anova。图6:如通过elisa所测定的,比较乳腺癌和对照样本中lg3bp的表达水平的anova。图7:s100a9的roc曲线。图8:lg3bp的roc曲线。图9:s100a9和lg3bp组合的roc曲线。图10:基于乳腺组织分类的s100a9表达的anova。图11:基于乳腺组织分类的lg3bp表达的anova。发明详述本申请提供了来自眼部样本的蛋白和通过胰蛋白酶消化获得的肽片段。产生的多肽选自下述以及如表1中所列:igλ链v-iv区hil(lv403)、ig重链v-iiibro(hv305)、ig重链v-iiivh26(hv303)、β-2-微球蛋白(b2mg)、脂质运载蛋白-1(lcn1)、锌-α-2-糖蛋白(za2g)、半胱氨酸蛋白酶抑制剂b(cytb)、抗白细胞蛋白酶(slp1)、半乳凝素-3(leg3)、组氨酸三聚体核苷结合蛋白1(d6rd60)、s100a9(s10a9)、s100a8(s10a8)、半乳凝素-3结合蛋白(lg3bp)、igα-1链c区簇(igha1)、igκ链v-iii区hah簇(kv312)、vegf共调节趋化因子1(vcc1)、l-乳酸脱氢酶a链(ldha)、醛-酮还原酶家族1成员c(akr1c1)、小根蛋白(b1akd8)、l-乳酸脱氢酶b链(ldhb)、视黄醛脱氢酶1(al1a1)、未被表征的蛋白(b4e1z4)、α-1-抗胰凝乳蛋白酶(aact)、超氧化物歧化酶[cu-zn](sodc)、sparc样蛋白1(sprl1)、ig重链v-iii区域til(hv304)、角蛋白(k1c9)、半胱氨酸蛋白酶抑制剂-sn(cytn)、α-辅肌动蛋白-4(actn4)、igλ-3链c区域(片段)(iglc3)、免疫球蛋白λ样多肽5(igll5)、醇脱氢酶1c(adhig)、线粒体苹果酸脱氢酶(mdhm)、类钙调蛋白5(call5)、α-1-抗胰蛋白酶(a1at)、α-1b-糖蛋白(a1bg)、富亮氨酸α-2-糖蛋白(a2gl)、小泛素相关修饰物3(a8mu27)、前梯度蛋白2同系物(agr2)、抑制蛋白-1(prof1)、igλ链v-iii区域loi簇(lv302)、凝血酶原(e9pit3)、血液结合素(hemo)、igγ-2链c区(ighg2)、泛素-40s核糖体蛋白s27a(rps27a)、afamin(afam)、载脂蛋白a-i(apoa1)、载脂蛋白a-iv(apoa4)、黄素还原酶(nadph)(blvrb)、鞘脂激活蛋白原(psap)、催泪蛋白(lacrt)、60s酸性核糖体蛋白p1(rla1)、间-α-胰蛋白酶抑制剂重链h2(itih2)、粘蛋白样蛋白1(mucl1)、s100a6(s100a6)、na(+)/h(+)交换调节辅因子nhe-rf1(nhrf1)、含硫氧还蛋白结构域蛋白17(i3l0k2)、淋巴细胞特异性蛋白(lsp1)、结合珠蛋白簇(h3bs21)、肌球蛋白调节轻链12a(j2qrs3)、核糖核酸酶抑制因子(rini)、α-烯醇化酶(enoa)、igκ链v-i区域eu簇(kv106)、醇脱氢酶4类μ/σ链(adh7)、蛋白ambp(ambp)、血管紧张素原(angt)、抗凝血酶-iii(ant3)、载脂蛋白a-ii(apoa2)、钙蛋白酶抑制蛋白(b7z574)、脑酸溶性蛋白1(basp1)、α-2-hs-糖蛋白(c9jv77)、钙网蛋白(calr)、钙蛋白酶-1催化亚基(can1)、细胞分裂调控蛋白42同系物(cdc42)、补体c3(co3)、冠蛋白-1a(cor1a)、程序性细胞死亡6相互作用蛋白(dcd)、防御素1(def1)、f盒特有蛋白50(fbx50)、γ-谷氨酰环化转移酶(ggct)、线粒体谷胱甘肽还原酶(gshr)、ii型角蛋白细胞支架1(k2c1)、ump-cmp激酶(kcy)、间皮素(msln)、n-乙酰胞壁酰-l-丙氨酸酰胺酶(pgrp2)、烟酰胺磷酸核糖基转移酶(pncb)、间-α-胰蛋白酶抑制剂重链h1(itih1)、核糖核酸酶t2(rnaset2)、线粒体超氧化物歧化酶[mn](sodm)、富含脯氨酸小蛋白3(sprr3)、src底物皮层肌动蛋白(src8)、微管蛋白β-4b链簇(tbb4b)、原肌球蛋白α-3链(tpm3)、血清铁传递蛋白(trfe)、谷胱甘肽s转移酶p(thio)、玻连蛋白(vtnc)、维生素d结合蛋白(q6ldc6)、间-α-胰蛋白酶抑制剂重链h4(itih4)、金属蛋白酶抑制剂(timp1)、热休克蛋白90(hsp90)、组织蛋白酶b(catb)、血浆铜蓝蛋白(ceru)、钙卫蛋白、14-3-3σ(1433s)、α-2-hs-糖蛋白(fetua)、α-2-巨球蛋白(a2mg)、转甲状腺素蛋白(tthy)。附件i中提供了胰蛋白酶序列和在癌症样本中被鉴定为下调的蛋白的全长氨基酸序列。实施例中蛋白和肽在应答乳腺癌的存在时在生物样本中显示出与对照相比的增加或降低。这些蛋白和肽是生物标志物,并将被用于确定患者或其它对象的疾病状态。对象包括人、家养动物(如猫、狗、牛、猪)或者易受癌症影响的其它动物。“患者”指这样的对象:其被诊断为患有疾病或患有癌症或者正在对患有癌症进行测试。因此术语对象和患者在本文中可互换使用。对象可以疑患癌症。对象可以疑似患有癌症,包括:乳腺癌、听神经瘤、急性成淋巴细胞性白血病、急性髓性白血病、肾上腺肿瘤、aids相关癌症、基底细胞癌、良性血液病、膀胱癌、骨癌、脑肿瘤(转移性的和原发性的)、乳腺癌、原发来源未知的癌症、宫颈癌、慢性淋巴细胞白血病、慢性髓性白血病、结直肠癌、食道癌、胆囊和胆管癌、胃肠道神经内分泌肿瘤、gerd、巴雷特食管(barrett′sesophagus)和弛缓不能、妊娠滋养细胞疾病、头颈癌、卡波西肉瘤(kaposisarcoma)、肾癌、白血病、肝癌、肝转移、低级神经胶质瘤、肺癌、淋巴瘤、雄性乳腺癌、黑素瘤、梅克尔细胞癌、间皮瘤、多发性骨髓瘤、骨髓增生异常综合征、卵巢癌、胰腺癌、胰腺囊肿、垂体瘤、前列腺癌、肺神经内分泌肿瘤、罕见的血液病、皮肤癌、软组织肉瘤、脊柱肿瘤、鳞状细胞癌、胃(胃部的)癌、睾丸癌(生殖细胞肿瘤)、胸腺瘤及其它胸腺肿瘤、气管疾病、子宫(子宫内膜)癌、子宫肉瘤。对象可以有增加的发展为乳腺癌的风险。例如,对象可以处于增加的患癌症的风险中,或者由于阳性乳房x线摄影术结果、通过检出乳房内的肿块、已知增加癌症风险的基因(如brca)检测阳性而疑似患有癌症,或者已经进行了切除、活组织检查或者其它程序以去除癌症。对象可以正在经受或之前经受过针对癌症的治疗,并且本文的方法和试剂盒被用于监测治疗进程或可选地用于监测癌症的复发或扩散。本申请还提供了方法和试剂盒,以收集用于确定在泪分泌物中鉴定的蛋白或多肽的表达水平的眼部样本。公开了含有蛋白酶抑制剂或蛋白稳定剂的收集条和管的使用。试剂盒还包括用于从已与眼接触从而收集泪液分泌物的收集条洗脱乳腺癌生物标志物的缓冲液或试剂。公开了从眼腔收集蛋白的装置的设计以及具有放置收集装置和洗脱缓冲液的容器的该装置的包装。本申请公开的方法包括利用三重四极杆lc-ms/ms平台,将这些癌症生物标志物单独或多个用于基于clia的方案中,所述方案在集中式实验室测试设备中实施。可将收集自个体的眼部样本运送至该实施方案中的测试设备。将如附件1中所示的鉴定的蛋白及其后续蛋白水解片段用于在三重四极杆中对产生的诊断肽进行定量分析。可以限定与选自下述以及如表1中所列的多肽直接相关的关于多肽浓度的阈值或相对值或实际值,或者可将样本与非癌样本直接进行比较,所述下述为:igλ链v-iv区hil(lv403)、ig重链v-iiibro(hv305)、ig重链v-iiivh26(hv303)、β-2-微球蛋白(b2mg)、脂质运载蛋白-1(lcn1)、锌-α-2-糖蛋白(za2g)、半胱氨酸蛋白酶抑制剂b(cytb)、抗白细胞蛋白酶(slp1)、半乳凝素-3(leg3)、组氨酸三聚体核苷结合蛋白1(d6rd60)、s100a9(s10a9)、s100a8(s10a8)、半乳凝素-3结合蛋白(lg3bp)、igα-1链c区簇(igha1)、igκ链v-iii区域hah簇(kv312)、vegf共调节趋化因子1(vcc1)、l-乳酸脱氢酶a链(ldha)、醛-酮还原酶家族1成员c(akr1c1)、小根蛋白(b1akd8)、l-乳酸脱氢酶b链(ldhb)、视黄醛脱氢酶1(al1a1)、未被表征的蛋白(b4e1z4)、α-1-抗胰凝乳蛋白酶(aact)、超氧化物歧化酶[cu-zn](sodc)、sparc样蛋白1(sprl1)、ig重链v-iii区til(hv304)、角蛋白(k1c9)、半胱氨酸蛋白酶抑制剂-sn(cytn)、α-辅肌动蛋白-4(actn4)、igλ-3链c区(片段)(iglc3)、免疫球蛋白λ样多肽5(igll5)、醇脱氢酶1c(adhig)、线粒体苹果酸脱氢酶(mdhm)、类钙调蛋白5(call5)、α-1-抗胰蛋白酶(a1at)、α-1b-糖蛋白(a1bg)、富亮氨酸α-2-糖蛋白(a2gl)、小泛素相关修饰物3(a8mu27)、前梯度蛋白2同系物(agr2)、抑制蛋白-1(prof1)、igλ链v-iii区loi簇(lv302)、凝血酶原(e9pit3)、血液结合素(hemo)、igγ-2链c区(ighg2)、泛素-40s核糖体蛋白s27a(rps27a)、afamin(afam)、载脂蛋白a-i(apoa1)、载脂蛋白a-iv(apoa4)、黄素还原酶(nadph)(blvrb)、鞘脂激活蛋白原(psap)、催泪蛋白(lacrt)、60s酸性核糖体蛋白p1(rla1)、间-α-胰蛋白酶抑制剂重链h2(itih2)、粘蛋白样蛋白1(mucl1)、s100a6(s100a6)、na(+)/h(+)交换调节辅因子nhe-rf1(nhrf1)、含硫氧还蛋白结构域蛋白17(i3l0k2)、淋巴细胞特异性蛋白(lsp1)、结合珠蛋白簇(h3bs21)、肌球蛋白调节轻链12a(j2qrs3)、核糖核酸酶抑制因子(rini)、α-烯醇化酶(enoa)、igκ链v-i区eu簇(kv106)、醇脱氢酶4类μ/σ链(adh7)、蛋白ambp(ambp)、血管紧张素原(angt)、抗凝血酶-iii(ant3)、载脂蛋白a-ii(apoa2)、钙蛋白酶抑制蛋白(b7z574)、脑酸溶性蛋白1(basp1)、α-2-hs-糖蛋白(c9jv77)、钙网蛋白(calr)、钙蛋白酶-1催化亚基(can1)、细胞分裂调控蛋白42同系物(cdc42)、补体c3(co3)、冠蛋白-1a(cor1a)、程序性细胞死亡6相互作用蛋白(dcd)、防御素1(def1)、f盒特有蛋白50(fbx50)、γ-谷氨酰环化转移酶(ggct)、线粒体谷胱甘肽还原酶(gshr)、ii型角蛋白细胞支架1(k2c1)、ump-cmp激酶(kcy)、间皮素(msln)、n-乙酰胞壁酰-l-丙氨酸酰胺酶(pgrp2)、烟酰胺磷酸核糖基转移酶(pncb)、间-α-胰蛋白酶抑制剂重链h1(itih1)、核糖核酸酶t2(rnaset2)、线粒体超氧化物歧化酶[mn](sodm)、富含脯氨酸小蛋白3(sprr3)、src底物皮层肌动蛋白(src8)、微管蛋白β-4b链簇(tbb4b)、原肌球蛋白α-3链(tpm3)、血清铁传递蛋白(trfe)、谷胱甘肽s转移酶p(thio)、玻连蛋白(vtnc)、维生素d结合蛋白(q6ldc6)、间-α-胰蛋白酶抑制剂重链h4(itih4)、金属蛋白酶抑制剂(timp1)、热休克蛋白90(hsp90)、组织蛋白酶b(catb)、血浆铜蓝蛋白(ceru)、钙卫蛋白、14-3-3σ(1433s)、α-2-hs-糖蛋白(fetua)、α-2-巨球蛋白(a2mg)、转甲状腺素蛋白(tthy),或者可以将样本直接与非癌性对照进行比较。可以将报告形式的定量信息提供给医师,以帮助其作出关于患者护理途径的决策。医师可将治疗决策基于这些结果,以及最终步骤可以包括向对象施用合适的抗癌治疗剂。在可选实施方案中,可以通过使用结合剂(例如抗体、类肽或包被的表面)和提供对这些蛋白特异的结合相互作用的试剂以产生可基于可检测的信号(如荧光、颜色变化或uv吸光度)的产生来定量的反应来检测选自下述以及如表1中所列的多肽:igλ链v-iv区hil(lv403)、ig重链v-iiibro(hv305)、ig重链v-iiivh26(hv303)、β-2-微球蛋白(b2mg)、脂质运载蛋白-1(lcn1)、锌-α-2-糖蛋白(za2g)、半胱氨酸蛋白酶抑制剂b(cytb)、抗白细胞蛋白酶(slp1)、半乳凝素-3(leg3)、组氨酸三聚体核苷结合蛋白1(d6rd60)、s100a9(s10a9)、s100a8(s10a8)、半乳凝素-3结合蛋白(lg3bp)、igα-1链c区簇(igha1)、igκ链v-iii区hah簇(kv312)、vegf共调节趋化因子1(vcc1)、l-乳酸脱氢酶a链(ldha)、醛-酮还原酶家族1成员c(akr1c1)、小根蛋白(b1akd8)、l-乳酸脱氢酶b链(ldhb)、视黄醛脱氢酶1(al1a1)、未被表征的蛋白(b4e1z4)、α-1-抗胰凝乳蛋白酶(aact)、超氧化物歧化酶[cu-zn](sodc)、sparc样蛋白1(sprl1)、ig重链v-iii区til(hv304)、角蛋白(k1c9)、半胱氨酸蛋白酶抑制剂-sn(cytn)、α-辅肌动蛋白-4(actn4)、igλ-3链c区(片段)(iglc3)、免疫球蛋白λ样多肽5(igll5)、醇脱氢酶1c(adhig)、线粒体苹果酸脱氢酶(mdhm)、类钙调蛋白5(call5)、α-1-抗胰蛋白酶(a1at)、α-1b-糖蛋白(a1bg)、富亮氨酸α-2-糖蛋白(a2gl)、小泛素相关修饰物3(a8mu27)、前梯度蛋白2同系物(agr2)、抑制蛋白-1(prof1)、igλ链v-iii区loi簇(lv302)、凝血酶原(e9pit3)、血液结合素(hemo)、igγ-2链c区(ighg2)、泛素-40s核糖体蛋白s27a(rps27a)、afamin(afam)、载脂蛋白a-i(apoa1)、载脂蛋白a-iv(apoa4)、黄素还原酶(nadph)(blvrb)、鞘脂激活蛋白原(psap)、催泪蛋白(lacrt)、60s酸性核糖体蛋白p1(rla1)、间-α-胰蛋白酶抑制剂重链h2(itih2)、粘蛋白样蛋白1(mucl1)、s100a6(s100a6)、na(+)/h(+)交换调节辅因子nhe-rf1(nhrf1)、含硫氧还蛋白结构域蛋白17(i3l0k2)、淋巴细胞特异性蛋白(lsp1)、结合珠蛋白簇(h3bs21)、肌球蛋白调节轻链12a(j2qrs3)、核糖核酸酶抑制因子(rini)、α-烯醇化酶(enoa)、igκ链v-i区eu簇(kv106)、醇脱氢酶4类μ/σ链(adh7)、蛋白ambp(ambp)、血管紧张素原(angt)、抗凝血酶-iii(ant3)、载脂蛋白a-ii(apoa2)、钙蛋白酶抑制蛋白(b7z574)、脑酸溶性蛋白1(basp1)、α-2-hs-糖蛋白(c9jv77)、钙网蛋白(calr)、钙蛋白酶-1催化亚基(can1)、细胞分裂调控蛋白42同系物(cdc42)、补体c3(co3)、冠蛋白-1a(cor1a)、程序性细胞死亡6相互作用蛋白(dcd)、防御素1(def1)、f盒特有蛋白50(fbx50)、γ-谷氨酰环化转移酶(ggct)、线粒体谷胱甘肽还原酶(gshr)、ii型角蛋白细胞支架1(k2c1)、ump-cmp激酶(kcy)、间皮素(msln)、n-乙酰胞壁酰-l-丙氨酸酰胺酶(pgrp2)、烟酰胺磷酸核糖基转移酶(pncb)、间-α-胰蛋白酶抑制剂重链h1(itih1)、核糖核酸酶t2(rnaset2)、线粒体超氧化物歧化酶[mn](sodm)、富含脯氨酸小蛋白3(sprr3)、src底物皮层肌动蛋白(src8)、微管蛋白β-4b链簇(tbb4b)、原肌球蛋白α-3链(tpm3)、血清铁传递蛋白(trfe)、谷胱甘肽s转移酶p(thio)、玻连蛋白(vtnc)、维生素d结合蛋白(q6ldc6)、间-α-胰蛋白酶抑制剂重链h4(itih4)、金属蛋白酶抑制剂(timp1)、热休克蛋白90(hsp90)、组织蛋白酶b(catb)、血浆铜蓝蛋白(ceru)、钙卫蛋白、14-3-3σ(1433s)、α-2-hs-糖蛋白(fetua)、α-2-巨球蛋白(a2mg)、转甲状腺素蛋白(tthy)。还提供了在具有配套指示仪的容器中(如可在及时现场护理(pointofcare)处使用的及时现场护理装置(point-of-caredevice))使用这些组分。还可将这些蛋白和多肽的结合剂用于侧向流动装置中的检测。因此,可将利用结合配偶体(如抗体)检测样本中的蛋白表达水平的方法用于在免疫分析中检测本文提供的标志物。免疫分析通常包括将测试样本与特异性结合生物标志物或以其它方式识别生物标志物的抗体或抗原接触,以及检测与样本中的生物标志物结合的抗体或抗原的复合物的存在。免疫分析方法可以选自本领域已知的涉及抗体/抗原复合物识别的多种免疫分析方法,包括酶联免疫吸附测定(elisa)、放射免疫分析(ria)和蛋白免疫印迹,以及多元分析的使用,所述多元分析的使用包括抗体阵列的使用,其中将若干种期望的抗体置于支持物(如玻璃珠或板)上,并使其与测试样本反应或以其它方式与测试样本接触。此类分析是本领域技术人员熟知的。可以以多种方式在样本中检测本文所述的生物标志物。在一个实施方案中,方法提供了从获自样本中的mrna进行互补dna的反转录。荧光染料标记的互补rna可以转录自互补的dna,然后其可以与寡核苷酸探针阵列杂交。由杂交产生的荧光颜色可被机器如surescan微阵列扫描仪(agilenttechnologies)读取,以及利用软件如安捷伦特征提取软件(agilentfeatureextractionsoftware)(9.1)获得数据并进行处理。此类基于阵列的方法包括微阵列分析以形成基因表达谱。本文使用的术语“基因表达谱”指对象中一组基因的mrna或蛋白的表达水平。本文使用的术语“诊断组”指一组基因、肽或蛋白,其中可依赖其表达水平来诊断或预测疾病的状态。如本文所提供的,在该组中包括选自下述以及如表1中所列的基因、肽和蛋白:igλ链v-iv区hil(lv403)、ig重链v-iiibro(hv305)、ig重链v-iiivh26(hv303)、β-2-微球蛋白(b2mg)、脂质运载蛋白-1(lcn1)、锌-α-2-糖蛋白(za2g)、半胱氨酸蛋白酶抑制剂b(cytb)、抗白细胞蛋白酶(slp1)、半乳凝素-3(leg3)、组氨酸三聚体核苷结合蛋白1(d6rd60)、s100a9(s10a9)、s100a8(s10a8)、半乳凝素-3结合蛋白(lg3bp)、igα-1链c区簇(igha1)、igκ链v-iii区hah簇(kv312)、vegf共调节趋化因子1(vcc1)、l-乳酸脱氢酶a链(ldha)、醛-酮还原酶家族1成员c(akr1c1)、小根蛋白(b1akd8)、l-乳酸脱氢酶b链(ldhb)、视黄醛脱氢酶1(al1a1)、未被表征的蛋白(b4e1z4)、α-1-抗胰凝乳蛋白酶(aact)、超氧化物歧化酶[cu-zn](sodc)、sparc样蛋白1(sprl1)、ig重链v-iii区til(hv304)、角蛋白(k1c9)、半胱氨酸蛋白酶抑制剂-sn(cytn)、α-辅肌动蛋白-4(actn4)、igλ-3链c区(片段)(iglc3)、免疫球蛋白λ样多肽5(igll5)、醇脱氢酶1c(adhig)、线粒体苹果酸脱氢酶(mdhm)、类钙调蛋白5(call5)、α-1-抗胰蛋白酶(a1at)、α-1b-糖蛋白(a1bg)、富亮氨酸α-2-糖蛋白(a2gl)、小泛素相关修饰物3(a8mu27)、前梯度蛋白2同系物(agr2)、抑制蛋白-1(prof1)、igλ链v-iii区loi簇(lv302)、凝血酶原(e9pit3)、血液结合素(hemo)、igγ-2链c区(ighg2)、泛素-40s核糖体蛋白s27a(rps27a)、afamin(afam)、载脂蛋白a-i(apoa1)、载脂蛋白a-iv(apoa4)、黄素还原酶(nadph)(blvrb)、鞘脂激活蛋白原(psap)、催泪蛋白(lacrt)、60s酸性核糖体蛋白p1(rla1)、间-α-胰蛋白酶抑制剂重链h2(itih2)、粘蛋白样蛋白1(mucl1)、s100a6(s100a6)、na(+)/h(+)交换调节辅因子nhe-rf1(nhrf1)、含硫氧还蛋白结构域蛋白17(i3l0k2)、淋巴细胞特异性蛋白(lsp1)、结合珠蛋白簇(h3bs21)、肌球蛋白调节轻链12a(j2qrs3)、核糖核酸酶抑制因子(rini)、α-烯醇化酶(enoa)、igκ链v-i区eu簇(kv106)、醇脱氢酶4类μ/σ链(adh7)、蛋白ambp(ambp)、血管紧张素原(angt)、抗凝血酶-iii(ant3)、载脂蛋白a-ii(apoa2)、钙蛋白酶抑制蛋白(b7z574)、脑酸溶性蛋白1(basp1)、α-2-hs-糖蛋白(c9jv77)、钙网蛋白(calr)、钙蛋白酶-1催化亚基(can1)、细胞分裂调控蛋白42同系物(cdc42)、补体c3(co3)、冠蛋白-1a(cor1a)、程序性细胞死亡6相互作用蛋白(dcd)、防御素1(def1)、f盒特有蛋白50(fbx50)、γ-谷氨酰环化转移酶(ggct)、线粒体谷胱甘肽还原酶(gshr)、ii型角蛋白细胞支架1(k2c1)、ump-cmp激酶(kcy)、间皮素(msln)、n-乙酰胞壁酰-l-丙氨酸酰胺酶(pgrp2)、烟酰胺磷酸核糖基转移酶(pncb)、间-α-胰蛋白酶抑制剂重链h1(itih1)、核糖核酸酶t2(rnaset2)、线粒体超氧化物歧化酶[mn](sodm)、富含脯氨酸小蛋白3(sprr3)、src底物皮层肌动蛋白(src8)、微管蛋白β-4b链簇(tbb4b)、原肌球蛋白α-3链(tpm3)、血清铁传递蛋白(trfe)、谷胱甘肽s转移酶p(thio)、玻连蛋白(vtnc)、维生素d结合蛋白(q6ldc6)、间-α-胰蛋白酶抑制剂重链h4(itih4)、金属蛋白酶抑制剂(timp1)、热休克蛋白90(hsp90)、组织蛋白酶b(catb)、血浆铜蓝蛋白(ceru)、钙卫蛋白、14-3-3σ(1433s)、α-2-hs-糖蛋白(fetua)、α-2-巨球蛋白(a2mg)、转甲状腺素蛋白(tthy)以及它们的任何组合。在其它实施方案中,从获自样本的mrna反转录出互补的dna,对其进行扩增,同时通过实时pcr定量,从而能够检测和定量(如绝对拷贝数或标准化为dna输入或其它标准化基因时的相对量)互补dna样本以及原始mrna样本中的特定基因产物。本申请方面的方法包括检测至少一种生物标志物。然而,可以检测任何数目的生物标志物。优选在分析中检测至少两种生物标志物。然而,意识到在分析中可以利用本文所述的生物标志物中的三种、四种或更多种,包括全部。因此,在检测中不仅可以检测一种或多种标志物,也可以使用任何数目或任何组合的标志物。此外,可将本文未描述的其它生物标志物与本公开的生物标志物中的任一种组合,以帮助癌症的诊断。此外,根据本申请的方面可以检测以上生物标志物的任何组合。相对于对照样本中的标志物的水平,选自下述以及如表1中所列的标志物可以增加或减少至少1.5倍、2倍、4倍、5倍、8倍、10倍或更多倍:igλ链v-iv区hil(lv403)、ig重链v-iiibro(hv305)、ig重链v-iiivh26(hv303)、β-2-微球蛋白(b2mg)、脂质运载蛋白-1(lcn1)、锌-α-2-糖蛋白(za2g)、半胱氨酸蛋白酶抑制剂b(cytb)、抗白细胞蛋白酶(slp1)、半乳凝素-3(leg3)、组氨酸三聚体核苷结合蛋白1(d6rd60)、s100a9(s10a9)、s100a8(s10a8)、半乳凝素-3结合蛋白(lg3bp)、igα-1链c区簇(igha1)、igκ链v-iii区hah簇(kv312)、vegf共调节趋化因子1(vcc1)、l-乳酸脱氢酶a链(ldha)、醛-酮还原酶家族1成员c(akr1c1)、小根蛋白(b1akd8)、l-乳酸脱氢酶b链(ldhb)、视黄醛脱氢酶1(al1a1)、未被表征的蛋白(b4e1z4)、α-1-抗胰凝乳蛋白酶(aact)、超氧化物歧化酶[cu-zn](sodc)、sparc样蛋白1(sprl1)、ig重链v-iii区til(hv304)、角蛋白(k1c9)、半胱氨酸蛋白酶抑制剂-sn(cytn)、α-辅肌动蛋白-4(actn4)、igλ-3链c区(片段)(iglc3)、免疫球蛋白λ样多肽5(igll5)、醇脱氢酶1c(adhig)、线粒体苹果酸脱氢酶(mdhm)、类钙调蛋白5(call5)、α-1-抗胰蛋白酶(a1at)、α-1b-糖蛋白(a1bg)、富亮氨酸α-2-糖蛋白(a2gl)、小泛素相关修饰物3(a8mu27)、前梯度蛋白2同系物(agr2)、抑制蛋白-1(prof1)、igλ链v-iii区loi簇(lv302)、凝血酶原(e9pit3)、血液结合素(hemo)、igγ-2链c区(ighg2)、泛素-40s核糖体蛋白s27a(rps27a)、afamin(afam)、载脂蛋白a-i(apoa1)、载脂蛋白a-iv(apoa4)、黄素还原酶(nadph)(blvrb)、鞘脂激活蛋白原(psap)、催泪蛋白(lacrt)、60s酸性核糖体蛋白p1(rla1)、间-α-胰蛋白酶抑制剂重链h2(itih2)、粘蛋白样蛋白1(mucl1)、s100a6(s100a6)、na(+)/h(+)交换调节辅因子nhe-rf1(nhrf1)、含硫氧还蛋白结构域蛋白17(i3l0k2)、淋巴细胞特异性蛋白(lsp1)、结合珠蛋白簇(h3bs21)、肌球蛋白调节轻链12a(j2qrs3)、核糖核酸酶抑制因子(rini)、α-烯醇化酶(enoa)、igκ链v-i区eu簇(kv106)、醇脱氢酶4类μ/σ链(adh7)、蛋白ambp(ambp)、血管紧张素原(angt)、抗凝血酶-iii(ant3)、载脂蛋白a-ii(apoa2)、钙蛋白酶抑制蛋白(b7z574)、脑酸溶性蛋白1(basp1)、α-2-hs-糖蛋白(c9jv77)、钙网蛋白(calr)、钙蛋白酶-1催化亚基(can1)、细胞分裂调控蛋白42同系物(cdc42)、补体c3(co3)、冠蛋白-1a(cor1a)、程序性细胞死亡6相互作用蛋白(dcd)、防御素1(def1)、f盒特有蛋白50(fbx50)、γ-谷氨酰环化转移酶(ggct)、线粒体谷胱甘肽还原酶(gshr)、ii型角蛋白细胞支架1(k2c1)、ump-cmp激酶(kcy)、间皮素(msln)、n-乙酰胞壁酰-l-丙氨酸酰胺酶(pgrp2)、烟酰胺磷酸核糖基转移酶(pncb)、间-α-胰蛋白酶抑制剂重链h1(itih1)、核糖核酸酶t2(rnaset2)、线粒体超氧化物歧化酶[mn](sodm)、富含脯氨酸小蛋白3(sprr3)、src底物皮层肌动蛋白(src8)、微管蛋白β-4b链簇(tbb4b)、原肌球蛋白α-3链(tpm3)、血清铁传递蛋白(trfe)、谷胱甘肽s转移酶p(thio)、玻连蛋白(vtnc)、维生素d结合蛋白(q6ldc6)、间-α-胰蛋白酶抑制剂重链h4(itih4)、金属蛋白酶抑制剂(timp1)、热休克蛋白90(hsp90)、组织蛋白酶b(catb)、血浆铜蓝蛋白(ceru)、钙卫蛋白、14-3-3σ(1433s)、α-2-hs-糖蛋白(fetua)、α-2-巨球蛋白(a2mg)、转甲状腺素蛋白(tthy)。对照样本可以是来自未患癌症的对象的样本、来自多个未患癌症的对象的混合样本,或者可以是已知为未患癌症的对象的平均表达水平的对照或基线表达水平。在整个本公开内容中使用了一些术语,并且应当如本领域通常所使用的对其进行定义,或者如本文所具体提供的进行定义。如本文所提供的,质谱分析法或ms指产生电场或磁场以确定肽和化合物的质荷比从而鉴定或确定肽序列和化学结构的分析技术。lc-ms/ms光谱测定法指将高效液相色谱(hplc)的分离能力与质谱分析法的质量分析组合的分析技术。三重四级杆质谱分析法指具有三个电离室(q1、q2&q3)的串联质谱仪。该技术允许对感兴趣分子进行目标检测。离子对指三重四级杆质谱分析法仪器中q1中检测的双电荷或三电荷形式的亲本肽以及如由q2形成并在q3中检测的产生的y或b离子。sis内部肽指具有与q1中待被监测的肽相同的序列并被用作内部参照标准品以定量目标肽的合成的同位素标记的肽。y离子指从肽片段的c端产生的离子。b离子指从肽片段的n端产生的离子。定量离子指用于确定生物样本中其亲本蛋白量的选择的最高强度的y或b离子。定性离子指被选择以确保定性离子与所选目标蛋白的整合以及标记的肽与所选标准品的整合的离子。clia指临床实验室改进修正案,其为除临床试验和基础研究之外适用于在美国对人进行的所有临床实验室测试的联邦监管标准。(clia相关的联邦公报和美国联邦法规公告(cliarelatedfederalregisterandcodeoffederalregulationannouncements))。clia批准的实验室指为了疾病或损害的诊断、预防或治疗对人样品进行实验室测试,且由食品和药品管理局(fda)认可的监管组织批准和监控的临床实验室(clia法律法规,2013)。clia豁免的试验指符合由fda定义的风险、误差和复杂性的具体标准的临床实验室试验。及时现场护理装置指在患者和医师护理场所可用的设备或容器,其含有目标生物标志物或一系列目标生物标志物的结合试剂,并且其可以产生关于测定的生物标志物的存在、不存在以及一些情况下的浓度的信息。分析物指任何可测量的生物标志物,其可以是蛋白、肽、高分子、代谢物、小分子或自身抗体。本文使用的生物流体指眼泪、全血、血清、尿以及唾液。生物标志物指由于疾病或病况,体内浓度水平改变(例如增加或减少)的任何物质(例如蛋白、肽、代谢物、多核苷酸序列)。标志物和生物标志物在本文可互换使用。侧向流动试验指利用烧结聚合物的多孔纸来测量生物流体中分析物的存在的装置。elisa指酶联免疫吸附测定,其利用抗体或抗原来检测目标分析物的存在和浓度。诊断组指一组分子(例如蛋白或肽),利用其组合浓度来诊断疾病状态(例如癌症)。乳腺癌标志物指由于癌症的存在或不存在,体内浓度水平改变(例如增加或减少)的分子,例如蛋白、肽、代谢物、多核苷酸序列。除了可用于诊断对象中的癌症并且特别是乳腺癌之外,本文提供的试剂盒和方法可用于监测先前被诊断为患有癌症的个体中癌症的治疗和复发。因此如果治疗之后,同一对象中选自下述以及如表1中所列的标志物的水平随时间增加或减少,则可施用靶向所述癌症的其它化学疗法:igλ链v-iv区hil(lv403)、ig重链v-iiibro(hv305)、ig重链v-iiivh26(hv303)、β-2-微球蛋白(b2mg)、脂质运载蛋白-1(lcn1)、锌-α-2-糖蛋白(za2g)、半胱氨酸蛋白酶抑制剂b(cytb)、抗白细胞蛋白酶(slp1)、半乳凝素-3(leg3)、组氨酸三聚体核苷结合蛋白1(d6rd60)、s100a9(s10a9)、s100a8(s10a8)、半乳凝素-3结合蛋白(lg3bp)、igα-1链c区簇(igha1)、igκ链v-iii区hah簇(kv312)、vegf共调节趋化因子1(vcc1)、l-乳酸脱氢酶a链(ldha)、醛-酮还原酶家族1成员c(akr1c1)、小根蛋白(b1akd8)、l-乳酸脱氢酶b链(ldhb)、视黄醛脱氢酶1(al1a1)、未被表征的蛋白(b4e1z4)、α-1-抗胰凝乳蛋白酶(aact)、超氧化物歧化酶[cu-zn](sodc)、sparc样蛋白1(sprl1)、ig重链v-iii区til(hv304)、角蛋白(k1c9)、半胱氨酸蛋白酶抑制剂-sn(cytn)、α-辅肌动蛋白-4(actn4)、igλ-3链c区(片段)(iglc3)、免疫球蛋白λ样多肽5(igll5)、醇脱氢酶1c(adhig)、线粒体苹果酸脱氢酶(mdhm)、类钙调蛋白5(call5)、α-1-抗胰蛋白酶(a1at)、α-1b-糖蛋白(a1bg)、富亮氨酸α-2-糖蛋白(a2gl)、小泛素相关修饰物3(a8mu27)、前梯度蛋白2同系物(agr2)、抑制蛋白-1(prof1)、igλ链v-iii区loi簇(lv302)、凝血酶原(e9pit3)、血液结合素(hemo)、igγ-2链c区(ighg2)、泛素-40s核糖体蛋白s27a(rps27a)、afamin(afam)、载脂蛋白a-i(apoa1)、载脂蛋白a-iv(apoa4)、黄素还原酶(nadph)(blvrb)、鞘脂激活蛋白原(psap)、催泪蛋白(lacrt)、60s酸性核糖体蛋白p1(rla1)、间-α-胰蛋白酶抑制剂重链h2(itih2)、粘蛋白样蛋白1(mucl1)、s100a6(s100a6)、na(+)/h(+)交换调节辅因子nhe-rf1(nhrf1)、含硫氧还蛋白结构域蛋白17(i3l0k2)、淋巴细胞特异性蛋白(lsp1)、结合珠蛋白簇(h3bs21)、肌球蛋白调节轻链12a(j2qrs3)、核糖核酸酶抑制因子(rini)、α-烯醇化酶(enoa)、igκ链v-i区eu簇(kv106)、醇脱氢酶4类μ/σ链(adh7)、蛋白ambp(ambp)、血管紧张素原(angt)、抗凝血酶-iii(ant3)、载脂蛋白a-ii(apoa2)、钙蛋白酶抑制蛋白(b7z574)、脑酸溶性蛋白1(basp1)、α-2-hs-糖蛋白(c9jv77)、钙网蛋白(calr)、钙蛋白酶-1催化亚基(can1)、细胞分裂调控蛋白42同系物(cdc42)、补体c3(co3)、冠蛋白-1a(cor1a)、程序性细胞死亡6相互作用蛋白(dcd)、防御素1(def1)、f盒特有蛋白50(fbx50)、γ-谷氨酰环化转移酶(ggct)、线粒体谷胱甘肽还原酶(gshr)、ii型角蛋白细胞支架1(k2c1)、ump-cmp激酶(kcy)、间皮素(msln)、n-乙酰胞壁酰-l-丙氨酸酰胺酶(pgrp2)、烟酰胺磷酸核糖基转移酶(pncb)、间-α-胰蛋白酶抑制剂重链h1(itih1)、核糖核酸酶t2(rnaset2)、线粒体超氧化物歧化酶[mn](sodm)、富含脯氨酸小蛋白3(sprr3)、src底物皮层肌动蛋白(src8)、微管蛋白β-4b链簇(tbb4b)、原肌球蛋白α-3链(tpm3)、血清铁传递蛋白(trfe)、谷胱甘肽s转移酶p(thio)、玻连蛋白(vtnc)、维生素d结合蛋白(q6ldc6)、间-α-胰蛋白酶抑制剂重链h4(itih4)、金属蛋白酶抑制剂(timp1)、热休克蛋白90(hsp90)、组织蛋白酶b(catb)、血浆铜蓝蛋白(ceru)、钙卫蛋白、14-3-3σ(1433s)、α-2-hs-糖蛋白(fetua)、α-2-巨球蛋白(a2mg)、转甲状腺素蛋白(tthy)。本申请的方法和试剂盒还可用于监测化学疗法治疗的有效性。在该可选的实施方案中,在单个对象中,如果治疗方案有效,选自下述以及如表1中所列的生物标志物的水平可以随时间增加或减少,以及如果治疗方案无效,所述生物标志物的水平将不改变或者可以随时间增加或减少,这取决于对对象中的哪种生物标志物进行检测,所述生物标志物选自:igλ链v-iv区hil(lv403)、ig重链v-iiibro(hv305)、ig重链v-iiivh26(hv303)、β-2-微球蛋白(b2mg)、脂质运载蛋白-1(lcn1)、锌-α-2-糖蛋白(za2g)、半胱氨酸蛋白酶抑制剂b(cytb)、抗白细胞蛋白酶(slp1)、半乳凝素-3(leg3)、组氨酸三聚体核苷结合蛋白1(d6rd60)、s100a9(s10a9)、s100a8(s10a8)、半乳凝素-3结合蛋白(lg3bp)、igα-1链c区簇(igha1)、igκ链v-iii区hah簇(kv312)、vegf共调节趋化因子1(vcc1)、l-乳酸脱氢酶a链(ldha)、醛-酮还原酶家族1成员c(akr1c1)、小根蛋白(b1akd8)、l-乳酸脱氢酶b链(ldhb)、视黄醛脱氢酶1(al1a1)、未被表征的蛋白(b4e1z4)、α-1-抗胰凝乳蛋白酶(aact)、超氧化物歧化酶[cu-zn](sodc)、sparc样蛋白1(sprl1)、ig重链v-iii区til(hv304)、角蛋白(k1c9)、半胱氨酸蛋白酶抑制剂-sn(cytn)、α-辅肌动蛋白-4(actn4)、igλ-3链c区(片段)(iglc3)、免疫球蛋白λ样多肽5(igll5)、醇脱氢酶1c(adhig)、线粒体苹果酸脱氢酶(mdhm)、类钙调蛋白5(call5)、α-1-抗胰蛋白酶(a1at)、α-1b-糖蛋白(a1bg)、富亮氨酸α-2-糖蛋白(a2gl)、小泛素相关修饰物3(a8mu27)、前梯度蛋白2同系物(agr2)、抑制蛋白-1(prof1)、igλ链v-iii区loi簇(lv302)、凝血酶原(e9pit3)、血液结合素(hemo)、igγ-2链c区(ighg2)、泛素-40s核糖体蛋白s27a(rps27a)、afamin(afam)、载脂蛋白a-i(apoa1)、载脂蛋白a-iv(apoa4)、黄素还原酶(nadph)(blvrb)、鞘脂激活蛋白原(psap)、催泪蛋白(lacrt)、60s酸性核糖体蛋白p1(rla1)、间-α-胰蛋白酶抑制剂重链h2(itih2)、粘蛋白样蛋白1(mucl1)、s100a6(s100a6)、na(+)/h(+)交换调节辅因子nhe-rf1(nhrf1)、含硫氧还蛋白结构域蛋白17(i3l0k2)、淋巴细胞特异性蛋白(lsp1)、结合珠蛋白簇(h3bs21)、肌球蛋白调节轻链12a(j2qrs3)、核糖核酸酶抑制因子(rini)、α-烯醇化酶(enoa)、igκ链v-i区eu簇(kv106)、醇脱氢酶4类μ/σ链(adh7)、蛋白ambp(ambp)、血管紧张素原(angt)、抗凝血酶-iii(ant3)、载脂蛋白a-ii(apoa2)、钙蛋白酶抑制蛋白(b7z574)、脑酸溶性蛋白1(basp1)、α-2-hs-糖蛋白(c9jv77)、钙网蛋白(calr)、钙蛋白酶-1催化亚基(can1)、细胞分裂调控蛋白42同系物(cdc42)、补体c3(co3)、冠蛋白-1a(cor1a)、程序性细胞死亡6相互作用蛋白(dcd)、防御素1(def1)、f盒特有蛋白50(fbx50)、γ-谷氨酰环化转移酶(ggct)、线粒体谷胱甘肽还原酶(gshr)、ii型角蛋白细胞支架1(k2c1)、ump-cmp激酶(kcy)、间皮素(msln)、n-乙酰胞壁酰-l-丙氨酸酰胺酶(pgrp2)、烟酰胺磷酸核糖基转移酶(pncb)、间-α-胰蛋白酶抑制剂重链h1(itih1)、核糖核酸酶t2(rnaset2)、线粒体超氧化物歧化酶[mn](sodm)、富含脯氨酸小蛋白3(sprr3)、src底物皮层肌动蛋白(src8)、微管蛋白β-4b链簇(tbb4b)、原肌球蛋白α-3链(tpm3)、血清铁传递蛋白(trfe)、谷胱甘肽s转移酶p(thio)、玻连蛋白(vtnc)、维生素d结合蛋白(q6ldc6)、间-α-胰蛋白酶抑制剂重链h4(itih4)、金属蛋白酶抑制剂(timp1)、热休克蛋白90(hsp90)、组织蛋白酶b(catb)、血浆铜蓝蛋白(ceru)、钙卫蛋白、14-3-3σ(1433s)、α-2-hs-糖蛋白(fetua)、α-2-巨球蛋白(a2mg)、转甲状腺素蛋白(tthy)。治疗癌症包括但不限于:减少对象中癌细胞的数量或者肿瘤或肿块的大小,将癌症的进展降低至侵袭性较弱的形式,减少癌细胞的增殖或者降低肿瘤生长的速度,杀死癌细胞,减少癌细胞的转移,或者减少对象中癌症复发的可能性。如本文所用的,治疗对象指为罹患疾病的对象或处于发展为所述疾病的风险的对象带来益处的任何类型的治疗,包括对象的病况的改善(例如一种或多种症状的改善)、疾病进展的延迟、症状发作的延迟或症状发展的延迟等。本公开内容不限于本文所述的构建、组件布置或方法步骤的具体细节。鉴于后续公开内容,能够以对本领域技术人员而言显而易见的各种方式来制造、实践、使用、实现和/或形成本文公开的组合物和方法。本文使用的词组和术语仅是出于描述的目的,并且不应被视为限制权利要求的范围。说明书和权利要求中使用的提及各种结构或方法步骤的顺序指示,如第一、第二和第三并不应被解释为指示任何特定结构或步骤或者此类结构或步骤的任何具体顺序或配置。可以以任何合适的顺序实施本文所述的所有方法,除非本文另外指明或者以其它方式与上下文明显矛盾。本文提供的任何及所有实例或者示例性语言(例如“如”)的用途仅意图利于公开,且不对公开的范围施加任何限制,除非另外要求。说明书中的语言和附图中显示的结构均不应被解释为表示任何未要求保护的元素对公开的主题的实施是必要的。本文使用的术语“包含”、“包括”或“具有”及其变体意为包括其后所列的元素和其等同物以及其它元素。描述为“包含”、“包括”或“具有”特定元素的实施方案也考虑“基本由那些特定元素组成”和“由那些特定元素组成”。本文述及的数值范围仅意图作为单独提及落入所述范围内的每个独立的值的速记法,除非本文另外指明,并且将每个独立的值并入说明书,如同在本文中单独对其进行叙述。例如,如果浓度范围被描述为1%至50%,则其意图在该说明书中明确列举了如2%至40%、10%至30%或1%至3%等的值。这些仅是具体意图的实例,并且认为在本公开中明确陈述了列举的最低值和最高值之间的数值(包括所述最低值和最高值)的所有可能的组合。用于描述具体述及的量或量的范围的词“约”意为表明临近所述量的数值包含于所述量中,如由于制造公差、形成测量值中的仪器和人为误差等可以或自然会被考虑的值。涉及量的所有百分数均以重量计,除非另外指明。不承认说明书中引用的任何参考文献包括任何非专利文件或专利文件构成现有技术。具体而言,应理解,除非另外说明,否则本文提及的任何文件不构成承认这些文件中的任何文件组成在美国或者任何其它国家本领域公知常识的一部分。参考文献的任何讨论陈述了作者主张什么,申请人保留质疑本文引用的任何文献的准确性和针对性的权利。将本文引用的所有参考文献通过引用完全并入,除非另外明确指明。如果引用的参考文献中发现的任何定义和/或描述之间存在分歧,本公开内容应当控制。不承认提及的任何参考文献是关于本发明的现有技术。下述实施例仅是说明性的,并且不意图限制本发明实施方案的范围或者所附的权利要求的范围。实施例实施例1:参与者选择在机构审查委员会(institutionalreviewboard)的批准下,研究参与者招募自在ar、ok、tn和wa乳房健康和手术中心(breasthealthandsurgerycenters)就诊的患者。所有患者都同意,并在采集样本或完成患者信息表之前提供了一份知情同意书。样本由临床人员(即护士和技师)和/或ascendantdx工作人员采集。用于患者选择的纳入/排除标准如下:纳入标准:年龄在18-100岁的个体,进行常规检查,或进行异常检查或检验的评估,或进行可触及的肿块的评估,或活组织检查之前或之后呈现肿块,只要所述肿块的一部分仍存在,或近期已被诊断为患有乳腺癌,但还未经受任何类型的治疗。排除标准:在18岁以下或超过100岁的个体,经历并发的眼部感染或创伤,或当前正经历急性结膜炎,或已被诊断为患有乳腺癌,并已经接受治疗。对照样本收集自就诊进行常规的筛查性乳房x线摄影检查且未接到进行其它程序的回电的患者。在活组织检查时收集良性样本,并且一旦确定病理学结果就将其纳入良性组。还在活组织检查时,采集来自手术前具有mri结果的患者以及手术前接受前哨淋巴结程序的患者的癌症样本,并且在得知病理学结果之后将其纳入癌症组。收集自参与者的数据包括下述:年龄、性别、种族、当前正采取避孕或进行激素替代疗法、眼科感染、当前或最近的化学疗法治疗、癌症家族史、遗传检测(brac1/2)(如果可以)、癌症阶段(i、ii、iii、iv)、癌症类型(导管原位癌、浸润性导管癌、浸润性小叶癌、小叶原位癌以及未知的癌症)、激素受体状态(er+/-、pr+/-、her2+/-)、肿块尺寸、肿瘤分级(i、ii、iii)、乳腺密度评分(密度鉴定为类别1、2、3或4)以及癌症既往史。实施例2:schirmer试纸条样本采集程序获得机构审查委员会的批准,利用schirmer试纸条(guldenopthalmicselkinspark,pa)采集眼泪。为了采集,将schirmer试纸条的圆顶端(roundedtip)在0mm线处折叠,形成唇形(lip)。将折叠的部分置于参与者的下眼睑且要求参与者闭眼,使折叠部分保持位于闭合位置5分钟。5分钟之后,将试纸条移出并置于无菌的1.5ml预先标记的顶部扣合的管(snaptoptube)中,放置于-20℃或-80℃,这取决于可用性。采集标准规定,如果在5分钟时间之前达到35mm的标记,则可将试纸条移出。在参与的诊所采集的样本由ascendantdx工作人员以周为单位取回,并在干冰上转移至ascendantdx的实验室设施。实施例3:schirmer试纸条样本处理通过首先利用无菌的镊子和剪刀将试纸条切割至干净无菌的1.5ml顶部扣合的管中来进行蛋白洗脱。向切割的试纸条中添加200μl1x磷酸盐缓冲盐水(pbs),并在4℃孵育样本,轻微摇动3小时。洗脱之后,将样本在台式离心机中短暂旋转以收集位于管底部的试纸条碎片,并将上清液转移至新的干净的1.5ml顶部扣合的管中。利用标准的二喹啉甲酸(bca)分析测定总蛋白含量,并将样本于-80℃保存直至进一步使用。利用bca分析试剂盒(pierce)来测定每个池(pool)的总蛋白含量,其中标准品和未知样本与工作试剂的比例为1∶20(v/v),并在37℃孵育30分钟。为了确保可靠的总蛋白含量计算,对每一样本进行一系列稀释,例如1∶2、1∶4、1∶6,并且所有稀释均一式三份。利用稀释的白蛋白(2mg/ml、1.5mg/ml、1m/ml、0.75mg/ml、0.5mg/ml、0.25mg/ml、0.125mg/ml、0.025mg/ml以及0mg/ml)产生标准曲线,并将减去空白应用于所有标准品和未知样本。利用标准曲线的四参数拟合来计算每一未知样本的蛋白浓度。将浓度乘以稀释系数,并进行平均以给出精确的总蛋白含量计算。如果变异系数(%cv)为15%或15%以下,则认为分析有效。实施例4:通过lcms/ms进行无标记定量的方法和结果实验1:通过位于阿肯色大学医学院的蛋白质组学中心(uams)对25例乳腺癌样本、25例良性样本和25例对照样本在溶液中进行胰蛋白酶消化,随后进行lcms/ms。通过加入100ng猪胰蛋白酶(promega)并在37℃孵育12-16小时而将所有75例样本在100mm碳酸氢铵(sigma-aldrich)中进行溶液消化,随后在10mm三(2-羧乙基)膦(pierce)中还原,并在50mm碘乙酰胺(sigma-aldrich)中烃化。然后将肽产物在0.1%蚁酸(fluka)中酸化。利用nanoacquityuplc系统(waters),通过100×0.075mm柱上的反相jupiterproteo树脂(phenomenex)来分离胰蛋白酶水解肽。利用80分钟的从97∶3至35∶65的缓冲液a∶b比例梯度洗脱肽。[缓冲液a=0.1%蚁酸、0.05%乙腈;缓冲液b=0.1%蚁酸、75%乙腈]。通过电喷射(1.8kv)将洗脱的肽电离,随后利用ltqorbitrapvelos质谱仪(thermo)的碰撞诱导解离进行ms/ms分析。利用ftms分析仪在375至1500m/z的范围内,于60,000的分辨率下,以轮廓图模式获得ms数据。利用离子阱分析仪,以棒状图(centroid)模式和正常的质量范围以及35.0的标准化碰撞能量获得来自每一ms扫描的前15个峰的ms/ms数据。通过数据库搜索mascot搜索引擎(matrixscience)或maxquant定量蛋白质组学软件(maxplanckinstitute),从ms/ms谱鉴定蛋白。利用scaffold(蛋白质组学软件)编辑mascot搜索结果。设定下述标准以选择能够指示改变的乳腺生理学的一组蛋白:1)蛋白具有1.5或更大的倍数改变(以相对于癌症的积极的方向或消极的方向);2)倍数变化应当伴有<0.05的p值;3)蛋白存在于25例癌症样本中的12例中。利用这些标准,将超过500种蛋白的列表简化至下述蛋白:α-1-抗胰蛋白酶(a1at)、抗白细胞蛋白酶(slp1)、丝切蛋白(cof1)、抗凝血酶-iii(ant3)、β-2-微球蛋白(b2mg)、蛋白-谷氨酰胺-γ-谷氨酰转移酶(b4dit7)、未被表征的蛋白(b8zzq6)、类钙调蛋白5(call5)、半胱氨酸蛋白酶抑制剂-b(cytb)、中性粒细胞防御1(neutrophildefensing-1)(def1)、解聚蛋白(destrin)(dest)、kaliocin-1(e7er44)、rabgdp解离抑制剂β簇(e7eu23)、延长因子1-α(ef1a1)、埃兹蛋白(ezri)、血红素结合蛋白2(heb2)、热休克同源物71(hsp7c)、热休克蛋白β1(hspb1)、ig重链v-iii(hv303)、ig重链v-iii区bro簇(hv305)、脂质运载蛋白-1(lcn1)、半乳凝素-3(leg3)、igλ链v-iv(lv403)、igμ链c区域同种型2(p01871)、热休克蛋白同种型2簇(p07900-2)、14-3-3蛋白ζδ簇(p63104)、脂周蛋白(perilipin)-3同种型3(plin3)、蛋白酶体激活剂复合物亚基1(q06323)、ump-cmp激酶(q5t0d2)、蛋白s100-a4(s10a4)、s100-a8(s10a8)、蛋白s100-a9(s10a9)、蛋白s100-a11(s10ab)、颔下腺雄激素调节蛋白(smr3b)、锌-α-2-糖蛋白(za2g)、酶原粒蛋白16同系物b(zg16b)。实验2:利用各组(乳腺癌、良性、对照)中的50个样本,重复在溶液中的胰蛋白酶消化,然后进行lcms/ms。将与实验1中所述的相同的方法用于实验2。样本量的增加导致在实验1中观察到的一些趋势消失,同时使实验1中浮现的趋势在实验2中更显著。根据该数据,实验1中所述的500种蛋白的列表被进一步精减至103个感兴趣的蛋白。该名单包括:组氨酸三聚体核苷结合蛋白1(d6rd60)、s100a9(s10a9)、s100a8(s10a8)、半乳凝素-3结合蛋白(lg3bp)、igα-1链c区簇(igha1)、igκ链v-iii区hah簇(kv312)、vegf共调节趋化因子1(vcc1)、l-乳酸脱氢酶a链(ldha)、醛-酮还原酶家族1成员c(akr1c1)、小根蛋白(b1akd8)、l-乳酸脱氢酶b链(ldhb)、视黄醛脱氢酶1(al1a1)、未被表征的蛋白(b4e1z4)、α-1-抗胰凝乳蛋白酶(aact)、超氧化物歧化酶[cu-zn](sodc)、sparc样蛋白1(sprl1)、ig重链v-iii区til(hv304)、角蛋白(k1c9)、半胱氨酸蛋白酶抑制剂-sn(cytn)、α-辅肌动蛋白-4(actn4)、igλ-3链c区(片段)(iglc3)、免疫球蛋白λ样多肽5(igll5)、醇脱氢酶1c(adhig)、线粒体苹果酸脱氢酶(mdhm)、类钙调蛋白5(call5)、α-1-抗胰蛋白酶(a1at)、α-1b-糖蛋白(a1bg)、富亮氨酸α-2-糖蛋白(a2gl)、小泛素相关修饰物3(a8mu27)、前梯度蛋白2同系物(agr2)、抑制蛋白-1(prof1)、igλ链v-iii区loi簇(lv302)、凝血酶原(e9pit3)、血液结合素(hemo)、igγ-2链c区(ighg2)、泛素-40s核糖体蛋白s27a(rps27a)、afamin(afam)、载脂蛋白a-i(apoa1)、载脂蛋白a-iv(apoa4)、黄素还原酶(nadph)(blvrb)、鞘脂激活蛋白原(psap)、催泪蛋白(lacrt)、60s酸性核糖体蛋白p1(rla1)、间-α-胰蛋白酶抑制剂重链h2(itih2)、粘蛋白样蛋白1(mucl1)、s100a6(s100a6)、na(+)/h(+)交换调节辅因子nhe-rf1(nhrf1)、含硫氧还蛋白结构域蛋白17(i3l0k2)、淋巴细胞特异性蛋白(lsp1)、结合珠蛋白簇(h3bs21)、肌球蛋白调节轻链12a(j2qrs3)、核糖核酸酶抑制因子(rini)、α-烯醇化酶(enoa)、igκ链v-i区eu簇(kv106)、醇脱氢酶4类μ/σ链(adh7)、蛋白ambp(ambp)、血管紧张素原(angt)、抗凝血酶-iii(ant3)、载脂蛋白a-ii(apoa2)、钙蛋白酶抑制蛋白(b7z574)、脑酸溶性蛋白1(basp1)、α-2-hs-糖蛋白(c9jv77)、钙网蛋白(calr)、钙蛋白酶-1催化亚基(can1)、细胞分裂调控蛋白42同系物(cdc42)、补体c3(co3)、冠蛋白-1a(cor1a)、程序性细胞死亡6相互作用蛋白(dcd)、防御素1(def1)、f盒特有蛋白50(fbx50)、γ-谷氨酰环化转移酶(ggct)、线粒体谷胱甘肽还原酶(gshr)、ii型角蛋白细胞支架1(k2c1)、ump-cmp激酶(kcy)、间皮素(msln)、n-乙酰胞壁酰-l-丙氨酸酰胺酶(pgrp2)、烟酰胺磷酸核糖基转移酶(pncb)、间-α-胰蛋白酶抑制剂重链h1(itih1)、核糖核酸酶t2(rnaset2)、线粒体超氧化物歧化酶[mn](sodm)、富含脯氨酸小蛋白3(sprr3)、src底物皮层肌动蛋白(src8)、微管蛋白β-4b链簇(tbb4b)、原肌球蛋白α-3链(tpm3)、血清铁传递蛋白(trfe)、谷胱甘肽s转移酶p(thio)、玻连蛋白(vtnc)、维生素d结合蛋白(q6ldc6)、间-α-胰蛋白酶抑制剂重链h4(itih4)、金属蛋白酶抑制剂(timp1)、热休克蛋白90(hsp90)、组织蛋白酶b(catb)、血浆铜蓝蛋白(ceru)、钙卫蛋白、14-3-3σ(1433s)、α-2-hs-糖蛋白(fetua)、α-2-巨球蛋白(a2mg)、转甲状腺素蛋白(tthy)(附件1)。从scaffold软件输出鉴定的蛋白的完整的列表,以利用jmppro11统计软件包进行分析。实施例5:利用jmppro11软件进行统计分析实验1:通过利用microsoft电子表格软件,按所有75例样本中每一先前鉴定的蛋白的光谱强度组织数据。电子表格中还包括样本状态(癌症、良性、对照)、癌症类型、肿瘤大小分组(1=0.1mm-1cm、2=1.1-2.9cm、3=3cm或更大)以及肿瘤分级状态。将该电子表格上传至jmppro11软件包用于分析。在癌症与对照样本之间应用二元线性回归。根据蛋白的s形曲线和p值,六种蛋白被鉴定为是显著的,它们是igλ链v-iv(lv403)、ig重链v-iii区bro(hv305)、ig重链v-iiivh26(hv303)、脂质运载蛋白-1(lcn1)、β-2-微球蛋白(b2mg)、锌-α-2-糖蛋白(za2g)。对于癌症,所有六种蛋白看起来都是下调的。为了确定这些蛋白的下调是否是乳腺癌特异的,在良性和对照之间重复二元线性回归。该比较表明这六种先前鉴定的蛋白在良性样本中也是下调的,并且另外四种蛋白被鉴定为在良性与对照之间是显著的:抗白细胞蛋白酶(slp1)、类钙调蛋白5(call5)、半胱氨酸蛋白酶抑制剂b(cytb)和半乳凝素-3(leg3)。利用所有三组和全部十种蛋白进行名义变数逻辑回归分析,以确定所有组之间的差异程度。十种蛋白的组的误分类程度为12%。每一类别的接受者操作曲线产生的auc值为:对于癌症,0.96;对于良性,0.94;以及对于对照,0.98(图1)。进行单向anova分析,以确保三类样本每一蛋白的移位均值(shiftingmeanvalue)(图3)。实验2:利用记录的根据质谱分析法鉴定的所有蛋白的光谱强度进行单向anova分析。分析所有蛋白的胰蛋白酶水解肽产物。以三种方式对蛋白进行比较:1)对照相对于癌症,2)癌症相对于良性,3)良性相对于对照。将0.05的α水平用作组间显著表达改变的指示因子。比较胰蛋白酶水解片段的光谱强度的变化。鉴定了相对于对照,在乳腺癌样本中表达水平增加的一系列蛋白。还鉴定了相对于对照,在乳腺癌样本中表达减少的蛋白。为了确保实验的有效性,已确定存在其表达在所有测试组中保持不变的蛋白(图4)。500种蛋白的初始列表减少至103种感兴趣的蛋白。在该蛋白组中,是对于乳腺癌具有增加的表达的蛋白,以及对于乳腺癌具有减少的表达的蛋白(图4)。对全蛋白序列、胰蛋白酶水解肽和序列异常的诊断能力(其能够作为疾病的结果)都感兴趣。实施例6:elisa分析通过质谱分析法观察到了相对于对照样本,在癌症样本中表达水平增加的一系列蛋白,并选择了一些候选物用于利用elisa进行进一步确认。将s100a9选作相对于对照,在乳腺癌患者的眼泪中表达增加的代表性的实例。lg3bp显示为相对于对照样本,在乳腺癌样本中表达水平降低的蛋白的代表。使用标准elisa方案来评估眼泪中的表达水平。利用从r&d系统公司(minneapolis,mn)购买的作为duosets的试剂盒获得s100a9和lg3bp的数据。根据r&d系统公司提供的说明书实施elisa程序。简言之,向高度结合的96孔板中添加每孔100μl在1×pbs中稀释至推荐的工作浓度(gal3bp1.0ug/ml;s100a90.5ug/ml)的捕获抗体,并在室温孵育过夜(~16小时)。将板用含0.05%吐温的1×pbs漂洗四次,并用干净的吸水纸吸干以移除每次洗涤之后的任何液体痕迹。在测定的每一步骤之后均进行漂洗周期。向所有孔中添加封闭缓冲液(含1%bsa的1×pbs)(~200μl/孔),并将板在室温孵育2小时。对于s100a9,以1∶10和1∶50的稀释度,以及对于半乳凝素3结合蛋白,以1∶100&1∶500的稀释度,用含1%bsa的1×pbs稀释眼泪样本。基于来自之前优化分析的结果选择落入各测定的标准曲线的线性区内的稀释度。使用100μl/孔对样本和标准品一式两份进行测试,并在室温孵育2小时。将检测抗体稀释至推荐的工作浓度(gal3bp2ug/ml以及s100a91ug/ml),向各孔中添加100μl,并允许板在室温孵育2小时。向各孔中添加链霉亲和素-hrp溶液(100μl/孔),并允许在室温孵育15分钟。通过添加tmb底物溶液实现可视化。15分钟之后,向各孔中添加50μl1mh2so4,并测定450nm处的吸光度。利用可获自graphpad的6.0版prism分析elisa数据。elisa数据的统计分析:将如由prism软件所计算的各蛋白的浓度输出至jmppro11用于统计评估。选择多个候选物,以利用elisa分析对对照、癌症或良性样本进行研究。显示了两种蛋白(s100a9和半乳凝素-3结合蛋白)的结果(分别为图5和图6),以提供相对于对照,在乳腺癌眼泪样本中蛋白表达增加或减少的代表性实例。当对所有三组进行评估时,63例乳腺癌样本、79例对照样本以及92例良性样本的s100a9的anova产生0.0005的p值。s100a9的组平均值为:乳腺癌=5673.02pg/ml;对照=2130.18pg/ml;良性=6179.10pg/ml。与对照样本相比,癌症样本中s100a9的表达增加了2.6倍,以及与对照样本相比,良性样本中s100a9的表达增加了2.9倍。当对所有三组进行评估时,66例乳腺癌样本、55例对照样本以及54例良性样本的半乳凝素-3结合蛋白的anova产生<0.0001的p值。lg3bp的组平均值为:乳腺癌=24448.1pg/ml;对照=70242.2pg/ml;良性=62329.7pg/ml。与癌症样本相比,在对照样本中lg3bp有2.8倍的增加,以及与癌症相比,在良性样本中lg3bp有2.5倍的增加。利用两种代表性蛋白进行乳腺癌和对照样本的名义变数逻辑回归分析。对于s100a9,产生的roc曲线具有0.78220的auc(图7),以及对于lg3bp,具有0.76088的auc(图8)。利用两种蛋白重复分析,获得了0.84250的auc(图9)。样本群体特征:获得关于尽可能多的样本的临床数据,如乳腺密度、癌症类型和肿瘤大小。实验1:在测试的75例样本中,获得样本中的41例的乳腺密度评分。通过乳腺密度对样本群体进行分类为:类别1,14%;类别2,36.6%;类别3,43.9%;类别4,4.7(图2)。25例癌症样本中的18例采集自被诊断为患有导管内癌(idc)的患者。两例患者被诊断为患有导管原位癌(dcis),一例患者被诊断为患有小叶原位癌(lcis),以及一名患者被诊断为患有小叶内癌(intralobularcarcinoma,ilc)。为了分类,设定数值范围,其中为“小”的分类给予<20mm的肿瘤,为“中等”的分类被分配至21mm-99mm的肿瘤,以及为“大”的分类被分配至>1cm的肿瘤。采集自乳腺癌患者的样本中,17例被分类为大肿瘤,2例样本被分类为中等肿瘤,以及六例被分类为小肿瘤。获得了癌症样本中8例的受体类型的病理学信息。1例样本为er-/her2-,1例样本为er-/pr-,两例样本为er+/her2-,三例样本为er+/her2+,以及1例样本为er+/pr-。实验2:本研究中分析的样本池由5.9%的类别1乳腺组织、50%的类别2乳腺组织、37.8%的类别3乳腺组织和5.4%的类别4乳腺组织组成。对通过elisa评估的一些蛋白进行anova分析,以确定乳腺组织的类型是否影响蛋白表达水平。提供了研究的两种蛋白的代表性数据(图10和图11)。利用0.05的α水平,没有观察到在图10和11中所示的elisa中评估的各蛋白在四种类型的乳腺组织的平均值有统计学上显著的差异。样本采集自多种乳腺癌类型,得到了17例来自被诊断为患有dcis的患者的样本,44例来自被诊断为患有idc的患者的样本,4例来自患有dcis&idc的患者的样本,以及5例来自患有ilc患者的样本。肿瘤大小变化极大。利用实验1中所述的分类系统,对于提供了肿瘤大小的样本,测试了来自具有大肿瘤的患者的33例样本,来自具有中等肿瘤大小的患者的9例样本和来自具有小肿瘤的患者的12例样本。在提供了受体类型的38例样本中,1例样本为er-,2例样本为er-/her2-,2例样本为三阴性(er-/her2-/pr-),1例样本为er-/her2+,11例样本为er+,er+/her216,以及5例样本为er+/her2+。迄今为止,对于已研究的蛋白,还未观察到基于肿瘤大小、癌症类型或受体状态的区别性趋势。表1参考文献armstrong,k.,handorf,e.a.,chen,j.,&bristoldemeter,m.n.(2013).breastcancerriskpredictionandmammographybiopsydecisions:amodel-basedstudy.americanjournalofpreventivemedicine,44(1),15-22.doi:10.1016/j.amepre.2012.10.002bigenwald,r.z.,warner,e.,gunasekara,a.,hill,k.a.,causer,p.a.,messner,s.j.,eisen,a.,plewes,d.b.,narod,s.a.,zhang,l.,yaffe,m.j.(2008)ismammographyadequateforscreeningwomenwithinheritedbrcamutationsandlowbreastdensity?.cancerepidemiologybiomarkersprevention.17(3);707-711.d.,keller,k.,pieter,j.,boehm,n.,wolters,d.,siggelkow,w.,etal.(2012).comparisonoftearproteinlevelsinbreastcancerpatientsandhealthycontrolsusingadenovoproteomicapproach.oncologyreports,28(2),429-438.doi:10.3892/or.2012.1849d.,keller,k.,wehrwein,n.,lebrecht,a.,schmidt,m.,h.,&grus,f.-h.(2011).serumproteomeprofilingofprimarybreastcancerindicatesaspecificbiomarkerprofile.oncologyreports,26(5),1051-1056.doi:10.3892/or.2011.1420boyd,n.f,guo,h.,martin,l.j.,sun,l.,stone,j.,fishell,e.,jong,r.a.,hislop,g.,chiarelli,a.,minkin,s.,yaffee,m.j.,(2007)mammographicdensityandtheriskanddetectionofbreastcancer.thenewenglandjournalofmedicine.356(3):227-236).brown,m.l.,houn,f.,sickles,e.a.,&kessler,l.g.(1995).screeningmammographyincommunitypractice:positivepredictive.americanjournalofradiology,165,1373-1377.clialawsandregulations,2013,http://wwwn.cdc.gov/clia/regulatory/default.aspx.grady,d.(2012).studyofbreastbiopsiesfindssurgeryusedtooextensively.newyorktimes,1-4.klifa,c.,carballido-gamio,j.,wilmes,l.,laprie,a.,shepherd,j.,gibbs,j.,fan,b.,noworolski,s.,hylton,n.(2010)magneticresonanceimagingforsecondaryassessmentofbreastdensityinahigh-riskcohort.magneticresonanceimaging.28;8-15.kolb,t.,lichy,j.,&newhouse,j.(2002).comparisonoftheperformanceofscreeningmammography,physicalexamination,andbreastusandevaluationoffactorsthatinfluencethem:ananalysisof27,825patientevaluations.radiology,225(1),165-175.lebrecht,a.,boehm,d.,schmidt,m.,koelbl,h.,&grus,f.h.(2009a).surface-enhancedlaserdesorption/ionisationtime-of-flightmassspectrometrytodetectbreastcancermarkersintearsandserum.cancergenomics&proteomics,6(2),75-83.lebrecht,a.,boehm,d.,schmidt,m.,koelbl,h.,schwirz,r.l.,&grus,f.h.(2009b).diagnosisofbreastcancerbytearproteomicpattern.cancergenomics&proteomics,6(3),177-182.li,j.,zhang,z.,rosenzweig,j.,wang,y.,&chan,d.(2002).proteomicsandbioinformaticsapproachesforidentificationofserumbiomarkerstodetectbreastcancer.clinchem,48(8),1296-1304.luftner,d.,&possinger,k.(2002).nuclearmatrixproteinsasbiomarkersforbreastcancer.expertrevmoldiagn,2(1),23-31.doi:erm020106[pii]10.1586/14737159.2.1.23pisano,e.d.,gatsonis,c.,hendricke.,yaffe,m.,baum,j.k.,acharyya,s.,conant,e.f.fajardo,l.l.,bassett,l.,d′orsi,c.jong,r.,rebner.,m.(2005).diagnosticperformanceofdigitalversusfilmmammographyforbreast-cancerscreening.thenewenglandjournalofmedicine.17(353).1773-1783.scheel,j.r.,lee,j.m.,sprague,b.l.,lee,c.i.,lehman,c.d.(2015)screeningultrasoundasanadjuncttomammographyinwomenwithmammographicallydensebreasts.gynecology.212(1);9-17.schiess,r.,wollscheid,b.,&aebersold,r.(2009).targetedproteomicstrategyforclinicalbiomarkerdiscovery.molecularoncology,3(1),33-44.doi:10.1016/j.molone.2008.12.001tabar,l.,vitak,b.,chen,t.h.,yen,a.m.,cohen,a.,tot,t.,chiu,s.,chen,s.fann,j.rosell,j.,fohlin,h.,smith,r.a.,duffy,s.w.,(2011)swedishtwo-countytrial:impactofmammographicscreeningonbreastcancermortalityduring3decades.radiology,3(260),658-663.vachon,c.m.,vangils,c.h.,sellers,t.a.,ghosh,k.,pruthi,s.,brandt,k.r.,pankratz,v.s.,(2007)mammographicdensity,breastcancerriskandriskprediction.breastcancerresearch9:2017(doi:10.1186/bcr1829).wu,k.,&zhang,y.(2007).clinicalapplicationoftearproteomics:presentandfutureprospects.proteomics.clinicalapplications,1(9),972-982.doi:10.1002/prca.200700125附件i通过实验1选择的蛋白:蛋白名称uniprotipi基因名称knger3iek4vehsdlsfskdwsfyllyyteftptek6deyacr5vnhvtlsqpkivkwdrdmgkglewvsaisgsggstyygdsvkgrftisrdnskntlylqmnslr2aedtavyycak选自实验2的蛋白:当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1