纤维蛋白修饰开管柱及在单克隆抗体异构体分离中的应用的制作方法
本发明属于仪器分析领域,具体涉及一种纤维蛋白修饰的开管柱及其在单克隆抗体异构体分离中的应用。
背景技术:
单克隆抗体是一种在生物医药领域应用前景广阔的蛋白类药物,由于其良好的药效、高选择性、副作用低等优点,被广泛应用于癌症的治疗。
在生产、提取、形成和储存过程中,单克隆抗体会经过一系列转译后修饰过程,包括糖基化、聚合、碎片化、脱酰氨基化等作用。尽管这些变化很小,但是会使单克隆抗体表现出多种类型的不均一性,进而产生不同类型的变体,它们在分子量、疏水性、电荷等理化性质上存在差异。而这些差异会直接影响单克隆抗体产品的质量、安全和药效。因此,准确的分析单克隆抗体的变体是非常重要和必不可少的工作。
到目前为止,已发展了一些对单克隆抗体的不均一性进行分析的方法,比如毛细管等点聚集、毛细管区带电泳、离子交换色谱、尺寸排阻色谱和疏水色谱等等。在这些方法中,毛细管电泳是作为一种受欢迎的分析方法去表征单克隆抗体的异质性。在毛细管电泳的多种分离模式中,毛细管电色谱是一种高效的复合分离技术,其分离机理主要依据电泳迁移和色谱保留,因此它既具有高效液相色谱的高选择性又具有毛细管电泳的高效性,在复杂生物样品的分离领域极具潜力。色谱柱是毛细管电色谱的分离核心,在不同类型的电色谱柱中,开管柱因其制备简单、操作方便、没有气泡产生等优点,受到人们越来越多的青睐。
目前开管柱的制备方法主要包括化学键合法、溶胶凝胶法、分子印迹法、多孔层法、物理吸附法和纳米涂层法。在这些方法中,物理吸附的方法由于其简单、快捷和低成本的优点,已经被广泛地应用于开管柱的制备中。
技术实现要素:
为了克服上述现有技术的缺陷,更好地分离单克隆抗体中以小峰形式出现的异构体,本发明的首要目的在于提供一种纤维蛋白修饰的开管柱的制备方法,该方法通过物理吸附的方式将纤维蛋白涂覆到开管柱上得到纤维蛋白固定相修饰的开管柱,该制备方法简单,条件温和,重现性好。
本发明的另一目的在于提供由上述方法制得的开管柱,该开管柱表面含有丰富的作用位点,可以有效地抑制生物样品的吸附,改善分离效果,提高分离选择性。
本发明的再一目的在于提供上述纤维蛋白修饰的开管柱在单克隆抗体异构体分离中的应用。
本发明的目的通过下述技术方案实现:
一种纤维蛋白修饰的开管柱的制备方法,是将纤维蛋白通过物理吸附在毛细管柱内表面,得到纤维蛋白修饰的开管柱;
具体地,上述方法包括以下步骤:
将纤维蛋白原溶液和凝血酶溶液溶解在含有氯化钠的磷酸盐缓冲液中配成蛋白水溶液,注入开管柱中,恒温反应4~8h,氮气加热固化12h,再用磷酸盐缓冲液和去离子水冲洗,氮气烘干,得到纤维蛋白修饰的开管柱;
上述步骤中,最后得到的纤维蛋白固定相是由纤维蛋白原在凝血酶的作用下裂解成纤维蛋白单体继而聚合而成的,通过调节纤维蛋白原与凝血酶的相对浓度可控制蛋白固定相的厚度;
所述的纤维蛋白原溶液中,纤维蛋白原的浓度优选0.5~4mg/mL;
所述的凝血酶溶液中,凝血酶的浓度优选0.02~0.8μΜ;
所述的磷酸盐缓冲液,其pH值优选7.4;
所述的恒温反应和加热固化,温度优选30~50℃;
所述的开管柱要经过预处理,预处理方法是:依次用氢氧化钠溶液、去离子水、盐酸溶液、去离子水冲洗开管柱,并烘干;
所述的开管柱,其材质优选玻璃或石英。
由上述方法制得的纤维蛋白修饰的开管柱可应用于单克隆抗体异构体的分离,该开管柱表面含有丰富的作用位点,可以有效地抑制蛋白的吸附,改善分离效果,提高分离选择性;
所述的单克隆抗体优选西妥昔单抗、利妥昔单抗和曲妥珠单抗。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明的开管柱以蛋白作为色谱固定相,其表面丰富的作用位点,有效抑制蛋白的吸附,改善分离效果,提高分离选择性。
(2)本发明的开管柱制备条件温和、操作简便,重现性和稳定性较好。
(3)本发明的开管柱对单克隆抗体的异构体表现了特殊的选择性。西妥昔单抗的六种不同形式的异构体获得成功分离,利妥昔单抗的五种异构体以及曲妥珠单抗的五种异构体被成功地从主峰中分离。
附图说明
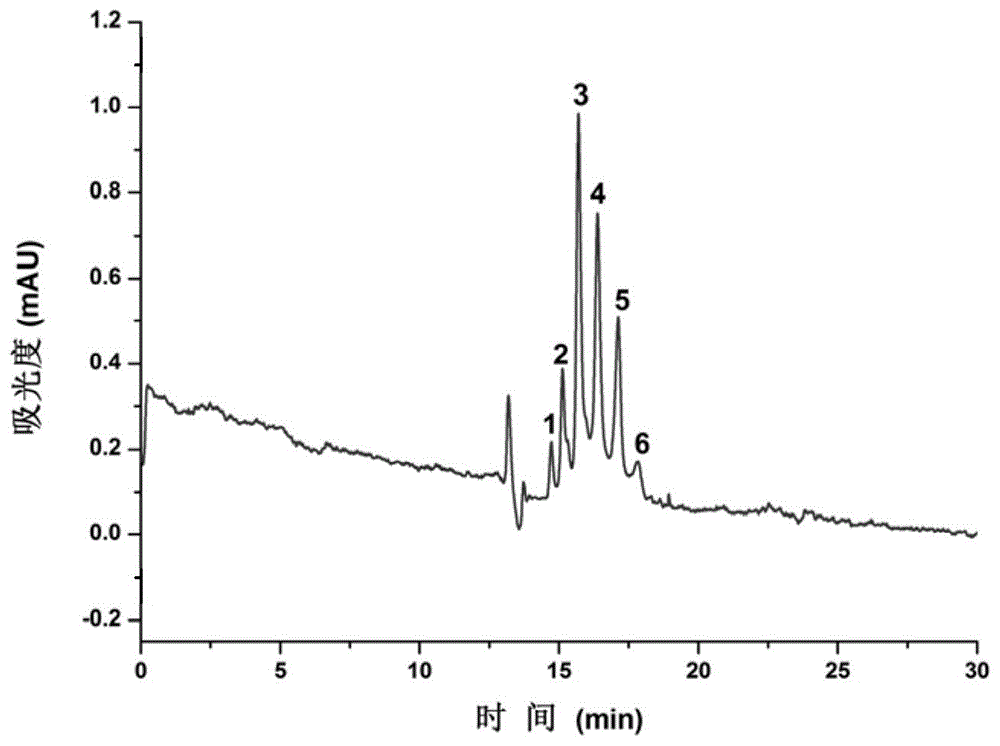
图1是西妥昔单抗异构体分离的毛细管电色谱谱图;其中,1~6为西妥昔单抗的不同异构体。
图2是利妥昔单抗异构体分离的毛细管电色谱谱图;其中,1~5为利妥昔单抗从主峰中分离出来的不同异构体。
图3是曲妥珠单抗异构体分离的毛细管电色谱谱图;其中,1~5为曲妥珠单抗从主峰中分离出来的不同异构体。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例1
一种纤维蛋白修饰的开管柱,由以下步骤制得:
(1)依次用氢氧化钠溶液(1M)、去离子水、盐酸溶液(1M)和去离子水冲洗开管柱,并烘干;
(2)将纤维蛋白原溶液(2mg/mL,500μL)、凝血酶溶液(0.12μΜ,25μL)和磷酸盐缓冲液(10mM,pH值7.4,含有0.15M氯化钠475μL)混合均匀,并迅速注入到预处理过的开管柱中,在37℃的恒温箱中保存5h,然后用氮气将多余的反应液冲出并在其保护下在40℃的环境中烘干。最后用10mM磷酸盐(pH值7.4)和去离子水冲洗柱子,并在40℃氮气保护下烘干,得到纤维蛋白修饰的开管柱。
实施例2
实施例1制得的纤维蛋白修饰开管柱在分离6种西妥昔单抗异构体中的应用,包括以下步骤:
将离心、稀释后的西妥昔单抗溶于水中,通过电色谱的方法进行分离,结果见图1。分离条件为:色谱柱内径为50μm,总长为62.5cm,有效长度为37.0cm,流动相为50mM(pH值7.0)的磷酸缓冲液,分离电压为20kV,检测波长为214nm,进样方式为高度进样。
由图1可见,西妥昔单抗的六种不同形式的异构体在纤维蛋白修饰的开管柱上获得了很好的分离效果,峰型尖锐,说明该涂层柱能够有效地应用于西妥昔单抗异构体的识别和分离。
实施例3
实施例1制得的纤维蛋白修饰开管柱在分离5种利妥昔单抗异构体中的应用,包括以下步骤:
将离心、稀释后的利妥昔单抗溶于水中,通过电色谱的方法进行分离,结果见图2。分离条件为:色谱柱内径为50μm,总长为62.5cm,有效长度为37.0cm,流动相为50mM(pH值7.0)的磷酸缓冲液,分离电压为20kV,检测波长为214nm,进样方式为高度进样。
由图2可见,利妥昔单抗的五种不同形式的异构体成功地从主峰中分离出来,说明该涂层柱能够有效地应用于利妥昔单抗异构体的识别和分离。
实施例4
实施例1制得的纤维蛋白修饰开管柱在分离5种曲妥珠单抗异构体中的应用,包括以下步骤:
将离心、稀释后的曲妥珠单抗溶于水中,通过电色谱的方法进行分离,结果见图3。分离条件为:色谱柱内径为50μm,总长为62.5cm,有效长度为37.0cm,流动相为50mM(pH值7.0)的磷酸缓冲液,分离电压为20kV,检测波长为214nm,进样方式为高度进样。
由图3可见,曲妥珠单抗的五种不同形式的异构体成功地从主峰中分离出来,说明该涂层柱能够有效地应用于曲妥珠单抗异构体的识别和分离。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!