一种富集检测磷酸化蛋白的方法与流程
本发明涉及材料分析化学和有机化学领域,尤其涉及一种富集检测磷酸化蛋白的方法。
背景技术:
蛋白质的磷酸化是一种可逆的翻译后修饰,在细胞的增殖、分化、信号传导以及转录与翻译、蛋白质复合体形成、蛋白质降解等方面发挥着极为重要的作用。因此,磷酸化蛋白成为了蛋白质组学研究的热点问题。天然样品中的磷酸化蛋白难以直接用于目前常用的质谱法检测。为解决该问题,改善质谱对磷酸化蛋白的信号响应,必须对磷酸化蛋白进行分离富集,这成为了磷酸化蛋白组学研究中的重要内容。目前由于完整磷酸化蛋白分离困难,磷酸化蛋白组学研究主要基于“自下而上”的策略,即先将蛋白无差别酶解成多肽链段,在肽段水平上鉴定其中的磷酸化位点,然后进行搜库、推理和拼接得到完整的磷酸化蛋白信息,这种方法虽然简单易行,但是所得蛋白水平的磷酸化信息离实际生物样品中的真实信息存在很大差距。因此,在蛋白水平上直接进行分离一直以来是磷酸化蛋白质组学研究者们所努力尝试但仍未解决的难题。
技术实现要素:
本发明为解决上述技术问题提供了一种富集检测磷酸化蛋白的方法。该方法分离效率高,样品损失小,低成本。
本发明采用下的技术方案如下:
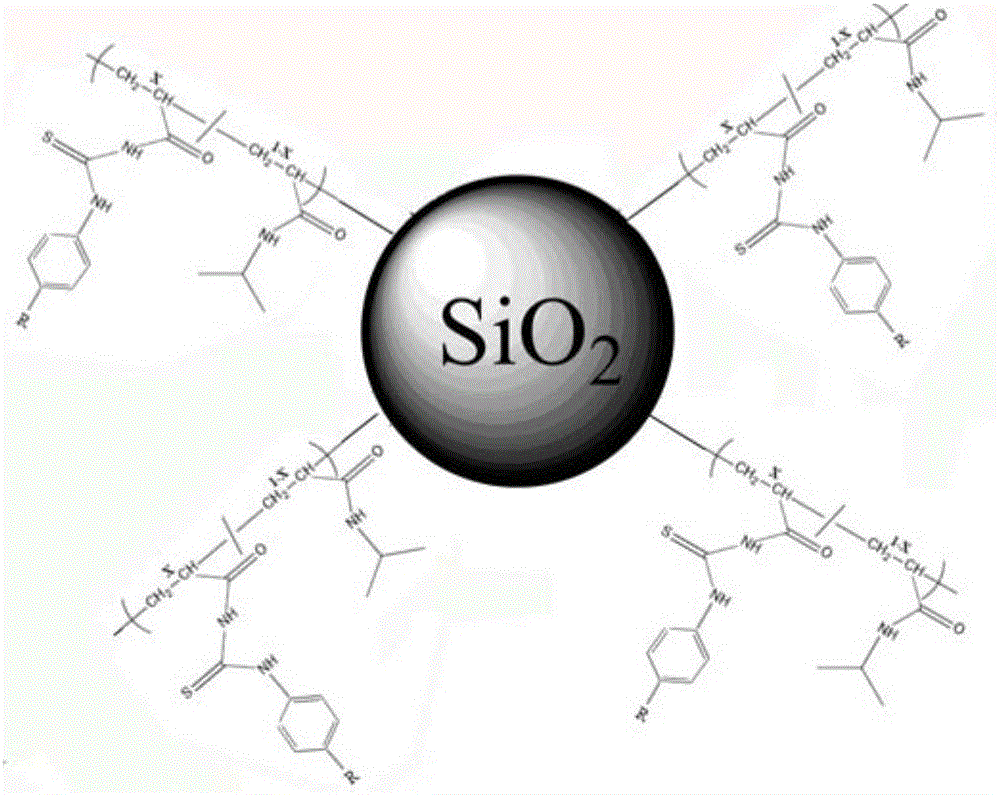
一种富集检测磷酸化蛋白的方法,该方法是将磷酸化蛋白和非磷酸化蛋白的混合后得到的蛋白混合物直接与富集材料混合,采用分散固相萃取模式来分离富集非磷酸化蛋白和磷酸化蛋白,并对样品进行色谱分析,所述富集材料包括基底及形成于基底表面的双组分共聚物层,所述双组分共聚物的分子结构如下:
其中R为羧基,硝基,甲基,甲酸乙酯基或氢;X=0.01-0.5;所述双组分共聚物层的厚度为50-100nm。
上述方案中,所述基底的材料为Si、Cu、Ag、Au、Pt、CuO、Fe3O4、多孔SiO2、多孔Al2O3、多孔TiO2或多孔ZrO2中的任意一种或者两种以上任意比例的混合。
上述方案中,所述富集材料是利用表面引发-原子转移自由基聚合反应机制,将双组分共聚物接枝到基底表面所得到,具体过程如下:
1)在烧瓶中依次加入异丙基丙烯酰胺和硫脲功能单体,同时加入超纯水及二甲基甲酰胺的混合溶液作溶剂,其中,异丙基丙烯酰胺和硫脲功能单体的摩尔比1-5:1,超纯水与二甲基甲酰胺的体积比为1:4-20;
2)在无氧条件下加入催化剂和配体,将基底浸入前述溶液中,保持氮气气氛,在恒温70-90℃条件下进行原子转移自由基聚合反应12-36小时;
3)反应结束后,洗涤基底表面并在60-80℃下真空干燥,得到所述富集材料。
上述方案中,样品的上样量为富集材料与蛋白混合物的质量比例为400:1-2000:1,孵育温度为20-40℃。
上述方案中,所述磷酸化蛋白为α-酪蛋白、β-酪蛋白或卵清蛋白,非磷酸化蛋白为牛血清蛋白。
上述方案中,所述分散固相萃取模式的具体步骤如下:
1)先采用活化液和平衡液活化及平衡富集材料,将该富集材料与蛋白混合物以质量比例为100:1-1000:1混合,孵化0.5分钟-60分钟;分散固相萃取分离,弃上层清液,收集沉淀,其中磷酸化蛋白与非磷酸化蛋白的质量比为1:1-1:50;
2)采用pH=0-7的有机溶液对沉淀清洗;
3)将清洗后的沉淀采用pH 3-7有机溶液洗涤,有机溶液与沉淀的体积比是5:1-100:1,分散固相萃取分离,收集上层清液;浓缩得到非磷酸化蛋白。
4)将清洗后的沉淀采用体积pH 0-3有机溶液洗涤,有机溶液与沉淀的体积比是5:1-100:1,分散固相萃取分离,收集上层清液,得磷酸化蛋白,上述过程的操作温度为20-40℃。
上述方案中,所述有机溶液、活化液和平衡液均为有机溶剂、有机酸和去离子水的混合液,有机溶剂为乙腈、甲醇或乙醇,有机酸为甲酸、乙酸或三氟乙酸,有机溶剂的体积浓度为10%-95%,有机酸的体积浓度为0.1%-5%。
上述方案中,所述活化液中有机溶剂体积浓度为10-30%,pH=5-7。
上述方案中,所述平衡液中有机溶剂体积浓度为30-70%,pH=0-5。
上述方案中,所述色谱分析的参数设置如下:
1)采用C4、C8或者C18反向色谱柱,填料直径1-20μm,孔径10-100nm,柱内径2-10mm,长度50-1000mm;
2)采用紫外或者二极管阵列检测器,检测波长范围为200-280nm;
3)采用流动相为甲醇/水或者乙腈/水的混合物再加0.1-0.5%三氟乙酸,其中有机相的比例为0%-70%,流速为0.05-2.0ml/min。
本发明的有益效果为:
1、本发明制备的富集材料在分离富集磷酸化蛋白时表现出了高选择性、高通量、低成本、分离效率高及样品损失小等特点,可以实现多磷酸化蛋白和非磷酸化蛋白的有效分离;
2、本发明制备的富集材料可以直接通过离心模式分离材料与样品底物,操作简单,易于重复。特别适合微量生物样品中磷酸化蛋白的分离富集;
3、本发明富集得到的磷酸化蛋白可通过配有普通紫外或者二极管阵列检测器的液相色谱检测,相比于天然生物样品直接用于质谱解析的方法,更加容易获得磷酸化蛋白的信号。
附图说明
图1为双组分聚合物分子结构示意图。
图2为双组分聚合物接枝的硅胶样品结构示意图。
图3为硫脲单体合成步骤示意图。
图4为双组分聚合物表面(以硫脲单体末端R为羧基为例)对α酪蛋白和牛血清蛋白的石英微天平(QCM-D)吸附曲线(载液为10%乙腈+90%去离子水)。图5为双组分聚合物表面(以硫脲单体末端R为羧基为例)对α酪蛋白和牛血清蛋白的石英微天平(QCM-D)吸附曲线(载液为30%乙腈+70%去离子水)。
图6为双组分聚合物表面原子力显微镜形貌图。
图7为双组分聚合物表面浸泡牛血清蛋白后的原子力显微镜形貌图。
图8为双组分聚合物表面浸泡α酪蛋白后的原子力显微镜形貌图。
图9为富集应用实例中使用固定相结构示意图。
图10为α-酪蛋白和牛血清蛋白标准蛋白纯样的色谱图。
图11为α-酪蛋白和牛血清蛋白1:1混合物经富集材料分离后不同馏分中α-酪蛋白和牛血清蛋白色谱图。
图12为α-酪蛋白和牛血清蛋白1:2混合物经富集材料分离后不同馏分中α-酪蛋白和牛血清蛋白色谱图。
图13为α-酪蛋白和牛血清蛋白1:5混合物经富集材料分离后不同馏分中α-酪蛋白和牛血清蛋白色谱图。
具体实施方式
为使本发明的内容、技术方案和优点更加清楚明白,以下结合具体实施例和附图进一步阐述本发明,这些实施例仅用于说明本发明,而本发明不仅限于以下实施例。
实施例中所用原料及设备:
HPLC柱色谱填料硅胶(氨基修饰)由上海月旭公司购得。溴化亚铜(CuBr,99.999%),联吡啶类配体,有机碱,异丙基丙烯酰胺,丙烯酰氯,对氨基苯甲酸乙酯以及各种测试用蛋白由Sigma-Aldrich公司购得。丙酮,甲醇,二甲基甲酰胺(DMF),甲酸由阿尔法公司购得。异丙基丙烯酰胺在使用前用正己烷重结晶三次,放置在真空干燥器中备用。其他试剂均使用市售分析纯。1H spectra在Bruker ARX300spectrometer检测获得。石英微天平(QCM)吸附数据由Q-Sense E4system检测获得。色谱分析结果由Waters 2695HPLC结合Waters 2998二极管阵列检测器检测获得。
实施例1
富集材料的制备
双组份共聚物结构如图1所示,其中X=0.01-0.5。以X=0.2为例,在25ml三口烧瓶中依次加入0.4mmol异丙基丙烯酰胺,0.1mmol的硫脲功能单体,物质摩尔比为4:1,同时加入6mL超纯水以及6mL DMF作溶剂;在搅拌下通入氮气,待单体充分溶解之后,在氮气保护下加入催化剂CuBr 0.032g以及联吡啶类配体0.16mL,随后反应体系抽真空-充氮气,除去反应体系中残余的氧气;将溴化处理过的基底浸入配置好的反应溶液;将烧瓶的温度控制在70-90℃静置反应12-36小时;反应结束后用N,N’-二甲基甲酰胺(DMF)和去离子水(H2O)依次洗涤聚合物接枝表面,得到富集材料,此富集材料表面双组分共聚物膜的厚度为50-100nm,氮气吹干表面后置于真空干燥器中备用。
本发明中,基底材料为Si、Cu、Ag、Au、Pt、CuO、Fe3O4、多孔SiO2、多孔Al2O3、多孔TiO2或多孔ZrO2中的任意一种或者两种以上任意比例的混合。在本实施例中,选用的基底材料为硅胶。图2为双组分共聚物接枝的硅胶样品的结构示意图。
实施例2
功能单体的结构与合成方法
为制备上述的聚合物,需要合成一系列硫脲功能单体,它们具体实施的合成方法类似,合成步骤如图3所示。
以合成末端基R为羧基的硫脲单体为例,在室温环境中,将0.582g(6mmol)溶解在30~50mL无水丙酮中,搅拌条件下,将0.453g(5mmol)丙烯酰氯逐滴滴加至上述溶液中,继续反应12小时。反应结束后离心(4500r/min,5min),取上清液备用。在室温条件下,将0.685g(6mmol)对氨基苯甲酸溶解在30mL无水丙酮中,加2~4mL超纯水,搅拌条件下将备用清液逐滴滴加至上述溶液中,继续反应12小时。反应结束后旋蒸除去溶剂,得黄色油状物。该粗产物用30mL无水丙酮清洗-过滤,重复三遍得到1.02g淡黄色固体目标产物,产率约为80%。产物的结构通过核磁氢谱、核磁碳谱和质谱进行了表征鉴定。产物的结构通过核磁氢谱、核磁碳谱和质谱进行了表征鉴定。其余含不同末端R端基的硫脲单体参照此方法合成。
R端基为羧基的硫脲单体表征数据:1H NMR(300MHz,DMSO):5.99-6.03(d,1H,=CH),6.42-6.66(m,2H,=CH),7.82-7.96(m,4H,Ph-H),11.73(s,1H,CNHCS),12.77(s,1H,CNHCS),12.91(br,1H,COOH);13C NMR(300MHz,d6-DMSO):δ(ppm):126.5,128.7,131.4,135.4,136.0,147.0,157.6,167.2,172.4,176.0;MADLI-MS:m/z calcd for C11H10N2O3S:250.04;found:250.68;FT-IR:σ(cm-1):875,978,1165,1252,1410,1570,1599,1673,2851,2972,3183;Tm:161.5℃。
R端基为硝基的硫脲单体表征数据:1H NMR(300MHz,DMSO):5.70-5.78(m,1H,=CH),6.22-6.43(m,2H,=CH),7.62-7.86(m,4H,Ph-H),11.52(s,1H,CNHCS),12.43(s,1H,CNHCS);13C NMR(300MHz,d6-DMSO):δ(ppm):126.7,128.5,135.3,136.2,138.1,147.6,159.9,170.5;MADLI-MS:m/z calcd for C10H9N3O3S:251.26;found:252.05;FT-IR:σ(cm-1):878,984,1300,1437,1570,1589,1601,1672,2977,3151;Tm:168.4℃。
R端基为甲基的硫脲单体表征数据:1H NMR(300MHz,DMSO):5.99-6.03(d,1H,=CH),6.42-6.66(m,2H,=CH),7.82-7.96(m,4H,Ph-H),11.73(s,1H,CNHCS),12.77(s,1H,CNHCS),12.91(br,1H,COOH);13C NMR(300MHz,d6-DMSO):δ(ppm):23.4,126.9,129.5,131.2,135.4,137.1,147.8,158.9,171.5;MADLI-MS:m/z calcd for C11H12N2OS:220.29;found:220.08;FT-IR:σ(cm-1):877,968,1108,1485,1571,1602,1667,1826,2962,3203;Tm:143.6℃。
R端基为酯基的硫脲单体表征数据:1H NMR(300MHz,DMSO):1.30-1.33(m,3H,CH3),4.33(s,2H,CH2-),5.74-6.85(d,1H,=CH),6.32-6.44(m,2H,=CH),7.81-7.91(m,4H,Ph-H),11.15(s,1H,CNHCS),12.51(s,1H,CNHCS);13C NMR(300MHz,d6-DMSO):δ(ppm):15.3,62.1,127.5,128.9,132.7,137.4,138.3,149.0,158.9,169.5,174.4;MADLI-MS:m/z calcd for C13H14N2O3S:278.33;found:278.98;FT-IR:σ(cm-1):865,988,1367,1406,1571,1601,1668,2981,3173;Tm:184.6℃。
R端基为氢的硫脲单体表征数据:1H NMR(300MHz,DMSO):5.89-5.93(d,1H,=CH),6.40-6.64(m,2H,=CH),7.84-7.96(m,4H,Ph-H),11.83(s,1H,CNHCS),12.67(s,1H,CNHCS);13C NMR(300MHz,d6-DMSO):δ(ppm):126.4,127.6,130.4,136.4,137.0,147.5,157.7,167.6,171.4,;MADLI-MS:m/z calcd for C11H10N2O3S:205.04;found:206.08;FT-IR:σ(cm-1):870,968,1155,1256,1390,1556,1663,2854,2962;Tm:148.5℃。
实施例3
通过QCM-D吸附量测定的方法,以R端基为羧基的硫脲单体为例评价了富集材料的双组分共聚物表面对α酪蛋白和牛血清蛋白不同的吸附行为。按实施例1所述将该聚合物接枝到QCM-D芯片表面,在控温20℃条件下,以10%乙腈+90%去离子水为载液分别对α酪蛋白和牛血清蛋白进行吸附实验。图4显示了该双组分共聚物表面α酪蛋白和牛血清蛋白不同的吸附行为,充分展现出了此类双组分共聚物特异性吸附磷酸化蛋白的能力。
实施例4
本实施例与实施例3大致相同,不同之处在于本实施例的载液为30%乙腈+70%去离子水。图5为该双组分共聚物表面α酪蛋白和牛血清蛋白不同的吸附行为,可以看出,通过调节有机溶剂梯度放大其对α酪蛋白和牛血清蛋白吸附能力的差别,在磷酸肽的蛋白的选择性分离领域具有非常广阔的应用前景。
实施例5
按照实施例1所述的方法,将双组份共聚物接枝到平整基底上,如平整的金片或者硅片表面(其中硫脲单体以R使羧基为例)得到的薄膜材料,分别浸泡于10ml含10mgα酪蛋白或者牛血清蛋白的水溶液中20分钟。之后通过原子力显微镜扫描模式观察浸泡蛋白溶液前后的智能聚合物薄膜材料表面的变化。由图6-8可以观察到该双组份共聚物薄膜材料在浸泡酪蛋白和牛血清蛋白溶液后表面发生了不同程度的明显的形貌变化,说明该双组份共聚物薄膜对磷酸化蛋白具有特殊响应性,能够应用于区分磷酸化蛋白和非磷酸化蛋白。
分离应用实例
实施例6
按实施例1所述方法将双组份共聚物接枝到多孔硅胶表面得到富集材料,以硫脲单元末端基R为羧基为例,固定相结构见图9。
富集材料的活化与平衡:将1.0mg的富集材料装入离心管中,加入100μL含30%乙腈且pH值为5的活化液,且添加甲酸调整pH值至5,采用涡旋、振荡的方式使富集材料完全分散于该溶液中,静置10分钟后离心,弃上清液,收集沉淀。然后加入100μL含30%乙腈的平衡液,添加甲酸调整pH值至5,重复上述过程所得富集材料进行下述实验操作。
各种蛋白样品(包括标准蛋白纯样和蛋白混合样品经富集材料分离后的不同馏分)的鉴定采用色谱分析进行。色谱柱采用Acchrom公司产C4反向柱(填料直径5μm,孔径规格为长度150mm×内径4.6mm,上样量为2μL蛋白浓度为0.1mg/mL的水溶液,流动相为A相:含0.1%三氟乙酸的水溶液;B相:含0.1%三氟乙酸的乙腈溶液。流动相梯度:十分钟内B相浓度由30%提升至50%;流速为1.0mL/min。
分离富集时采用分散固相萃取模式,具体固相材料分离方式为离心分离。
取三份2μL(80pmol/L)α-酪蛋白溶液溶于50μL乙腈/去离子水(30:70,v/v)的溶液中,然后分别加入2μL、4μL、10μL(80pmol/L)的牛血清蛋白溶液,混合均匀得到三份蛋白混合物样品。将这三份样品分别与1mg经过活化和平衡的富集材料混合,孵化15min,离心后弃上清液,沉淀再用50μL乙腈/去离子水(30:70,v/v)+0.1%甲酸(pH 3)的溶液孵化15min,离心后收集上清液,重复此孵化和离心步骤两遍后合并两次上清液。接着将沉淀与50μL乙腈/去离子水(30:70,v/v)+1%三氟乙酸(pH小于2)的溶液混合孵化15min,离心后收集上清液,重复此孵化和离心步骤两遍后合并两次上清液。各收集的上清液直接按照上述方法进入液相色谱分析。
由图10-13可见,无论是α-酪蛋白/牛血清蛋白是1:1,1:2还是1:5,经过双组份共聚物修饰的硅胶材料富集分离后得到的蛋白样品,通过色谱分析鉴定可以获得接近于标准蛋白纯样的效果(保留时间相匹配,峰形较好)。说明该富集材料能选择性地分离和纯化磷酸化蛋白。
综上所述,本发明的富集材料对于磷酸化蛋白和非磷酸化蛋白具有很好的区分能力,和常规的金属氧化物相比,聚合物修饰硅胶材料分离磷酸化蛋白时具有更高选择性,更高的回收率和更好的重复性。同时与传统的免疫共沉淀方法相比具有成本低廉,高通量的优点。因此可将其应用于复杂体系中大规模、高通量的磷酸化蛋白的选择性分离,结合液相色谱、液质联用等检测手段,在磷酸化蛋白质组学研究等领域具有广阔的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!