用于前列腺癌分析的组合物和方法与流程
相关申请
本申请要求2015年4月21日提交的美国临时专利申请no.62/150,724的优先权权益,将其通过提述完整并入本文。
发明领域
本发明涉及肿瘤学和癌症诊断领域,更具体地涉及用于前列腺癌筛查、分期和治疗监测的组合物和方法。在具体实施方案中,本发明涉及用于前列腺癌的新型预后和诊断试验以及治疗方法。
发明背景
前列腺癌是男性最常见的癌症之一。虽然早期发病的大多数前列腺癌是无症状和缓慢生长的,但某些前列腺癌更具侵袭性、令人痛苦并导致死亡。目前,两种主要类型的无创筛查试验可用于男性前列腺癌的检测。一种是数字直肠检查(dre),其允许医生通过将戴有手套的手指插入直肠并触摸前列腺来检测前列腺异常,另一种是前列腺表面抗原测试(psa测试),所述测试测量血液样品中的psa抗原。虽然fda已经批准与dre一起使用psa测试来帮助检测男性前列腺癌,但psa测试在筛查中是有争议的,因为尚不清楚测试是否真的可以挽救生命。具体地说,基于这样的发现,即psa筛查没有降低或几乎没有降低前列腺癌死亡率而同时导致引起不必要的疼痛和副作用的治疗或测试,美国预防服务工作组(unitedstatespreventiveservicestaskforces)最近建议不要在健康男性中进行psa筛查(参见,例如r.chou等人,ann.intern.med.,october7,2011e-375;djulbegovic等人,bmj2010,341:c4543)。前列腺癌的最明确诊断是活组织检查,其中从疑似患者取出一小块前列腺用于显微镜检查,以示肿瘤细胞的存在。显然,这样的操作在早期筛查和检测中是相当有创和不太理想的。因此,鉴于最近发现psa筛查不能降低死亡率并且活组织检查是有创的,因此开发可以为前列腺癌的诊断和预后提供可靠结果的试剂和方法仍然存在大量需求。
与许多其他类型的癌症一样,前列腺癌患者的主要死亡原因不是原发性肿瘤,而是转移。一些原发性肿瘤细胞自身可以从原始组织脱离并进入循环。这些细胞称为循环肿瘤细胞(ctc)。一旦ctc将其自身种植在身体内的适合部位,它们可能发展成难以检测到的转移灶,但是当它们发展为继发性肿瘤时可能威胁生命。
ctc的检测和计数对于患者护理很重要,原因有很多。它们可能在原发性肿瘤之前可检出,从而允许早期诊断。它们对治疗的反应下降,因此计数ctc的能力允许人们监测给定治疗方案的有效性。此外,在辅助治疗中,ctc诊断可用作监测无可测量疾病患者复发的手段。例如,在乳房切除术后8-22年,在36%的乳腺癌患者中发现存在明显来自微转移(单个肿瘤细胞的沉积或非常小的肿瘤细胞簇)的ctc。meng等人,clin.can.res.1024):8152-62,2004。然而,在传统诊断测试失败的情况下,虽然ctc诊断提供了检测癌症的希望,但当前方法受到它们检测特异性肿瘤标志物(例如,steap1)的敏感性的限制。
另外,ctc可用于预测无进展生存期(pfs)和总生存期(os),因为已显示转移癌患者中循环肿瘤细胞的存在/数量与pfs和os相关。参见,例如,cristofanilli等人,j.clin.oncol.23(1):1420-1430,2005;cristofanilli等人,n.engi.j.med.351(8):781-791,2004。然而,正如需要提高ctc诊断的敏感性一样,还需要提高检测特异性肿瘤标志物(例如,steap1)的ctc测试的敏感性,以确定pfs。
对于临床试验中的前列腺癌及许多其他疾病,存在着多种认可的治疗选项。治疗选项包括但不限于:在未给予任何治疗情况下进行主动监视和监测直到症状出现和/或改变为止、手术(例如,耻骨后前列腺切除术、会阴前列腺切除术、盆腔淋巴结清扫术和经尿道前列腺切除术)、放射治疗(例如,外放射治疗、进展内放射治疗(progressioninternalradiationtherapy)和/或α发射体放射治疗)、激素治疗(例如,促黄体生成激素释放激动剂、抗雄激素如恩杂鲁胺、阻止肾上腺产生雄激素的药物、睾丸切除术、和雌激素)、化学疗法(例如,阿比特龙、比卡鲁胺、卡巴他赛、康士得、地加瑞克、多西他赛、恩杂鲁胺、醋酸戈舍瑞林、醋酸亮丙瑞林、盐酸米托蒽醌、泼尼松、西普鲁塞-t(sipuleucel-t)和二氯化镭223)、生物治疗以及双膦酸盐治疗。
具体地说,关于生物治疗,抗体药物缀合物(adc)是特别有意义的,因为它们有希望提高细胞毒药物的治疗指数。steap1在转移性去势抗性前列腺癌(mcrpc)中过表达,并且在临床开发中是adc的靶标。然而,需要伴随诊断来鉴定将对steap1-adc治疗作出反应的患者。同样,需要伴随诊断来鉴定正在对steap1-adc治疗作出反应的患者。因此,仍然需要伴随诊断来预测adc疗法的功效,以便优化和开发新的患者治疗。
为了鉴定最有可能受益于steap1-adc治疗的患者,在存档和/或新获得的肿瘤组织中(使用clia认证的ihc测定法)、以及在血液中的循环肿瘤细胞(ctc)上(使用epic平台)将steap1表达用作预测性生物标志物。具体地说,本文中开发并公开了在鉴定steap1阳性ctc中具有增强的敏感性的新型多通道诊断和预后测试,以预测和评估steap1-adc治疗的功效。因此,本文中公开的steap1-adcctc测定法的益处为:1)新的测定法可以检测具有steap1+mcrpc的患者,其检测敏感性是旧的测定法所不具备的,2)新的测定法可以检测steap1+mcrpc患者,无需有创且令人痛苦的活组织检查,所述患者是steap1-adc治疗的候选者,3)新的测定法最重要的是能够在整个治疗过程中监测steap1表达,而无需有创且令人痛苦的活组织检查。
发明概述
一方面,本公开提供了利用ctc来诊断测试受试者中的前列腺癌的方法,其包括:a)鉴定来自从测试受试者取得的血液样品的ctc;b)使ctc与特异性结合steap1的抗体、特异性结合cd45的抗体和特异性结合细胞角蛋白的抗体接触;c)用dapi将ctc染色;和d)用增强信号的酪胺信号放大(tsa)方案检测dapi染色和结合抗体;其中在没有cd45表达的情况下表达细胞角蛋白和前列腺特异性标志物并且显示dapi染色的ctc的存在预测了测试受试者患有前列腺癌。
在具体实施方案中,抗steap1抗体是由具有微生物保藏号pta-12259的杂交瘤细胞产生的15a5抗体。
在具体实施方案中,所述方法进一步包括确定steap1在癌细胞上的表达水平。
在具体实施方案中,所述方法进一步包括基于steap1的癌细胞表达水平对癌细胞进行分级,并确定每个级别中的癌细胞的百分比。在具体实施方案中,所述方法进一步包括计算每个级别的级别得分(通过将所述级别中的癌细胞的百分比乘以代表所述级别中的前列腺特异性标志物表达水平的独特级别数),并且将所有级别得分汇总获得h得分,其中h得分指示测试受试者中的前列腺癌的阶段。
在某些实施方案中,使用捕捉组合物从血液样品鉴定癌细胞,所述捕捉组合物包含与上皮起源的癌细胞特异性结合的配体。在具体实施方案中,所述配体是与癌细胞上优先表达的上皮抗原特异性结合的抗体。在具体实施方案中,所述上皮抗原是上皮细胞粘附分子(epcam)。
在某些实施方案中,经过鉴定的癌细胞富集在从血液样品分离的细胞级分中。在具体实施方案中,将所述细胞级分在磁场下分离。在具体实施方案中,将所述捕捉组合物中的配体与磁性颗粒(例如胶体磁性颗粒,例如胶体磁性纳米颗粒)偶联。在具体实施方案中,所述配体包括epcam抗体。
在某些实施方案中,抗steap-1抗体以≤1000nm的kd与steap-1结合。
在某些实施方案中,将抗steap-1抗体、抗cd45抗体和/或抗细胞角蛋白抗体与可检测标记物缀合。
一方面,本公开提供了预测steap1-adc治疗在患有前列腺癌的测试受试者中的功效的方法,其包括:a)鉴定来自从测试受试者取得的血液样品的ctc;b)使ctc与特异性结合steap1的抗体、特异性结合cd45的抗体和特异性结合细胞角蛋白的抗体接触;c)用dapi将ctc染色;和d)用增强信号的酪胺信号放大(tsa)方案检测dapi染色和结合抗体;其中在没有cd45表达的情况下表达细胞角蛋白和steap1并且显示dapi染色的ctc的存在预测了steap1-adc的功效。
一方面,本公开提供了使用增强信号的酪胺信号放大(tsa)方案来监测在患有前列腺癌的测试受试者中对steap1-adc治疗的反应的方法,所述方法包括:a)使第一组ctc与特异性结合steap1的抗体、特异性结合cd45的抗体和特异性结合细胞角蛋白的抗体接触,用dapi将细胞染色,其中第一组癌细胞来自在用steap1-adc治疗之前从所述测试受试者取得的第一血液样品;b)确定第一组中表达steap1和细胞角蛋白并用dapi染色的ctc的数量;c)使第二组ctc与特异性结合steap1的抗体、特异性结合cd45的抗体和特异性结合细胞角蛋白的抗体接触,用dapi将细胞染色,其中第二组癌细胞来自在用steap1-adc治疗期间或治疗之后从所述测试受试者取得的第二血液样品;d)确定第二组中表达steap1和细胞角蛋白并用dapi染色的癌细胞的量;和e)将在b)中确定的表达steap1和细胞角蛋白并用dapi染色的ctc的量与在d)中的量进行比较,其中ctc量的降低和/或steap1+ctc的降低指示在测试受试者中对前列腺癌治疗的响应。
在某些实施方案中,steap1-adc包括共价附着至细胞毒剂的抗steap-1抗体。在具体实施方案中,所述细胞毒剂选自毒素、化疗剂、药物模块、单甲基奥瑞司他汀e(mmae)、抗生素、放射性同位素和溶核酶。
附图简述
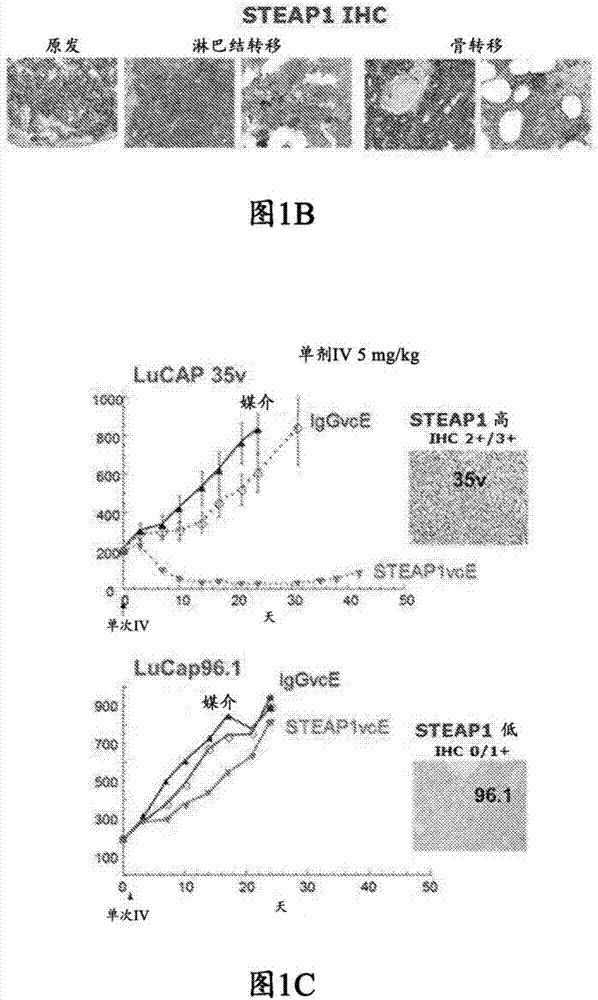
图1显示,steap1在正常前列腺上皮和大多数原发性前列腺肿瘤中高表达。图1a显示了跨多种组织的steap1affymetrix信号。图1b显示,在前列腺癌转移灶中保持steap1表达。37/42(88%)的原发性前列腺腺癌为ihcsteap1阳性,24/28(86%)的转移性前列腺腺癌为ihcsteap1阳性。图1c显示了steap1-adc的稳健的临床前活性。
图2显示了用于测量组织和血液中steap1水平的生物样品采集计划和方法的示意图。具体地说,它显示了疾病史、治疗和进展过程中的综合性组织和血液采集计划。
图3显示,患有steap1高表达肿瘤的患者倾向于在研究中表现出最高的psa下降和最长的停留时间。图3a显示,在steap1ihc3+肿瘤患者中,与基线水平相比≥50%的psa反应最常见。图3b显示,对于steap1ihc3+肿瘤患者,在研究中>6个月的时间最常见。
图4显示了在psa降低与ctc转换之间的相关性。在展现出从≥5个ctc/7.5ml血液的预后不利计数到有利的<5个ctc/7.5ml血液的ctc转换的患者中,观察到离开基线的最佳psa降低。
图5显示,steap1表达在存档组织和基线组织中是稳定的。除了一个病例之外,与存档样品相比,通过ihc在基线活组织检查中测量的steap1水平相似或更高。
图6显示,steap1-adc治疗使steap1+ctc耗竭。开发了两种新的基于4色if的测定法,以使用传统方案(非放大)和新的信号放大方案(放大方案)来测量ctc表面上steap1的表达。
图7a和7b显示在用steap1-adc治疗后观察到ctc总数/ml以及steap1+ctc数量的减少。
图8a和8b显示了基于免疫荧光的在ctc上steap1表达水平的检测。
图9显示,信号放大方案(酪胺信号放大(tsa)方案)增加了steap1ctc测定法在对照细胞中的动态范围。图9a显示,使用放大方案,steap1信号增加8.1倍,而背景仅增加2.4倍。图9b显示,放大方案能够鉴定用传统非放大方案不能鉴定的steap1+患者。
图10显示了患者病例研究,其中用steap1-adc治疗导致总ctc/ml和steap+ctc计数均减少。
发明详述
i.定义
如本文中可互换使用的术语“肿瘤”或“癌症”是指以肿瘤性或恶性细胞生长、增殖或转移为特征的任何医学病症,包括实体癌和诸如白血病的非实体癌。
如本文中使用的术语“前列腺癌”或“前列腺肿瘤”是指源于前列腺组织的癌症或肿瘤。
在疾病(比如癌症或肿瘤)背景下的术语“阶段”是指指示疾病严重性的疾病进展状态。
如本文中使用的术语“分期”是指鉴定已经进展的疾病所处的具体阶段。
术语“诊断”(及其诸如“诊断”或“诊断的”的语法变化)是指分子或病理状态、诸如癌症的疾病或病症的鉴定,或是指可能受益于特定治疗方案的癌症患者的鉴定。
术语“预后”(及其诸如“预后”或“预后的”的语法变化)是指受益于治疗(比如癌症治疗)的益处的可能性的预测。
术语“预测”(“prediction”)或“预测”(“predicting”)在本文中用于指患者有利或不利地对特定抗前列腺癌治疗将作出反应的可能性。在一个实施方案中,预测(prediction)或预测(predicting)涉及这些反应的程度。在一个实施方案中,预测(prediction)或预测(predicting)涉及患者在治疗(例如用特定治疗剂治疗)之后是否将存活或改善和/或存活或改善并且持续一段时间没有疾病进展的概率。
术语“益处”在最广义上加以使用,并且是指任何期望的效果,具体包括如本文中定义的临床益处。
“个体”或“受试者”为哺乳动物。哺乳动物包括但不限于驯养动物(例如母牛、绵羊、猫、狗和马)、灵长类动物(例如人类和非人灵长类动物如猴子)、兔、和啮齿动物(例如小鼠和大鼠)。在某些实施方案中,所述个体或受试者是人。
术语前列腺六跨膜表皮抗原1(也称为steap-1)是指主要在前列腺组织中表达的细胞表面抗原,并被发现在多种癌细胞系中上调。hubert等人(1999),proc.natl.acad.sci.usa,96(25),14523-8。示例性人steap-1具有在2007年10月26日提交的us2009/0280056a1中公开的seqidno:1的氨基酸序列,该专利的全部公开内容通过提述明确并入本文。
术语“抗steap-1抗体”和“与steap-1结合的抗体”是指能够以足够的亲和力结合steap-1的抗体,所述亲和力使得该抗体可用作靶向steap-1的诊断剂。在一个实施方案中,抗steap-1抗体与无关的非steap-1蛋白的结合程度小于所述抗体与steap-1的结合的约10%,正如例如通过放射免疫测定(ria)所测量的。在某些实施方案中,结合steap-1的抗体具有≤1μm、≤100nm、≤10nm、≤1nm、≤0.1nm、≤0.01nm、或≤0.001nm(例如10-8m或更小,例如10-8m至10-13m,例如10-9m至10-13m)的解离常数(kd)。在某些实施方案中,抗steap-1抗体与来自在不同物种的steap-1中为保守的steap-1表位结合。
术语“steap1-adc”是指抗steap1抗体-药物缀合物。
术语“ctc”是指循环肿瘤细胞。ctc是存在于具有不同实体恶性肿瘤的患者的循环中的上皮起源的细胞。它们源自原发性肿瘤的克隆并且是恶性的。(参见fehm等人,clin.cancerres.8:2073-84,2002.)具体地说,ctc从原发性肿瘤脱落进入脉管系统,在整个血流中循环,并可用作远处重要器官后续转移灶的“种子”,从而触发作为绝大多数癌症相关死亡原因的机制。此外,文献中已经积累了证据表明,ctc可以被视为多种癌的癌症进展的独立诊断(beitsch和clifford,am.j.surg.180(6):446-49,2000(乳腺);feezor等人,ann.oncol.surg.9(10):944-53,2002(结肠直肠);ghossein等人,diagn.mol.pathol.8(4):165-75,1999(黑素瘤、前列腺、甲状腺);glaves,br.j.cancer48:665-73,1983(肺);matsunami等人,ann.surg.oncol.10(2):171-5,2003(胃);racila等人,1998;pantel等人,1999)。
“亲和力”是指分子(例如抗体)的单一结合位点与其结合伴侣(例如抗原)之间的非共价相互作用的总和的强度。除非另外指明,如本文中使用的,“结合亲和力”是指反映结合对的成员(例如抗体和抗原)之间的1:1相互作用的固有结合亲和力。分子x对其伴侣y的亲和力通常可以由解离常数(kd)表示。可以通过本领域已知的常用方法测量亲和力,包括本文所述的那些方法。在下文描述了用于测量结合亲和力的具体的说明性和示例性实施方案。
在本文中以最广义的方式使用术语“抗体”,其涵盖各种抗体结构,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如,双特异性抗体)和抗体片段,只要它们表现出期望的抗原结合活性即可。
“抗体片段”指的是除了完整抗体之外的分子,其包含与完整抗体所结合的抗原结合的所述完整抗体的一部分。抗体片段的实例包括但不限于fv、fab、fab'、fab’-sh、f(ab')2;双抗体;线性抗体;单链抗体分子(例如scfv);和由抗体片段形成的多特异性抗体。
就参考抗体而言“结合相同表位的抗体”是指在竞争测定法中阻断参考抗体与其抗原的结合的50%或以上的抗体,相反地,参考抗体在竞争测定法中阻断所述抗体与其抗原的结合的50%或以上。本文中提供了示例性的竞争测定法。
如本文中使用的术语“抗体15a5”是指由具有微生物保藏号pta-12259的杂交瘤细胞系产生的小鼠单克隆抗steap-1抗体。所述杂交瘤细胞系的微生物保藏信息如下:atcc保藏号:pta-12259;保藏日期:2011年11月17日;保藏的材料:产生抗体15a5的杂交瘤15a5.1.1.1(也命名为7284)。
抗体的“类”是指其重链所具有的恒定结构域或恒定区的类型。有五大类的抗体:iga、igd、ige、igg和igm,其中几类可进一步分为亚类(同种型),例如,igg1、igg2、igg3、igg4、iga1、和iga2。对应于不同类型免疫球蛋白的重链恒定结构域分别称作α、δ、ε、γ、和μ。
术语“全长抗体”、“完整抗体”和“全抗体”在本文中可互换使用,指的是具有与天然抗体结构基本相似的结构或具有包含如本文中定义的fc区的重链的抗体。
如本文中使用的术语“单克隆抗体”是指从基本上同质的抗体的群获得的抗体,即构成该群的单独的抗体是相同的和/或结合同一表位,例外情况是可能存在变体抗体,例如,含有天然存在的突变的或在单克隆抗体制剂生产过程中产生的抗体,这样的变体通常以少量存在。与通常包括针对不同决定簇(表位)的不同抗体的多克隆抗体制剂相反,单克隆抗体制剂的每种单克隆抗体针对抗原上的单一决定簇。因此,修饰语“单克隆的”表示从基本上同质的抗体群获得的抗体的特性,并且不被解释为需要通过任何特定的方法产生抗体。例如,根据本发明使用的单克隆抗体可以通过多种技术加以制备,所述技术包括但不限于杂交瘤法、重组dna法、噬菌体展示法、以及利用含有人免疫球蛋白基因座的全部或部分的转基因动物的方法,此类方法和其他示例性方法用于制造本文所述的单克隆抗体。
“天然抗体”指的是具有不同结构的天然存在的免疫球蛋白分子。例如,天然igg抗体是约150,000道尔顿的异四聚体糖蛋白,由二硫键结合的两条完全相同的轻链和两条完全相同的重链组成。从n末端至c末端,每条重链具有可变区(vh),也称为可变重链结构域或重链可变结构域,其后是三个恒定结构域(ch1、ch2、和ch3)。类似地,从n末端至c末端,每条轻链具有可变区(vl),也称为可变轻链结构域或轻链可变结构域,其后是轻链恒定结构域(cl)。基于其恒定结构域的氨基酸序列,抗体轻链可被指定为两种类型之一,称为卡帕(κ)和兰布达(λ)。
如本文中使用的术语“细胞毒剂”是指抑制或阻止细胞功能和/或引起细胞死亡或破坏的物质。细胞毒剂包括但不限于放射性同位素(例如at211、i131、i125、y90、re186、re188、sm153、bi212、p32、pb212和lu的放射性同位素);化疗剂或药物(例如甲氨蝶呤、阿霉素、长春花生物碱(长春新碱、长春花碱、依托泊苷)、多柔比星、美法仑、丝裂霉素c、苯丁酸氮芥、柔红霉素或其他嵌入剂);生长抑制剂;酶及其片段,比如溶核酶;抗生素;和毒素,比如细菌、真菌、植物或动物来源的小分子毒素或酶促活性毒素,包括其片段和/或变体。适用于本发明的细胞毒剂的非限制性实例包括2007年10月26日提交的us2009/0280056a1中所述的那些,其全部公开内容通过提述明确并入本文。例如,在某些实施方案中,细胞毒剂是单甲基奥瑞司他汀e(mmae)。
“半胱氨酸工程改造的抗体”或“半胱氨酸工程改造的抗体变体”是其中抗体的一个或多个残基被半胱氨酸残基取代的抗体。半胱氨酸工程改造的抗体的硫醇基团可以与药物部分(例如经由接头)缀合以形成thiomabtm抗体(即,thiomabtm药物缀合物(tdc))。在特定实施方案中,取代的残基出现在抗体的可接近位点。通过用半胱氨酸取代那些残基,由此反应性硫醇基团被定位在抗体的可接近位点,并且可以用于将抗体与其他模块(例如药物模块或接头-药物模块)缀合以产生免疫缀合物,正如本文中进一步描述的。例如,thiomabtm抗体可以是具有非半胱氨酸天然残基的单一突变的抗体,所述单一突变针对轻链(例如,根据kabat编号的g64c、k149c、r142c和v205c)或重链(例如,根据kabat编号的d101c、a118c、v184c或t205c)中的半胱氨酸。在具体实例中,thiomabtm抗体具有在重链或轻链中的单个半胱氨酸突变,使得每个全长抗体(即,具有两条重链和两条轻链的抗体)具有两个工程改造的半胱氨酸残基。在具体实施方案中,steap1-adc是steap1thiomabtm抗体。在具体实施方案中,steap1-adc是具有与mmae缀合的重链a118c取代的steap1thiomabtm抗体。
术语“治疗”(“treat”)和“治疗”(“treatment”)是指治疗性治疗和预防性或防止性措施,其目的是预防或减缓(减轻)不期望的生理变化或失调,例如癌症的发展或扩散。出于本发明的目的,有益或期望的临床结果包括但不限于:症状的减轻、疾病程度的降低、疾病状态的稳定化(即,未恶化)、疾病进展的延迟或减缓、疾病状态的改善或减轻、以及缓解(不管是部分还是全部),无论是可检测的还是不可检测的。如果没有接受治疗,“治疗”也可能意味着相比于预期生存的生存期延长。需要治疗者包括已经患有病症或失调者以及具有患该病症或失调的倾向者、或其中有待预防该病症或失调者。
术语“治疗有效量”是指有效治疗哺乳动物的疾病或失调的药物的量。在癌症的情况下,药物的治疗有效量可以减少癌细胞的数量;减小肿瘤大小;抑制(即,在一定程度上减慢并优选地停止)癌细胞浸润到周围器官中;抑制(即,在一定程度上减慢并优选停止)肿瘤转移;在一定程度上抑制肿瘤生长;和/或在一定程度上减轻与癌症相关的一种或多种症状。在药物可以预防现有癌细胞生长和/或将其杀死的情况下,所述药物可能是细胞生长抑制的和/或细胞毒性的。对于癌症治疗,可以例如通过评定疾病进展时间(ttp)和/或确定响应率(rr)来量度功效。
术语“癌症”和“癌性的”是指或描述在哺乳动物中典型地以不受调节的细细胞生长为特征的生理状况。“肿瘤”包含一个或多个癌细胞。癌症的实例包括但不限于,癌瘤、淋巴瘤、母细胞瘤、肉瘤、以及白血病或淋巴系统恶性肿瘤。这些癌症的更具体的实例包括鳞状细胞癌(例如上皮鳞状细胞癌);肺癌,包括小细胞肺癌、非小细胞肺癌(“nsclc”)、肺腺癌和肺鳞状细胞癌;腹膜癌;肝细胞癌;胃的癌或胃癌,包括胃肠癌;胰腺癌;胶质母细胞瘤;宫颈癌;卵巢癌;肝癌;膀胱癌;肝细胞瘤;乳腺癌;结肠癌;直肠癌;结肠直肠癌;子宫内膜癌或子宫癌;唾液腺癌,肾脏癌或肾癌;前列腺癌;外阴癌;甲状腺癌;肝的癌;肛门癌;阴茎癌;以及头颈癌。
“表达steap1的癌”是包含在其细胞表面存在steap1蛋白的细胞的癌。“表达steap1的癌”是在其细胞表面产生足够水平的steap1的癌,使得抗steap1抗体可以与其结合并具有针对所述癌症的治疗效果。
“steap1-adc”是指与细胞毒性模块缀合的steap1抗体。在具体实施方案中,steap1-adc是在内在半胱氨酸残基处利用二硫键与细胞毒性模块缀合的15a5抗steap1抗体。在具体实施方案中,steap1-adc是在内在半胱氨酸残基处利用二硫键与mmae模块缀合的15a5抗steap1抗体。在具体实施方案中,steap1-adc是thiomabtm抗体(抗steap1thiomabtm抗体),其中thiomabtm抗体是在工程改造的半胱氨酸残基处利用二硫键与细胞毒性模块缀合的15a5抗steap1抗体。在具体实施方案中,抗steap1thiomabtm抗体与mmae缀合。在具体实施方案中,抗steap1thiomabtm抗体在重链a118c处具有工程改造的半胱氨酸残基。
与相同组织类型的非癌细胞相比,“过表达”抗原受体的癌是在其细胞表面具有显著更高水平的受体(比如steap1)的癌。这种过表达可能由基因扩增或由转录或翻译增加引起。在诊断或预后测定中,通过评估存在于细胞表面上的受体蛋白质的水平增加可以确定受体过表达(例如通过免疫组织化学测定;ihc)。替代地或另外地,人们可以测量细胞中受体编码核酸的水平,例如通过荧光原位杂交(fish;参见wo98/45479)、southern印迹或聚合酶链式反应(pcr)技术,比如实时定量pcr(rt-pcr)。
“分离的”抗体是已经从其天然环境的组分中分离的抗体。在一些实施方案中,正如通过例如电泳(例如,sds-page、等电聚焦(ief)、毛细管电泳)或色谱法(例如,离子交换或反相hplc)测定的,将抗体纯化至大于95%或99%的纯度。关于评估抗体纯度的方法的评述,参见例如,flatman等人,j.chromatogr.b848:79-87(2007)。
“分离的”核酸是指已经从其天然环境的组分中分离的核酸分子。分离的核酸包括通常含有核酸分子的细胞中所含的核酸分子,但核酸分子在染色体外存在或在与其天然染色体位置不同的染色体位置处存在。
“编码抗steap-1抗体的分离的核酸”是指编码抗体重链和轻链(或其片段)的一个或多个核酸分子,包括在单一的载体或分开的载体中的此类核酸分子,并且此类核酸分子存在于宿主细胞中的一个或多个位置。
如本文中使用的术语“载体”意指能够传送与其连接的另一个核酸的核酸分子。该术语包括作为自身复制核酸结构的载体以及组入其已被引入的宿主细胞中的基因组中的载体。某些载体能够指导与它们可操作连接的核酸的表达。这样的载体在本文中被称为“表达载体”。
术语“宿主细胞”、“宿主细胞系”和“宿主细胞培养物”可互换使用,并且是指在其中引入了外源核酸的细胞,包括这些细胞的后代。宿主细胞包括“转化体”和“转化细胞”,其包括初级转化细胞和从其衍生的后代,而不考虑传代次数。后代在核酸含量方面与亲本细胞可能不完全相同,而可能含有突变。在本文中包括具有与在原始转化细胞中所筛选或选择相同的功能或生物活性的突变体后代。
术语“包装说明书”用于指通常包括在治疗产品的商业包装中的说明书,其包含关于使用这种治疗产品的适应症、用法、剂量、给药、联合疗法、禁忌症和/或警告的信息。
ii.方法
本文中公开的方法满足了下列未满足的需求:能够鉴定将受益于steap1-adc治疗的患者并且能够监测疾病进展和steap1-adc治疗功效而不进行有创的外科活组织检查。这些方法允许检测患者和选择作为针对steap1-adc治疗的良好候选者的患者以及对steap1-adc治疗将作出反应的患者,而不进行有创的且令人痛苦的活组织检查。这些方法还允许在用steap1-adc治疗期间频繁地监测steap1+ctc和steap1的表达。频繁的监测允许剂量调整和个性化,而这些是外科活组织检查由于其有创性质所不允许的。因此,本文中公开的方法对于adc治疗特别重要,因为adc治疗集中于特异性生物标志物,并且在adc治疗之前、之中和之后能够监测和检测该特异性生物标志物的水平是有利的。
在一个方面,本公开提供了使用来自测试受试者的血液样品来诊断测试受试者中的前列腺癌或将其分期的方法。具体而言,本公开提供了通过确定循环肿瘤细胞(ctc)是否表达一种或多种前列腺特异性标志物来诊断测试受试者中的前列腺癌或将其分期的方法。在具体实施方案中,本公开提供了诊断在进行或将要进行steap1-adc治疗(即,用steap1-adc进行治疗)的测试受试者中的前列腺癌或将其分期的方法。
在本文提供的方法中,针对表达一种或多种前列腺特异性标志物来分析ctc。检测ctc上的前列腺特异性标志物提供了进一步的关于前列腺癌诊断和分期的信息。在具体实施方案中,前列腺特异性标志物是steap1。
在具体实施方案中,针对四种标志物分析ctc:细胞角蛋白(ck)、cd45、dapi和steap1。ck是用于检测ctc的上皮标志物。cd45是白细胞标志物,dapi是核标志物。steap1是前列腺癌的标志物。在具体实施方案中,用steap1+/ck+/dapi+特征来鉴定steap1阳性ctc。
在某些实施方案中,本公开提供了用于诊断测试受试者中的前列腺癌或将其分期的方法,其包括:a)使上皮起源的癌细胞与特异性结合前列腺特异性标志物的抗体接触,其中所述癌细胞来自从所述测试受试者取得的血液样品;b)进一步针对dapi染色以及ck和cd45表达筛查细胞;c)确定任何癌细胞是否表达前列腺特异性标志物cd45和ck,其中表达前列腺特异性标志物ck和被dapi染色的癌细胞的存在预测了测试受试者患有前列腺癌。在具体实施方案中,上皮起源的癌细胞是ctc。在具体实施方案中,前列腺特异性标志物是steap1。
在某些实施方案中,诊断和预后测定法采用放大方案。所述放大方案是酪胺信号放大(tsa)方案,其可以例如与染料(例如alexafluors)联合使用,以在细胞应用中实现高分辨率信号放大。tsa是酶介导的检测方法,其利用辣根过氧化物酶(hrp)的催化活性来产生靶蛋白的高密度标记。
术语“上皮起源的癌细胞”是指表达至少一种上皮标志物的癌细胞。如本文中使用的术语“标志物”是指优先在特定类型的细胞上表达并有助于将这些细胞与其他类型的细胞区分开的抗原分子。例如,上皮标志物可以是在上皮细胞上普遍表达但通常未在白细胞上发现的抗原分子。上皮起源的癌细胞还可以表达肿瘤标志物,例如优先在肿瘤细胞上发现但在正常细胞上较不常见的抗原分子。在某些实施方案中,上皮起源的癌细胞包括ctc。
在某些实施方案中,上皮起源的癌细胞表达至少一种也优先在癌细胞中发现的上皮标志物。这样的上皮标志物的检出指示上皮起源的癌细胞。在某些实施方案中,这样的上皮标志物是上皮细胞粘附分子(epcam)。
所述上皮起源的癌细胞来自从测试受试者获得的血液样品。血液样品可以是源自人血液的任何样品,例如已经用诸如抗凝剂的某些试剂处理过的血浆样品、血清样品、全血或血液。血液样品可以直接从测试受试者获得,或者可以从自测试受试者采集样品的组织机构获得。
在某些实施方案中,使用捕捉组合物从血液样品鉴定癌细胞。在某些实施方案中,所述捕捉组合物包含与上皮起源的癌细胞特异性结合的配体。在某些实施方案中,所述配体是与癌细胞上优先表达的上皮抗原特异性结合的抗体。在某些实施方案中,所述上皮抗原是epcam。
如本文中使用的术语“鉴定”(“identify”)或“鉴定”(“identification”)是指将上皮起源的癌细胞与血液样品中的其余组分基本上区分开来。例如,上皮起源的癌细胞可被捕捉组合物结合或捕捉,而其余组分不被结合或捕捉。
所鉴定的癌细胞可以与或可以不与血液样品中的其余组分分离。在某些实施方案中,所鉴定的癌细胞未与样品中的其他组分分离或富集。例如,可以将诸如血清样品的血液样品上样到载玻片上,用捕捉组合物鉴定,并且不进行任何分离或富集操作,样品可以进一步与其他试剂接触。
在某些实施方案中,经过鉴定的癌细胞富集在从血液样品分离的细胞级分中。如本文中使用的术语“富集”是指在所述细胞级分中的鉴定的癌细胞的密度高于血液样品中的密度。可以使用任何适合的技术来分离细胞级分。本领域通常采用的技术包括但不限于,例如在癌细胞与允许分离癌细胞的捕捉组合物形成复合物之后的重力分离、磁分离或亲和分离。对于重力分离,捕捉组合物可以与能够旋转下降的颗粒或珠子偶联,以允许所鉴定的癌细胞富集。对于磁分离,捕捉组合物可以与能够在适当磁场中分离的磁性颗粒偶联。对于亲和分离,捕捉组合物可以固定在诸如载玻片的装置上,并允许捕捉所鉴定的细胞。
在某些实施方案中,将所述细胞级分在磁场下分离。在某些实施方案中,捕捉组合物中的配体与磁性颗粒偶联。
可以使用本领域已知的方法制备适用于本文中公开的方法的磁性颗粒,参见例如美国专利5,597,531、5,698,271和6,365,362,以及还有描述于liberti等人,于fineparticlesscienceandtechnology,777-90,e.pelizzetti(ed.)(1996)中的程序。简言之,磁性颗粒包括用聚合物或蛋白质(例如,牛血清白蛋白和酪蛋白)包被的磁芯(例如氧化铁)。可以控制磁性颗粒的磁质量和尺寸,使得磁性颗粒是磁响应的,然而对于细胞分析技术如免疫荧光检测而言是基本上不可见的。磁性颗粒的合适尺寸可以小于200nm,优选具有合适的尺寸分布范围,例如在90-150nm内。颗粒的磁质量可以在70%-90%之间。
在某些实施方案中,磁性颗粒是胶体的。这种胶体磁性颗粒在延长的时间段内在溶液中基本上是稳定的,并且不会倾向于在重力作用下或在没有施加磁场的情况下聚集。在某些实施方案中,磁性颗粒是胶体纳米颗粒。
可以使用本领域已知的任何适合的方法使捕捉组合物中的配体与磁性颗粒偶联。例如,可以使用异双功能接头如琥珀酰亚胺吡啶二硫代丙酸酯(spdp)和4-[马来酰亚胺甲基]环己烷-1-羧酸磺酸基琥珀酰亚胺酯(smcc))使捕捉组合物与磁性颗粒直接偶联。对于另一个实例,包含生物素化抗体的捕捉组合物可以偶联到与链霉亲和素缀合的磁性颗粒上。捕捉组合物和磁性颗粒也可以引入可引起偶联的其他缀合对,例如亲和素-生物素、蛋白a-抗体fc、受体-配体和凝集素-碳水化合物。
在某些实施方案中,捕捉组合物包含与磁性胶体纳米颗粒偶联的epcam抗体。在某些实施方案中,可以使用
使上皮起源的癌细胞与特异性结合前列腺特异性标志物的抗体接触。如本文中使用的术语“前列腺特异性”表示,该标志物优先发现于前列腺组织中,并且基本上使前列腺组织或细胞与其他组织或细胞区分开来。在某些实施方案中,前列腺特异性标志物是是前列腺细胞的表面或膜标志物。在某些实施方案中,前列腺特异性标志物选自:前列腺六跨膜上皮抗原(steap-1)(参见,例如,hubert等人,(1999)proc.natl.acad.sci.usa,96,14523-14528)、前列腺特异性膜抗原(psm)(参见,例如,israeli,r.s.等人,(1993)cancerres.53,227–230)、前列腺癌肿瘤抗原(pcta-1)(参见,例如,su,z.z.等人,(1996)proc.natl.acad.sci.usa93,7252–7257)、和前列腺干细胞抗原(psca)(参见,例如,reiter,r.e.等人,(1998)proc.natl.acad.sciusa95,1735–1740)。示例性人steap-1具有在2007年10月26日提交的us2009/0280056a1中公开的seqidno:1的氨基酸序列,该专利的全部公开内容通过提述明确并入本文。
在某些实施方案中,特异性结合前列腺特异性标志物的抗体包括抗steap-1抗体。在某些实施方案中,抗steap-1抗体以≤1000nm的kd与steap-1结合。抗steap-1抗体可以是多克隆抗体或单克隆抗体,并且可以是任何适合的物种,例如绵羊抗体、兔抗体或鼠抗体。
在某些实施方案中,抗steap-1抗体是鼠单克隆抗体。在某些实施方案中,抗steap-1抗体是由具有微生物保藏号pta-12259的杂交瘤细胞产生的15a5。在某些实施方案中,抗steap-1抗体是与抗体15a5所结合的基本相同的表位结合的抗体。
在某些实施方案中,抗steap-1抗体与第一可检测标记物缀合。可以使用任何适合的可检测标记物。在某些实施方案中,可检测标记物是荧光标记,例如像荧光团af-488、花青染料的衍生物、荧光素、罗丹明、德克萨斯红、氨基甲基香豆素(amca)、藻红蛋白、异硫氰酸荧光素(fitc)等。将抗体与可检测标记物缀合的方法是本领域熟知的,参见例如,hermanson,g.t.,bioconjugatetechniques,academicpress,2008。
在某些实施方案中,抗steap-1抗体不被缀合。可以用缀合有可检测标记物(例如第一可检测标记物)的二级抗体检测未缀合的抗steap-1抗体。这样的二级抗体可以是与抗steap-1抗体不同的物种产生的任何抗体,并且识别抗steap-1抗体的恒定区,正如本领域通常使用的那样。
在某些实施方案中,用一种或多种允许检测上皮起源的癌细胞的试剂来鉴定癌细胞。
在某些实施方案中,所述试剂包括特异性结合上皮标志物的配体。在某些实施方案中,所述上皮标志物不是epcam。在某些实施方案中,所述上皮标志物是细胞角蛋白。细胞角蛋白是通常在上皮细胞中表达的一组蛋白质,并且在上皮组织的细胞骨架中形成含角蛋白的丝。
在某些实施方案中,特异性结合上皮标志物的配体是抗细胞角蛋白抗体,其任选地与第二可检测标记物缀合。可以使用任何适合的可检测标记物,例如荧光标记,如藻红蛋白。
在某些实施方案中,所述试剂进一步包括区分细胞与非细胞组分的细胞特异性染料。例如,可以使用使细胞核染色的染料。在某些实施方案中,染料是4',6-二脒基-2-苯基吲哚(dapi)。
在某些实施方案中,所述试剂进一步包括特异性结合白细胞标志物的配体。白细胞标志物可以选择为在白细胞上普遍表达,但通常不在非白细胞上表达,例如,cd45可以是适合的白细胞标志物。在某些实施方案中,特异性结合白细胞标志物的配体与第三可检测标记物缀合。例如,配体可以是与别藻蓝蛋白缀合的抗cd45抗体。将鉴定的细胞通过抗cd45抗体染色可有助于从上皮起源的ctc中排除白细胞。
在一次测试中使用一种以上可检测标记物(包括染料)的情况下,优选这样选择可检测标记物,使得可以独立地检测每种标记物,而对样品中存在的任何其他可检测信号没有实质性干扰。例如,可检测标记物(包括染料)可以是在检测条件下显示不同颜色的不同荧光分子。
可以通过任何适合的方法进行检测,例如基于免疫荧光显微镜检查、流式细胞术、光纤扫描细胞术或激光扫描细胞术的那些方法。
在某些实施方案中,在用细胞特异性染料以及针对上皮标志物、前列腺特异性标志物和白细胞标志物的不同标记的抗体或配体染色之后,在荧光显微镜下显现癌细胞。细胞特异性染料、上皮标志物和前列腺特异性标志物为阳性但白细胞标志物为阴性的细胞被分类为表达前列腺特异性标志物的上皮起源的癌细胞。也可以使用流式细胞术分析这样的细胞,参见,例如,cruz,i.等人,amjclinpathol,vol.123:66-74(2005)。
或者,还可以使癌细胞沉积在载玻片的表面上,并扫描细胞特异性染料、上皮标志物和前列腺特异性标志物为阳性但白细胞标志物为阴性的细胞(参见,例如,marrinucci,d.等人,humanpathology,vol.38,no.3,514-519(2007))。类似地,也可以使用激光扫描技术分析所鉴定的沉积在载玻片上的细胞(参见,例如,pachmann,k.等人,breastcancerresearch,vol.7,no.6,r975-r979(2005))。
在某些实施方案中,所述方法进一步包括确定表达前列腺特异性标志物的癌细胞的量,其中所述量用于预测测试受试者中前列腺癌的阶段。已经假定将肿瘤的大小和/或侵袭性与外周血中肿瘤细胞的数目相关联。例如,据报道,具有直径1mm肿瘤的患者可能具有的外周血中的肿瘤细胞频率为每100ml血液约6个肿瘤细胞(参见,例如,美国专利6,365,362)。假定肿瘤大小的增加可与这个频率成正比,可以建立标准来指示测试受试者中癌症的阶段。在某些实施方案中,来自诊断为早期或转移性前列腺癌的患者的临床血液样品可用于确定这些患者的外周血中的癌细胞的统计水平,从而为将来检测和分析提供标准。
在某些实施方案中,所述方法进一步包括确定前列腺特异性标志物在癌细胞上的表达水平。一些前列腺特异性标志物是其表达水平可能由于肿瘤生长、转移和/或晚期癌症而上调的抗原。这样的前列腺特异性标志物可以包括但不限于steap-1、psma、pcta-1和psca。可以通过任何适合的方法来确定癌细胞上的前列腺特异性标志物的表达水平,例如通过确定对应于前列腺特异性标志物的荧光信号的强度。
在某些实施方案中,所述方法进一步包括基于前列腺特异性标志物的癌细胞表达水平对癌细胞进行分级,并确定每个级别中的癌细胞的百分比。在某些实施方案中,分别将表达高水平、中等水平和低水平的前列腺特异性标志物的癌细胞分级。可以例如使用已建立的具有已知的标志物表达水平的细胞系来确定“高水平”、“中等水平”和“低水平”的标准。例如,已知lb50细胞系表达高水平的steap-1,已知lncapner细胞系表达中等水平的steap-1,并且已知pc3细胞系表达低水平的steap-1。因此,检测出具有与lb50细胞系相当或具有更高的steap-1表达水平的癌细胞可以被分级为“高水平”。类似地,可以将“中等水平”指定给这样的癌细胞,其steap-1表达水平与lncapner细胞系相当或相比更高但低于lb50细胞系。具有与pc3细胞系相当或更低的steap-1表达水平的那些癌细胞可以被分级为“低水平”。
可以进一步确定每个等级中的癌细胞数。在某些实施方案中,可以计算每个等级中的癌细胞的百分比。较高百分比的高级别癌细胞可以指示前列腺癌的更晚期阶段。类似地,处于早期阶段的前列腺癌可能显示较低百分比的高级别癌细胞和/或较高百分比的低级别癌细胞。
在某些实施方案中,所述方法进一步包括计算每个级别的级别得分(通过将该级别中的癌细胞的百分比乘以基于前列腺特异性标志物表达水平指定给该级别的独特级别数),并且将所有级别得分汇总获得h得分,其中h得分指示测试受试者中的前列腺癌的阶段。例如,可以将等级数3指定给高级别,2指定给中等级别,1指定给低级别,这样将h得分的范围限定在0到300之间。较高的h得分指示更多的细胞处于高级别,即前列腺癌的更晚期阶段,较低的h得分指示更多的细胞处于低级别,即前列腺癌的相对早期阶段。
在一些实施方案中,所述方法进一步包括确定标志物的存在和/或标志物存在的频率。在一些实施方案中,通过下列方法确定标志物的存在:免疫组织化学(“ihc”),western印迹分析、免疫沉淀、分子结合测定、elisa、elifa、荧光激活细胞分选(“facs”)、massarray、蛋白质组学、基于血液的定量测定法(例如血清elisa)、生物化学酶活性测定法、原位杂交、northern分析、包括定量实时pcr(“qrt-pcr”)在内的聚合酶链式反应(“pcr”)、和其他扩增型检测方法,例如像分支dna、sisba、tma等)、rna-seq、fish、微阵列分析、基因表达谱和/或基因表达系列分析(“sage”),以及多种多样的可以通过蛋白质、基因和/或组织阵列分析进行的测定法的任何一种。在一些实施方案中,通过荧光原位杂交(fish)确定标志物的存在。在一些实施方案中,所述标志物是pten。在一些实施方案中,所述ctc是三倍体。在一些实施方案中,所述ctc是具有pten丢失的三倍体。在一些实施方案中,通过cep10fish将ctc确定为三倍体。在一些实施方案中,通过ptenfish确定ctc包括pten丢失。
在另一方面,本公开还提供了预测前列腺癌治疗在测试受试者中的功效的方法,其包括:a)使上皮起源的癌细胞与特异性结合前列腺特异性标志物的抗体接触,其中所述癌细胞来自从所述测试受试者取得的血液样品;和b)确定任何癌细胞是否表达前列腺特异性标志物,其中表达前列腺特异性标志物的癌细胞的存在预测了所述前列腺癌治疗在测试受试者中的功效。
某些前列腺特异性标志物也可能是前列腺癌治疗的治疗靶标。因此,这种标志物在ctc上的表达水平和这种水平的变化可以预测靶向这种标志物的疗法的功效。
在某些实施方案中,所述方法进一步包括确定表达前列腺特异性标志物的癌细胞的量和/或确定癌细胞上的前列腺特异性标志物的表达水平。例如,在早期临床试验中,可以使来自基线治疗前样品的癌细胞上的前列腺特异性标志物(例如steap-1)的表达水平与临床终点相关联,所述临床终点例如无进展生存期、psa变化、患者报告的骨痛、总生存期或其他,以确定高于某一阈值的前列腺特异性标志物的表达是否预测了前列腺癌治疗(例如,基于steap-1抗体-药物缀合物(adc)的治疗)的临床活性。也可以使癌细胞中前列腺特异性标志物(例如steap-1)的表达水平的动态变化(即,治疗后样品中的下调)与临床结局度量相关联,以确定这些变化是否预测了治疗活性。作为能够用于选择前列腺癌治疗(例如,基于steap-1adc的治疗)患者的候选预测生物标志物,这样的方法可以用作定量测定中的第一步,随后在验证性iii期研究中进行预期确认。
在另一方面,本公开还提供了监测在测试受试者中对前列腺癌治疗的反应的方法,其包括:a)使上皮起源的第一组癌细胞与特异性结合前列腺特异性标志物的抗体接触,其中所述第一组癌细胞来自从所述测试受试者取得的第一血液样品;b)确定所述第一组中表达前列腺特异性标志物的癌细胞的量和/或癌细胞中前列腺特异性标志物的表达水平;c)使上皮起源的第二组癌细胞与特异性结合前列腺特异性标志物的抗体接触,其中第二组癌细胞来自在前列腺癌治疗测试周期之后从所述测试受试者取得的第二血液样品;d)确定第二组中表达前列腺特异性标志物的癌细胞的量和/或癌细胞中前列腺特异性标志物的表达水平;和e)将在b)中确定的表达前列腺特异性标志物的癌细胞的量和/或前列腺特异性标志物表达水平与步骤d)中的进行比较,其中表达前列腺特异性标志物的癌细胞的量的变化和/或癌细胞中前列腺特异性标志物表达水平的增加预测了在所述测试受试者中对前列腺癌治疗的反应。在某些实施方案中,前列腺特异性标志物是steap-1。
iii.抗体
在另一方面,本公开提供了与抗体15a5所结合的表位基本相同的表位结合的抗体,其中抗体15a5由具有微生物保藏号pta-12259的杂交瘤细胞产生。
在某些实施方案中,本文中提供的抗体与15a5抗体竞争结合steap-1。竞争测定法可用于鉴定与抗steap-1抗体15a5竞争结合steap-1的抗体。
在示例性竞争测定法中,将固定的steap-1在包含与steap-1结合的第一标记抗体(例如,15a5)的溶液中温育,测试第二未标记抗体与第一抗体竞争结合steap-1的能力。所述第二抗体可存在于杂交瘤上清液中。作为对照,将固定的steap-1在包含第一标记抗体但不包含第二未标记抗体的溶液中温育。在允许第一抗体与steap-1结合的条件下温育之后,除去过量未结合的抗体,并测量与固定的steap-1结合的标记物的量。如果在测试样品中与固定的steap-1结合的标记物的量相对于对照样品实质性降低,则表明第二抗体与第一抗体竞争结合steap-1。参见harlow和lane(1988)antibodies:alaboratorymanualch.14(coldspringharborlaboratory,coldspringharbor,ny)。
在某些实施方案中,本文中提供的抗体与steap-1具有≤1000nm、≤100nm、≤10nm、≤1nm、≤0.1nm、≤0.01nm、或≤0.001nm(例如10-8m或更小,例如10-8m至10-13m,例如10-9m至10-13m)的解离常数(kd)。
在一个实施方案中,通过如下测定法所述用感兴趣抗体的fab型式及其抗原进行的放射性标记抗原结合测定法(ria)来测量kd。通过在存在未标记抗原的滴定系列的情况下用最小浓度的(125i)标记抗原平衡fab,然后用抗fab抗体包被板捕捉结合的抗原来测量fab对抗原的溶液结合亲和力(参见,例如,chen等人,j.mol.biol.293:865-881(1999))。为了建立测定法的条件,将
根据另一个实施方案,使用表面等离振子共振测定法使用
也可在octetred仪器(fortebio,menlopark,ca,usa)上进行动力学结合测量。例如,在以1000rpm振摇板的同时,在octet缓冲液(0.2%十二烷基麦芽糖苷或ddm,--pbs)中进行所有洗涤、稀释和测量。将链霉亲合素生物传感器在octet缓冲液中平衡10分钟,然后加载生物素化steap-1(来自1%ddm中的病毒裂解物,在octet缓冲液中1:8稀释)5分钟,并洗涤10分钟。对于结合相,将配体包被的链霉亲合素尖头在抗steap-1抗体片段中浸泡10分钟(8次连续2倍稀释,从500或50nm开始)。可以在仅含octet缓冲液的孔中测量ab-steap-1复合物的解离持续600秒。使用具有全局拟合的1:1结合模型,用octet评估软件v6.3来确定kd、ka和kd。
在某些实施方案中,本文中提供的抗体包括但不限于鼠抗体、绵羊抗体和兔抗体。在某些实施方案中,抗体是鼠单克隆抗体。
在某些实施方案中,本文中提供的抗体包含抗体15a5的至少一个cdr区。可以使用本领域已知的方法确定抗体的cdr区。示例性的cdr(cdr-l1、cdr-l2、cdr-l3、cdr-h1、cdr-h2、和cdr-h3)发生在l1的24-34、l2的50-56、l3的89-97、h1的31-35b、h2的50-65、和h3的95-102氨基酸残基处。(kabat等人,sequencesofproteinsofimmunologicalinterest,5thed.publichealthservice,nationalinstitutesofhealth,bethesda,md(1991).)除了重链可变区中的cdr1之外,cdr通常包含形成高变环的氨基酸残基。cdr还包含“特异性决定残基”或“sdr”,它们是接触抗原的残基。sdr被包含在称为缩略cdr(或a-cdr)的cdr区域中。示例性的a-cdr(a-cdr-l1、a-cdr-l2、a-cdr-l3、a-cdr-h1、a-cdr-h2、和a-cdr-h3)存在于l1的31-34、l2的50-55、l3的89-96、h1的31-35b、h2的50-58、和h3的95-102氨基酸残基处。(参见almagroandfransson,front.biosci.13:1619-1633(2008).)除非另外指明,在本文中根据上文kabat等人将cdr残基和可变结构域中的其他残基(例如fr残基)编号。
在某些实施方案中,本文中提供的抗体包含抗体15a5的至少一个重链可变区、或抗体15a5的至少一个轻链可变区。
术语“可变区”或“可变结构域”是指涉及抗体与抗原结合的抗体重链或轻链的结构域。天然抗体的重链和轻链的可变结构域(分别为vh和vl)通常具有相似的结构,每个结构域包含四个保守的框架区(fr)和三个高变区(hvr)。(参见,例如,kindt等人kubyimmunology,6thed.,w.h.freemanandco.,第91页(2007)。)单个vh或vl结构域可足以赋予抗原结合特异性。此外,可以使用来自结合抗原的抗体的vh或vl结构域来分离结合特定抗原的抗体,以分别筛选互补的vl或vh结构域的文库。参见,例如,portolano等人,j.immunol.150:880-887(1993);clarkson等人,nature352:624-628(1991)。
本公开还涵盖包括本文中提供的抗体的抗体片段。在某些实施方案中,本文中提供的抗体是抗体片段。抗体片段包括但不限于fab、fab’、fab’-sh、f(ab’)2、fv、和scfv片段,及下文描述的其他片段。关于某些抗体片段的综述,参见hudson等人,nat.med.9:129-134(2003)。关于scfv片段的综述,参见例如pluckthün,引自thepharmacologyofmonoclonalantibodies,vol.113,rosenburgandmooreeds.,(springer-verlag,newyork),pp.269-315(1994);还参见wo93/16185;和美国专利no.5,571,894和5,587,458。关于包含补救受体结合表位残基并具有增加的体内半衰期的fab和f(ab')2片段的讨论,参见美国专利no.5,869,046。
双抗体指具有两个抗原结合位点的抗体片段,其可以是二价的或双特异性的。参见,例如,ep404,097;wo1993/01161;hudson等人,nat.med.9:129-134(2003);和hollinger等人,proc.natl.acad.sci.usa90:6444-6448(1993)。hudson等人,nat.med.9:129-134(2003)中还描述了三抗体和四抗体。
单结构域抗体是包含抗体的全部或部分重链可变结构域或全部或部分轻链可变结构域的抗体片段。在某些实施方案中,单结构域抗体是人单域抗体(domantis,inc.,waltham,ma;参见例如美国专利no.6,248,516b1)。
可以通过各种技术制造抗体片段,包括但不限于完整抗体的蛋白水解消化以及通过重组宿主细胞(例如大肠杆菌或噬菌体)产生,如本文中所述。
在某些实施方案中,本文中提供的抗体是抗体15a5或其抗原结合片段。
在某些实施方案中,本文中提供的抗体进一步与可检测标记物缀合。适合的标记物包括但不限于直接检测的标记物或模块(比如荧光、发色、电子致密、化学发光、和放射性标记物),以及(例如经由酶促反应或分子相互作用)间接检测的模块(比如酶或配体)。示例性标记物包括但不限于放射性同位素32p、14c、125i、3h和131i;荧光团如稀土螯合物或荧光素及其衍生物;罗丹明及其衍生物;丹酰;伞形酮;萤光素酶例如萤火虫萤光素酶和细菌萤光素酶(美国专利no.4,737,456);萤光素;2,3-二氢酞嗪二酮;辣根过氧化物酶(hrp);碱性磷酸酶;β-半乳糖苷酶;葡糖淀粉酶;溶菌酶;糖类氧化酶,例如葡萄糖氧化酶、半乳糖氧化酶、和葡萄糖-6-磷酸脱氢酶;杂环氧化酶,如尿酸酶和黄嘌呤氧化酶(其与采用过氧化氢氧化染料前体的酶如hrp偶联);乳过氧化物酶;或微过氧化物酶;生物素/亲合素;自旋标记物;噬菌体标记物;稳定的自由基,等等。
iv.核酸和宿主细胞
可以使用重组方法和组合物生成抗体,例如美国专利no.4,816,567中所述。在一个实施方案中,提供了分离的编码本文所述的抗steap-1抗体的核酸。这样的核酸可编码包含抗体vl的氨基酸序列和/或包含抗体vh的氨基酸序列(例如抗体的轻和/或重链)。在一个另外的实施方案中,提供了一种或多种包含这种核酸的载体(例如,表达载体)。在一个另外的实施方案中,提供了包含这种核酸的宿主细胞。在一个这样的实施方案中,宿主细胞包含(例如,已经转化有):(1)包含编码包含抗体vl的氨基酸序列和包含抗体vh的氨基酸序列的核酸的载体,或(2)包含编码包含抗体vl的氨基酸序列的核酸的第一载体和包含编码包含抗体vh的氨基酸序列的核酸的第二载体。在一个实施方案中,宿主细胞是真核的,例如,中国仓鼠卵巢(cho)细胞或淋巴样细胞(例如y0、ns0、sp20细胞)。在一个实施方案中,提供了制造抗steap-1抗体的方法,其中该方法包括在适合于表达抗体的条件下培养如上文提供的包含编码该抗体的核酸的宿主细胞,并任选地从宿主细胞(或宿主细胞培养基)回收抗体。
为了重组产生抗steap-1抗体,分离编码例如如上所述的抗体的核酸,并将其插入一个或多个载体中,以便在宿主细胞中进一步克隆和/或表达。可使用常规程序(例如通过使用能够特异性结合编码抗体重链和轻链的基因的寡核苷酸探针)容易对此类核酸进行分离和测序。
用于克隆或表达抗体编码载体的适合的宿主细胞包括本文中描述的原核或真核细胞。例如,尤其是在不需要糖基化和fc效应子功能时,可以在细菌中产生抗体。关于在细菌中表达抗体片段和多肽,参见例如美国专利no.5,648,237、5,789,199和5,840,523。(还可参见charlton,methodsinmolecularbiology,vol.248(b.k.c.lo,ed.,humanapress,totowa,nj,2003),pp.245-254,其描述了在大肠杆菌中表达抗体片段。)表达后,可以从细菌细胞糊分离出作为可溶性级分的抗体,并可将其进一步纯化。
除了原核生物之外,诸如丝状真菌或酵母的真核微生物是编码抗体的载体的适合克隆或表达宿主,包括其糖基化途径已被“人源化”的导致产生具有部分或完全人糖基化样式的抗体的真菌和酵母菌株。参见gerngross,nat.biotech.22:1409-1414(2004),和li等人,nat.biotech.24:210-215(2006)。
用于表达糖基化抗体的适合宿主细胞还衍生自多细胞生物(无脊椎动物和脊椎动物)。无脊椎动物细胞的实例包括植物和昆虫细胞。已经鉴定了可以与昆虫细胞结合使用尤其是用于转染草地贪夜蛾(spodopterafrugiperda)细胞的许多杆状病毒株。
植物细胞培养物也可以用作宿主。参见例如美国专利no.5,959,177、6,040,498、6,420,548、7,125,978、和6,417,429(描述了用于在转基因植物中产生抗体的plantibodiestm技术)。
脊椎动物细胞也可以用作宿主。例如,适于在悬液中生长的哺乳动物细胞系可能是有用的。有用的哺乳动物宿主细胞系的其他实例为:经sv40转化的猴肾cv1系(cos-7);人胚肾系(293或293细胞,如描述于例如graham等人,j.genvirol.36:59(1977));幼仓鼠肾细胞(bhk);小鼠塞托利(sertoli)细胞(tm4细胞,如描述于例如mather,biol.reprod.23:243-251(1980));猴肾细胞(cv1);非洲绿猴肾细胞(vero-76);人宫颈癌细胞(hela);犬肾细胞(mdck;牛鼠(buffalorat)肝细胞(brl3a));人肺细胞(w138);人肝细胞(hepg2);小鼠乳腺肿瘤(mmt060562);tri细胞,如描述于例如mather等人,annalsn.y.acad.sci.383:44-68(1982);mrc5细胞;和fs4细胞。其他有用的哺乳动物宿主细胞系包括中国仓鼠卵巢(cho)细胞,包括dhfr-cho细胞(urlaub等人,proc.natl.acad.sci.usa77:4216(1980));和骨髓瘤细胞系如yo、ns0、和sp2/0。关于适合于抗体产生的某些哺乳动物宿主细胞系的综述,参见例如yazaki和wu,methodsinmolecularbiology,vol.248(b.k.c.lo,ed.,humanapress,totowa,nj),pp.255-268(2003)。
本文中还提供了具有微生物保藏号pta-12259的杂交瘤细胞系。该杂交瘤细胞系产生抗体15a5。
v.抗体的用途
本文中提供的抗体可用于制造前列腺癌的诊断试剂。抗体可以与适合于诊断目的的可检测标记物进一步缀合,并且可以呈现为适合的形式,如冻干粉或适合的溶液形式。
vi.检测试剂盒
在本公开的另一方面,提供了包含可用于前列腺癌诊断或预后的组合物的检测试剂盒。
本公开进一步提供了用于检测血液样品中表达steap-1的前列腺癌细胞的存在的检测试剂盒,其包含特异性结合steap-1的抗体。
在某些实施方案中,抗体与第一可检测标记物缀合。可以使用任何适合的可检测标记物,例如荧光标记物。
在某些实施方案中,抗体是本文中提供的抗steap-1抗体。在某些实施方案中,抗体为抗体15a5。
在某些实施方案中,检测试剂盒进一步包含一种或多种选自下组的组合物:与特异性结合上皮起源的癌细胞的第一配体偶联的磁性颗粒,特异性结合上皮标志物的第二配体,特异性结合白细胞标志物的第三配体,和区分细胞与非细胞组分的染料。
在某些实施方案中,第二配体与第二可检测标记物缀合,和/或第三配体与第三可检测标记物缀合。在某些实施方案中,当检测试剂盒包含一种以上可检测标记物(包括染料)时,优选这样选择可检测标记物(包括染料),使得可以独立检测每种标记物,而对样品中存在的任何其他可检测信号没有实质性干扰。
在某些实施方案中,第一配体、第二配体和/或第三配体包括抗体。在某些实施方案中,第一配体包括抗epcam抗体。在某些实施方案中,第二配体包括抗角蛋白抗体。在某些实施方案中,第三配体包括抗cd45抗体。
检测试剂盒可进一步包括容器以及在容器上或与容器相关联的标签或包装说明书。适合的容器包括例如瓶、小瓶、注射器、iv溶液袋等。可以由各种材料如玻璃或塑料形成容器。容器装有自身或与另一种组合物组合时用于有效诊断病症的组合物。组合物中至少一种试剂是本发明的抗体。标签或包装说明书指示该组合物用于体外诊断选择的病症。
vii.实施例
以下是本发明的方法和组合物的实施例。应当理解,根据上面提供的一般描述,可以实践各种其他实施方案。
实施例1:ctc上stetc1表达水平的基于免疫荧光的检测
如本实施例中所示,基于免疫荧光的测定法能够显示出在ctc表面上的steap1的稳健检测、以及ctc总数和治疗后steap1+ctc的降低。
使用如本文中所述的四通道epicctc平台处理和分析样品。采用steap1-adc治疗前后,从42例转移性去势抗性前列腺癌患者(mcrpc)采集血液样品。在epicsciences收到患者血液样品后,裂解全血,将有核细胞(每载玻片约3x106个)沉积在显微镜载玻片上,并在-80℃冷冻直到用于分析。解冻后,用包含细胞角蛋白、cd45、dapi和15a5抗steap1抗体的抗体混合物将载玻片染色,用于评估ctc上的这种蛋白质生物标志物表达。使用抗细胞角蛋白抗体、抗cd45抗体和dapi染色来鉴定ctc。使用抗steap115a5抗体来检测表达steap1的ctc。开发了使用没有放大(“非放大”)的传统方案和信号放大方案(“放大”)的测定法来测量ctc表面上的steap1。放大方案的信噪比和动态范围分别比非放大方案的高4倍和5倍(图8a)。随后扫描染色的载玻片,并使用多参数数字病理学算法分析生成的图像,以检测ctc候选物并定量steap1水平。针对ctc亚型和周围的白细胞(wbc),显示了dapi(蓝色)、细胞角蛋白(红色)、cd45(绿色)(marrinucci等人,joncol.2010:861341(2010);cho等人,physbiol.9:016001(2012);marrinucci等人,physbiol.9:016003(2012)和steap1(白色)通道的代表性10x免疫荧光图像,其中4通道合并到图8b中的每个图像的最左边。
在用steap1-adc治疗后,观察到ctc总数/ml的减少以及steap1+ctc数量减少和steap1-ctc数量增加。具体地说,在18/42的样品(43%,30%-57%)中,ctc上的steap1表达水平很容易检测到,其中每病例steap1+ctc的范围为1%-56%。治疗后,与基线相比,观察到steap1阳性患者比例降低,而steap1-ctc患者比例升高。
实施例2:使用ctc测定法评估adc的预后和功效
六十例进行性mcrpc患者接受0.3-2.8mg/kg剂量范围的steap1-adc每三周一次。通过psa下降和研究时间>6个月来量度adc活性。在≥2mg/kg剂量时,在10/45(22%±12.1)的患者中观察到psa下降≥50%。在ihc3+肿瘤患者中,adc活性最显著。在≥2mg/kg时,20/45(44%±14.5)的患者在基线处具有不利的每7.5ml≥5个ctc计数,并且被认为是可评估的。在第一个治疗周期之后,在11/20(55%±21.8)的患者中观察到从不利到有利的ctc计数转换,并与psa下降显著相关(spearman等级r=0.74)。通过facs,在14/29的样品(49%±31-66%)的epcam+/cd45-事件中,ctc显示出易于检出的steap1+信号。steap1+事件显示出0-74%范围内的epcam+/cd45-特征,并且facs分选的epcam+/cd45-事件证明了steap1+rt-pcr表达,连同前列腺癌的假定标志物ar和klk3。通过epic,在18/42(43%±14.98)的样品中检出steap1,其中steap1+ctc的范围为1%-56%。治疗后,与基线相比,观察到steap1+患者比例降低,而steap1-ctc患者比例升高。17例患者入选steap1pet研究。在用steap1-adc治疗的14例患者中,4/14(29%±12-55%)的患者的psa下降≥50%。使治疗时间与骨转移suvmax(r=0.63)相关联。所有8例具有高suv转移的pet引导的活组织检查证实steap1ihc2+/3+。
因此,作为针对steap1-adc敏感性的预测生物标志物,可以基于组织或血液中的steap1/epcam/cd45表达样式(如上所述)或steap1/cd45/dapi表达样式(在实施例1中描述)来选择患有2+/3+肿瘤的患者,并评估在ctc上的steap1表达的值,作为选择最有可能受益于steap1-adc治疗的患者的替代终点。
实施例3:信号放大方案增加steap1ctc测定法的动态范围。
在存在和不存在扩增方案的情况下,测量了skbr3(steap1阴性对照)和lncap(steap1阳性对照)前列腺癌细胞系中的steap1信号(图9)。使用非放大方案时的steap+样品的截止值为>3的信号,而使用放大方案时为>8的信号。非放大方案显示,lncap(阳性对照)细胞系中的信号比skbr3(阴性对照)细胞系中的增加7.6倍。放大方案显示,lncap(阳性对照)细胞系中的信号比skbr3(阴性对照)细胞系中的增加25倍(图9a)。对于lncap(阳性对照)细胞系,steap1信号放大导致平均steap1信号增加8.1倍,而仅使背景(即skbr3阴性对照信号)增加2.4倍(图9a)。
steap1放大方案还揭示了steap1阳性患者,从而提供比现有测试更敏感的预后和诊断测试(图9b)。在36个样品中,使用非放大方案时12/36(33%)为steap1+,而使用放大方案(其中对于steap1+ctc的截止值为1)时18/36(50%)为steap1+(图9b)。如图9b中所示,使用放大测定法,将使用旧的非放大方案已经分类为steap1-的7例患者样品归类为steap1+。
对于steap1+样品,与steap1非放大测定法相比,放大测定法能够检出更多的steap1+ctc(即样品)(图9b)。因此,steap1放大方案允许鉴定将受益于steap1-adc治疗的患者,而使用传统的非放大方案不能鉴定这些患者(例如,对于steap1+ctc数量低的患者,不能使用传统的非放大方案进行鉴定)。
实施例4:steap1-adc治疗导致总ctc/ml和steap1+ctc计数均降低。
在用steap1-adc治疗前、治疗期间和治疗后,从患者获取血液样品。正如从图10中可以看出,随着治疗的进行,steap1+ctc的数量减少。
- 还没有人留言评论。精彩留言会获得点赞!