生物传感器芯片和生物传感器装置的制作方法
本发明涉及生物传感器芯片和生物传感器装置,例如用于血液试样中的成分的浓度测定的生物传感器芯片和生物传感器装置。
背景技术:
近年来,糖尿病患者不断增加。糖尿病的治疗的基本是血糖值的控制,在血糖值的控制方面,通常使用胰岛素。给用胰岛素的必要性基于糖尿病患者的血糖值进行判断。因此,提出了血糖自测定(smbg:selfmonitoringofbloodglucose)用的各种各样的装置,以使得糖尿病患者在日常生活中也能够容易地确认血糖值。
作为smbg用的装置,一般使用的是以电化学方法为工作原理的生物传感器装置。用于smbg的这样的生物传感器装置例如可以将一次性的生物传感器芯片安装至装置主体部而使用。该装置的工作原理如下所示。将血液滴加或引入至生物传感器芯片的电极部分时,预先设置于生物传感器芯片中的酶将血液中的血糖(葡萄糖)氧化,并且酶自身被还原。还原状态的酶通过与预先设置于生物传感器芯片中的电子载体(氧化状态)的氧化还原反应而使电子载体成为还原状态。该还原状态的电子载体到达电极表面,在施加有电位的电极表面发生电子载体的氧化反应,从而使电流在电极间流动。此时流动的电流取决于血液中的葡萄糖浓度,因此可以通过该电流值间接测定血液中的葡萄糖浓度(血糖值)。
如上所述,在血糖值的测定中,需要使血液试样与生物传感器芯片的电极接触。但是,血液试样中的红血球附着于电极时,在电极的表面之中附着有红血球的部分被绝缘,电极的有效面积减小。其结果是,检测出的电流值降低,在血糖值的测定上产生误差。
因此,作为可以减小上述的误差的装置,提出了如下生物传感器装置:根据血液的流动性求出血液试样的红细胞压积(在血液中红血球体积所占的比例),基于求出的红细胞压积值,校正血糖值的测定结果(红细胞压积校正)(专利文献1和2)。
现有技术文献
专利文献
专利文献1:日本特开2006-215034号公报
专利文献2:日本特开2011-145291号公报
技术实现要素:
发明所要解决的问题
但是,也指出了在红细胞压积校正中成为过度校正的危险性,在改善测定精度方面是不足的。可以列举例如,基于与实际的血糖值不同的不准确的测定结果,患者进行错误的胰岛素给用的危险性。在这种情况下,也无法否定会导致对患者的身体带来不良影响的重大医疗事故的可能性。因此可以说,从引起脑梗塞、心肌梗塞、神经障碍等各种各样的并发症的糖尿病治疗的观点出发,血糖值的测定精度的提高是重要的医疗上的课题之一。
因此,本发明的目的在于提供一种能够以更高的精度测定作为感应对象的试样的例如血液试样中的成分(血糖等)的浓度的生物传感器芯片和生物传感器装置。
用于解决问题的手段
本发明的第1方式的生物传感器芯片包含:
基板,所述基板在第1主面上设置有电极;
覆盖膜,所述覆盖膜与所述基板的所述第1主面相对地配置;以及
间隔层,所述间隔层配置于所述基板与所述覆盖膜之间,并且作为使所述基板与所述覆盖膜一体化的接合材料起作用;
所述间隔层设置有狭缝,所述狭缝构成试样引入口和试样流路,所述试样引入口设置于所述基板、所述间隔层和所述覆盖膜的层叠体的侧面,所述试样流路用于利用毛细管现象使试样流向所述电极,
在所述间隔层的所述狭缝与所述基板的所述电极的试样感应部之间设置有亲水性过滤器。
本发明的第2方式的生物传感器芯片包含:
基板,所述基板在第1主面上设置有电极;
覆盖膜,所述覆盖膜与所述基板的所述第1主面相对地配置;
间隔层,所述间隔层配置于所述基板与所述覆盖膜之间,具有设置在至少与所述电极对应的部分的狭缝,并且作为使所述基板与所述覆盖膜一体化的接合材料起作用;以及
亲水性过滤器,所述亲水性过滤器配置于所述间隔层与所述基板之间,并且覆盖所述电极的至少与所述狭缝对应的部分;
通过所述覆盖膜、所述间隔层的所述狭缝、所述基板而形成的区域为试样流路。
本发明的第3方式的生物传感器芯片包含:
基板,所述基板在第1主面上设置有感应血液试样的感应部;
覆盖膜,所述覆盖膜与所述基板的所述第1主面相对地配置;
间隔层,所述间隔层配置于所述基板与所述覆盖膜之间,具有利用毛细管现象引入所述血液试样的试样流路,并且作为使所述基板与所述覆盖膜一体化的接合材料起作用,以及
亲水性过滤器,所述亲水性过滤器配置于所述间隔层与所述基板之间,并且设置于要到达所述感应部的所述血液试样经过的位置。
另外,本发明还提供生物传感器装置,其包含:
装置主体部、以及
可拆卸地安装于所述装置主体部的上述本发明的生物传感器芯片;
所述装置主体部包含:
基于流过所述生物传感器芯片的所述一对电极间的电流值而检测试样中的检测物质的检测部、
对由所述检测部得到的检测结果进行分析的分析部、以及
将由所述分析部得到的分析结果显示为测定值的显示部。
发明效果
本发明的生物传感器芯片中,在作为感应对象的试样为血液试样的情况下,由于经由试样流路而到达电极或感应部的血液试样会通过亲水性过滤器,因此可以防止作为血液成分的例如红血球的透过。因此,以流过电极的电流检测出的值或由感应部得到的感应结果成为减小了例如由红血球产生的影响的更准确的值或结果。由此,根据本发明的生物传感器芯片,可以以更高的精度测定例如血液试样中的成分(例如血糖)的浓度。
由于本发明的生物传感器装置包含取得如上所述的效果的本发明的生物传感器芯片,因此可以以更高的精度测定例如血液试样中的成分(例如血糖)的浓度。
附图说明
图1a为表示本发明的实施方式中的生物传感器芯片的一个构成例的分解透视示意图。
图1b为图1a的i-i线剖视图。
图2a为表示本发明的实施方式中的生物传感器芯片的另一构成例的分解透视示意图。
图2b为图2a的ii-ii线剖视图。
图3a为表示本发明的实施方式中的生物传感器芯片的又一构成例的分解透视示意图。
图3b为图3a的iii-iii线剖视图。
图4a为表示本发明的实施方式中的生物传感器芯片的又一构成例的分解透视示意图。
图4b为图4a的iv-iv线剖视图。
图5a为表示本发明的实施方式中的生物传感器芯片的又一构成例的分解透视示意图。
图5b为图5a的v-v线剖视图。
图6为本发明的实施方式中的生物传感器装置的示意图。
图7为参考例a中使用的测试单元的剖视图。
图8为参考例a中使用的测试单元的俯视图。
图9为表示在参考例a中使用的测试单元中设置有过滤器的状态的剖视图。
图10为表示在参考例b中使用的测试单元中设置有过滤器的状态的俯视图。
图11a为图10的a-a线剖视图。
图11b为图10的b-b线剖视图。
图12表示在参考例b中使用的另一测试单元中设置有过滤器的状态的俯视图。
具体实施方式
以下,对于本发明的实施方式进行说明。需要说明的是,以下的记载并不限定本发明。
本发明的生物传感器芯片的一个实施方式包含:在第1主面上设置有电极的基板;与所述基板的所述第1主面相对地配置的覆盖膜;配置于所述基板与所述覆盖膜之间的间隔层,所述间隔层具有设置在至少与所述电极对应的部分的狭缝,并且作为使所述基板与所述覆盖膜一体化的接合材料起作用;以及配置于所述间隔层与所述基板之间并且覆盖所述电极的至少与所述狭缝对应的部分的亲水性过滤器。通过所述覆盖膜、所述间隔层的所述狭缝、所述基板而形成的区域成为试样流路。另外,本实施方式的生物传感器芯片中,设置试样流路的试样引入口的位置并无限定,以下,对于试样引入口为基板、间隔层和覆盖膜的层叠体的侧面上的试样流路的开口的例子进行说明。
需要说明的是,本实施方式中,列举感应对象为血液试样的情况为例子进行说明。
本实施方式的生物传感器芯片具有如下构成:将基板、间隔层和覆盖膜的层叠体的侧面上的试样流路的开口作为该试样流路的试样引入口,并且利用所谓的毛细管现象将试样引入试样流路。具有这样的构成的本实施方式的生物传感器芯片中,从试样引入口开始经由试样流路而到达电极的血液试样会通过亲水性过滤器,因此可以防止红血球的透过。因此,以流过电极的电流检测出的值成为减小了由红血球产生的影响的准确的值。由此,根据本实施方式的生物传感器芯片,可以以更高的精度测定血液试样中的特定的成分(例如血糖)的浓度。另外,在具有利用毛细管现象将血液试样引入试样流路的构成的生物传感器芯片的情况下,以往,为了辅助毛细管现象,需要对覆盖膜的面向试样流路的部分进行亲水化等、对作为试样流路的壁面的构件进行亲水化。但是,本实施方式的生物传感器芯片中,位于试样流路内并且以覆盖血液试样要到达的电极中至少与狭缝对应的部分的方式设置的过滤器为亲水性,因此不需要对作为试样流路的壁面的构件进行亲水化,此外,与对作为试样流路的壁面的构件进行亲水化的以往的构成相比,可以同时取得能够更有效地将血液试样引入至电极的效果。需要说明的是,本说明书中,在间隔层中与电极对应的部分设置有狭缝是指如下构成:例如,对将基板与间隔层层叠而得到的层叠体从沿层叠方向的方向观察时,以与电极的至少一部分重叠的方式在间隔层上设置有狭缝。另外,电极的与狭缝对应的部分是指:例如,对将基板与间隔层层叠而得到的层叠体从沿层叠方向的方向观察时,电极中与狭缝重叠的部分。另外,亲水性过滤器覆盖电极的至少与狭缝对应的部分包含:亲水性过滤器直接覆盖电极的该部分(接触的状态下)的构成、以及间接地(不接触的状态下)覆盖电极的该部分的构成这两者。
以下,对于本实施方式的生物传感器芯片的构成例,一边参照附图,一边进行说明。
[第1构成例]
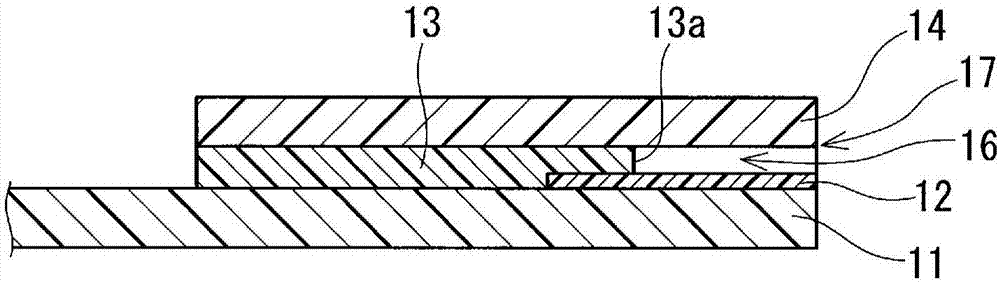
在图1a和图1b中示出生物传感器芯片的一个构成例(第1构成例)。需要说明的是,图1a为生物传感器芯片的分解透视示意图,图1b为图1a的i-i线剖视图。图1a和图1b所示的生物传感器芯片1具有电极基板11、亲水性过滤器12、间隔层13和覆盖膜14。在电极基板11的第1主面11a上设置有包含一对电极(第1电极151、第2电极152)和规定的布线153的电极图案15。亲水性过滤器12以在电极基板11的第1主面11a上且覆盖电极151、152的方式配置。需要说明的是,电极151、152中被亲水性过滤器12覆盖的部分只要为至少与形成于间隔层13的后述的狭缝13a对应的部分即可,换言之,只要为不被间隔层13覆盖且有可能与血液试样接触的部分即可。第1构成例中,亲水性过滤器12配置在整个后述的试样流路16上,为与间隔层13的后述的狭缝13a基本相同的形状,且具有大于狭缝13a的尺寸(第1构成例中,稍大的尺寸)。在配置有亲水性过滤器12的电极基板11的第1主面11a上配置有间隔层13。间隔层13为用于形成试样流路16的间隔层,并且具有设置在电极151、152的至少与狭缝13a对应的部分的狭缝13a。此外,间隔层13也作为使电极基板11与覆盖膜14一体化的接合材料起作用。另外,以狭缝13a的边缘位于比亲水性过滤器12的外缘更靠内侧的方式配置间隔层13,通过间隔层13将亲水性过滤器12与电极基板11接合。覆盖膜14配置在间隔层13上,并且与电极基板11的第1主面11a相对。通过电极基板11、间隔层13的狭缝13a和覆盖膜14而形成的区域成为试样流路16,电极基板11、间隔层13和覆盖膜14的层叠体的侧面上的试样流路16的开口成为试样引入口17(参照图1(b))。需要说明的是,在试样流路16中,在与试样引入口17相反侧的任意位置形成有通气孔(未图示)。利用毛细管现象将血液试样从试样引入口17引入至试样流路16内部(与试样引入口17相反侧的端部),并且经由亲水性过滤器12而到达电极151、152。
以下,对于生物传感器芯片1的各构成要素更详细地进行说明。
(电极基板11)
电极基板11可以通过以下方式形成:在至少一个主面具有绝缘性的支撑基板上,利用导电材料印刷包含第1电极151、第2电极152和规定的布线153的电极图案15。对于支撑基板而言,可以使用树脂基板等、生物传感器芯片中用作构成电极基板的支撑基板的公知的基板。另外,支撑基板可以为多层结构,在这种情况下,只要作为至少一个主面的最外层由具有绝缘性的材料形成即可。
对于作为一对电极的第1电极151和第2电极152而言,一个作为工作电极起作用,另一个作为对电极起作用。与第1电极151连接的布线和与第2电极152连接的布线各自延伸至端子(未图示)。电极图案15只要使用生物传感器芯片中用于电极等的公知的材料、利用公知的方法制作即可,因此其材料和制作方法没有特别限定。另外,不需要用相同的材料形成电极、布线和端子,也可以使用不同的材料。另外,电极和布线的图案、以及电极的数量也不限定于图1所示的方式,可以根据生物传感器装置的测定方式等适当选择。例如,作为电极图案15的变形例,布线153并不朝向电极基板11的前端延伸,可以在途中弯曲而朝向侧端部延伸(第1构成例的变形例1)。需要说明的是,变形例1中,也可以改变间隔层13中的狭缝13a的延伸方向以使得与电极151、152的位置对应。由此,在变形例1中,试样流路16延伸的方向也不同,此外,亲水性过滤器12的配置位置也可以根据电极151、152的位置和狭缝13a的延伸方向进行适当变更。
在电极151、152中至少作为工作电极起作用的电极的表面,例如可以通过涂布包含酶和电子载体的试剂而形成反应层(未图示)。此处,对于生物传感器芯片中的酶和电子载体的行为,简单地进行说明。需要说明的是,此处列举血液试样中的测定对象成分为血糖(葡萄糖)的情况作为例子进行说明。血液试样到达涂布有包含酶和电子载体的试剂的电极的表面时,酶将血液中的葡萄糖氧化,并且酶自身被还原。还原状态的酶通过与电子载体(氧化状态)的氧化还原反应而使电子载体成为还原状态。该还原状态的电子载体到达电极表面,在施加有电位的电极的表面发生电子载体的氧化反应,由此电流在电极间流动。需要说明的是,此时流动的电流取决于血液中的葡萄糖浓度,因此通过该电流值可以间接地测定血液中的葡萄糖浓度(血糖值)。
对于用于葡萄糖浓度的测定的酶而言,可以列举例如:葡萄糖氧化酶、葡糖脱氢酶和葡萄糖脱氢酶等生物传感器中用于葡萄糖浓度的测定的公知的酶。另外,对于用于葡萄糖浓度的测定的电子载体而言,可以列举例如:二茂铁、二茂铁衍生物、醌、醌衍生物、有机导电性盐和氯化六氨合钌(iii)等生物传感器中用于葡萄糖浓度的测定的公知的电子载体。另外,在测定对象成分为胆固醇等除葡萄糖以外的成分的情况下,只要使用与各成分对应的公知的酶和电子载体即可。
需要说明的是,在酶和电子载体包含于亲水性过滤器12中的情况下,也可以省略在电极151、152的表面形成反应层的操作。
(亲水性过滤器12)
亲水性过滤器12的厚度优选为50μm以下。通过将亲水性过滤器12的厚度设定为50μm以下,可以将亲水性过滤器12设置在试样流路16的内部而不会与公知的生物传感器芯片的试样流路相比大幅扩大试样流路16。此外,如果将亲水性过滤器12的厚度设定为50μm以下,则亲水性过滤器12的体积占试样流路16的比例不会变得过高,因此不阻碍向试样流路16中的血液试样的引入,此外,这样的薄的过滤器可以不进行加压的情况下实现有效的过滤。因此,通过使用厚度50μm以下的亲水性过滤器,可以保持与以往的生物传感器芯片相同程度的测定速度。需要说明的是,亲水性过滤器12的厚度的下限值并没有特别限定。但是,为了使厚度均匀从而防止过滤器内的功能的变动,亲水性过滤器12的厚度优选为5μm以上。
可以使用多孔膜作为亲水性过滤器12。多孔膜的孔径例如优选为5μm以下,更优选小于1μm,特别优选小于0.5μm。通过使用孔径为5μm以下的多孔膜作为亲水性过滤器12,亲水性过滤器12可以更可靠地捕获血液试样中的红血球。如果使用孔径小于1μm的多孔膜作为亲水性过滤器12,则可以进一步可靠地捕获血液试样中的红血球,如果使用孔径小于0.5μm的多孔膜,则可以更进一步可靠地捕获红血球。另外,孔径的下限值并没有特别限定。但是,考虑到血液的渗透速度,多孔膜的孔径优选为0.05μm以上。
亲水性过滤器12的材料并没有特别限定,可以使用例如:聚乙烯和聚丙烯等聚烯烃树脂、聚甲基丙烯酸甲酯(pmma)和聚丙烯腈(pan)等丙烯酸类树脂或甲基丙烯酸类树脂、聚对苯二甲酸乙二醇酯(pet)等聚酯树脂、环氧树脂、聚砜、聚醚砜、乙酸纤维素等改性纤维素、纤维素、聚偏二氟乙烯(pvdf)、以及聚四氟乙烯(ptfe)等树脂材料。在使用包含不具有亲水性的树脂材料的多孔膜的情况下,可以对多孔膜的表面实施亲水化处理。作为亲水化处理,可以列举例如:在多孔膜的表面涂布表面活性剂、对多孔膜的表面进行等离子体处理、用亲水性材料涂布多孔膜的表面(上浆处理)等。需要说明的是,用于亲水化处理的表面活性剂可以从在生物领域中使用的表面活性剂中适当选择,并没有特别限定。作为用于亲水性过滤器12的亲水化处理的表面活性剂,可以列举例如:作为非离子型表面活性剂的“tritonx-100”、“tritonx-114”、“tween20”、“tween60”、“tween80”等。需要说明的是,在使用包含具有亲水性的材料的多孔膜的情况下,虽然不需要进行亲水化处理,但是为了进一步提高亲水性,也可以进行亲水化处理。
亲水性过滤器12可以包含酶和电子载体。酶和电子载体如上述所说明的。通过使酶和电子载体包含于亲水性过滤器12中,不需要在电极151、152的表面形成反应层。此外,该构成的情况与血液试样到达电极151、152的表面上的反应层后发生反应并进行测定的情况相比,血液试样在通过亲水性过滤器12的同时还均匀地发生反应,测定速度和测定精度提高。
第1构成例中的亲水性过滤器12如图1所示配置于整个试样流路16上,为与形成于间隔层13的狭缝13a基本相同的形状,并且具有比狭缝13a稍大的尺寸。但是,只要亲水性过滤器12至少覆盖在电极151、152上即可,其形状并不限定于此。
对于图1所示的亲水性过滤器12而言,以亲水性过滤器12的端部处于与电极基板11、间隔层13和覆盖膜14的前端基本相同的位置的方式设置,亲水过滤器12的端部也可以位于比电极基板11、间隔层13和覆盖膜14的前端更靠外侧的位置(第1构成例的变形例2)。根据该变形例2,从芯片的前端延伸出来的亲水性过滤器12的端部成为血液试样引入部分,可以更顺利地将血液试样引入试样流路16。
另外,也可以以亲水性过滤器12覆盖包含电极基板11的设置有电极151、152的部分的更广的区域的方式,将亲水性过滤器12形成为具有与例如电极基板11的前端部相同的形状的形状,并且以使电极基板11的前端与过滤器12的端部对齐的方式将亲水性过滤器12配置在电极基板11上(第1构成例的变形例3)。另外,在这种情况下,可以利用电极基板11上的未设置有电极图案15的部分,通过胶粘剂将亲水性过滤器12与电极基板11接合。根据该变形例3,可以更有效地进行从血液试样中除去红血球,因此可以得到使到达电极151、152的血液试样进一步除去了红血球的试样。
另外,也可以通过在电极151、152的表面涂布用于形成反应层的试剂,并且在该涂膜上配置亲水性过滤器12后使该涂膜干燥等工序,从而将亲水性过滤器12固定在电极基板11上。在这种情况下,不需要通过间隔层13将亲水性过滤器12与电极基板11接合。因此,在这种情况下,也可以将亲水性过滤器12的形状和大小设定为与间隔层13的狭缝13a相同,或者例如为了仅配置在与电极对应的部分而将其设定为小于狭缝13a(第1构成例的变形例4)。
(间隔层13)
间隔层13中,通过狭缝13a而构成了试样流路16。试样流路16的流路截面由狭缝13a的宽度的大小以及间隔层13的厚度来确定。狭缝13a的宽度可以设定为例如0.2mm~5mm。另外,间隔层13的厚度可以设定为例如0.1mm~1mm。
间隔层13通过将电极基板11、亲水性过滤器12和覆盖膜14彼此接合而一体化。因此,对于间隔层13而言,适合使用例如双面胶带等在片基材的两表面具有粘合层的片状的接合材料。在使用这样的接合材料的情况下,片基材优选为亲水性。片基材在狭缝13a的侧面露出并面向试样流路16,因此通过为亲水性,更易于将血液试样引入试样流路16。
需要说明的是,本实施方式中,狭缝13a的一端延伸至间隔层13的前端,狭缝13a在间隔层13的侧面开口。但是,狭缝13a的形状并不限定于此,狭缝13a的一端也可以不延伸至间隔层13的前端,即狭缝13a在间隔层13的侧面不开口。
(覆盖膜14)
对于覆盖膜14而言,可以使用例如聚对苯二甲酸乙二醇酯(pet)薄膜等生物传感器中用作覆盖膜的公知的薄膜。如上所述,亲水性过滤器12担负用于利用毛细管现象将血液试样引入试样流路16内的辅助的作用。因此,作为覆盖膜14,也可以使用未实施亲水化处理的薄膜。需要说明的是,也可以在覆盖膜14的前端部分设置槽(未图示),从而形成易于将血液试样引入试样流路16的构成(第1构成例的变形例5)。
[第2构成例]
接着,对于本实施方式的生物传感器芯片的另一构成例(第2构成例),一边参照图2a和图2b,一边进行说明。需要说明的是,图2a为生物传感器芯片的分解透视示意图,图2b为图2a的ii-ii线剖视图。需要说明的是,对于与第1构成例的生物传感器芯片1相同的构成,赋予相同的构件编号并省略其说明。
图2a和图2b所示的第2构成例的生物传感器芯片2与图1所示的生物传感器芯片1的不同点在于:亲水性过滤器21的形状与亲水性过滤器12不同,并且还包含配置于亲水性过滤器21与电极基板11之间的、将亲水性过滤器21与电极基板11接合的接合材料21。因此,关于生物传感器芯片2,仅对亲水性过滤器21和接合材料22进行说明。
(亲水性过滤器21)
亲水性过滤器21具有与间隔层13和覆盖膜14基本相同的外形形状。即,亲水性过滤器21覆盖包含电极基板11的设置有电极151、152的部分的更广的区域。需要说明的是,除了形状以外,亲水性过滤器21与亲水性过滤器12相同,因此此处省略说明。
(接合材料22)
对于接合材料22而言,在与间隔层13的狭缝13a对应的部分、即对将间隔层13与接合材料22层叠而得到的层叠体从沿层叠方向的方向观察时与狭缝13a重叠的部分,以不阻碍血液试样到达电极151、152的流路的方式,具有与狭缝13a基本相同的形状的狭缝22a。该狭缝22a的空隙(由狭缝22a形成的开口)作为构成试样流路的一部分的通孔起作用。由此,可以在不阻碍血液试样到达电极151、152的表面的流路的情况下将亲水性过滤器21牢固地固定于电极基板11。对于接合材料22而言,适合使用例如双面胶带等在片基材的两表面具有粘合层的片状的接合材料。需要说明的是,狭缝22a可以不必具有与狭缝13a基本相同的形状,只要以不截断到达电极151、152的血液试样的流动的方式形成即可。需要说明的是,接合材料22的形状并不限定于图2所示的形状。例如,也可以以接合材料22不截断试样流路16的方式将接合材料22分割成多个部分(第2构成例的变形例1)。
[第3构成例]
接着,对于本实施方式的生物传感器芯片的另一构成例(第3构成例),一边参照图3a和图3b,一边进行说明。需要说明的是,图3a为生物传感器芯片的分解透视示意图,图3b为图3a的iii-iii线剖视图。需要说明的是,对于与第1构成例的生物传感器芯片1相同的构成,赋予相同的构件编号并省略其说明。
图3a和图3b所示的第3构成例的生物传感器芯片3与图1所示的生物传感器芯片1的不同点在于:还包含配置于亲水性过滤器12与电极基板11之间的、覆盖电极基板11的前端部分的电极基板覆盖膜31,并且该电极基板覆盖膜31通过胶粘剂32与电极基板11接合。因此,关于生物传感器芯片2,仅对电极基板覆盖膜31进行说明。
(电极基板覆盖膜31)
电极基板覆盖膜31的外形与电极基板11的前端部分的外形基本相同,并且覆盖电极基板11的前端部分。但是,在电极基板覆盖膜31的与电极151、152重叠的部分(对将电极基板11与电极基板覆盖膜31层叠而得到的层叠体从沿层叠方向的方向观察时,至少与电极151、152的一部分重叠的部分)设置有开口31a,以使得血液试样到达电极151、152的表面的流路不会被电极基板覆盖膜31阻碍。对于电极基板覆盖膜31而言,可以使用例如pet薄膜等能够用作覆盖膜14的薄膜。电极基板覆盖膜31的厚度并没有特别限定,可以设定为例如50μm~300μm。
[第4构成例]
接着,对于本实施方式的生物传感器芯片的另一构成例(第4构成例),一边参照图4a和图4b,一边进行说明。需要说明的是,图4a为生物传感器芯片的分解透视示意图,图4b为图4a的iv-iv线剖视图。需要说明的是,对于与第1构成例的生物传感器芯片1相同的构成,赋予相同的构件编号并省略其说明。
图4a和图4b所示的第4构成例的生物传感器芯片4与图1所示的生物传感器芯片1不同点在于:还包含配置于亲水性过滤器12与电极基板11之间的、将亲水性过滤器12与电极基板11接合的接合材料41。因此,关于生物传感器芯片4,仅对接合材料41进行说明。
(接合材料41)
对于接合材料41而言,在与间隔层13的狭缝13a对应的部分、即在对将间隔层13与接合材料41层叠而得到的层叠体从沿层叠方向的方向观察时与狭缝13a重叠的部分,以不阻碍血液试样到达电极151、152的流路的方式,具有与狭缝13a基本相同形状的狭缝41a。该狭缝41a的空隙(由狭缝41a形成的开口)作为构成试样流路的一部分的通孔起作用。但是,设置于接合材料41的狭缝41a与间隔层13的狭缝13a不同,狭缝41a的一端未延伸至接合材料41的前端,在接合材料41的侧面未开口而是封闭的。通过设置于接合材料41的狭缝41a,可以在不阻碍血液试样到达电极151、152的表面的流路的情况下将亲水性过滤器12牢固地固定于电极基板11上。此外,在接合材料41上设置有与狭缝41a的空隙的内部连通的排气孔41b。通过设置这样的排气孔41b,即使为具有狭缝41a的一端(芯片4的前端侧的一端)未延伸至接合材料41的前端而封闭的构成的接合材料41,在试样向亲水性过滤器12渗透时,狭缝41a的空隙的内部的空气从排气孔41b排出至芯片4外,因此可以防止试样向亲水性过滤器12的渗透变慢。需要说明的是,对于接合材料41而言,适合使用例如双面胶带等在片基材的两表面具有粘合层的片状的接合材料。需要说明的是,狭缝41a可以不必具有与狭缝13a基本相同的形状,只要以不截断到达电极151、152的血液试样的流动的方式形成即可。需要说明的是,接合材料41的形状并不限定于图4所示的形状。例如,可以以接合材料41不截断试样流路16的方式将接合材料41分割成多个部分(第4构成例的变形例1)。另外,接合材料41的排气孔41b的形状只要能够排出气体并且不漏出血浆就没有特别的限定。因此,如图4a所示,可以在接合材料41上设置2个以上排气孔41b,也可以为1个。
[第5构成例]
接着,对于本实施方式的生物传感器芯片的另一构成例(第5构成例),一边参照图5a和图5b,一边进行说明。需要说明的是,图5a为生物传感器芯片的分解透视示意图,图5b为图5a的v-v线剖视图。需要说明的是,对于与第1构成例的生物传感器芯片1相同的构成,赋予相同的构件编号并省略其说明。
图5a和图5b所示的第5构成例的生物传感器芯片5与图1所示的生物传感器芯片1不同点在于:电极基板51的形状与电极基板11不同,以及还包含配置于亲水性过滤器12与电极基板51之间的、将亲水性过滤器12与电极基板51接合的接合材料52。因此,关于生物传感器芯片5,仅对电极基板51和接合材料52进行说明。需要说明的是,为了便于说明,首先对接合材料52进行说明,接着对电极基板51进行说明。
(接合材料52)
对于接合材料52而言,在与间隔层13的狭缝13a对应的部分、即在对将间隔层13与接合材料52层叠而得到的层叠体从沿层叠方向的方向观察时与狭缝13a重叠的部分,以不阻碍血液试样到达电极151、152的流路的方式,具有与狭缝13a基本相同形状的狭缝52a。该狭缝52a的空隙(由狭缝52a形成的开口)作为构成试样流路的一部分的通孔起作用。但是,设置于接合材料52的狭缝52a与间隔层13的狭缝13a不同,狭缝52a的一端未延伸至接合材料52的前端,在接合材料52的侧面未开口而是封闭的。通过设置于接合材料52的狭缝52a,可以在不阻碍血液试样到达电极151、152的表面的流路的情况下将亲水性过滤器12牢固地固定于电极基板11上。需要说明的是,对于接合材料52而言,适合使用例如双面胶带等在片基材的两表面具有粘合层的片状的接合材料。需要说明的是,狭缝52a不必具有与狭缝13a基本相同的形状,只要以不截断到达电极151、152的血液试样的流动的方式形成即可。需要说明的是,接合材料52的形状并不限定于图5所示的形状。例如,可以以接合材料52不截断试样流路16的方式将接合材料52分割成多个部分(第5构成例的变形例1)。
(电极基板51)
在电极基板51上设置有贯穿电极基板51的排气孔51a。需要说明的是,电极基板51除了设置有该排气孔51a这一点以外具有与电极基板11相同的构成,因此此处仅对排气孔51a进行说明。排气孔51a设置在其内部空间可以与设置于接合材料52的狭缝52a的空隙的内部连通的位置。通过将这样的排气孔51a设置于电极基板51,即使在使用具有狭缝52a的一端(芯片5的前端侧的一端)未延伸至接合材料52的前端且封闭的构成的接合材料52的情况下,在试样向亲水性过滤器12渗透时也可以将狭缝52a的空隙的内部的空气从排气孔51b排出至芯片5外,因此可以防止试样向亲水性过滤器12的渗透变慢。需要说明的是,对于电极基板51的排气孔51a的形状而言,只要排出气体且不损害作为电极基板的功能,就没有特别的限定。因此,如图5a所示,可以在电极基板51上仅设置1个排气孔51a,也可以设置2个以上。
以上,对本实施方式的生物传感器芯片的各构成例进行了说明,但是本发明的生物传感器芯片并不限定于以上的构成例。例如,电极基板11、51中,作为感应血液试样的手段,可以设置感应血液试样的感应部来代替电极151、152。另外,狭缝13a的形状只要为可以利用毛细管现象引入血液试样的形状即可,因此并不限定于如图1a、2a、3a、4a和5a所示的直线状的狭缝。狭缝13a也可以为例如曲线状,也可以为锯齿状弯曲的形状,此外还可以为直线状、曲线状或弯曲形状的组合。
本发明的生物传感器芯片并不限定于本实施方式,例如还包含如下规定的生物传感器芯片a和b,在以下规定的生物传感器芯片a和b的范围内,可以对各构成进行各种各样的变更而实施。
(生物传感器芯片a)
一种生物传感器芯片,其包含:
基板,所述基板在第1主面上设置有电极;
覆盖膜,所述覆盖膜与所述基板的所述第1主面相对地配置;以及
间隔层,所述间隔层配置于所述基板与所述覆盖膜之间,并且作为使所述基板与所述覆盖膜一体化的接合材料起作用;
所述间隔层设置有狭缝,所述狭缝构成试样引入口和试样流路,所述试样引入口设置于所述基板、所述间隔层和所述覆盖膜的层叠体的侧面,所述试样流路用于利用毛细管现象使试样流向所述电极,
在所述间隔层的所述狭缝与所述基板的所述电极的试样感应部之间设置有亲水性过滤器。
(生物传感器芯片b)
一种生物传感器芯片,其包含:
基板,所述基板在第1主面上设置有感应血液试样的感应部;
覆盖膜,所述覆盖膜与所述基板的所述第1主面相对地配置;
间隔层,所述间隔层配置于所述基板与所述覆盖膜之间,具有利用毛细管现象引入所述血液试样的试样流路,并且作为使所述基板与所述覆盖膜一体化的接合材料起作用;以及
亲水性过滤器,所述亲水性过滤器配置于所述间隔层与所述基板之间,并且设置于要到达所述感应部的所述血液试样经过的位置。
[生物传感器装置]
接着,对于本发明的生物传感器装置的实施方式进行说明。如图6所示,本实施方式的生物传感器装置6包含:装置主体部7、以及可拆卸地安装于装置主体部7的图1所示的生物传感器芯片1。装置主体部7包含:基于流过生物传感器芯片1的一对电极151、152间的电流值而检测试样中的检测物质的检测部(未图示)、对由检测部得到的检测结果进行分析的分析部(未图示)、以及将由分析部得到的分析结果显示为测定值的显示部8。需要说明的是,也可以使用生物传感器芯片2、3、4、5来代替生物传感器装置6中的生物传感器芯片1。
需要说明的是,此处,对于生物传感器芯片可拆卸地设置于生物传感器装置的装置主体部的构成、即仅生物传感器芯片为一次性部件的例子进行了说明,但是并不限定于此。例如,生物传感器芯片本身可以还包含:基于流过一对电极间的电流值而检测试样中的检测物质的检测部、对由检测部得到的检测结果进行分析的分析部、以及将由分析部得到的分析结果显示为测定值的显示部。由此,生物传感器芯片本身能够成为不需要装置主体部的测定装置。在生物传感器芯片本身成为测定装置的情况下,也可以将测定装置本身作为一次性的。
实施例
接着,对于本发明的生物传感器芯片,利用实施例具体地进行说明。
[过滤器的制作]
(过滤器a)
在3l的圆筒形的塑料容器中使jer(注册商标)828(双酚a型环氧树脂、三菱化学株式会社制造、环氧当量184g/eq.~194g/eq.)100重量份、tetrad(注册商标)-c(缩水甘油胺型环氧树脂、三菱瓦斯化学株式会社制造、环氧当量95g/eq.~110g/eq.)25重量份溶解于聚丙二醇(株式会社艾迪科制造、adekapolyetherp-400)211.9重量份中,从而制备环氧树脂/聚丙二醇溶液。然后,在该塑料容器中添加1,6-二氨基己烷22.3重量份,从而制备环氧树脂/胺/聚丙二醇溶液。然后,使用行星搅拌装置(株式会社新基制造、商品名“あわとり練太郎(注册商标)”),在约0.7kpa下进行真空脱泡,同时在自转/公转比率3/4的条件下,以公转800rpm的比率进行搅拌10分钟,重复2次该步骤。然后,自然冷却数日,从塑料容器中取出环氧树脂块,使用切削车床装置,以16μm的厚度连续地切片而得到环氧树脂片。将该环氧树脂片浸渍于加热至40℃的ro水中进行清洗,然后再浸渍于80℃的ro水中进行清洗。将清洗后的环氧树脂片浸渍于聚氧化乙烯(10)辛基苯基醚的0.5体积%水溶液中而进行亲水化,除去表面的液体并使其风干。将得到的环氧树脂多孔膜作为过滤器a。得到的过滤器a的孔径为0.4μm。
(过滤器b)
除了未实施使用聚氧化乙烯(10)辛基苯基醚的水溶液的亲水化处理以外,通过与过滤器a同样的方法制作了过滤器b。
(过滤器c)
除了使用将葡萄糖氧化酶go-na(天野酶制造)50mg溶解于“tween60”的0.5体积%水溶液10g中而得到的液体代替聚氧化乙烯(10)辛基苯基醚的0.5体积%水溶液实施亲水化处理以外,通过与过滤器a同样的方法制作了过滤器c。
[参考例a]
(测试单元的制作)
在载玻片上,使用厚度120μm的双面胶带(日东电工公司制造、no.5015)和聚丙烯(pp)薄膜(厚度200μm),制作具有如图7所示的截面结构的带流路的测试单元100。图7中,101表示载玻片、102表示双面胶带、103表示pp薄膜、104表示流路。图8为该测试单元100的俯视图。将流路104的一个开口用作水的引入口104a,将另一个开口用作通气孔104b,从而形成不阻碍水向流路104中的进入的结构。流路104的宽度为1mm、长度为25mm。在室温下,向流路104的引入口滴加约20μl的ro水,测定ro水进入经过流路104的长度25mm之中的中央部分10mm的距离的时间,并定义为渗透时间。需要说明的是,使用的pp薄膜对ro水具有103°的接触角,具有充分的疏水性。
(实施参考例1)
将过滤器a切割成与测试单元100的流路104相同的形状,将其如图9所示作为过滤器105设置在流路104内,并测定渗透时间,结果是0.8秒。
(比较参考例1)
直接使用图7所示的测试单元100,即在流路104内未设置任何部件的情况下测定渗透时间。但是,未发生ro水向流路104中的渗透,因而无法测定渗透时间。
(比较参考例2)
将过滤器b切割成与测试单元100的流路104相同的形状,将其如图9所示作为过滤器105设置在流路104内,并测定渗透时间。但是,未发生ro水向流路104中的渗透,因而无法测定渗透时间。
根据实施参考例1和实施比较例1、2的结果确认了:ro水等亲水性液体向使用了测试单元的流路中的引入时,亲水性过滤器作为辅助毛细管现象的构件有效地发挥作用。
[参考例b]
(测试单元的制作)
使用与参考例a的测试单元100相同的材料,制作了具有如图10的俯视图和图11a和11b的剖视图所示的结构的带流路的测试单元200。图11a为图10的a-a线剖视图,图11b为图10的b-b线剖视图。需要说明的是,图10以及图11a和11b表示在测试单元200中设置有过滤器105的状态。测试单元200与测试单元100不同,在比设置过滤器105的位置更靠下侧的部分,也以1mm的宽度形成了流路106。除了设置有流路106以外,测试单元200具有与测试单元100相同的结构。需要说明的是,对于该流路106而言,向测试单元200的引入口104a滴加水时,其成为透过所设置的过滤器105的水进入的区域,因此,以下记载为透过侧流路106。另外,作为另一测试单元,制作了相对于测试单元200还设置有与透过侧流路106的内部空间连通的宽度约0.5mm的通气孔107的测试单元300。图12为表示在测试单元300中设置有过滤器105的状态的俯视图。
(实施参考例2)
如图11b所示,配置过滤器a以使其覆盖测试单元200的透过流路106,并且将其用双面胶带固定至测试单元200,从而制成过滤器105。在室温下,向流路104的引入口104a滴加约20μl的ro水,确认向透过侧流路106中的ro水渗透性。ro水透过过滤器a并进入透过侧流路106,但是最终残留有气泡,无法完全充满透过侧流路106。
(实施参考例3)
与实施参考例2同样地,配置过滤器a以使其覆盖测试单元300的透过侧流路106,并且将其用双面胶带固定至测试单元300,从而制成过滤器105。在室温下,向流路104的引入口104a滴加约20μl的ro水,确认向透过侧流路106中的ro水渗透性。ro水透过过滤器a并快速进入透过侧流路106,无气泡残留,可以充满透过侧流路106。
根据实施参考例2和3的结果确认了:在相对于亲水性过滤器成为水的透过侧的部分也设置有流路的情况下,为了ro水等亲水性液体有效地进入流路内,优选设置通气孔、即排气孔。
[实施例1]
准备具有宽度1mm、长度5mm、高度200μm的试样流路的市售的血糖值测定用生物传感器芯片(泰博科技公司制造)。除去该生物传感器芯片的最上表面的覆盖膜,代替该覆盖膜而粘贴用于测试单元100的pp薄膜,并开设通气孔。此外,将过滤器a切割成宽度1mm、长度5mm,并一边使试样流路的前端与过滤器端部对齐,一边将其嵌入试样流路内,从而制成实施例1的生物传感器芯片。即,实施例1的生物传感器芯片的覆盖膜为疏水性薄膜,此外在试样流路内设置了亲水性过滤器。使该生物传感器芯片的试样流路的引入口接触成人男性血液,并测定通过流路长度5mm的时间。血液被试样流路吸入,用0.4秒完成向流路长度5mm的试样流路中的渗透。可见,对于在试样流路内设置有亲水性过滤器的生物传感器芯片而言,通过过滤器可以从到达电极的血液中减少红血球,此外,虽然覆盖膜为疏水性并且在试样流路内设置有过滤器,但是可以在无阻碍的情况下顺利地实现血液向试样流路内的渗透。
[实施例2]
除了使用过滤器c代替过滤器a以外,以与实施例1同样的方式制作了生物传感器芯片。使成人男性血液接触引入口,并测定通过流路长度5mm的时间,结果用0.5秒完成了向试样流路中的渗透。
[比较例1]
准备实施例1中使用的市售的血糖值测定用生物传感器芯片。除去该生物传感器芯片的最上表面的覆盖膜,代替该覆盖膜而粘贴用于测试单元100的pp薄膜,并开设通气孔。由此,制作覆盖膜为疏水性薄膜的比较例1的生物传感器芯片。使成人男性血液接触该生物传感器芯片的试样流路的引入口,但是血液附着并停留在引入口附近,未向试样流路内渗透。
产业实用性
本发明的生物传感器芯片和生物传感器装置可以以更高的精度测定例如血液试样中的成分(例如血糖)的浓度,因此作为smbg用的芯片和装置是有用的。
- 还没有人留言评论。精彩留言会获得点赞!