一种利用聚苯乙烯球的细胞周期散射光强模型建立方法与流程
本发明涉及生物检测技术领域,尤其涉及细胞检测技术,具体涉及一种利用聚苯乙烯球的细胞周期散射光强模型建立方法。
背景技术:
细胞周期是指细胞从一次分裂完成开始到下一次分裂结束所经历的全过程,分为间期与分裂期两个阶段。其中,间期又分为三期、即dna合成前期(g1期)、dna合成期(s期)与dna合成后期(g2期)。分裂期(m期)分为前期、中期、后期和末期。
细胞周期理论不仅为肿瘤的研究提供重要的理论依据,而且细胞周期是肿瘤化疗的理论基础。精准的抗肿瘤药物可以直接针对不同周期的癌细胞进行灭杀,从而达到治疗的目的。因此,利用相关散射光强技术对不同周期的癌细胞进行分析测量对癌症的治疗诊断具有重要意义。
在利用散射光强技术对活体生物细胞周期进行检测时,其标准散射光强信息的建立至关重要。然而,由于活体生物细胞在培养器皿内难以永久的存活,并且生物细胞在存活期间也会不断分裂生长而导致细胞周期不断变化,因此很难利用生物细胞制作和保存每个固定细胞周期的散射光强检测参照标准。目前尚无其他有效的细胞周期散射光强模型建立方法。
技术实现要素:
针对现有技术中存在的上述不足,本发明的目的在于提供一种利用聚苯乙烯球的细胞周期散射光强模型建立方法,其利用不同粒径聚苯乙烯球的悬液建立各个不同细胞周期的细胞周期散射光强模型,能够用以作为永久保存的对活体生物细胞周期进行散射光强检测的参照标准,解决现有技术中永久保存的细胞周期散射光强检测参照标准难以制作的问题。
为解决上述技术问题,本发明采用了如下的技术方案:
一种利用聚苯乙烯球的细胞周期散射光强模型建立方法,预先制作具有指定浓度的不同粒径聚苯乙烯球的悬液,利用广角光散射仪分别进行散射光强度测量,得到各不同粒径聚苯乙烯球的悬液各自对应的散射光强度分布曲线;然后采用各不同细胞周期的细胞样品分别制成具有同样指定浓度的对应各不同细胞周期的细胞悬液,在相同测量条件下利用广角光散射仪分别进行散射光强度测量,得到各个细胞周期的细胞悬液各自对应的散射光强度分布曲线,并与预先得到的各不同粒径聚苯乙烯球的悬液的散射光强度分布曲线进行对比,分别确定各个不同细胞周期的细胞悬液的散射光强度分布曲线各自所匹配的聚苯乙烯球悬液,从而将匹配得到的各粒径聚苯乙烯球的悬液作为细胞周期散射光强模型。
上述利用聚苯乙烯球的细胞周期散射光强模型建立方法中,具体而言,具体包括下述步骤:
1)预先制作具有指定浓度的不同粒径聚苯乙烯球的悬液并装入玻璃试管内,分别摇匀后,利用广角光散射仪分别测量每种粒径聚苯乙烯球的悬液在0~180°范围内每间隔5°上的散射光强度,根据测量结果,得到各不同粒径聚苯乙烯球的悬液各自对应的散射光强度分布曲线;
2)采用g1期、s期、g2期和m期的细胞样品,分别制成具有同样指定浓度的对应g1期、s期、g2期和m期的细胞悬液并装入玻璃试管内,分别摇匀后,在相同测量条件下,利用广角光散射仪分别测量每个细胞周期的细胞悬液在0~180°范围内每间隔5°上的散射光强度,根据测量结果,得到g1期、s期、g2期和m期的细胞悬液各自对应的散射光强度分布曲线;
3)将g1期、s期、g2期和m期的细胞悬液各自对应的散射光强度分布曲线与预先得到的各不同粒径聚苯乙烯球的悬液的散射光强度分布曲线进行对比,分别确定g1期、s期、g2期和m期的细胞悬液的散射光强度分布曲线各自所匹配的聚苯乙烯球悬液,从而将匹配得到的各粒径聚苯乙烯球的悬液作为细胞周期散射光强模型。
上述利用聚苯乙烯球的细胞周期散射光强模型建立方法中,作为优选方案,所述步骤1)中,在测量每种粒径聚苯乙烯球的悬液的散射光强度分布曲线时,重复测量5~10次相应粒径聚苯乙烯球的悬液在0~180°范围内每间隔5°上的散射光强度,剔除其中离均差率的绝对值大于10%的散射光强度值,再将该散射角度上其它次测量所得的散射光强度值求平均,得到该粒径聚苯乙烯球的悬液在相应射角度上的散射光强度平均值,从而分别得到该粒径聚苯乙烯球的悬液在0°~180°散射角范围内每间隔5°上的散射光强度平均值,并进行曲线数据拟合和平滑滤波处理,得到该粒径聚苯乙烯球的悬液所对应的散射光强度分布曲线。
上述利用聚苯乙烯球的细胞周期散射光强模型建立方法中,作为优选方案,所述步骤2)中,在测量每个细胞周期的细胞悬液的散射光强度分布曲线时,重复测量5~10次该细胞周期的细胞悬液在0~180°范围内每间隔5°上的散射光强度,剔除其中离均差率的绝对值大于10%的散射光强度值,再将该散射角度上其它次测量所得的散射光强度值求平均,得到该细胞周期的细胞悬液在相应射角度上的散射光强度平均值,从而分别得到该细胞周期的细胞悬液在0°~180°散射角范围内每间隔5°上的散射光强度平均值,并进行曲线数据拟合和平滑滤波处理,最后得到该细胞周期的细胞悬液所对应的散射光强度分布曲线。
上述利用聚苯乙烯球的细胞周期散射光强模型建立方法中,作为优选方案,所制成的聚苯乙烯球的悬液的指定浓度为106个聚苯乙烯球/ml、2×105个聚苯乙烯球/ml、105个聚苯乙烯球/ml或5×104个聚苯乙烯球/ml,所制成的细胞悬液的指定浓度相对应的为106个细胞/ml、2×105个细胞/ml、105个细胞/ml或5×104个细胞/ml。
上述利用聚苯乙烯球的细胞周期散射光强模型建立方法中,作为优选方案,利用广角光散射仪进行散射光强度测量时,采用激光器作为光源。
上述利用聚苯乙烯球的细胞周期散射光强模型建立方法中,作为优选方案,所述激光器的激光波长为532nm。
相比于现有技术,本发明具有如下有益效果:
1、本发明利用聚苯乙烯球的细胞周期散射光强模型建立方法,能够利用不同粒径聚苯乙烯球的悬液建立得到用以作为对活体生物细胞周期进行散射光强检测参照标准的细胞周期散射光强模型,且聚苯乙烯球的性质稳定,也不会产生因细胞分裂生长而导致细胞周期不断变化,因此能够得以永久保存,解决了现有技术中永久保存的细胞周期散射光强检测参照标准难以制作的问题。
2、由于不同粒径聚苯乙烯微球稀释成不同梯度的浓度时,呈现出角度依赖光散射特性与细胞周期中不同时相的光散射特性相符合或经过修正后符合,因此采用本发明方法建立的细胞周期散射光强模型具有很好的普适性,为未来完善更多种类细胞周期光散射光强模型提供了可扩展的思路,具有很好的技术应用前景。
附图说明
图1为本发明利用聚苯乙烯球的细胞周期散射光强模型建立方法的流程图。
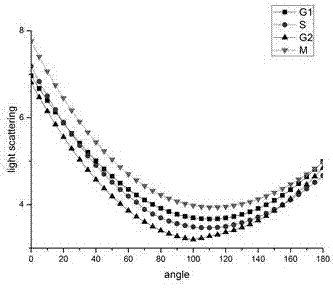
图2为实施例中g1期、s期、g2期和m期四个不同细胞周期的细胞悬液散射光强度分布曲线图。
图3为实施例中g1期的hela细胞悬液和12μm粒径聚苯乙烯球的悬液的散射光强度分布曲线对比图。
图4为实施例中s期的hela细胞悬液和14μm粒径聚苯乙烯球的悬液的散射光强度分布曲线对比图。
图5为实施例中g2期的hela细胞悬液和11μm粒径聚苯乙烯球的悬液的散射光强度分布曲线对比图。
图6为实施例中m期的hela细胞悬液和22μm粒径聚苯乙烯球的悬液的散射光强度分布曲线对比图。
具体实施方式
针对如何建立细胞周期散射光强模型的问题,经过研究发现,聚苯乙烯微球是很好的能够用以建立细胞周期散射光强模型的材料。聚苯乙烯微球是通过苯乙烯单体进行加成聚合之后形成的,特点是无色、透明,并且光学性能极好,经过重复测量实验验证,聚苯乙烯球的散射光强度分布曲线稳定,重复率高;同时,聚苯乙烯微球具有很好的耐热性能,对其进行灭菌处理也不会影响它的性能;此外,聚苯乙烯微球在水溶液中的分散性能较好,不容易发生团聚。聚苯乙烯球所具备的这些特性,体现了其能够用以模拟细胞散射光强的重要特性,是作为细胞散射光强模型的较佳选择。
基于此,本发明提供了一种利用聚苯乙烯球的细胞周期散射光强模型建立方法,其实施方式是,预先制作具有指定浓度的不同粒径聚苯乙烯球的悬液,利用广角光散射仪分别进行散射光强度测量,得到各不同粒径聚苯乙烯球的悬液各自对应的散射光强度分布曲线;然后采用各不同细胞周期的细胞样品分别制成具有同样指定浓度的对应各不同细胞周期的细胞悬液,在相同测量条件下利用广角光散射仪分别进行散射光强度测量,得到各个细胞周期的细胞悬液各自对应的散射光强度分布曲线,并与预先得到的各不同粒径聚苯乙烯球的悬液的散射光强度分布曲线进行对比,分别确定各个不同细胞周期的细胞悬液的散射光强度分布曲线各自所匹配的聚苯乙烯球悬液,从而将匹配得到的各粒径聚苯乙烯球的悬液作为细胞周期散射光强模型。
具体而言,本发明利用聚苯乙烯球的细胞周期散射光强模型建立方法流程如图1所示,包括下述步骤:
1)预先制作具有指定浓度的不同粒径聚苯乙烯球的悬液并装入玻璃试管内,分别摇匀后,利用广角光散射仪分别测量每种粒径聚苯乙烯球的悬液在0~180°范围内每间隔5°上的散射光强度,根据测量结果,得到各不同粒径聚苯乙烯球的悬液各自对应的散射光强度分布曲线。
预先分别测量得到各不同粒径聚苯乙烯球的悬液各自对应的散射光强度分布曲线,可以用于匹配制作针对不同种类细胞的细胞周期散射光强模型。在具体测量每种粒径聚苯乙烯球的悬液的散射光强度分布曲线时,可以重复测量5~10次相应粒径聚苯乙烯球的悬液在0~180°范围内每间隔5°上的散射光强度,剔除其中离均差率的绝对值大于10%的散射光强度值,再将该散射角度上其它次测量所得的散射光强度值求平均,得到该粒径聚苯乙烯球的悬液在相应射角度上的散射光强度平均值,从而分别得到该粒径聚苯乙烯球的悬液在0°~180°散射角范围内每间隔5°上的散射光强度平均值,并进行曲线数据拟合和平滑滤波处理,最后得到该粒径聚苯乙烯球的悬液所对应的散射光强度分布曲线。这样可以消除测量中各种原因引起的散射光强畸变误差,更好的确保所得的聚苯乙烯球悬液的散射光强度分布曲线的测量准确性。
2)采用g1期、s期、g2期和m期的细胞样品,分别制成具有同样指定浓度的对应g1期、s期、g2期和m期的细胞悬液并装入玻璃试管内,分别摇匀后,在相同测量条件下,利用广角光散射仪分别测量每个细胞周期的细胞悬液在0~180°范围内每间隔5°上的散射光强度,根据测量结果,得到g1期、s期、g2期和m期的细胞悬液各自对应的散射光强度分布曲线。
在具体测量每个细胞周期的细胞悬液的散射光强度分布曲线时,可以重复测量5~10次该细胞周期的细胞悬液在0~180°范围内每间隔5°上的散射光强度,剔除其中离均差率的绝对值大于10%的散射光强度值,再将该散射角度上其它次测量所得的散射光强度值求平均,得到该细胞周期的细胞悬液在相应射角度上的散射光强度平均值,从而分别得到该细胞周期的细胞悬液在0°~180°散射角范围内每间隔5°上的散射光强度平均值,并进行曲线数据拟合和平滑滤波处理,最后得到该细胞周期的细胞悬液所对应的散射光强度分布曲线。这样可以消除测量中各种原因引起的散射光强畸变误差,更好的确保所得的细胞悬液的散射光强度分布曲线的测量准确性。
3)将g1期、s期、g2期和m期的细胞悬液各自对应的散射光强度分布曲线与预先得到的各不同粒径聚苯乙烯球的悬液的散射光强度分布曲线进行对比,分别确定g1期、s期、g2期和m期的细胞悬液的散射光强度分布曲线各自所匹配的聚苯乙烯球悬液,从而将匹配得到的各粒径聚苯乙烯球的悬液作为细胞周期散射光强模型。
通过上述流程可以看到,本发明利用聚苯乙烯球的细胞周期散射光强模型建立方法,能够利用不同粒径聚苯乙烯球的悬液建立得到用以作为对活体生物细胞周期进行散射光强检测参照标准的细胞周期散射光强模型,且聚苯乙烯球的性质稳定,也不会产生因细胞分裂生长而导致细胞周期不断变化,因此能够得以永久保存,解决了现有技术中永久保存的细胞周期散射光强检测参照标准难以制作的问题。
在具体实施时,所制成的聚苯乙烯球的悬液的指定浓度可以为106个聚苯乙烯球/ml、2×105个聚苯乙烯球/ml、105个聚苯乙烯球/ml或5×104个聚苯乙烯球/ml这四种浓度,所制成的细胞悬液的指定浓度也可以相应地为106个细胞/ml、2×105个细胞/ml、105个细胞/ml或5×104个细胞/ml这四种浓度,因为这四个浓度范围的聚苯乙烯球悬液和细胞悬液,复散射不会对散射光强造成影响,并且如果浓度过低会导致散射光强很弱,不利于测量,因此选择这四种浓度作为指定浓度,有利于确保基于光散射测量确定细胞周期的重复性和稳定性。其中,作为最优选方案,指定浓度的设定最好为105个聚苯乙烯球/ml、105个细胞/ml,其好处是在该浓度下的散射光强适中,可以较为方便的观察到不同样本之间散射光强的差异。制作聚苯乙烯球的悬液时,可以采用去离子水或胰蛋白酶溶液作为试剂稀释聚苯乙烯球到指定浓度;而制作细胞浮液时,可以采用胰蛋白酶溶液作为试剂稀释细胞样品到指定浓度。而在利用广角光散射仪进行散射光强度测量时,最好采用激光器作为光源,其优点是光束质量好,具有非常好的单色性、方向性和稳定性。此外,激光器的激光波长最好设定为532nm,因为在该波长下的细胞散射光强差异最佳,且动态光散射仪的性能和测量结果在该波长下更好。
下面用实施方式来说明本发明方法。应该理解的是这些实施方式仅仅是用于进一步说明本发明的实施方案,而不是用于限制本发明。
实施例:
采用本发明的方法,建立hela细胞的细胞周期散射光强模型,具体包括下述步骤:
1)预先制作指定浓度为105个聚苯乙烯球/ml的不同粒径聚苯乙烯球的悬液并装入玻璃试管内,分别摇匀后,利用广角光散射仪分别测量每种粒径聚苯乙烯球的悬液在0~180°范围内每间隔5°上的散射光强度,采用激光器作为光源,且激光器的激光波长为532nm,根据测量结果,得到各不同粒径聚苯乙烯球的悬液各自对应的散射光强度分布曲线。
2)采用g1期、s期、g2期和m期的hela细胞样品,分别按105个细胞/ml的指定浓度制成对应g1期、s期、g2期和m期的hela细胞悬液并装入玻璃试管内,分别摇匀后,在相同测量条件下,利用广角光散射仪分别测量每个细胞周期的hela细胞悬液在0~180°范围内每间隔5°上的散射光强度,采用激光器作为光源,且激光器的激光波长为532nm,根据测量结果,得到g1期、s期、g2期和m期的hela细胞悬液各自对应的散射光强度分布曲线。
本实施例中,所得到的g1期、s期、g2期和m期的hela细胞悬液各自对应的散射光强度分布曲线如图2所示。
3)将g1期、s期、g2期和m期的hela细胞悬液各自对应的散射光强度分布曲线与预先得到的各不同粒径聚苯乙烯球的悬液的散射光强度分布曲线进行对比,分别确定g1期、s期、g2期和m期的hela细胞悬液的散射光强度分布曲线各自所匹配的聚苯乙烯球悬液,从而将匹配得到的各粒径聚苯乙烯球的悬液作为hela细胞的细胞周期散射光强模型。
本实施例中,通过对比得知,g1期的hela细胞悬液(g1phasecell)和12μm粒径聚苯乙烯球的悬液(12μmps)的散射光强度分布曲线相匹配,如图3所示;s期的hela细胞悬液(sphasecell)和14μm粒径聚苯乙烯球的悬液(14μmps)的散射光强度分布曲线相匹配,如图4所示;g2期的hela细胞悬液(g2phasecell)和11μm粒径聚苯乙烯球的悬液(11μmps)的散射光强度分布曲线相匹配,如图5所示;而m期的hela细胞悬液(mphasecell)和22μm粒径聚苯乙烯球的悬液(22μmps)的散射光强度分布曲线相匹配,如图6所示。由此,就分别以12μm、14μm、11μm和22μm粒径聚苯乙烯球的悬液作为hela细胞在g1期、s期、g2期和m期的细胞周期散射光强模型。
在上述的图2~图6中,横坐标均表示散射角度值(angle),纵坐标均表示散射光强度值(lightscattering)。
综上所述,本发明利用聚苯乙烯球的细胞周期散射光强模型建立方法,能够利用不同粒径聚苯乙烯球的悬液建立得到用以作为对活体生物细胞周期进行散射光强检测参照标准的细胞周期散射光强模型,且聚苯乙烯球的性质稳定,也不会产生因细胞分裂生长而导致细胞周期不断变化,因此能够得以永久保存,解决了现有技术中永久保存的细胞周期散射光强检测参照标准难以制作的问题;并且,由于不同粒径聚苯乙烯微球稀释成不同梯度的浓度时,呈现出角度依赖光散射特性与细胞周期中不同时相的光散射特性相符合或经过修正后符合,因此采用本发明方法建立的细胞周期散射光强模型具有很好的普适性,为未来完善更多种类细胞周期光散射光强模型提供了可扩展的思路,具有很好的技术应用前景。
最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!