病原体检测方法与流程
本发明涉及用于检测生物样品中的分枝杆菌(mycobacterium)特异性代谢物的方法和试剂盒。
背景技术:
与结核分枝杆菌(mycobacteriumtuberculosis)相关的分枝杆菌疾病特别是肺结核(“tb”)每年导致超过一百万人死亡;死亡率与hiv感染的情况特别相关。对分枝杆菌感染的早期检测和阳性识别是治疗该疾病的关键组成部分,由于分枝杆菌可以通过气溶胶滴传播,因此在活动性感染的情况下具有高的传播率。此外,目前已知结核分枝杆菌的多重耐药性菌株,包括多重耐药性(mdr)菌株,需要及时识别以确保进行正确的治疗过程。
诊断分枝杆菌感染的常用方法是通过直接显微镜和培养检测痰中的耐酸细菌。尽管使用抗酸染色液(ziehl-neelsen)(zn)染色的显微镜检测tb快速且便宜,但是当正确完成时,与痰培养相比,仅能检测所有具有肺结核的成人的60-70%。然而实际上,这些数字要低得多。培养目前被列为诊断tb的“黄金标准”,目前在所有发展中国家都被推荐用于此目的。但是,培养也具有局限性,主要是诊断的时间,即2-8周。用于基因分型分析痰中细菌含量的分子生物学技术涉及繁琐的样品制备,用聚合酶链式反应(pcr)破坏复杂的痰的微结构以及分枝杆菌细胞壁以获得分枝杆菌遗传物质。最近,pcr技术已被用于tb诊断应用。然而,考虑到其高成本以及对高技术的基础设施和训练有素的人员的需求,pcr技术也具有局限性。由实验室交叉污染造成的假阳性结果的高发率也限制了其在现场条件下的表现,其在涂片阴性培养确认的样品中的灵敏度已报道为47-68%之间的任何值。pcr是一种昂贵的、高灵敏的和准确的分子生物学手段,容易出现样品处理错误和样品制备不当造成的抑制,使得它不适用于贫困和未受过教育的地区,只能通过受过训练的人员。这些不足导致未经治疗的传染性个体长期暴露于其社区,并且被认为是造成tb和mdr-tb感染、疾病和死亡率增加的主要因素。
早期检测肺结核可能导致:1.预防其传播和mdr-tb新菌株的发展;2.死亡率降低;和3.更有效的治疗结果。在过去几年中,快速诊断护理(point-of-care)(poc)设备的发展受到了研究人员的更多关注,尤其是对纳米技术和纳米粒子的兴趣日益增加。商业性的poc具有良好的特异性(90-95%),但目前的局限性是检测限低以及低至中等的灵敏度。
被称为霉菌硫醇(mycothiol)的硫醇类被认为是放线菌所独有的(geraldetal(1996)journalofbacteriology178(7):1990-1995),放线菌是一类生物体,其包括感染性tb致病性分枝杆菌,后者是导致tb相关症状的唯一放线菌属,因此它是识别肺结核病人痰中这些生物体的特征。这继而导致开发了许多用于检测生物样品中的霉菌硫醇的免疫分析系统(unsonetal(1998)journalofimmunologicalmethods214:29-39和unsonetal(1999)journalofclinicalmicrobiology37(7):2153-2157)。这些方法使用酶联免疫吸附分析(elisa)方法能够具有高灵敏度,然而,为了获得这些结果需要很长的设置和处理步骤(至少10小时)。
鉴于上述情况,显然需要快速、灵敏和高度特异性分析方法以检测人类受试者中的分枝杆菌感染。
技术实现要素:
因此,本发明的目的是提供一种检测生物样品中的分枝杆菌特异性代谢物的方法,利用该方法可以克服或至少将上述缺点最小化。
根据本发明的第一方面,提供了一种体外检测生物样品中以霉菌硫醇形式存在的分枝杆菌特异性代谢物的方法,包括以下步骤:
-通过将生物样品与酶溶液混合来制备反应混合物,酶溶液含有反应缓冲液、烟酰胺腺嘌呤二核苷酸(nad)和甲醛依赖性霉菌硫醇脱氢酶(fd-mdh);
-通过fd-mdh与如果存在于生物样品中的霉菌硫醇形式的预定量的分枝杆菌特异性代谢物的相互作用,允许在反应混合物中还原nad以产生nadh;和
-检测样品中的还原型nad(nadh),表明生物样品中存在霉菌硫醇,并因此表明生物样品来源中的分枝杆菌感染。
分枝杆菌感染通常但非排他性地是结核分枝杆菌的感染或其他分枝杆菌属物种的感染,其他分枝杆菌属物种的感染通常以相同的方式进行治疗。
此外,根据本发明,检测样品中的还原型nad(即nadh)的步骤包括通过任何一种或多种选自比色反应、酶分析法、色谱法,质谱法和分光光度法的方法检测变化的步骤。
生物样品可以选自纯代谢物、细胞提取物、血液、痰、尿、脑脊液、液体培养物及其组合。
此外,根据本发明,酶溶液包括选自盐、醛、胺、氢氧化物、还原剂及其组合的辅助物。
优选地,酶溶液选自氯化钠、甲醛、三(羟甲基)氨基甲烷、二硫苏糖醇及其组合。
酶促反应可以在25-40℃的温度下进行2-840分钟。或者,酶促反应进行2-80分钟。再者,酶促反应可以进行2-20分钟。
酶促反应可以在比色皿、透明多孔板或玻璃样品瓶中进行,各个反应的总体积低于250μl。或者,反应在常规实验室玻璃器皿中进行。
根据本发明的第二方面,提供了一种体外检测生物样品中的分枝杆菌特异性代谢物的试剂盒,其包括酶溶液以及合适的容器,酶溶液含有反应缓冲液、烟酰胺腺嘌呤二核苷酸(nad)和甲醛依赖性霉菌硫醇脱氢酶(fd-mdh);所述容器用于接收生物样品和酶溶液以形成反应混合物。
根据本发明的详细说明,本发明的这些和其他目的、特征和优点对于本领域技术人员将是显而易见的。
附图说明
下面参考附图来说明本发明优选的实施例,其中:
图1是示出了在tris-缓冲液中msh和md-faldh的酶促反应的标准化,其中在340nm测得的光密度的增加与nadh的增加线性相关;
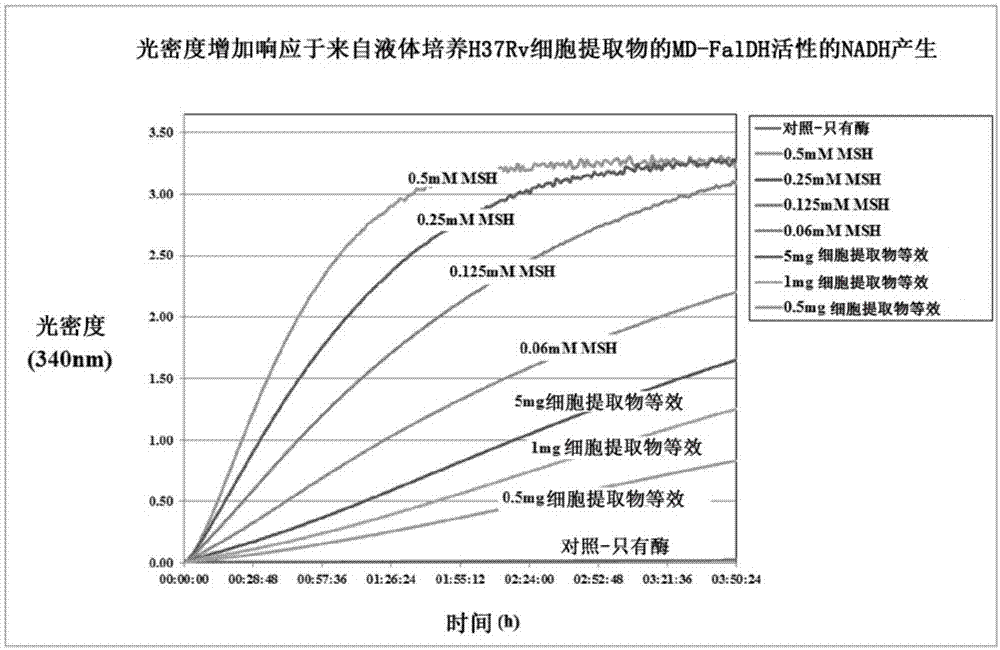
图2示出了在低浓度msh和md-faldh存在下无效循环14小时时在tris缓冲液中msh和md-faldh的酶促反应的标准化,其中(a)是对培养的细胞裂解液分析14小时,(b)是放大图,显示了检测下限为0.05μg(或50ng)细胞提取物等效(cellextractequivalent);在340nm处测得的光密度的增加与nadh的增加线性相关;
图3示出了(a)使用痰样品(培养阳性;涂片镜检阳性(c+ve;sm+ve);培养阳性;涂片镜检阴性(c+ve;sm-ve)),对于msh-md-faldh分析光密度在340nm处增加和使用培养和涂片(痰-ve)的tb阴性痰样品;和(b)图的放大区域表示对于tb+样品产生可检测的信号,对照或tb-样品(b)没有可察觉的信号。
现在将在下文中参照附图实例更详细地描述本公开的主题,其中示出了代表性实施例。然而,本公开的主题可以以不同的形式来实施,并且不应该被解释为限于本文阐述的实施例。相反,提供这些实施例是为了使本公开透彻和完整,并且将实施例的范围充分地传达给本领域技术人员。
具体实施方式
根据本发明优选的实施例,一种体外检测生物样品中以霉菌硫醇形式存在的分枝杆菌特异性代谢物的方法,包括以下步骤:
-通过将生物样品与酶溶液混合来制备反应混合物,酶溶液含有反应缓冲液、烟酰胺腺嘌呤二核苷酸(nad)和甲醛依赖性霉菌硫醇脱氢酶(fd-mdh);
-通过fd-mdh与如果存在于生物样品中的霉菌硫醇形式的预定量的分枝杆菌特异性代谢物的相互作用,允许在反应混合物中还原nad以产生nadh;和
-检测样品中的还原型nad(nadh),表明生物样品中存在霉菌硫醇,并因此表明生物样品来源中的分枝杆菌感染。
该方法特别适于但不限于检测包括结核分枝杆菌的分枝杆菌感染在内的分枝杆菌感染,但可以预见的是,使用本发明的方法可以在生物样品中检测到具有霉菌硫醇分布的任何放线菌的存在。但是,考虑到患者样品将根据与传染性分枝杆菌引起的症状相关的症状来采集,这将是肺结核的特征。
生物样品选自纯代谢物、细胞提取物、血液、痰、尿、脑脊液、液体培养物及其组合。
检测样品中的还原型nad(即nadh)的步骤包括通过任何一种或多种选自比色反应、酶分析法、色谱法、质谱法和分光光度法的方法检测变化的步骤。
酶溶液选自盐和缓冲液,特别是醛、胺、氢氧化物、还原剂及其组合。优选地,酶溶液包含氯化钠、甲醛、三(羟甲基)氨基甲烷、二硫苏糖醇的混合物。
可以理解,酶促反应的速率取决于生物样品中分枝杆菌特异性代谢物的起始浓度。因此,在反应期间产生一定浓度的nadh所需的时间也取决于生物样品中分枝杆菌特异性代谢物的起始浓度。
酶促反应在25-40℃的温度下进行2-840分钟。或者,酶促反应进行2-80分钟。再者,酶促反应进行2-20分钟。
可以理解,酶促反应可以在许多装置中以多种体积进行,其中各种选择对于本领域技术人员是众所周知的。在本发明的一个实施例中,酶促反应在比色皿、透明多孔板或小玻璃样品瓶中进行,各个反应的总体积低于250μl。在本发明的另一个实施例中,反应在常规实验室玻璃器皿中进行。
根据本发明的第二方面,提供了一种体外检测生物样品中的分枝杆菌特异性代谢物的试剂盒,其包括酶溶液以及合适的容器,酶溶液含有反应缓冲液、烟酰胺腺嘌呤二核苷酸(nad)和甲醛依赖性霉菌硫醇脱氢酶(fd-mdh);所述容器用于接收生物样品和酶溶液以形成反应混合物。
参考图1至3,下面更详细地描述本发明优选的实施例的非限制性实例。
实例:用于检测结核分枝杆菌的可视化分析
根据本发明优选的实施例,在霉菌硫醇(msh)的甲醛加合物(adducts)存在下,使用甲醛依赖性霉菌硫醇脱氢酶(fd-mdh)产生还原型能量载体(nadh)。酶溶液缓冲液取决于ph、温度、霉菌硫醇(还原型)含量以及甲醛含量。
该方法可以在高通量96孔板中进行,反应体积共200μl。反应在30℃进行2分钟至14小时。
酶分析法的标准化
为了标准化,使用纯合成的霉菌硫醇(三氟乙酸盐)。由于三氟乙酸盐阻止霉菌硫醇的自氧化,所以将纯合成的霉菌硫醇(三氟乙酸盐)制成10mm的储备液而无需精炼。md-faldh活性筛选设置在96孔微孔板中(总体布局见表1)。制备含有酶活性筛选的所有组分的预混合物(lessmeier等人;2013)。预混组合物由100mmtris(ph8.25)、500mmnacl、5mmnad+、1mmdtt、1-5mm甲醛和0.001-0.05mg/mlmd-faldh组成。“样品”包含用于复制所使用的实际患者样品材料的一致性的成分的混合物,或包含没有检测到传染性病原体和/或生物化合物的实际患者样品的基质(在这种情况下为霉菌硫醇)。
表1:总体布局的实例以及使用从液体培养物中分离的h37rv结核分枝杆菌对所提出的霉菌硫醇分析和初步细胞提取物测试进行标准化的准备
在bioteksynergyuv-vis分光计读板机或任何类似的模型仪器上,在340nm测量光密度的增加(nadh),培养箱温度设定为30℃。所有空白和波长校正均使用gen5软件完成。动力学间隔以30-90s间隔读取,取决于样品的数量。对于所有动力学分析,纯msh被用作光密度增加(340nm)的标准。所有读数进行三次。出于所有目的,在可能的情况下,msh标准溶解在与含病原体样品相同的基质中,例如,用于痰样品的液体培养生长培养基或提取缓冲液。
为了分析的目的,无nacl或用hepes/mops缓冲液替换tris对340nm处随时间的光密度增加并没有明显影响。发现决定性因素仅为ph依赖性,其中最佳活性对应于lessmeier等人(2013)在文献中描述的活性(ph8.25)。在图1和图2a中可以看到340nm处光密度的增加(nadh),其中在标准情况下,如前所述,分别在4小时和14小时在含有纯霉菌硫醇的混合物观察到光密度的增加。用于图1中产生的结果的标准的组合物包括使用0.05mg/mlmd-faldh和msh标准系列:分别为0.5mm、0.25mm、0.125mm和0.06mm。用于图2a中产生的结果的标准的组合物包括使用0.002mg/mlmd-faldh和msh标准系列:0.032mm、0.016mm和0.008mm。
在液体培养的h37rv结核分枝杆菌细胞裂解物中进行的酶促反应在340nm处的光密度的增加(nadh)能够在图1和图2b中分别在4小时和14小时看到,被描绘并标记为0.5、1和5mg细胞提取物等效。样品对照在此指的是与样品一样经过相同的制备步骤的水/基质样品,其不含霉菌硫醇或酶。
对于来自液体培养的结核分枝杆菌的细胞提取物(裂解物),开发了新的提取缓冲液。缓冲液是根据众多方案编制的,特别是从植物材料中分离基因组dna的方案。直至存在细胞材料时缓冲液出现白浊,其中溶液变得光学清晰。缓冲液(ph8)由100mm4-(2-羟乙基)-1-哌嗪乙烷磺酸(hepes)缓冲液、500mmnacl、5%十二烷基硫酸钠(sds)、5%十六烷基三甲基溴化铵(ctab)组成。以下是使用裂解缓冲液的一般方案:
将过量的裂解缓冲液(100-500μl)加入到从液体培养物中分离的50mg结核分枝杆菌沉淀湿细胞团中。通过在同一小瓶中重复微量移液直至微粒可见并且样品具有奶油质地和外观,将细胞沉淀机械分散。然后将细胞沉淀-裂解缓冲液混合物剧烈涡旋60秒,随后在65℃加热30-45分钟或在90℃加热20分钟。最后涡旋10秒。通过离心(在4000g的相对离心力(rcf)下)沉淀细胞碎片,并将上清液用于随后的分析。或者,通过降低混合物的温度(例如通过将其置于冰上或冰箱或冷冻机中)或通过重力沉降使样品沉淀。
表2代表利用上文所述的裂解缓冲液的典型的实验方案。
表2:总体布局的实例以及使用从h37rv结核分枝杆菌液体培养物分离的细胞来确定所提出的霉菌硫醇方法的检测极限的准备
在下面的实例中,为了确定检测下限(即样品中需要存在的最小数量的分枝杆菌),将5mg湿细胞团悬浮在500μl裂解缓冲液中并如上所述处理。然后稀释细胞裂解物以产生等同于5mg、1mg、0.05mg、50μg、5μg、0.5μg、0.05μg、0.005μg湿细胞的稀释系列,每个使用20μl以制备如表2中的样品列中所示的分析物样品。实验重复三次,每个样品读取三次,对于每个重复获得类似的结果,其结果在图1(对于5mg、1mg和0.5mg细胞质量等效)和图2a和b(500μg-0.005μg(或0.5ng))中给出。
表3:每个分析样品的分枝杆菌细胞等效的估计量。计算基于1×108个细胞/3mg湿细胞糊剂的文献接受值。cfu=细胞形成单位(cellformingunits)
如表3中所总结的,酶分析法估计的检测灵敏度证明在低至0.05μg(50ng)等效细胞裂解物的量下观察到光密度的增加(图2b)。
随后,为了评估酶分析法在检测在分枝杆菌中存在的霉菌硫醇的能力,该分枝杆菌包括患者采集的诊断样品,如表4中所示的实例,对患者采集的痰进行与液体培养细胞裂解物相同的提取方案。光密度的增加(340nm)表明对所有4个tb+样品(包括培养阳性;涂片镜检阳性(c+ve;sm+ve);培养阳性和涂片镜检阴性(c+ve;sm-ve))和tb阴性痰样品可检测的信号,对照组或5tb-ve样品无活性(使用培养和涂片镜检(痰-ve)证实)(图3)。图3a(图3b)中,图的特定区域的放大显示了光密度的快速增加以及快速下降。这可能是由于来自痰样品的残余酶活性或与nadh相互作用的小分子造成的。样品对照(图3a)经历了与痰样品完全相同的准备步骤。与5tb(-)样品以及样品对照(图3b)相比,4tb(+)样品在340nm处光密度的增加较低但仍可检测到。通过优化细胞裂解方案、酶缓冲系统或掺入酶促“增强剂”(如对碘硝基四氮唑紫(p-iodonitrotetrazoliumviolet)或吩嗪硫酸甲酯(phenazinemethosulfate))(hinman和blass,1981)以及荧光报告分子(fluorescentreportermolecules),可以尝试以产生类似于细胞裂解物的结果,以进一步降低检测限(即增加方法的灵敏度)。
表4:总体布局的实例在tb+ve和tb-ve痰样品中检测霉菌硫醇的准备
在验证过程中,直接从痰提取样品中检测nadh的msh-md-faldh酶分析法证明了所有tb+ve(其中2个培养阳性和涂片阳性,2个培养阳性和涂片阴性)和5个tb-ve样品成功的差异(图3)。
可以容易地理解,分析方法的酶组分可以用于液体培养物以及进一步验证痰样品,并且可以用于研究以及诊断。
结果表明,本发明对检测孵育10分钟后1.6×107cfu、孵育约2小时到半小时后1.6×104cfu以及孵育约6小时后1.6×103cfu足够灵敏。考虑到诊断的灵敏度和时间,这使其成为涂片镜检(需要1×104)的良好的替代方法。然而,当对实际患者采集的痰进行测试时,该方法能够正确识别所有tb阳性样品,甚至是常规涂片镜检所错过的样品,表明它比涂片镜检更灵敏,并且最有可能检测在痰基质中由分枝杆菌复合物产生的外源性霉菌硫醇,使得该方法可能成为与培养一样灵敏的候选者,而培养只能在更大的样品队列中证实。
如上所述,根据本发明优选的实施例的方法与现有技术方法相比具有许多优点。
首先,本发明易于执行并且可以以比其他现有的高灵敏度分析方法低得多的成本商业化。其次,如上所述,该分析比其他方法相对更快,即最多需要几小时就能同时完成多个样品(当使用96孔板完成时),并且可以完全自动化。考虑到其他广泛基于tb诊断方法基本上是大量耗时的,该方法可以比得上目前最快的基于pcr的方法,基于pcr的方法至少需要几个小时用于扩增步骤并且可能需要几天才能完成,而最快的培养方法最快2天(平均2-8周)。与本文描述的分析方法相比,除了具有低得多的灵敏度之外,涂片镜检也是劳动密集型的,需要熟练的组织学培训,可能引入多个操作误差和视觉评估,这可能引入确认偏差(confirmationbias),通常需要几个小时的准备和分析;然而,多个样品制备是时间限制因素。
最后,如本文所述的测试检测代谢标志物,并且因此不依赖于遗传物质。与现有的遗传方法相比,这提高了本发明的准确性,因为残留的遗传物质可能产生假阳性结果。
此外,该分析方法可以构建到护理诊断设备中。
应该理解,在不脱离所附权利要求的范围的情况下,根据本发明的方法的细节变化是可能的。
- 还没有人留言评论。精彩留言会获得点赞!