使用细胞内生物发光共振能量转移识别生物活性剂的细胞靶标结合的制作方法
相关申请的交叉引用
本申请要求2012年12月12日提交的美国临时专利申请序列no.61/736,429;2013年3月15日提交的美国临时专利申请序列no.61/794,461;以及2013年9月19日提交的美国临时专利申请序列no.61/880,048的优先权,每个专利在此以引用的方式整体并入。
发明领域
本发明提供用于检测和分析生物活性剂与细胞靶标的细胞内结合的组合物和方法。具体说来,本文提供拴系至荧光团的生物活性剂;融合至生物发光报道子、或生物发光报道子的部分、组分或亚基的细胞靶标;以及检测和分析生物活性剂与随其的细胞靶标的相互作用的方法。
发明背景
分子种类与细胞靶标的相互作用在理解细胞生理学和开发治疗干预措施如新的合成药物和生物药剂中是极其重要的。需要精确且高效地测定靶标结合(engagement)的方法,特别是在其中这些相互作用介导其表型响应的活细胞内。有效地检测靶标结合的能力对发现过程具有广泛的启示,包括高通量筛选、优化对药物先导物的命中物(hit)的筛选、以及发现和表征治疗相关的细胞靶标。
使用小分子文库的基于表型的筛选在药物发现领域中起重要作用。使用这种筛选方法,在没有预先得知其潜在的细胞靶标的情况下就其引发表型响应(例如缓解疾病症状)的能力对化合物文库进行筛选。虽然此方法可用于鉴定能够调节细胞生理的生物活性剂,例如小分子,但确定这些小分子命中物的生物相关靶标是主要的技术挑战。另外,促进一些想要的表型响应的小分子可由于脱靶相互作用而成为体内不利因素。为了预测药物选择性并使可能的副作用减至最少,重要的是还鉴定了脱靶相互作用(例如较低的亲和力)。目前用于鉴定生物活性剂靶标的大多数方法都依赖使用含有选择性部分(例如生物活性剂或相关化合物)和分类部分(例如亲和标记物或固体支持物)的“双官能”化合物从复杂的细胞裂解物富集这些靶标。因为富集是基于化合物的结合特性,其中这些化合物对于其靶标的固有亲和力是不够的,所以化合物类似物被设计以便共价地结合至靶标(例如光交联)。通过任一种方法,靶标分离的效力和特异性是必需的,且这些方法的失败率很高。这些方法的失败可能是由于靶标的不充分捕获或因非特异性捕获所致的高本底。此失败的影响因素包括:化合物以低至中等亲和力在难以检测的这些相对较弱的相互作用下结合多个靶标;缺乏稳固的、简明的、无偏技术来表征检测到的相互作用;不能在相互作用可依赖的天然细胞环境内进行靶标分离;所提供的关于靶标在细胞中的结合效能的信息有限;以及由于非特异性结合至固体支持物或官能化小分子所致的假阳性相互作用的高本底。
发明概述
在一些实施方案中,本发明提供bret测定系统,其包含:(a)拴系至发色团(例如荧光团)的生物活性剂;(b)融合至生物发光报道子的细胞靶标;以及(c)所述生物发光报道子的底物。在一些实施方案中,生物活性剂是小分子。在一些实施方案中,生物活性剂是蛋白质功能的抑制剂,例如酶抑制剂或受体抑制剂。在一些实施方案中,发色团是荧光团。在一些实施方案中,荧光团是羧基若丹明类似物。在一些实施方案中,生物发光报道子包含与seqidno:1具有至少70%序列同一性(例如,75%同一性…80%同一性…85%同一性…90%同一性、95%同一性…98%同一性…99%同一性)的多肽。在一些实施方案中,(b)是融合至生物发光报道子的部分、或亚基或组分的细胞靶标。在一些实施方案中,(b)是融合至需要与另一多肽相互作用以产生发光的多肽的细胞靶标。在一些实施方案中,(a)和(b)是在细胞内。在一些实施方案中,(b)作为与目标蛋白质(例如细胞靶标)一起的融合蛋白在细胞内表达。在一些实施方案中,细胞靶标由一种以上组分、亚基或多肽组成,例如,细胞靶标是蛋白质复合物。在一些实施方案中,生物发光报道子由一种以上组分、亚基或多肽组成,例如,生物发光报道子是蛋白质复合物。在一些实施方案中,(a)是在细胞外添加的并进入细胞中。在一些实施方案中,(a)存在于细胞内和细胞周围的介质中。在一些实施方案中,(a)结合至细胞和于细胞周围的介质中存在。在一些实施方案中,(a)存在于周围介质中的量显著地大于在细胞中或结合至细胞的量,例如大至少2倍、至少5倍、10倍、30倍或100倍。在一些实施方案中,细胞靶标是生物活性剂的结合配偶体。在一些实施方案中,生物发光报道子的发射光谱与荧光团的吸收光谱重叠。在一些实施方案中,生物活性剂一旦与细胞靶标结合,底物通过生物发光报道子向反应产物的转化便造成荧光团由bret激发和来自荧光团的光发射。在一些实施方案中,(a)是拴系至发色团的试剂或化合物文库中的一个。在一些实施方案中,(a)是拴系至荧光团的试剂或化合物文库中的一个。在一些实施方案中,(b)是融合至生物发光报道子的多个潜在的细胞靶标中的一个。在一些实施方案中,(b)是表达融合至生物发光报道子的多个潜在的细胞靶标中的一个的细胞的文库。
在一些实施方案中,本发明提供对生物活性剂与细胞靶标的结合进行检测、分析、表征等的方法。在一些实施方案中,细胞靶标可以是主要的药物靶标。在一些实施方案中,细胞靶标是可在体内引起不希望的副作用的脱靶倾向(liability)。在一些实施方案中,生物活性剂与细胞靶标的结合可能不具有可辨别的生物效应。在一些实施方案中,本发明提供细胞,其包含以下一个或多个(例如其中的每一个):(a)拴系至发色团(例如荧光团)的生物活性剂;(b)融合至生物发光报道子的细胞靶标;以及(c)所述生物发光报道子的底物。在一些实施方案中,生物活性剂与细胞靶标的结合是非共价的。在一些实施方案中,发色团是荧光团。在一些实施方案中,本发明提供用于检测生物活性剂与细胞靶标之间的相互作用的方法,其包括:(a)在细胞中表达所述细胞靶标与在第一波长(例如,波长范围、光谱分布等)下发射能量的生物发光报道子的融合体;(b)使所述细胞与拴系至荧光团的所述生物活性剂接触,其中所述荧光团在所述第一波长下接收能量且在第二波长(例如,波长范围、光谱分布等)下发射能量;(c)使所述细胞与所述生物发光报道子的底物接触;(d)在所述第二波长下检测能量,其中在所述第二波长下所述能量的存在指示所述生物活性剂与所述细胞靶标相互作用。
在一些实施方案中,本发明提供用于检测生物活性剂与细胞靶标之间的相互作用的方法,其包括:(a)提供所述细胞靶标与生物发光报道子的融合体;(b)使所述融合体与拴系至发色团(例如荧光团)的所述生物活性剂接触;(c)使所述融合体与所述报道子的底物接触;(d)检测发射光的光谱分布在不存在所述发色团下相对于与所述底物接触的所述融合体的变化。在一些实施方案中,本发明提供用于检测第二生物活性剂与细胞靶标的相互作用的方法,其包括:(a)提供所述细胞靶标与生物发光报道子的融合体;(b)使所述融合体与拴系至发色团(例如荧光团)的第一生物活性剂和所述第二生物活性剂接触;(c)使所述融合体与所述报道子的底物接触;(d)检测发射光的光谱分布在不存在所述第二生物活性剂下相对于与所述第一生物活性剂和所述底物接触的所述融合体的变化。在一些实施方案中,发射光的光谱分布的变化是由于所述第二生物活性剂置换所述第一生物活性剂而引起。在一些实施方案中,所述置换是竞争性置换。在一些实施方案中,发射光的光谱分布的变化被用于估计生物活性剂与细胞靶标的结合亲和力。在一些实施方案中,所述第二生物活性剂是多种生物活性剂中的一种。在一些实施方案中,发射光的光谱分布的变化被用于估计多种生物活性剂与细胞靶标的相对结合亲和力。在一些实施方案中,所述第一生物活性剂和所述第二生物活性剂是合成分子。在一些实施方案中,所述细胞靶标是在活细胞、透化的细胞或细胞裂解物中。在一些实施方案中,发射光的光谱分布的变化是通过测量在两个不同波长或两个不同波长范围下的光强度的比率来测定的。在一些实施方案中,检测光谱分布随时间的变化。在一些实施方案中,发色团是荧光团。
在一些实施方案中,本发明提供一种bret测定系统,其包含:(a)拴系至荧光团的生物活性剂;(b)融合至生物发光报道子的结构互补肽的第一相互作用配偶体;(c)融合至生物发光报道子的结构互补多肽的第二相互作用配偶体;以及(d)所述生物发光报道子的底物,其中第一与第二相互作用配偶体相互作用以形成相互作用复合物,并且其中第一相互作用配偶体、第二相互作用配偶体和/或相互作用复合物是所述生物活性剂的结合配偶体。在一些实施方案中,第一相互作用配偶体和第二相互作用配偶体是相互作用以形成蛋白质复合物的蛋白质或多肽。在一些实施方案中,第一相互作用配偶体和第二相互作用配偶体通过结构互补多肽的相互作用被合在一起。在一些实施方案中,结构互补多肽通过第一相互作用配偶体与第二相互作用配偶体的相互作用被合在一起。在一些实施方案中,第一相互作用配偶体与第二相互作用配偶体的相互作用是通过发光的增加来测定的。在一些实施方案中,第一与第二相互作用配偶体在生物活性剂的存在或不存在下形成相互作用复合物。在一些实施方案中,相互作用复合物是生物活性剂的结合配偶体,但第一或第二相互作用配偶体单独都不是生物活性剂的结合配偶体。在一些实施方案中,相互作用配偶体中的一个而非另一个是生物活性剂的结合配偶体。在一些实施方案中,相互作用复合物形成需要生物活性剂结合至相互作用配偶体。在一些实施方案中,相互作用复合物形成不依赖于生物活性剂的结合。在一些实施方案中,本发明提供bret测定系统,其包含:(a)拴系至荧光团的生物活性剂;(b)融合至生物发光报道子的结构互补肽的细胞靶标;(c)生物发光报道子的结构互补多肽;以及(d)生物发光报道子的底物。在一些实施方案中,生物发光报道子的互补肽和多肽缔合形成活性生物发光报道酶。在一些实施方案中,一旦生物活性剂与细胞靶标结合且互补肽和多肽缔合,底物通过生物发光报道酶向反应产物的转化便造成荧光团被bret激发和来自所述荧光团的荧光发射。
在一些实施方案中,本发明提供一种测定系统,其包含:(a)拴系至荧光团的生物活性剂;(b)融合至生物发光报道子的互补肽的第一结合配偶体;(c)融合至生物发光报道子的互补多肽的第二结合配偶体;以及(c)生物发光报道子的底物。在一些实施方案中,生物发光报道子的互补肽和多肽缔合形成活性生物发光报道酶。在一些实施方案中,当第一与第二结合配偶体相互作用,生物活性剂结合至相互作用配偶体且互补肽和多肽发生缔合时,底物通过生物发光报道酶向反应产物的转化造成荧光团被bret激发和来自所述荧光团的荧光发射。
在一些实施方案中,生物活性剂拴系至荧光或发光猝灭剂(例如dabcyl)。在这样的实施方案中,未拴系的生物活性剂的滴定产生信号增益。
在一些实施方案中,本发明提供对本文所述的任一系统成像(例如,bret成像、经由电荷耦合器件摄影机等)以便证实和/或鉴定荧光的位置(例如胞内、胞外等)和/或由系统组分(例如生物活性剂、细胞靶标等)的存在和/或相互作用产生的bret信号。
在一些实施方案中,本文所述的系统和方法(参见,例如针对一个示例性实施方案的实施例23)用于测量生物活性剂对一组推定的细胞靶标的胞内选择性和亲和力。在一些实施方案中,监测对bret的影响,因为生物活性剂/细胞靶标复合物被竞争性地破坏。在一些实施方案中,通过经由竞争性破坏生成的ic50值推测亲和力。在一些实施方案中,抑制剂对细胞靶标的个别结构域的亲和力是经由生物发光报道子与细胞靶标的分离结构域的遗传融合来测定。
本申请涉及下述实施方案。
1.一种测定系统,其包含:
(a)拴系至荧光团的生物活性剂;
(b)融合至生物发光报道子的细胞靶标;以及
(c)所述生物发光报道子的底物。
2.如实施方案1所述的系统,其中所述生物活性剂是小分子。
3.如实施方案1所述的系统,其中所述荧光团是羧基若丹明类似物。
4.如实施方案1所述的系统,其中所述生物发光报道子包含与seqidno.:1具有至少70%序列同一性的多肽。
5.如实施方案1所述的系统,其中(a)和(b)是在细胞内。
6.如实施方案5所述的系统,其中(b)是作为融合体在细胞内表达。
7.如实施方案5所述的系统,其中(a)是在细胞外添加并进入所述细胞。
8.如实施方案1所述的系统,其中所述细胞靶标是所述生物活性剂的结合配偶体。
9.如实施方案8所述的系统,其中所述生物发光报道子的发射光谱与所述荧光团的吸收光谱重叠。
10.如实施方案9所述的系统,其中所述生物活性剂一旦与所述细胞靶标结合,所述底物通过所述生物发光报道子向反应产物的转化便造成所述荧光团被bret激发和来自所述荧光团的荧光发射。
11.如实施方案1所述的系统,其中(a)是拴系至荧光团的生物活性剂的文库中的一个。
12.如实施方案1所述的系统,其中(b)是融合至生物发光报道子的多个细胞靶标中的一个。
13.如实施方案1所述的系统,其中所述生物活性剂或拴系至荧光团的所述生物活性剂是通过非天然化学合成产生的。
14.一种检测生物活性剂与细胞靶标结合的方法,其包括如实施方案1-13中任一项所述的系统。
15.一种细胞,其包含如实施方案1-13中任一项所述的系统。
16.一种用于检测生物活性剂与细胞靶标之间的相互作用的方法,其包括:
(a)在细胞中表达所述细胞靶标与在第一波长下发射能量的生物发光报道子的融合体;
(b)将所述细胞与拴系至荧光团的所述生物活性剂接触,其中所述荧光团在所述第一波长下接收能量且在第二波长下发射能量;
(c)使所述细胞与所述生物发光报道子的底物接触;
(d)在所述第二波长下检测能量,其中在所述第二波长下所述能量的存在指示所述生物活性剂与所述细胞靶标相互作用。
附图简述
图1示出本发明的一个实施方案的示意图:(a)荧光团拴系的生物活性剂和生物发光-报道子-拴系的细胞靶标;(b)生物活性剂与细胞靶标的结合;(c)报道子底物的加入产生bret;以及(d)过量的未拴系的生物活性剂的置换导致bret和荧光的损失。
图2示出比较两个不同的荧光团-saha衍生物作为用于活细胞中nanoluc-hdac6融合体的bret受体的bret曲线的图。
图3示出描绘表达的稀释物对测定性能的影响的图。第一图显示使用来自nanoluc-融合的hdac6的荧光团拴系saha的竞争性置换的降低的表达对bret测定窗的影响的图。第二图显示降低的表达对bret测定窗以及对于结合至nanoluc-组胺h1受体的药物示踪剂所观察到的化合物效能(ec50)两者的影响。
图4示出显示前药加工的细胞环境的需求的图。
图5示出显示使用渗透剂加强不可渗透的药物示踪剂的进入的能力的图。
图6示出描绘来自nanoluc-融合的p38的荧光团拴系的birb-衍生物的竞争性置换的图。
图7示出描绘测量来自nanoluc-融合的p38的荧光团拴系的birb衍生物的动力学的图。
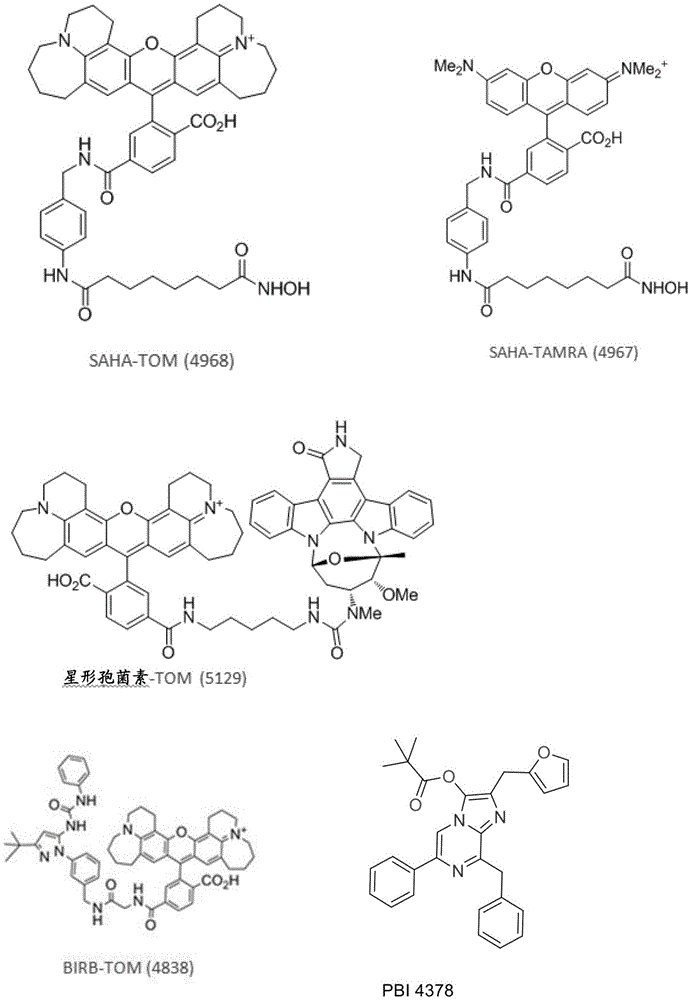
图8示出示例性荧光团拴系的生物活性剂及在本文所述的实施方案中获得应用的其它化合物。
图9示出在本文所述的一个实施方案内p38与renilla荧光素酶和与nanoluc荧光素酶的融合体的比较。
图10示出当nanoluc融合体的表达接近内源水平时,实现与具有最佳信号本底比的药物示踪剂的高亲和力相互作用。
图11示出与birb-tmr缀合物相比结合至birb-tom缀合物的nanoluc-p38α的剂量响应曲线。
图12示出与bim-tmr缀合物相比结合至bim-tom缀合物的pkcα-nanoluc的剂量响应曲线。
图13示出描绘检测在活细胞中的特异性bret响应的图。
图14示出pbi-4838对jnk2、p38β和p38α的亲和力。
图15示出pbi-4838对jnk2、p38β和p38α的亲和力。
图16示出pbi-4966对野生型brd4对比突变型brd4的相对亲和力。
图17示出结构上不同的化合物可通过使用本发明方法进行药物示踪剂的竞争性置换来鉴定。
图18示出在细胞中使用荧光团药物缀合物监测药物/靶标相互作用的能力。
图19示出描绘在tnt中的特异性bret响应的图。
图20示出描绘测量荧光标记的细胞因子与nanoluc-egfr的结合的图。治疗性抗体维克替比(vectibix)、爱必妥(erbitux)和赫赛汀(herceptin)的亲和力还通过细胞因子的竞争性置换来证明。
图21含有与单独互补肽(seqidno:4)或显示高效能量转移的缀合至tmr的互补肽(seqidno:4)互补的互补多肽(seqidno:5)的波长扫描。
图22含有融合至halotag的nanoluc(nl-ht)和与连接至荧光非chlorotom(nct)染料(pbi-5074)的互补肽互补的互补多肽(seqidno:6)的波长扫描。
图23示出三级相互作用的示意图,其中与生物发光蛋白的结构上互补肽和多肽的复合物的能量转移还可用于测量相互作用配偶体的相互作用。在示意图中,融合至生物发光蛋白的互补多肽的gpcr(第一相互作用配偶体)与融合至生物发光蛋白的互补肽的gpcr相互作用蛋白(第二相互作用配偶体)在它们相互作用(以形成相互作用复合物)时形成生物发光复合物。这允许测量二级相互作用。如果带有用于能量转移的荧光部分的小分子gpcr配体与此系统相互作用,那么便发生能量转移。因此,二级蛋白-蛋白相互作用和三级药物-蛋白-蛋白相互作用可在相同的实验中测量。
图24示出显示在11s肽和brd4的细胞表达融合体与缀合至brd4配体的外源添加的nct之间的bret数据取决于pep-80(与11s在结构上互补)的存在的图;(a)供体强度,(b)受体强度。
图25示出显示在11s肽和brd4的细胞表达融合体与缀合至ibet的外源添加的nct之间的bret数据取决于pep-80(与11s结构上互补)的存在的图;(a)1μmpep-80,(b)没有pep-80对照。
图26示出依赖于增强的11s-brd4/114-组蛋白h3.3复合物的bret信号(受体和供体强度)。
图27示出荧光brd4配体(ibet-nct/pbi-4966)可置换11s-brd4/114-组蛋白h3.3复合物。
图28示出11s-brd4/114-组蛋白h3.3复合物的非荧光ibet-151ic50竞争性置换。
图29示出i类hdac(hdac1、2、3和8)与saha-tom一起产生特定的bret信号,如基于所报道的saha对这些个别靶标的亲和力和选择性所预测。
图30示出iib类hdac(hdac6和10)以及hdac6的分离结构域与saha-tom一起产生特定的bret,如基于saha对这些个别靶标报道的亲和力和选择性所预测。
图31示出iia类hdac不与saha-tom一起产生显著的bret,如基于所报道的saha对i类和iib类hdac的选择性所预测。
图32示出saha针对与saha-tom复合的个别hdac-nanoluc融合体的竞争性置换结果,如经由bret所测定。可由这些浓度响应曲线计算ic-50值,如紧挨着图的表中所示。
图33(左)示出个别hdac-nanoluc融合体的ic-50值与ki值之间的转换,如经由bret所测定。cheng-prusoff方程被用于此转换。图33(右)示出表现saha针对个别hdac/nanoluc融合蛋白的相对亲和力的图,如经由bret所测定。
图34示出在作为特异性对照的saha存在或不存在下胞内hdaclo-nluc/pbi-4968+/-saha复合物的bret成像。
图35示出在作为特异性对照的saha存在或不存在下胞内nluc-hdac6/pbi-4968+/-saha复合物的bret成像。
图36示出使用hdac10和hdac6进行的saha结合胞内saha-tom(pbi-4968)bret成像实验的点阵图分析。
发明详述
本发明提供用于检测和分析生物活性剂与细胞靶标的胞内结合的组合物和方法。具体地说,本文提供拴系至发色团(例如荧光团)的生物活性剂;融合至生物发光报道蛋白的潜在细胞靶标;以及检测和分析生物活性剂与随其的细胞靶标的相互作用的方法(参见图1)。
通过检测/测量由在同第一实体连接、融合、拴系、连接等的第三实体(例如,荧光团)与同第二实体连接、融合、拴系、连接等的第四实体(例如,生物发光报道蛋白)之间的信号转移(例如能量转移(例如,荧光、光能、共振,通过bret,等等))产生的信号,对第一实体(例如生物活性剂)与第二实体(例如细胞靶标)的相互作用进行检测、表征、定量、分析等。第一与第二实体的相互作用和/或结合将第三与第四实体靠得足够近以使得彼此之间的信号转移(例如能量转移)。在一些实施方案中,第四实体(例如,生物发光报道蛋白)发射能量(例如,一旦与其底物相互作用),且发射的能量被第三实体(例如荧光团)吸收,致使第三实体发射与第四实体显著不同的能量(例如,在不同波长下的光)。在这样的实施方案中,一旦将第四实体(例如生物发光报道子)的底物添加到系统中便检测到从第三实体发射的能量(例如,在第三实体的发射最大值下的光)指示第一与第二实体的相互作用。在一些实施方案中,基于在各种条件下对第四实体(例如,生物发光报道蛋白)的信号输出的测量对第一与第二实体的结合的持续时间、动力学、亲和力、强度和/或特异性进行检测、测量、定量、测定、分析等。
在各种实施方案中,(例如,在胞内、胞外、裂解物中、体外等)提供融合至生物发光报道蛋白的细胞靶标和拴系至发色团(例如荧光团)的生物活性剂。将生物发光报道蛋白的底物添加至系统中。如果生物活性剂与细胞靶标之间发生相互作用(例如结合),那么将生物发光报道蛋白与发色团(例如荧光团)靠得足够近以便bret发生,并且从发色团(例如荧光团)发射可检测的信号。
在一些实施方案中,使用可相互作用(形成复合物)以形成生物发光报道蛋白(或蛋白质复合物)的互补肽和多肽。在一些实施方案中,互补肽融合至第一相互作用配偶体且互补多肽融合至第二相互作用配偶体。在一些实施方案中,第一与第二相互作用配偶体形成复合物(例如,通过彼此结合)。在一些实施方案中,第一与第二相互作用配偶体当一者或两者与生物活性剂相互作用时形成相互作用复合物。在一些实施方案中,第一与第二相互作用配偶体在生物活性剂的存在或不存在下形成相互作用复合物。在一些实施方案中,相互作用复合物的形成将互补肽与多肽合在一起形成生物发光报道子。在一些实施方案中,生物发光报道子的形成允许检测相互作用复合物的形成。在一些实施方案中,荧光团拴系至生物活性剂。在一些实施方案中,当形成相互作用复合物且生物活性剂结合至相互作用配偶体或相互作用复合物中的一个时,能量从生物发光报道子转移到荧光团。在一些实施方案中,荧光团允许检测或测量第一与第二相互作用配偶体的相互作用。在一些实施方案中,荧光团允许检测或测量生物活性剂与其结合配偶体(例如,第一相互作用配偶体、第二相互作用配偶体和/或相互作用复合物)的结合。
在一些实施方案中,生物发光报道子的互补肽稠合至目标靶标。提供互补多肽和拴系至荧光团的生物活性剂来检测或测量生物活性剂与目标靶标的相互作用。在一些实施方案中,生物发光报道子的互补肽融合至目标靶标,生物发光报道蛋白的互补多肽,且拴系至荧光团的生物活性剂被用于通过将复合物的成员与多组分发光供体的组分连接来检测荧光标记的配体(例如生物活性剂)与蛋白质复合物的接近性(例如检测与异二聚体或同二聚体受体的选择性结合的配体)。此项应用可由此用于监测可在疾病病状中具有作用的蛋白质复合物内的靶标结合。
在一些实施方案中,细胞靶标和生物发光报道子融合体在其中有待进行测定的细胞中表达。在一些实施方案中,融合体是以或接近细胞靶标的天然丰度表达的。在一些实施方案中,荧光团拴系的生物活性剂在细胞外被添加(例如添加到培养基中)且经由扩散、主动运输、被动运输、胞吞或任何适合的机制进入细胞。在一些实施方案中,变化量的荧光团拴系的生物活性剂被添加至细胞中以测定结合动力学、测定结合亲和力提供足够的信号等。
在某些实施方案中,本发明提供用于检测生物活性剂与细胞靶标(例如,已知的或未知的)之间的胞内相互作用的组合物、方法和系统。在一些实施方案中,生物发光报道子与细胞靶标的融合体是在细胞内表达的。拴系至荧光团的生物活性剂被引入细胞中(例如,荧光团与生物活性剂的缀合物是细胞可渗透的,所述细胞被渗透,等)。生物发光报道蛋白的底物在添加生物活性剂之前、同时或之后被添加至细胞中。来自荧光团的荧光信号的检测(作为bret的结果)指示生物活性剂与细胞靶标之间的胞内相互作用(例如结合)。在一些实施方案中,融合至生物发光报道子的细胞靶标是以天然细胞丰度(例如,相对于天然细胞靶标,或在适于融合的靶标的适当生物功能的水平下)表达。在一些实施方案中,在细胞内检测生物活性剂与细胞靶标的相互作用。
在一些实施方案中,生物活性剂与细胞靶标之间的相互作用的特征通过改变细胞条件或系统条件来分析。例如,在一些实施方案中,细胞靶标的竞争性结合剂(例如,未拴系的生物活性剂)被添加至细胞中以便与荧光团拴系的生物活性剂竞争。
在一些实施方案中,(例如,在溶液中、裂解物中、固定在表面上、表达在细胞内等)提供生物发光报道蛋白标记的细胞靶标的文库。在一些实施方案中,提供缺乏已知的细胞靶标或对细胞靶标的认识不确定或不完全的生物活性剂。生物活性剂的细胞靶标是通过添加生物活性剂到文库中并测定哪一种细胞靶向融合体产生生物活性剂拴系的荧光团的bret诱发荧光来确定的。在一些实施方案中,提供生物发光报道子标记的细胞靶标文库作为编码蛋白质融合体的核酸或包含所述核酸的载体(例如,质粒、bacmam病毒、慢病毒等)的集合。在一些实施方案中,生物发光报道蛋白标记的细胞靶标在细胞内表达。在一些实施方案中,通过在无细胞翻译反应中翻译核酸提供生物发光报道子标记的细胞靶标的文库。在一些实施方案中,细胞靶标融合体的文库或表达细胞靶标融合体的细胞是以微板规格提供。在这样的实施方案中,可以高通量方式(例如,在溶液中、裂解物中、细胞内等)分析生物活性剂(例如经由表型测定或筛选所鉴定的一种生物活性剂)与整个细胞靶标文库的相互作用。在一些实施方案中,生物发光报道子标记的细胞靶标被固定在固体表面上以形成蛋白质阵列。例如,在一些实施方案中,除生物发光报道子之外,细胞靶标还表现为具有标记的融合体或偶联到蛋白质上(例如halotag,promega),从而允许蛋白质共价地固定在固体表面(例如,呈现适当配体(例如halotag配体)的表面)上。在某些实施方案中,潜在的生物活性剂(例如,命中化合物或药物样小分子)的文库被添加至系统(例如阵列)中并且鉴定能产生bret的任何对。在一些实施方案中,对于生物活性剂文库的所有或一部分的细胞靶标是未知的。
在某些实施方案中,本文中的组合物、方法和系统提供生物活性剂与能量受体(例如,荧光团、发色团)的缀合物。在一些实施方案中,生物活性剂是能与细胞生物相互作用的任何小分子(例如,>2000道尔顿、>1000道尔顿、>500道尔顿等)、大分子、合成分子或分子复合物。在一些实施方案中,能量受体是当通过能量吸收(例如共振能量转移)触发时能产生、展现和/或发射信号(例如,光、热、化学反应、荧光、共振能等)的实体。在一些实施方案中,生物活性剂和能量受体(例如荧光团、发色团)通过任何适合的结构或机制(例如,表现为融合构建体(例如有或没有肽接头)、化学上连接(例如直接或间接地)、酶促连接、通过接头(例如肽、核酸、聚合物、酯键、peg接头、碳链等)连接)进行融合、拴系、连接等。在一些实施方案中,生物活性剂与能量受体(例如拴系至荧光团的生物活性剂)的缀合物通过非天然化学合成(例如,目的性地进行不存在于天然细胞中的化学反应)产生。连接的类型不应被视为限制的。
如本文所用,术语“生物活性剂”通常是指任何生理或药理活性物质或适用于检测的物质。在一些实施方案中,生物活性剂是潜在的治疗性化合物(例如小分子、肽、核酸等)或药物样分子。在一些实施方案中,生物活性剂是通过非天然化学合成(例如,目的性地进行不存在于天然细胞中的化学反应)产生的。用于本文所述的实施方案中的生物活性剂不受大小和结构的限制。
在某些实施方案中,提供生物活性剂文库(例如,>10种剂、>50种剂、>100种剂、>500种剂、>1000种剂、>5000种剂、>10,000种剂、>50,000种剂等)。在一些实施方案中,提供系统、方法和组合物用于筛选生物活性剂文库。在一些实施方案中,本发明提供鉴定文库中负责产生、引发、诱发等表型效应和/或活性的生物活性剂的方法。在一些实施方案中,本发明提供鉴定生物活性剂(例如,负责表型效应和/或活性的生物活性剂)的细胞靶标的方法。
如本文所用,术语“能量受体”是指响应于能量吸收(例如共振能量转移)产生容易检测的信号的任何小分子(例如发色团)、大分子(例如自动荧光蛋白、藻胆蛋白、纳米颗粒、表面等)或分子复合物。在某些实施方案中,能量受体是荧光团或其它可检测的发色团。适合的荧光团包括但不限于:氧杂蒽衍生物(例如荧光素、若丹明、俄勒冈绿、曙红、得克萨斯红等)、花青衍生物(例如花青、吲哚羰菁、氧杂碳菁、硫杂碳菁、部花青等)、萘衍生物(例如丹酰和氟硅酸钠(prodan)衍生物)、噁二唑衍生物(例如吡啶基噁唑、硝基苯并噁二唑、苯并噁二唑等)、芘衍生物(例如瀑布蓝)、噁嗪衍生物(例如尼罗红、尼罗蓝、甲酚紫、噁嗪170等)、吖啶衍生物(例如原黄素、吖啶橙、吖啶黄等)、芳基次甲基衍生物(例如金胺、结晶紫、孔雀绿等)、四吡咯衍生物(例如卟吩、酞花青、胆红素等)、cf染料(biotium)、bodipy(invitrogen)、alexafluor(invitrogen)、dylightfluor(thermoscientific,pierce)、atto和tracy(sigmaaldrich)、fluoprobes(interchim)、dy和megastokes(dyomics)、sulfocy染料(cyandye,llc)、setau和square染料(setabiomedicals)、quasar和calfluor染料(biosearchtechnologies)、surelight染料(apc、rpe、percp、藻胆蛋白体)(columbiabiosciences)、apc、apcxl、rpe、bpe(phyco-biotech)、自发荧光蛋白(例如yfp、rfp、mcherry、mkate)、量子点纳米晶体等。在一些实施方案中,荧光团是若丹明类似物(例如羧基若丹明类似物),如美国专利申请序列no.13/682,589中所述的那些,该专利以引用的方式整体并入本文。一些这样的荧光团在本文中于实施例8中描述。在一些实施方案中,bret效率通过若丹明类似物(例如羧基若丹明类似物)作为能量受体与其它荧光团相比的技术特征而显著地增强。例如,这些染料的左移的ec50和减少的非特异性背景对于在一些实施方案中的使用是有利的。
如本文所用,术语“tom”和“nonchlorotom”(或“nct”)是指相同类型的荧光团且在本申请通篇中可互换地使用。
在某些实施方案中,本文中的组合物、方法和系统提供细胞靶标与生物发光报道蛋白(例如,荧光素酶)的融合体。在一些实施方案中,细胞靶标和生物发光报道蛋白通过任何适合的结构或机制(例如,表达为融合构建体(例如,有或没有肽接头)、化学上连接(例如,通过共价键或非共价键)、酶促连接、通过接头(例如肽、核酸、其它聚合物(例如酯键、peg接头、碳链等))连接)进行融合、拴系、连接等。在一些实施方案中,将氨基酸链(例如,3-100个氨基酸)用于连接细胞靶标与生物发光报道蛋白。在一些实施方案中,细胞靶标和生物发光报道子两者的结构和/或功能都不受融合体或接头存在的影响(例如,显著影响)。在某些实施方案中,接头允许融合,而不会损失活性或成员中的一者或两者。在其它实施方案中,氨基酸接头适当地对为与荧光团的能量转移而报道的生物发光体进行间隔和/或定向。
在一些实施方案中,细胞靶标包含任何适用于生物活性剂(例如,小分子、蛋白质、核酸、脂质等)的结合/相互作用配偶体(例如,受体、酶、蛋白质复合物)。然而,在一些实施方案中,实施本发明不需要对细胞靶标与生物活性剂之间的相互作用的认识。在具体的实施方案中,细胞靶标是结合至生物活性剂或另外与生物活性剂相互作用(例如,对生物活性剂具有结合亲和力)的蛋白质或蛋白质复合物。在更具体的实施方案中,细胞靶标是结合至小分子生物活性剂或另外与小分子生物活性剂相互作用(例如,对小分子生物活性剂具有结合亲和力)的受体蛋白或酶。本发明不受细胞靶标的特性、类型或种类的限制。在某些实施方案中,数百、成千或上万更多的不同细胞靶标的文库在本发明中获得应用。细胞靶标的实例可包括核酸(例如dna或rna)、多糖或包含这些中的任一种与多肽的复合物。在一些实施方案中,细胞靶标是g蛋白偶联受体或蛋白激酶。
在某些实施方案中,生物发光报道子是荧光素酶。在一些实施方案中,荧光素酶选自以下中所发现的那些:高斯(gaussia)、鞘翅目(coleoptera,例如萤火虫)、海肾(renilla)、弯喉萤属(vargula)、刺虾属(oplophorus)、多管水母属(aequoria)、其突变体、其部分、其变体、以及适用于本文所述的系统和方法的任何其它荧光素酶。在一些实施方案中,生物发光报道蛋白是来自刺虾属的修饰的增强荧光素酶酶(例如,来自promegacorporation的nanoluc酶,seqidno:1或与其具有至少70%同一性(例如,>70%、>80%、>90%、>95%)的序列)。在一些实施方案中,生物发光报道蛋白是热稳定的宾夕法尼亚萤火虫(photurispennsylvanica)荧光素酶或与其至少具有70%同一性(例如,>70%、>80%、>90%、>95%)的序列。示例性生物发光报道子描述于例如美国专利申请no.2010/0281552和美国专利申请no.2012/0174242中,两者都以引用的方式整体并入本文。
在一些实施方案中,生物发光报道蛋白包含nanoluc(参见,美国专利申请no.2010/0281552和2012/0174242,其以引用的方式整体并入本文)。在一些实施方案中,生物发光报道蛋白包含与保留生物发光特征的seqidno:1具有至少70%同一性(例如,>70%、>80%、>90%、>95%)的多肽。在某些实施方案中,nanoluc酶或其变体的使用提供能够实现本文所述的bret测定的使用的特征(例如,信号强度、亮度、高光输出、窄光谱等)。在一些实施方案中,nanoluc的高光输出能够实现测定组分(例如,编码nanoluc的dna)的低浓度(例如,<1μm、<100nm、<10nm、<1nm等),这对于在生理相关条件下进行测定是有用的。在一些实施方案中,nanoluc能够实现bret在表征表型筛选中所鉴定的细胞靶标中的使用。
在一些实施方案中,提供用于生物发光报道蛋白的底物。在一些实施方案中,生物发光报道蛋白将底物转化为反应产物且释放光能作为副产物。在一些实施方案中,底物是荧光素酶酶的底物。在一些实施方案中,底物是腔肠素的结构变体或衍生物(例如furimazine)。在一些实施方案中,底物是来自刺虾属的修饰的增强的荧光素酶,例如来自promegacorporation的nanoluc酶(例如seqidno:1)的底物。在一些实施方案中,提供生物发光报道蛋白的底物原,其通过化学或物理过程(例如,水解、酶促反应、光裂解等)产生底物。在一些实施方案中,底物原包括腔肠素、腔肠素衍生物、腔肠素的结构或功能等效物、基本上与腔肠素(例如结构上和/或功能上)等效的分子、或功能上或结构上与腔肠素类似的分子。在一些实施方案中,生物发光报道蛋白将腔肠素、腔肠素衍生物、腔肠素的结构或功能等效物、或腔肠素的实质性等效物转化为腔肠酰胺、腔肠酰胺衍生物、腔肠酰胺的结构或功能等效物、或腔肠酰胺的实质性等效物并且释放光能作为副产物。
在一些实施方案中,选择展现(例如生物发光报道子的)发射光谱与(例如荧光团的)激发光谱的足够重叠以(例如通过非辐射偶极-偶极偶合)提供两者之间的高效能量转移的荧光团和生物发光报道子。在一些实施方案中,生物发光报道子的峰值发射与荧光团的峰值发射在波长上基本上分开例如至少80nm、100nm、120nm、140nm等。在具体实施方案中,荧光团与生物发光报道子对的福斯特距离(forsterdistance)较小(例如,<20nm、<10nm、<5nm、<3nm等)。在这样的实施方案中,短福斯特距离导致了以下需要:荧光团与生物发光报道子必须非常接近以便能量转移发生。因此,短福斯特距离减少异常和/或背景信号(例如,通过扩散荧光团和/或报道子而产生)。
在某些实施方案中,选择亮度足以允许检测目标蛋白质和/或融合至生物发光报道子的细胞靶标的天然丰度(或近天然丰度)下的转移信号的荧光团和生物发光报道子。在一些实施方案中,要么选择的荧光团或生物发光报道子会产生不足的能量(光)发射,要么细胞靶标与生物发光报道子的融合体将需要过度表达(例如,超过天然丰度、超过生物学相关水平等),和/或荧光团拴系的生物活性剂的量将必须增加(例如,至潜在的毒性水平、超过生理学相关水平、当可进行动力学实验时的量以上等)。在一些实施方案中,生物发光报道子和荧光团的亮度足以允许检测在浓度和比率范围内的生物活性剂与细胞靶标相互作用。
在一些实施方案中,提供组合物、方法和系统用于鉴定从表型测定或表型筛选中出来的命中化合物的细胞靶标。在一些实施方案中,在识别能引发表型的生物活性剂之后,将拴系至荧光团的“命中化合物”用于通过它们与生物发光报道蛋白的连接(例如,生物活性剂与细胞靶标的结合造成生物发光报道蛋白与荧光团之间的bret)鉴定细胞靶标。在这样的实施方案中,虽然表型与具体的生物活性剂有关,但所述生物活性剂的相互作用配偶体(例如细胞靶标)是未知的或不确定的。在一些实施方案中,拴系至荧光团的生物活性剂能够使表型再生,从而验证生物活性剂与荧光团(或细胞靶标与生物发光报道分子)的拴系不会影响细胞结合模式和/或破坏其生物活性。在一些实施方案中,细胞靶标(每个都融合至生物发光报道蛋白(例如nanoluc))文库的使用由于细胞靶标的不良溶解度或低的天然丰度与其它检测方法(例如质谱分析)相比提供更少干扰。在一些实施方案中,这样一种检测方法提供更高的灵敏度或特异性。在一些实施方案中,通过与生物发光报道蛋白的连接鉴定靶标使得能够通过能量转移来检测,甚至当靶标结合是低效或不完全时也如此。在一些实施方案中,生物活性剂(例如小分子)与细胞靶标的结合是使用竞争性结合测定来表征的(参见图1小图c和d)。在一些实施方案中,bret允许使用结合至细胞靶标上的相同位点的荧光示踪剂(例如荧光团)的竞争性置换分析命中化合物在活细胞中的结合亲和力。在一些实施方案中,本文所述的系统和方法提供以下能力:使用两种不同方法进行靶标识别,由此提供对于鉴定细胞靶标的更高严谨性,解决其它方法的限制的互补方法(例如,bret提供在实验中维持生物活性剂与靶标的平衡的优点)。
本文所述的一些实施方案在药物发现、药物验证、药物靶标发现或药物靶标验证中获得应用。在某些实施方案中,可对生物活性剂(例如药物样小分子)与细胞靶标之间的结合相互作用进行检测、验证和/或表征。在一些实施方案中,生物活性剂对细胞靶标(例如,在溶液中、裂解物中、表面上、细胞中等)的相对结合亲和力可通过其置换已拴系至荧光团的生物活性剂的能力来确定。具体地说,第一生物活性剂相对于第二生物活性剂的更高结合亲和力是通过需要相对于第二生物活性剂的较低浓度的第一生物活性剂置换拴系的生物活性剂来指示。拴系的生物活性剂的置换通过来自融合至细胞靶标的生物发光报道蛋白的能量转移的损失或减少来确定。在一些实施方案中,需要用来置换拴系的生物活性剂的生物活性剂的浓度被用于估计生物活性剂的结合ec50或抑制常数(ki)。在一些实施方案中,新的或修饰的生物活性剂的开发是通过其置换来自一个或多个细胞靶标(每个都融合至生物发光报道蛋白)的一种或多种生物活性剂(每种都拴系至荧光团)的能力来指导。
在一些实施方案中,可通过测定其置换拴系至荧光团的生物活性剂的能力,就其结合融合至生物发光蛋白的靶标的能力对可对细胞靶标具有未知的结合亲和力的化合物集合进行筛选。在一些实施方案中,可通过其相对于来自第二生物活性靶标的第二拴系的生物活性剂置换来自第一细胞靶标的第一拴系的生物活性剂的能力,就其相对于第二细胞靶标优先结合第一细胞靶标的能力对化合物进行筛选。在一些实施方案中,第一和第二拴系的生物活性剂是相同的。
在一些实施方案中,本文所述的系统和方法提供测定生物活性剂(例如,命中化合物、研究先导物、先导化合物等)对野生型和突变形式的细胞靶标(例如靶蛋白)的亲和力的能力。在一些实施方案中,可在细胞中进行荧光标记的生物活性剂(例如药物)与疾病相关的突变蛋白的亲和力和选择性的表征。这类系统和方法可用于区别地鉴定选择性地结合野生型或突变蛋白的生物活性剂(例如药物)。
除主要靶标、预定靶标和/或已知靶标之外,生物活性剂(例如命中化合物)还可结合至非预期的和/或无意的细胞靶标(脱靶)。在一些情况下,生物活性剂的脱靶结合导致与施用生物活性剂有关的一部分治疗作用和/或不良作用。在一些实施方案中,本文所述的系统和方法提供鉴定生物活性剂的脱靶的能力。了解脱靶生物活性剂结合的特性和程度提供关于试剂药理学的有价值的信息。
在一些实施方案中,本文所述的系统和方法提供估计拴系至荧光团的生物活性剂与融合至生物发光报道子的细胞靶标的结合特征(例如,ec50、kd、结合率、环境影响等)的能力。在一些实施方案中,结合特征与同细胞靶标有关的生化、物理或表型特征相关联。在一些实施方案中,bret复合物的形成或溶解的动力学曲线可用于推测未拴系的生物活性剂的缔合速率或解离速率。在一些实施方案中,这些缔合/解离速率可用于估计个别靶标在完整细胞内的药物停留时间。在一些实施方案中,系统和方法可用于针对熵对比焓的相互作用的热力学分子作用机制(mmoa)研究中。在一些实施方案中,通过分离剂进行的拴系的生物活性剂的置换可通过细胞靶标上的分离位点进行。在一些实施方案中,拴系的生物活性剂的结合特征可用于确定翻译后修饰(例如,裂解、磷酸化、甲基化、乙酰化、脂化等)、胞内易位(例如,移动到核、线粒体、膜等)或蛋白质相互作用(例如,与其它蛋白质、核酸、脂质等相互作用)对细胞靶标的影响。一个实施例是通过其对拴系的生物活性剂的结合特征的影响确定抗体对细胞靶标的结合特征。在一些实施方案中,拴系的生物活性剂的结合特征可用于确定生物活性剂或拴系的荧光团的化学修饰或转化的影响(例如,胞内代谢、离子状态的变化等)。
在一些实施方案中,细胞靶标可包含一种以上分子组分。例如,靶标可包含一种以上多肽,且可进一步包含其它天然或合成分子(例如,辅基、辅因子、代谢物、核酸、脂质、碳水化合物等)。在一些实施方案中,拴系至荧光团的生物活性剂结合至第一分子组分,且生物发光报道子融合至第二分子组分,以便当结合至第一分子组分且第一分子组分非常接近于第二分子组分时产生来自拴系的生物活性剂的信号。
对于实施本发明不需要对生物活性剂与细胞靶标之间的相互作用的存在的先验知识。在一些实施方案中,提供通过能量转移的未知或先前未鉴定的相互作用进行的检测和/或表征。本文所述的系统、组合物和方法与其它靶标发现方法相比的优点可包括:宽范围的可能的生物活性剂浓度,因为(在一些实施方案中)它不必在细胞内表达(例如,允许添加足够的受体荧光团以产生可检测的信号);细胞靶标的天然蛋白质浓度(例如,不需要过度表达来获得足够的检测用信号);在读板器上的可检测信号(例如,高通量检测,不必成像);检测在细胞内的相互作用等。
在一些实施方案中,生物活性剂(例如命中化合物)缀合至荧光能量受体染料,且因此修饰剂与其荧光素酶融合的(例如nanoluc融合的)细胞靶标的结合造成从nanoluc到受体染料的能量转移。这样一种系统提供可在活细胞中进行的同源测定。在一些实施方案中,标记的生物活性剂在实验自始至终保持与细胞靶标平衡,从而允许测量以低亲和力与命中化合物相互作用的靶标。在一些实施方案中,bret使得能够通过竞争性置换针对相同结合位点设计的荧光示踪剂来测量活细胞中的结合亲和力。
在一些实施方案中,bret效率通过作为能量供体的nanoluc与其它荧光素酶相比的技术特征而显著提高。例如,nanoluc与常用于bret的其它荧光素酶相比显著更亮,从而允许能量转移在更适用于维持细胞内的相关生物状况的较低表达水平下定量。在一些实施方案中,nanoluc的窄发射光谱通过减少受体信道中的光谱交叉(spectralcross-over)而扩大动态范围。在一些实施方案中,动态范围可通过使用在近红光谱区(600至650nm)中发射的长波长受体进一步扩大。在一些实施方案中,在本发明实施方案的开展期间对多个染料配体的评价显示,若丹明类似物(例如羧基若丹明类似物),如美国专利申请序列no.13/682,589(其以引用的方式整体并入本文)中所述的那些,在与nanoluc一起使用和/或本文所述的bret应用中提供最佳的动态范围。
实施例
实施例1
在本发明实施方案的展开期间进行实验以显示pbi示踪剂缀合物与具有标准染料的缀合物相比在药物示踪剂应用中的改善的性能。在此实施例中,辛二酰苯胺异羟肟酸(saha)的缀合物、组蛋白脱乙酰酶6(hdac6)的抑制剂、以及pbi染料(saha-tom(pbi-4968);参见图8)或标准染料(saha-tamra(pbi-4967);参见图8)被用于使用nanoluc-hdac融合蛋白(seqidno:3)的细胞内bret测定中。
使用fugenehd(promegacorp.)用编码nanoluc-hdac6融合蛋白的质粒dna转染hek293细胞。用无启动子载体dna(pgem3z)以1:1000稀释nanoluc-hdac6dna以在96孔平板规格中产生50ng/孔的总dna最终浓度(在20,000个细胞/孔的接种密度下)。转染后二十四小时,接着在摩尔过量的未标记的saha(作为特异性对照)存在或不存在下将细胞与连续稀释的示踪剂一起孵育。在用药物示踪剂平衡之后,以20um的浓度添加furimazine(nanoluc的腔肠素衍生物底物;promegacorp),且在varioskan光度计上量化bret。特异性bret信号是通过将由saha示踪剂单独产生的信号减去非特异性信号(在未标记的saha存在下)来计算。
图2中的结果显示saha-tom(pbi-4968)缀合物/示踪剂与saha-tmr(pbi-4967)相比产生优良的特异性bret信号并且还产生针对在活细胞内结合的左移的ec50值。作为用于bret应用的药物缀合物,可将pbi-4968tom染料高于其它常用的荧光团的益处用于使用nanoluc融合蛋白文库的竞争性结合测定或靶标识鉴定(化学蛋白质组)筛选。
虽然此实施例证明药物示踪剂与已知的高亲和力靶标的结合,但在其它实施方案中这类示踪剂与nanoluc融合蛋白文库组合以概述(profile)靶标家族中的相对药物亲和力和特异性。在这种实施方案中,概况分析工作有助于鉴定具有混杂的结合概况的药物,这可能与不良的体内药物副作用有关联。
实施例2
在本发明实施方案的开展期间进行实验以显示nanoluc的低表达水平对于bret应用的意外益处。
a)将hek293细胞使用具有变化量的nanoluc-hdac6dna的fugenehd来转染并接种于96孔平板规格中。对于转染,用无启动子载体dna(pgem3z)稀释nanoluc-hdac6dna。最终dna浓度/孔维持在50ng/孔;然而,以1:10、1:100和1:1000稀释nanoluc-hdac6dna(在96孔格式中以20,000个细胞/孔的接种密度)。转染后二十四小时,在固定浓度(1um)的saha-tom(pbi-4968;参见图8)缀合物存在下用连续稀释的saha处理细胞。孵育两小时之后,添加furimazine至20um,且在varioskan光度计上检测bret。图3中的结果显示需要编码nanoluc融合体的dna的出乎意料高的稀释来实现对于bret应用适当的信号本底比。
b)使用范围在未稀释至1:10,000(用无启动子载体dna(如上所述的pgem3z)稀释以维持如上所述的恒定量的dna/转染)内的变化量的dna将编码nanoluc-组胺h1(gpcr)融合蛋白的dna转染到hek293细胞中。转染后二十四小时,将细胞用美吡拉敏-bodipy-633(cellaura)进行连续稀释处理并平衡2小时。然后用furimazine处理细胞至20um的浓度,且在varioskan光度计上检测bret。
图3小图b中的结果表明需要编码nanoluc融合体的dna的大量稀释来产生具有最佳信号本底比的高亲和力相互作用。稀释nanoluc融合蛋白至极低水平的能力在包括nanoluc融合蛋白的竞争性结合测定或靶标鉴定(化学蛋白质组)筛选的各种bret应用中是有益的。
实施例3
在本发明实施方案的开展期间进行实验以显示与传统的生化(基于活性的)形式相比用于量化前药结合的细胞内bret测量的预测值。这个实施例包括天然前药fk228,其需要细胞质的还原环境以变得活化且能够结合至hdac6。
将hek293细胞用以如先前所述的载体dna进行1:1000稀释的编码nanoluc-hdac6的dna转染。转染后二十四小时,在固定浓度(1um)的saha-tom(pbi-4968)缀合物存在下将细胞与连续稀释的天然前药fk-228一起孵育。为了比较,并行进行生化的、基于活性的hdac6测定。简言之,在96孔平板的各孔中在100%dmso中在100x下进行fk-228(selleckchem目录号s3020)的3倍连续稀释。将此100x/100%dmso滴定系列的5μl等分试样添加至245μl单独的hdac-glotmi/ii测定缓冲液(promegacorp.)或245μl补充有2x(0.5mm)dtt的hdac-glotmi/ii测定缓冲液中以便在96孔平板的各孔中制备fk-228的2x/2%dmso主要中间滴定系列。将5μl复制物从此主要中间滴定系列转移到白色384孔测定平板(corning3673)的孔中。将2x(2nm)hdac6(bpsbioscience目录号50006)的5μl添加物添加到所有孔中至1nmhdac6/孔的最终浓度。将10μl酶/抑制剂混合物在室温下预孵育45分钟。将相等体积(10μl)的hdac-glotmi/ii最终检测试剂(promegacorp.)添加至所有孔中(20μl最终测定体积),且在室温下孵育10分钟之后测量发光。对于所有测试条件,hdac-glotmi/ii底物的最终浓度是50μm。使用来自graphpad的prismtm软件对数据进行作图(s形剂量响应-可变斜率)(无dtt:实心圆;0.25mmdtt:空心方块)。
图4小图a和b中的结果表明需要细胞环境用于测量必须由细胞进行加工以变得活化的前药的结合。
实施例4
在本发明实施方案的开展期间进行实验以显示使用渗透剂将不可渗透的药物示踪剂引入细胞中。
将hek293细胞在用如先前所述的无启动子载体dna1:1000稀释dna下,用编码pkcα(pkca)-nanoluc或nanoluc-pkcα的dna转染。转染后二十四小时,用或不用毛地黄皂苷处理细胞至50ug/ml的最终浓度。然后用连续稀释的星形孢菌素-pbi-染料缀合物(pbi-5129;参见图8)处理细胞。将细胞在5um作为用于结合的特异性对照的非缀合的星形孢菌素存在或不存在下共孵育。用示踪剂平衡两小时之后,添加furimazine至20um的最终浓度并且在varioskan光度计上测量bret比率(图5小图a和b)。
在第二实验中,将相同转染的pkca-nanoluc细胞用连续稀释的毛地黄皂苷处理,之后在5um未标记的星形孢菌素(特异性对照)存在或不存在下用固定浓度的星形孢菌素-tom(pbi-5129;参见图8)示踪剂(5um最终浓度)处理(图5小图c)。
图5小图a-c证明使用渗透剂加强不可渗透的药物示踪剂的进入的能力且将此能力应用于nanoluctm融合蛋白文库的基于bret的化学蛋白质组筛选。
实施例5
在本发明实施方案的开展期间进行实验以显示使用nanoluc/bret来测量活细胞中的相对药物亲和力。在一些实施方案中,类似的实验被配置来从高通量化学筛选中优化先导物。
用编码nanoluc-p38融合蛋白的dna转染hek293细胞(在96孔规格中至50ng/孔的最终浓度)。转染后二十四小时,在0.5umpbi-4838存在下用连续稀释的birb-796或pbi-4835处理细胞(birb缀合衍生物;参见,例如美国13/682,589;以引用的方式整体并入本文)。
平衡两小时之后,添加furimazine至20um的浓度,且在varioskan光度计上测量bret。
图6表明剂量-反应bret曲线支持birb-796与pbi-4835相比更高的已知亲和力(“birb衍生物”)。测量未标记的药物的相对亲和力的能力可应用于hts筛选、先导物优化或化学蛋白质组应用。在一些实施方案中,类似的实验被配置来表征从高通量化学筛选中优化的命中化合物(例如,具有针对示踪剂置换的较低的ic50值的化合物将显示与目标靶标的更高结合效率)。
实施例6
在本发明实施方案的开展期间进行实验以显示使用nanoluc/bret监测活细胞中的药物结合动力学。在一些实施方案中,类似的实验被配置来从高通量化学筛选中优化先导物。
用编码nanoluc-p38融合体的dna转染hek293细胞(在96孔规格中至50ng/孔的最终浓度)。转染后二十四小时,用受保护的furimazine(pbi-4378;参见图8)将细胞预处理2小时至20um的最终浓度。在设定至37℃的varioskan光度计上随着时间测量bret。短的预读取之后,用各种浓度的pbi-4838(在1um作为特异性对照的birb796的存在或不存在下)刺激细胞。然后经4小时在动力学上监测bret的剂量和时间依赖性增加。
在单独的实验中,用20umpbi-4377和1umpbi-4838预处理转染的细胞以产生稳定的bret信号。
短的预读取之后,用1um未标记的birb-796刺激细胞,且通过bret实时地监测竞争性置换。
图7小图a-b中的结果支持使用bret在动力学上测量活细胞中的靶标结合。可将这种形式用于活细胞中的nanoluc融合蛋白的hts或化学蛋白质组筛选。在一些实施方案中,类似的实验被配置来表征从高通量化学筛选中优化的先导化合物(例如,对目标靶标具有改变的缔合或解离动力学的化合物)。除提供相对化合物亲和力的测量之外,这类动力学bret测量还能够实现在生物化学上或完整细胞内的靶标停留时间的定量评价。
实施例7
以下实施例涉及使用特异性nanoluc底物(参见图8)或酶组分来区别使用bret的药物结合事件的亚细胞定位。
互补nanoluc酶多肽或肽的物理分离允许nanoluc(供体)信号分离到细胞外隙中。例如,小信号肽遗传拴系至细胞表面受体。一旦外源性添加大信号多肽到细胞培养基中,供体信号便分离到细胞外隙中。此信号分离增加在包括药物示踪剂结合/置换的各种bret应用中产生的信号/背景比。
在一些实施方案中,如果应用不可渗透的nanoluc底物,那么利用全长nanoluc蛋白融合体。
实施例8
以下提供在本发明的实施方案中获得应用的示例性化合物的合成方案。
boc-保护的saha胺
将7-三苯甲氧基氨基甲酰基庚酸(200mg,463umol)与4-[(n-boc)氨甲基]苯胺(113mg,510umol)、hbtu(352mg,927umol)及三乙胺(194ul,1.4mmol)在3mldmf中合并。将反应物搅拌过夜,然后吸附到硅藻土上,并且通过用梯度0->100%etoac的庚烷溶液洗脱的柱色谱获得产物。m+h的计算值:635.3;实测值:635.9
saha胺
将辛二酰基(4-[(n-boc)氨甲基]苯胺)异羟肟酸(286mg,450mmol)溶于其中添加了0.25mltis的2mldcm中。然后添加三氟乙酸(0.9ml),并且搅拌反应物30min。在减压下除去溶剂,并且可通过制备型hplc纯化粗的反应产物或未经进一步纯化使用。
pbi-4967saha-tamra
将辛二酰基[4-(氨甲基)苯胺]异羟肟酸粗反应产物(27mg)与4mg(7.6umol)四甲基若丹明6-琥珀酰亚胺基酯在含有5滴tea的1mldmf中合并。30min之后,用h2o和mecn稀释反应物,且通过制备型hplc(5->60%在0.1%水性tfa中的mecn)分离产物。对适当级分冻干产生呈洋红色固体的所需产物。m+h的计算值:706.3;实测值:706.6。
pbi-4968saha-tom
将辛二酰基[4-(氨甲基)苯胺]异羟肟酸粗反应产物(8mg)与5mg(7.6umol)tom6-琥珀酰亚胺基酯在含有3滴tea的0.8mldmf中合并。30min之后,用h2o和mecn稀释反应物,且通过制备型hplc(5->60%在0.1%水性tfa中的mecn)分离产物。对适当级分冻干产生所需产物。m+h的计算值:838.4;实测值:838.7
星形孢菌素-胺
将星形孢菌素对硝基苯基氨基甲酸酯(3mg,4.8umol)溶于0.5mldmf中并用过量尸胺处理。将反应物在70℃油浴中温热2h,然后用h2o稀释,用甲酸酸化,并且经受用25%->75%在10mm水性nh4oac中的mecn洗脱的制备型hplc。对适当级分进行冻干以得到浅黄色固体。m+h的计算值:595.3;实测值:595.5
pbi-5129星形孢菌素-tom
将星形孢菌素5-氨基戊基甲酰胺(5mg,8.4umol)溶于1mldmf中且用三乙胺和tom6-se(4mg,6umol)处理。通过分析型hplc监测反应。一旦反应完成,便添加mecn和h2o,并且通过添加少量acoh中和tea。制备型hplc(25%->100%在10mmnh4oac中的meoh)及随后的浓缩产生1.8mg深蓝色固体。m+h的计算值:1139.5;实测值:1139.8。
达沙替尼-tom
tom-戊胺
将tom6-羧酸(26mg,46umol)与2当量三乙胺一起在1mldmf中搅拌且用tstu(17mg,56.5umol,1.2当量)处理,并且通过hplc监测反应。40min之后,将反应物添加到尸胺(94mg,0.92mmol,20当量)在0.5mldmf中的溶液中并搅拌20min。然后通过添加tfa中和反应并用mecn和水稀释。制备型hplc(25->100%在0.1%水性tfa中的mecn)及随后的冻干得到呈紫色固体的所需产物。lcms:((m+2h)/2)的计算值:324.4;实测值:324.3。
达沙替尼-tom
将达沙替尼(25mg,51umol)与氯甲酸对硝基苯酯(14mg,69umol,1.36当量)和30ultea在0.9ml2:1dmf:thf中合并。搅拌反应物过夜,然后添加35mg额外的氯甲酸对硝基苯酯。再搅拌24h之后,将1/2体积的反应物添加到7mg(10umol)tom-戊胺在0.5mldmf和30ultea中的溶液中。然后搅拌反应物1h,接着用mecn和水稀释并通过制备型hplc纯化。冻干得到呈紫色固体的所需产物。ms:((m+2h)/2)的计算值:580.8;实测值:581.0。
普瓦纳醇-tompbi5077
将普瓦纳醇(10mg,23umol)在含有20mgtea(198umol)的1mldmf中搅拌并用7.7mg(25.4umol,1.1当量)的tstu处理。30min之后,用et2o稀释反应物并将1/2总反应体积添加到含有6mg(9umol)tom(5-氨基戊基)-6-甲酰胺的小瓶中。搅拌反应物3h,并在减压下除去挥发性有机物。将所得的dmf溶液用水和mecn稀释并用tfa酸化,然后将产物通过制备型hplc(25->100%在0.1%水性tfa中的mecn)分离且随后冻干以产生3.5mg紫色固体。ms:m+h的计算值:1061.5;实测值:1061.6。
实施例9
在本发明的化合物鉴定方法中使用海肾荧光素酶或nanoluc荧光素酶
将hek293细胞使用fugenehd(promegacorporation)用编码nanoluc-p38α或海肾luc-p38α的质粒dna在3:1脂质:dna比率下转染并以每孔20,000个细胞的密度接种到96孔平板中(以产生50ng/孔的dna)。转染后24小时,将细胞培养基更换为不含血清的培养基(opti-mem)并在1umbirb796的存在/不存在下与连续稀释的pbi-4838(缀合至tom染料的birb796衍生物)一起孵育。在37℃下孵育细胞两小时。向表达nanoluc的样品中添加furimazine至20um的最终浓度。向表达海肾luc的样品中添加天然腔肠素至20um的最终浓度。然后在配备有450nm带通和630nm长通滤光片的varioskan光度计上测量bret。bret比率是通过将630信道中的信号除以450信道中的信号来确定的。
图9显示海肾荧光素酶和nanoluc荧光素酶两者都可用于本发明方法中。一旦用连续稀释的pbi-4838处理表达nanoluc-p38α或海肾luc-p38α的细胞,便观察到bret的剂量依赖性增加。饱和浓度的未标记的birb-796能够阻断此bret信号,表明使用任一种荧光素酶融合体对于p38α的结合特异性。
实施例10
tom-birb比对tmr-birb针对nanoluc-p38α的比较
如上所述,将hek293细胞使用fugenehd用编码nanoluc-p38α的质粒dna转染并接种到96孔平板中(以产生50ng/孔的dna)。转染后24小时,将细胞培养基更换为不含血清的培养基(opti-mem)并在1umbirb796的存在/不存在下与连续稀释的pbi-4838(缀合至tom染料的birb796衍生物)或pbi-4836(缀合至tmr染料的birb衍生物)一起孵育。在37℃下孵育细胞两小时。向表达nanoluc的样品中添加furimazine至20um的最终浓度。然后在配备有450nm带通和630nm长通滤光片的varioskan光度计上测量bret。bret比率是通过将630信道中的信号除以450信道中的信号来确定的。
图11显示tom加合物与tmr加合物相比针对以基于细胞形式结合至靶蛋白的提高的效能的另一实例。nanoluc-p38α结合的剂量响应曲线指示birb-tom缀合物的ec50是38nm,相比之下,birb-tmr缀合物的ec50是450nm。birb-tom的报道的亲和力与birb-tmr相比同文献报道更一致(chembioldrugdes2009;74:547-559)。
实施例11
bim-tom比对bim-tmr针对pkcα-nanoluc的比较
如上所述,将hek293细胞使用fugenehd用编码pkcα-nanoluc的质粒dna(1:1000稀释到pgem3z载体dna中)转染并接种到96孔平板中(以产生50ng/孔的总dna)。转染后24小时,将细胞培养基更换为不含血清的培养基(opti-mem)并在5um星形孢菌素的存在/不存在下与连续稀释的pbi-5075(缀合至tom染料的bim)或pbi-5051(缀合至tmr染料的bim)一起孵育。在37℃下孵育细胞两小时。向表达nanoluc的样品中添加furimazine至20um的最终浓度。然后在配备有450nm带通和630nm长通滤光片的varioskan光度计上测量bret。bret比率是通过将630信道中的信号除以450信道中的信号来确定的。为了测定特异性bret信号,将未标记的星形孢菌素不存在下每个浓度的示踪剂的bret比率减去每个浓度的示踪剂+未标记的星形孢菌素的bret比率。
图12显示tom加合物与tmr加合物相比针对以透化细胞形式结合至靶蛋白的提高的效能的另一个实例。pkcα-nanoluc结合的剂量响应曲线指示bim-tom缀合物的ec50是483nm,相比之下,bim-tmr缀合物的效能显著右移。bim-tom的报道的亲和力与bim-tmr相比同文献报道更一致(jbiolchem.1991年8月25日;266(24):15771-81)。
实施例12
通过p38/mapk途径的靶标鉴定-选择性测定
以下实施例用来证明概述药物示踪剂对给定的系统发生靶标家族内的一组推定的靶标的选择性的能力。类似的实验配置可用于在细胞中使用bret来鉴定荧光标记药物的靶标。此配置可实现对主要药物靶标以及脱靶相互作用物的鉴定。多个靶标的结合可指示药物混杂性和潜在的药物副作用。此实施例用来证明经由bret测量主要以及次要靶标相互作用的能力。
将hek293细胞使用fugenehd(promegacorporation)在3:1脂质:dna的比例下用编码针对mapk途径的各种成员(分别是jnk1、jnk2、jnk3、p38α、p38β、p38γ、p38δ、或pkcα或mapk8、9、10、14、11、12或13、pkcα)的n端或c端nanoluc融合体的质粒dna转染,并以每孔20,000个细胞的密度接种于96孔平板中(产生50ng/孔的dna)。转染后24小时,将细胞培养基更换为不含血清的培养基(opti-mem)并在4umbirb796的存在或不存在下与2umpbi-4838一起孵育。在37℃下孵育细胞两小时。向表达nanoluc的样品中添加furimazine至20um的最终浓度。然后在配备有450nm带通和630nm长通滤光片的varioskan光度计上测量bret。bret比率是通过将630信道中的信号除以450信道中的信号来确定的。为了测定响应比率,将示踪剂单独的bret值除以示踪剂+未修饰的birb796的bret值。
图13指示pbi-4838对jnk2、p38β和p38α的选择性,与文献报道一致。p38α被识别为birb796的主要靶标。然而,与靶标如jnk2和p38β的相互作用可指示潜在的脱靶倾向。如所预期,与pbi-4838合并的pkcα-nanoluc融合体显示相对较小的特异性bret信号,这是由于birb796对此靶标的不良亲和力。
实施例13
通过p38/mapk途径的靶标鉴定-亲和力测定
以下实施例用来证明概述药物示踪剂对给定的系统发生靶标家族内的一组推定的靶标的亲和力的能力。类似的实验配置可用于在细胞中使用bret来表征荧光标记的药物对给定靶标的亲和力。
将hek293细胞使用fugenehd(promegacorporation)用编码nanoluc-p38α、nanoluc-p38β、jnk2-nanoluc、pkcα-nanoluc或nanoluc-hdac6的质粒dna在3:1的脂质:dna比率下转染,并以每孔20,000个细胞的密度接种到96孔平板中(产生50ng/孔的dna)。转染后24小时,将细胞培养基更换为不含血清的培养基(opti-mem)并在4umbirb796的存在或不存在下与连续稀释的pbi-4838一起孵育。在37℃下孵育细胞两小时。对于一组单独的样品,将转染的细胞在1umpbi-4838存在下用连续稀释的birb796处理。向表达nanoluc的样品中添加furimazine至20um的最终浓度。然后在配备有450nm带通和630nm长通滤光片的varioskan光度计上测量bret。bret比率是通过将630信道中的信号除以450信道中的信号来确定的。
图14和15显示pbi-4838对jnk2、p38β和p38α的表观亲和力。如所预期,pkcα和hdac6示出相对较小的特异性bret信号,这是由于pbi-4838对这些靶标的不良亲和力。此外,birb796对jnk2、p38α和p38β的高亲和力是通过细胞中的竞争性置换来证明的。类似的实验可被配置来为药物示踪剂对给定组的靶标(通过bret的增加)或未修饰的药物(通过竞争性置换)的亲和力进行排序。如上所指出,与靶标如jnk2和p38β的高亲和力相互作用可指示潜在的脱靶倾向。
实施例14
药物示踪剂对于野生型对比突变形式的靶蛋白的亲和力测定
以下实施例用来证明测量药物示踪剂对野生型对比突变靶蛋白的相对亲和力的能力。在此实施例中,测定荧光标记的ibet化合物(结合brd4以防止其与乙酰化组蛋白相互作用的小分子抑制剂)对野生型和突变形式(n140a/n433a;缺乏对ibet的完全结合力)brd4(含有溴结构域的蛋白4)的亲和力。类似的实验配置可用于表征细胞中的荧光标记药物对疾病相关突变蛋白的亲和力和选择性。这类实验可用于区别地鉴定选择性地结合至野生型或突变蛋白的药物。
将hek293细胞使用fugenehd(promegacorporation)用编码nanoluc-brd4或nanoluc-brd4(n140a/n433a)的质粒dna在3:1脂质:dna的比率下转染,并以每孔20,000个细胞的密度接种到96孔平板中(产生50ng/孔的dna)。转染后24小时,将细胞培养基更换为不含血清的培养基(opti-mem)并在10umibet的存在/不存在下与连续稀释的pbi-4966(缀合至tom染料的ibet)一起孵育。在37℃下孵育细胞两小时。向表达nanoluc的样品中添加furimazine至20um的最终浓度。然后在配备有450nm带通和630nm长通滤光片的varioskan光度计上测量bret。bret比率是通过将630信道中的信号除以450信道中的信号来确定的。
图16显示pbi-4966对野生型brd4对比突变型brd4的相对亲和力。如所预期,观察到突变型brd4的右移效能,表明pbi-4966的亲和力降低。类似的实验可被配置来对药物示踪剂对于靶标的疾病相关的突变体的亲和力进行排序。此原理可扩展到通过竞争性示踪剂置换来测量药物对野生型或突变蛋白的相对亲和力。因为增加的bret信号仅指示与nanoluc融合体的结合,所以此方法能够测量在测定样品中存在的类似抗原的复合混合物中的靶标结合。这些抗原可包括具有类似性质但与目标靶标不相同的靶标(例如,为了区别异源比对内源分析物或突变体比对野生型分析物等)。
实施例15
筛选化合物组以确定靶标结合
以下实施例表明本发明的方法可用于筛选化合物组以确定靶标结合。此筛选方法还可扩展至更大的化合物文库(例如lopac)。
将hek293细胞使用fugenehd用nanoluc-hdac6dna转染并接种于96孔平板的各孔中。对于转染,用无启动子载体dna(pgem3z)稀释nanoluc-hdac6dna。最终dna浓度/孔维持在50ng/孔;然而,以1:1000稀释nanoluc-hdac6dna(在96孔规格中接种密度为20,000个细胞/孔)。转染后二十四小时,在固定浓度(1um)的saha-tom缀合物(pbi-4968)存在下用连续稀释的抑制剂(参见图17)处理细胞。孵育两小时之后,添加furimazine至20um,且在varioskan光度计上检测bret。
图17中的结果表明结构上不同的化合物可通过使用本发明方法进行药物示踪剂的竞争性置换来鉴定。此外,各种化合物类别的相对效能可得到证实。结果表明与panabinostat或saha对hdac6的高结合效率相比,阿匹西汀对hdac6的结合效率几乎没有或没有。这与使用正交测定形式的文献报道一致。此筛选方法可扩展以包括大化学品文库的高通量筛选,以便鉴定/表征对给定靶标具有抑制潜能的新化学物质。
实施例16
监测药物-靶标相互作用
通常认为高度的非特异性bret出现在具有显著光谱重叠的荧光团存在下的含有荧光素酶的培养基中(couturier2012)。这被描述为使用bret进行高通量化学筛选的倾向。以下实施例用来证明在荧光素酶nanoluc存在下在通常被bret视为成问题的浓度范围内的培养基中使用荧光团-药物缀合物监测药物/靶标相互作用的能力。
将hek293细胞使用fugenehd(promegacorporation)用编码cdk2-nanoluc的质粒dna(1:100稀释到pgem3z载体dna中)在3:1脂质:dna的比率下转染并以每孔20,000个细胞的密度接种到96孔平板的孔中(产生50ng/孔的总dna)。转染后24小时,将细胞培养基更换为不含血清的培养基(opti-mem)并在10um普瓦纳醇b的存在/不存在下与连续稀释的pbi-5077(缀合至tom染料的普瓦纳醇b)一起孵育。细胞在37℃下孵育两小时。
向表达nanoluc的样品中添加furimazine至20um的最终浓度。然后在配备有450nm带通和630nm长通滤光片的varioskan光度计上测量bret。bret比率是通过将630信道中的信号除以450信道中的信号来确定的(图18)。
此实施例支持在培养基中使用荧光团示踪剂来经由bret监测药物/靶标相互作用。通过将样品(+药物示踪剂)与普瓦纳醇b(未修饰的药物)共同孵育,可测量nanoluc与示踪剂之间的非特异性bret信号。在所测试的示踪剂浓度范围中,此背景bret信号是低的。这些结果表明可在细胞培养基中监测药物示踪剂与nanoluc-靶标融合体之间的特异性结合,尽管nanoluc(供体)与荧光团(受体)之间有显著的光谱重叠。
实施例17
使用蛋白阵列的靶标id筛选
以下实施例证明使用无细胞的表达产生nanoluc融合体阵列并且通过bret测量药物结合和相对亲和力的能力。
11种激酶(n端和c端nanoluc融合体)的组,包括birb796的推定靶标(如mapk和jnk家族的成员)、达沙替尼的推定靶标(如src和lck)以及不相关的hdac6阴性对照,是在如制造商所推荐的
结果(图19)表明birb-tom示踪剂对jnk2、jnk3、mapk14、mapk11和mapk13的选择性以及达沙替尼-tom示踪剂对abl1、src、lck、mek5、mapk11和mapk14的选择性与文献报道一致。这些结果证明概述药物示踪剂针对在无细胞的表达系统中表达的一组推定靶标并鉴定命中物的能力。此无洗涤蛋白nanoluc融合体阵列配置可实现对主要药物靶标以及脱靶相互作用物的鉴定。
以上筛选之后,进一步分析birb-tom命中物对birb-tom示踪剂的结合亲和力以及用birb796对birbtom示踪剂的竞争性置换。通过在10umbirb796的存在/不存在下将稀释的tnt反应物的3份复制品与连续稀释的birb-tom示踪剂一起孵育来进行与birb-tom示踪剂的结合亲和力实验。在室温下在恒定的混合下孵育反应物两小时并且在添加furimazine至20um的最终浓度之后如上所述进行分析。通过在2umbirb-tom示踪剂的存在下将稀释的tnt反应物的3份复制品与连续稀释的birb796一起孵育来进行竞争性置换实验。在室温下在恒定的混合下孵育反应物两小时并且在添加furimazine至20um的最终浓度之后如上所述进行分析。图19中的竞争性置换实验结果表明birb796对mapk14和jnk2具有最高亲和力,而对mapk11、mapk13和jnk3具有较低的亲和力。与文献报道一致,birb796有效地结合mapk14,而且还结合其它mapk和jnk家族成员,表明对birb-796的脱靶责任。这些结果表明在无细胞的表达系统中表达且在蛋白阵列筛选中鉴定的命中物可通过bret来进一步分析与药物的结合亲和力。此外,结果支持使用无细胞的表达系统来产生nanoluc蛋白融合体作为适用于靶标结合应用的分析物。
实施例18
nanoluc融合体的表达水平
以下实施例表明当nanoluc融合体的表达接近于内源水平时,实现与具有最佳信号本底比的药物示踪剂的高亲和力相互作用。如先前所述,已证实需要用载体dna1:1000稀释nanoluchdac6dna来实现高亲和力相互作用。在此实施例中,使用蛋白质印迹分析将nanoluchdac6dna的连续稀释物的表达与内源hdac6的表达相比较。
将hek293细胞以2.5×105个细胞/孔接种于6孔平板的孔中并用具有变化量的nanoluchdac6dna的pei转染。用非表达载体dna(pcineo)稀释nanoluchdac6dna。dna的最终浓度保持在2ug/孔,而nanoluchdac6dna被稀释1:0、1:10、1:100、1:1000和1:10000。对照是未转染的细胞。转染后24小时,除去培养基,且将细胞用pbs洗涤并用400ul哺乳动物裂解缓冲液(promega)+1:50rq1dnase(promega)+1xrq1缓冲液裂解10min。裂解之后,将133ul4xsds-加样缓冲液添加到每孔中,并且收集细胞裂解物,在sds-page凝胶上分析并电转移到pvdf膜(invitrogen)上。将膜在tbs缓冲液中用5%bsa(promega)阻断1小时且在4℃下在补充有0.1%吐温(tbst)的tbs中用hdac6抗体(millipore)的1:500稀释物探测过夜。在tbst中洗涤3次之后,将膜用在tbst中的抗兔hrp抗体(jackson)孵育1小时,然后用tbst洗涤5次并用tbs洗涤1次。然后将膜与来自promega的ecl底物孵育1min并在imagequantlas4000(ge)上扫描。结果(图10)表明nanoluchdac6dna的1:1000稀释物具有类似于内源hdac6的表达水平的表达水平。这是提供与具有最佳信号本底比的药物示踪剂的高亲和力相互作用的相同稀释。
实施例19
荧光细胞因子与细胞表面受体和nanoluc的融合体结合的量化
在本发明实施方案的开展期间进行实验以证明通过荧光标记的细胞因子的竞争性置换测量治疗性抗体针对细胞表面受体的相对亲和力的能力。在此实施例中,将商购获得的tamra-表皮生长因子(tmr-egf;lifetechnologies)应用于使用表达nanoluc-egfr(her1)融合蛋白的稳定细胞系的细胞bret测定中。一旦用已知干扰egf结合的治疗性抗体处理,在tmr-egf与nanoluc-egfr之间产生的bret信号便可受到抑制。
通过pf5nanoluc-egfr质粒dna(promegacorp.)和fugenehd(promegacorp.)的转染生成hek293稳定细胞系。转染之后,通过g418选择、接着有限稀释克隆生成稳定的细胞系。将表达nanoluc-egfr的源于克隆的细胞以每孔20,000个细胞的密度接种于96孔平板中。接种后20小时,将培养基更换为无血清的optimem且对细胞进行血清饥饿。饥饿之后,用连续稀释的tmr-egf(lifetechnologies)处理细胞。与tmr-egf平衡之后,以20um的浓度添加furimazine(nanoluc的腔肠素衍生物底物;promegacorp),且在varioskan光度计上量化bret。在随后的实验中,通过在用tmr-egf(10ng/ml最终浓度)刺激之前用维克替比、爱必妥或赫赛汀(阴性对照)预处理细胞来测量tmr-egf的抗体介导的置换。
图20中的结果表明bret可用于量化荧光细胞因子与拴系到nanoluc的细胞表面受体的结合。此外,能抑制细胞因子结合的治疗性抗体的亲和力可通过荧光细胞因子的竞争性置换来测量。维克替比和爱必妥能够抑制tmr-egf与nanoluc-egfr的结合,而赫赛汀(对her1具有可忽略的亲和力的her2结合剂)不能抑制tmr-egf结合。此实施例表明荧光细胞因子与已知的高亲和力靶标的结合可通过bret、以可容易被重新配置以便通过荧光细胞因子的竞争性置换监测治疗性抗体(例如维克替比、爱必妥等)或其它结合剂(例如细胞因子生物制剂)的结合的形式来量化。这证明了使用bret作为以细胞形式测量生物药物的相对效能的技术的能力。
实施例20
bret应用
在一些实施方案中,本发明能够检测/测量集合在一起的三个部分:(1)生物发光报道蛋白的肽和(2)通过结构互补进行相互作用以形成复合物的生物发光报道蛋白的多肽,以及(3)荧光第三部分(例如荧光小分子)。
a)此实施例显示来自由形成生物发光复合物的结构上互补肽(seqidno:6)和多肽(seqidno:7)形成的生物发光复合物的能量转移。荧光染料附着于互补肽序列。或者,荧光蛋白可与肽或多肽(例如由遗传构建体形成)融合(例如融合蛋白)。
制备表达互补多肽序列的大肠杆菌澄清的裂解物(聚裂解物)。将40ul聚裂解物与10ul互补肽(pep)或荧光标记的互补肽(pep-tmr)混合并在rt下孵育10min。添加50ul100um在50mmhepesph7.4中的用于复合物的底物(furimazine)并在rt下孵育30min。在tecanm1000上在400-700nm下测量发光。
图21示出从poly/pep复合物(供体)向tmr(受体)的非常有效的能量转移,以及在发射光的波长下的相应红移。
b)此实施例显示在检测中使用bret,如检测小分子浓度或酶活性。因为能量转移非常依赖于距离,所以能量转移的幅度可经常与系统的构造有关。例如,螯合钙的多肽的插入可用于通过能量转移的调制测量钙浓度。
还通过引起如上的传感蛋白的构象变化或通过从荧光部分裂解传感蛋白而改变距离的酶可通过如本文所述的系统来测量。复合物的一个结构上互补成员结合至当生物发光报道蛋白的结构上互补肽和多肽相互作用时转移其能量的荧光部分。其中一个实例是已经制造的肽传感蛋白,其中肽经由接头(例如,devd胱天蛋白酶-3裂解位点)缀合至荧光染料。当暴露于互补多肽时,观察到能量转移。当暴露于胱天蛋白酶-3时,荧光部分从复合物释放,并且能量转移被排除但在460nm下保持发光。
对互补多肽(seqidno:8)和nl-ht(融合至halotag的nanoluc)进行纯化。将20ul的8pmnl-ht与20ul的100nmpbi-3781(参见,例如美国专利申请序列no.13/682,589,以引用的方式整体并入本文)混合并在rt下孵育10min。添加40ulnanoglo+100umfurimazine,且在tecanm1000上在300-800nm下测量发光。
将20ul的33ng/ul互补多肽(seqidno:6)与20ul的~500umpbi-5074(荧光染料-接头-互补肽)混合。添加40ulnanoglo+100umfurimazine,且在tecanm1000上在300-800nm下测量发光。
图22示出从互补肽/多肽复合物(供体)向pbi-5074的tom-染料(受体)的能量转移,以及在发射光的波长下的相应红移。
c)三级相互作用
与生物发光报道蛋白的结构上互补对的能量转移还可用于测量三个分子相互作用。一个实例是融合至生物发光报道蛋白的互补多肽的gpcr以及与当它们相互作用时形成生物发光复合物的生物发光报道蛋白的互补肽融合的gpcr相互作用蛋白。这允许测量二级相互作用。如果带有用于能量转移的荧光部分的小分子gpcr配体与所述复合物相互作用,那么便发生能量转移。因此,二级蛋白-蛋白相互作用和三级药物-蛋白-蛋白相互作用可在相同的实验中测量。并且,荧光分子仅当与蛋白质对相互作用时产生信号,这将除去来自与无活性蛋白质相互作用的配体的任何信号(图23)。
实施例21
使用多组分供体的bret
以下实施例表明配体-受体相互作用可经由来自多组分发光供体的能量转移来监测,其中光发射需要供体组分的同时存在。在此实施例中,供体由两个互补亚基组成,即11s多肽和pep-80肽。11s多肽遗传拴系至brd4的n端,且融合蛋白在hek293细胞中表达。仅在furimazine()和pep-80互补多肽两者的存在下从融合蛋白产生发光(图24小图a)。与单独furimazine(没有pep-80肽)孵育的细胞裂解物不产生显著的供体信号或受体信号(图24小图a、图25小图a)。当应用荧光brd4配体(ibet-nct)的溶液时,仅在pep-80肽存在下产生剂量依赖性bret信号(图24小图b、图25小图a、图25小图b)。此外,此bret信号可经由通过非荧光brd4配体进行的竞争性结合而减弱,表明信号特异性(图25小图a)。
将hek293细胞使用fugenehd用11s-brd4dna转染并接种于96孔平板规格中。对于转染,用无启动子载体dna(pgem3z)稀释11s-brd4dna。最终dna浓度/孔维持在50ng/孔;然而,以1:10稀释11s-brd4dna(在96孔规格中以20,000个细胞/孔的接种密度)。转染后二十小时,在1umpep-80肽的存在或不存在下在optimem+50ug/ml毛地黄皂苷中裂解细胞。然后在10um作为特异性对照的ibet存在或不存在下用连续稀释的ibet-nct(pbi-4966)处理细胞。孵育1小时之后,添加furimazine至10um,且在varioskan光度计上检测bret。
由此实施例说明的概念可应用于通过将复合物的成员连结至多组分发光供体的组分来检测荧光标记的配体与蛋白质复合物的接近性(例如,检测选择性地结合至异二聚体或同二聚体受体的配体)。此应用可由此用于监测疾病相关的蛋白质复合物内的靶标结合。
实施例22
在本发明实施方案的开展期间进行实验以显示细胞内配体-受体相互作用可经由来自蛋白质复合物的能量转移来监测,其中光发射需要发光供体组分接近,这是通过蛋白质之间的相互作用来促进。在此实施例中,供体由两个亚基组成,即11s多肽和114肽。11s肽遗传拴系至brd4的n端,且114肽遗传拴系至组蛋白h3.3的c端。这些融合蛋白同时在hek293细胞中表达。仅在两种融合构建体存在下由融合蛋白产生发光(图26小图a)。单独表达11s-brd4、单独表达h3.3-114的细胞或各种对照构建体不产生显著的供体信号或受体信号(图26)。当应用荧光brd4配体(ibet-nct/pbi-4966)的溶液时,仅在用11s-brd4和组蛋白h3.3-114共转染的样品中产生剂量依赖性受体信号(图27)。当表示为bret比率(610/450)时,仅从11s和114亚基与ibet-nct或nanoluc-brd4与ibet-nct的强化复合物观察到特异性bret。此外,此bret信号通过非荧光brd4配体(ibet151)的竞争性结合以剂量依赖性方式减弱,表明信号特异性(图28)。
将hek293细胞使用fugenehd用brd4dna融合构建体+/-组蛋白h3.3dna融合构建体转染并接种于96孔平板规格中。对于转染,用无启动子载体dna(pgem3z)稀释报道子构建体。最终dna浓度/孔维持在50ng/孔;然而,以1:10稀释每个dna表达构建体(在96孔规格中以20,000个细胞/孔的接种密度)。转染后二十小时,在10um作为特异性对照的ibet151存在或不存在下用连续稀释的ibet-nct(pbi-4966)处理细胞。为了确定ibet-151是否可以剂量依赖性方式与ibet-nct示踪剂竞争,在固定浓度(2um)的ibet-nct/pbi-4966示踪剂存在下用连续稀释的ibet-151处理转染的细胞。孵育1小时之后,添加furimazine至10um,且在varioskan光度计上检测bret。
由此实施例说明的概念可应用于通过将复合物的成员连结至多组分发光供体的组分来检测荧光标记的配体与蛋白质复合物的接近性(例如,检测选择性地结合至异二聚体或同二聚体受体的配体)。此应用可用于监测蛋白质复合物内的靶标结合。此外,此技术能够鉴定或表征对疾病相关的细胞内蛋白质复合物有选择性的化合物。
实施例23
在本发明实施方案的开展期间进行实验以证明使用bret概述药物针对给定的系统发生靶标家族内的一组推定的靶标的细胞内选择性和亲和力的能力。在此实施例中,概述伏立诺他(saha)在细胞内对i类/ii类/iv类(非sirtuin)hdac的整个组的结合。首先,使用bret概述针对各种nanoluc/hdac融合体的荧光saha衍生物(saha-nct)。一旦证实在个别nanoluc/hdac融合体与saha示踪剂之间的能量转移,便通过每个能量转移复合物的竞争性破坏来确定saha的亲和力。然后可通过在每个实验中产生的ic50值来推测亲和力。此外,抑制剂对个别结构域的亲和力可经由nanoluc与靶蛋白的分离结构域的遗传融合来确定。
saha示踪剂在细胞内对个别hdac的亲和力的测定。将hela细胞用编码具有整个家族的非sirtuin组蛋白脱乙酰基酶(hdac1-11)的nanoluc融合体的质粒dna转染。将细胞通过将每个dna构建体以1:100的质量比稀释到pgem3z载体dna中并在3:1脂质:dna的比率下使用fugenehd(promegacorporation)形成脂质dna复合物来转染。然后将转染的细胞以每孔20,000个细胞的密度接种于96孔平板中(总共产生50ng/孔的dna)。转染后24小时,将细胞培养基更换为不含血清的培养基(opti-mem)并在20umsaha的存在或不存在下与连续稀释的pbi-4968一起孵育(后一样品用于量化非特异性bret)。在37℃下孵育细胞两小时。向表达nanoluc的样品中添加furimazine至10um的最终浓度。然后在配备有450nm带通和610nm长通滤光片的bmgclariostar光度计上测量bret。bret比率是通过将630信道中的信号除以450信道中的信号来测定。为了确定特异性背景校正的bret值,将单独示踪剂的bret值减去每个示踪剂浓度下的非特异性bret值。
实施例24
以下实施例用来证明通过使用bret成像以单细胞分辨率测量化合物与细胞内靶标结合的能力。此实施例显示saha及其荧光衍生物saha-nct(pbi-4968)与nanoluc-hdac6和hdac10-nanoluc在活细胞中的结合。
通过bret成像测量活细胞中saha和saha-nct与hdac6和hdac10的结合。将hela细胞用编码分别具有hdac6和hdac10的nanoluc融合体的质粒dna转染。将细胞通过将每个dna构建体以1:100的质量比稀释到pgem3z载体dna中并通过在3:1脂质:dna比率下添加fugenehd(promegacorporation)形成脂质dna复合物来转染。将转染复合物与细胞悬浮液(1e5个细胞/ml)混合,接着以每盘200,000个细胞的密度涂布到玻璃底的35mm盘中(总共产生50ng/孔的dna)。转染后24小时,将细胞培养基更换为不含血清的培养基(opti-mem)并在10mmsaha的存在或不存在下与2mmpbi-4968一起孵育。在37℃下孵育细胞两小时。向表达nanoluc的样品中添加furimazine至10um的最终浓度。使用olympuslv200生物发光显微镜对样品进行成像。为了通过bret测量pbi-4968与nanoluc-hdac6或hdac10-nanoluc的结合和置换,分别使用495短通和590nm长通滤光片获取连续的图像(图34和35)。使用图像分析程序imagej定量地分析表示单独细胞的图像部分。bret比率是通过将针对590信道获得的值除以450信道的值来测定的。针对每份样品分析最少100个单独细胞。所有数据都以点阵图形式概括(图36)。saha和saha-nct的特异性结合通过比较分析从三个不同样品获得的bret值来证明。
样品1-阴性对照(未处理的),
样品2-阳性对照(2mmpbi-4968),
样品3-示踪剂置换(2mmpbi-4968+10mmsaha)
结果证明pbi-4968以及saha与hdac家族的不同成员(hdac6和10)在单细胞水平上的细胞摄取和特异性结合。结果表明摄取和/或结合的程度在细胞群体中相当大地变化。基于图像的bret测定形式能够分析在单细胞水平上的靶标特异性化合物结合以便基于细胞类型、细胞密度、细胞周期状态以及需要分析用的单细胞分辨率的其它生理参数确定差异。
在本申请中提到和/或以下列出的所有公布和专利以引用的方式并入本文。本发明所述的方法和组合物的各种修改和变化在没有偏离本发明的范围和精神下对本领域技术人员是显而易见的。虽然本发明已结合具体优选实施方案来描述,但应理解如所要求的本发明不应不当地限于这类具体实施方案。实际上,对相关领域技术人员来说明显的用于进行本发明的所述模式的各种修改旨在以下权利要求书的范围内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种基于荧光共振能量转移技术的前列腺素受体4筛选模型的制作方法
- 一种基于荧光共振能量转移技术的g蛋白偶联受体40筛选模型的制作方法
- 一种基于荧光共振能量转移技术的血管活性肠肽i型受体抑制剂高通量筛选方法
- 一种基于荧光共振能量转移技术的多巴胺5受体抑制剂高通量筛选方法
- 一种基于荧光共振能量转移技术的阿尔法1d受体筛选模型的制作方法
- 基于荧光共振能量转移的双酚a痕量检测法
- 一种基于荧光共振能量转移技术的黑素皮质素受体1药物筛选模型的制作方法
- 一种基于荧光共振能量转移技术的阿尔法1b受体筛选模型的制作方法
- 一种基于荧光共振能量转移技术的白三烯b4受体1拮抗剂药物筛选模型的制作方法
- 一种采用共振能量转移层的宽波段太阳能电池的制作方法