一种筛查谷氨酸棒杆菌中蛋白相互作用的方法与流程
本发明属于生物工程
技术领域:
,涉及一种筛查谷氨酸棒杆菌中蛋白相互作用的方法。
背景技术:
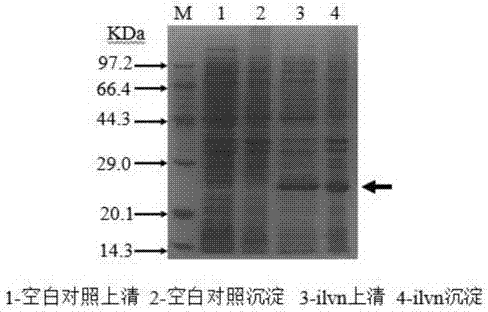
:谷氨酸棒杆菌(corynebacteriumglutamicum),被广泛应用于l-谷氨酸、l-赖氨酸等大多数氨基酸的生产,在工业应用方面有着举足轻重的地位。在谷氨酸棒杆菌中,各种氨基酸,特别是分支链氨基酸(缬氨酸、亮氨酸、异亮氨酸)的合成途径存在密切的关联,多种关键酶之间相互影响。蛋白质相互作用研究的不足,限制了谷氨酸棒杆菌的进一步工业应用。近年来,通过将生物化学、生物物理学,分子生物学、遗传学、微生物学、蛋白质组学和生物信息学等的理论和研究成果有机结合,发展了许多有效的研究蛋白质间相互作用的方法。这些方法设计巧妙实用,能全面的揭示生命现象中生物功能的精确调控过程和影响生命变化的分子基础,不仅有极大的实用价值,而且有潜在的启发和指导意义。现阶段人们对谷氨酸棒杆菌中的蛋白相互作用研究较少。针对这一现状,本发明提供了一种筛查谷氨酸棒杆菌中蛋白相互作用方法,对于解析谷氨酸棒杆菌中氨基酸合成的相互关联,拓宽谷氨酸棒杆菌的工业应用具有重要的意义。技术实现要素:本发明目的是解决筛查谷氨酸棒杆菌中蛋白相互作用的问题,提供一种筛查谷氨酸棒杆菌中蛋白相互作用的方法,采用本方法能够简单快速的寻找到谷氨酸棒杆菌中与目的蛋白质存在相互作用的蛋白。利用该方法获得的谷氨酸棒杆菌中蛋白相互作用关系,为进一步协调代谢工程改造以及在其他方面的应用提供有效策略和指导。本发明所采用的技术方案如下:一种筛查谷氨酸棒杆菌中蛋白相互作用的方法,包括以下步骤:1.目的基因的克隆以及原核表达载体构建根据谷氨酸棒杆菌目的基因的全序列,在目的基因两端引入双酶切位点,利用pcr技术扩增目的基因片段,并进行测序验证。将克隆产物和带his-taq的原核表达载体用相同内切酶进行酶切并连接,构建好的原核表达质粒转化到大肠杆菌e.colidh5α中,提取质粒并对构建好的质粒进行双酶切验证。2.构建蛋白表达菌株以及目的蛋白的大量表达;将步骤1中构建好的载有谷氨酸棒杆菌目的基因的原核表达载体转化到大肠杆菌e.colibl21或者e.colirosetta菌株中,添加诱导剂诱导目的基因表达,通过sds-page检测目的蛋白表达情况。从诱导温度、诱导时间、加诱导剂时od和诱导剂的添加量等方面对目的蛋白表达条件进行优化以确定最佳条件,使带his-taq的可溶性目的蛋白大量表达。3.谷氨酸棒杆菌胞内蛋白的提取;收集菌体,先用液氮研磨2~4次,用lysisbuffer重悬,加入蛋白酶抑制剂,在冰上进行超声破碎。离心收集上清。4.对目的蛋白进行纯化以及用his-pulldown技术捕获互作蛋白;(1)取适量ni+混合树脂于柱内,用lysisbuffer冲洗平衡好。将破碎液上清与平衡好的ni+树脂混合,使用小型磁力搅拌器或垂直混悬仪,4℃吸附0.5~3h。吸附后上柱,5~10倍柱体积washbuffer清洗杂蛋白,每个分离梯度用3~5倍柱体积咪唑洗脱分别取样。取样后进行sds-page检测。检测后收集蛋白较纯的梯度洗脱蛋白,将其合并后进行脱盐。(2)将步骤4(1)中所得脱盐后的蛋白与适量ni+树脂混合,使用小型磁力搅拌器或垂直混悬仪,吸附0.5~3h;将步骤3中收集的谷氨酸棒杆菌胞内蛋白置于树脂和纯化脱盐后his-taq蛋白混合体系中,使用小型磁力搅拌器或垂直混悬仪,孵育5h以上。孵育完成后进行纯化。未和胞内蛋白混育的一组作空白对照,其他条件相同。取样后进行sds-page检测。5.对his-pulldown后的蛋白进行还原烷基化和胶内酶解,酶解后的肽段用q-tof进行鉴定,通过进行mascot数据库搜索,对互作蛋白进行鉴定。对比谷氨酸棒杆菌胞内蛋白混合孵育后和空白对照组,确定差异条带,切取胶粒,胶粒直径1-2mm;用200μl超纯水清洗胶粒2~3次,加200μl考染脱色液,超声脱色,吸干,反复洗至胶粒基本无色;脱色后加100μlch3cn,使胶粒变白,吸弃ch3cn;加10mmdtt20μl,37℃水浴1小时;冷至室温,吸弃溶液;快速加30mm碘乙酰胺20μl,置于暗室45min;依次用双蒸水和50%ch3cn进行超声或混悬清洗;将0.1μg/μl胰蛋白酶液用25mmnh4hco3稀释10~20倍,每管加2~3μl,稍微离心一下,让酶液与胶粒充分接触,4℃放置30min;待酶液被胶粒完全吸收后,加入10-15μl25mmnh4hco3,过夜;离心收集酶解液。酶解后的肽段用q-tof进行质谱鉴定,通过进行mascot数据库搜索,对互作蛋白进行鉴定。其中,纯化过程中有关溶液具体为:配制lysisbuffer和washbuffer用到的母液分别为:母液1:0.5mna2hpo4溶液;母液2:3mnacl溶液;母液3:1m咪唑溶液;lysisbuffer:母液1:母液2:超纯水=20:20:160,ph8.0;washbuffer:母液1:母液2:母液3:超纯水=20:20:2:158,ph8.0;咪唑梯度溶液:10ml量,超纯水定容,ph8.0,如下表:咪唑浓度50mm75mm100mm150mm200mm300mm500mm母液11ml1ml1ml1ml1ml1ml1ml母液21ml1ml1ml1ml1ml1ml1ml母液3500μl750μl1ml1.5ml2ml3ml5ml本发明的优点和有益效果在于:(1)能够简单快速的寻找到谷氨酸棒杆菌中与目的蛋白存在相互作用的蛋白,操作简便,作用确实。(2)利用该方法可得到谷氨酸棒杆菌中蛋白间的相互作用关系,为进一步协调代谢工程改造以及在其他方面的应用提供有效策略和指导。附图说明图1是corynebacteriumglutamicumyi中ilvn基因表达sds-page电泳图。图2是corynebacteriumglutamicumyi中ilvn基因表达诱导温度条件的确定sds-page蛋白图。图3是corynebacteriumglutamicumyi中ilvn基因表达诱导时间条件的确定sds-page蛋白图。图4是corynebacteriumglutamicumyi中ilvn基因表达诱导剂添加量的确定sds-page电泳图。图5是corynebacteriumglutamicumyi中ilvn基因表达添加诱导剂时od的确定sds-page电泳图。图6是corynebacteriumglutamicumyi中ilvn蛋白纯化sds-page电泳图。图7是corynebacteriumglutamicumyi中ilvn蛋白his-pulldownsds-page电泳图。图8是corynebacteriumglutamicumxv中ilvn蛋白纯化sds-page电泳图。图9是corynebacteriumglutamicumxv中ilvn蛋白his-pulldownsds-page电泳图。具体实施方式下面结合具体实施例对本发明所述技术方案作进一步的说明。实施例1:corynebacteriumglutamicumyi中ilvn基因的过表达①corynebacteriumglutamicumyi中ilvn基因的克隆和原核表达载体的构建通过kegg查找corynebacteriumglutamicumyi菌ilvn基因序列,以corynebacteriumglutamicumyi基因组为模板,设计上游引物yi-ilvn-u(引入ecori酶切位点);下游引物yi-ilvn-d(引入hindiii酶切位点),用pcr成功扩增出对应序列dna长度,测序验证。用takarat4dna连接酶将扩增得到的片段与pet-28a载体连接,将连接产物转入感受态大肠杆菌dh5α中,在含卡那霉素的琼脂平板上挑选克隆,以碱裂解法小提重组质粒,用takara限制性内切酶ecori和hindiii进行双酶切鉴定;其中,所述编码corynebacteriumglutamicumyi菌ilvn基因的核苷酸序列为序列表seqidno:1所示序列。②构建蛋白表达菌株将携带ilvn基因的重组质粒通过电转化法转化到大肠杆菌e.colirosetta菌株中,使用电压为1850v。在含卡那霉素和氯霉素的琼脂平板上挑选单克隆,保菌。③ilvn蛋白的表达从保菌管中取10μl菌液接种于装有5mllb培养基的摇管中进行活化,培养基中加入卡那霉素(100μg/ml)和氯霉素(50μg/μl)双抗,37℃,200rpm培养12h;从培养好的摇管中取1ml菌液接种于装有100mllb培养基的种子瓶中,双抗,37℃,200rpm培养12h;从培养好的种子瓶中取4ml接种于装有400mllb培养基的发酵瓶中,双抗,37℃,200rpm培养至od600为0.6左右时加入0.1mm的iptg诱导剂,18℃,180rpm培养10h。8000rpm,4℃离心15min收集菌体,收集到的菌体用pbs缓冲液洗2遍,lysisbuffer洗1遍。清洗好的菌体用20mllysisbuffer重悬起来,加入10mmpmsf,在冰上进行超声破碎,功率为35%,工作5s,停5s,破碎20min,镜检观察细胞破碎情况。破碎完成后,13000rpm,4℃离心15min取上清,沉淀用离心前原体积的lysisbuffer重悬起来,取上清样和沉淀样处理后进行sds-page检测(检测结果如附图1所示)。实施例2corynebacteriumglutamicumyi中ilvn基因表达诱导温度的确定分别使用18℃、23℃、28℃作为诱导温度,摇瓶接菌量1%(v/v),od600为0.45时加入0.1mmiptg诱导剂,180rpm诱导10h;除温度条件不同外,其他条件和步骤与实施例1③相同。进行sds-page电泳(电泳结果如附图2所示)。由电泳结果看,最佳的诱导温度为18℃,此条件下表达的可溶性蛋白最多。实施例3corynebacteriumglutamicumyi中ilvn基因表达诱导时间的确定分别使用3h、6h、9h、12h、15h作为诱导时间,诱导温度18℃,摇瓶接菌量1%(v/v),od600为0.45时加入0.1mmiptg诱导剂;除诱导时间条件不同外,其他条件和步骤与实施例1③相同。进行sds-page电泳(电泳结果如附图3所示)。由电泳结果看,诱导3h和6h蛋白表达量较少,诱导9h以上可溶性蛋白表达量近乎相等,而不可溶性蛋白表达量逐渐增大,所以最佳诱导时间为9h。实施例4corynebacteriumglutamicumyi中ilvn基因表达诱导剂添加量的确定添加iptg浓度梯度为0.05mm、0.1mm、0.2mm、0.3mm,诱导温度18℃,摇瓶接菌量1%(v/v),od600为0.45时加入诱导剂,180rpm诱导9h;除添加iptg的浓度不同外,其他条件和步骤与实施例1③相同。进行sds-page电泳(电泳结果如附图4所示)。由电泳结果看,最佳诱导剂添加量为0.1mm,此条件下表达的可溶性蛋白最多。实施例5corynebacteriumglutamicumyi中ilvn基因表达添加诱导剂时od的确定添加诱导剂时od600梯度为0.2、0.4、06、0.8、1,诱导温度18℃,摇瓶接菌量1%(v/v),加入0.1mmiptg诱导剂180rpm诱导9h;除添加诱导剂时od600不同外,其他条件和步骤与实施例1③相同。进行sds-page电泳(电泳结果如附图5所示)。由电泳结果看,od600为0.2时表达量较少,od600超过0.4时不可溶性蛋白表达逐渐增大,可溶性表达量相近,所以添加诱导剂时最佳od600为0.4。实施例6对corynebacteriumglutamicumyi中ilvn蛋白进行纯化以及his-pulldown技术捕获与ilvn存在相互作用的蛋白①以最佳表达条件即诱导温度18℃,加诱导剂时od600为0.4,iptg添加量为0.1mm,诱导9h进行蛋白诱导表达,离心收集菌体,pbs缓冲液洗2遍,lysisbuffer洗1遍,最后用30mllysisbuffer重悬起来后在冰上进行超声破碎,功率为30%,工作3s停3秒,破碎15min,离心收集破碎液上清。②吸取1.5ml的ni+树脂(50%的树脂匀浆,genscript公司生产)于柱内,用30ml的lysisbuffer冲洗平衡好。将步骤①中收集的破碎液上清过0.45μm滤膜后,与平衡好的ni+树脂混合,使用小型磁力搅拌器,4℃吸附2h。吸附后上柱,自然流下取样ft,用8倍柱体积washbuffer清洗杂蛋白取样,每个分离梯度用5倍柱体积咪唑洗脱分别取样。取样后进行sds-page检测(检测结果如附图6所示)。由检测结果,收集150mm、200mm、300mm梯度洗脱蛋白,合并后用脱盐柱进行脱盐,用脱盐柱脱盐后蛋白浓度为0.697mg/ml。。③corynebacteriumglutamicumyi菌株胞内蛋白的提取:取400mlbhi培养基,接种量1%(v/v),32℃,200rpm培养24h,离心收集菌体,洗涤后先用液氮研磨3次,之后用30mllysisbuffer重悬起来,加入10mmpmsf,在冰上进行超声破碎,功率为35%,工作5s,停5s,破碎3h,13000rpm,4℃离心15min取上清,测得胞内蛋白浓度为11.6mg/ml。④将步骤②中所得纯化并脱盐后的蛋白与2mlni+树脂混合,使用小型磁力搅拌器,4℃吸附3h;3h后加入步骤③中收集的胞内蛋白,使用小型磁力搅拌器,4℃孵育5h。孵育完成后进行纯化。未和胞内蛋白混育的一组作空白对照,其他条件均相同。取样后进行sds-page检测(检测结果如附图7所示),检测后发现了有比空白对照组多出来的条带,即可能存在蛋白相互作用,互作蛋白捕获成功。⑤对his-pulldown后的结合蛋白进行还原烷基化和胶内酶解切胶:取胞内蛋白孵育后比对空白照组多出来的条带,用枪头切取胶粒(胶粒直径1-2mm),置于1.5mlappendorf试管中。清洗:用200μl超纯水清洗胶粒2次,每次10分钟。脱色:加200μl考染脱色液(25mmnh4hco3,50%ch3cn),超声脱色5分钟,吸干,反复洗至胶粒基本无色。脱水:加ch3cn100μl,使胶粒变白,吸弃ch3cn。还原:加10mmdtt(溶于25mmnh4hco3)20μl,37℃水浴1小时。烷基化:冷至室温,吸弃溶液。快速加30mm碘乙酰胺(溶于25mmnh4hco3)20μl,置于暗室45min。清洗:依次用双蒸水(2次)和50%ch3cn(2次)进行超声或混悬清洗,每次10分钟。脱水:加ch3cn100μl,使胶粒变白,吸弃ch3cn。酶解:将0.1μg/μl酶液用25mmnh4hco3稀释10-20倍,每管加2-3μl,稍微离心一下,让酶液与胶粒充分接触,4℃放置30min。待酶液被胶粒完全吸收后,加入10-15μl25mmnh4hco3,37℃过夜。离心收集酶解液。实施例7corynebacteriumglutamicumxv中ilvn蛋白的过表达①corynebacteriumglutamicumxv中ilvn基因的克隆和原核表达载体的构建通过kegg查找corynebacteriumglutamicumxv菌ilvn基因序列,以corynebacteriumglutamicumxv基因组为模板,设计上游引物为xv-ilvn-u(含ecori酶切位点);下游引物为xv-ilvn-d(含hindiii酶切位点),用pcr成功扩增出对应序列dna长度。用takarat4dna连接酶将扩增得到的片段与pet-28a载体连接,将连接产物转入感受态大肠杆菌dh5α中,在含卡那霉素琼脂平板上挑选克隆,以碱裂解法小提重组质粒,用takara限制性内切酶ecori和hindiii进行双酶切鉴定和测序。所述编码corynebacteriumglutamicumxv菌中ilvn基因的序列核苷酸序列为序列表seqidno:2所示序列;②构建蛋白表达菌株具体实施过程同实施例1②③ilvn蛋白的表达具体实施过程同实施例1③实施例8corynebacteriumglutamicumxv菌中ilvn蛋白表达条件的优化选定诱导温度梯度为18℃、23℃、28℃,诱导时间梯度为4h、6h、8h、10h、12h、14h、16h,添加iptg浓度梯度为0.05mm、0.1mm、0.2mm、0.3mm,添加诱导剂时od600梯度为0.2、0.4、06、0.8、1进行实验,确定最佳的蛋白表达条件;优选的,最佳表达条件为诱导温度18℃,诱导时间12h,诱导剂0.1mm,加诱导剂时od600为0.4,此条件下表达的可溶性蛋白最多。实施例9对表达的corynebacteriumglutamicumxv菌ilvn蛋白进行纯化以及his-pulldown技术捕获与ilvn存在相互作用的蛋白①以最佳表达条件即诱导温度18℃,加诱导剂时od600为0.4,iptg添加量为0.1mm,诱导12h进行蛋白诱导表达,离心收集菌体,pbs缓冲液洗2遍,lysisbuffer洗1遍,最后用30mllysisbuffer重悬起来后进行超声破碎,离心收集破碎液上清。②吸取2ml的ni+树脂(50%的树脂匀浆,genscript公司生产)于柱内,用30ml的lysisbuffer冲洗平衡好。将步骤①收集到的破碎液上清与平衡好的ni+树脂混合,使用小型磁力搅拌器,4℃吸附2h。吸附后上柱,用30mm、50mm、100mm、300mm咪唑梯度洗脱并分别取样。取样后进行sds-page检测(检测结果如附图8所示)。由检测结果,收集300mm梯度洗脱蛋白,用脱盐柱脱盐后测得蛋白浓度为0.479mg/ml。③corynebacteriumglutamicumxv菌株胞内蛋白的获取:取1.2lbhi培养基,接种量1%(v/v),32℃,200rpm培养24h,离心收集菌体,洗涤后先用液氮研磨3次,之后用50mllysisbuffer重悬起来,加入10mmpmsf,在冰上进行超声破碎,功率为35%,工作5s,停5s,破碎2h,13000rpm,4℃离心15min取上清,测得胞内蛋白浓度为51.5mg/ml。④将步骤②中所得纯化并脱盐后的蛋白与2mlni+树脂混合,使用小型磁力搅拌器,4℃吸附3h;之后加入步骤③中收集的corynebacteriumglutamicumxv菌胞内蛋白于混合体系中,使用小型磁力搅拌器,4℃孵育12h。孵育完成后进行纯化。未和胞内蛋白混育的一组作空白对照,其他条件均相同。取样后进行sds-page检测(检测结果如附图9所示),检测后发现了有比空白对照组多出来的条带,即可能存在蛋白相互作用,互作蛋白捕获成功。引物名称序列(5’-3’)yi-ilvn-uccggaattcatggctaattctgacgtcacccyi-ilvn-dcccaagcttgtcacatttatgcagcaggtgcxv-ilvn-uccggaattcatggctaattctgacgtcacccxv-ilvn-dcccaagcttgtcacatttatgcagcaggtgc序列表<110>天津科技大学<120>一种筛查谷氨酸棒杆菌中蛋白相互作用的方法<141>2018-09-28<160>2<170>siposequencelisting1.0<210>1<211>519<212>dna<213>谷氨酸棒杆菌(corynebacteriumglutamicum)<400>1atggctaattctgacgtcacccgccacatcctgtccgtactcgttcaggacgtagacgga60atcatttcccgcgtatcaggtatgttcacccgacgcgcattcaacctcgtgtccctcgtg120tctgcaaagaccgaaacactcggcatcaaccgcatcacggttgttgtcgacgccgacgag180ctcaacattgagcagatcaccaagcagctcaacaagctgatccccgtgctcaaagtcgtg240cgacttgatgaagagaccaccatcgcccgcgcaatcatgctggttaaggtctctgcggat300agcaccaaccgtccgcagatcgtcgacgccgcgaacatcttccgcgcccgagtcgtcgac360gtggctccagactctgtggttattgaatccacaggcaccccaggcaagctccgcgcactg420cttgatgtgatggaaccattcggaatccgcgaactgatccaatccggacagattgcactc480aaccgcggtccgaagaccatggctccggccaagatctaa519<210>2<211>519<212>dna<213>谷氨酸棒杆菌(corynebacteriumglutamicum)<400>2atggctaattctgacgtcacccgccacatcctgtccgtactcgttcaggacgtagacgga60atcatttcccgcgtatcaggtatgttcacccgacgcgcattcaacctcgtgtccctcgtg120tctgcaaagaccgaaacactcggcatcaaccgcatcacggttgttgtcgacgccgacgag180ctcaacattgagcagatcaccaagcagctcaacaagctgatccccgtgctcaaagtcgtg240cgacttgatgaagagaccactatcgcccgcgcaatcatgctggttaaggtttctgcggac300agcaccaaccgtccgcagatcgtcgacgccgcgaacatcttccgcgcccgagtcgtcgac360gtggctccagactctgtggttattgaatccacaggcaccccaggcaagctccgcgcactg420cttgacgtgatggaaccattcggaatccgcgaactgatccaatccggacagattgcactc480aaccgcggtccgaagaccatggctccggccaagatctaa519当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1