生物反应装置以及基于该装置进行生物检测的方法与流程
本发明涉及生物
技术领域:
,特别涉及生物反应装置以及基于该装置进行生物检测的方法。
背景技术:
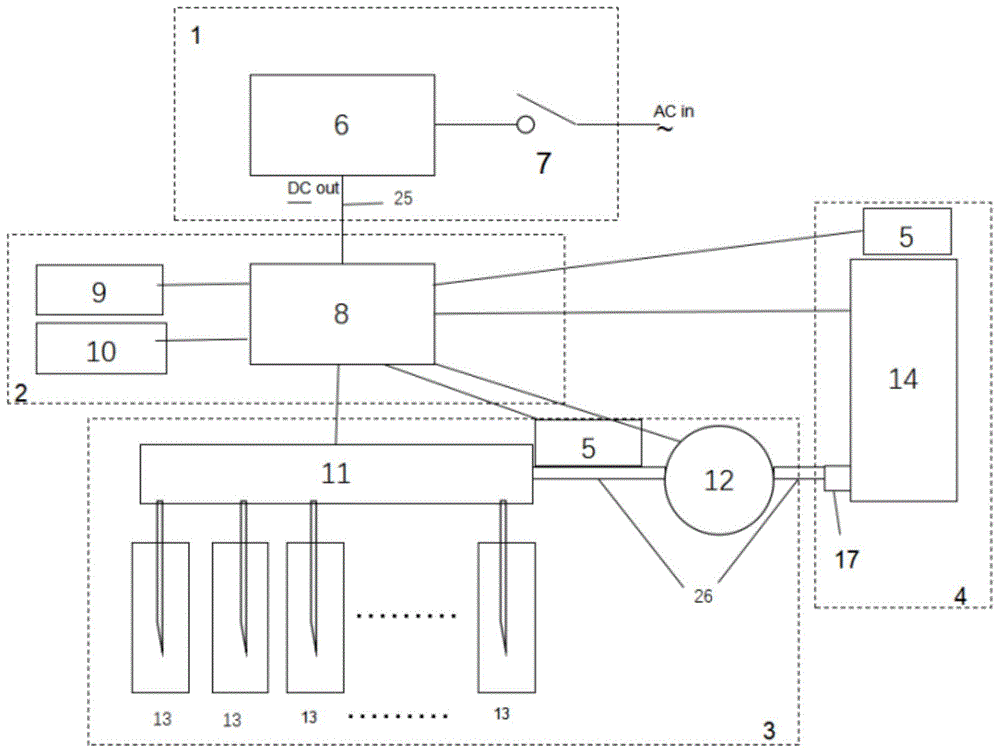
:生物大分子常见的检测方法,均是基于生物大分子与检测试剂的结构,形成反馈信号。常见的实验方法如下1、蛋白质检测a)带有蛋白的凝胶或其他载体放入染色溶液中b)通过振动、加热,促使染料与蛋白结合c)将完成染色的凝胶等放入脱色液中d)通过振动、加热,促使未与蛋白结合的染料从凝胶等中去除2、核酸检测a)带有核酸凝胶或其他载体放入染色溶液中b)通过振动、加热,促使染料与核酸结合c)将完成染色的凝胶等放入脱色液中d)通过振动、加热,促使未与核酸结合的染料从凝胶等中去除3、探针检测a)将带有样品的载体放入封闭液中b)通过振动、加热,加速未结合样品区域结合封闭物c)将封闭后的载体放入探针溶液中d)通过振动、加热,加速探针与样品结合e)将载体放入清洗中f)通过振动、加热,洗去非特异性结合的探针生物大分子一般检测方法,可以描述为浸泡法。通过大量溶液进行加浸泡,依靠分子的热运动,进行特异性的结合和非特异性的去除,虽然可以通过振动、加热、超声、微波等等方式来加速分子的热运动,但依旧无法避免其既有缺陷,例如费时费力、浪费试剂、重复性差、均一性长等。因此,提供一种自动化生物反应装置对生物大分子进行检测具有重要的现实意义。技术实现要素:有鉴于此,本发明提供一种生物反应装置以及基于该装置进行生物检测的方法。装置结构简单实用,操作简便,在该反应器中,利用极少量的试剂,即可实现均匀、高灵敏的反应。为了实现上述发明目的,本发明提供以下技术方案:本发明提供了一种生物反应装置,包括电源模块1、控制模块2、液体处理模块3、反应器模块4和传感器5;所述电源模块1包括直流电源6和开关7;所述控制模块2包括系统控制器8、输入设备9和输出设备10;所述液体处理模块3包括阀11或所述阀11的组合、泵12或所述泵12的组合和样品池13;所述反应器模块4包括反应器14;所述反应器14包括反应器框架15以及由所述反应器框架15形成的反应器腔体16;所述电源模块1通过电缆25分别与所述控制模块2、所述液体处理模块3、所述反应器模块4连接;所述控制模块2通过电缆25分别与所述液体处理模块3、所述反应器模块4连接;所述液体处理模块3通过管路26与所述反应器模块4连接;所述控制模块2与所述反应器模块4通过所述传感器5连接。在本发明的一些具体实施方案中,所述反应器框架15设置至少1个开口17;所述开口17与所述泵12或所述泵12的组合连接。在本发明的一些具体实施方案中,所述反应器框架15还设置有压紧部件18。在本发明的一些具体实施方案中,所述反应器框架15还设置有密封部件19。在本发明的一些具体实施方案中,所述反应器框架15包括反应器前板20和反应器后板21,在所述反应器前板20和反应器后板21之间还设置有限位部件22。限位部件的作用是防止96和15在压合过程中,行程过大,导致16体积过小。在本发明的一些具体实施方案中,所述液体处理模块3与所述反应器模块4之间还设置有母液池23。在本发明的一些具体实施方案中,所述反应器腔体16内还设置有至少1个分流格挡24。在上述研究的基础上,本发明还提供了所述的生物反应装置在生物样本检测中的应用。本发明还提供了生物样本的检测方法,基于本发明提供的所述的生物反应装置,取承载有待反应物的载体置于所述反应器腔体16内,取反应液置于所述液体处理模块3的所述样品池13内,通过电源模块1启动控制模块2控制液体处理模块3的泵12或所述泵12的组合将所述样品池(13)内的反应液输送至所述反应器腔体16内与所述承载有待反应物的载体混合,反应,检测。本发明提供的一种自动化生物反应装置,只需要将样品以及反应溶液放置到指定位置,设定好程序后,即可自动化完成整个流程。实验表明:考马斯亮蓝染色试验中,在igg上,传统方法与本发明所有条带均可见,但本发明着色更深。在bsa上,传统方法可见第10样品,本发明12个样品均可见,本发明灵敏度更优。在溶菌酶上,传统方法可见第9样品,本发明可见第11样品,本发明灵敏度更优。由图9(c)、图9(d)、图9(e)以及表2~表4可知,本发明与传统方法相比,igg检测结果的着色度提高了4.49%~22.90%;bsa检测结果的着色度提高了14.87%~60.00%;溶菌酶检测结果的着色度提高了9.72%~28.37%。相较于传统方法,本发明只需使用50%的试剂,且灵敏度和着色深度皆优于传统方法。银染试验中,在使用少一半的试剂的情况,本发明灵敏度优于传统方法,背景优于传统方法。在igg上,传统方法与本发明所有条带均可见。在bsa上,传统方法可见第10样品,本发明12个样品均可见,本发明灵敏度更优。由图10(c)、图10(d)以及表6~表7结果可知,本发明提供的方法与传统方法相比,igg检测结果的着色度提高了114.91%~139.27%;bsa检测结果的着色度提高了100.88%~186.47%。相较传统方法,本发明只需使用50%的试剂,且其灵敏度以及着色度优于传统方法。wb1试验中,在93kd,传统方法第4泳道可见,本发明第5泳道可见,本发明灵敏度更优。在7kd,传统方法第8泳道可见,本发明第9泳道可见,本发明灵敏度更优。由图11(e)、图11(f)以及表9~表10可知,本发明提供的方法与传统方法相比,93kd检测结果的着色度提高了102.09%~507.93%;7kd检测结果的着色度提高了20.61%~432.91%。相较于传统方法,本发明只需使用74%的试剂和80%的抗体,且本发明的灵敏度和信号强度皆优于传统方法。wb2试验中,传统方法可见第6泳道,本发明可见第8泳道,本发明的灵敏度更优。由图12(c)以及表12可知,本发明提供的方法与传统方法相比,β-actin的检测结果的着色度提高了3.05%~305.33%。相较于传统方法,本发明只需使用65%的试剂、40%的抗体以及较短的处理时间,本发明的灵敏度和信号强度皆优于传统方法。wb5试验中,图13(b)和图13(d)颜色比图13(a)、图13(c)更深,由图13(e)以及表13可知,本发明提供的方法与传统方法相比,gapdh检测结果的着色度提高了50.38%~108.84%。即其信号强度更大,进一步的,说明本发明效果优于传统方法。相较于传统方法,本发明只需使用66%的试剂,且本发明的灵敏度和信号强度皆优于传统方法。wb3试验中,从图14中可以看出,传统方法可见第4泳道,本发明可见第5泳道,本发明的灵敏度更优。由图14(c)以及表15可知,本发明提供的方法与传统方法相比,β-actin检测结果的着色度提高了27.52%~603.57%。相较于传统方法,本发明只需使用30%的试剂和较短的处理时间,且本发明的灵敏度和信号强度皆优于传统方法。wb4试验中,从图15(d)以及表16可以看出,本方发明条带深度强于传统方法,着色度提高了59.26%~111.13%,说明本发明效果更佳。相较于传统方法,本发明只需使用20%的试剂和较短的处理时间,且本发明的信号强度优于传统方法。综上,该自动化生物反应装置与传统方法相比,具备以下优势:1.节约时间。系统全自动完成,节省了大量的人工部分,极大的提高了效率。2.高灵敏度。通过液流控制,相比较传统方法,提高了反应效率,进而在与传统方法相同的条件下,灵敏度更高。3.节约反应器试剂。在本自动化生物反应装置中,反应器只需要少量液体即可完成传统方法大量试剂的反应。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。图1示本发明实施例1提供的生物反应装置结构示意图;图2示本发明实施例2中公开的生物反应装置的结构示意图;图3示本发明实施例3中公开的生物反应装置的结构示意图;图4示液体在反应器14内在时间轴的流动方向;图5示本发明实施例4~6中公开的生物反应装置的结构示意图;其中,图5(a)示本发明实施例4中公开的生物反应装置的结构示意图;图5(b)~图5(d)示本发明实施例5中公开的生物反应装置的结构示意图;图5(b)为主视图;图5(c)为剖视图;图5(d)为后视图;图5(e)~图5(g)示本发明实施例6中公开的生物反应装置的结构示意图;图5(e)为主视图;图5(f)为剖视图;图5(g)为后视图;图6示本发明实施例7中公开的生物反应装置的结构示意图;其中,图6(a)为主视图;图6(b)、图6(c)为侧视图,展示通过液体悬浮待反应物;图7示本发明实施例8中公开的生物反应装置的结构示意图;图8示本发明实施例9中公开的生物反应装置的结构示意图;该生物反应装置包含双向快插件;其中,图8(a)示双向快插示意图;图8(b)示快插件b113示意图;图8(c)示快插件b113剖视图;图8(d)示快插件a112示意图;图8(e)示快插件a112剖视图;图9示实施例10的染色结果;其中图9(a)示传统方法染色结果;图9(b)示本发明染色结果;图9(c)示传统方法染色结果和本发明染色结果中igg着色度对比分析;图9(d)示传统方法染色结果和本发明染色结果中溶菌酶着色度对比分析;图9(e)示传统方法染色结果和本发明染色结果中bsa着色度对比分析;图10示实施例11的染色结果;其中图10(a)示本发明染色结果;图10(b)示传统方法染色结果;图10(c)示传统方法染色结果和本发明染色结果中igg着色度对比分析;图10(d)示传统方法染色结果和本发明染色结果中bsa着色度对比分析;图11示实施例12的结果;其中图11(a)~图11(b)示传统方法结果;图11(c)~图11(d)示本发明提供方法的结果;图11(e)示传统方法结果和本发明结果中93kd蛋白着色度对比分析;图11(f)示传统方法结果和本发明结果中7kd蛋白着色度对比分析;图12示实施例13的结果;其中图12(a)示传统方法结果;图12(b)示本发明结果;图12(c)示传统方法结果和本发明结果中β-actin蛋白着色度对比分析;图13示实施例16的结果;其中图13(a)示a膜结果;图13(b)示b膜结果;图13(c)示c膜结果;图13(d)示d膜结果;图13(e)示传统方法结果和本发明结果中gapdh蛋白着色度对比分析;图14示实施例14的结果;其中图14(a)示传统方法的结果;图14(b)示本发明的结果;图14(c)示传统方法结果和本发明结果中β-actin蛋白着色度对比分析;图15示实施例15的结果;其中图15(a)示传统方法的结果;图15(b)示本发明的结果;图15(c)示一抗和二抗母液加入对应储液池的液流方向;图15(d)示传统方法结果和本发明结果中7kd蛋白着色度对比分析;其中,1-电源模块;2-控制模块;3-液体处理模块;4-反应器模块;5-传感器;6-直流电源;7-开关;8-系统控制器;9-输入设备;10-输出设备;11-阀;12-泵;13-样品池;14-反应器;15-反应器框架;16-反应器腔体;17-开口;18-压紧部件;19-密封部件;20-反应器前板;21-反应器后板;22-限位部件;23-母液池;24-分流格挡;25-电缆;26-管路;17-1:进液口;17-2:出液口;27-废液收集器;28-液面高度示意部件;29-反应液进出液管路;30-废液排出或空气进入管路;50、51、52、53、54、55-两位三通阀;32、33、34-一个两位三通阀三个接液口,33为公共端,32与33为常开连接;38、39、40-一个两位三通阀三个接液口,39为公共端,38与39为常开连接;35、36、37为一个两位三通阀三个接液口,36为公共端,35与36为常开连接;41、42、43-一个两位三通阀三个接液口,43为公共端,42与43为常开连接;44、45、46-一个两位三通阀三个接液口,44为公共端,46与44为常开连接;47、48、49-一个两位三通阀三个接液口,49为公共端,47与49为常开连接;62-气体缓冲瓶;66、67、68、69、70、71、72、73-八位阀的选择接口;74-公用接口;65-选择通路,其根据控制模块2的信号,使选择接口66、67、68、69、70、71、72、73与公用接口74连通;64-四位选择阀组;18-1:反应器前压紧结构,18-2:反应器后压紧结构;91-压紧部件的转轴,压紧部件18通过其固定于反应器框架15上,并可以绕其旋转;96-反应器上盖;99-反应器上盖96和反应器框架15的连接轴;106-反应器14的内壁;107-待反应物;109-液流示意;112-快插件a;113-快插件b;114-快插件b113宝塔接头,其为125衍生部分,用于连接管路,或直接与容器壁连接;125-快插件b113闭合件,其与116形成一个容腔;118-114内部流道;115-快插件b113内宝塔纹,用于快插件a和快插件b组装后内部防漏以及防脱落用;116-快插件b113主体;117-导通件;119-导通件内部流道;120-快插件b113导向结构,其与快插件a结合后,用于内部导向固定;121-导通件限位结构,防止导通件117从快插件b113脱落;122-快插件b113内限位结构,限制导通件117内退距离;124-快插件b113外限位结构,限制导通件117外出距离;123-具备单向阀功能的结构件,其控制快插件b113在与快插件a112分离时,快插件b从118至119方向封闭,从119至118方向连通;129-快插件a112上封闭结构,其作用是固定防漏环130;130-快插件a112防漏环;128-快插件a112主体;127-快插件a112下封闭结构;126-快插件a112宝塔接头;131-快插件a112导向结构;132-126内部流道;133-具备单向阀功能的结构件,其控制快插件b113在与快插件a112分离时,快插件a从132至129方向封闭,从129至132方向连通;当快插件a和快插件b组合后,导通件119后退至122,将113的123打开,使其失去单向阀功能,119插入112的123,使其失去单向阀功能。具体实施方式本发明公开了一种生物反应装置以及基于该装置进行生物检测的方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本
发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。本发明的目的是针对现有技术的不足,提供一种用于生物大分子反应的自动化系统。本发明的另一个目的是提供使用生物大分子自动化反应系统对生物大分子进行检测的方法。本发明的目的可以通过如下技术方案实现:本发明保护了一种生物大分子自动化反应系统(在本发明中,也可以称作生物反应装置),包括电源模块1、控制模块2、液体处理模块3和反应器模块4和传感器5;电源模块1向液体处理模块3和反应器模块4提供驱动能量和反应所需能量,液体处理模块3由控制模块2控制并向其反馈运行状态,液体处理模块3向反应器模块4输入或输出反应物,反应器模块4向控制模块2、液体处理模块3反馈运行状态,反应器模块4可以承载待反应物并将待反应物悬浮于反应器模块4中。在一些实施方案中,所述电源模块1包括直流电源6和开关7;所述控制模块2包括系统控制器8、输入设备9和输出设备10;所述液体处理模块3包括阀11或所述阀11的组合、泵12或所述泵12的组合和样品池13;所述反应器模块4包括反应器14;所述反应器14包括反应器框架15以及由所述反应器框架15形成的反应器腔体16;所述电源模块1通过电缆25分别与所述控制模块2、所述液体处理模块3、所述反应器模块4连接;所述控制模块2通过电缆25分别与所述液体处理模块3、所述反应器模块4连接;所述液体处理模块3通过管路26与所述反应器模块4连接;所述控制模块2与所述反应器模块4通过所述传感器5连接。在一些实施方案中,所述反应器模块4利用液流或者气流使待反应物悬浮于反应器14中。待反应物和反应器14壁间可形成液膜或气膜,以防止待反应物形成贴壁效应。在一些实施方案中,所述反应器14为一个或多个,可以承受压力。在一些实施方案中,所述反应器14为多个时,可以串联或并联。在一些实施方案中,所述反应器14可以是一次性反应器,也可以是多次使用的反应器。在一些实施方案中,所述反应器14上存在至少一个液体进出口,用于反应液体的进入以及排出。在一些实施方案中,所述反应器14的内壁为光滑的或带有一定的结构,例如分流格挡24,该结构用于液体的分流,使液体在反应器中均匀分布。在一些实施方案中,所述反应器14的内壁可以疏水化或亲水化处理。在一些实施方案中,疏水化可以是硅机化、烷基化中的一种或多种。在一些实施方案中,亲水化可以是羟基化、羧基化、氨基化中的一种或多种。在一些实施方案中,所述反应器框架15还设置有压紧部件18,以确保反应器闭合后的密封性能。在一些实施方案中,所述反应器14的材料为金属材料,如不锈钢、铝合金等;或聚合物材料,如聚丙烯、丙烯腈-苯乙烯-丁二烯共聚物等。在一些实施方案中,所述反应器框架15还设置有密封部件19,所述密封部件19的材料为弹性材料或者与反应溶液相斥的材料。在一些实施方案中,所述反应器模块4还包含识别模块,本发明提供的生物反应装置通过识别结果,反馈该反应器的类型以及既有程序。在一些实施方案中,使用rfid作为识别模块。所述反应器模块4上带有是识别器,反应器上有序号芯片。当所述反应器14转入所述反应器模块4后,识别器识别芯片的序号,该序号在所述反应器模块4中已有对应或没有对应程序。对于已有程序,所述反应器模块4会调用该程序。对于没有对应程序,可以通过所述反应器模块4设定程序并进行保存。在一些实施方案中,通过识别方法,实现反应的中断后继续进行。例如当一种反应液反应后,将反应器14从所述反应器模块4上取出,中断该流程。当反应器14再次放入所述反应器模块4后,所述反应器模块4识别其存在未完成的程序,在界面上显示存在未完成的程序,提示操作者是否继续该程序。在一些实施方案中,在反应器14前,还包括母液池23,通过反应稀释流过母液池23,将反应溶液稀释带出,在反应器14内形成最终反应溶液。在一些实施方案中,所述待反应物为生物大分子载体,例如薄膜、聚丙烯酰胺凝胶、琼脂糖凝胶等。在一些实施方案中,当待反应物为薄膜时,此时的反应器14形成微容腔。当待反应物为凝胶时,所述微容腔为反应器腔体16,可以承受正压或负压。在一些实施方案中,所述液体处理模块3包含一个或多个样品放置容器,即样品池13。在一些实施方案中,所述液体处理模块3包含至少一个单向和/或双向的泵12。在一些实施方案中,所述泵12为蠕动泵、隔膜泵、齿轮泵、柱塞泵中的一种或多种。在一些实施方案中,反应溶液由泵12向反应器14内泵入或泵出。在一些实施方案中,所述液体处理模块3包括阀11或阀11的组合。在一些实施方案中,所述阀11为隔膜阀、夹管阀、柱位阀中的一种或多种。在一些实施方案中,所述液体处理模块3可以使用两种或多种不同的溶液,并操纵反应器14中这些溶液之间的自动交换。在一些实施方案中,所述反应器14与液体处理模块3,通过管路26或单向阀或双向快接口连接。双向快插是用于管路和反应器连接,其作用是当反应器中含有液体时,反应器从系统中取出(实施例17),反应器中与管路断开后,均封闭,防止漏液或污染。在一些实施方案中,该生物反应装置利用泵12使反应液体在反应器14中形成循环。在一些实施方案中,生物大分子为核酸、蛋白、多肽中的一种或多种。在一些实施方案中,所述生物反应装置中包含液体感应模块。在一些实施方案中,包含至少1个反应器14。反应器14数量取决于反应器14样品数量以及反应溶液的需求。例如1个样品,1种溶液,需要1个反应器14;2个样品,1种溶液,需要1个反应器14。将样品放入反应器14中,设定溶液数量、顺序、时间,系统将会按照设定进行运行。本生物反应装置中,通过泵12向反应器14中泵入、泵出溶液,根据需求,可根据设定形成循环,以增加样品与反应溶液的接触时间。在一些实施方案中,可以通过设定脉冲进液,提升接触几率。具体的,本发明提供的生物大分子自动化反应系统的结构如下所示:图1展示了本发明的基本组成。1为电源模块,其包含直流电源6,开关7,其作用是将交流输入转换为直流输出,提供本发明其他部件工作所需要的能量。2为控制模块,其包含了系统控制器8,输入设备9,输出设备10,其通过电源模块1输入的能量进行工作,通过电缆25将电源模块1提供的能量转至液体处理模块3和反应器模块4,通过传感器5检测液体处理模块3和反应器模块4的工作状态并进行控制。3为液体处理模块,其包含了阀11或阀的组合,泵12或泵的组合以及样品池13,阀11或阀的组合、泵12或泵的组合、反应器14通过管路(26)连接。阀11或阀的组合根据控制模块2信号进行样品选择,泵12或泵的组合将样品泵入或泵出反应器14。传感器5用于检测液体处理模块3运行状态,并反馈给控制模块2。液体处理模块3的运行能量由控制模块2传输自电源模块1,也可以直接由电源模块1提供能量。4为反应器模块,其中14为反应器,17为设置于反应器框架15的开口,为进液口17-1或出液口17-2,液体由泵12或泵的组合通过管路连接开口17泵入或泵出反应器14。传感器5检测反应器14的工作状态,并反馈给控制模块2。反应器模块4的运行能力由控制模块2传输自电源模块1,也可以直接由电源模块1提供能力。图2展示了本发明的一个应用实例,其中包含一个反应器,四种反应液,1个泵,6个两位三通阀。其中:13为四种样品池,每个样品池13中均可以装反应液。12为泵,具体为蠕动泵。14为反应器。17-1为进液口。17-2为出液口。23为母液池。27为废液收集器。28为液面高度示意部件。29为反应液进出液管路。30为废液排出或空气进入管路。50、51、52、53、54、55为两位三通阀。32、33、34为一个两位三通阀三个接液口,33为公共端,32与33为常开连接。38、39、40为一个两位三通阀三个接液口,39为公共端,38与39为常开连接。35、36、37为一个两位三通阀三个接液口,36为公共端,35与36为常开连接。41、42、43为一个两位三通阀三个接液口,43为公共端,42与43为常开连接。44、45、46为一个两位三通阀三个接液口,44为公共端,46与44为常开连接。47、48、49为一个两位三通阀三个接液口,49为公共端,47与49为常开连接。28必须维持在容器液面以下,以确保运行时能够进入足够的液体。30必须维持在容器液面以上,以确保在进气时不会将废液吸入管路。更进一步的,可以在30末端增加气液选择阀,以确保进气与排液完全隔离。图3展示了本发明的一个应用实例,其中包含三个反应器14,六种反应液,三个泵12,两个阀11或阀组。其中:62为气体缓冲瓶。27为废液收集器。13为样品池。11为阀,具体为八位选择阀。66、67、68、69、70、71、72、73为八位阀的选择接口。74为公用接口。65为选择通路,其根据控制模块2的信号,使选择接口66、67、68、69、70、71、72、73与公用接口74连通。64为四位选择阀组。12为泵,具体为柱塞泵。14为反应器。图4展示了液体在反应器14内在时间轴的流动方向。更进一步的,可以增加液体静止时间,以提升效果。图5a展示了反应器的示意图。其中19为密封部件,20为反应器前板,21为反应器后板,18-1为反应器前压紧结构,18-2为反应器后压紧结构。其中,18-1和20可以为一体,21和18-2可以为一体。当反应器14的反应器框架15闭合后,可以形成反应器腔体16。反应器腔体16大小可以由密封部件19以及压紧部件18决定。当待反应物为薄膜时,此时的反应器腔体16形成微容腔。更进一步的,可以在20和21内部增加限位部件22,以维持一定的容腔。更进一步的,可以省略密封部件19,直接由20和21的紧合度形成密封容腔。在反应器14上至少存在1个开口17,17-1为进液口;17-2为出液口;开口17泵12或阀11或反应器14相连接,用于样品的输入或输出。图5b展示了一个反应器设计方案,图5c为剖视图,图5d位后视图。其中:18为压紧部件;91为压紧部件的转轴,压紧部件18通过其固定于反应器框架15上,并可以绕其旋转;20为反应器前板;21为反应器后板;15为反应器框架;17为开口,其穿过反应器框架15与反应器后板21连接;19为密封部件;16为形成的反应器腔体。图5e展示了一个反应器设计方案,图5f为剖视图,图5g为后视图。其中:96为反应器上盖;15为反应器框架;20为反应器前板;21为反应器后板;99为反应器上盖96和反应器框架15的连接轴;18为压紧部件;19为密封部件;22为限位部件;16为反应器腔体;17为开口。图6a,6b,6c:其中,106为反应器14的内壁。17为开口。107为待反应物。19为密封部件。109为液流示意。图6a展示了待反应物107在未悬浮时其在反应器14中的状态,为不规则形态,可能部分与反应器14的内壁106相贴。图6b和6c展示了通过液体悬浮待反应物的示意。当液体进入反应器14后,液流通过待反应物和反应器14间隙,将待反应物悬浮于反应器14中。通过两侧进液口进液,通过液流使待反应物悬浮于反应器14中。更进一步的,如图6b所示,可以通过单侧进液实现使待反应物悬浮。图7展示了通过增加开口17或分流格挡24对液流进行分割,以实现进入反应器14的液体均匀分布。其中:17为开口,具体为进液口;19为密封部件,具体为密封圈;16为反应器腔体;24为反应器14内部的分流格挡。图8a为一套双向快插示意图,其由快插件a112和快插件b113两部分组成;图8b为快插件b113示意图;图8c为快插件b113剖视图;图8d为快插件a112示意图;图8e为快插件a112剖视图;114为快插件b113宝塔接头,其为125衍生部分,用于连接管路,或直接与容器壁连接;125为快插件b113闭合件,其与116形成一个容腔;118为114内部流道;115为快插件b113内宝塔纹,用于快插件a和快插件b组装后内部防漏以及防脱落用;116为快插件b113主体;117为导通件;119为导通件内部流道;120为快插件b113导向结构,其与快插件a结合后,用于内部导向固定;121为导通件限位结构,防止导通件117从快插件b113脱落;122为快插件b113内限位结构,限制导通件117内退距离;124为快插件b113外限位结构,限制导通件117外出距离;123为具备单向阀功能的结构件,其控制快插件b113在与快插件a112分离时,快插件b从118至119方向封闭,从119至118方向连通;129为快插件a112上封闭结构,其作用是固定防漏环130;130为快插件a112防漏环;128为快插件a112主体;127为快插件a112下封闭结构;126为快插件a112宝塔接头;131为快插件a112导向结构;132为126内部流道;133为具备单向阀功能的结构件,其控制快插件b113在与快插件a112分离时,快插件a从132至129方向封闭,从129至132方向连通。当快插件a和快插件b组合后,导通件119后退至122,将113的123打开,使其失去单向阀功能,119插入112的123,使其失去单向阀功能。本发明另一方面保护了使用所述的生物大分子自动化反应系统对生物大分子进行检测的方法。本发明的有益效果:节约时间。系统全自动完成,节省了大量的人工部分,极大的提供了效率。高灵敏度。通过液流控制,相比较传统方法,提高了反应效率,进而在与传统方法相同的情况下,结果灵敏度更高。节约反应器试剂。在本系统中,反应器只需要少量液体即可完成传统方法大量试剂的反应。本发明提供的生物反应装置以及基于该装置进行生物检测的方法中所用原料及试剂均可由市场购得。下面结合实施例,进一步阐述本发明:实施例1本发明提供的生物反应装置本发明提供了一种生物反应装置,如图1所示,包括电源模块1、控制模块2、液体处理模块3、反应器模块4和传感器5;其中:1为电源模块,其包含直流电源6,开关7,其作用是将交流输入转换为直流输出,提供本发明其他部件工作所需要的能量。2为控制模块,其包含了系统控制器8,输入设备9,输出设备10,其通过电源模块1输入的能量进行工作,通过电缆(25)将电源模块1提供的能量转至液体处理模块3和反应器模块4,通过传感器5检测液体处理模块3和反应器模块4的工作状态并进行控制。3为液体处理模块,其包含了阀11或阀的组合,泵12或泵的组合以及样品池13,阀11或阀的组合、泵12或泵的组合、反应器14通过管路(26)连接。阀11或阀的组合根据控制模块2信号进行样品选择,泵12或泵的组合将样品泵入或泵出反应器14。传感器5用于检测液体处理模块3运行状态,并反馈给控制模块2。液体处理模块3的运行能量由控制模块2传输自电源模块1,也可以直接由电源模块1提供能量。4为反应器模块,其中14为反应器,包括反应器框架15以及由反应器框架15形成的反应器腔体16;17为设置于反应器框架15的开口,为进液口17-1或出液口17-2,液体由泵12或泵的组合通过管路连接开口17泵入或泵出反应器14。传感器5检测反应器14的工作状态,并反馈给控制模块2。反应器模块4的运行能力由控制模块2传输自电源模块1,也可以直接由电源模块1提供能力。电源模块1通过电缆25分别与控制模块2、液体处理模块3、反应器模块4连接;控制模块2通过电缆25分别与液体处理模块3、反应器模块4连接;液体处理模块3通过管路26与反应器模块4连接;控制模块2与反应器模块4通过传感器5连接,开口17与泵12或泵12的组合连接。实施例2在实施例1提供的生物反应装置的结构基础上,本发明还提供了一个生物反应装置,如图2所示,包含一个反应器,四种反应液,1个泵,6个两位三通阀。其中:13为四种样品池,每个样品池13中均可以装反应液。12为泵,具体为蠕动泵。14为反应器。17-1为进液口。17-2为出液口。23为母液池。27为废液收集器。28为液面示意部件。29为反应液进出液管路。30为废液排出或空气进入管路。50、51、52、53、54、55为两位三通阀。32、33、34为一个两位三通阀三个接液口,33为公共端,32与33为常开连接。38、39、40为一个两位三通阀三个接液口,39为公共端,38与39为常开连接。35、36、37为一个两位三通阀三个接液口,36为公共端,35与36为常开连接。41、42、43为一个两位三通阀三个接液口,43为公共端,42与43为常开连接。44、45、46为一个两位三通阀三个接液口,44为公共端,46与44为常开连接。47、48、49为一个两位三通阀三个接液口,49为公共端,47与49为常开连接。28必须维持在容器液面以下,以确保运行时能够进入足够的液体。30必须维持在容器液面以上,以确保在进气时不会将废液吸入管路。更进一步的,可以在30末端增加气液选择阀,以确保进气与排液完全隔离。实施例3在实施例1提供的生物反应装置的结构基础上,本发明还提供了一个生物反应装置,如图3所示,包含三个反应器14,六种反应液,三个泵12,两个阀11或阀组。其中:62为气体缓冲瓶。27为废液收集器。13为样品池。11为阀,具体为八位选择阀。66、67、68、69、70、71、72、73为八位阀的选择接口。74为公用接口。65为选择通路,其根据控制模块2的信号,使选择接口66、67、68、69、70、71、72、73与公用接口74连通。64为四位选择阀组。12为泵,具体为柱塞泵。14为反应器。反应器之间即可以串联也可以并联,例如,反应器14-1和反应器14-2为串联状态。实施例4在实施例1提供的生物反应装置的结构基础上,本发明还提供了一个生物反应装置,如图5(a)所示,其中19为密封部件,20为反应器前板,21为反应器后板,18-1为反应器前压紧结构,18-2为反应器后压紧结构。18-1和20可以为一体,21和18-2可以为一体。当反应器14的反应器框架15闭合后,可以形成反应器腔体16。反应器腔体16大小可以由密封部件19以及压紧部件18决定。当待反应物为薄膜时,此时的反应器腔体16形成微容腔。更进一步的,可以在20和21内部增加限位部件22,以维持一定的容腔。更进一步的,可以省略密封部件19,直接由20和21的紧合度形成密封容腔。在反应器14上至少存在1个开口17,17-1为进液口;17-2为出液口;开口17泵12或阀11或反应器14相连接,用于样品的输入或输出。实施例5在实施例1提供的生物反应装置的结构基础上,本发明还提供了一个生物反应装置,如图5(b)~图5(d)所示,其中:18为压紧部件;91为压紧部件的转轴,压紧部件18通过其固定于反应器框架15上,并可以绕其旋转;20为反应器前板;21为反应器后板;15为反应器框架;17为开口,其穿过反应器框架15与反应器后板21连接;19为密封部件;16为形成的反应器腔体。实施例6在实施例1提供的生物反应装置的结构基础上,本发明还提供了一个生物反应装置,如图5(e)~图5(g)所示,其中:96为反应器上盖;15为反应器框架;20为反应器前板;21为反应器后板;99为上盖和框体的连接轴;18为压紧部件;19为密封部件;22为限位部件;16为反应器腔体;17为开口。实施例7在实施例1提供的生物反应装置的结构基础上,本发明还提供了一个生物反应装置,如图6所示。其中,106为反应器14的内壁。17为开口。107为待反应物。19为密封部件。109为液流示意。图6(a)展示了待反应物107在未悬浮时其在反应器14中的状态,为不规则形态,可能部分与反应器14的内壁106相贴。图6(b)和图6(c)展示了通过液体悬浮待反应物的示意。当液体进入反应器14后,液流通过待反应物和反应器14间隙,将待反应物悬浮于反应器14中。通过两侧进液口进液,通过液流使待反应物悬浮于反应器14中。更进一步的,如附图6b所示,可以通过单侧进液实现使待反应物悬浮。实施例8在实施例1提供的生物反应装置的结构基础上,本发明还提供了一个生物反应装置,如图7所示,其中:17为开口,具体为进液口;19为密封部件,具体为密封圈;16为反应器腔体;24为反应器14内部的分流格挡。实施例9在实施例1提供的生物反应装置的结构基础上,本发明还提供了一个生物反应装置,如图8所示。图8a为一套双向快插示意图,其由快插件a112和快插件b113两部分组成;图8b为快插件b113示意图;图8c为快插件b113剖视图;图8d为快插件a112示意图;图8e为快插件a112剖视图;其中,114为快插件b113宝塔接头,其为125衍生部分,用于连接管路,或直接与容器壁连接;125为快插件b113闭合件,其与116形成一个容腔;118为114内部流道;115为快插件b113内宝塔纹,用于快插件a和快插件b组装后内部防漏以及防脱落用;116为快插件b113主体;117为导通件;119为导通件内部流道;120为快插件b113导向结构,其与快插件a结合后,用于内部导向固定;121为导通件限位结构,防止导通件117从快插件b113脱落;122为快插件b113内限位结构,限制导通件117内退距离;124为快插件b113外限位结构,限制导通件117外出距离;123为具备单向阀功能的结构件,其控制快插件b113在与快插件a112分离时,快插件b从118至119方向封闭,从119至118方向连通;129为快插件a112上封闭结构,其作用是固定防漏环130;130为快插件a112防漏环;128为快插件a112主体;127为快插件a112下封闭结构;126为快插件a112宝塔接头;131为快插件a112导向结构;132为126内部流道;133为具备单向阀功能的结构件,其控制快插件b113在与快插件a112分离时,快插件a从132至129方向封闭,从129至132方向连通。当快插件a和快插件b组合后,导通件119后退至122,将113的123打开,使其失去单向阀功能,119插入112的123,使其失去单向阀功能。实施例10考马斯亮蓝染色基于实施例1提供的生物反应装置,本发明的染色步骤如下:1、在染色液、脱色液储液瓶中加入对应的工作液;2、将待染色的凝胶或膜放入反应器;3、设定仪器工作程序:温度为20~30℃,待染色物的面积为7.5*8cm,设定流速为40ml/min。a、染色液进液(100ml)b、染色液循环1hc、染色液排液d、脱色液进液(100ml)e、脱色液循环1hf、脱色液排液g、脱色液进液(100ml)h、脱色液循环1hi、脱色液排液j、仪器结束工作4、取出凝胶,记录结果传统方法染色流程1、将凝胶或膜放入盒子中2、倒入200ml染色液3、室温震荡1h4、弃染色液,倒入200ml脱色液5、室温震荡1h6、弃步骤4中脱色液,倒入200ml脱色液7、室温整的1h8、6~7,直至条带清晰,背景干净实验样品为蛋白marker(genscriptm00521)、牛血清白蛋白(bsa)、大肠杆菌裂解液(e.colicelllysis)、小鼠igg、溶菌酶上样量为:1:marker5μl2:e.colicelllysis20μl3:e.colicelllysis16μl4:e.colicelllysis12μl5:e.colicelllysis8μl6:e.colicelllysis4μl7:maker5μl8:1000ngigg,1000ngbsa,1000ng溶菌酶9:500ngigg,500ngbsa,500ng溶菌酶10:250ngigg,250ngbsa,250ng溶菌酶11:125ngigg,125ngbsa,125ng溶菌酶12:62.5ngigg,62.5ngbsa,62.5ng溶菌酶染色配方:染色液:0.1%r250,30%乙醇,10%乙酸,60%水;脱色液:10%乙醇,10%乙酸,80%水。图9(a)为传统方法染色结果,图9(b)为本发明染色结果,图9(c)示传统方法染色结果和本发明染色结果中igg着色度对比分析;图9(d)示传统方法染色结果和本发明染色结果中溶菌酶着色度对比分析;图9(e)示传统方法染色结果和本发明染色结果中bsa着色度对比分析;其结果为在同一平面上,使用bio-rad光敏度扫描仪呈现结果。传统方法染色,一片凝胶需要至少600ml液体进行反应,采用本发明,只需要300ml液体即可完成。结果分析:表1表2igg传统方法本发明本发明与传统方法相比提高泳道860.774.622.90%泳道948.551.25.57%泳道1037.939.64.49%泳道1129.133.715.81%泳道1229.531.67.12%表3bsa传统方法本发明本发明与传统方法相比提高泳道845.765.944.20%泳道941.747.914.87%泳道1031.539.224.44%泳道1122.733.748.46%泳道12203260.00%表4溶菌酶传统方法本发明本发明与传统方法相比提高泳道837.14110.51%泳道928.831.69.72%泳道1020.826.728.37%泳道1122.224.49.91%泳道1200——在igg上,传统方法与本发明所有条带均可见,但本发明着色更深。在bsa上,传统方法可见第10样品,本发明12个样品均可见,本发明灵敏度更优。在溶菌酶上,传统方法可见第9样品,本发明可见第11样品,本发明灵敏度更优。由图9(c)、图9(d)、图9(e)以及表2~表4可知,本发明与传统方法相比,igg检测结果的着色度提高了4.49%~22.90%;bsa检测结果的着色度提高了14.87%~60.00%;溶菌酶检测结果的着色度提高了9.72%~28.37%。综上所述,相较于传统方法,本发明只需使用50%的试剂,且灵敏度和着色深度皆优于传统方法。实施例11银染基于实施例2提供的生物反应装置,反应如下:固定液:40%甲醇和每200ml含有100ul甲醛致敏剂:0.2g/l硫代硫酸钠染色剂:20%agno3250ul/50mlh2o显色液:3%的碳酸钠和0.0004%l硫代硫酸钠使用前加入25ul甲醛溶液/50ml实验样品为:蛋白marker(genscriptm00521)、大肠杆菌裂解液(e.colicelllysis)、小鼠igg、牛血清白蛋白(bsa)上样量为:1:marker5μl2:e.colicelllysis10μl3:e.colicelllysis8μl4:e.colicelllysis6μl5:e.colicelllysis4μl6:e.colicelllysis1μl7:maker5μl8:100ngigg,100ngbsa9:50ngigg,50ngbsa10:25ngigg,25ngbsa11:12.5ngigg,12.5ngbsa12:6.25ngigg,6.25ngbsa13:3.125ngigg,3.125ngbsa本发明步骤:1、将凝胶放入反应器2、设定程序如下温度为20~30℃,凝胶面积为7.5*8cm,相较于案例10,银染试剂的反应率低于考马斯亮蓝,需要降低流速,设定流速为20ml/min。1)泵入固定液100ml,设置循环10min,反应结束泵出2)泵入ddh2o100ml,循环5min,泵出,共2次3)泵入致敏剂100ml,循环1min,泵出4)泵入ddh2o100ml,循环1min,泵出,共2次5)泵入染色剂100ml,循环10min,泵出6)泵入ddh2o100ml,循环1min,泵出,共2次7)泵入显色液100ml,循环10min,泵出8)泵入ddh2o100ml,循环5min,泵出3、取出凝胶,记录结果传统方法步骤:1、将凝胶放入容器2、倒入固定液200ml,室温震荡10min,弃废液3、倒入ddh2o200ml,室温震荡5min,弃废液4、重复步骤35、倒入致敏剂200ml,室温震荡1min,弃废液6、倒入ddh2o200ml,室温震荡1min,弃废液7、重复步骤68、倒入染色剂200ml,室温震荡10min,弃废液9、倒入ddh2o200ml,室温震荡1min,弃废液10、重复步骤11、倒入显色液200ml,室温震荡10min,弃废液12、倒入ddh2o200ml,室温震荡5min,弃废液13、取出凝胶,记录结果图10(a)为本发明染色结果,图10(b)为传统方法染色结果;图10(c)示传统方法染色结果和本发明染色结果中igg着色度对比分析;图10(d)示传统方法染色结果和本发明染色结果中bsa着色度对比分析。表5表6igg传统方法本发明本发明与传统方法相比提高泳道881.8175.8114.91%泳道979.5177.3123.02%泳道1076.5175128.76%泳道1174169.6129.19%泳道1271.3170.6139.27%表7bsa传统方法本发明本发明与传统方法相比提高泳道879.3159.3100.88%泳道970.5157.3123.12%泳道1063.7156.8146.15%泳道1158155.2167.59%泳道1254.7156.7186.47%从图中可以看出,在使用少一半的试剂的情况,本发明灵敏度优于传统方法,背景优于传统方法。在igg上,传统方法与本发明所有条带均可见。在bsa上,传统方法可见第10样品,本发明12个样品均可见,本发明灵敏度更优。由图10(c)、图10(d)以及表6~表7结果可知,本发明提供的方法与传统方法相比,igg检测结果的着色度提高了114.91%~139.27%;bsa检测结果的着色度提高了100.88%~186.47%。综上所述,相较传统方法,本发明只需使用50%的试剂,且其灵敏度以及着色度优于传统方法。实施例12wb1基于实施例3提供的生物反应装置,反应如下:样品为带有his标签的蛋白,分子量为93kd和7kd上样量为1、wbmarker1ul2、150ng93kd,10ng7kd3、75ng93kd,5ng7kd4、37.5ng93kd,2.5ng7kd5、18.75ng93kd,1.25ng7kd6、9ng93kd,0.6ng7kd7、4.5ng93kd,0.3ng7kd8、2.25ng93kd,0.15ng7kd9、1ng93kd,0.075ng7kd10、0.5ng93kd,0.0375ng7kd封闭液为5%脱脂奶粉pbs溶液pbst为在pbs中添加千分之一吐温20一抗为鼠抗his,浓度为1mg/ml,使用封闭液,按1:3000稀释二抗为羊抗小鼠hrp,浓度为1mg/ml,使用封闭液,按1:10000稀释本发明步骤:1、将两张膜背靠背放入反应器中,温度为20~30℃,膜面积为7.5*8cm*2,设定流速为40ml/min;2、泵入封闭液8ml,循环1h,泵出;3、泵入pbst8ml,循环5min,泵出,共3次;4、泵入一抗稀释液8ml,循环1h,泵出;5、泵入pbst8ml,循环5min,泵出,共3次;6、泵入二抗稀释液8ml,循环1h,泵出;7、泵入pbst8ml,循环5min,泵出,共3次;8、取出膜进行曝光。传统方法:1、将两张膜背靠背放入容器中2、加入封闭液10ml,震荡1h,弃封闭液3、加入pbst10ml,震荡5min,弃pbst4、重复步骤3两次5、加入一抗稀释液10ml,震荡1h,弃一抗稀释液6、加入pbst10ml,震荡5min,弃pbst7、重复步骤3三次8、加入二抗稀释液10ml,震荡1h,弃二抗稀释液9、重复步骤3三次10、取出膜进行曝光图11(a)为传统方法结果,图11(b)为本发明提供方法的结果;图11(c)~图11(d)示本发明提供方法的结果;图11(e)示传统方法结果和本发明结果中93kd蛋白着色度对比分析;图11(f)示传统方法结果和本发明结果中7kd蛋白着色度对比分析。表8表9表10从图11中可以看出,在93kd,传统方法第4泳道可见,本发明第5泳道可见,本发明灵敏度更优。在7kd,传统方法第8泳道可见,本发明第9泳道可见,本发明灵敏度更优。由图11(e)、图11(f)以及表9~表10可知,本发明提供的方法与传统方法相比,93kd检测结果的着色度提高了102.09%~507.93%;7kd检测结果的着色度提高了20.61%~432.91%。综上所述,相较于传统方法,本发明只需使用74%的试剂和80%的抗体,且本发明的灵敏度和信号强度皆优于传统方法。实施例13wb2基于实施例4提供的生物反应装置,反应如下:样品为293t细胞裂解液上样量为1、wbmarker1ul2、裂解液20ug3、裂解液10ug4、裂解液5ug5、裂解液2.5ug6、裂解液1.25ug7、裂解液0.625ug8、裂解液0.3125ug封闭液为5%脱脂奶粉pbs溶液pbst为在pbs中添加千分之一吐温20一抗为兔抗β-actin,浓度为1mg/ml,使用封闭液,按1:3000稀释二抗为羊抗兔hrp,浓度为1mg/ml,使用封闭液,按1:10000稀释本发明步骤温度为20~30℃,膜面积为7.5*8cm,设定流速为20ml/min;1、将一张膜放入反应器中2、泵入封闭液3、在封闭液充满反应器时,泵入pbst4、在pbst充满反应器时,泵入一抗稀释液5、在一抗稀释液充满反应器时,泵入pbst6、在pbst充满反应器时,泵入二抗稀释液7、在二抗稀释液充满反应器时,泵入pbst8、在pbst充满反应器时,继续泵入2倍体积pbst9、取出膜进行显影其中封闭液、一抗稀释液、二抗稀释液均为4ml,pbst为16ml使用本发明共计需要2h完成传统方法:1、将膜放入容器;2、加入封闭液10ml,震荡1h,弃封闭液;3、加入pbst10ml,震荡5min,弃pbst;4、重复步骤3两次;5、加入一抗稀释液10ml,震荡1h,弃一抗稀释液;6、加入pbst10ml,震荡5min,弃pbst;7、重复步骤3三次;8、加入二抗稀释液10ml,震荡1h,弃二抗稀释液;9、重复步骤3三次;10、取出膜进行曝光。图12(a)为传统方法,图12(b)为本发明结果;图12(c)示传统方法结果和本发明结果中β-actin蛋白着色度对比分析。表11表12β-actin传统方法本发明本发明与传统方法相比提高泳道2109.9161.747.13%泳道3128131.93.05%泳道4111.1120.18.10%泳道554.7100.383.36%泳道632.673.5125.46%泳道77.530.4305.33%泳道85.211.1113.46%从附图中可以看出,传统方法可见第6泳道,本发明可见第8泳道,本发明的灵敏度更优。由图12(c)以及表12可知,本发明提供的方法与传统方法相比,β-actin的检测结果的着色度提高了3.05%~305.33%。综上所述,相较于传统方法,本发明只需使用65%的试剂、40%的抗体以及较短的处理时间,本发明的灵敏度和信号强度皆优于传统方法。实施例14wb5基于实施例3提供的生物反应装置,反应如下:样品为293t细胞裂解液上样量为1、wbmarker1ul2、裂解液20ug3、裂解液10ug4、裂解液5ug5、裂解液2.5ug6、裂解液1.25ug一抗为鼠抗gapdh二抗为羊抗鼠本发明步骤1、将膜b放入反应器14-1,膜d放入反应器14-2;2、设定反应器14-1和反应器14-2串联温度为20~30℃,膜b和膜d面积为7.5*4cm,设定流速为10ml/min3、泵入封闭液,充满反应器14-1和反应器14-2后,循环1h,泵出4、泵入pbst,循环5min,泵出,共3次5、泵入一抗稀释液,循环1h,泵出6、泵入pbst,循环5min,泵出,共3次7、泵入二抗稀释液,循环1h,泵出8、泵入pbst,循环5min,泵出,共3次9、取出膜进行曝光其中封闭液、一抗稀释液、二抗稀释液均为8ml,pbst为7ml传统方法:1、将两张膜(a,c)分别放入容器中2、各加入封闭液10ml,震荡1h,弃封闭液3、各加入pbst10ml,震荡5min,弃pbst4、重复步骤3两次5、各加入一抗稀释液10ml,震荡1h,弃一抗稀释液6、各加入pbst10ml,震荡5min,弃pbst7、重复步骤3三次8、各加入二抗稀释液10ml,震荡1h,弃二抗稀释液9、重复步骤3三次10、取出膜进行曝光图13(a)为a膜结果,图13(b)位b膜结果,图13(c)为c膜结果,图13(d)为d膜结果;图13(e)示传统方法结果和本发明结果中gapdh蛋白着色度对比分析。表13gapdh泳道2泳道3泳道4泳道5膜a79.760.329.99.4膜b154.3124.443.112.3膜c84.55420.63.9膜d143.6114.344.67.7膜a与膜c的平均值82.157.1525.256.65膜b与膜d的平均值148.95119.3543.8510本发明与传统方法相比提高81.43%108.84%73.66%50.38%从图中可以看出,图13(b)和图13(d)颜色比图13(a)、图13(c)更深,由图13(e)以及表13可知,本发明提供的方法与传统方法相比,gapdh检测结果的着色度提高了50.38%~108.84%。即其信号强度更大,进一步的,说明本发明效果优于传统方法。综上所述,相较于传统方法,本发明只需使用66%的试剂,且本发明的灵敏度和信号强度皆优于传统方法。实施例15wb3基于实施例5提供的生物反应装置,反应如下:样品为293t细胞裂解液上样量为1、裂解液20ug2、裂解液10ug3、裂解液5ug4、裂解液2.5ug5、裂解液1.25ug6、裂解液0.625ug封闭液为5%脱脂奶粉pbs溶液pbst为在pbs中添加千分之一吐温20一抗为兔抗β-actin,浓度为1mg/ml,使用封闭液,按1:3000稀释二抗为羊抗兔hrp,浓度为1mg/ml,使用封闭液,按1:10000稀释本发明步骤:1、温度为20~30℃,膜面积为7.5*4cm,设定流速为10ml/min;2、泵入封闭液5ml,循环1h,泵出;3、泵入pbst5ml,循环5min,泵出,共3次;4、泵入一抗和二抗混合溶液5ml,循环1h,泵出回收;5、泵入pbst5ml,循环5min,泵出,共3次;6、泵入显影液,充满后泵出;7、取出膜进行显影;传统方法:1、将一张膜背靠背放入容器中;2、加入封闭液10ml,震荡1h,弃封闭液;3、加入pbst10ml,震荡5min,弃pbst;4、重复步骤3两次;5、加入一抗稀释液10ml,震荡1h,弃一抗稀释液;6、加入pbst10ml,震荡5min,弃pbst;7、重复步骤3三次;8、加入二抗稀释液10ml,震荡1h,弃二抗稀释液;9、重复步骤3三次;10、取出膜进行曝光。图14(a)为传统方法的结果,图14(b)为本发明的结果;图14(c)示传统方法结果和本发明结果中β-actin蛋白着色度对比分析。表14表15β-actin传统方法本发明本发明与传统方法相比提高泳道1171.9219.227.52%泳道2122.821272.64%泳道382.7183.2121.52%泳道416.779.7377.25%泳道52.819.7603.57%泳道62.94.762.07%从图14中可以看出,传统方法可见第4泳道,本发明可见第5泳道,本发明的灵敏度更优。由图14(c)以及表15可知,本发明提供的方法与传统方法相比,β-actin检测结果的着色度提高了27.52%~603.57%。综上所述,相较于传统方法,本发明只需使用30%的试剂和较短的处理时间,且本发明的灵敏度和信号强度皆优于传统方法。实施例16wb4基于实施例6提供的生物反应装置,反应如下:样品为带有his标签的蛋白,分子量为7kd上样量为1、10nghisprotein2、5nghisprotein3、2.5nghisprotein4、1.25nghisprotein5、0.6nghisprotein6、0.3nghisprotein封闭液为5%脱脂奶粉pbs溶液pbst为在pbs中添加千分之一吐温20一抗为鼠抗his,浓度为1mg/ml,使用封闭液,按1:3000稀释二抗为羊抗小鼠hrp,浓度为1mg/ml,使用封闭液,按1:10000稀释本发明步骤:1、温度为20~30℃,膜面积为7.5*8cm,设定流速为20ml/min;2、将一抗和二抗母液加入对应储液池(如图15(c),23-1为二抗母液池,23-2为一抗母液池,143为液流方向)中;3、泵入封闭液5ml,封闭液通过储液池时将抗体稀释带出,进入反应器,循环1h,泵出;4、泵入pbst5ml,循环5min,泵出,共3次;5、泵入tmb显色液,泵出;6、通过观察窗查看,记录结果。传统方法:1、将一张膜背靠背放入容器中;2、加入封闭液10ml,震荡1h,弃封闭液;3、加入pbst10ml,震荡5min,弃pbst;4、重复步骤3两次;5、加入一抗稀释液10ml,震荡1h,弃一抗稀释液;6、加入pbst10ml,震荡5min,弃pbst;7、重复步骤3三次;8、加入二抗稀释液10ml,震荡1h,弃二抗稀释液;9、重复步骤3三次;10、向容器中加入tmb显色液,记录结果。图15(b)为传统方法的结果,图15(a)为本发明的结果;图15(c)示一抗和二抗母液加入对应储液池的液流方向;图15(d)示传统方法结果和本发明结果中7kd蛋白着色度对比分析。表16从图15(d)以及表16可以看出,本方发明条带深度强于传统方法,着色度提高了59.26%~111.13%,说明本发明效果更佳。综上所述,相较于传统方法,本发明只需使用20%的试剂和较短的处理时间,且本发明的信号强度优于传统方法。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1