一种用于检测新型冠状病毒SARS-COV-2感染的γ干扰素释放方法与流程
本发明属于病毒检测技术领域,具体是指一种用于检测新型冠状病毒sars-cov-2感染的γ干扰素释放方法。
背景技术:
新型冠状病毒肺炎(covid-19)是由2型严重急性呼吸综合征冠状病毒(sars-cov-2,以下简称新型冠状病毒)感染引起的呼吸系统疾病。据流行病学调查,新型冠状病毒的潜伏期为1-14天,大多数为3-7天。患者可能有发热、咳嗽、呼吸短促、肌肉疼痛、精神错乱、头痛、咽喉痛、鼻涕、胸痛、腹泻、恶心呕吐、双侧肺炎等临床表现,影像学检测可能出现多处斑点和磨玻璃样混浊。一些患者可能出现急性呼吸窘迫综合征,并在短时间内恶化。未治愈的患者多死于多器官衰竭。
在当前的技术条件下,诊断新型冠状病毒感染的标准方法是使用呼吸道分泌物或血样作为样本,用实时rt-pcr或基因组测序的方法检测。实时rt-pcr测试新型冠状病毒的特异性比较高,但临床表现的灵敏度较低,约为30%,常常需要多次检测才能确诊或排除新型冠状病毒的感染。另外,呼吸道分泌物可能含有活的病毒颗粒,可能会感染采样人员或检测人员,有一定的生物安全风险。新型冠状病毒肺炎也可以使用影像学方法(如x射线计算机断层摄影,简称ct)和血清学方法进行诊断。ct检测covid-19的敏感性和特异性较低,且设备较昂贵,检测通量低。使用胶体金免疫层析和酶联免疫实验(elisa)等血清学方法可以检测血清igm和igg浓度,igm浓度能反映当前的感染情况,但其敏感性和特异性较低。因此需要提供一种更好的方法,以满足临床和疾病控制的需要。
技术实现要素:
针对上述情况,为克服现有技术的缺陷,本发明提供了一组经过设计和筛选的多肽,并构建了一种灵敏度较高,特异度较好且具有较好生物安全性的用于检测新型冠状病毒sars-cov-2感染的γ干扰素释放方法。
本发明采取的技术方案如下:本发明提供一种用于检测新型冠状病毒sars-cov-2感染的γ干扰素释放方法,具体包括下列步骤:
(1)设计和筛选一组高灵敏度和特异度的病毒抗原多肽序列
收集新型冠状病毒基因序列,找出刺突蛋白和核衣壳蛋白的序列,分析刺突蛋白和核衣壳蛋白的主要组织相容性复合物ⅱ类(mhcii)分子结合位点,从蛋白序列中选择长度为12-36个氨基酸(aa)的序列,序列应覆盖尽可能多的主要组织相容性复合物ⅱ类(mhcii)分子结合位点,并且序列总长度尽可能短;将所选序列与已知病原体基因库与人类基因组进行比对,排除可能与其他常见病原体或人类基因组具有相似区域的序列;化学合成所述序列,得到纯度高于95%的多肽,将多肽溶于超纯水,得到最终浓度为500μg/ml(每种)的多肽混合物;经过筛选,得到一组高灵敏度和特异度的病毒抗原多肽序列,见表1。
表1多肽组的序列
(2)准备试验培养管
分别准备3组全血样本的培养管,3组培养管分别为不含抗原的空白对照管、每种多肽含量为5μg的病毒抗原培养管和含5μg植物血凝素(pha)的阳性对照管;
(3)微孔反应板的制备
用pbs缓冲液将鼠抗人γ干扰素抗体稀释成最适工作浓度,混匀成包被工作液,在微孔反应板中准确加入130μl包被工作液,2~8℃过夜,取出反应板,拍干反应板,再加150μl封闭液,所述封闭液含有5%bsa的pbs,室温放2小时,拍干反应板,2~8℃贮存;
(4)铕标记物的制备
将预处理好的标记物原料加入铕标记试剂(eu-dtta)的瓶中,充分混匀孵育反应至适当时间,上分离柱进行洗脱分离纯化,用自动部分收集器进行收集,检测每管标记物的荧光值,至少应出现两个完整峰后停止收集,合并铕标记物峰,即为所得的tb-igras铕标记物母液,然后用铕标记物稀释液稀释至适当浓度,2~8℃贮存;
(5)生物素标记抗体的制备
用稀释液将生物素标记鼠抗人γ干扰素单克隆抗体稀释至适当浓度,2~8℃贮存;
(6)血液培养
在培养管内添加抗凝剂,用肝素钠或肝素锂真空集合管采集外周血置于培养管内,之后将培养管颠倒混合6次以上,使抗凝剂完全溶解于采集的血液中,将血液分别加入步骤(2)准备的3组培养管内,每根培养管加入1ml,立即上下混合6次以上,以确保培养管内容物和血液完全混合,将全血培养管在37±1℃培养箱中直立放置16~22小时,培养完成后,用3000~5000rpm转速离心10min,得到血浆上清;
(7)γ干扰素浓度的检测
采用免疫学方法测定步骤(2)各培养管中血浆上清的γ干扰素浓度,具体操作如下:采用γ干扰素的国际标准品配制校准品样品,将100μl校准品和样品加入96孔微孔板并盖上封片,在220ppm的振荡强度下,室温孵育45分钟,孵育完成,小心取出并丢弃封片,用洗板机清洗5次,将其拍干,每孔加入100μl生物素标记的抗体工作液,贴上封片,室温下振荡孵育45分钟,小心取出并丢弃封片,用洗板机洗涤5次,将100μleu标记的链霉亲和素工作液加入各孔中,在室温下振荡孵育15分钟,小心取出并丢封片,用洗板机洗涤6次,拍打干净,每孔加入100μl增强液,在30分钟内用时间分辩仪光仪检测eu荧光强度。
采用上述结构本发明取得的有益效果如下:本方案提供了一种用于新型冠状病毒感染检测及covid-19诊断的γ干扰素释放方法,该方法通过γ干扰素释放试验检测新型冠状病毒特异性效应t细胞的存在,可检测新型冠状病毒新型冠状病毒感染,具有较好的生物安全性、较高的灵敏度,并具有大规模筛查潜在感染的能力。
附图说明
附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。在附图中:
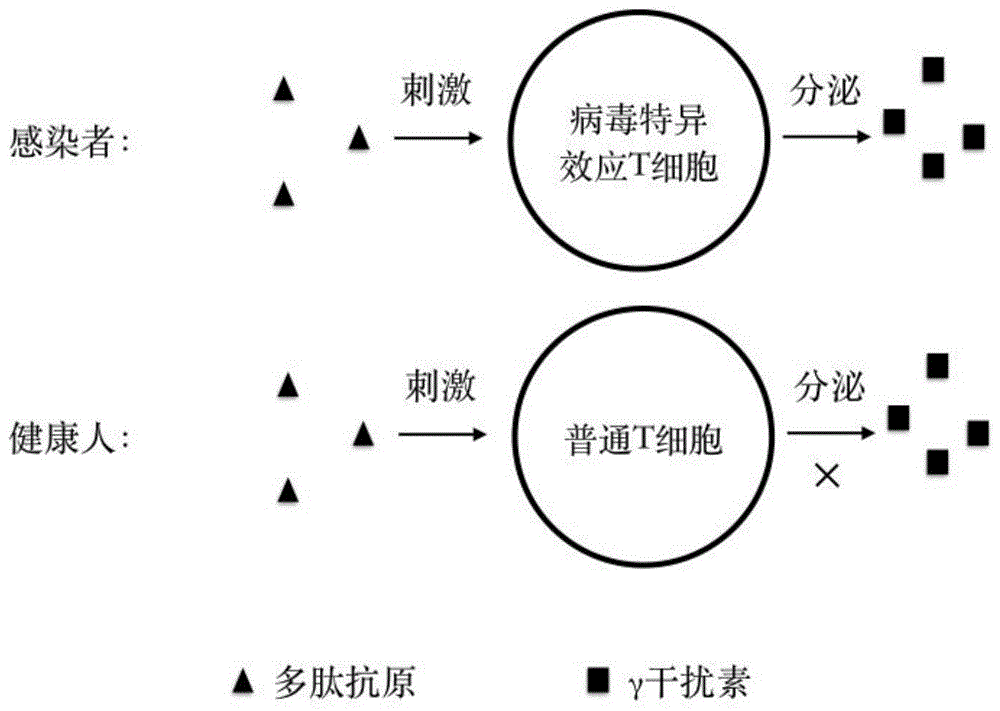
图1为本发明中抗原多肽识别新型冠状病毒感染的原理示意图;
图2为本发明中健康对照、疑似病例和阳性病例中空白对照培养管和病毒抗原培养管中γ干扰素浓度分布图;
图3为本发明中健康对照、疑似病例和阳性病例之间的γ干扰素释放水平对照图;
图4为本发明中以γ干扰素释放水平为依据系统识别阳性病例能力的受试者工作特征曲线(roc曲线)。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例;基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例:
使用该方法检测12例经实时rt-pcr法检测确诊为阳性的新鲜全血样本,5例有相似症状但无核酸证据的疑似患者的新鲜全血样本,254例健康人的新鲜全血样本。其中阳性和疑似患者平均年龄41岁,其中女性9例,男性8例,阳性患者的平均诊断时间为31.25天。
具体操作包括下列步骤:
(1)化学合成抗原多肽序列
化学合成表1中的序列,要求纯度>95%,将多肽溶于超纯水,得到最终浓度为500μg/ml的多肽混合物。
(2)准备试验培养管
分别准备3组全血样本的培养管,3组培养管分别为不含抗原的空白对照管、每种多肽含量为5μg的病毒抗原培养管和含5μg植物血凝素(pha)的阳性对照管;
(3)微孔反应板的制备
用pbs缓冲液将鼠抗人γ干扰素抗体稀释成最适工作浓度,混匀成包被工作液,在微孔反应板中准确加入130μl包被工作液,2~8℃过夜,取出反应板,拍干反应板,再加150μl封闭液,所述封闭液含有5%bsa的pbs,室温放2小时,拍干反应板,2~8℃贮存;
(4)铕标记物的制备
将预处理好的标记物原料加入铕标记试剂(eu-dtta)的瓶中,充分混匀孵育反应至适当时间,上分离柱进行洗脱分离纯化,用自动部分收集器进行收集,检测每管标记物的荧光值,至少应出现两个完整峰后停止收集,合并铕标记物峰,即为所得的tb-igras铕标记物母液,然后用铕标记物稀释液稀释至适当浓度,2~8℃贮存;
(5)生物素标记抗体的制备
用稀释液将生物素标记鼠抗人γ干扰素单克隆抗体稀释至适当浓度,2~8℃贮存;
(6)血液培养
在培养管内添加抗凝剂,用肝素钠或肝素锂真空集合管采集外周血置于培养管内,之后将培养管颠倒混合6次以上,使抗凝剂完全溶解于采集的血液中,将血液分别加入步骤(2)准备的3组培养管内,每根培养管加入1ml,立即上下混合6次以上,以确保培养管内容物和血液完全混合,将全血培养管在37±1℃培养箱中直立放置16~22小时,培养完成后,用3000~5000rpm转速离心10min,得到血浆上清;
(7)γ干扰素浓度的检测
采用免疫学方法测定步骤(2)各培养管中血浆上清的γ干扰素浓度,具体操作如下:采用γ干扰素的国际标准品配制校准品样品,将100μl校准品和样品加入96孔微孔板并盖上封片,在220ppm的振荡强度下,室温孵育45分钟,孵育完成,小心取出并丢弃封片,用洗板机清洗5次,将其拍干,每孔加入100μl生物素标记的抗体工作液,贴上封片,室温下振荡孵育45分钟,小心取出并丢弃封片,用洗板机洗涤5次,将100μleu标记的链霉亲和素工作液加入各孔中,在室温下振荡孵育15分钟,小心取出并丢封片,用洗板机洗涤6次,拍打干净,每孔加入100μl增强液,在30分钟内用时间分辩仪光仪检测eu荧光强度;
(8)统计分析
用prism8软件绘制图形:对t细胞反应进行分析,采用wilson/brown方法,用prism8进行受试者工作特征(roc)分析,通过描述性统计分析得到各组数据的平均误差和标准误差,对可比组进行t检验。
实验结果如表2所示:阳性者淋巴细胞平均数为1.97×109/l,cd4+细胞平均数为0.80×109/l,cd8+细胞平均数为0.45×109/l。
表2样本信息表
如图2所示,分别测定空白对照管、病毒抗原培养管和阳性对照管中γ干扰素的浓度。阳性病例、疑似病例和健康对照者的空白对照管上清的γ干扰素浓度分别为4.14pg/ml(95%ci,0.617~7.66)、6.83pg/ml(95%ci,1.60~12.06)和11.29pg/ml(95%ci,8.71~13.87)。阳性病例、疑似病例和健康对照的病毒抗原管γ干扰素浓度分别为20.12pg/ml(95%ci,12.12~28.14)、6.52pg/ml(95%ci,0~15.49)和9.18pg/ml(95%ci,6.56~11.82)。依据病毒抗原管γ干扰素浓度不能区分阳性感染者。
如图3所示,γ干扰素释放试验中,病原体抗原培养管的γ干扰素浓度与空白对照培养管之间的差异是更重要和更有效的参数。这种差异称为γ干扰素反应水平(计算方法为γ干扰素反应水平=病毒抗原培养管的γ干扰素浓度-空白对照培养管的γ干扰素浓度。显然因为该参数是两个测值的差值,有存在负值的可能)。健康对照,疑似病例和阳性病例的γ干扰素反应水平分别为-2.12pg/ml(95%ci,-4.76~0.56),-0.31pg/ml(95%ci,-10.46~9.85)和15.98pg/ml(95%ci,10.11~22.86),阳性患者与健康对照组比较有显著性差异(p<0.01)。
如图4所示,经过roc分析,roc曲线下面积为0.9165(95%ci,0.8724~0.9606,p<0.0001)。当临界值为8.00pg/ml时,系统的灵敏度为75.00%(95%ci,46.77%~91.11%),特异性为89.37%(95%ci,84.98%~92.59%)。
要说明的是,在本文中,诸如第一和第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物料或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物料或者设备所固有的要素。
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
- 还没有人留言评论。精彩留言会获得点赞!