一种干血斑中四种维生素的检测方法及检测试剂盒与流程
本发明创造属于临床体外检测试剂技术领域,尤其是涉及一种干血斑中四种维生素的检测方法及检测试剂盒。
背景技术:
维生素是机体维持正常代谢和机能所必需的一类小分子化合物,是人体必需的营养要素,主要调节体内各种代谢过程和生理活动。大多数维生素必须从食物中获得,仅少数可在体内合成或由肠道细菌产生。在人体内含量少,但生理作用很大,摄入量不足或过量都会引发相应的疾病。
维生素a是生长发育、细胞识别、视觉、免疫功能和繁殖所必需的必需维生素,还可以帮助心脏、肺、肾脏和其他器官正常运行。维生素d水平对调节钙、磷代谢至关重要,缺乏可能会导致儿童佝偻病、成人骨质疏松症、软骨症、肌无力,增加老人跌倒骨折风险。近期研究表明,维生素d缺乏还与心血管疾病、自身免疫性疾病、糖尿病以及肿瘤等疾病有关。维生素e有抗氧化的生物作用,不仅可以防止细胞膜上脂类过氧化,也可以终止自由基链反应,对动物生长、骨骼及视力发育、繁殖和免疫功能有着尤为重要的影响,同时在身体退行性病变,癌症以及心血管等疾病方面也有一定的预防作用。
临床检测维生素的方法有有紫外可见分光光度法、酶联免疫吸附法、高效液相色谱法等,免疫法可实现自动化操作,检测快速、成本低,但单次仅能检测一种分析物,特异性差、易出现交叉反应,紫外可见分光光度法和高效液相色谱法所需样本量较大,灵敏度较低等无法满足检测需求。随着技术的发展,以色谱作为分离手段、三重四极杆串联质谱作为检测手段的液相色谱-串联质谱技术成为了定量检测生物样品中痕量目标分析物的强有力的手段。现有的基于液相色谱串联质谱技术检测血清中维生素的定量检测方法多为实验室自建方法,由于每个实验室检测方法和试剂选择不同,会造成室间的检测结果差异大,特别是在面对临床大量的检测样本,很难保证检测结果的一致性。想要解决这些问题,就需要针对检测项目直接提供经过验证的配套试剂盒以及标准的检测流程,提高液相色谱-串联质谱技术在临床检测的推广性,保证检测结果的一致性和准确性。
此外,在检测过程中,干血斑具备采血量少、制备操作简单、生物危险性低、生物稳定性好、运输保存方便等优势,可以更好地应用于临床,不仅减少了对样本量的需求,降低了患者的生理负担,而且便于异地检测,检测精准。而目前基于液相色谱串联质谱进行干血斑中维生素a、d、e的检测方法及检测试剂盒鲜有报道。
技术实现要素:
有鉴于此,本发明创造旨在提出一种干血斑中四种维生素的检测方法及检测试剂盒,以克服现有技术的缺陷,能够提供校准品、样品前处理所涉及的试剂和质控品,免除实验室检测自配的繁琐步骤和造成的误差,保证检测结果的准确性。
为达到上述目的,本发明创造的技术方案是这样实现的:
一种干血斑中四种维生素的检测方法及检测试剂盒,包括校准品、质控品、内标混合液、第一提取液、第二提取液、复溶液、流动相a、流动相b和洗针液;所述内标混合液为氘代维生素a、氘代25羟基维生素d2、氘代25羟基维生素d3和氘代维生素e。
进一步的,所述校准品为含有梯度浓度维生素a、d、e的干血斑,所述校准品的制备方法为:先用甲醇稀释维生素a、d、e标品溶剂到梯度浓度,然后与全血混合均匀,滴加到干血斑晾干封装;所述校准品中维生素a的浓度范围为50-2000ng/ml,25羟基维生素d2浓度范围为5-40ng/ml,25羟基维生素d3浓度范围为5-200ng/ml,维生素e的浓度范围1-40μg/ml。
进一步的,所述质控品包括第一质控品、第二质控品和第三质控品,且三者浓度依次升高;所述第一质控品中维生素a的含量范围为50-200ng/ml,25羟基维生素d2的含量范围为5-15ng/ml,25羟基维生素d3的含量范围为5-20ng/ml,维生素e的含量范围分别为1-4μg/ml;第二质控品中维生素a的含量范围为400-1000ng/ml,25羟基维生素d2的含量范围为20-30ng/ml,25羟基维生素d3的含量范围为35-100ng/ml,维生素e的含量范围为8-20μg/ml;第三质控品中维生素a的含量范围为1600-2000ng/ml、25羟基维生素d2的含量范围为35-40ng/ml、25羟基维生素d3的含量范围为160-200ng/ml、维生素e的含量范围为30-40μg/ml。
进一步的,所述质控品的制备方法为:用甲醇分别配制具有第一质控品、第二质控品和第三质控品相应浓度的校准品,然后将相应的校准品与全血混合均匀,滴加到干血斑上晾干封装,即得第一质控品、第二质控品和第三质控品。
进一步的,所述干血斑中维生素a、d、e的检测试剂盒还包括内标混合液、第一提取液、第二提取液、复溶液、流动相a、流动相b和洗针液;所述内标为氘代维生素a、氘代25羟基维生素d2、氘代25羟基维生素d3、氘代维生素e的混合溶液;内标中氘代维生素a浓度范围为1-5μg/ml,氘代25羟基维生素d2浓度范围为100-300ng/ml,氘代25羟基维生素d3浓度范围为300-600ng/ml,氘代维生素e浓度范围为10-30μg/ml。
进一步的,所述第一提取液为甲醇和乙腈混合溶液;甲醇与乙腈的体积比为1:1;所述第二提取液可以为正己烷;所述复溶液为甲醇水;所述流动相a为含甲酸的水溶液,甲酸与水的体积比为0.1%;所述流动相b为含甲酸的甲醇溶液,甲酸与甲醇的体积比为0.1%;所述洗针液为甲醇和水按体积比1:1混合的混合溶液
进一步的,包括以下步骤:
(1)样品制备:吸取一定量的全血滴到滤纸上,室温晾干置于塑料密封袋中,冷冻储存备用;
(2)样本处理:工作人员从干血斑上取下整个血斑,将该血斑与事先调配好的第一提取液、第二提取液、内标混合液涡旋混合密封,并于20-30℃的条件下超声水浴孵化;将孵化样品于-20℃冷冻10-20min,并于4-10℃冷冻离心5-10min,取400-550μl上清液进行氮吹,再用50-100μl复溶液复溶进样,用液相色谱-串联质谱检测;
(3)检测结果计算:将校准品出峰面积与对应内标出峰面积的比值作为纵坐标,校准品溶液的浓度作为横坐标,拟合线性方程得到校准品标准曲线;再将质控品样本的峰面积带入标准曲线中计算得到实际的浓度。
进一步的,所述液相色谱-串联质谱检测的液相色谱条件为:流动相a为含甲酸的水溶液,流动相b为含甲酸的甲醇溶液;色谱柱为kinetexc18,50*3mm,2.6μm;柱温为40℃;检测时间为5min;进样量为10-20μl;梯度洗脱条件:0-0.5min,70%b,0.5-1.5min,100%b,1.5-3.5min,100%b,3.5-3.6min,70%b,3.6-5min,70%b,流速0.4-0.8ml/min;质谱条件为:正离子模式,采用esi源,碰撞气3-5psi,气帘气20-40psi,雾化气40-70psi,辅助加热气40-70psi,喷雾电压5000v,雾化温度300-500℃。
相对于现有技术,本发明创造所述的一种干血斑中四种维生素的检测方法及检测试剂盒具有以下优势:
(1)本发明创造所述的一种干血斑中四种维生素的检测方法及检测试剂盒能够提供校准品、样品前处理所涉及的试剂和质控品,免除实验室检测自配的繁琐步骤和造成的误差,保证检测结果的准确性,而且所需样本量少,大大降低了患者的生理负担。
(2)本发明创造所述的一种干血斑中四种维生素的检测方法及检测试剂盒是一次取样,多个指标同时检测,节约了样本和时间,而且干血斑与血清相比更便于保存和运输。
(3)本发明创造所述的一种干血斑中四种维生素的检测方法及检测试剂盒前处理过程简单,可尽量避免操作过程带来的实验误差,从而提高了检测准确度。
附图说明
构成本发明创造的一部分的附图用来提供对本发明创造的进一步理解,本发明创造的示意性实施例及其说明用于解释本发明创造,并不构成对本发明创造的不当限定。在附图中:
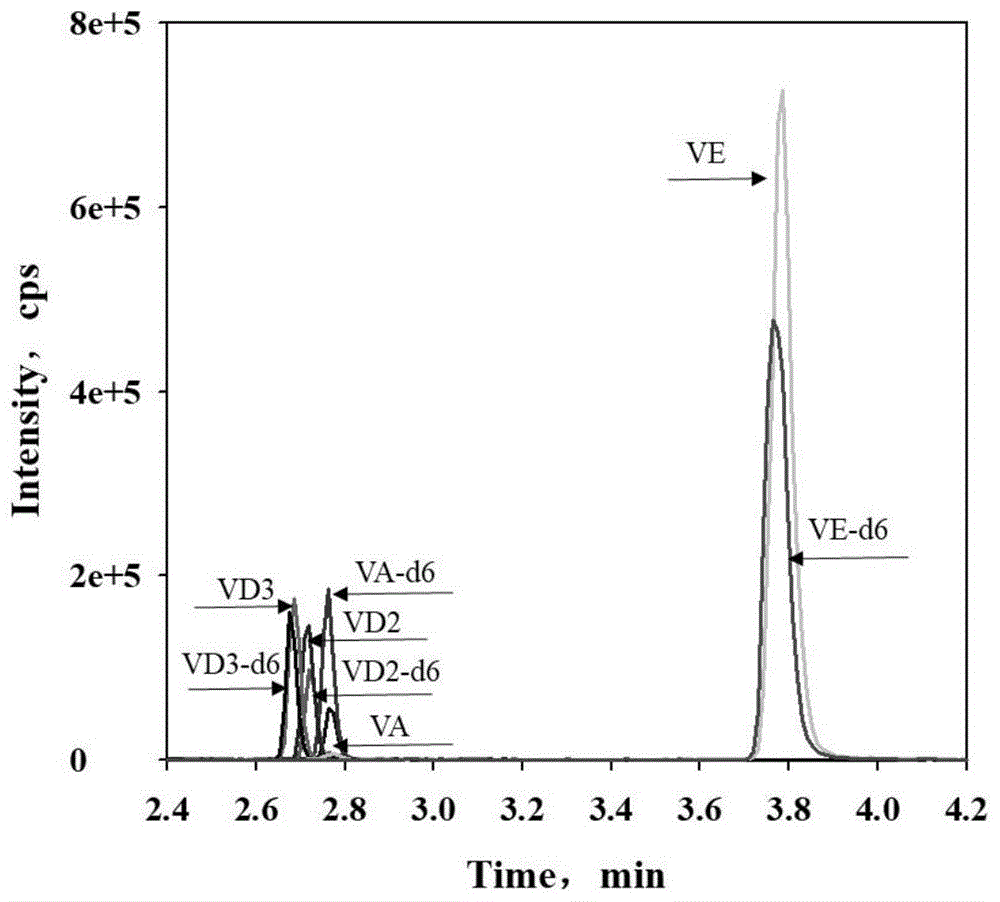
图1为本发明创造实施例所述的一种干血斑中四种维生素的检测方法及检测试剂盒中校准品色谱图;
图2为本发明创造实施例所述的一种干血斑中四种维生素的检测方法及检测试剂盒中维生素a线性曲线图;
图3为本发明创造实施例所述的一种干血斑中四种维生素的检测方法及检测试剂盒中25羟基维生素d2线性曲线图;
图4为本发明创造实施例所述的一种干血斑中四种维生素的检测方法及检测试剂盒中25羟基维生素d3线性曲线图;
图5为本发明创造实施例所述的一种干血斑中四种维生素的检测方法及检测试剂盒中维生素e线性曲线图;
图6为本发明创造实施例所述的一种干血斑中四种维生素的检测方法及检测试剂盒中维生素a、d、e的校准品溶液梯度浓度分布表;
图7为本发明创造实施例所述的一种干血斑中四种维生素的检测方法及检测试剂盒中第一提取液与样本量体积比优化表;
图8为本发明创造实施例所述的一种干血斑中四种维生素的检测方法及检测试剂盒中第二提取液用量优化表;
图9为本发明创造实施例所述的一种干血斑中四种维生素的检测方法及检测试剂盒中化合物质谱参数表;
图10为本发明创造实施例所述的一种干血斑中四种维生素的检测方法及检测试剂盒中内标归一化表;
图11为本发明创造实施例所述的一种干血斑中四种维生素的检测方法及检测试剂盒中定量下限样本测试结果表;
图12为本发明创造实施例所述的一种干血斑中四种维生素的检测方法及检测试剂盒中维生素a、d、e正确度表;
图13为本发明创造实施例所述的一种干血斑中四种维生素的检测方法及检测试剂盒中试剂盒测试的批内、批间和总精密度表。
具体实施方式
需要说明的是,在不冲突的情况下,本发明创造中的实施例及实施例中的特征可以相互组合。
在本发明创造的描述中,需要理解的是,术语“中心”、“纵向”、“横向”、“上”、“下”、“前”、“后”、“左”、“右”、“竖直”、“水平”、“顶”、“底”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明创造和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明创造的限制。此外,术语“第一”、“第二”等仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”等的特征可以明示或者隐含地包括一个或者更多个该特征。在本发明创造的描述中,除非另有说明,“多个”的含义是两个或两个以上。
在本发明创造的描述中,需要说明的是,除非另有明确的规定和限定,术语“安装”、“相连”、“连接”应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或一体地连接;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通。对于本领域的普通技术人员而言,可以通过具体情况理解上述术语在本发明创造中的具体含义。下面将参考附图并结合实施例来详细说明本发明创造。
一、试剂来源
(1)维生素a:sigma-aldrich,cas号68-26-8,为液体试剂试剂,100μg/ml,临用前用甲醇复溶即可使用。
(2)维生素a-d6:buchembv,cas号68-26-8,为干粉试剂,1mg/瓶,临用前用甲醇复溶即可使用。
(3)25-羟基维生素d2:torontoresearchchemicals,cas号21343-40-8,为干粉试剂,1mg/瓶,临用前用甲醇复溶即可使用。
(4)25-羟基维生素d2-d6:medicalisotopes,cas号1262843-46-8,为液体试剂,100μg/ml,临用前用甲醇复溶即可使用。
(5)25-羟基维生素d3:torontoresearchchemicals,cas号19356-1-3,为干粉试剂,1mg/瓶,临用前用甲醇复溶即可使用。
(6)25-羟基维生素d3-d6:medicalisotopes,cas号78782-98-6,为液体试剂,100μg/ml,临用前用甲醇复溶即可使用。
(7)维生素e:sigmaalrich,cas号10191-41-0,为液体试剂,1mg/ml,临用前用甲醇复溶即可使用。
(8)氘代维生素e:上海谱芬生物,cas号113892-08-3,为液体试剂,50μg/ml,临用前用甲醇复溶即可使用。
(9)甲醇:使用fisherchemical公司67-56-1号试剂,纯度为lc/ms级,常温密封储存。
(10)乙腈:使用fisherchemical公司75-05-8号试剂,纯度为lc/ms级,常温密封储存。
(11)正己烷:使用sigma公司110-54-3号试剂,纯度为hplc级,常温密封储存。
(12)水:符合国标gb/t6682-2008的一级水。
二、名词解释
va:维生素a;25(oh)d2:25羟基维生素d2;25(oh)d3:25羟基维生素d3;ve:维生素e;va-d6:氘代维生素a;25-ohd2-d6:氘代25羟基维生素d2;25-ohd3-d6:氘代25羟基维生素d3;ve-d6:氘代维生素e。
三、实施例
如图1至图13所示,一种干血斑中四种维生素的检测方法及检测试剂盒,包括校准品、质控品、内标混合液、第一提取液、第二提取液、复溶液、流动相a、流动相b和洗针液;所述内标混合液为氘代维生素a、氘代25羟基维生素d2、氘代25羟基维生素d3和氘代维生素e。
所述校准品为含有梯度浓度维生素a、d、e的干血斑,所述校准品的制备方法为:先用甲醇稀释维生素a、d、e标品溶剂到梯度浓度,然后与全血混合均匀,滴加到干血斑晾干封装;所述校准品中维生素a的浓度范围为50-2000ng/ml,25羟基维生素d2浓度范围为5-40ng/ml,25羟基维生素d3浓度范围为5-200ng/ml,维生素e的浓度范围1-40μg/ml。具体到本实施例,可以采用如表1所示的梯度浓度的校准品。
所述质控品包括第一质控品、第二质控品和第三质控品,且三者浓度依次升高;所述第一质控品中维生素a的含量范围为50-200ng/ml,25羟基维生素d2的含量范围为5-15ng/ml,25羟基维生素d3的含量范围为5-20ng/ml,维生素e的含量范围分别为1-4μg/ml;第二质控品中维生素a的含量范围为400-1000ng/ml,25羟基维生素d2的含量范围为20-30ng/ml,25羟基维生素d3的含量范围为35-100ng/ml,维生素e的含量范围为8-20μg/ml;第三质控品中维生素a的含量范围为1600-2000ng/ml、25羟基维生素d2的含量范围为35-40ng/ml、25羟基维生素d3的含量范围为160-200ng/ml、维生素e的含量范围为30-40μg/ml,在实验时,质控品样本:含有维生素a、d、e低、中、高三个浓度的干血斑。工作人员可以根据上述质控品浓度范围调配出第一质控品、第二质控品和第三质控品,具体的,低浓度的质控品(也即第一质控品)浓度分别为100ng/ml(维生素a)、10ng/ml(25羟基维生素d2)、10ng/ml(25羟基维生素d3)、2μg/ml(维生素e);中浓度的质控品(也即第二质控品)浓度分别为400ng/ml(维生素a)、20ng/ml(25羟基维生素d2)、35ng/ml(25羟基维生素d3)、20μg/ml(维生素e);高浓度的质控品(也即第三质控品)浓度分别为1600ng/ml(维生素a)、35ng/ml(25羟基维生素d2)、160ng/ml(25羟基维生素d3)、30μg/ml(维生素e)。
所述质控品的制备方法为:用甲醇分别配制具有第一质控品、第二质控品和第三质控品相应上述浓度的校准品,然后将相应的校准品与全血混合均匀,滴加到干血斑上晾干封装,即得第一质控品、第二质控品和第三质控品。
所述干血斑中维生素a、d、e的检测试剂盒还包括内标混合液、第一提取液、第二提取液、复溶液、流动相a、流动相b和洗针液;所述内标为氘代维生素a、氘代25羟基维生素d2、氘代25羟基维生素d3、氘代维生素e的混合溶液;内标中氘代维生素a浓度范围为1-5μg/ml,氘代25羟基维生素d2浓度范围为100-300ng/ml,氘代25羟基维生素d3浓度范围为300-600ng/ml,氘代维生素e浓度范围为10-30μg/ml,在实验中,工作人员内标混合液的配比可以采取以下数值:氘代维生素a浓度为2μg/ml、氘代25羟基维生素d2浓度为250ng/ml、氘代25羟基维生素d3浓度为500ng/ml、氘代维生素e浓度为20μg/ml。
所述第一提取液为甲醇和乙腈混合溶液;甲醇与乙腈的体积比为1:1,这样比单独使用甲醇或乙腈时待测样品的沉淀效果更好;所述第二提取液可以为正己烷,正己烷能够提高待测样品的萃取效果;所述复溶液为甲醇水,甲醇和水按体积比1:1混合;所述流动相a为含甲酸的水溶液,甲酸与水的体积比为0.1%,甲酸可以使待测样本的离子化效率高,灵敏度强;所述流动相b为含甲酸的甲醇溶液,甲酸与甲醇的体积比为0.1%;所述洗针液为甲醇和水按体积比1:1混合的混合溶液。具体到本实施例,可以采用如表2-3所示的第一提取液、第二提取液与样本量体积比,通过结果比较,选用第一提取液与样本量的体积比为4:1进行样本沉淀,选用600μl的第二提取液进行样本处理,都是取中数值,这是因为其对应的峰面积较大较好,虽然再大一点的数值对应的峰面积也会偏大一些,但是没有大太多,而且取中数值试剂的量不会过多浪费。
一种干血斑中四种维生素的检测方法,包括以下步骤:
(1)样品制备:吸取一定量的全血滴到滤纸上,室温晾干置于塑料密封袋中,冷冻储存备用,具体的,工作人员将静脉血与乙二胺四乙酸充分混合,然后用移液器吸取50ul全血滴到whatman903滤纸上,让血液滤纸片于室温下自然干燥(干燥至少4小时,且不要加热血片或将其堆叠在一起),干血斑充分干燥后,将其放入玻璃纸、塑料纸里(若需要邮寄,则需要将分装的干血斑放入大的密封袋,加入干燥剂和湿度指示卡,送检清单、申请报告单等),避免滤纸间的污染,一般无法立即检测时,可暂时储存在-20℃冰柜中,乙二胺四乙酸可以阻止血液凝固,以便于充分混合,另外在静脉血与乙二胺四乙酸充分混合时如果静脉血中的血浆与血细胞分层,需轻柔地上下颠倒采血管,避免血细胞破裂;而现有维生素的检测常用血清检测,其采集方式是:工作人员首先采集血液样本,并将其置于不含抗凝剂的试管内;室温下自然凝集30-60min,待血液凝固;以2000-3000rpm的速度离心5-10min,上清液即为血清。但这种血清不便于保存,而且运输不便,另外用仪器离心时不注意会造成溶血等现象,从而增大了对待测样本量的需求,增加了患者的生理负担。
(2)样本处理:使用该试剂盒进行样品处理,处理步骤如下,工作人员用8mm打孔器从干血斑上取下整个血斑,置于2ml的离心管内,加入10μl混和内标,200μl第一提取液,600μl第二提取液涡旋混合密封,并于25℃的条件下超声水浴孵化;将孵化样品于-20℃冷冻15min,并于4℃冷冻离心10min,取500μl上清液进行氮吹,再用100μl复溶液复溶进样,用液相色谱-串联质谱检测。
(3)检测方法
所述液相色谱-串联质谱检测的液相色谱条件为:流动相a为含甲酸的水溶液,流动相b为含甲酸的甲醇溶液;色谱柱为kinetexc18,50*3mm,2.6μm;柱温为40℃;检测时间为5min;进样量为10-20μl;梯度洗脱条件:0-0.5min,70%b,0.5-1.5min,100%b,1.5-3.5min,100%b,3.5-3.6min,70%b,3.6-5min,70%b,流速0.4-0.8ml/min;质谱条件为:正离子模式,采用esi源,碰撞气3-5psi,气帘气20-40psi,雾化气40-70psi,辅助加热气40-70psi,喷雾电压5000v,雾化温度300-500℃,在实验中,工作人员将复溶液在液相色谱(岛津)-串联质谱(爱博才思)设备中进行检测。采用多反应监测(mrm)扫描方式,色谱测试条件为:流动相a为0.1%甲酸水溶液,流动相b为0.1%甲酸甲醇溶液;色谱柱为kinetexc18(50mm×3mm,2.6μm);柱温为40℃;检测时间为5min;进样量为10μl;采用梯度洗脱,0min~0.5min,70%b;0.5min~1.5min,100%b;1.5min~3.5min,100%b;3.5min~3.6min,70%b;3.6min~5min,70%b;流速为0.6ml/min。质谱条件为正离子模式,采用esi源,碰撞气4psi,气帘气20psi,雾化气60psi,辅助加热气55psi,喷雾电压5000v,雾化温度450℃。具体化合物质谱参数如表4所示。
(4)检测结果计算:将校准品出峰面积与对应内标出峰面积的比值作为标准曲线的纵坐标,校准品溶液的浓度作为横坐标,拟合线性方程得到校准品标准曲线;再将质控品样本的峰面积带入标准曲线中计算得到实际的浓度,并与理论值比较评估。
三、效果验证
1、基质效应实验
通过样本处理后加入法对基质效应进行评价,即mf=提取后的空白基质加入分析物的响应/纯溶剂(纯溶剂采用甲醇)中分析物的响应。内标归一化mf=分析物mf/内标mf,当内标归一化mf的范围为0.8~1.2可接受。目标分析物选取低中高三个浓度进行验证,每个浓度的样本为5份,进行测定。结果如表5所示,表明干血斑没有明显的基质效应影响。
2、定量下限
根据维生素a、d、e的临床检测需求以及仪器设备的灵敏度,将方法及试剂盒的定量下限定为维生素a为15ng/ml,25羟基维生素d2为5ng/ml,25羟基维生素d3为5ng/ml,维生素e为1μg/ml,连续检测10次,计算检测值和理论值的偏差以及测试结果的变异系数cv值。测试结果如表6所示。测试值和理论值的偏差均在15%以内,测试的平行样本变异系数在15%以内,故该方法及试剂盒的定量下限分别为维生素a为15ng/ml,25羟基维生素d2为5ng/ml,25羟基维生素d3为5ng/ml,维生素e为1μg/ml。
3、线性范围
根据临床检测需求确定检测范围,并在检测范围需求内设置浓度梯度,检测梯度浓度的校准品,将目标分析物和内标峰面积的比值与梯度浓度进行拟合,得到工作曲线,拟合曲线及工程曲线方程如下图所示。计算测试值和理论值的比值,计算结果如图2至图5所示,线性相关系数r分别为0.9999(维生素a)、0.9974(25(oh)d2)、0.9968(25(oh)d3)、0.9983(维生素e)、此检测方法及相关试剂盒的线性范围分别为50-2000ng/ml(维生素a)、5-40ng/ml(25羟基维生素d2)、5-200ng/ml(25羟基维生素d3)、1-40μg/ml(维生素e)。
4、正确度验证
以实施例所述的试剂盒测试实际的人全血样品,通过加标回收率测定试剂盒的正确度,结果如表7所示。
5、精密度验证
以实施例所述的试剂盒验证方法及试剂盒的精密度,分别检测批内、批间和总精密度,结果见表8。试剂盒样品中维生素a、d、e的批内、批间、总精密度均小于10%。
本发明针对上述的现有检测维生素a、d、e的问题,所提供的试剂盒的使用方法涵盖从样本处理到进样检测、数据质控的整体解决方案,此外,本方案所需要的血清样本量很少,可满足临床试剂检测的需求。
以上所述仅为本发明创造的较佳实施例而已,并不用以限制本发明创造,凡在本发明创造的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明创造的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!