用于锂离子电池的包覆钛酸锂的制作方法
本公开总体上涉及锂离子电池,特别是涉及其中负极为钛酸锂的锂离子电池。
背景技术:
二次(或可再充电)锂离子电池用于许多固定和便携式设备中,例如在消费电子产品、汽车和航空航天工业中所遇见的那些设备。出于多种原因(包括相对高的能量密度、与其它种类的可再充电电池相比通常不出现任何记忆效应、相对低的内阻、在不使用时的低自放电速率、以及成形为各种各样的形状(例如棱柱形)和尺寸以便有效填充电动车辆、移动电话和其它电子设备中的可用空间的能力),锂类电池已经得到普及。此外,锂电池在其使用寿命期间经历重复的功率循环的能力也使它们成为有吸引力且可靠的电源。
发明概述
本发明提供了包括电解质和钛酸锂负极的锂离子电池。钛酸锂负极包含钛酸锂核和包围各钛酸锂核的共形层的结构,其中该共形层:
i.包含氧化钛,其基本上不含锂;或
ii.具有范围从该层表面部分处的较低浓度到与钛酸锂核相邻的该层内部部分处的较高浓度的锂浓度。
本文中公开的负极的实例可以包括在锂离子电池中。
附图概述
本公开的实例的特征通过参照以下详细描述和附图将变得明显,其中类似的附图标记对应于类似——尽管可能并不相同——的组件。为了简洁起见,具有先前描述的功能的附图标记或特征可以结合或不结合它们出现在其中的其它附图来进行描述。
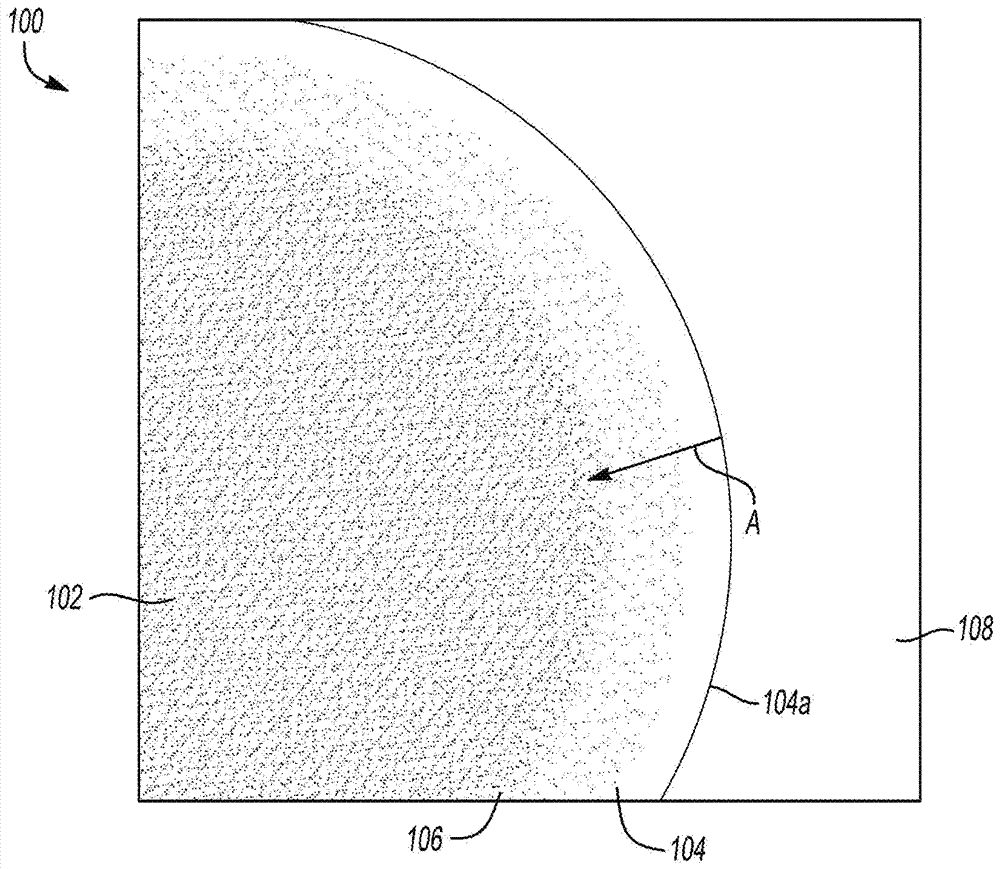
图1是示意图,描绘了具有包围钛酸锂核的共形层的钛酸锂结构的一部分。
图2示意性图解了在放电状态过程中锂离子电池的一个实例,其包括具有本文中公开的钛酸锂结构的负极的实例。
图3,基于强度(i,以任意单位)和电子能量(ee,以ev为单位)的坐标,是图1中所描绘的钛酸锂结构的表面和内部的eels(电子能量损失谱法)谱图的曲线图,显示在表面处缺少锂。
发明详述
锂离子电池通常通过在负极(有时称为阳极)和正极(有时称为阴极)之间可逆地传递锂离子来运行。负极和正极位于浸有适于传导锂离子的电解质溶液的多孔聚合物隔膜的相对侧。负极和正极各自还伴随着相应的集流体。与两个电极相关联的集流体通过可断开的外电路连接,该外电路允许电流在电极之间通过,以便电平衡锂离子的相关迁移。此外,负极可包括嵌锂主体材料(如钛酸锂),正极可包括活性材料,所述活性材料可以在比负极的嵌锂主体材料更高的电势下储存锂离子。
简而言之,对于其中负极(阳极)为钛酸锂(li4ti5o12,lto,因其尖晶石晶体结构也称为尖晶石钛酸锂)的锂离子电池,正极(阴极)可以是锂基活性材料,如层状锂过渡金属氧化物。例如,锂基活性材料可以是尖晶石锂锰氧化物(limn2o4,lmo)、锂钴氧化物(licoo2,lco)、锰-镍氧化物尖晶石[li(mn1.5ni0.5)o2,lmno]、磷酸铁锂(lifepo4,lfp)或层状镍锰钴氧化物(具有通式:xli2mno3·(1-x)limo2,其中m由任意比率的ni、mn和/或co组成)。在其它实例中,正极可以是非锂基活性材料,如金属氧化物,包括但不限于锰氧化物(mn2o4)、钴氧化物(coo2)、镍-锰氧化物尖晶石、层状镍锰钴氧化物、或铁聚阴离子氧化物,如磷酸铁(fepo4)或氟磷酸铁(fepo4f)、或钒氧化物(v2o5)。
lto是一种特别合意的负极材料。许多li-离子电池可能由于多种因素而受困于容量衰减,所述因素包括在负极表面上形成被称为固体电解质中间相(sei)层的钝化膜(其通常由负极材料的反应产物、电解质还原和/或锂离子还原生成)。sei层形成在确定电极行为和性质(包括循环寿命、不可逆的容量损失、高电流效率和高倍率性能,对于动力电池和启停电池用途而言特别有利)方面起重要的作用。lto具有合意地最小化或避免sei形成的高截止电压(cutvoltage)(例如相对于锂金属基准电势的截止电势),并且是一种零应变材料,其在锂嵌入和脱嵌过程中具有最小体积变化,这使得能够获得长期循环稳定性、高电流效率和高倍率性能。这样的长期循环稳定性、高电流效率和高倍率性能对于动力电池和启停电池用途而言特别有利。
如上所述,lto是用于高功率锂离子电池的一种有前途的负极材料。但是,当与某些正极材料和电解质一起使用时,lto可能潜在地存在某些挑战。例如,已经观察到,li4+xti5o12可能在电池组电池中生成主要由氢气组成的大量气体,尤其是在充电状态下的升高温度条件下。这样的气体形成可使lto成为对于商业用途而言不太理想的选择。
不受限于任何特定理论,这样的放气的机理似乎是:
li4ti5o12+3li++3e-↔li7ti5o12。
在该机理中,li4ti5o12中的ti4+被部分还原成li7ti5o12中的ti4+/ti3+。ti3+可以如下与氢离子反应以形成ti4+和氢气:
ti3++h+→ti4++½h2↑。
因此,可以理解的是,放气至少主要来自氢气的生成。据信ti3+催化电解质还原反应,由此还生成诸如co2、co、n2、和其它气体之类的气体。
在运行过程中在li4ti5o12锂离子动力电池中生成气体是一个长期存在的问题。以往的研究已表明,涂层(如碳和金属氧化物)可以在一定程度上抑制析气问题,但是不能完全解决这一问题。
本文中公开的锂离子电池实例表现出减少的放气。本发明人已经出人意料地发现,将li4ti5o12电极与电解质隔离减少(甚至消除了)放气,并改善了高功率锂离子电池的循环寿命。
本发明人已经发现,在li4ti5o12结构表面上的紧密的共形层(其中通过化学酸浸或化学酸浸与热处理的组合来控制锂浓度)似乎有效地将li4ti5o12分离以免于与电解质直接物理接触,并由此避免发生上述电解质还原反应。因此,可以减少或甚至消除li4ti5o12动力电池中的放气。
根据本文中的教导,提供了包括钛酸锂负极和电解质的锂离子电池。该钛酸锂负极包含钛酸锂核和包围各钛酸锂核的共形表面梯度层的结构,其中该共形层:
i)包含氧化钛,其基本上不含锂;或
ii)具有范围从该层表面部分处的较低浓度到与钛酸锂核相邻的该层内部部分处的较高浓度的锂浓度。
图1是示意图,描绘了本文中公开的钛酸锂结构的一部分。具体而言,钛酸锂结构100包括被共形层104包围或包覆的钛酸锂核102。共形层104具有表面104a,当包含在电池中时,其与电解质108接触。
钛酸锂结构100可以是粒子,其可以是球形的、棒状的(例如纳米棒)或具有某些其它构型。钛酸锂结构100还可以是某些其它纳米结构或微米结构。该结构的尺寸可以在大约200nm至大约5µm的范围内。
钛酸锂核102是尖晶石钛酸锂li4ti5o12。
共形层104可以是氧化钛,据信最可能为tio2,其基本上不含锂。也就是说,起初为钛酸锂的共形层104通过去除锂变为氧化钛。在除去(例如浸出)锂时,钛离子应处于其最高氧化态,由此tio2可能是剩余的氧化钛。但是,要理解的是,也可能存在一些tiox(0<x<2)。锂可以通过各种技术除去,包括酸浸,其在下文中更详细地描述。在这种情况下,可能更合适的是将层104称为壳,在那里锂浓度基本上为零,跨越层104直到达到核102,在此锂浓度为100%,即为完全化学计量组成li4ti5o12。
或者,共形层104可以具有锂浓度梯度a,其范围从表面104a处的基本上为零(无锂)到与核102相邻的共形层104的内部部分106处的高浓度(例如100%)。核102本身可以被视为具有100%的锂浓度。这样的梯度a可以通过热处理经酸浸的钛酸锂结构而形成,如下文中更详细地描述的那样。
在任一种情况下,要理解的是,在结构100的表面104a上缺少锂可以将钛酸锂结构100的核102中的锂与电解质108隔离。由于结构100的表面104a基本上不含锂,上述电解质还原反应可能不会发生。因此,可以由此减少或甚至消除析气。
共形层104的内部部分106可以是从共形层104到核102的过渡区域。内部部分(或过渡区域)106可能相对突兀,如可以是在壳/共形层104中基本上不含锂的情况。例如,整个共形层104,包括内部部分106,可以几乎不具有或不具有锂,且核102可以具有100%的锂浓度。或者,内部部分(或过渡区域)106可能相对模糊,如可以是锂的实际浓度在整个共形层104中改变并朝向核102增加的情况。梯度a可以是锂浓度从0%li到100%li的线性梯度,或可以是某些其它浓度梯度。
共形层104可以具有大约0.5nm至大约100nm的厚度。在一个实例中,层104的厚度可以为大约7nm。
处理钛酸锂前体结构以形成钛酸锂结构100的一个实例的方法可以包括用酸浸出钛酸锂前体结构。钛酸锂前体结构的一个实例是li4ti5o12。酸浸形成钛酸锂结构100的一个实例,其包含钛酸锂核102和在钛酸锂核102上的共形层104。酸浸从钛酸锂前体结构中抽出锂,在表面处开始并随后更深地渗透到该结构中,取决于酸的强度和/或实施酸浸的时间长度。在酸浸过程中,锂的去除是扩散控制过程,该前体结构的已反应部分不应包括锂。由此,因酸浸而形成的层104可能具有壳结构(在层104中基本上无锂)。对于本文中提供的范围的较高端点处的层104的厚度,可能存在一些保留在层/壳104中(主要是靠近内部部分或核/壳界面106)的残留锂。
浸出过程中使用的酸可以是强酸、中强酸或弱酸。此类酸的实例包括硝酸/hno3(强酸)、磷酸/h3po4(中强酸)和乙酸/ch3cooh(弱酸)。也可以使用其它酸,要理解的是,这些仅仅是代表性实例。酸的强度是指其失去质子(h+)的能力或倾向。强酸是在溶液中完全电离(离解)的酸(前提是有足够的溶剂)。在水中,一摩尔强酸ha溶解,产生一摩尔h+(以水合氢离子h3o+形式)和一摩尔共轭碱a−。基本上,不会留下未电离的酸ha。在水中强酸的另外的实例包括盐酸(hcl)、氢碘酸(hi)、氢溴酸(hbr)、高氯酸(hclo4)和硫酸(h2so4)。在水溶液中,这些各自基本上100%电离。相比之下,弱酸仅部分离解。在水中弱酸的另外的实例包括碳酸(h2co3)。在平衡时,酸和共轭碱均存在于溶液中。
酸的浓度可以为大约0.1摩尔浓度至大约10摩尔浓度。酸的一个示例性浓度可以是1摩尔浓度。酸浸的时间段可以为大约3小时至大约72小时,取决于酸的强度。通常,较短的酸浸时间可能与较高的酸强度相关联。例如,当使用强酸时,72小时的浸出可能过长。在该实例中,对于强酸而言的酸浸时间段可以为大约24小时至大约48小时。对于另一实例而言,当使用弱酸时,24小时的浸出可能过短。在这一其它实例中,对于弱酸而言的酸浸时间段可以为大约48小时至大约72小时。酸浸温度可以为大约0℃至大约90℃。
可以向酸中加入强氧化剂以帮助在整个酸浸过程中将钛保持在+4态(ti4+)。如本文中所用,强氧化剂是容易从其它物类中除去电子的氧化剂。强氧化剂可以吸收o2,并且还可以氧化ti3+。合适的强氧化剂的一个实例是过氧化氢/h2o2。强氧化剂的另外的实例包括氧气(o2)、臭氧(o3)、无机过氧化物、氟(f2)、氯(cl2)和其它卤素。强氧化剂在酸中的浓度可以为大约0.1重量百分比(重量%)至大约20重量%。在一个实例中,可以将2毫升的50重量%h2o2添加到25毫升hno3中,由此导致使用大约3.7重量%的50重量%h2o2。
在酸浸之后,结构100可以成形为电极(如下文中进一步描述的那样)。在另一方面,在酸浸之后,可以通过热处理进一步处理钛酸锂结构100。热处理可以在大约400℃至大约800℃的温度下进行大约1小时至大约24小时的时间段。通常,较短的热处理时间可能与较高的热处理温度相关联。在酸浸加热处理之后,结构100可以随后成形为电极。
热处理的目的是在共形层104(例如,由酸浸而形成的壳)中生成锂梯度,否则共形层104因酸浸而基本上不含锂。热处理导致锂从核102扩散到共形层104中。热处理后跨越共形层104的锂的浓度分布可以随着热处理的时间和温度而改变。较长的加热时间和/或较高的加热温度可能导致在共形层104中更多的锂和/或在表面104a处存在至少一部分锂。为了保持表面104a基本上不含锂,可以调节加热时间和/或加热温度以使锂不扩散至表面104a。
热处理的另一目的是确保钛酸锂核102被共形层104紧密共形覆盖。“共形”覆盖是指层104符合结构100的轮廓并包覆或包围钛酸锂核102。由此,共形层104用于保护内部(或核102)以免暴露于电解质108。尽管共形(壳)层104由于酸浸而被认为是共形的,热处理可以进一步增强层104的共形性质。
本发明提供了减少具有钛酸锂负极的锂离子电池中的气体产生的方法。该方法包括:
将本文中公开的钛酸锂结构100的任一实例并入负极;
将该负极并入锂离子电池;和
循环该锂离子电池。
至于负极的制备,以钛酸锂粉末形式从酸浸或酸浸加热处理中回收处理过的钛酸锂结构100。将该粉末与导电碳和聚合物粘合剂在溶剂中混合,随后将所得浆料涂布到合适的集流体材料(例如cu或al箔)上并干燥以形成干燥电极。下面给出制备负极的进一步细节,以及导电碳和聚合物粘合剂的浓度范围。
下面参照图2描述上文列举的并入步骤和循环步骤,以及锂离子电池的说明。
现在参照图2,图解了锂离子电池10的一个实例。锂离子电池10通常包括负极12、负极侧集流体12a、正极14、正极侧集流体14a和设置在负极12与正极14之间的聚合物隔膜16。可断开的外电路18连接负极12与正极14。负极12、正极14和聚合物隔膜16各自浸泡在能够传导锂离子的电解质溶液中。
负极侧集流体12a和正极侧集流体14a可以分别定位成与负极12和正极14接触以便向外电路18和从外电路18收集和移动自由电子。采用本文中公开的方法,负极12可以直接在负极侧集流体12a上形成,正极14可以直接在正极侧集流体14上形成。下面描述集流体12a和14a的实例。
锂离子电池10可以支持负载设备22,其可操作地连接到外电路18上。当锂离子电池10放电时,负载设备22可以完全或部分由通过外电路18的电流来供电。尽管负载设备22可以是任意数量的已知电动装置,耗电负载设备的少许具体实例包括用于混合动力车辆或全电动车辆的电动机、手提电脑、移动电话和无绳电动工具。然而,负载设备22也可以是将锂离子电池10充电以便储存能量的发电装置。例如,风车和太阳能电池板可变和/或间歇式发电的趋势常常导致需要储存多余的能量供以后使用。
锂离子电池10可以包括宽范围的其它组件,尽管并未在此描绘出这些组件,但它们是本领域技术人员已知的。例如,锂离子电池10可以包括外壳、垫圈、端子、极耳(tab)和出于性能相关或其它实践目的而可以置于负极12与正极14之间或周围的任何其它合意的组件或材料。此外,锂离子电池10的尺寸和形状,以及其主要组件的设计和化学构成,可以根据为此进行设计的特定应用而改变。例如,电池供电的汽车和手持式消费电子设备是其中锂离子电池10最可能设计为不同尺寸、容量和功率输出规格的两种情况。锂离子电池10还可以与其它类似的锂离子电池串联和/或并联连接,以便在负载设备22有此需要时产生更大的电压输出和电流(如果并联布置)或电压(如果串联布置)。
锂离子电池10可以通过可逆电化学反应在电池放电过程中生成可用的电流,在负极12含有足够较高的相对量的锂嵌入/脱嵌材料(例如钛酸锂)时,当外电路18闭合以连接负极12和正极14时发生该可逆电化学反应。正极14与负极12之间的化学势差(范围为大约1.5v至5.0v,取决于电极12、14的确切化学组成)驱动在负极12处通过钛酸锂的氧化产生的电子穿过外电路18通向正极14。锂离子(其也在负极12处产生)同时被电解质溶液携带穿过聚合物隔膜16并通向正极14。流经外电路18的电子和迁移穿过电解质溶液中的聚合物隔膜16的锂离子最终在正极14处复合并形成嵌入锂。通过外电路18的电流可以控制并引导穿过负载设备22,直到负极12中的嵌入锂的水平下降到可工作水平以下或电能需求停止。
通过向锂离子电池10施加外部电池充电器以逆转电池放电过程中发生的电化学反应,由此可以在其可用容量部分或完全放电后的任何时间对锂离子电池10充电或再供电。将外部电池充电器连接到锂离子电池10上迫使在正极14处发生例如锂过渡金属氧化物的否则非自发的氧化以产生电子并释放锂离子。电子(其通过外电路18流回至负极12)和锂离子(其被电解质携带穿过聚合物隔膜16返回至负极12)在负极12处再结合并用嵌入锂将其重新装填以供下一电池放电循环过程中的消耗。
可用于将锂离子电池10充电的外部电池充电器可以根据锂离子电池10的尺寸、构造和特定最终用途而改变。一些合适的外部电源的实例包括插入ac壁装电源插座和机动车交流发电机的电池充电器。
如前所述,锂离子电池10通常通过在负极12和正极14之间可逆地传递锂离子来运行。在完全充电状态下,电池10的电压处于最大值(通常为1.5v至5.0v);而在完全放电状态下,电池10的电压处于最小值(通常为0v至2.0v)。实质上,正极和负极14、12中活性材料的费米能级在电池运行过程中改变,二者之间的差值(称为电池电压)也是如此。电池电压在放电过程中随着费米能级变得彼此更接近而减少。在充电过程中,发生相反的过程,电池电压随着费米能级被驱使分开而增加。在电池放电过程中,外部负载设备22使电流能够在外电路18中以使得费米能级之间的差值(以及相应地,电池电压)减少的方向流动。在电池充电过程中发生相反的情况:电池充电器迫使电流在外电路18中以使得费米能级之间的差值(以及相应地,电池电压)增加的方向流动。
在放电开始时,锂离子电池10的负极12含有高浓度的嵌入锂,而正极14相对贫乏。当负极12含有足够较高的相对量的嵌入锂时,锂离子电池10可以通过前述的可逆电化学反应生成有利的电流,当外电路18闭合以连接负极12和正极14时发生该可逆电化学反应。在这样的情况下,闭合外电路的建立导致嵌入锂从负极12中抽出。当它们在负极-电解质界面处离开嵌入主体时,抽出的锂原子分裂为锂离子(标记为黑点和具有(+)电荷的空心圆圈)和电子(e-)。
负极12可以包含以基于负极12的组合物计大约85重量百分比(重量%)至大约95重量%的量存在的钛酸锂结构100。钛酸锂结构的初级粒度可以为5µm或更小。钛酸锂结构100的粒度分布具有小于10µm的d50和小于30µm的d95。换句话说,钛酸锂结构100的50%具有小于10µm的尺寸,并且钛酸锂结构100的95%具有小于30µm的尺寸。钛酸锂结构100的bet表面积小于16m2/g。在1c的c-rate下,具有这些规格的钛酸锂结构100表现出大约150mah/g至大约170mah/g的容量。
负极12还可以包含导电填料。该导电填料可以是碳、石墨、气相生长碳纤维(vgcf)和/或碳纳米管。当包含碳时,其可以以基于负极12的组合物计大约1重量%至大约6重量%的量存在。碳导电填料可以具有大于50m2/g的bet表面积。碳导电填料的一个实例是superp®(炭黑,可获自timcalgraphite&carbon(bodio,switzerland))。当包含石墨时,其可以以基于负极12的组合物计大于0重量%至大约3重量%的量存在。石墨导电填料可以具有小于8µm的d50,并可以具有大约5m2/g至大约30m2/g的bet表面积。可以在负极12中用作导电填料的石墨的商业形式可获自例如timcalgraphite&carbon,lonzagroup(basel,switzerland)或superiorgraphite(chicago,il)。一个具体实例是timrex®ks6(来自timcalgraphite&carbon的初级合成石墨)。当包含气相生长碳纤维或碳纳米管时,其可以以基于负极12的组合物计大于0重量%至大约5重量%的量存在。气相生长碳纤维可以是直径为大约100nm至大约200nm、长度为大约3µm至大约10µm和bet表面积为大约10m2/g至大约20m2/g的纤维形式。在一个实例中,气相生长碳纤维以基于负极12的组合物计大于0重量%至大约3重量%的量存在。碳纳米管可以具有大约8nm至大约25nm的直径和大约1µm至大约20µm的长度。
负极12还可以包含单独地以基于负极的组合物计大约1重量%至大约8重量%的量存在的粘合剂。在一个实例中,粘合剂以基于负极12的组合物计2重量%至大约8重量%的量存在。粘合剂可以是聚偏二氟乙烯(pvdf)、聚四氟乙烯(ptfe)、羧甲基纤维素钠和聚合的苯乙烯丁二烯橡胶(cmc+sbr)、la133、或la132或其组合。la133是水性粘合剂,其是丙烯腈多元共聚物的水分散体,la132是水性粘合剂,其据信是丙烯酰胺、甲基丙烯酸锂和丙烯腈的三嵌段共聚物;这两种丙烯腈共聚物均可获自chengduindigopowersourcesco.,ltd.,sichuan,p.r.c。
负极12的组合物的一个实例包含大约89.5重量%的钛酸锂结构100、3重量%的碳、1重量%的石墨、1重量%的气相生长碳纤维和5.5重量%的pvdf。
与负极12相邻的是负极侧集流体12a,其可以由铝或铜形成。在一个实例中,铝可以为裸露的铝箔形式。负极侧集流体12a的厚度可以为大约15µm至大约25µm。在另一实例中,负极侧集流体12a可以在至少一面上涂有碳。当包含碳涂层时,在集流体12a的一面上的碳涂层厚度为大约0.1µm至大约2µm。
负极12的另外的特征包括:孔隙率为大约28%至大约44%;水分含量小于700ppm;电导率小于2ω•cm;压制密度(压制该电极后的密度)为大约1.8g/cm3至大约2.2g/cm3。当将负极12涂布在集流体12a的一面上时,容量载荷可以为大约0.28mah/cm2至大约0.84mah/cm2。水分含量可以通过karlfisher法(如使用可获自mettlertoledointernational,inc.(columbus,oh)的c30compactkarlfischercoulometer)测得。
对于锂离子电池10,正极14可以是任何合适的活性材料或其组合,以基于正极14的组合物计大约85重量%至大约95重量%的量存在。更具体而言,适于正极14的这一实例的常见类别的已知锂基活性材料包括层状锂过渡金属氧化物。例如,锂基活性材料可以是尖晶石锂锰氧化物(limn2o4,lmo)、锂钴氧化物(licoo2)、锰-镍氧化物尖晶石[li(mn1.5ni0.5)o2]或层状镍锰钴氧化物(具有通式:xli2mno3·(1-x)limo2,其中m由任意比率的ni、mn和/或co组成)。层状镍-锰-钴氧化物的具体实例包括(xli2mno3·(1−x)li(ni1/3mn1/3co1/3)o2)。其它合适的锂基活性材料包括li(ni1/3mn1/3co1/3)o2、lix+ymn2-yo4(lmo,0<x<1和0<y<0.1)或锂铁聚阴离子氧化物,如磷酸铁锂(lifepo4,lfp)或氟磷酸铁锂(li2fepo4f)或富锂层结构。还可以使用另外其它锂基活性材料,如lini1-xco1-ymx+yo2或limn1.5-xni0.5-ymx+yo4(m由任意比率的al、ti、cr和/或mg组成)、稳定化锂锰氧化物尖晶石(lixmn2-ymyo4,其中m由任意比率的al、ti、cr和/或mg组成)、锂镍钴铝氧化物(例如,lini0.8co0.15al0.05o2)或nca)、铝稳定的锂锰氧化物尖晶石(例如lixal0.05mn0.95o2)、锂钒氧化物(liv2o5)、li2msio4(其中m由任意比率的co、fe和/或mn组成)、锂镍锰钴氧化物(linixcoymn1-x-yo2,nmc)和任何其它高能镍-锰-钴材料(he-nmc)。“任意比率”是指任意元素可以以任意的量存在。因此,在一些实例中,m可以是al,含有或不含cr、ti和/或mg,或所列举的元素的任意其它组合。在另一实例中,在锂过渡金属基活性材料的任意实例的晶格中可以进行阴离子取代以稳定晶体结构。例如,任意o原子可以被f原子取代。
当选择锂锰氧化物作为正极14中的活性材料时,锂锰氧化物的粒度分布可以具有小于10µm的d50和小于20µm的d95。换句话说,锂锰氧化物粒子的50%具有小于10µm的尺寸,并且锂锰氧化物粒子的95%具有小于20µm的尺寸。锂锰氧化物粒子的bet表面积可以为大约0.4m2/g至大约1.2m2/g。在1c的c-rate下,具有这些规格的锂锰氧化物粒子表现出大约95mah/g至大约110mah/g的容量。
当选择锂镍锰钴氧化物作为正极14中的活性材料时,锂镍锰钴氧化物的粒度分布可以具有小于8µm的d50和小于15µm的d95。换句话说,锂镍锰钴氧化物粒子的50%具有小于8µm的尺寸,并且锂镍锰钴氧化物粒子的95%具有小于15µm的尺寸。锂镍锰钴氧化物粒子的bet表面积为大约0.4m2/g至大约1.0m2/g。在1c的c-rate下,具有这些规格的锂镍锰钴氧化物粒子表现出大约135mah/g至大约300mah/g的容量。
正极14还可以包含导电填料,其中该导电填料可以是碳、石墨、和/或气相生长碳纤维或碳纳米管。当包含碳时,其可以以基于正极14的组合物计大约1重量%至大约6重量%的量存在。该碳导电填料可以具有大于50m2/g的bet表面积。碳导电填料的一个实例是superp®(炭黑,可获自timcalgraphite&carbon(bodio,switzerland))。当包含石墨时,其可以以基于正极14的组合物计大于0重量%至大约3重量%的量存在。在一个实例中,石墨导电填料具有小于8µm的d50,和大约5m2/g至大约30m2/g的bet表面积。可以在正极14中用作导电填料的石墨的商业形式可获自例如timcalgraphite&carbon(bodio,switzerland)、lonzagroup(basel,switzerland)或superiorgraphite(chicago,il)。一个具体实例是timrex®ks6(来自timcalgraphite&carbon的初级合成石墨)。当包含气相生长碳纤维或碳纳米管时,其可以以基于正极14的组合物计大于0重量%至大约5重量%的量存在。气相生长碳纤维可以是直径为大约100nm至大约200nm、长度为大约3µm至大约10µm和bet表面积为大约10m2/g至大约20m2/g的纤维形式。碳纳米管可以具有大约8nm至大约25nm的直径和大约1µm至大约20µm的长度。
正极14还可以包含以基于正极14的总重量%计大约1重量%至大约8重量%的量存在的粘合剂。在一个实例中,粘合剂以基于正极14的组合物计1重量%至大约5重量%的量存在。该粘合剂可以是任意上文列举的相同粘合剂,即聚偏二氟乙烯(pvdf)、聚四氟乙烯(ptfe)、羧甲基纤维素钠和聚合的苯乙烯丁二烯橡胶(cmc+sbr)、la133、或la132或其组合。
正极14的组合物的一个实例包含大约88.5重量%的lmo或nmc、4重量%的碳、1.5重量%的石墨、3重量%的气相生长碳纤维和3重量%的pvdf。
与正极14相邻的是正极侧集流体14a,其可以由铝形成。正极侧集流体14a的厚度可以为大约15µm至大约25µm。在一个实例中,铝可以为箔的形式。在另一实例中,正极侧集流体14a可以在至少一面上涂有碳。当包含碳涂层时,在集流体14a一面上的碳涂层厚度为大约0.1µm至大约2µm。
正极14的另外的特征包括:孔隙率为大约25%至大约35%;电导率小于2ω•cm。在正极14基于锂锰氧化物的情况下,水分含量小于300ppm。在正极14基于锂镍锰钴氧化物的情况下,水分含量小于500ppm。在正极活性材料为锂锰氧化物的情况下,正极14由此具有大约2.5g/cm3至大约2.9g/cm3的压制密度。在正极活性材料为锂镍锰钴氧化物的情况下,正极14由此具有大约2.7g/cm3至大约3.1g/cm3的压制密度。当将正极14的任意实例涂布在集流体14a的一面上时,容量载荷可以为大约0.28mah/cm2至大约0.84mah/cm2。
起电绝缘体和机械支撑作用的隔膜16夹在负极12与正极14之间以防止两个电极12、14之间的物理接触和短路的发生。隔膜16,除了在两个电极12、14之间提供物理屏障之外,还经由填充其孔隙的电解质溶液确保锂离子(在图2中标记为黑点和具有(+)电荷的空心圆圈)和相关阴离子(在图2中标记为具有(-)电荷的空心圆圈)的通过。这有助于确保锂离子电池10正常工作。
隔膜16可以是微孔聚合物隔膜。隔膜16的孔隙率为大约40%至大约60%。隔膜16的厚度为大约10µm至大约30µm。
隔膜16包括膜,或在一些实例中为膜,并且该膜可以例如由聚烯烃形成。该聚烯烃可以是均聚物(衍生自单一单体成分)或杂聚物(衍生自超过一种单体成分),并可以是直链或支链的。如果采用衍生自两种单体成分的杂聚物,则聚烯烃可以设想任意共聚物链排列,包括嵌段共聚物或无规共聚物的那些。如果聚烯烃是衍生自超过两种单体成分的杂聚物的话同样如此。作为实例,聚烯烃可以是聚乙烯(pe)、聚丙烯(pp)、pe和pp的共混物、或pe和/或pp的多层结构化多孔膜。市售聚烯烃微孔聚合物隔膜16包括可获自celgardllc的celgard®2500(单层聚丙烯隔膜)和celgard®2320(三层聚丙烯/聚乙烯/聚丙烯隔膜)。一些其它市售隔膜可获自entekinternational、asahi-kaseicorporation、torayindustries和skenergy。
在另一实例中,隔膜(或16)的膜可以由另一聚合物形成,所述聚合物选自聚对苯二甲酸乙二醇酯(pet)、聚偏二氟乙烯(pvdf)、聚酰胺(nylons)、聚氨酯、聚碳酸酯、聚酯、聚醚醚酮(peek)、聚醚砜(pes)、聚酰亚胺(pi)、聚酰胺-酰亚胺、聚醚、聚甲醛(例如缩醛)、聚对苯二甲酸丁二醇酯、聚环烷酸亚乙酯(polyethylenenaphthenate)、聚丁烯、聚烯烃共聚物、丙烯腈-丁二烯苯乙烯共聚物(abs)、聚苯乙烯共聚物、聚甲基丙烯酸甲酯(pmma)、聚氯乙烯(pvc)、聚硅氧烷聚合物(如聚二甲基硅氧烷(pdms))、聚苯并咪唑(pbi)、聚苯并噁唑(pbo)、聚亚苯基类(例如parmaxtm(mississippipolymertechnologies,inc.,baysaintlouis,mississippi))、聚芳醚酮、聚全氟环丁烷、聚四氟乙烯(ptfe)、聚偏二氟乙烯共聚物和三元共聚物、聚偏二氯乙烯、聚氟乙烯、液晶聚合物(例如vectrantm(hoechstag,germany)和zenite®(dupont,wilmington,de))、聚芳酰胺、聚苯醚和/或其组合。据信可用于隔膜16的膜的液晶聚合物的另一实例是聚(对羟基苯甲酸)。在又一实例中,该膜可以是这些聚合物之一与聚烯烃(如pe和/或pp)的组合。
在又一实例中,隔膜16的膜可以选自聚烯烃(如pe和/或pp)与一种或多种上文列举的用于隔膜16的聚合物的组合。
隔膜16可以含有单层或多层层压件,其由干法或湿法通过溶剂浇注、通过无纺纤维铺设工艺、或通过任意其它用于制造具有适于li-离子电池应用的性质的微孔聚合物膜的工艺制得。例如,聚烯烃的单层可以构成隔膜16的整体。在另一实例中,可以由此形成隔膜16的任意聚合物(例如聚烯烃和/或上文对于隔膜16所列举的其它聚合物中的一种或多种)的一种或组合的单一层可以构成隔膜16的整体。但是,作为另一实例,可以将相似或不同的聚烯烃和/或用于隔膜16的聚合物的多个离散层组装成隔膜16。在一个实例中,所述聚合物中的一种或多种的离散层可以经涂布和/或层压在用于隔膜16的聚烯烃的离散层上。此外,聚烯烃(和/或其它聚合物)层和任意其它任选的聚合物层可以以纤维层形式进一步包含在隔膜16中以帮助给隔膜16提供适当的结构特征和孔隙率特征。另外其它合适的聚合物隔膜16包括具有附着于其上的陶瓷层的那些,以及在聚合物基质中具有陶瓷填料的那些(即有机-无机复合基质)。
负极12、正极14和多孔隔膜16各自浸泡在电解质溶液中。要理解的是,可以在负极12与正极14之间传导锂离子的任意合适的电解质溶液可用于锂离子电池10。在一个实例中,电解质溶液可以是非水液体电解质溶液,其包含溶解在有机溶剂或有机溶剂混合物中的锂盐。可以溶解在有机溶剂中以形成非水液体电解质溶液的锂盐的实例包括liclo4、lialcl4、lii、libr、liscn、libf4、lib(c6h5)4、licf3so3、lin(cf3so2)2(litfsi)、lin(fso2)2(lifsi)、liasf6、lipf6、lib(c2o4)2(libob)、libf2(c2o4)(liodfb)、lipf4(c2o4)(lifop)、lino3及其混合物。这些和其它类似的锂盐可以溶解在多种有机溶剂中,如环状碳酸酯(碳酸亚乙酯(ec)、碳酸亚丙酯(pc)、碳酸亚丁酯、碳酸氟代亚乙酯)、直链碳酸酯(碳酸二甲酯(dmc)、碳酸二乙酯(dec)、碳酸甲乙酯(emc))、脂族羧酸酯(甲酸甲酯、乙酸甲酯、丙酸甲酯)、γ-内酯(γ-丁内酯、γ-戊内酯)、链结构醚(1,2-二甲氧基乙烷、1,2-二乙氧基乙烷、乙氧基甲氧基乙烷)、环状醚(四氢呋喃、2-甲基四氢呋喃)及其混合物。
电解质溶液还可以包含多种添加剂,如溶剂和/或作为溶液的次要组分的盐。添加剂的实例包括双草酸硼酸锂(bis(oxalatoborate),libob)、二氟草酸硼酸锂(lidfob)、碳酸亚乙烯酯、碳酸单氟亚乙酯、丙磺酸内酯、2-丙炔-醇-甲磺酸酯、二氟乙酸甲酯、琥珀酸酐、马来酸酐、己二腈、联苯、邻三联苯、联苄、二苯醚、n-甲基吡咯、呋喃、噻吩、3,4-亚乙基二氧基噻吩、2,5-二氢呋喃、磷酸三(六氟异丙基)酯、三羟基苯、四甲氧基钛等等。尽管在本文中已经给出了一些实例,要理解的是,可以使用其它添加剂。当包含添加剂时,其可以构成电解质溶液组合物的大约0.05%至大约5%。
在一个实例中,电解质溶液具有大于1.8ms/cm的在-30℃下测得的电导率。
本文中公开的锂离子电池10具有大约0.9至大约1.05的负极容量对正极容量的比率。锂离子电池10具有大约-30℃至大约70℃的工作温度。锂离子电池10可以为软包电池、方形电池或圆柱形电池的形式。
在制造钛酸锂负极12的方法的一个实例中,本文中公开的钛酸锂结构100的任一实例可以与(一种或多种)导电填料和(一种或多种)粘合剂混合。在制造正极14的方法的一个实例中,任意前述活性材料可以与(一种或多种)导电填料和(一种或多种)粘合剂混合。
对于电极12、14中的每一个,相应的组分可以通过干法研磨来手工混合。在将所有这些组分研磨在一起后,将研磨组分与水或有机溶剂(取决于所用的粘合剂)组合以形成分散体/混合物。在一个实例中,溶剂是极性非质子溶剂。合适的极性非质子溶剂的实例包括二甲基乙酰胺(dmac)、n-甲基-2-吡咯烷酮(nmp)、二甲基甲酰胺(dmf)、二甲基亚砜(dmso)或另一种路易斯碱、或其组合。
该分散体/混合物可以通过研磨来混合。研磨有助于将分散体/混合物转变为可涂布的浆料。低剪切研磨或高剪切研磨可用于混合分散体/混合物。分散体/混合物研磨时间为大约10分钟至大约20小时,取决于研磨剪切速率。在一个实例中,转子混合器在大约2000rpm下使用大约20分钟以研磨分散体/混合物。
随后将各自的浆料涂布或沉积到各自的集流体12a、14a上。可以使用任意合适的技术来沉积浆料。作为实例,可以将浆料浇注在集流体12a、14a的表面上,或可以铺展在集流体12a、14a的表面上,或可以使用狭缝式涂布机(slotdiecoater)涂布在集流体12a、14a的表面上。
沉积的浆料可以暴露于干燥过程以除去任何残留的溶剂和/或水。可以使用任意合适的技术来完成干燥。例如,干燥可以在大约60℃至大约130℃的升高的温度下实施。在一些实例中,也可以使用真空来加速干燥过程。作为干燥过程的一个实例,沉积的浆料可以在大约120℃下暴露于真空大约12至24小时。干燥过程导致负极12或正极14的形成。
为了进一步举例说明本公开,在本文中给出了实施例。要理解的是,为了举例说明的目的而提供这些实施例,并且不应解释为限制本公开的范围。
实施例
实施例i
在一个实施例中,采用水热法制备50毫克li4ti5o12纳米棒。更具体而言,经由两步骤水热合成和随后的离子交换及热处理过程来制备一维(1d)li4ti5o12纳米棒。首先,通过naoh与锐钛矿tio2之间的化学驱动反应制备钛酸钠(na)。通过搅拌0.5小时并且通过再超声处理0.5小时将3克的锐钛矿tio2纳米粉末与60毫升的10mnaoh溶液混合,然后转移到teflon内衬的高压釜中。在180℃下保持48小时后,将沉淀物收集并用蒸馏水冲洗,随后用0.1mhcl溶液离子交换直到达到ph7。钛酸钠在na+与h+离子之间的离子交换后变为质子化的钛酸盐。其次,将所获得的质子化钛酸盐分散在1mlioh水溶液中。然后将分散剂放入高压釜中并保持在150℃下24小时。在二次水热处理后,将产物用甲醇洗涤几遍,在80℃下真空干燥过夜,并在800℃下在空气中退火24小时。在退火后获得1dli4ti5o12纳米棒。
在室温(25℃)下,在六种酸之一或酸加强氧化剂中浸出纳米棒24小时或72小时的时间。用于各实施例的特定基质显示在下表1中。在每种情况下,使用25毫升的1m酸(仅有酸)或使用25毫升1m酸加2毫升h2o2(50重量%)(酸加氧化剂)。通过悬浮在所指示的溶液中一段所指示的时间来浸出纳米棒。不同的实施例标记为e1至e12。实施热处理以在共形层104中生成锂梯度。对于所有实施例,热处理在500℃下进行3小时。
表1
备注:*50重量%h2o2。
在酸浸后和在热处理前对实施例e1-e12实施透射电子显微镜(tem)成像以检查在表1中列举的各条件下酸浸的结果。tem结果显示大多数条件(e1、e2、e5-e8和e10-e12)导致产生具有各种壳厚度的核壳结构。但是,对于实施例e3和e4(即最强的酸,单独或加h2o2,以及最长的浸出时间),纳米棒完全溶解(即所有材料均被浸离)。相比之下,对于实施例e9(即最弱的酸,不含h2o2以及最短的浸出时间),初始纳米棒看起来保持完好,因为未观察到明显变化。其它实施例e1、e2、e5-e8和e10-e12在这两种极端情况内,并在酸浸后在纳米棒表面上形成某种类型的壳层。
对于实施例e2(强酸加强氧化剂24小时的组合),透射电子显微镜(tem)结果显示其中壳为大约7nm厚的核/壳结构。
为了确定在实施例e2(其具有最厚的壳)中li是否已经从纳米棒表面浸出,在将其热处理后对e2样品实施电子能量损失谱(eels)。对于eels测量,将热处理过的e2样品粉末撒在微栅碳支承的铜网上,将其装载到在200kv下运行的jeoljem-2100f显微镜中以获得透射电子显微镜(tem)数据。
eels装置使用在200kev下的电子并使它们通过铜网。在高能量下,透射的光束包含非弹性散射电子,其能量已经减少了与固体中的特征吸收频率相对应的量。
eels表明,在顶表面中不存在li。由于热处理,在共形层104中存在梯度,但该层太薄以至于不能获得关于锂梯度的性质的细节。图3呈现了eels结果,显示纳米棒的核区域(曲线图中的曲线50)证明了在大约62ev(电子伏特)下的li-k边缘52,指示li的存在,而纳米棒的壳区域(曲线图的曲线54)缺乏任何li-k边缘的证据,指示不存在li。
如本文中所述,用于锂离子电池10的酸浸或酸浸和热处理钛酸锂结构100衍生出许多益处。例如,不同于涂布方法,当前的酸浸(单独或与热处理组合)方法生成紧密的共形层104(含有或不含锂或具有朝向表面104a减小的锂浓度梯度)以便将li4ti5o12核102与电解质108分离。通过改变所用的酸、酸浸时间、热处理时间、热处理温度等等,共形层104的厚度可以很好地控制并且可以容易地调节。当前的合成方法简单、成本低且易于扩大规模。
要理解的是,本文中提供的范围包括所述范围和所述范围内的任意值或子范围。例如,大约0.5nm至大约100nm的范围应解释为不仅包括明确列举的大约0.5nm至大约100nm的界限,而且还包括个别的值,如75nm、90nm等等,以及子范围,如大约6.5nm至大约85nm等等。此外,当“大约“用于描述一个值时,这意味着涵盖了自所述值的微小变化(最高±10%)。
在本说明书通篇中提到“一个实例”、“另一实例”、“实例”等等指的是与该实例相关联描述的特定要素(例如特征、结构和/或特性)包括在本文中描述的至少一个实例中,并且可以存在或不存在于其它实例中。此外,要理解的是,对于任意实例描述的要素可以在各种实例中以任意合适的方式组合,除非上下文另行明确说明。
在描述和要求保护本文中公开的实例时,单数形式“一”、“一个/种”和“该”包括复数指代物,除非上下文另行明确说明。
尽管已经详细描述了若干个实例,要理解的是可以对所公开的实例进行修改。因此,前文的描述应视为是非限制性的。
- 还没有人留言评论。精彩留言会获得点赞!