一种植物乳杆菌发酵大麦提取物片剂及其制备方法与流程
本发明属于食品生物技术领域,重点是植物乳杆菌发酵大麦粉提取物的降脂活性及其片剂的制备方法。
背景技术:
由于生活节奏与饮食的变化,导致全球肥胖人口比例逐年增加,并使营养型肥胖成为侵害国民健康最主要的非传染性慢性疾病之一。因此,如何控制代谢综合征的发生就成为各国研究的热点问题。肥胖和胰岛素抵抗作为代谢综合征的主要表现,因此对于肥胖和胰岛素抵抗的预防或干预就显得极为重要。而鉴于减肥和改善胰岛素抵抗的药物普遍具有一定的毒副作用,寻找天然安全产物以防治肥胖和改善胰岛素抵抗,就具有更大的意义和市场需求。而通过天然活性因子激活棕色脂肪组织(BAT)解耦连产热以减轻肥胖的途径,具有既治标又治本、既安全又有效的优势,因此而蕴藏巨大的应用潜力。
近年来全谷物的健康功能已受到各国的广泛关注。大麦含有丰富的β-葡聚糖、功能蛋白、黄酮、多酚类化合物等多种活性成分,具有调节血糖、降血脂、降低胆固醇和改善肥胖等功能。随着科学技术的发展,生物加工(发酵)技术与传统谷物的结合显露出其前所未有的活力,已有研究发现传统谷物经发酵后其品质明显改善,功能活性显著提高,应用范围也得到了拓宽,具有显著的开发潜力。
关于大麦发酵的研究,日本专利WO2007034958公开了一种脱壳大麦的乙醇提取物、碱提取物和发酵产物的制备方法,其活性成分具有抑制血管生成的作用,但并未研究其对肥胖及预防肥胖的影响。
中国专利CN201310264094.9公开了乳酸菌发酵大麦提取物的制备方法及其抗肿瘤作用。乳酸菌发酵大麦提取物能够有效的抑制肿瘤的生长,但并未研究其对代谢综合征的作用。
中国专利CN201510073680.4公开了乳酸菌发酵大麦提取物及其制备方法与用途,通过乳酸菌发酵大麦,可以实现营养的生物转化。乳酸菌发酵大麦提取物可作为抑制肥胖及改善胰岛素抵抗的功能食品或食品原料。
文章UCP1:its involvement and utility in obesity(UCP1在肥胖中的涉及和功能),International journal of obesity,2008,32:S32-S38,指出BAT在能量平衡和脂代谢中扮演重要角色,因为其可以被活性天然产物激活而消耗脂肪。国内外有诸多研究指出活性天然物质能通过UCP1代谢通路激活BAT线粒体消耗脂肪产热,减轻试验体肥胖。由于大多天然产物的降脂活性成分不明确,所以开发一种即能调节人体脂代谢,且活性成分明确的功能产品十分必要。
技术实现要素:
本发明提供了乳酸菌发酵大麦提取物片剂的制备方法与用途,因其具有改善“三高”病症、减缓胰岛素抵抗、减少体脂肪量和促进白色脂肪棕色化的效果。乳酸菌发酵大麦提取物片剂是一款效果明确、服用方便且安全无毒的片剂,具有调节糖脂代谢紊乱的功能。
本发明是通过以下技术手段实现上述技术目的的。
(1)植物乳杆菌发酵大麦粉提取物(LFBE)的制备:发酵初始pH=5、固液比为1:7(g/mL)、每克大麦粉添加植物乳杆菌的量为7×107cfu~9×107cfu、发酵温度为31~34℃、发酵时间为24~28h。以此工艺进行发酵后,8000rpm/min离心得到的提取物为LFBE;
(2)LFBE的稳定化处理:每100mL LFBE加入1g~2gβ-环糊精,以包埋LFBE内活性成分,40℃水浴10min~15min,期间不断搅拌至发酵液澄清;
(3)β-环糊精包埋LFBE冻干粉的制备:采用冷冻干燥法对经稳定化处理的LFBE进行干燥,所得干燥提取物为β-环糊精包埋植物乳杆菌发酵大麦提取物冻干粉(BLFBE);
(4)LFBE片剂制备:向BLFBE中添加1.5%~2%的羧甲基纤维素钠与0.5%~1%的维生素C后,经超微粉碎后,加入1.0%~1.5%的硬脂酸镁,混合均匀,选用12mm模具压片,压力控制在500kg,每片重约0.45g~0.55g。
本发明得到的LFBE片剂具有激活BAT进行线粒体解耦连产热,以消耗多余能量的作用。
本发明得到的LFBE片剂具有促使白色脂肪棕色化,以消耗多余能量的作用。
本发明得到的LFBE片剂具有抑制肥胖及改善胰岛素抵抗的功能。
本发明有益效果:
(1)本发明所述的乳酸菌发酵大麦提取物片剂的制备方法,其工艺简单,成本低,适于产业化应用。
(2)本发明所述的乳酸菌发酵大麦提取物片剂具有明显的调脂降糖的益生功能,故特别适用于肥胖与高血糖患者的辅助治疗。
附图说明
图1为本发明所述三组SD大鼠十周内的体重变化图。
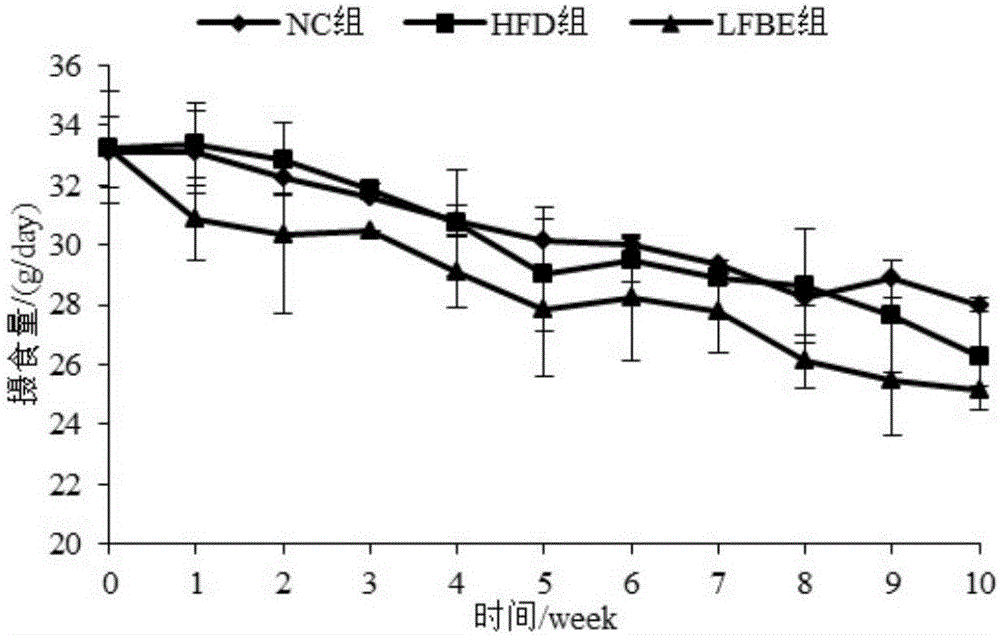
图2为本发明所述三组SD大鼠十周内的摄食量变化图。
图3为本发明所述三组SD大鼠分别在0周和10周的口服糖耐量结果图。
图4为本发明所述三组SD大鼠BAT组织脂肪切片及其细胞直径大小图。
图5为本发明所述三组SD大鼠BAT内有关脂代谢基因表达水平和UCP1蛋白表达量图。
图6为本发明所述三组SD大鼠附睾脂肪内有关脂代谢基因表达水平和UCP1蛋白表达量图。
(注:图1-6中:NC:正常组;HFD:高脂饮食组;LFBE:乳酸菌发酵大麦提取物片剂组)
具体实施方式
下面结合附图以及具体实施例对本发明做进一步的说明,但本发明的保护范围并不限于此。
1.LFBE片剂的制备
(1)选用植物乳杆菌dy-1(该菌株已经获批中国发明专利,专利号为ZL201310261606.6,发明名称为一种发酵谷物的乳酸菌及其用途),发酵扬饲麦3号大麦粉,发酵工艺为:发酵初始pH=5、固液比为1:7(g/mL)、每克大麦粉添加植物乳杆菌的量为7×107cfu~9×107cfu、发酵温度为31~34℃、发酵时间为24~28h。以此工艺进行发酵后,8000r/min离心得到的提取物为植物乳杆菌发酵大麦提取物(LFBE);
(2)LFBE的稳定化处理:每100mL LFBE加入1.5g~2gβ-环糊精,40℃水浴10-15min,期间不断搅拌至发酵液澄清;
(3)β-环糊精包埋植LFBE冻干粉的制备:采用冷冻干燥法对经β-环糊精稳定化处理的LFBE进行干燥,所得干燥提取物为β-环糊精包埋植物乳杆菌发酵大麦提取物冻干粉(BLFBE);
(4)LFBE片剂制备:向BLFBE中添加1.5%~2%的羧甲基纤维素钠与0.5%~1%的维生素C后,经超微粉碎后,加入1.0%~1.5%的硬脂酸镁,混合均匀,选用12mm模具压片,压力控制在500kg,每片重约0.45g~0.55g。
2.动物实验设计
清洁级健康SD大鼠24只,56周龄,180~200g左右,雄性,购于江苏大学实验动物中心,试验过程符合江苏省实验动物管理委员会和国家实验动物福利保护的规定,大鼠饲养于江苏大学实验动物中心动物房:室温(25±2)℃,相对湿度(55±5)%,12h/12h光照,自由获取食物和饮水。SD大鼠适应环境后,随机分为3组。第一组为正常组(Normal Control,NC),喂基础饲料,同时灌胃生理盐水;第二组为高脂饮食组(High Fat Diet,HFD),喂高脂饲料(73%基础饲料、12%猪油、10%白砂糖以及5%蛋黄粉),同时灌胃生理盐水;第三组为LFBE组,饲喂高脂饲料(73%基础饲料、12%猪油、10%白砂糖以及5%蛋黄粉),同时灌胃800mg/kg/d的LFBE。
3.试验方法
各组试验大鼠均口服BLFBE片剂10周,每天一次,记录每组大鼠周体重变化。在第1和第10周测定口服糖耐量;末次灌胃后禁食8h,次日,采用水合氯醛麻痹,腹主动脉取血,3500r/min离心10min分离血清,-20℃保存。解剖大鼠取出附睾脂肪组织(EAT)、腹部脂肪组织(AAT)和棕色脂肪组织(BAT),用生理盐水漂净、滤干后称重,保存在—80℃。
血脂水平的测定:采用全自动生化分析仪测定大鼠血清中甘油三醋(TG)、总胆固醇(Tc)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)和胰岛素含量。
口服糖耐量测试(OGTT)方法:对空腹大鼠经口灌胃葡萄糖2g/kg,分别于0、0.5、1、2h时断尾取血,采用强生one-touChBasiC血糖仪测定血糖水平。
使用CFX96TM Real-Time PCR Detection System扩增仪进行cDNA扩增。按照SYBR Premix Ex TaqTM kit(Takara Bio,大连,中国)说明应体系,反应总体积为25μl,其中含有12.5μl SYBR Premix Ex Taq(2×),2.0μl反转示反应产物,0.5μl前引物,0.5μl后引物,引物序列见表3-2。最后用无菌水补足25μl。实时PCR反应条件:95℃预变性30s,然后以95℃5s和60℃30s进行40个循环。使用β-actin作为内对照,待测基因的量通过2-ΔΔt法确定,ΔΔt=(tRNA-tβ-actin)对照组-(tRNA-tβ-actin)实验组。
表1 RT-PCR引物表
BAT中UCP1蛋白表达水平:取不同组大鼠的BAT 0.5g,在冰浴条件下剪成碎块,并加入液氮迅速研磨成粉,加入0.5mL组织裂解液,放置冰上裂解20min,用组织匀浆机进行组织匀浆,4℃12000g/min离心5min,取上清液,用BCA法测定上清液的蛋白浓度。每个样品加入5×上样缓冲液,100℃下加热5min使其变性,上样,10%SDS-PAGE(聚丙烯酞胺凝胶电泳)电泳分离,先恒压80V,再恒压100V。将胶取出,连同PVDF膜和滤纸一块放在转运液中浸润,做好标记,然后按照装置说明组装好海绵-滤纸-凝胶-PVDF膜-滤纸-海绵的“三明治”状,置于转运仪上,加入转运液,调稳流200fnA,转运2h。将PVDF膜取出后置于TBST中洗涤3次,每次10min,再置于含有5%脱脂奶粉溶液中摇晃封闭90min;膜封闭后,用TBST洗涤3次,每次10min;再加入稀释的一抗4℃孵育过夜;然后用TBST洗涤3次,每次10min;加入稀释的二抗,室温摇晃2h;最后用TBST洗涤3次,每次10min。化学发光法(ECL)曝光显色。
4.实验结果
注:各组数据以平均值±标准偏差表示,采用SPSS14.0中ANOVA模块对试验数据进行方差分析,p<0.05认为存在显著性差异。
(1)大鼠血生化分析
表2为LFBE组大鼠血清中的TG、TC、HDL、LDL和胰岛素水平。连续10周灌胃大鼠LFBE后,LFBE组大鼠的TG、TC、HDL、LDL和胰岛素水平都明显低于HFD组大鼠的水平,且接近NC组大鼠的水平,说明LFBE显著降低有关肥胖指标,具有缓解肥胖的作用。
表2大鼠血生化指标
(2)大鼠脂肪组织重量
如表3所示,LFBE组大鼠的BAT重量是三组中最大的,约比HFD组和NC组大鼠高70%。同时,LFBE组AAT和EAT重量分别约低于HFD大鼠46.46%和35.79%。
表3大鼠脂肪组织重量
BAT作为大鼠重要的产热组织,通过解偶联ATP生成而产热,质量大的BAT理论上能产生较多能量。并且,LFBE组拥有较低AAT和EAT,说明LFBE促使LFBE组大鼠BAT生长并消耗体脂,减少白色脂肪重量。
(3)大鼠体重与摄食量变化
图1为三组大鼠体重在十周内的变化趋势图,图2为三组大鼠摄食量在十周内的变化趋势图。前四周内,LFBE组与HFD组大鼠的体重没有明显差异,但自第六周之后,LFBE组大鼠体重的增长速率明显低于HFD组大鼠,说明LFBE有效的抑制HFD组大鼠体重的增加。实验期间,LFBE组大鼠的摄食量略低于HFD组大鼠的摄食量,但两组摄食量无明显差异。NC组大鼠的摄食量则一直保持在30~33g/day。
(4)大鼠口服糖耐量水平
大鼠肥胖模型建立时,三组大鼠的OGTT曲线如图3(a)所示。HFD组和LFBE组的OGTT曲线未有明显差别,且两组的空腹血糖值都较高。口服葡萄糖后两小时,两组大鼠血糖值都停留在较高值,两组糖耐量曲线下面积分别为13.81±0.12和13.34±0.57。NC组大鼠的OGTT曲线与前两组相比,空腹血糖值和口服葡萄糖后血糖值都较低,其糖耐量曲线下面积显著低于前两组。在肥胖模型建立初期,HFD组和LFBE组都拥有较高的空腹血糖值以及较高的口服葡萄糖后血糖值,说明两组大鼠都有一定程度的胰岛素抵抗,这与建立肥胖模型的目的是相一致的。
图3(b)为持续10周用800mg/Kg/D LFBE灌喂大鼠后的OGTT结果。HFD组和LFBE组的OGTT曲线出现明显差别,LFBE组的空腹血糖和口服葡萄糖后2小时血糖值都明显低于HFD组,且LFBE组糖耐量曲线下面积显著低于HFD组。与第一次OGTT结果相比,NC组和HFD组的OGTT结果未有明显差别。LFBE组OGTT结果与第一次比较,口服葡萄糖后2小时血糖值明显下降,糖耐量曲线下面积降低10%。说明LFBE干预LFBE肥胖大鼠后,有效缓解大鼠的胰岛素抵抗水平。
(5)大鼠BAT细胞直径
如图4所示,NC组、HFD组和LFBE组的BAT细胞直径分别为99.531±12.60、299.44±32.75和124.24±11.58μm。HFD组大鼠BAT细胞直径在三组中最大,其超过LFBE组141.02%。从三组BAT H&E染色切片图能看出LFBE组BAT内脂滴大小明显小于HFD组BAT的细胞直径,且与NC组BAT脂滴大小相近。以上结果说明,LFBE能显著减少LFBE组大鼠BAT内脂肪的积累。
(6)大鼠脂代谢基因表达水平
由图5所示,BAT内与脂肪代谢有关基因表达水平和其UCP1蛋白表达量。相对HFD组,LFBE组BAT的UCP1基因表达水平提高了2.225倍。同时,LFBE组BAT的PGC-1α、COX和β-3-AR基因表达水平相对HFD组也有显著提高,但其cAMP基因表达水平没有显著提高。NC组、HFD组和LFBE组BAT的UCP1蛋白条带相对浓度为0.347±0.0202、0.223±0.0133和0.483±0.036,说明LFBE显著提高BAT内UCP1的含量。UCP1基因表达水平与UPC1含量的升高,说明线粒体的解耦连反应被激活,并通过UCP1相关代谢通路,刺激大鼠消耗体内过多脂肪。
由图5所示,EAT内与脂肪代谢有关基因表达水平和其UCP1蛋白表达量。大鼠LFBE组EAT的β-3-AR、UCP1和COX基因表达水平较HFD组增加3.204、3.594和3.743倍,但其cAMP表达水平没有显著提高。NC组、HFD组和LFBE组EAT的UCP1条带相对浓度为0.4415±0.023、0.469±0.0308和0.692±0.058。LFBE组EAT的UCP1含量相对高脂组都有显著提高。LFBE组EAT的UCP1基因表达量与含量的升高,说明EAT出现棕色化,即LFBE激活AAT内线粒体进行解耦连产热,消耗大鼠体内多于能量。
综上所述,与HFD组大鼠相比,LFBE能明显降低饮食诱导型肥胖大鼠的体重及体内脂肪组织重量,改善大鼠血清中胆固醇、甘油三酯、低密度脂蛋白以及胰岛素水平,降低大鼠OGTT水平,这些效果主要是LFBE通过激活BAT内UCP1及其相关脂代谢途径消耗大鼠体内脂肪,并且诱导大鼠EAT出现棕色化而减少脂肪积累,以缓解大鼠肥胖。
所述实施例为本发明的优选的实施方式,但本发明并不限于上述实施方式,在不背离本发明的实质内容的情况下,本领域技术人员能够做出的任何显而易见的改进、替换或变型均属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种植物乳杆菌及其在发酵腌腊肉制品中的应用
- 用布氏乳杆菌、黑曲霉和植物乳杆菌组合固态发酵木薯渣的方法
- 一株植物乳杆菌及其在发酵饲料中的应用
- 一株植物乳杆菌及其在生产发酵鹅肉中的应用
- 一种植物乳杆菌发酵虾头、虾壳回收蛋白质和甲壳素的方法
- 一种可预防胃溃疡的发酵乳杆菌Lactobacillus fermentum strain Lee及其用图
- 一种可预防胃溃疡的发酵乳杆菌Lactobacillus fermentum Lee及其保健用图
- 一种可预防胃溃疡的发酵乳杆菌Lactobacillus fermentum strain suo及其用图
- 高密度固态发酵培养乳杆菌的培养基及方法
- 一种植物乳杆菌处理甜菜汁制备发酵型甜菜浸膏的方法
- 用布氏乳杆菌、黑曲霉和植物乳杆菌组合固态发酵木薯渣的方法
- 一株植物乳杆菌及其在发酵饲料中的应用
- 一株植物乳杆菌及其在生产发酵鹅肉中的应用
- 一种植物乳杆菌发酵虾头、虾壳回收蛋白质和甲壳素的方法
- 一种可预防胃溃疡的发酵乳杆菌Lactobacillus fermentum strain Lee及其用图
- 一种可预防胃溃疡的发酵乳杆菌Lactobacillus fermentum Lee及其保健用图
- 一种可预防胃溃疡的发酵乳杆菌Lactobacillus fermentum strain suo及其用图
- 高密度固态发酵培养乳杆菌的培养基及方法
- 一种植物乳杆菌处理甜菜汁制备发酵型甜菜浸膏的方法
- 一种可预防胃溃疡的发酵乳杆菌Lactobacillus fermentum suo及其保健用图