能够与配体偶联的单甲基缬氨酸化合物的制造方法与工艺
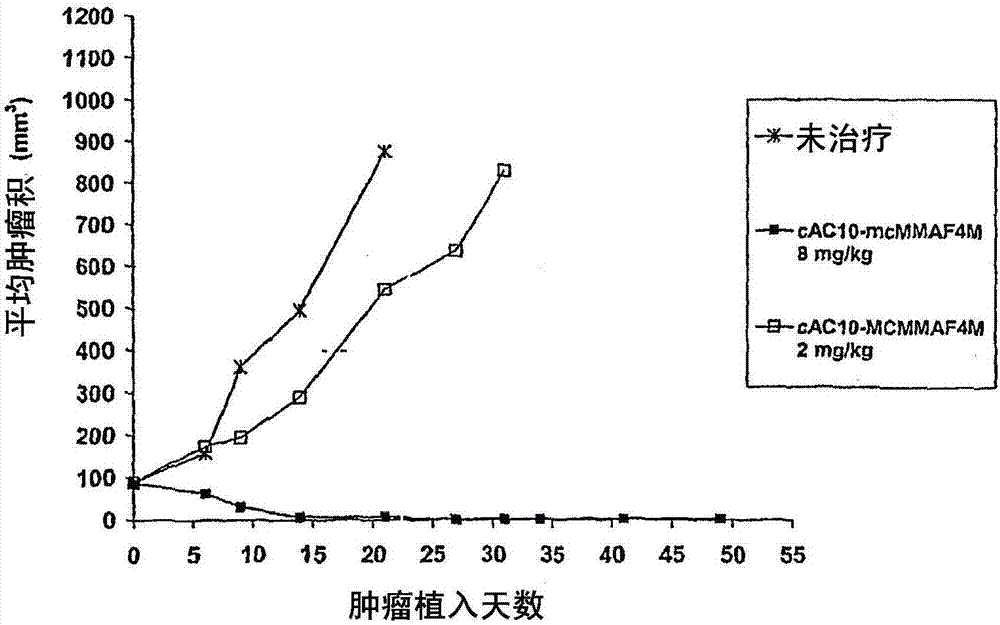
能够与配体偶联的单甲基缬氨酸化合物本申请是国际申请PCT/US2004/038392,国际申请日2004年11月5日,中国国家阶段申请号200480039706.3的发明专利申请的分案申请。连续性本申请要求2003年11月6日提交的美国临时专利申请号60/518,534;2004年3月26日提交的美国临时专利申请号60/557,116;2004年8月4日提交的美国临时专利申请号60/598,899;和2004年10月27日提交的美国临时专利申请号60/622,455的优先权;将其公开内容纳入本文作为参考。1.发明领域本发明涉及药物化合物,更具体说,涉及药物-接头-配体偶联物、药物-接头化合物和药物-配体偶联物,涉及包含它们的组合物,以及涉及用它们治疗癌症、自身免疫疾病或传染病的方法。本发明也涉及抗体-药物偶联物,涉及包括它的组合物,以及涉及用它治疗癌症、自身免疫疾病或传染病的方法。本发明也涉及在体外、原位和体内用抗体-药物偶联物诊断或治疗哺乳动物细胞,或相关疾病的方法。2.发明背景多年来,大量研究集中在提高药物或其它制剂向靶细胞、组织或肿瘤递送效率以实现最大疗效和最小毒性。虽然为开发在体内和体外将生物活性分子输入细胞的有效方法已作出许多努力,但是没有一种证明是令人完全满意的。优化药物与其胞内靶分子的结合,同时最大程度减少药物的胞内再分布(如再分布到邻近细胞中)常常是困难或无效的。目前经胃肠道外给予患者的大部分药物不是靶向的,这导致这种药物全身递送给不需要它们的机体细胞和组织,常常引起不良反应。这可导致药物的不良副作用,常常限制可给予的药物剂量(如化疗(抗癌),细胞毒,酶抑制剂和抗病毒或抗微生物药物)。比较而言,虽然口服给药被认为是方便和经济的给药模式,但一旦该药物被吸收进入全身循环系统中时,也可能对未受疾病影响的细胞产生相同的非特异性毒性问题。其它复杂情况包括口服生物利用度问题和药物在内脏中滞留问题,这使内脏与药物接触过久,从而有产生内脏毒性的风险。因此,开发(药物递送)方法的主要目标是使药物特异性靶向细胞和组织。这种治疗的益处包括避免将这种药物不合适地递送给其它细胞和组织,如未受感染的细胞而产生的全身生理效应。可通过使生物活性物质即活性代谢物在细胞内累积或保留的方法、化合物和制剂实现胞内靶向。已建立了能靶向治疗癌症患者、免疫系统疾病患者和新生血管生成疾病患者的单克隆抗体治疗方法。利用抗体-药物偶联物局部递送细胞毒性剂或细胞生长抑制剂,如癌症治疗中杀伤或抑制肿瘤细胞的药物(Syrigos和Epenetos(1999)AntiCancerResearch19:605-614;Niculescu-Duvaz和Springer(1997)Adv.Drg.Del.Rev.26:151-172;美国专利号4975278)理论上能使该药物分子靶向递送到肿瘤并在肿瘤细胞内累积,而全身给予这些非偶联药物制剂可能对正常细胞以及要清除的肿瘤细胞可能产生不可接受水平的毒性(Baldwin等,1986,Lancet(1986年3月15日):第603-05页;Thorpe,1985,“在癌症治疗中细胞毒性药物的抗体运载体:综述”(AntibodyCarriersOfCytotoxicAgentsInCancerTherapy:AReview),刊于《单克隆抗体′84:生物和临床引用》(MonoclonalAntibodies′84:BiologicalandClinicalApplications),A.Pinchera等(编),第475-506页)。因此,需要设法在最小毒性的情况下实现最大疗效。据报道,多克隆抗体和单克隆抗体可用于这些方案(Rowland等,1986,CancerImmunol.Immunother.21:183-87)。用于这些方法的药物包括道诺霉素、多柔比星、甲氨蝶呤和长春地辛(Rowland等,1986,上述)。用作抗体-毒素偶联物中的毒素包括细菌毒素如白喉毒素,植物毒素如蓖麻毒蛋白,小分子毒素如格尔德霉素(Kerr等,1997,BioconjugateChem.8(6):781-784;Mandler等(2000)Jour.oftheNat.CancerInst.92(19):1573-1581;Mandler等(2000)Bioorganic&Med.Chem.Letters10:1025-1028;Mandler等(2002)BioconjugateChem.13:786-791),类美坦西醇(EP1391213;Liu等,(1996)Proc.Natl.Acad.Sci.USA93:8618-8623)和卡奇霉素(Lode等(1998)CancerRes.58:2928;Hinman等(1993)CancerRes.53:3336-3342)。这些毒素可能通过微管蛋白结合、DNA结合或拓扑异构酶抑制等机制发挥其细胞毒性和细胞抑制效应(Meyer,D.L.和Senter,P.D.“用于癌症治疗的抗体药物偶联物的最新进展”(RecentAdvancesinAntibody-DrugConjugatesforCancerTherapy)刊于《药物化学年报》(AnnualReportsinMedicinalChemistry),第38卷(2003)第23章,229-237)。一些细胞毒药物在与大抗体或蛋白受体配体偶联时倾向于失活或活性降低。ZEVALIN(伊莫单抗(ibritumomabtiuxetan),Biogen/Idec)是一种抗体-放射性同位素偶联物,含有针对正常和恶性B淋巴细胞表面上发现的CD20抗原的鼠IgG1κ单克隆抗体和通过硫脲接头螯合剂连接的111In或90Y放射性同位素(Wiseman等(2000)Eur.Jour.Nucl.Med.27(7):766-77;Wiseman等(2002)Blood99(12):4336-42;Witzig等(2002)J.Clin.Oncol.20(10):2453-63;Witzig等(2002)J.Clin.Oncol.20(15):3262-69)。虽然ZEVALIN具有抗B-细胞非霍奇金淋巴瘤(NHL)的活性,但在大多数患者中给药导致严重的和长时间的血细胞减少症。MYLOTARGTM(吉妥单抗(gemtuzumabozogamicin),WyethPharmaceuticals)是一种抗体药物偶联物,含有连接于卡奇霉素的人CD33抗体,在2000年被批准用于注射治疗急性髓细胞白血病(DrugsoftheFuture(2000)25(7):686;美国专利号4970198;5079233;5585089;5606040;5693762;5739116;5767285;5773001)。坎妥单抗(Cantuzumabmertansine)(Immunogen,Inc.)是一种抗体药物偶联物,含有通过二硫键接头SPP连接于类美坦西醇药物部分DM1的人C242抗体,已进入临床II期试验,用于治疗表达CanAg的癌症,如结肠癌、胰腺癌、胃癌等。MLN-2704(MillenniumPharm.,BZLBiologics,ImmunogenInc.)是一种抗体药物偶联物,含有连接于类美坦西醇药物部分DM1的抗-前列腺特异性膜抗原(PSMA)的单克隆抗体,正在开发为前列腺肿瘤的可能治疗药物。通过非二硫键接头SMCC将相同的类美坦西醇药物分子DM1连接于小鼠单克隆抗体TA.1(Chari等(1992)CancerResearch52:127-131)。据报道,此偶联物的效能比相应的二硫键接头偶联物低200倍。本文中认为SMCC接头是“不可切割的”。从海洋软体动物耳状截尾海兔(Dolabellaauricularia)中分离了几种短肽化合物,发现它们有生物活性(Pettit等(1993)Tetrahedron49:9151;Nakamura等(1995)TetrahedronLetters36:5059-5062;Sone等(1995)Jour.OrgChem.60:4474)。也制备了这些化合物的类似物,发现一些有生物活性(综述参见Pettit等(1998)《抗癌药物设计》(Anti-CancerDrugDesign)13:243-277)。例如,耳抑素(auristatin)E(美国专利号5635483)是海洋天然产物海兔毒肽10的合成类似物,该物质通过结合微管蛋白上的结构域而抑制微管蛋白聚合,其结合的结构域与抗癌药长春新碱相同(G.R.Pettit,(1997)Prog.Chem.Org.Nat.Prod.70:1-79)。海兔毒肽10、耳抑素PE和耳抑素E是具有4个氨基酸和C-末端酰胺的线性肽,4个氨基酸中三个是海兔毒肽类化合物独特的。将耳抑素肽、耳抑素E(AE)和单甲基耳抑素(MMAE)、海兔毒肽的合成类似物偶联于:(i)嵌合单克隆抗体cBR96(对癌上LewisY特异);(ii)对血液恶性肿瘤上CD30特异的cAC10(Klussman等(2004),BioconjugateChemistry15(4):765-773;Doronina等(2003)NatureBiotechnology21(7):778-784;“能够偶联于配体的单甲基缬氨酸化合物”(MonomethylvalineCompoundsCapableofConjugationtoLigands”;Francisco等(2003)Blood102(4):1458-1465;美国公开专利2004/0018194;(iii)用于治疗表达CD20的癌症和免疫疾病的抗CD20抗体如利妥昔(RITUXAN)(WO04/032828);(iv)用于治疗结肠直肠癌的抗EphB2抗体2H9和抗IL-8抗体(Mao等(2004)CancerResearch64(3):781-788);(v)E-选择蛋白抗体(Bhaskar等(2003)CancerRes.63:6387-6394);和(vi)其它抗CD30抗体(WO03/043583)。偶联于单克隆抗体的耳抑素E公开于Senter等,《美国癌症研究协会论文集》(ProceedingsoftheAmericanAssociationforCancerResearch),第45卷,摘要号623,2004年3月28日。尽管有海兔毒肽类化合物及其类似物的体外研究数据,它们在获得疗效所需剂量下具有显著的全身毒性,这损害了它们在临床研究中的功效。因此,本领域明显需要毒性显著降低但仍有疗效的海兔毒肽/耳抑素衍生物。本发明解决了既往的这些和其它限制问题。受体酪氨酸激酶ErbB家族是细胞生长、分化和存活的重要调节者。该受体家族包括4个不同成员,包括表皮生长因子受体(EGFR、ErbB1、HER1),HER2(ErbB2或p185neu),HER3(ErbB3)和HER4(ErbB4或tyro2)。用人乳腺肿瘤细胞系SKBR3分析了一组抗ErbB2抗体的特征(Hudziak等,(1989)Mol.Cell.Biol.9(3):1165-1172。用称为4D5的抗体获得最大抑制,能够抑制56%细胞的增殖。该组中其它抗体在此测定中抑制细胞增殖的程度较低。还发现抗体4D5能使ErbB2-过表达乳腺肿瘤细胞系对TNF-α的细胞毒作用敏感(美国专利号5677171)。在Fendly等(1990)CancerResearch50:1550-1558;Kotts等(1990)InVitro26(3):59A;Sarup等(1991)GrowthRegulation1:72-82;Shepard等J.(1991)Clin.Immunol.11(3):117-127;Kumar等(1991)Mol.Cell.Biol.11(2):979-986;Lewis等(1993)CancerImmunol.Immunother.37:255-263;Pietras等(1994)Oncogene9:1829-1838;Vitetta等(1994)CancerResearch54:5301-5309;Sliwkowski等(1994)J.Bio.Chem.269(20):14661-14665;Scott等(1991)J.Bio.Chem.266:14300-5;D′souza等Proc.Natl.Acad.Sci.(1994)91:7202-7206;Lewis等(1996)CancerResearch56:1457-1465;和Schaefer等(1997)Oncogene15:1385-1394中进一步特征分析了Hudziak等讨论的抗-ErbB2抗体。在Tagliabue等Int.J.Cancer47:933-937(1991);McKenzie等Oncogene4:543-548(1989);Maier等CancerRes.51:5361-5369(1991);Bacus等MolecularCarcinogenesis3:350-362(1990);Stancovski等Proc.Natl.Acad.Sci.USA88:8691-8695(1991);Bacus等CancerResearch52:2580-2589(1992);Xu等Int.J.Cancer53:401-408(1993);WO94/00136;Kasprzyk等CancerResearch52:2771-2776(1992);Hancock等(1991)CancerRes.51:4575-4580;Shawver等(1994)CancerRes.54:1367-1373;Arteaga等(1994)CancerRes.54:3758-3765;Harwerth等(1992)J.Bio.Chem.267:15160-15167;美国专利号5783186;和Klapper等(1997)Oncogene14:2099-2109中描述了具有各种性能的其它抗ErbB2抗体。同源筛选导致鉴定到两种其它ErbB受体家族成员;ErbB3(美国专利号5,183,884;美国专利号5,480,968;KraU.S.等(1989)Proc.Natl.Acad.Sci.USA86:9193-9197)和ErbB4(EP599274;Plowman等(1993)Proc.Natl.Acad.Sci.USA90:1746-1750;和Plowman等(1993)Nature366:473-475)。在至少一些乳腺癌细胞系上这两种受体都显示表达增加。贺赛汀(曲妥珠单抗)是一种重组DNA获得的人源化单克隆抗体,在基于细胞的试验中,能以高亲和力(Kd=5nM)选择性结合于人表皮生长因子受体2蛋白HER2(ErbB2)的胞外结构域(美国专利号5821337;美国专利号6054297;美国专利号6407213;美国专利号6639055;CoussensL等(1985)Science230:1132-9;SlamonDJ等(1989)Science244:707-12)。曲妥珠单抗是IgG1κ抗体含有人构架区,该区含有能结合HER2的鼠抗体(4D5)的互补决定区。曲妥珠单抗能结合HER2抗原,从而抑制癌细胞生长。因为曲妥珠单抗是人源化抗体,所以它在患者中引起的HAMA应答很小。用哺乳动物细胞(中国仓鼠卵巢细胞,CHO)悬浮培养物产生了抗HER2的人源化抗体。HER2(或c-erbB2)原癌基因编码一种185kDa的跨膜受体蛋白,它与表皮生长因子受体结构相关。在25%–30%的原发性乳腺癌中发现有HER2蛋白过表达,这可通过固定肿瘤块的免疫组化评价来确定(PressMF等(1993)CancerRes53:4960-70。在体外试验和动物体中,曲妥珠单抗均显示出能够抑制过表达HER2的人肿瘤细胞增殖(HudziakRM等(1989)MolCellBiol9:1165-72;LewisGD等(1993)CancerImmunolImmunother;37:255-63;BaselgaJ等(1998)CancerRes.58:2825-2831)。曲妥珠单抗是抗体依赖性细胞毒性ADCC的调节物(HotalingTE等(1996)[摘要]。Proc.AnnualMeetingAmAssocCancerRes;37:471;PegramMD等(1997)[摘要]。ProcAmAssocCancerRes;38:602)。在体外,与不过表达HER2的癌细胞相比,已显示曲妥珠单抗可优选对HER2过表达癌细胞上介导ADCC。贺赛汀作为单一药物,用于治疗过表达HER2蛋白的转移性乳腺癌和为此接受过一种或多种化疗方案的患者。贺赛汀可与紫杉醇联用,治疗过表达HER2蛋白的转移性乳腺癌和没有为此转移性疾病接受化疗的患者。贺赛汀在曾接受过广泛抗癌治疗的过表达ErbB2的转移性乳腺癌患者有临床活性(Baselga等,(1996)J.Clin.Oncol.14:737-744)。抗HER2鼠单克隆抗体能抑制以2+和3+(每个细胞1-2×106HER2受体)水平过表达HER2的乳腺癌细胞系的生长,但对HER2表达水平较低的细胞无活性(Lewis等,(1993)CancerImmunol.Immunother.37:255-263)。根据这一观察,将抗体4D5人源化(huMAb4D5-8,rhuMAbHER2,美国专利号5821337;Carter等,(1992)Proc.Natl.Acad.Sci.USA89:4285-4289),并在过表达HER2但经常规化疗后没有进展的乳腺癌肿瘤患者中进行测试(Cobleigh等,(1999)J.Clin.Oncol.17:2639-2648)。虽然贺赛汀是治疗之前曾接受过广泛抗癌治疗的过表达ErbB2的乳腺癌患者的一个突破,但此人群中一些患者对贺赛汀治疗无反应或反应很差。因此,临床上明显需要进一步开发针对HER2的癌症治疗药物,用于对贺赛汀治疗无反应或反应差的过表达HER2的肿瘤患者或与HER2表达相关的其它疾病患者。本申请中引用的任何参考文献并非意味着承认这些参考文献对本申请来说是现有技术。3.发明概述本发明一方面提供了具有式Ia的药物-接头-配体化合物:或其药学上可接受的盐或溶剂合物其中,L-是配体单元;-Aa-Ww-Yy-是接头单元(LU),其中该接头单元包括:-A-是拉伸单元(Stretcherunit),a是0或1,-W-各自独立地是氨基酸单元,w是0-12之间的一个整数,-Y-是间隔单元,和y是0、1或2;p的范围是1~约20;和-D是具有式DE和DF的药物单元:其中,各位置相互独立:R2选自H和C1-C8烷基;R3选自H、C1-C8烷基、C3-C8碳环、芳基、C1-C8烷基-芳基、C1-C8烷基-(C3-C8碳环)、C3-C8杂环和C1-C8烷基-(C3-C8杂环);R4选自H、C1-C8烷基、C3-C8碳环、芳基、C1-C8烷基-芳基、C1-C8烷基-(C3-C8碳环)、C3-C8杂环和C1-C8烷基-(C3-C8杂环);R5选自H和甲基;或者R4和R5连接形成碳环,并具有式-(CRaRb)n-,其中Ra和Rb独立地选自H、C1-C8烷基和C3-C8碳环,n选自2、3、4、5和6;R6选自H和C1-C8烷基;R7选自H、C1-C8烷基、C3-C8碳环、芳基、C1-C8烷基-芳基、C1-C8烷基-(C3-C8碳环)、C3-C8杂环和C1-C8烷基-(C3-C8杂环);R8各自独立地选自H、OH、C1-C8烷基、C3-C8碳环和O-(C1-C8烷基);R9选自H和C1-C8烷基;R10选自芳基或C3-C8杂环;Z是O、S、NH或NR12,其中R12是C1-C8烷基;R11选自H、C1-C20烷基、芳基、C3-C8杂环、-(R13O)m-R14或-(R13O)m-CH(R15)2;m是范围在1-1000之间的一个整数;R13是C2-C8烷基;R14是H或C1-C8烷基;各个出现的R15独立地是H、COOH、-(CH2)n-N(R16)2、-(CH2)n-SO3H或-(CH2)n-SO3-C1-C8烷基;各个出现的R16独立地是H、C1-C8烷基或-(CH2)n-COOH;其中n是0-6之间的一个整数;和R18选自-C(R8)2-C(R8)2-芳基、-C(R8)2-C(R8)2-(C3-C8杂环)和-C(R8)2-C(R8)2-(C3-C8碳环)。在另一方面,提供了具有式Ib的药物化合物:或其药学上可接受的盐或溶剂合物,其中:R2选自氢和–C1-C8烷基;R3选自氢、-C1-C8烷基、-C3-C8碳环、芳基、-C1-C8烷基-芳基、-C1-C8烷基-(C3-C8碳环)、-C3-C8杂环和-C1-C8烷基-(C3-C8杂环);R4选自氢、-C1-C8烷基、-C3-C8碳环、-芳基、-C1-C8烷基-芳基、-C1-C8烷基-(C3-C8碳环)、-C3-C8杂环和-C1-C8烷基-(C3-C8杂环),其中R5选自-H和-甲基;或R4和R5连接具有式-(CRaRb)n-,其中Ra和Rb独立地选自-H、-C1-C8烷基和-C3-C8碳环,n选自2、3、4、5和6,并与它们连接的碳原子形成环;R6选自H和-C1-C8烷基;R7选自H、-C1-C8烷基、-C3-C8碳环、芳基、-C1-C8烷基-芳基、-C1-C8烷基-(C3-C8碳环)、-C3-C8杂环和-C1-C8烷基-(C3-C8杂环);R8各自独立地选自H、-OH、-C1-C8烷基、-C3-C8碳环和-O-(C1-C8烷基);R9选自H和-C1-C8烷基;R10选自芳基或-C3-C8杂环;Z是-O-、-S-、-NH-或-NR12-,其中R12是C1-C8烷基;R11选自H、C1-C20烷基、芳基、-C3-C8杂环、-(R13O)m-R14或-(R13O)m-CH(R15)2;m是范围在1-1000之间的一个整数;R13是-C2-C8烷基;R14是H或-C1-C8烷基;各个出现的R15独立地是H、-COOH、-(CH2)n-N(R16)2、-(CH2)n-SO3H或-(CH2)n-SO3-C1-C8烷基;各个出现的R16独立地是H、-C1-C8烷基或-(CH2)n-COOH;和n是0-6之间的一个整数。式(Ib)化合物可用于治疗患者的癌症,自身免疫病或传染病或可用作合成具有可切割药物单元的药物-接头、药物-接头-配体偶联物和药物-配体偶联物的中间体。在另一方面,本发明所提供的组合物包括有效量的药物-接头-配体偶联物和药学上可接受的运载体或介质。在又一方面,本发明提供的药物组合物含有有效量的药物-接头化合物和药学上可接受的运载体或介质。在又一方面,本发明提供的组合物含有有效量的含有药物-配体偶联物的可切割药物单元的药物-配体偶联物和药学上可接受的运载体或介质。在又一方面,本发明提供杀伤或抑制肿瘤细胞或癌细胞增殖的方法,该方法包括将有效量的药物-接头化合物给予需要它的患者。在另一方面,本发明提供杀伤或抑制肿瘤细胞或癌细胞增殖的方法,该方法包括将有效量的药物-接头-配体偶联物给予需要它的患者。在另一方面,本发明提供杀伤或抑制肿瘤细胞或癌细胞增殖的方法,该方法包括将有效量的含有药物-配体偶联物的可切割药物单元的药物-配体偶联物给予需要它的患者。在又一方面,本发明提供治疗癌症的方法,该方法包括将有效量的药物-接头化合物给予需要它的患者。在又一方面,本发明提供治疗癌症的方法,该方法包括将有效量的药物-接头-配体偶联物给予需要它的患者。在又一方面,本发明提供治疗癌症的方法,该方法包括将有效量的含有药物-配体偶联物的可切割药物单元的药物-配体偶联物给予需要它的患者。在又一方面,本发明提供杀伤或抑制表达自身免疫抗体的细胞复制的方法,该方法包括将有效量的药物-接头化合物给予需要它的患者。在另一方面,本发明提供杀伤或抑制表达自身免疫抗体的细胞复制的方法,该方法包括将有效量的药物-接头-配体偶联物给予需要它的患者。在另一方面,本发明提供杀伤或抑制表达自身免疫抗体的细胞复制的方法,该方法包括将有效量的含有药物-配体偶联物的可切割药物单元的药物-配体偶联物给予需要它的患者。在又一方面,本发明提供治疗自身免疫病的方法,该方法包括将有效量的药物-接头化合物给予需要它的患者。在又一方面,本发明提供治疗自身免疫病的方法,该方法包括将有效量的药物-接头-配体偶联物给予需要它的患者。在又一方面,本发明提供治疗自身免疫病的方法,该方法包括将有效量的含有药物-配体偶联物的可切割药物单元的药物-配体偶联物给予需要它的患者。在又一方面,本发明提供治疗传染病的方法,该方法包括将有效量的药物-接头化合物给予需要它的患者。在又一方面,本发明提供治疗传染病的方法,该方法包括将有效量的药物-接头-配体偶联物给予需要它的患者。在又一方面,本发明提供治疗传染病的方法,该方法包括将有效量的含有药物-配体偶联物的可切割药物单元的药物-配体偶联物给予需要它的患者。在又一方面,本发明提供预防肿瘤细胞或癌细胞增殖的方法,该方法包括将有效量的药物-接头化合物给予需要它的患者。在另一方面,本发明提供预防肿瘤细胞或癌细胞增殖的方法,该方法包括将有效量的药物-接头-配体偶联物给予需要它的患者。在另一方面,本发明提供预防肿瘤细胞或癌细胞增殖的方法,该方法包括将有效量的含有药物-配体偶联物的可切割药物单元的药物-配体偶联物给予需要它的患者。在又一方面,本发明提供预防癌症的方法,该方法包括将有效量的药物-接头化合物给予需要它的患者。在又一方面,本发明提供预防癌症的方法,该方法包括将有效量的药物-接头-配体偶联物给予需要它的患者。在又一方面,本发明提供预防癌症的方法,该方法包括将有效量的含有药物-配体偶联物的可切割药物单元的药物-配体偶联物给予需要它的患者。在又一方面,本发明提供预防表达自身免疫抗体的细胞增殖的方法,该方法包括将有效量的药物-接头化合物给予需要它的患者。在另一方面,本发明提供预防表达自身免疫抗体的细胞增殖的方法,该方法包括将有效量的药物-接头-配体偶联物给予需要它的患者。在另一方面,本发明提供预防表达自身免疫抗体的细胞增殖的方法,该方法包括将有效量的含有药物-配体偶联物的可切割药物单元的药物-配体偶联物给予需要它的患者。在又一方面,本发明提供预防自身免疫病的方法,该方法包括将有效量的药物-接头化合物给予需要它的患者。在又一方面,本发明提供预防自身免疫病的方法,该方法包括将有效量的药物-接头-配体偶联物给予需要它的患者。在又一方面,本发明提供预防自身免疫病的方法,该方法包括将有效量的含有药物-配体偶联物的可切割药物单元的药物-配体偶联物给予需要它的患者。在又一方面,本发明提供预防传染病的方法,该方法包括将有效量的药物-接头化合物给予需要它的患者。在又一方面,本发明提供预防传染病的方法,该方法包括将有效量的药物-接头-配体偶联物给予需要它的患者。在又一方面,本发明提供预防传染病的方法,该方法包括将有效量的含有药物-配体偶联物的可切割药物单元的药物-配体偶联物给予需要它的患者。在另一方面,提供的药物化合物可用作合成含有药物-配体偶联物的可切割药物单元的药物-接头化合物的中间体。在另一方面,提供的药物-接头化合物可用作合成药物-接头-配体偶联物的中间体。在另一方面,提供了具有式Ia’的化合物:或其药学上可接受的盐或溶剂合物,其中:Ab包括抗体,包括能与CD30、CD40、CD70和LewisY抗原结合的抗体,A是拉伸单元,a是0或1,W各自独立地是氨基酸单元,w是0-12之间的一个整数,Y是间隔单元,和y是0、1或2,p的范围是1~约20,和D是选自式DE和DF的药物单元:其中,各位置相互独立:R2选自H和C1-C8烷基;R3选自H、C1-C8烷基、C3-C8碳环、芳基、C1-C8烷基-芳基、C1-C8烷基-(C3-C8碳环)、C3-C8杂环和C1-C8烷基-(C3-C8杂环);R4选自H、C1-C8烷基、C3-C8碳环、芳基、C1-C8烷基-芳基、C1-C8烷基-(C3-C8碳环)、C3-C8杂环和C1-C8烷基-(C3-C8杂环);R5选自H和甲基;或者R4和R5连接形成碳环,并具有式-(CRaRb)n-,其中Ra和Rb独立地选自H、C1-C8烷基和C3-C8碳环,n选自2、3、4、5和6;R6选自H和C1-C8烷基;R7选自H、C1-C8烷基、C3-C8碳环、芳基、C1-C8烷基-芳基、C1-C8烷基-(C3-C8碳环)、C3-C8杂环和C1-C8烷基-(C3-C8杂环);R8各自独立地选自H、OH、C1-C8烷基、C3-C8碳环和O-(C1-C8烷基);R9选自H和C1-C8烷基;R10选自芳基或C3-C8杂环;Z是O、S、NH或NR12,其中R12是C1-C8烷基;R11选自H、C1-C20烷基、芳基、C3-C8杂环、-(R13O)m-R14或-(R13O)m-CH(R15)2;m是范围在1-1000之间的一个整数;R13是C2-C8烷基;R14是H或C1-C8烷基;各个出现的R15独立地是H、COOH、-(CH2)n-N(R16)2、-(CH2)n-SO3H或-(CH2)n-SO3-C1-C8烷基;各个出现的R16独立地是H、C1-C8烷基或-(CH2)n-COOH;R18选自-C(R8)2-C(R8)2-芳基、-C(R8)2-C(R8)2-(C3-C8杂环)和-C(R8)2-C(R8)2-(C3-C8碳环);和n是0-6之间的一个整数。在一个实施方式中,Ab不是能与ErbB受体结合的或受体(1)-(35)中一种或多种结合的抗体:(1)BMPR1B(骨形态发生蛋白受体-IB型,Genbank登录号NM_001203);(2)E16(LAT1,SLC7A5,Genbank登录号NM_003486);(3)STEAP1(六次跨膜的前列腺上皮抗原,Genbank登录号NM_012449);(4)0772P(CA125、MUC16,Genbank登录号AF361486);(5)MPF(MPF、MSLN、SMR、巨核细胞强化因子、间皮素(mesothelin),Genbank登录号NM_005823);(6)Napi3b(NAPI-3B、NPTIIb、SLC34A2、溶质运载体家族34(磷酸钠)、成员2、II型钠依赖性磷酸转运蛋白3b,Genbank登录号NM_006424);(7)Sema5b(FLJ10372、KIAA1445、Mm.42015、SEMA5B、SEMAG、脑信号蛋白(semaphorin)5bHlog、sema结构域、七个血小板反应蛋白重复序列(1型和1型样)、跨膜结构域(TM)和短胞质结构域、(脑信号蛋白)5B,Genbank登录号AB040878);(8)PSCAhlg(2700050C12Rik、C530008O16Rik、RIKENcDNA2700050C12、RIKENcDNA2700050C12基因,Genbank登录号AY358628);(9)ETBR(内皮缩血管肽B型受体,Genbank登录号AY275463);(10)MSG783(RNF124,假拟蛋白FLJ20315,Genbank登录号NM_017763);(11)STEAP2(HGNC_8639、IPCA-1、PCANAP1、STAMP1、STEAP2、STMP、前列腺癌相关基因1、前列腺癌相关蛋白1、六次跨膜的前列腺上皮抗原2、六次跨膜的前列腺蛋白,Genbank登录号AF455138);(12)TrpM4(BR22450、FLJ20041、TRPM4、TRPM4B、瞬时受体电势阳离子通道、亚家族M、成员4,Genbank登录号NM_017636);(13)CRIPTO(CR、CR1、CRGF、CRIPTO、TDGF1、畸胎癌衍生生长因子,Genbank登录号NP_003203或NM_003212);(14)CD21(CR2(补体受体2)或C3DR(C3d/EB病毒受体)或Hs.73792,Genbank登录号M26004);(15)CD79b(IGb(免疫球蛋白-相关β)、B29,Genbank登录号NM_000626);(16)FcRH2(IFGP4、IRTA4、SPAP1A(含有磷酸酶锚定蛋白1a的SH2结构域)、SPAP1B、SPAP1C,Genbank登录号NM_030764);(17)HER2(Genbank登录号M11730);(18)NCA(Genbank登录号M18728);(19)MDP(Genbank登录号BC017023);(20)IL20Rα(Genbank登录号AF184971);(21)短小蛋白聚糖(Genbank登录号AF229053);(22)Ephb2R(Genbank登录号NM_004442);(23)ASLG659(Genbank登录号AX092328);(24)PSCA(Genbank登录号AJ297436);(25)GEDA(Genbank登录号AY260763);(26)BAFF-R(Genbank登录号NP_443177.1);(27)CD22(Genbank登录号NP-001762.1);(28)CD79a(CD79A,CD79α,免疫球蛋白相关α,与Igβ(CD79B)发生共价作用并在表面与IgM分子形成复合物、转导参与B细胞分化信号的B细胞特异性蛋白,Genbank登录号NP_001774.1);(29)CXCR5(伯基特淋巴瘤受体1,受CXCL13趋化因子活化的G蛋白偶联受体,在淋巴细胞迁移和体液防御中起作用,在HIV-2感染中、也可能在AIDS、淋巴瘤、骨髓瘤和白血病的发展中起作用,Genbank登录号NP_001707.1);(30)HLA-DOB(能与肽结合并将肽提呈给CD4+T淋巴细胞的II型MHC分子的β亚基(Ia抗原),Genbank登录号NP_002111.1);(31)P2X5(嘌呤能受体P2X配体-门控离子通道5,由胞外ATP门控的离子通道,可能参与突触传递和神经发生,其缺陷可造成特发性逼尿肌不稳定性的生理病变,Genbank登录号NP_002552.2);(32)CD72(B细胞分化抗原CD72,Lyb-2,Genbank登录号NP_001773.1);(33)LY64(淋巴细胞抗原64(RP105),富含亮氨酸的重复序列(LRR)家族的I型膜蛋白,调节B细胞活化和凋亡,其功能缺失与系统性红斑狼疮患者的疾病活动升高相关,Genbank登录号NP_005573.1);(34)FCRH1(Fc受体样蛋白1,推测为含有C2型Ig样和ITAM结构域的免疫球蛋白Fc结构域的受体,可能在B-淋巴细胞分化中起作用,Genbank登录号NP_443170.1);或(35)IRTA2(免疫球蛋白超家族受体易位相关2,推测在B细胞发育和淋巴瘤发生中可能起作用的免疫受体;在一些B细胞恶性肿瘤中发生易位使该基因失调,Genbank登录号NP_112571.1)。在又一方面,本发明提供了药物组合物,该组合物含有有效量的药物-接头-抗体偶联物和药学上可接受的运载体或介质。在又一方面,本发明提供了组合物,该组合物含有有效量的含有药物-抗体偶联物的可切割药物单元(部分)的药物-抗体偶联物和药学上可接受的运载体或介质。在另一方面,本发明提供杀伤或抑制肿瘤细胞或癌细胞增殖的方法,该方法包括将有效量的药物-接头-抗体偶联物给予需要它的患者。在另一方面,本发明提供杀伤或抑制肿瘤细胞或癌细胞增殖的方法,该方法包括将有效量的含有药物-抗体偶联物的可切割药物单元的药物-抗体偶联物给予需要它的患者。在又一方面,本发明提供治疗癌症的方法,该方法包括将有效量的药物-接头-抗体偶联物给予需要它的患者。在又一方面,本发明提供治疗癌症的方法,该方法包括将有效量的含有药物-抗体偶联物的可切割药物单元的药物-抗体偶联物给予需要它的患者。在另一方面,本发明提供杀伤或抑制表达自身免疫抗体的细胞复制的方法,该方法包括将有效量的药物-接头-抗体偶联物给予需要它的患者。在另一方面,本发明提供杀伤或抑制表达自身免疫抗体的细胞复制的方法,该方法包括将有效量的含有药物-抗体偶联物的可切割药物单元的药物-抗体偶联物给予需要它的患者。在又一方面,本发明提供治疗自身免疫病的方法,该方法包括将有效量的药物-接头-抗体偶联物给予需要它的患者。在又一方面,本发明提供治疗自身免疫病的方法,该方法包括将有效量的含有药物-抗体偶联物的可切割药物单元的药物-抗体偶联物给予需要它的患者。在又一方面,本发明提供治疗传染病的方法,该方法包括将有效量的药物-接头-抗体偶联物给予需要它的患者。在又一方面,本发明提供治疗传染病的方法,该方法包括将有效量的含有药物-抗体偶联物的可切割药物单元的药物-抗体偶联物给予需要它的患者。在另一方面,本发明提供预防肿瘤细胞或癌细胞增殖的方法,该方法包括将有效量的药物-接头-抗体偶联物给予需要它的患者。在另一方面,本发明提供预防肿瘤细胞或癌细胞增殖的方法,该方法包括将有效量的含有药物-抗体偶联物的可切割药物单元的药物-抗体偶联物给予需要它的患者。在又一方面,本发明提供预防癌症的方法,该方法包括将有效量的药物-接头-抗体偶联物给予需要它的患者。在又一方面,本发明提供预防癌症的方法,该方法包括将有效量的含有药物-抗体偶联物的可切割药物单元的药物-抗体偶联物给予需要它的患者。在另一方面,本发明提供预防表达自身免疫抗体的细胞增殖的方法,该方法包括将有效量的药物-接头-抗体偶联物给予需要它的患者。在另一方面,本发明提供预防表达自身免疫抗体的细胞增殖的方法,该方法包括将有效量的含有药物-抗体偶联物的可切割药物单元的药物-抗体偶联物给予需要它的患者。在又一方面,本发明提供预防自身免疫病的方法,该方法包括将有效量的药物-接头-抗体偶联物给予需要它的患者。在又一方面,本发明提供预防自身免疫病的方法,该方法包括将有效量的含有药物-抗体偶联物的可切割药物单元的药物-抗体偶联物给予需要它的患者。在又一方面,本发明提供预防传染病的方法,该方法包括将有效量的药物-接头-抗体偶联物给予需要它的患者。在又一方面,本发明提供预防传染病的方法,该方法包括将有效量的含有药物-抗体偶联物的可切割药物单元的药物-抗体偶联物给予需要它的患者。在另一方面,提供的药物化合物可用作合成含有药物-抗体偶联物的可切割药物单元的药物-接头化合物的中间体。在另一方面,提供的药物-接头化合物可用作合成药物-接头-抗体偶联物的中间体。在一个方面,本发明提供具有式Ic的药物-接头-抗体偶联物(也称为抗体-药物偶联物):或其药学上可接受的盐或溶剂合物,其中:Ab是能与抗原(1)-(35)中一种或多种结合的抗体:(1)BMPR1B(骨形态发生蛋白受体-IB型,Genbank登录号NM_001203);(2)E16(LAT1,SLC7A5,Genbank登录号NM_003486);(3)STEAP1(六次跨膜的前列腺上皮抗原,Genbank登录号NM_012449);(4)0772P(CA125、MUC16,Genbank登录号AF361486);(5)MPF(MPF、MSLN、SMR、巨核细胞强化因子、间皮素,Genbank登录号NM_005823);(6)Napi3b(NAPI-3B、NPTIIb、SLC34A2、溶质运载体家族34(磷酸钠)、成员2、II型钠依赖性磷酸转运蛋白3b,Genbank登录号NM_006424);(7)Sema5b(FLJ10372、KIAA1445、Mm.42015、SEMA5B、SEMAG、脑信号蛋白5bHlog、sema结构域、七个血小板反应蛋白重复序列(1型和1型样)、跨膜结构域(TM)和短胞质结构域、(脑信号蛋白)5B,Genbank登录号AB040878);(8)PSCAhlg(2700050C12Rik、C530008O16Rik、RIKENcDNA2700050C12、RIKENcDNA2700050C12基因,Genbank登录号AY358628);(9)ETBR(内皮缩血管肽B型受体,Genbank登录号AY275463);(10)MSG783(RNF124,假拟蛋白FLJ20315,Genbank登录号NM_017763);(11)STEAP2(HGNC_8639、IPCA-1、PCANAP1、STAMP1、STEAP2、STMP、前列腺癌相关基因1、前列腺癌相关蛋白1、六次跨膜的前列腺上皮抗原2、六次跨膜的前列腺蛋白,Genbank登录号AF455138);(12)TrpM4(BR22450、FLJ20041、TRPM4、TRPM4B、瞬时受体电势阳离子通道、亚家族M、成员4,Genbank登录号NM_017636);(13)CRIPTO(CR、CR1、CRGF、CRIPTO、TDGF1、畸胎癌衍生生长因子,Genbank登录号NP_003203或NM_003212);(14)CD21(CR2(补体受体2)或C3DR(C3d/EB病毒受体)或Hs.73792,Genbank登录号M26004);(15)CD79b(IGb(免疫球蛋白-相关β)、B29,Genbank登录号NM_000626);(16)FcRH2(IFGP4、IRTA4、SPAP1A(含有磷酸酶锚定蛋白1a的SH2结构域)、SPAP1B、SPAP1C,Genbank登录号NM_030764);(17)HER2(Genbank登录号M11730);(18)NCA(Genbank登录号M18728);(19)MDP(Genbank登录号BC017023);(20)IL20Rα(Genbank登录号AF184971);(21)短小蛋白聚糖(Genbank登录号AF229053);(22)Ephb2R(Genbank登录号NM_004442);(23)ASLG659(Genbank登录号AX092328);(24)PSCA(Genbank登录号AJ297436);(25)GEDA(Genbank登录号AY260763);(26)BAFF-R(Genbank登录号NP_443177.1);(27)CD22(Genbank登录号NP-001762.1);(28)CD79a(CD79A,CD79α,免疫球蛋白相关α,与Igβ(CD79B)发生共价作用并在表面与IgM分子形成复合物、转导参与B细胞分化信号的B细胞特异性蛋白,Genbank登录号NP_001774.1);(29)CXCR5(伯基特淋巴瘤受体1,受CXCL13趋化因子活化的G蛋白偶联受体,在淋巴细胞迁移和体液防御中起作用,在HIV-2感染中、也可能在AIDS、淋巴瘤、骨髓瘤和白血病的发展中起作用,Genbank登录号NP_001707.1);(30)HLA-DOB(能与肽结合并将肽提呈给CD4+T淋巴细胞的II型MHC分子的β亚基(Ia抗原),Genbank登录号NP_002111.1);(31)P2X5(嘌呤能受体P2X配体-门控离子通道5,由胞外ATP门控的离子通道,可能参与突触传递和神经发生,其缺陷可造成特发性逼尿肌不稳定性的生理病变,Genbank登录号NP_002552.2);(32)CD72(B细胞分化抗原CD72,Lyb-2,Genbank登录号NP_001773.1);(33)LY64(淋巴细胞抗原64(RP105),富含亮氨酸的重复序列(LRR)家族的I型膜蛋白,调节B细胞活化和凋亡,其功能缺失与系统性红斑狼疮患者的疾病活动升高相关,Genbank登录号NP_005573.1);(34)FCRH1(Fc受体样蛋白1,推测为含有C2型Ig样和ITAM结构域的免疫球蛋白Fc结构域的受体,可能在B-淋巴细胞分化中起作用,Genbank登录号NP_443170.1);或(35)IRTA2(免疫球蛋白超家族受体易位相关2,推测在B细胞发育和淋巴瘤发生中可能起作用的免疫受体;在一些B细胞恶性肿瘤中发生易位使该基因失调,Genbank登录号NP_112571.1);A是拉伸单元,a是0或1,W各自独立地是氨基酸单元,w是0-12之间的一个整数,Y是间隔单元,和y是0、1或2,p的范围是1~约20,和D是选自式DE和DF的药物部分:其中,DE和DF的波浪线表示与A、W或Y的共价连接位点,各位置相互独立:R2选自H和C1-C8烷基;R3选自H、C1-C8烷基、C3-C8碳环、芳基、C1-C8烷基-芳基、C1-C8烷基-(C3-C8碳环)、C3-C8杂环和C1-C8烷基-(C3-C8杂环);R4选自H、C1-C8烷基、C3-C8碳环、芳基、C1-C8烷基-芳基、C1-C8烷基-(C3-C8碳环)、C3-C8杂环和C1-C8烷基-(C3-C8杂环);R5选自H和甲基;或者R4和R5连接形成碳环,并具有式-(CRaRb)n-,其中Ra和Rb独立地选自H、C1-C8烷基和C3-C8碳环,n选自2、3、4、5和6;R6选自H和C1-C8烷基;R7选自H、C1-C8烷基、C3-C8碳环、芳基、C1-C8烷基-芳基、C1-C8烷基-(C3-C8碳环)、C3-C8杂环和C1-C8烷基-(C3-C8杂环);R8各自独立地选自H、OH、C1-C8烷基、C3-C8碳环和O-(C1-C8烷基);R9选自H和C1-C8烷基;R10选自芳基或C3-C8杂环;Z是O、S、NH或NR12,其中R12是C1-C8烷基;R11选自H、C1-C20烷基、芳基、C3-C8杂环、-(R13O)m-R14或-(R13O)m-CH(R15)2;m是范围在1-1000之间的一个整数;R13是C2-C8烷基;R14是H或C1-C8烷基;各个出现的R15独立地是H、COOH、-(CH2)n-N(R16)2、-(CH2)n-SO3H或-(CH2)n-SO3-C1-C8烷基;各个出现的R16独立地是H、C1-C8烷基或-(CH2)n-COOH;R18选自-C(R8)2-C(R8)2-芳基、-C(R8)2-C(R8)2-(C3-C8杂环)和-C(R8)2-C(R8)2-(C3-C8碳环);和n是0-6之间的一个整数。在另一方面,本发明抗体-药物偶联物(ADC)中的抗体能与ErbB2基因编码的受体特异性结合。在另一方面,该抗体-药物偶联物中的抗体是人源化抗体,选自huMAb4D5-1、huMAb4D5-2、huMAb4D5-3、huMAb4D5-4、huMAb4D5-5、huMAb4D5-6、huMAb4D5-7和huMAb4D5-8(曲妥珠单抗)。在另一方面,本发明包括含有本发明抗体-药物偶联物的制品;容器;说明该化合物可用于治疗特征是过表达ErbB2受体的癌症的药品说明书或标签。在另一方面,本发明包括在哺乳动物中治疗癌症的方法,所述癌症的特征是过表达ErbB2受体,并对抗ErbB2抗体治疗无反应或反应差,该方法包括将治疗有效量的本发明抗体-药物偶联物给予该哺乳动物。在另一方面,直到该抗体-药物偶联物进入具有该抗体-药物偶联物中抗体的特异性细胞表面受体的细胞,才将基本上所有药物部分与该抗体切开;当该抗体-药物偶联物进入细胞时将药物部分与抗体切开。在另一方面,当与含有该抗体-药物偶联物中药物部分的药物化合物相比,或当与不含药物部分的该化合物类似物相比,该抗体-药物偶联物或该化合物在哺乳动物中的胞内代谢物的生物利用度得到改善。在另一方面,在哺乳动物的细胞内该化合物或其胞内代谢物中的所述药物部分与抗体被切开。在另一方面,本发明包括一种药物组合物,该组合物含有有效量的本发明抗体-药物偶联物或其药学上可接受的盐,和药学上可接受的稀释剂、运载体或赋形剂。该组合物还可包含治疗有效量的化疗药如微管蛋白形成抑制剂、拓扑异构酶抑制剂和DNA结合剂。在另一方面,本发明包括杀伤或抑制肿瘤细胞或癌细胞增殖的方法,该方法包括用一定量的本发明抗体-药物偶联物或其药学上可接受的盐或溶剂合物处理肿瘤细胞或癌细胞,有效杀伤或抑制肿瘤细胞或癌细胞的增殖。在另一方面,本发明包括抑制细胞增殖的方法,该方法包括使细胞培养基中的哺乳动物细胞接触本发明的抗体-药物偶联物化合物,所述抗体-药物偶联物化合物进入细胞内,将药物与抗体-药物偶联物化合物的其余部分切开;从而抑制细胞增殖。。在另一方面,本发明包括治疗癌症的方法,该方法包括将本发明的抗体-药物偶联物和药学上可接受的稀释剂、运载体或赋形剂的制剂给予患者。在另一方面,本发明包括检测癌细胞的试验,该试验包括:(a)使细胞接触本发明的抗体-药物偶联物;和(b)测定所述抗体-药物偶联物与细胞的结合程度。通过结合本文所附图形、图片和方案参考以下示范性实施方式的详述,将最好地理解本发明。以下讨论是描述性、说明性和示范性的,不应认为是限制所附权利要求所限定的范围。附图简要说明图1显示cAC10-mcMMAF对皮下Karpas-299ALCL异种移植瘤的单剂量体内药效试验。图2显示cAC10-mcMMAF对皮下L540cy的单剂量体内药效试验。此研究中,未治疗组有4只小鼠,治疗组各有10只。图3a和3b显示cBR96-mcMMAF对皮下L2987的体内药效。图3a中的实心三角和图3b中的箭头指示治疗天数。图4a和4b显示cAC10-抗体-药物偶联物对CD30+细胞系的体外活性。图5a和5b显示cBR96-抗体-药物偶联物对Ley+细胞系的体外活性。图6a和6b显示c1F6-抗体-药物偶联物对CD70+肾细胞癌细胞系的体外活性。图7显示用抗体-药物偶联物(ADC)处理SK-BR-3细胞的体外细胞增殖试验:-●-曲妥珠单抗-MC-vc-PAB-MMAF,3.8MMAF/抗体,-○-曲妥珠单抗-MC-MMAF,4.1MMAF/抗体,-△-曲妥珠单抗-MC-MMAF,4.8MMAF/抗体,以相对荧光单位(RLU)与μg/mlADC浓度表示。H=曲妥珠单抗,H通过半胱氨酸[cys]连接。图8显示用ADC处理BT-474的体外细胞增殖试验:-●-曲妥珠单抗-MC-vc-PAB-MMAF,3.8MMAF/抗体,-○-曲妥珠单抗-MC-MMAF,4.1MMAF/抗体,-△-曲妥珠单抗-MC-MMAF,4.8MMAF/Ab。图9显示用ADC处理MCF-7细胞的体外细胞增殖试验:-●-曲妥珠单抗-MC-vc-PAB-MMAF,3.8MMAF/抗体,-○-曲妥珠单抗-MC-(N-Me)vc-PAB-MMAF,3.9MMAF/抗体,-△-曲妥珠单抗-MC-MMAF,4.1MMAF/Ab。图10显示用ADC处理MDA-MB-468细胞的体外细胞增殖试验:-●-曲妥珠单抗-MC-vc-PAB-MMAE,4.1MMAE/抗体,-○-曲妥珠单抗-MC-vc-PAB-MMAE,3.3MMAE/抗体,-△-曲妥珠单抗-MC-vc-PAB-MMAF,3.7MMAF/Ab。图11显示将H-MC-vc-PAB-MMAF-TEG和H-MC-vc-PAB-MMAF给予Sprague-Dawley大鼠后的血浆浓度清除率研究:给药剂量为每千克大鼠体重2mgADC。测定随时间推移的总抗体浓度和ADC浓度。(H=曲妥珠单抗)。图12显示将0.5、1.5、2.5和3.0mg/kg剂量的H-MC-vc-MMAE给予食蟹猴后第1天和第21天血浆浓度清除率研究。测定随时间推移的总抗体浓度和ADC浓度。(H=曲妥珠单抗)。图13显示对移植了MMTV-HER2Fo5乳腺肿瘤同种异体移植物的无胸腺裸小鼠,第0天给予运载体、曲妥珠单抗-MC-vc-PAB-MMAE(1250μg/m2)和曲妥珠单抗-MC-vc-PAB-MMAF(555μg/m2)后,平均肿瘤体积随时间的改变。(H=曲妥珠单抗)。图14显示对移植了MMTV-HER2Fo5乳腺肿瘤同种异体移植物的无胸腺裸小鼠,第0天给予10mg/kg(660μg/m2)曲妥珠单抗-MC-MMAE和1250μg/m2曲妥珠单抗-MC-vc-PAB-MMAE后,平均肿瘤体积随时间的改变。图15显示对移植了MMTV-HER2Fo5乳腺肿瘤同种异体移植物的无胸腺裸小鼠,第0天给予运载体和650μg/m2曲妥珠单抗-MC-MMAF后,平均肿瘤体积随时间的改变。图16显示对移植了MMTV-HER2Fo5乳腺肿瘤同种异体移植物的无胸腺裸小鼠,第0天给予运载体和350μg/m2的MMAF/曲妥珠单抗(H)之比为2、4、5.9和6的四种曲妥珠单抗-MC-MMAF偶联物后,平均肿瘤体积随时间的改变。图17显示给予运载体、曲妥珠单抗-MC-val-cit-MMAF、曲妥珠单抗-MC(Me)-val-cit-PAB-MMAF、曲妥珠单抗-MC-MMAF和曲妥珠单抗-MC-val-cit-PAB-MMAF后,动物(大鼠)体重(平均值±标准差)的组平均值改变(加误差线)。图18显示给予9.94mg/kgH-MC-vc-MMAF、24.90mg/kgH-MC-vc-MMAF、10.69mg/kgH-MC(Me)-vc-PAB-MMAF、26.78mg/kgH-MC(Me)-vc-PAB-MMAF、10.17mg/kgH-MC-MMAF、25.50mg/kgH-MC-MMAF和21.85mg/kgH-MC-vc-PAB-MMAF后,动物(大鼠)体重(平均值±标准差)的组平均值改变(加误差线)。H=曲妥珠单抗。各偶联物中MC接头通过曲妥珠单抗的半胱氨酸相连接。图19显示以2105、3158和4210μg/m2的剂量给予曲妥珠单抗(H)-MC-MMAF后,SpragueDawley大鼠体重(平均值±标准差)的组平均值改变(加误差线)。各偶联物中MC接头通过曲妥珠单抗的半胱氨酸相连接。4.示范性实施方式详述4.1定义和缩写除非另有说明,本文所用以下术语和短语的涵义如下:当本文中使用商品名时,申请人旨在各自包括该商品名产品的制剂、该商品名产品的非专利药和活性药物成分。本文所用术语“抗体”在最广义上,和具体含义上包括完整的单克隆抗体、多克隆抗体、由至少两种完整抗体形成的多特异性抗体(如双特异性抗体)和抗体片段,只要它们具有所需生物学活性。抗体是免疫系统产生的能够识别和结合特定抗原的蛋白。就其结构而言,抗体一般是由四条氨基酸链(两条重链两条轻链)组成的Y形蛋白。各抗体主要具有两个区域:可变区和恒定区。可变区位于Y臂的两末端,能与靶抗原结合和相互作用。可变区包括能识别和结合具体抗原特异性结合位点的互补决定区(CDR)。恒定区位于Y的尾部,可为免疫系统识别并相互作用(Janeway,C.,Travers,P.,Walport,M.,Shlomchik(2001)ImmunoBiology,第5版,GarlandPublishing,NewYork)。靶抗原通常具有数个结合位点,也称为表位,可被多种抗体的CDR识别。与不同表位特异性结合的各抗体具有不同结构。因此,一种抗原可能具有一种以上的对应抗体。本文所用术语“抗体”也指全长免疫球蛋白分子或全长免疫球蛋白分子的免疫活性部分,即含有与感兴趣靶抗原或其一部分免疫特异性结合的抗原结合位点的分子,这些靶包括但不限于,癌细胞或产生与自身免疫病相关的自身免疫性抗体的细胞。本文所述的免疫球蛋白可以是任何类型的免疫球蛋白分子(如IgG、IgE、IgM、IgD和IgA)、或其亚型(如IgG1、IgG2、IgG3、IgG4、IgA1和IgA2)。免疫球蛋白可获自任何动物。然而,在一个方面,所述免疫球蛋白是人、鼠或兔源的。在另一方面,所述抗体是多克隆、单克隆、双特异性、人、人源化或嵌合抗体、单链抗体、Fv、Fab片段、F(ab’)片段、F(ab’)2片段、Fab表达文库产生的片段、抗独特型(抗Id)抗体、CDR和上述与癌细胞抗原、病毒抗原或微生物抗原免疫特异性结合的抗体的表位结合片段。本文所用术语“单克隆抗体”指获自基本均一抗体群的抗体,即,群体中所含的单个抗体相同,除了可能存在的少量天然突变产生的外。单克隆抗体具有高度特异性,只针对一个抗原位点。而与包含针对不同决定簇(表位)的不同抗体的多克隆抗体制剂相反,各单克隆抗体只针对抗原上的一个决定簇。除它们的特异性之外,单克隆抗体的优点在于它们的合成可不污染其它抗体。修饰词“单克隆”指该抗体的特征是获自基本均一的抗体群,且不应认为需要用任何特定方法来产生该抗体。例如,可用如Kohler等(1975)Nature256:495首先描述的杂交瘤方法制备用于本发明的单克隆抗体,或可用重组DNA方法制备(参见美国专利号4816567)。也可用Clackson等(1991)Nature,352:624-628和Marks等(1991)J.Mol.Biol.,222:581-597所述技术从噬菌体抗体文库中分离“单克隆抗体”。本文中单克隆抗体特别包括“嵌合”抗体,其重链和/或轻链的一部分与衍生自某特定动物的相应序列相同或同源或属于某特定抗体类型或亚型,而二链其余部分与衍生自另一种动物的相应序列相同或同源或者属于另一抗体类型或亚型的抗体以及其片段,只要它们具有所需生物学活性(美国专利mp/4816567;和Morrison等(1984)Proc.Natl.Acad.Sci.USA,81:6851-6855)。已采用了各种方法来产生单克隆抗体(MAb)。杂交瘤技术指产生单一类型抗体的克隆细胞系,该技术采用各种动物的细胞,包括小鼠(鼠)、仓鼠、大鼠和人。制备MAb的另一方法是采用遗传工程技术,包括重组DNA技术。由这些技术制备的单克隆抗体包括嵌合抗体和人源化抗体等。嵌合抗体中组合了一种以上动物的DNA编码区。例如,嵌合抗体可从小鼠获得可变区,从人获得恒定区。人源化抗体主要部分来自人,尽管它含有非人部分。就像嵌合抗体一样,人源化抗体可包含完整的人恒定区。但不像嵌合抗体,其可变区可部分来源于人。人源化抗体的非人合成部分常常来自鼠抗体中的CDR。在任何情况下,这些(CDR)区域对于抗体识别和结合特异性抗原都是关键的。如上所述,可使用鼠抗体。虽然可用于诊断和短期治疗。但不可能将鼠抗体长期给予人而不增加发生有害免疫原应答的风险。这种称为人抗鼠抗体(HAMA)的应答反应,在人免疫系统将鼠抗体识别为外来者并进行攻击时发生。HAMA反应可引起中毒性休克,甚至死亡。嵌合和人源化抗体通过最大程度减少所给予抗体的非人部分而降低发生HAMA反应的可能性。而且,嵌合和人源化抗体具有激活继发性人免疫应答反应,如抗体依赖性细胞毒性的额外好处。“抗体片段”含有完整抗体的一部分,优选含有完整抗体的抗原结合区或可变区。抗体片段的例子包括Fab、Fab’、F(ab’)2和Fv片段;双抗体(diabody);线性抗体;单链抗体分子;和由抗体片段形成的多特异性抗体。“完整”的抗体是含有抗原结合可变区以及轻链恒定区(CL)和重链恒定区CH1、CH2和CH3的抗体。恒定区可以是天然序列的恒定区(如人天然序列的恒定区)或其氨基酸序列变体。完整抗体可具有一个或多个“效应器功能”,效应器功能指归因于抗体Fc区(天然序列的Fc区或氨基酸序列变体的Fc区)的生物学活性。抗体效应器功能的例子包括C1q结合;补体依赖性细胞毒性;Fc受体结合;抗体依赖性细胞介导的细胞毒性(ADCC);吞噬作用;细胞表面受体(如B细胞受体;BCR)的下调等。根据它们重链的恒定区的氨基酸序列,完整抗体可分为不同“型”。完整抗体主要有五种型:IgA、IgD、IgE、IgG和IgM,其中几型可再分为“亚型”(同种型),如IgG1、IgG2、IgG3、IgG4、IgA和IgA2。对应于不同抗体型的重链恒定区分别称为α、δ、ε、γ和μ。不同型的免疫球蛋白的亚基结构和三维构型是熟知的。在本文中,表述“ErbB2”和“HER2”可互换使用,指人HER2蛋白,如Semba等,Proc.Natl.Acad.Sci.USA,82:6497-6501(1985)和Yamamoto等,(1986)Nature,319:230-234(Genebank登录号X03363)中所述。术语“erbB2”指编码人ErbB2的基因,“neu”指编码ratp185neu的基因。ErbB2优选是天然序列的人ErbB2。可从许多公司购得ErbB受体的抗体,包括例如SantaCruzBiotechnology,Inc.,California,USA。“ErbB配体”指结合和/或激活ErbB受体的多肽。ErbB配体可以是天然序列的人ErbB配体,如表皮生长因子(EGF)(Savage等(1972)J.Biol.Chem.,247:7612-7621);转化生长因子α(TGF-α)(Marquardt等(1984)Science223:1079-1082);双调蛋白也称为施万细胞瘤或角质形成细胞自分泌生长因子(Shoyab等(1989)Science243:1074-1076;Kimura等,Nature,348:257-260(1990);和Cook等,Mol.Cell.Biol.,11:2547-2557(1991));β动物纤维素(Shing等,Science,259:1604-1607(1993);和Sasada等,Biochem.Biophys.Res.Commun.,190:1173(1993));肝素结合性表皮生长因子(HB-EGF)(Higashiyama等,Science,251:936-939(1991));表皮调节蛋白(epiregulin)(Toyoda等,J.Biol.Chem.,270:7495-7500(1995);和Komurasaki等,Oncogene,15:2841-2848(1997));调蛋白(见下);神经调节蛋白-2(NRG-2)(Carraway等,Nature,387:512-516(1997));神经调节蛋白-3(NRG-3)(Zhang等,Proc.Natl.Acad.Sci.,94:9562-9567(1997));神经调节蛋白-4(NRG-4)(Harari等,Oncogene,18:2681-89(1999))或cripto(CR-1)(Kannan等,J.Biol.Chem.,272(6):3330-3335(1997))。结合EGFR的ErbB配体包括EGF、TGF-α、双调蛋白、β动物纤维素、HB-EGF和表皮调节蛋白。结合ErbB3的ErbB配体包括调蛋白。能够结合ErbB4的ErbB配体包括β动物纤维素、表皮调节蛋白、HB-EGF、NRG-2、NRG-3、NRG-4和调蛋白。ErbB配体也可以是合成的ErbB配体。合成配体可以对特定ErbB受体具有特异性,或可以识别特定的ErbB受体复合物。合成配体的一个例子是合成的调蛋白/EGF嵌合双调蛋白(biregulin)(参见例如,Jones等,(1999)FEBSLetters,447:227-231,纳入作为参考)。“调蛋白”(HRG)指由调蛋白基因产物编码的多肽,如美国专利号5641869或Marchionni等,Nature,362:312-318(1993)所述。调蛋白的例子包括调蛋白-α、调蛋白-β1、调蛋白-β2和调蛋白-β3(Holmes等,Science,256:1205-1210(1992);和美国专利号5641869);神经分化因子(NDF)(Peles等,Cell69:205-216(1992));乙酰胆碱能受体-诱导的活性(ARIA)(Falls等(1993)Cell72:801-815);神经胶质生长因子(GGFs)(Marchionni等,Nature,362:312-318(1993));感觉和运动神经元衍生因子(SMDF)(Ho等,J.Biol.Chem.,270:14523-14532(1995));γ-调蛋白(Schaefer等,Oncogene,15:1385-1394(1997))。该术语包括天然序列HRG多肽的生物活性片段和/或氨基酸序列变体,如其EGF样结构域片段(如HRGβ1177-244)。“ErbB异质寡聚物”是含有至少两种不同ErbB受体的非共价结合的寡聚物。“ErbB二聚体”是含有两种不同ErbB受体的非共价结合的寡聚物。当表达两种或多种ErbB受体的细胞接触ErbB配体时可形成这种复合物。ErbB寡聚物,如ErbB二聚物可用免疫沉淀分离并用SDS-PAGE分析,如Sliwkowski等,J.Biol.Chem.,269(20):14661-14665(1994)所述。这种ErbB异质寡聚物的例子包括EGFR-ErbB2(也称为HER1/HER2)、ErbB2-ErbB3(HER2/HER3)和ErbB3-ErbB4(HER3/HER4)复合物。而且,ErbB异质寡聚物可含有两种或多种与不同ErbB受体如ErbB3、ErbB4或EGFR(ErbB1)组合的ErbB2受体。该异质寡聚物可包括其它蛋白如细胞因子受体亚基(如gp130)。“天然序列”多肽是具有的氨基酸序列与天然多肽如肿瘤相关抗原受体相同的多肽。这种天然序列多肽可分离自天然产生的或可重组或合成方法产生的。因此,天然序列多肽可具有天然存在的人多肽、鼠多肽或其它哺乳动物物种的多肽的氨基酸序列。术语“氨基酸序列变体”指氨基酸序列在某种程度上与天然序列多肽不同的多肽。通常,氨基酸序列变体与天然配体的至少一个受体结合域,或与天然受体如肿瘤相关抗原的至少一个配体结合域的同源性至少约70%,它们与所述受体或配体结合域的同源性优选至少约80%,更优选至少约90%。氨基酸序列变体在天然氨基酸序列的某些位置上具有取代、缺失和/或插入。“序列相同性”的定义是两条序列比对和按需引入空隙以获得最大序列相同性百分数后,氨基酸序列变体中相同的残基百分数。用于比对的方法和计算机程序是本领域熟知的。这种计算机程序之一是“比对2”,出版者是Genentech,Inc.,1991年12月10日将其用户文件说明提交给美国著作权局,Washington,DC20559。“抗体依赖性细胞介导的细胞毒”和“ADCC”指细胞介导的反应,其中表达Fc受体(FcRs)(如自然杀伤(NK)细胞、嗜中性粒细胞和巨噬细胞)的非特异性细胞毒细胞识别靶细胞上结合的抗体,然后引起靶细胞裂解。介导ADCC的主要细胞即NK细胞仅表达FcγRIII,而单核细胞表达FcγRI、FcγRII和FcγRIII。在Ravetch和Kinet,(1991)Annu.Rev.Immunol,9:457-92第464页的表3中小结了造血细胞上的FcR表达。为评价感兴趣分子的ADCC活性,可进行体外ADCC试验,如美国专利号5500362或5821337所述。用于这些试验的效应细胞包括外周血单核细胞(PBMC)和自然杀伤(NK)细胞。或者,或此外,可在体内,如动物模型中评价感兴趣分子的ADCC活性,如Clynes等,Prco.Natl.Acad.Sci.USA,95:652-656(1998)所述。术语“Fc受体”或“FcR”用于描述与抗体的Fc区结合的受体。优选的FcR是天然序列的人FcR。而且,优选的FcR是结合IgG抗体的FcR(γ受体),包括受体FcγRI、FcγRII和FcγRIII亚型,包括这些受体的等位基因变体和交替剪接形式。FcγRII受体包括FcγRIIA(“激活性受体”)和FcγRIIB(“抑制性受体”),它们具有相似的氨基酸序列,主要是其胞质结构域不同。激活性受体FcγRIIA的胞质结构域含有基于免疫受体酪氨酸的活化基序(ITAM)。抑制性受体FcγRIIB的胞质结构域含有基于免疫受体酪氨酸的抑制基序(ITIM)。(参见综述M.inAnnu.Rev.Immunol.,15:203-234(1997))。Ravetch和Kinet,Annu.Rev.Immunol.,9:457-92(1991);Capel等,Immunomethods,4:25-34(1994);和deHaas等,J.Lab.Clin.Med.,126:330-41(1995)对FcR进行了综述。本文中的术语“FcR”包括其它FcR,包括将来鉴定的FcR。该术语也包括新生儿受体FcRn,它负责将母亲的IgG转运给胎儿。(Guyer等,J.Immunol.,117:587(1976)和Kim等,J.Immunol.,24:249(1994))。“补体依赖性细胞毒”或“CDC”指某分子在补体的存在下裂解靶细胞的能力。当补体系统的第一组分(C1q)与相关抗原形成复合物的某分子(如抗体)结合时能启动补体激活途径。为评价补体激活,可进行CDC试验,如Gazzano-Santoro等,J.Immunol.Methods,202:163(1996)所述。术语“可变”指抗体可变区某些部分的序列大不相同的情况,这些序列是各特定抗体用于对其特定抗原相结合和特异性的序列。然而,在抗体的整个可变区中,可变性不是均匀分布的。在轻链和重链可变区中,可变性集中在三个称为超变区的节段中。可变区中保守程度较高的部分称为构架区(FR)。天然重链和轻链的可变区各自包含四个FR,大部分采用β-片层构型,由形成环状连接的和在一些情况下形成β-片层结构部分的三个超变区连接。各链的超变区与另一条链的超变区通过FR紧密地靠在一起形成了抗体的抗原结合位点(参见Kabat等(1991),《免疫学感兴趣蛋白的序列》(SequencesofProteinsofImmunologicalInterest),第5版,PublicHealthService,国立卫生研究院(NationalInstitutesofHealth),Bethesda,MD)。恒定区不直接参与抗体与抗原的结合,但具有各种效应器功能,如参与抗体的抗体依赖性细胞毒(ADCC)。本文所用术语“超变区”指抗体中负责抗原结合的氨基酸残基。超变区通常包括“互补性决定区”或“CDR”的氨基酸残基(如轻链可变区中的残基24-34(L1)、50-56(L2)和89-97(L3)和重链可变区中的31-35(H1)、50-65(H2)和95-102(H3);Kabat等,同上)和/或“超变环”的残基(如轻链可变区中的残基26-32(L1)、50-52(L2)和91-96(L3)和重链可变区中的26-32(H1),53-55(H2)和96-101(H3);Chothia和Lesk(1987)J.Mol.Biol.,196:901-917)。“构架区”或“FR”残基是除了本文所定义的超变区残基之外的可变区残基。木瓜酶消化抗体产生两个相同的抗原结合片段,称为“Fab”片段,各片段具有一个抗原结合位点,和一个残留的“Fc”片段,其名称反映出它易结晶的能力。胃蛋白酶处理产生具有两个抗原结合位点的F(ab’)2片段,仍能够交联抗原。“Fv”是含有完整抗原识别和抗原结合位点的最小抗体片段。该区域由一条重链和一条轻链的可变区通过紧密的非共价连接组成二聚体。在此构型中,各可变区的三个超变区互相作用确定了VH-VL二聚体表面上的抗原结合位点。总之,是这六个超变区赋予了抗体的抗原结合特异性。然而,即使一个可变区(或仅含有抗原特异性三个超变区的Fv的一半)就能够识别和结合抗原,但是亲和力低于完整的结合位点。Fab片段也含有轻链的恒定区和重链的第一恒定区(CH1)。Fab’片段与Fab片段的不同之处是重链CH1结构域的羧基末端加入了几个残基,包括抗体绞链区的一个或多个半胱氨酸。本文中Fab’-SH指Fab’恒定区的半胱氨酸残基带有至少一个游离的巯基。最初产生的F(ab’)2抗体片段是一对Fab’片段,二片段之间含有绞链区半胱氨酸。抗体片段的其它化学偶联方式也是已知的。根据恒定区的氨基酸序列可将脊椎动物的抗体“轻链”分为两种有明显区别的类型,称为κ和λ。“单链Fv”或“scFv”抗体片段含有抗体的VH和VL结构域,这些结构域存在于一条多肽链中。Fv多肽优选在VH和VL结构域之间还含有多肽接头,使scFv形成用于结合抗原所需的结构。scFv的综述参见Plückthun,《单克隆抗体的药理学》(ThePharmacologyofmonoclonalAntibodies),第113卷,Rosenburg和Moore编,Springer-Verlag,NewYork,第269-315页(1994)。术语“双抗体”指具有两个抗原结合位点的小抗体片段,该片段在同一多肽链中含有连接的轻链可变区(VL)和重链可变区(VH)(VH-VL)。用一个短接头使同一链上的两个结构域之间不能配对,而迫使这两个结构域与另一条链的互补结构域配对,从而产生两个抗原结合位点。在例如EP404,097、WO93/11161和Hollinger等(1993)Proc.Natl.Acad.Sci.USA90:6444-6448中更全面地描述了双抗体。非人(如啮齿类)抗体的“人源化”形式是含有衍生自非人免疫球蛋白最小序列的嵌合抗体。人源化抗体大部分是人免疫球蛋白(受体抗体),但受体抗体超变区的残基被具有所需特异性、亲和力和容量的非人动物(供体抗体)如小鼠、大鼠、兔或非人灵长类的超变区的残基所取代。在一些情况下,用相应非人残基取代人免疫球蛋白的构架区(FR)残基。而且,人源化抗体可包含在受体抗体或供体抗体中没有发现的残基。进行这些修饰以进一步精制抗体的性能。通常,人源化抗体基本上含有所有可变区的至少一个,一般是两个,可变区中所有或基本上所有超变环对应于非人免疫球蛋白,所有或基本上所有的FR是人免疫球蛋白序列的FR。人源化抗体也任选地包含至少一部分免疫球蛋白恒定区(Fc),一般是人免疫球蛋白的恒定区。详细内容参见Jones等(1986)Nature,321:522-525;Riechmann等(1988)Nature332:323-329;和Presta,(1992)Curr.Op.Struct.Biol.,2:593-596。人源化抗ErbB2抗体包括huMAb4D5-1、huMAb4D5-2、huMAb4D5-3、huMAb4D5-4、huMAb4D5-5、huMAb4D5-6、huMAb4D5-7和huMAb4D5-8(贺赛汀),如美国专利号5821337的表3所述,特别将其纳入本文作为参考;人源化520C9(WO93/21319)和人源化2C4抗体如下所述。“分离”抗体是从抗体天然环境的成分中鉴定和分离和/或回收的抗体。抗体天然环境的污染成分是可能干扰该抗体的诊断或治疗应用的物质,可包括酶、激素和其它蛋白性或非蛋白性溶质。在优选实施方式中,纯化抗体至(1)使抗体占重量的95%以上,如Lowry法测定,最优选占重量99%以上,(2)达到用离心杯序列分析仪足以获得N-末端或内部氨基酸序列的至少15个残基的程度,或(3)使得用考马斯蓝或优选用银染色在还原或非还原条件下SDS-PAGE检测为均一性。分离的抗体包括重组细胞中的原位抗体,因为该抗体的天然环境的至少一种成分不存在。然而,通常用至少一个纯化步骤来制备分离的抗体。“结合”某感兴趣抗原的抗体是能够以足够亲和力结合该抗原,从而该抗体可用于靶向表达该抗原的细胞。“诱导凋亡”的抗体是能诱导程序性细胞死亡的抗体,如通过膜联蛋白V结合、DNA片段化、细胞皱缩、内质网膨胀、细胞片段化和/或形成膜小泡(称为凋亡小体)来测定。所述细胞是肿瘤细胞,如乳腺、卵巢、胃、子宫内膜、唾液腺、肺、肾、结肠、甲状腺、胰腺或膀胱肿瘤细胞。可用各种方法评价伴随凋亡的细胞变化。例如,可通过膜联蛋白结合测定磷脂酰丝氨酸(PS)易位;通过DNA成梯评价DNA片段化;用亚二倍体细胞的增加来评价伴有DNA片段化的核/染色质浓缩。“疾病”是会从本发明治疗中获益的任何状况,包括慢性和急性失调或疾病,包括使哺乳动物易患所述失调的病理状况。本发明治疗的疾病的非限制性例子包括良性和恶性肿瘤;白血病和淋巴系统恶性肿瘤,具体是乳腺癌、卵巢癌、胃癌、子宫内膜癌、唾液腺癌、肺癌、肾癌、结肠癌、甲状腺癌、胰腺癌、前列腺癌或膀胱癌;神经元、神经胶质、星形胶质细胞、下丘脑和其它腺体、巨噬细胞、上皮、基质和囊胚腔疾病;以及炎症、新生血管生成和免疫系统疾病。术语“治疗有效量”指在哺乳动物中能有效治疗疾病或失调的药物用量。在癌症的情况下,治疗有效量的药物可减少癌细胞数量;缩小肿瘤体积;抑制(即减慢到某种程度,优选停止)癌细胞浸润到周围器官中;抑制(即减慢到某种程度,优选停止)肿瘤转移;抑制肿瘤生长至某种程度;和/或缓解癌症伴随的一种或多种症状至某种程度。药物可防止癌细胞生长和/或杀伤现有癌细胞至某种程度,可以是细胞生长抑制性和/或细胞毒性药物。对于癌症治疗而言,例如,可通过评价疾病发展的时间(TTP)和/或测定反应速率(RR)来衡量药效。术语“大量”指多数,即群体中、集合中或样品中的>50%。术语“胞内代谢物”指细胞内对抗体-药物偶联物(ADC)代谢加工或反应所产生的化合物。这种代谢加工或反应可以是酶加工如蛋白水解切下ADC的肽接头,或水解官能团如腙、酯或酰胺。胞内代谢物包括但不限于:进入、扩散、摄取或转运入细胞后受到胞内切割的抗体和游离药物。术语“胞内切割”指细胞内对药物-配体偶联物、药物-接头-配体偶联物、抗体-药物偶联物(ADC)等进行的代谢加工或反应,从而使药物部分(D)和抗体(Ab)之间的接头的共价连接断裂,导致细胞内游离药物与抗体解离。因此,药物-配体偶联物、药物-接头-配体偶联物或ADC的切下部分是胞内代谢物。术语"生物利用度"指给予患者的给定量药物的全身利用度(即血液/血浆水平)。生物利用度是一种绝对术语,表示对药物从给药剂型到达全身循环的时间(速率)和总量(程度)的衡量结果。术语“细胞毒活性”指抗体-药物偶联物化合物或抗体-药物偶联物化合物的胞内代谢物的细胞杀伤、细胞生长抑制或抗增殖效果。细胞毒活性可以表示为IC50值,即半数细胞存活时每单位体积的(药物)浓度(摩尔或质量)。术语“癌症”和“癌”指或描述哺乳动物中一般特征为细胞失调性生长的生理状态。“肿瘤”包含一种或多种癌细胞。癌症的例子包括但不限于:上皮癌、淋巴瘤、胚细胞瘤、肉瘤和白血病或淋巴系统恶性肿瘤。这些癌症的更具体例子包括:鳞状细胞癌(如鳞状上皮细胞癌),肺癌包括小细胞肺癌、非小细胞肺癌(“NSCLC”)、肺腺癌和肺鳞状细胞癌,腹膜癌,肝细胞癌,胃癌包括胃肠癌,胰腺癌,成胶质细胞瘤,宫颈癌,卵巢癌,肝癌,膀胱癌,肝细胞癌,乳腺癌,结肠癌,直肠癌,结肠直肠癌,子宫内膜或子宫癌,唾液腺癌,肾癌,前列腺癌,外阴癌,甲状腺癌,肝癌,肛门癌,阴茎癌,以及头颈癌。“表达ErbB2的癌症”的癌细胞表面产生足够水平的ErbB2,因而抗ErbB2抗体可与其结合并对该癌症有疗效。“特征是过度激活”ErbB2受体的癌症,是癌细胞ErbB2受体激活程度大大超过同类组织的非癌细胞中该受体激活水平的癌症。这种过度激活可能是因为在癌细胞ErbB2受体过表达和/或可用于激活ErbB2受体的ErbB2配体超过正常水平。这种过度激活可引起和/或由癌细胞的恶性状态引起。在一些实施方式中,可对癌症进行诊断或预后试验,以确定是否发生了导致过度激活ErbB2受体的ErbB2受体的扩增和/或过表达。或者,或此外,可对癌症进行诊断或预后试验,以确定癌症中是否发生了造成该受体过度激活的ErbB2配体的扩增和/或过表达。在这种癌症亚类中,该受体的过度激活可能是自分泌刺激途径所引起的。“过表达”ErbB2受体的癌症是与同类组织的非癌细胞相比,癌细胞表面ErbB2受体水平明显较高的癌症。这种过表达可能是基因扩增或转录或翻译增加所引起。可通过在诊断或预后试验中评价细胞表面上提呈的ErbB2蛋白水平提高(如通过免疫组化试验;IHC)确定ErbB2受体的过表达。或者,或此外,可通过如荧光原位杂交(FISH;参见WO98/45479)、Southern印迹或聚合酶链反应(PCR)技术如实时定量PCR(RT-PCR)来测定细胞内编码ErbB2的核酸水平。可通过例如,肿瘤活检或各种诊断试验如上述IHC、FISH、Southern印迹、PCR或体内试验来评价患者的配体(或编码它的核酸)水平,从而在诊断上确定ErbB2配体的过表达。也可检测生物液体如血清中抗原(如ErbB2胞外结构域)来研究ErbB2受体的过表达(参见例如美国专利号4933294;WO91/05264;美国专利号5401638;和Sias等,(1990)J.Immunol.Methods,132:73-80)。除了上述试验,本领域技术人员可利用各种其它体内试验。例如,可使患者体内的细胞接触用可检测标记如放射性同位素任选地标记的抗体,然后可通过,例如外部放射活性扫描或分析从先前曾接触该抗体患者的活检组织,来评价该抗体与患者细胞的结合。通过每个细胞表达的HER2分子拷贝数对应的免疫组化评分评价过表达HER2的肿瘤,也可用生化方法测定:0=0-10,000拷贝/细胞,1+=至少约200,000拷贝/细胞,2+=至少约500,000拷贝/细胞,3+=约1-2×106拷贝/细胞。HER2以3+水平过表达导致酪氨酸激酶的配体非依赖性活化(Hudziak等,(1987)Proc.Natl.Acad.Sci.USA,84:7159-7163),这发生在约30%乳腺癌中,在这些患者中,无复发存活和总存活率减少(Slamon等,(1989)Science,244:707-712;Slamon等,(1987)Science,235:177-182)。相反,“特征不是ErbB2受体过表达”的癌症是与同类组织的非癌细胞相比,在诊断试验中不表达高于正常水平的ErbB2受体的癌症。本文所用术语“细胞毒剂”指能抑制或阻止细胞功能和/或引起细胞破坏的物质。该术语包括放射性同位素(如211At、131I、125I、90Y、186Re、188Re、153Sm、212Bi、32P、60C和Lu的放射性同位素),化疗药和毒素如小分子毒素或细菌、真菌、植物或动物来源的具有酶活性的毒素,包括它们的合成类似物和衍生物。在一个方面,该术语不包括放射性同位素。"化疗药"是用于治疗癌症的化合物。化疗药的例子包括:烷化剂如塞替派和Cytoxan环磷酰胺;烷基磺酸盐如白消安、英丙舒凡和哌泊舒凡;吖丙啶类如苯佐多巴(benzodopa)、卡波醌、美妥多巴(meturedopa)和乌瑞多巴(uredopa);氮丙啶和甲基蜜胺(methylamelamine)包括六甲蜜胺、曲他胺、三乙烯磷酰胺、三乙烯硫代磷酰胺和三甲基蜜胺;TLK286(TELCYTATM);多聚乙酰(尤其是bullatacin和bullatacinone);δ-9-四氢大麻酚(屈大麻酚,MARINOL);β-拉伯酮;拉伯醇;秋水仙素;桦木酸;喜树碱(包括合成类似物拓扑替康(HYCAMTIN)、CPT-11(伊立替康、CAMPTOSAR)、乙酰基喜树碱、东莨菪亭(scopolectin)和9-氨基喜树碱);苔藓抑素;callystatin;CC-1065(包括它的阿多来新、卡折来新和比折来新合成类似物);鬼臼毒素;足叶草酸;替尼泊苷;隐花素(cryptophycin)(尤其是隐花素1和隐花素8);海兔毒肽;多卡霉素(duocarmycin)(包括合成类似物,KW-2189和CB1-TM1);红葱甲素(eleutherobin);pancratistatin;sarcodictyin;海绵抑素(spongistatin);氮芥类如苯丁酸氮芥、萘氮芥、胆磷酰胺、雌莫司汀、异环磷酰胺、氮芥、氧氮芥盐酸盐、美法仑、新恩比兴、苯乙酰胆固醇氮芥、泼尼莫司汀、曲磷胺、乌拉莫司汀;亚硝基脲如卡莫司汀、吡葡亚硝脲、福莫司汀、洛莫司汀、尼莫司汀和雷诺司汀;双膦酸盐类,如氯屈膦酸盐;抗生素如烯二炔类抗生素(如卡奇霉素,尤其是卡奇霉素γ1I和卡奇霉素ωI1(参见例如Agnew、ChemIntl.Ed.Engl.、33:183-186(1994))和蒽环类如红霉素乙琥珀酸酯(annamycin)、AD32、alcarubicin、柔红霉素、右雷佐生、DX-52-1、表柔比星、GPX-100、伊达比星、KRN5500、美诺立尔,蒽环类抗生素,包括蒽环类抗生素A、望菌霉素(esperamicin)、新抑癌蛋白生色团和相关色素蛋白烯二炔类抗生素生色团、阿柔比星、放线菌素、安曲霉素(authramycin)、偶氮丝氨酸、博来霉素、放线菌素C、卡拉比星(carabicin)、洋红霉素、嗜癌霉素、色霉素、放线菌素D、地托比星、6-重氮-5-氧代-L-正亮氨酸、ADRIAMYCIN多柔比星(包括吗啉代-多柔比星、氰基吗啉代-多柔比星、2-吡咯啉并-多柔比星、脂质体多柔比星和脱氧多柔比星)、依索比星、马赛罗霉素、丝裂霉素如丝裂霉素C、麦考酚酸、诺拉霉素、橄榄霉素、培洛霉素、potfiromycin、嘌罗霉素、三铁阿霉素、罗多比星、链黑霉素、链佐星、块菌素、乌苯美司、净司他丁和佐柔比星;叶酸类似物如denopterin、蝶罗呤和三甲曲沙;嘌呤类似物如氟达拉滨、6-硫基嘌呤、硫咪嘌呤和硫鸟嘌呤;嘧啶类似物如安西他滨、阿扎胞苷、6-氮尿嘧啶、卡莫氟、阿糖胞苷、双脱氧尿嘧啶、去氧氟尿嘧啶、依诺他滨和氟尿嘧啶;雄激素如卡普睾酮、屈他雄酮丙酸酯、环硫雄醇、美雄烷和睾内酪;抗肾上腺药如氨鲁米特、米托坦和曲洛司坦;叶酸补充剂如亚叶酸;醋葡醛内酯;抗叶酸抗瘤药如ALIMTALY231514培美曲塞、二氢叶酸还原酶抑制剂如甲氨蝶呤、抗代谢药如5-氟尿嘧啶(5-FU)及其前药如UFT、S-1和卡培他滨,以及胸苷酸合酶抑制剂和甘氨酰胺核苷酸甲酰基转移酶抑制剂如雷替曲塞(TOMUDEXRM,TDX);二氢嘧啶脱氢酶抑制剂如恩尿嘧啶(eniluracil);醛磷酰胺糖苷;氨基-γ-酮戊酸;安吖啶;bestrabucil;比生群;依达曲沙;磷胺氮芥(defofamine);秋水仙胺;地吖醌;elfornithine;依利醋铵;大环内酯类;依托格鲁;硝酸镓;羟基脲;蘑菇多糖;氯尼达明(lonidainine);类美坦西醇如美登素和ansamitocins;米托胍腙;米托蒽醌;莫哌达醇;尼曲吖啶(nitraerine);喷司他丁;异丙嗪(phenamet);吡柔比星;洛索蒽醌;2-乙基酰肼;丙卡巴肼;PSK多糖复合物(JHSNaturalProducts,Eugene,OR);雷佐生;根霉素;西佐喃;锗螺胺;细交链孢菌酮酸;三亚胺醌;2,2′,2"-三氯三乙胺;单端孢霉烯类(尤其是T-2毒素,疣孢菌素A(verracurinA),杆孢菌素A和蛇形菌素);乌拉坦;长春地辛(ELDISINEFILDESIN);达卡巴嗪;甘露莫司汀;二溴甘露醇;二溴卫矛醇;哌泊溴烷;卡胞嘧啶(gacytosine);阿拉伯糖苷("Ara-C");环磷酰胺;塞替派;类紫杉醇类和紫杉烷类,如泰素紫杉醇(Bristol-MyersSquibbOncology,Princeton,N.J.),ABRAXANETM无克列莫佛、清蛋白改造的紫杉醇纳米颗粒制剂(AmericanPharmaceuticalPartners,Schaumberg,Illinois)和TAXOTEREdoxetaxel(Rorer,Antony,France);瘤可宁;吉西他滨(GEMZAR);6-硫鸟嘌呤;巯嘌呤;铂;铂类似物或基于铂的类似物如顺铂、奥沙利铂和卡铂;长春碱(VELBAN);依托泊苷(VP-16);异环磷酰胺;米托蒽醌;长春新碱(ONCOVIN);长春花生物碱;长春瑞滨(NAVELBINE);二羟基蒽醌;依达曲沙;道诺霉素;氨蝶呤;适罗达;伊班膦酸盐;拓扑异构酶抑制剂RFS2000;二氟甲基鸟氨酸(DMFO);视黄醇类如视黄酸;上述物质的药学上可接受的盐、酸或衍生物;以及上述两种或多种物质的组合;如CHOP,是环磷酰胺、多柔比星、长春新碱和泼尼松龙联合疗法的缩写;FOLFOX,是奥沙利铂(ELOXATINTM)以及5-FU和亚叶酸联合治疗方案的缩写。本定义中也包括调节或抑制激素对肿瘤作用的抗激素药,如抗雌激素药和选择性雌激素受体调节剂(SERMs),包括例如,他莫昔芬(包括NOLVADEX他莫昔芬)、雷洛昔芬、屈洛昔芬、4-羟基他莫昔芬、曲沃昔芬、基奥昔芬(keoxifene)、LY117018、奥那司酮和FARESTON托瑞米芬;抑制芳香酶的芳香酶抑制剂,它在肾上腺中调节雌激素的生产,例如4(5)-咪唑、氨鲁米特、MEGASE甲地孕酮乙酸盐、AROMASIN依西美坦、福美坦(formestanie)、法倔唑、RIVISOR伏氯唑、FEMARA来曲唑和ARIMIDEX阿那曲唑;以及抗雄激素药如氟他胺、尼鲁米特、比卡鲁胺、亮丙瑞林和戈舍瑞林;以及曲沙他滨(1,3-二氧戊环核苷胞嘧啶类似物);反义寡核苷酸,尤其是抑制参与异常细胞增殖信号传导途径的基因如PKC-α、Raf、H-Ras和表皮生长因子受体(EGF-R)基因表达的反义寡核苷酸;疫苗如基因治疗疫苗,例如ALLOVECTIN疫苗、LEUVECTIN疫苗和VAXID疫苗;PROLEUKINrIL-2;LURTOTECAN拓扑异构酶1抑制剂;ABARELIXrmRH;和上述物质的药学上可接受的盐、酸或衍生物。本文所用术语“靶向EGFR的药物”指与EGFR结合并任选地抑制EGFR活化的治疗剂。这种药物的例子包括与EGFR结合的抗体和小分子。与EGFR结合的抗体的例子包括:MAb579(ATCCCRLHB8506)、MAb455(ATCCCRLHB8507)、MAb225(ATCCCRL8508)、MAb528(ATCCCRL8509)(参见美国专利号4943533,Mendelsohn等)及其变体,如嵌合性225(C225或西妥昔单抗;ERBITUX)和改形的人225(H225)(参见WO96/40210,ImcloneSystemsInc.);结合II型EGFR突变体的抗体(美国专利号5,212,290);结合EGFR的人源化和嵌合抗体,如美国专利号5891996所述;和结合EGFR的人抗体,如ABX-EGF(参见WO98/50433,Abgenix)。可将抗EGFR抗体与细胞毒剂偶联,从而产生免疫偶联物(参见例如EP659,439A2,MerckPatentGmbH)。与EGFR结合的小分子例子包括:ZD1839或Gefitinib(IRESSATM;AstraZeneca),埃罗替尼盐酸盐(CP-358774,TARCEVATM;Genentech/OSI)和AG1478,AG1571(SU5271;Sugen)。“酪氨酸激酶抑制剂”是以某种程度抑制酪氨酸激酶如ErbB受体的酪氨酸激酶活性的分子。这种抑制剂的例子包括前一自然段所述靶向EGFR的药物以及喹唑啉,如PD153035,4-(3-氯苯胺基)喹唑啉,吡啶并嘧啶,嘧啶并嘧啶,吡咯并嘧啶如CGP59326、CGP60261和CGP62706,以及吡唑并嘧啶,4-(苯基氨基)-7H-吡咯并[2,3-d]嘧啶,姜黄素(二阿魏酸基甲烷,4,5-双(4-氟苯胺基)酞亚胺),含有硝基噻吩部分的tyrphostine;PD-0183805(Warner-Lambert);反义分子(如与编码ErbB的核酸结合的分子);喹喔啉(美国专利号5,804,396);tryphostin(美国专利号5804396);ZD6474(AstraZeneca);PTK-787(Novartis/ScheringAG);泛ErbB抑制剂如CI-1033(Pfizer);Affinitac(ISIS3521;Isis/Lilly);伊马替尼甲磺酸盐(Gleevac;Novartis);PKI166(Novartis);GW2016(GlaxoSmithKline);CI-1033(Pfizer);EKB-569(Wyeth);Semaxanib(Sugen);ZD6474(AstraZeneca);PTK-787(Novartis/ScheringAG);INC-1C11(Imclone);或如以下公开专利之一所述:美国专利号5804396;WO99/09016(AmericanCyanamid);WO98/43960(AmericanCyanamid);WO97/38983(WarnerLambert);WO99/06378(WarnerLambert);WO99/06396(WarnerLambert);WO96/30347(Pfizer,Inc);WO96/33978(Zeneca);WO96/3397(Zeneca);和WO96/33980(Zeneca)。“抗新生血管生成剂”指以某种程度阻断或干扰血管发育的化合物。例如,抗新生血管生成因子可以是与参与促进新生血管生成的生长因子或生长因子受体相结合的小分子或抗体。在一个实施方式中,抗新生血管生成因子是与血管内皮生长因子(VEGF)相结合的抗体。通用术语“细胞因子”是由一群细胞分泌,作为胞间媒介物作用于另一种细胞的蛋白的总称。这种细胞因子的例子是淋巴因子、单核因子和传统多肽激素。细胞因子中包括生长激素如人生长激素、N-甲硫氨酰基人生长激素和牛生长激素;甲状旁腺激素;甲状腺素;胰岛素;胰岛素原;松弛素;松弛素原;糖蛋白激素如促卵泡激素(FSH)、促甲状腺激素(TSH)和黄体生成素(LH);肝生长因子;成纤维细胞生长因子;促乳素;胎盘催乳素;肿瘤坏死因子-α和-β;米勒管抑制物;小鼠促性腺素相关肽;抑制素;活化素;血管内皮生长因子;整联蛋白;血栓形成素(TPO);神经生长因子如NGF-β;血小板生长因子;转化生长因子(TGF)如TGF-α和TGF-β;胰岛素样生长因子-I和-II;红细胞生成素(EPO);成骨诱导因子;干扰素如干扰素-α、-β和-γ;集落刺激因子(CSF)如巨噬细胞-CSF(M-CSF);粒细胞-巨噬细胞-CSF(GM-CSF);和粒细胞-CSF(G-CSF);白介素(ILs)如IL-1、IL-1α、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL-8、IL-9、IL-10、IL-11、IL-12;肿瘤坏死因子如TNF-α或TNF-β;以及其它多肽因子包括LIF和kit配体(KL)。本文所用术语细胞因子包括天然来源或重组细胞培养物来源的蛋白,以及天然序列细胞因子的生物活性等价物。本申请中所用术语“前药”指形式与母体药物相比对肿瘤细胞的细胞毒性较小,并能够经酶作用或水解作用而活化或转变为活性更高的母体形式的药学活性物质的前体或衍生物。参见例如Wilman,“癌症化疗中的前药”(ProdrugsinCancer化疗)BiochemicalSocietyTransactions,14,第375-382页,第615届贝尔法斯特会议(1986)和Stella等,“前药:靶向药物递送的化学方法”(Prodrug:AChemicalApproachtoTargetedDrugDelivery)DirectedDrugDelivery,Borchardt等(编),第247-267页,HumanaPress(1985)。本发明的前药包括但不限于:含有磷酸的前药、含有硫代磷酸的前药、含有硫酸的前药、含有肽的前药、D-氨基酸修饰的前药、糖基化前药、含有β-内酰胺的前药、含有任选取代的苯氧基乙酰胺的前药或含有任选取代的苯基乙酰胺的前药、5-氟胞嘧啶和其它5-氟尿嘧啶前药,它们可转化为活性更高的细胞毒性游离药物。可衍生为前药形式用于本发明的细胞毒药物的例子包括但不限于:上述化疗药。“脂质体”是由各种类型的脂质、磷脂和/或表面活性剂组成的小囊泡,可用于将药物(如包括抗CD30、抗CD40、抗CD70或抗LewisY抗体以及任选的化疗药)递送给哺乳动物。脂质体的成分通常排列成双层形式,类似于生物膜的脂质排列。术语“药品说明书”用来指按照惯例包括在治疗产品的商品包装中的说明书,它含有关于适应症、用法、剂量、给药方式、禁忌症和/或关于使用该治疗产品的警告的信息。“分离的”核酸分子是经鉴定已与通常伴随抗体核酸天然来源中至少一种污染性核酸分子相分离的核酸分子。分离的核酸分子不是其天然状态下所发现的形式。因此,分离的核酸分子与存在于天然细胞中的核酸分子有区别。然而,分离的核酸分子包括通常表达该抗体的细胞中所含的核酸分子,例如,在此种核酸分子在染色体中的位置不同于天然细胞。表述“调控序列”指在特定宿主生物体中表达操作性连接的编码序列必需的DNA序列。例如,适用于原核生物的调控序列包括启动子、任选的操纵子序列和核糖体结合位点。已知真核细胞利用的启动子、聚腺苷酸化信号和增强子。当一核酸的安置与另一核酸序列在功能上相关时,称该二核酸“操作性连接”。例如,如果要将某多肽的前导序列或分泌性前导序列表达为参与该多肽分泌的前蛋白,可将该前导序列或分泌性前导序列的DNA操作性连接于编码该多肽的DNA;如果要用启动子或增强子影响某编码序列的转录,可将该启动子或增强子操作性连接于该序列;或如果要使核糖体结合位点安置在能促进翻译的位置,可将该核糖体结合位点操作性连接于编码序列。通常,“操作性连接”指被连接的DNA序列是毗连的,就分泌性前导序列而言,则是在阅读框中毗连的。然而,增强子不必毗连。可通过在方便的限制性位点连接来完成连接。如果不存在这种位点,可根据常规实践采用合成的寡核苷酸衔接子或接头。本文所用表述“细胞”、“细胞系”和“细胞培养物”可互换使用,所有这些称谓都包括后代。因此,术语“转化子”和“转化细胞”包括原代细胞和从其获得的培养物,无论传代次数。也应理解,由于有意或无意的突变,所有后代的DNA内容不可能精确相同。包括经筛选与最初转化的细胞具有相同功能或生物活性的突变后代。当使用不同称谓时,可从其内容中明显看出。本文中“自身免疫病”是个体自身组织所引起并针对自身组织的疾病或失调,或其并发症或症状表现,或自身组织发生的病症。自身免疫病或失调的例子包括但不限于:关节炎(类风湿性关节炎、青少年类风湿性关节炎、骨关节炎、牛皮癣性关节炎和强直性脊柱炎),牛皮癣,皮炎包括特发性皮炎;慢性特发性荨麻疹包括慢性自身免疫性荨麻疹,多肌炎/皮肌炎,毒性表皮坏死溶解,系统性硬皮病和硬化症,炎性肠病(IBD)相关反应(克罗恩氏病、溃疡性结肠炎)和具有坏疽性脓皮病、结节性红斑、原发性硬化性胆管炎和/或巩膜外层炎并发症的IBD),呼吸窘迫综合征包括成人呼吸窘迫综合征(ARDS),脑膜炎,IgE介导的疾病如变态反应和变应性鼻炎,脑炎如Rasmussen脑炎,葡萄膜炎,结肠炎如显微结肠炎和胶原性结肠炎,肾小球肾炎(GN)如膜性GN、特发性膜性GN、膜性增生性GN(MPGN)包括I型和II型和急进性GN,变应性病,湿疹,哮喘,涉及T细胞浸润和慢性炎症反应的疾病,动脉粥样硬化,自身免疫性心肌炎,白细胞粘着缺陷,系统性红斑狼疮(SLE)如皮肤SLE,狼疮(包括肾炎、脑炎、儿科、非肾性、盘状狼疮、脱发症),青少年发作性糖尿病,多发性硬化(MS)如脊髓-眼MS,变应性脑脊髓炎,与细胞因子和T-淋巴细胞介导的急性和迟发性超敏感相关的免疫反应,结核病,结节病,肉芽肿病包括Wegener肉芽肿病,粒细胞缺乏症,血管炎(包括大血管血管炎(包括风湿性多肌痛和巨细胞(Takayasu)动脉炎)、中等血管血管炎(包括Kawasaki病和结节性多动脉炎)、CNS血管炎和ANCA-相关血管炎如Churg-Strauss血管炎或综合征(CSS)),再生障碍性贫血,Coombs阳性贫血,DiamondBlackfan贫血,免疫性溶血贫血包括自身免疫性溶血贫血(AIHA),恶性贫血,纯红细胞再生障碍(PRCA),凝血VIII因子缺陷,血友病A,自身免疫性嗜中性白血球减少症,全血细胞减少症,白细胞减少症,涉及白细胞渗出的疾病,CNS炎性疾病,多发性器官损伤综合征,重症肌无力,抗原-抗体复合物介导的疾病,抗肾小球基底膜病,抗磷脂抗体综合征,变应性神经炎,Bechet病,Castleman综合征,Goodpasture综合征,朗伯-伊顿肌无力综合征,雷诺综合征,Sjorgen综合征,斯蒂文斯-约翰逊综合症,实体器官移植排斥(包括高效价反应性抗体的预处理,组织中IgA沉积,和肾移植、肝移植、肠移植、心脏移植等产生的排斥),移植物抗宿主病(GVHD),类天疱疮大疱,天疱疮(包括寻常性、叶状和疱疮粘膜类天疱疮),自身免疫性多发性内分泌病,Reiter病,全身肌强直综合征,免疫复合物肾炎,IgM多发性神经病或IgM介导的神经病,特发性血小板减少性紫癜(ITP),血栓形成性血小板减少性紫癜(TTP),血小板减少(如心肌梗塞患者发生的血小板减少)包括自身免疫性血小板减少,睾丸和卵巢的自身免疫病包括自身免疫性睾丸炎和卵巢炎,原发性甲状腺功能减退症;自身免疫性内分泌病包括自身免疫性甲状腺炎,慢性甲状腺炎(Hashimoto甲状腺炎),亚急性甲状腺炎,特发性甲状腺功能减退症,Addison病,Grave病,自身免疫性多发性内分泌腺综合征(或多发性腺性内分泌病综合征),I型糖尿病也称为胰岛素依赖型糖尿病(IDDM)包括儿科IDDM和Sheehan综合征;自身免疫性肝炎,淋巴样间隙性肺炎(HIV),闭塞性细支气管炎(非移植性)与NSIP,Guillain-Barré综合征,伯杰病(IgA肾病),原发性胆汁性肝硬化,脂肪便症(谷朊肠病),具有疱疹样皮炎并发症的顽固性口炎性腹泻,冷球蛋白血症,肌萎缩性侧索硬化症(ALS;卢格里克病),冠状动脉病,自身免疫性内耳病(AIED),自身免疫性听力丧失,视觉眼肌阵挛综合征(OMS),多发性软骨炎如顽固性多发性软骨炎,肺泡蛋白沉着症,淀粉样变,巨细胞肝炎,巩膜炎,意义不确定/未知的单克隆丙种球蛋白病(MGUS),外周神经病,肿瘤伴随综合征,通道疾病(channelopathy)如癫痫症、偏头痛、心律失常、肌失调症、耳聋、失明、周期性瘫痪和CNS通道病;孤独症、炎性肌病和局部区段性肾小球血管硬化症(FSGS)。"烷基"是含有伯、仲、叔或环碳原子的C1-C18烃基。例子是甲基(Me,-CH3)、乙基(Et,-CH2CH3)、1-丙基(正Pr,正丙基,-CH2CH2CH3)、2-丙基(异Pr,异丙基,-CH(CH3)2)、1-丁基(正Bu,正丁基,-CH2CH2CH2CH3)、2-甲基-1-丙基(异Bu,异丁基,-CH2CH(CH3)2)、2-丁基(仲Bu,仲丁基,-CH(CH3)CH2CH3)、2-甲基-2-丙基(叔Bu,叔丁基,-C(CH3)3)、1-戊基(正戊基,-CH2CH2CH2CH2CH3)、2-戊基(-CH(CH3)CH2CH2CH3)、3-戊基(-CH(CH2CH3)2)、2-甲基-2-丁基(-C(CH3)2CH2CH3)、3-甲基-2-丁基(-CH(CH3)CH(CH3)2)、3-甲基-1-丁基(-CH2CH2CH(CH3)2)、2-甲基-1-丁基(-CH2CH(CH3)CH2CH3)、1-己基(-CH2CH2CH2CH2CH2CH3)、2-己基(-CH(CH3)CH2CH2CH2CH3)、3-己基(-CH(CH2CH3)(CH2CH2CH3))、2-甲基-2-戊基(-C(CH3)2CH2CH2CH3)、3-甲基-2-戊基(-CH(CH3)CH(CH3)CH2CH3)、4-甲基-2-戊基(-CH(CH3)CH2CH(CH3)2)、3-甲基-3-戊基(-C(CH3)(CH2CH3)2)、2-甲基-3-戊基(-CH(CH2CH3)CH(CH3)2)、2,3-二甲基-2-丁基(-C(CH3)2CH(CH3)2)、3,3-二甲基-2-丁基(-CH(CH3)C(CH3)3。“链烯基”是至少有一个位置不饱和即碳-碳sp2双键的含有伯、仲、叔或环碳原子的C2-C18烃基。例子包括但不限于:乙烯或乙烯基(-CH=CH2)、烯丙基(-CH2CH=CH2)、环戊烯基(-C5H7)和5-己烯基(-CH2CH2CH2CH2CH=CH2)。“炔基”是至少有一个位置不饱和即碳-碳sp三键的含有伯、仲、叔或环碳原子的C2-C18烃基。例子包括但不限于:乙炔基(-C≡CH)和炔丙基(-CH2C≡CH)。“亚烷基”指1-18个碳原子的饱和支链或直链或环状烃基,因去除母体烷烃的同一或两个不同碳原子上的两个氢原子而产生了两个单价基中心。亚烷基一般包括但不限于:亚甲基(-CH2-)、1,2-乙基(-CH2CH2-)、1,3-丙基(-CH2CH2CH2-)、1,4-丁基(-CH2CH2CH2CH2-)等。“亚链烯基”指2-18个碳原子的不饱和支链或直链或环状烃基,因去除母体烯烃的同一或两个不同碳原子上的两个氢原子而产生了两个单价基中心。亚链烯基一般包括但不限于:1,2-乙烯基(-CH=CH-)。“亚炔基”指2-18个碳原子的不饱和支链或直链或环状烃基,因去除母体炔烃的同一或两个不同碳原子上的两个氢原子而产生了两个单价基中心。亚炔基一般包括但不限于:乙炔基(-C≡C-)、炔丙基(-CH2C≡C-)和4-戊炔基(-CH2CH2CH2C≡CH-)。"芳基"指去除母体芳环系统的一个碳原子上一个氢原子所产生的6-20个碳原子的单价芳族烃基。在示范结构中,一些芳基用“Ar”代表。芳基一般包括但不限于:由苯衍生的基团、取代的苯、萘、蒽、联苯基等。"芳烷基"指其中连接于碳原子的一个氢原子,一般是末端或sp3碳原子被芳基取代的脂肪族烷基。芳烷基一般包括但不限于:苄基、2-苯基乙烷-1-基、2-苯基乙烯-1-基、萘基甲基、2-萘基乙烷-1-基、2-萘基乙烯-1-基、萘并苄基、2-萘并苯基乙烷-1-基等。芳烷基含有6-20个碳原子,例如,芳烷基的烷基部分包括链烷基、链烯基或炔基有1-6个碳原子,芳基部分有5-14个碳原子。"杂芳烷基"指其中连接于碳原子的一个氢原子,一般是末端或sp3碳原子被杂芳基取代的脂肪族烷基。杂芳烷基一般包括但不限于:2-苯并咪唑基甲基,2-呋喃基乙基等。杂芳烷基含有6-20个碳原子,例如,芳烷基的烷基部分包括链烷基、链烯基或炔基有1-6个碳原子,杂芳基部分有5-14个碳原子和选自N、O、P和S的1-3个杂原子。杂芳烷基的杂芳基部分可以是3-7元单环(2-6个碳原子)或含有7-10个环原子的双环(4-9个碳原子和1-3个选自N、O、P和S的杂原子),例如:双环[4,5]、[5,5]、[5,6]或[6,6]系统。"取代烷基”、“取代芳基"和"取代芳烷基"分别指烷基、芳基和芳烷基中一个或多个氢原子各自独立地被取代基所取代。取代基一般包括但不限于:-X、-R、-O-、-OR、-SR、-S-、-NR2、-NR3、=NR、-CX3、-CN、-OCN、-SCN、-N=C=O、-NCS、-NO、-NO2、=N2、-N3、NC(=O)R、-C(=O)R、-C(=O)NR2、-SO3-、-SO3H、-S(=O)2R、-OS(=O)2OR、-S(=O)2NR、-S(=O)R、-OP(=O)(OR)2、-P(=O)(OR)2、-PO-3、-PO3H2、-C(=O)R、-C(=O)X、-C(=S)R、-CO2R、-CO2-、-C(=S)OR、-C(=O)SR、-C(=S)SR、-C(=O)NR2、-C(=S)NR2、-C(=NR)NR2,其中X各自独立是卤原子:F、Cl、Br或I;R各自独立地是-H、C2-C18烷基、C6-C20芳基、C3-C14杂环、保护基团或前药部分。上述亚烷基、亚链烯基和亚炔基也可被类似地取代。“杂芳基”和"杂环"指其中一个或多个环原子是杂原子如氮、氧和硫的环系统。杂环基含有1-20个碳原子和1-3个选自N、O、P和S的杂原子。杂环可以是含有3-7个环原子(2-6个碳原子和1-3个选自N、O、P和S的杂原子)的单环或含有7-10个环原子(4-9个碳原子和1-3个选自N、O、P和S的杂原子)的双环,例如:双环[4,5]、[5,5]、[5,6]或[6,6]系统。在Paquette,LeoA.;《现代杂环化学原理》(PrinciplesofModernHeterocyclicChemistry)(W.A.Benjamin,NewYork,1968),具体是第1、3、4、6、7和9章;《杂环化合物化学,一系列专著》(TheChemistryofHeterocyclicCompounds,AseriesofMonographs)(JohnWiley&Sons,NewYork,1950至今),具体是第13、14、16、19和28卷;和J.Am.Chem.Soc.(1960)82:5566中描述了杂环。杂环的示范性例子包括但不限于:吡啶基、二氢吡啶基、四氢吡啶基(哌啶基)、噻唑基、四氢硫代苯基、硫氧化的四氢硫代苯基、嘧啶基、呋喃基、噻吩基、吡咯基、吡唑基、咪唑基、四唑基、苯并呋喃基、硫茚基(thianaphthalenyl)、吲哚基、假吲哚基(indolenyl)、喹啉基、异喹啉基、苯并咪唑基、哌啶基、4-哌啶酮基、吡咯烷基、2-吡咯烷酮基、吡咯啉基、四氢呋喃基、双四氢呋喃基、四氢吡喃基、双四氢吡喃基、四氢喹啉基、四氢异喹啉基、十氢喹啉基、八氢异喹啉基、吖辛因基、三嗪基、6H-1,2,5-噻二嗪基、2H,6H-1,5,2-二噻嗪基、噻吩基、噻蒽基、吡喃基、异苯并呋喃基、色烯基、呫吨基、苯并氧硫杂环己二烯基(phenoxathinyl)、2H-吡咯基、异噻唑基、异噁唑基、吡嗪基、哒嗪基、中氮茚基、异吲哚基、3H-吲哚基、1H-吲唑基、嘌呤基、4H-喹嗪基、酞嗪基、萘啶基、喹喔啉基、喹唑啉基、噌啉基、蝶啶基、4aH-咔唑基、咔唑基、β-咔啉基、菲啶基、吖啶基、嘧啶基、菲咯啉基、吩嗪基、吩噻嗪基、呋咱基(furazanyl)、苯并噁嗪基、异色满基、色满基、咪唑烷基、咪唑啉基、吡唑烷基、吡唑啉基、哌嗪基、二氢吲哚基、异二氢吲哚基、奎宁环基、吗啉基、噁唑烷基、苯并三唑基、苯并异噁唑基、羟吲哚基、苯并噁唑啉基和靛红酰(isatinoyl)。以实例而非限制方式,碳连接的杂环连接在吡啶的2、3、4、5或6位,哒嗪的3、4、5或6位,嘧啶2、4、5或6位,吡嗪的2、3、5或6位,呋喃、四氢呋喃、硫代呋喃、噻吩、吡咯或四氢吡咯的2、3、4或5位,噁唑、咪唑或噻唑的2、4或5位,异噁唑、吡唑或异噻唑的3、4或5位,吖丙啶的2或3位,氮杂环丁烷的2、3或4位,喹啉的2、3、4、5、6、7或8位或异喹啉的1、3、4、5、6、7或8位。更一般来说,碳连接的杂环包括2-吡啶基、3-吡啶基、4-吡啶基、5-吡啶基、6-吡啶基、3-哒嗪基、4-哒嗪基、5-哒嗪基、6-哒嗪基、2-嘧啶基、4-嘧啶基、5-嘧啶基、6-嘧啶基、2-吡嗪基、3-吡嗪基、5-吡嗪基、6-吡嗪基、2-噻唑基、4-噻唑基或5-噻唑基。以实例而非限制方式,氮连接的杂环连接在吖丙啶、氮杂环丁烷、吡咯、吡咯烷、2-吡咯啉、3-吡咯啉、咪唑、咪唑烷、2-咪唑啉、3-咪唑啉、吡唑、吡唑啉、2-吡唑啉、3-吡唑啉、哌啶、哌嗪、吲哚、二氢吲哚、1H-吲唑的1位,异吲哚或异二氢吲哚的2位,吗啉的4位,和咔唑或β-咔啉的9位。更一般来说,氮连接的杂环包括1-吖丙啶基、1-氮杂环丁烷基(azetedyl)、1-吡咯基、1-咪唑基、1-吡唑基和1-哌啶基。“碳环”指含有3-7个碳原子的饱和或不饱和单环或含有7-12个碳原子的饱和或不饱和双环。单环碳环含有3-6个环原子,更一般是5或6个环原子。双环碳环含有7-12个环原子,如排列为双环[4,5]、[5,5]、[5,6]或[6,6]系统;或含有9或10个环原子,排列为双环[5,6]或[6,6]系统。单环碳环的例子包括环丙基、环丁基、环戊基、1-环戊-1-烯基、1-环戊-2-烯基、1-环戊-3-烯基、环己基、1-环己-1-烯基、1-环己-2-烯基、1-环己-3-烯基、环庚基和环辛基。“接头”、“接头单元”或“连接”指含有将抗体与药物部分共价连接的共价键或原子链的化学部分。在各种实施方式中,接头表示为LU。接头包括二价基团如二价烷基、二价芳基,二价杂芳基,部分如:-(CR2)nO(CR2)n-,烷氧基重复单元(如聚氧乙烯,PEG,聚亚甲基氧)和烷基氨基(如聚氨基乙烯,JeffamineTM);和二酸酯和酰胺,包括琥珀酸酯、琥珀酰胺、二乙醇酸酯、丙二酸酯和己酰胺。术语“手性”指不能与其镜像对应伙伴重叠的分子,而术语"非手性"指可与其镜像对应伙伴重叠的分子。术语“立体异构体”指化学组成相同,但原子或基团的空间排列不同的化合物。"非对映异构体”指具有两个或多个手性中心和分子不互为镜像的立体异构体。非对映异构体具有不同物理特性,如熔点、沸点、广谱特性和反应性。可在高分辨率分析方法如电泳和色谱下分离非对映异构体的混合物。“对映异构体”指一对立体异构体化合物的镜像可互相重叠。本文所用立体化学定义和惯例通常遵循S.P.Parker编,《McGraw-Hill化学术语字典》(McGraw-HillDictionaryofChemicalTerms)(1984)McGraw-HillBookCompany,NewYork;以及Eliel,E.和Wilen,S.,《有机化合物的立体化学》(StereochemistryofOrganiccompounds)(1994)JohnWiley&Sons,Inc.,NewYork中所述。许多有机化合物以旋光活性形式存在,即它们具有沿平面-偏光的平面旋转的能力。在描述旋光活性化合物中,用前缀D和L,或R和S表示该分子手性中心的绝对构型。用前缀d和l或(+)和(-)作为表示该化合物沿平面-偏光旋转的符号,(-)或1指该化合物是左旋的。前缀是(+)或d的化合物是右旋的。对于给定的化学结构,这些立体异构体是相同的,除了它们互为镜像外。也可将特定立体异构体称为对映异构体,这些异构体的混合物常常称为对映异构混合物。对映异构体的50:50混合物称为外消旋混合物或外消旋物,可在化学反应或加工中不发生立体选择性或立体特异性。术语"外消旋混合物"和"外消旋物"指两种对映异构的等摩尔混合物,无旋光性。“患者”的例子包括但不限于:人、大鼠、豚鼠、猴、猪、山羊、奶牛、马、犬、猫、鸟和家禽。在示范性实施方式中,患者是人。“芳基”指碳环芳族基团。芳基的例子包括但不限于:苯基、萘基和蒽基。碳环芳族基团或杂环芳族基团可以是不取代的或被一个或多个基团取代的,这些基团包括但不限于:-C1-C8烷基、-O-(C1-C8烷基)、-芳基、-C(O)R’、-OC(O)R’、-C(O)OR’、-C(O)NH2、-C(O)NHR’、-C(O)N(R’)2-NHC(O)R’、-S(O)2R’、-S(O)R’、-OH、-卤素、-N3、-NH2、-NH(R’)、-N(R’)2和-CN;其中各R’独立地选自H、-C1-C8烷基和芳基。本文所用术语“C1-C8烷基”指含有1-8个碳原子的直链或支链、饱和或不饱和的烃基。代表性“C1-C8烷基”包括但不限于:-甲基、-乙基、-正丙基、-正丁基、-正戊基、-正己基、-正庚基、-正辛基、-正壬基和-正癸基;而支链C1-C8烷基包括但不限于:-异丙基,-仲丁基,-异丁基,-叔丁基,-异戊基,2-甲基丁基,不饱和C1-C8烷基包括但不限于:-乙烯基、-烯丙基、-1-丁烯基、-2-丁烯基、-异丁烯基、-1-戊烯基、-2-戊烯基、-3-甲基-1-丁烯基、-2-甲基-2-丁烯基、-2,3-二甲基-2-丁烯基、1-己基、2-己基、3-己基、-乙炔基、-丙炔基、-1-丁炔基、-2-丁炔基、-1-戊炔基、-2-戊炔基、-3-甲基-1丁炔基;甲基,乙基,丙基,异丙基,正丁基,异丁基,仲丁基,叔丁基,正戊基,异戊基,新戊基,正己基,异己基,2-甲基戊基,3-甲基戊基,2,2-二甲基丁基,2,3-二甲基丁基,2,2-二甲基戊基,2,3-二甲基戊基,3,3-二甲基戊基,2,3,4-三甲基戊基,3-甲基己基,2,2-二甲基己基,2,4-二甲基己基,2,5-二甲基己基,3,5-二甲基己基,2,4-二甲基戊基,2-甲基庚基,3-甲基庚基,正庚基,异庚基,正辛基,和异辛基。C1-C8烷基可以不取代或用一个或多个基团取代,这些基团包括但不限于:-C1-C8烷基、-O-(C1-C8烷基)、-芳基、-C(O)R’、-OC(O)R’、-C(O)OR’、-C(O)NH2、-C(O)NHR’、-C(O)N(R’)2-NHC(O)R’、-SO3R’、-S(O)2R’、-S(O)R’、-OH、-卤素、-N3、-NH2、-NH(R’)、-N(R’)2和-CN;其中各R’独立地选自H、-C1-C8烷基和芳基。“C3-C8碳环”是3-、4-、5-、6-、7-或8-元饱和或不饱和非芳族碳环。代表性C3-C8碳环包括但不限于:-环丙基、-环丁基、-环戊基、-环戊二烯基、-环己基、-环己烯基、-1,3-环己二烯基、-1,4-环己二烯基、-环庚基、-1,3-环庚二烯基、-1,3,5-环庚三烯基、-环辛基和-环辛二烯基。C3-C8碳环基团可以不取代或用一个或多个基团取代,这些基团包括但不限于:-C1-C8烷基、-O-(C1-C8烷基)、-芳基、-C(O)R’、-OC(O)R’、-C(O)OR’、-C(O)NH2、-C(O)NHR’、-C(O)N(R’)2-NHC(O)R’、-S(O)2R’、-S(O)R’、-OH、-卤素、-N3、-NH2、-NH(R’)、-N(R’)2和-CN;其中各R’独立地选自H、-C1-C8烷基和芳基。“C3-C8碳环基”指碳环基团的氢原子之一被连接键取代的上述C3-C8碳环基团。“C1-C10亚烷基”是式-(CH2)1-10-的直链饱和烃基。C1-C10亚烷基的例子包括亚甲基、亚乙基、亚丙基、亚丁基、亚戊基、亚己基、亚庚基、亚辛基、亚壬基和亚癸基。“亚芳基”是含有两个共价键,可以是邻位、间位或对位构型的芳基,结构如下:其中苯基可以不取代的或被多至4个基团取代的,这些基团包括但不限于:-C1-C8烷基、-O-(C1-C8烷基)、-芳基、-C(O)R’、-OC(O)R’、-C(O)OR’、-C(O)NH2、-C(O)NHR’、-C(O)N(R’)2-NHC(O)R’、-S(O)2R’、-S(O)R’、-OH、-卤素、-N3、-NH2、-NH(R’)、-N(R’)2和-CN;其中各R’独立地选自H、-C1-C8烷基和芳基。“C3-C8杂环”指其中1-4个环碳原子独立地被选自O、S和N的杂原子取代的芳族或非芳族C3-C8碳环。C3-C8杂环的代表性例子包括但不限于:苯并呋喃基、苯并噻吩、吲哚基、苯并吡唑基、香豆素基、异喹啉基、吡咯基、硫代苯基、呋喃基、噻唑基、咪唑基、吡唑基、三唑基、喹啉基、嘧啶基、吡啶基、吡啶酮基、吡嗪基、哒嗪基、异噻唑基、异噁唑基和四唑基。C3-C8杂环可以不取代或用至多7个基团取代,这些基团包括但不限于:-C1-C8烷基、-O-(C1-C8烷基)、-芳基、-C(O)R’、-OC(O)R’、-C(O)OR’、-C(O)NH2、-C(O)NHR’、-C(O)N(R’)2-NHC(O)R’、-S(O)2R’、-S(O)R’、-OH、-卤素、-N3、-NH2、-NH(R’)、-N(R’)2和-CN;其中各R’独立地选自H、-C1-C8烷基和芳基。“C3-C8杂环基”指杂环基团的氢原子之一被连接键取代的上述C3-C8杂环基团。C3-C8杂环基可以是不取代的或被多至6个基团取代的,这些基团包括但不限于:-C1-C8烷基、-O-(C1-C8烷基)、-芳基、-C(O)R’、-OC(O)R’、-C(O)OR’、-C(O)NH2、-C(O)NHR’、-C(O)N(R’)2-NHC(O)R’、-S(O)2R’、-S(O)R’、-OH、-卤素、-N3、-NH2、-NH(R’)、-N(R’)2和-CN;其中各R’独立地选自H、-C1-C8烷基和芳基。“示范性化合物”是药物化合物或药物-接头化合物。“示范性偶联物”是含有药物-配体偶联物或药物-接头-配体偶联物的可切割药物单元的药物-配体偶联物。在一些实施方式中,所述示范性化合物和示范性偶联物是分离或纯化形式。本文所用“分离”指与(a)天然来源如植物或动物细胞或细胞培养物,或(b)合成的有机化学反应混合物的其它成分分离。本文所用“纯化”指当分离后,该分离物占示范性化合物或示范性偶联物的至少95重量%,在另一方面占至少98重量%。“羟基保护基团”的例子包括但不限于:甲氧基甲醚、2-甲氧基乙氧基甲醚、四氢吡喃醚、苄醚、对甲氧基苄醚、三甲基甲硅烷基醚、三乙基甲硅烷基醚、三异丙基甲硅烷基醚、叔丁基二甲基甲硅烷基醚、三苯基甲基甲硅烷基醚、乙酸酯、取代的乙酸酯、新戊酸酯(pivaloate)、苯甲酸酯、甲基磺酸酯和对甲苯磺酸酯。“离去基团”指可被另一官能团取代的官能团。这种离去基团是本领域熟知的,例子包括但不限于:卤素(如氯、溴、碘)、甲基磺酰基(甲磺酰基)、对甲苯磺酰基(甲苯磺酰基)、三氟甲磺酰基(triflate)和三氟甲基磺酸酯。本文所用术语“药学上可接受的盐”指示范性化合物或示范性偶联物的药学上可接受的有机盐或无机盐。示范性化合物和示范性偶联物含有至少一个氨基,因此可用此氨基形成酸加成盐。示范性盐包括但不限于:硫酸盐、柠檬酸盐、乙酸盐、草酸盐、盐酸盐、氢溴酸盐、氢碘酸盐、硝酸盐、硫酸氢盐、磷酸盐、磷酸氢盐、异烟酸盐、乳酸盐、水杨酸盐、柠檬酸氢盐、酒石酸盐、油酸盐、丹宁酸盐、泛酸盐、酒石酸氢盐、抗坏血酸盐、琥珀酸盐、马来酸盐、龙胆酸盐(gentisinate)、富马酸盐、葡糖酸盐、葡糖醛酸盐、糖酸盐、甲酸盐、苯甲酸盐、谷氨酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐和双羟萘酸盐(即1,1’-亚甲基-双-(2-羟基-3-萘甲酸盐))。药学上可接受的盐可包括另一分子如乙酸根离子、琥珀酸根离子或其它抗衡离子。抗衡离子可以是能稳定母体化合物上电荷的任何有机或无机部分。而且,药学上可接受的盐的结构中可具有一个以上的带电荷原子。在多个带电原子是药学上可接受的盐的一部分的情况下,可具有多个抗衡离子。因此,药学上可接受的盐可具有一个或多个带电原子和/或一个或多个抗衡离子。“药学上可接受的溶剂合物”或“溶剂合物”指一种或多种溶剂分子和本发明化合物,如示范性化合物或示范性偶联物的结合物。形成药学上可接受的溶剂合物的溶剂例子包括但不限于:水、异丙醇、乙醇、甲醇、DMSO、乙酸乙酯、乙酸和乙醇胺。本文中使用了以下缩写,它们具有以下所示的定义:AE是耳抑素E,Boc是N-(叔丁氧基羰基),Cit是瓜氨酸,dap是dolaproine,DCC是1,3-二环己基碳二亚胺,DCM是二氯甲烷,DEA是二乙胺,DEAD是偶氮二羧酸二乙酯,DEPC是磷酰基氰酸二乙酯,DIAD是偶氮二羧酸二异丙酯,DIEA是N,N-二异丙基乙胺,dil是dolaisoleuine,DMAP是4-二甲基氨基吡啶,DME是乙二醇二甲基醚(或1,2-二甲氧基乙烷),DMF是N,N-二甲基甲酰胺,DMSO是二甲亚砜,doe是dolaphenine,dov是N,N-二甲基缬氨酸,DTNB是5,5’-二硫双(2-硝基苯甲酸),DTPA是二亚乙基三胺五乙酸,DTT是二硫苏糖醇,EDCI是1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐,EEDQ是2-乙氧基-1-乙氧基羰基-1,2-二氢喹啉,ES-MS是电喷射质谱,EtOAc是乙酸乙酯,Fmoc是N-(9-芴基甲氧基羰基),gly是甘氨酸,HATU是O-(7-氮杂苯并三唑-1-基)-N,N,N’,N’-四甲基六氟磷酸脲,HOBt是1-羟基苯并三唑,HPLC是高压液相色谱,ile是异亮氨酸,lys是赖氨酸,MeCN(CH3CN)是乙腈,MeOH是甲醇,Mtr是4-茴香基二苯基甲基(或4-甲氧基三苯甲基),nor是(1S,2R)-(+)-去甲麻黄碱,PAB是对氨基苄基,PBS是磷酸盐缓冲盐水(pH7.4),PEG是聚乙二醇,Ph是苯基,Pnp是对硝基苯基,MC是6-马来酰亚氨基己酰基(马来酰亚氨基己酰基),phe是L-苯丙氨酸,PyBrop是溴代三吡咯烷并六氟磷酸膦,SEC是分子大小排阻色谱,Su是琥珀酰亚胺,TBTU是O-苯并三唑-1-基-N,N,N,N-四甲基四氟硼酸脲,TFA是三氟乙酸,TLC是薄层色谱,UV是紫外线,Val是缬氨酸。本文使用了以下接头缩写,它们具有以下所示的定义:ValCit是蛋白酶可切割接头中的缬氨酸-瓜氨酸二肽位点;PAB是对氨基苄基氨甲酰基;(Me)vc是N-甲基-缬氨酸瓜氨酸,该接头肽键经修饰而防止其被组织蛋白酶B切断;MC(PEG)6-OH是马来酰亚氨基己酰基-聚乙二醇;SPP是N-琥珀酰亚胺基4-(2-吡啶基硫)戊酸酯;SMCC是N-琥珀酰亚胺基4-(N-马来酰亚氨基甲基)环己烷-1羧酸酯。除非文中另有说明,术语“治疗”指治疗性和预防性手段,目的是预防或减慢(减弱)不良生理改变或失调,如癌症发展或蔓延。对于本发明目的,有益或所需的临床结果包括但不限于:可检测或不可检测的症状缓解、疾病程度减轻,疾病状态稳定(即不恶化),疾病进展延迟或减慢,疾病状态改善或减轻,以及缓解(部分或全部)。“治疗”也可指与不接受治疗的预计存活期相比,存活期延长。需要治疗的对象包括已经患有疾病或失调的对象以及倾向于患病或失调的对象或需要预防疾病或失调的对象。在癌症中,术语“治疗”包括以下一种或全部:防止肿瘤细胞、癌细胞或肿瘤生长;防止肿瘤细胞或癌细胞复制,减轻总的肿瘤负荷或减少癌细胞数量,改善该疾病相关的一种或多种症状。在自身免疫病中,术语“治疗”包括以下一种或全部:防止自身免疫病状态相关的细胞(包括但不限于:产生自身免疫性抗体的细胞)复制,减轻自身免疫性抗体负荷,改善自身免疫病的一种或多种症状。在传染病中,术语“治疗”包括以下一种或全部:防止引起传染病的病原体的生长、增殖和复制,改善传染病的一种或多种症状。本文中使用以下细胞毒药物缩写,它们具有以下所示的定义:MMAE是单甲基耳抑素E(MW718);MMAF是N-甲基缬氨酸-缬氨酸-dolaisoleuine-dolaproine-苯丙氨酸(MW731.5);MMAF-DMAEA是C-末端苯丙氨酸酰胺连接的MMAF与DMAEA(二甲基氨基乙胺)(MW801.5);MMAF-TEG是MMAF与酯化到苯丙氨酸上的四乙二醇;MMAF-NtBu是N-叔丁基,作为酰胺连接于MMAF的C-末端;AEVB是耳抑素E戊酰苄基腙,通过AE的C末端的酸不稳定性接头(MW732);AFP是带有耳抑素F的C-末端苯丙氨酸的对亚苯基二胺的单酰胺(MW732)。4.2本发明化合物4.2.1式(Ia)化合物在一个方面,本发明提供具有式Ia的药物-接头-配体偶联物:或其药学上可接受的盐或溶剂合物其中,L-是配体单元;-Aa-Ww-Yy-是接头单元(LU),该接头单元包括:-A-是拉伸单元,a是0或1,-W-各自独立地是氨基酸单元,w是0-12之间的一个整数,-Y-是间隔单元,和y是0、1或2;p的范围是1~约20;和-D是具有式DE和DF的药物单元:其中,各位置独立:R2选自H和C1-C8烷基;R3选自H、C1-C8烷基、C3-C8碳环、芳基、C1-C8烷基-芳基、C1-C8烷基-(C3-C8碳环)、C3-C8杂环和C1-C8烷基-(C3-C8杂环);R4选自H、C1-C8烷基、C3-C8碳环、芳基、C1-C8烷基-芳基、C1-C8烷基-(C3-C8碳环)、C3-C8杂环和C1-C8烷基-(C3-C8杂环);R5选自H和甲基;或者R4和R5连接形成碳环,并具有式-(CRaRb)n-,其中Ra和Rb独立地选自H、C1-C8烷基和C3-C8碳环,n选自2、3、4、5和6;R6选自H和C1-C8烷基;R7选自H、C1-C8烷基、C3-C8碳环、芳基、C1-C8烷基-芳基、C1-C8烷基-(C3-C8碳环)、C3-C8杂环和C1-C8烷基-(C3-C8杂环);R8各自独立地选自H、OH、C1-C8烷基、C3-C8碳环和O-(C1-C8烷基);R9选自H和C1-C8烷基;R10选自芳基或C3-C8杂环;Z是O、S、NH或NR12,其中R12是C1-C8烷基;R11选自H、C1-C20烷基、芳基、C3-C8杂环、-(R13O)m-R14或-(R13O)m-CH(R15)2;m是范围在1-1000之间的一个整数;R13是C2-C8烷基;R14是H或C1-C8烷基;各个出现的R15独立地是H、COOH、-(CH2)n-N(R16)2、-(CH2)n-SO3H或-(CH2)n-SO3-C1-C8烷基;各个出现的R16独立地是H、C1-C8烷基或-(CH2)n-COOH;R18选自-C(R8)2-C(R8)2-芳基、-C(R8)2-C(R8)2-(C3-C8杂环)和-C(R8)2-C(R8)2-(C3-C8碳环);和n是0-6之间的一个整数。在另一实施方式中,本发明提供具有式Ib的药物化合物:或其药学上可接受的盐或溶剂合物,其中:R2选自氢和–C1-C8烷基;R3选自氢、-C1-C8烷基、-C3-C8碳环、芳基、-C1-C8烷基-芳基、-C1-C8烷基-(C3-C8碳环)、-C3-C8杂环和-C1-C8烷基-(C3-C8杂环);R4选自氢、-C1-C8烷基、-C3-C8碳环、-芳基、-C1-C8烷基-芳基、-C1-C8烷基-(C3-C8碳环)、-C3-C8杂环和-C1-C8烷基-(C3-C8杂环),其中R5选自-H和-甲基;或者R4和R5连接具有式-(CRaRb)n-,其中Ra和Rb独立地选自H、-C1-C8烷基和-C3-C8碳环,n选自2、3、4、5和6,并以它们连接的碳原子形成环;R6选自H和-C1-C8烷基;R7选自H、-C1-C8烷基、-C3-C8碳环、芳基、-C1-C8烷基-芳基、-C1-C8烷基-(C3-C8碳环)、-C3-C8杂环和-C1-C8烷基-(C3-C8杂环);R8各自独立地选自H、-OH、-C1-C8烷基、-C3-C8碳环和-O-(C1-C8烷基);R9选自H和-C1-C8烷基;R10选自芳基或-C3-C8杂环;Z是-O-、-S-、-NH-或-NR12-,其中R12是C1-C8烷基;R11选自H、C1-C20烷基、芳基、-C3-C8杂环、-(R13O)m-R14或-(R13O)m-CH(R15)2;m是范围在1-1000之间的一个整数;R13是-C2-C8烷基;R14是H或-C1-C8烷基;各个出现的R15独立地是H、COOH、-(CH2)n-N(R16)2、-(CH2)n-SO3H或-(CH2)n-SO3-C1-C8烷基;各个出现的R16独立地是H、C1-C8烷基或-(CH2)n-COOH;和n是0-6之间的一个整数。在又一实施方式中,本发明提供具有式Ia’的药物-接头-配体偶联物:或其药学上可接受的盐或溶剂合物。其中:Ab是抗体,A是拉伸单元,a是0或1,W各自独立地是氨基酸单元,w是0-12之间的一个整数,Y是间隔单元,和y是0、1或2,p的范围是1~约20,和D是选自式DE和DF的药物部分:其中,在各位置独立地为:R2选自H和C1-C8烷基;R3选自H、C1-C8烷基、C3-C8碳环、芳基、C1-C8烷基-芳基、C1-C8烷基-(C3-C8碳环)、C3-C8杂环和C1-C8烷基-(C3-C8杂环);R4选自H、C1-C8烷基、C3-C8碳环、芳基、C1-C8烷基-芳基、C1-C8烷基-(C3-C8碳环)、C3-C8杂环和C1-C8烷基-(C3-C8杂环);R5选自H和甲基;或者R4和R5连接形成碳环,并具有式-(CRaRb)n-,其中Ra和Rb独立地选自H、C1-C8烷基和C3-C8碳环,n选自2、3、4、5和6;R6选自H和C1-C8烷基;R7选自H、C1-C8烷基、C3-C8碳环、芳基、C1-C8烷基-芳基、C1-C8烷基-(C3-C8碳环)、C3-C8杂环和C1-C8烷基-(C3-C8杂环);R8各自独立地选自H、OH、C1-C8烷基、C3-C8碳环和O-(C1-C8烷基);R9选自H和C1-C8烷基;R10选自芳基或C3-C8杂环;Z是O、S、NH或NR12,其中R12是C1-C8烷基;R11选自H、C1-C20烷基、芳基、C3-C8杂环、-(R13O)m-R14或-(R13O)m-CH(R15)2;m是范围在1-1000之间的一个整数;R13是C2-C8烷基;R14是H或C1-C8烷基;各个出现的R15独立地是H、COOH、-(CH2)n-N(R16)2、-(CH2)n-SO3H或-(CH2)n-SO3-C1-C8烷基;各个出现的R16独立地是H、C1-C8烷基或-(CH2)n-COOH;R18选自-C(R8)2-C(R8)2-芳基、-C(R8)2-C(R8)2-(C3-C8杂环)和-C(R8)2-C(R8)2-(C3-C8碳环);和n是0-6之间的一个整数。Ab是共价连接于一个或多个药物单元的任何抗体。Ab包括与CD30、CD40、CD70、LewisY抗原结合的抗体。在另一实施方式中,Ab不包括与ErbB受体或(1)-(35)中一种或多种受体结合的抗体:(1)BMPR1B(骨形态发生蛋白受体-IB型,Genbank登录号NM_001203);(2)E16(LAT1,SLC7A5,Genbank登录号NM_003486);(3)STEAP1(六次跨膜的前列腺上皮抗原,Genbank登录号NM_012449);(4)0772P(CA125、MUC16,Genbank登录号AF361486);(5)MPF(MPF、MSLN、SMR、巨核细胞强化因子、间皮素,Genbank登录号NM_005823);(6)Napi3b(NAPI-3B、NPTIIb、SLC34A2、溶质运载体家族34(磷酸钠)、成员2、II型钠依赖性磷酸转运蛋白3b,Genbank登录号NM_006424);(7)Sema5b(FLJ10372、KIAA1445、Mm.42015、SEMA5B、SEMAG、脑信号蛋白5bHlog、sema结构域、七个血小板反应蛋白重复序列(1型和1型样)、跨膜结构域(TM)和短胞质结构域、(脑信号蛋白)5B,Genbank登录号AB040878);(8)PSCAhlg(2700050C12Rik、C530008O16Rik、RIKENcDNA2700050C12、RIKENcDNA2700050C12基因,Genbank登录号AY358628);(9)ETBR(内皮缩血管肽B型受体,Genbank登录号AY275463);(10)MSG783(RNF124,假拟蛋白FLJ20315,Genbank登录号NM_017763);(11)STEAP2(HGNC_8639、IPCA-1、PCANAP1、STAMP1、STEAP2、STMP、前列腺癌相关基因1、前列腺癌相关蛋白1、六次跨膜的前列腺上皮抗原2、六次跨膜的前列腺蛋白,Genbank登录号AF455138);(12)TrpM4(BR22450、FLJ20041、TRPM4、TRPM4B、瞬时受体电势阳离子通道、亚家族M、成员4,Genbank登录号NM_017636);(13)CRIPTO(CR、CR1、CRGF、CRIPTO、TDGF1、畸胎癌衍生生长因子,Genbank登录号NP_003203或NM_003212);(14)CD21(CR2(补体受体2)或C3DR(C3d/EB病毒受体)或Hs.73792,Genbank登录号M26004);(15)CD79b(IGb(免疫球蛋白-相关β)、B29,Genbank登录号NM_000626);(16)FcRH2(IFGP4、IRTA4、SPAP1A(含有磷酸酶锚定蛋白1a的SH2结构域)、SPAP1B、SPAP1C,Genbank登录号NM_030764);(17)HER2(Genbank登录号M11730);(18)NCA(Genbank登录号M18728);(19)MDP(Genbank登录号BC017023);(20)IL20Rα(Genbank登录号AF184971);(21)短小蛋白聚糖(Genbank登录号AF229053);(22)Ephb2R(Genbank登录号NM_004442);(23)ASLG659(Genbank登录号AX092328);(24)PSCA(Genbank登录号AJ297436);(25)GEDA(Genbank登录号AY260763);(26)BAFF-R(Genbank登录号NP_443177.1);(27)CD22(Genbank登录号NP-001762.1);(28)CD79a(CD79A,CD79α,免疫球蛋白相关α,与Igβ(CD79B)发生共价作用并在表面与IgM分子形成复合物、转导参与B细胞分化信号的B细胞特异性蛋白,Genbank登录号NP_001774.1);(29)CXCR5(伯基特淋巴瘤受体1,受CXCL13趋化因子活化的G蛋白偶联受体,在淋巴细胞迁移和体液防御中起作用,在HIV-2感染中、也可能在AIDS、淋巴瘤、骨髓瘤和白血病的发展中起作用,Genbank登录号NP_001707.1);(30)HLA-DOB(能与肽结合并将肽提呈给CD4+T淋巴细胞的II型MHC分子的β亚基(Ia抗原),Genbank登录号NP_002111.1);(31)P2X5(嘌呤能受体P2X配体-门控离子通道5,由胞外ATP门控的离子通道,可能参与突触传递和神经发生,缺陷可造成特发性逼尿肌不稳定性的生理病变,Genbank登录号NP_002552.2);(32)CD72(B细胞分化抗原CD72,Lyb-2,Genbank登录号NP_001773.1);(33)LY64(淋巴细胞抗原64(RP105),富含亮氨酸的重复序列(LRR)家族的I型膜蛋白,调节B细胞活化和凋亡,其功能缺失与系统性红斑狼疮患者的疾病活动升高相关,Genbank登录号NP_005573.1);(34)FCRH1(Fc受体样蛋白1,推测为含有C2型Ig样和ITAM结构域的免疫球蛋白Fc结构域的受体,可能在B-淋巴细胞分化中起作用,Genbank登录号NP_443170.1);或(35)IRTA2(免疫球蛋白超家族受体易位相关2,推测在B细胞发育和淋巴瘤发生中可能起作用的免疫受体;在一些B细胞恶性肿瘤中发生易位使该基因失调,Genbank登录号NP_112571.1);在一个实施方式中,-Ww-是-Val-Cit-。在另一实施方式中,R3、R4和R7独立地是异丙基或仲丁基,R5是-H。在示范性实施方式中,R3和R4各自是异丙基,R5是-H,R7是仲丁基。在又一实施方式中,R2和R6各自是甲基,R9是-H。在又一实施方式中,各个出现的R8是-OCH3。在示范性实施方式中,R3和R4各自是异丙基,R2和R6各自是甲基,R5是-H,R7是仲丁基,各个出现的R8是-OCH3,R9是-H。在一个实施方式中,Z是-O-或-NH-。在一个实施方式中,R10是芳基在示范性实施方式中,R10是-苯基。在示范性实施方式中,当Z是-O-时,R11是-H、甲基或叔丁基。在一个实施方式中,当Z是-NH时,R11是-CH(R15)2,其中R15是-(CH2)n-N(R16)2,R16是-C1-C8烷基或-(CH2)n-COOH。在另一实施方式中,当Z是-NH时,R11是-CH(R15)2,其中R15是-(CH2)n-SO3H。在一个方面,Ab是cAC10、cBR96、cS2C6、c1F6、c2F2、hAC10、hBR96、hS2C6、h1F6和h2F2。式Ia的示范性实施方式具有以下结构:其中L是抗体,Val是缬氨酸,Cit是瓜氨酸。p代表药物加载量,即分子(如式Ia、Ia’和Ic分子)中每个抗体(加载)的药物分子平均数量。药物加载量的范围可以是每个配体(如Ab或mAb)1-20个药物(D)。式Ia和式Ia’的组成包括与一系列药物(1-20个)偶联的抗体集合。可用常规方法如质谱、ELISA试验和HPLC特征鉴定偶联反应制品中每个抗体(加载)的药物分子平均数量。也可根据p确定配体-药物-偶联物的数量分布。在一些情况下,分离、纯化和特征分析均一的配体-药物-偶联物,其中p是得自配体-药物-偶联物的某个值,其它药物加载量可用诸如反向HPLC或电泳等方法获得。4.2.2式(Ib)的药物化合物在另一方面,本发明提供具有式(Ib)的药物化合物:或其药学上可接受的盐或溶剂合物,其中:R2选自–氢和–C1-C8烷基;R3选自-氢、-C1-C8烷基、-C3-C8碳环、芳基、-C1-C8烷基-芳基、-C1-C8烷基-(C3-C8碳环)、-C3-C8杂环和-C1-C8烷基-(C3-C8杂环);R4选自-氢、-C1-C8烷基、-C3-C8碳环、-芳基、-C1-C8烷基-芳基、-C1-C8烷基-(C3-C8碳环)、-C3-C8杂环和-C1-C8烷基-(C3-C8杂环),其中R5选自-H和-甲基;或者R4和R5一起具有式-(CRaRb)n-,其中Ra和Rb独立地选自H、-C1-C8烷基和-C3-C8碳环,n选自2、3、4、5和6,并以它们连接的碳原子形成环;R6选自-H和-C1-C8烷基;R7选自-H、-C1-C8烷基、-C3-C8碳环、芳基、-C1-C8烷基-芳基、-C1-C8烷基-(C3-C8碳环)、-C3-C8杂环和-C1-C8烷基-(C3-C8杂环);R8各自独立地选自-H、-OH、-C1-C8烷基、-C3-C8碳环和-O-(C1-C8烷基);R9选自-H和-C1-C8烷基;R10选自芳基或-C3-C8杂环;Z是-O-、-S-、-NH-或-NR12-,其中R12是C1-C8烷基;R11选自–H、C1-C20烷基、芳基、-C3-C8杂环、-(R13O)m-R14或-(R13O)m-CH(R15)2;m是范围在1-1000之间的一个整数;R13是-C2-C8烷基;R14是-H或-C1-C8烷基;各个出现的R15独立地是-H、-COOH、-(CH2)n-N(R16)2、-(CH2)n-SO3H或-(CH2)n-SO3-C1-C8烷基;各个出现的R16独立地是-H、-C1-C8烷基或-(CH2)n-COOH;和n是0-6之间的一个整数。在一个实施方式中,R3、R4和R7独立地是异丙基或仲丁基,R5是-H。在示范性实施方式中,R3和R4各自是异丙基,R5是-H,R7是仲丁基。在另一实施方式中,R2和R6各自是甲基,R9是-H。在又一实施方式中,各个出现的R8是-OCH3。在示范性实施方式中,R3和R4各自是异丙基,R2和R6各自是甲基,R5是-H,R7是仲丁基,各个出现的R8是-OCH3,R9是-H。在一个实施方式中,Z是-O-或-NH-。在一个实施方式中,R10是芳基在示范性实施方式中,R10是-苯基。在示范性实施方式中,当Z是-O-时,R11是–H、甲基或叔丁基。在一个实施方式中,当Z是-NH时,R11是-CH(R15)2,其中R15是-(CH2)n-N(R16)2,R16是-C1-C8烷基或-(CH2)n-COOH。在另一实施方式中,当Z是-NH时,R11是-CH(R15)2,其中R15是-(CH2)n-SO3H。说明性式(Ib)化合物,各化合物可用作ADC中的药物部分(D),包括具有以下结构的化合物:及其药学上可接受的盐或溶剂合物。式(Ic)化合物在另一方面,本发明提供具有式Ic的抗体-药物偶联物(ADC):包含共价连接于一个或多个药物单元(部分)的抗体。抗体-药物偶联物包括其药学上可接受的盐或溶剂合物。式Ic化合物中的定义是:Ab是与一种或多种肿瘤相关抗原受体(1)-(35)结合的抗体:(1)BMPR1B(骨形态发生蛋白受体-IB型,Genbank登录号NM_001203);(2)E16(LAT1,SLC7A5,Genbank登录号NM_003486);(3)STEAP1(六次跨膜的前列腺上皮抗原,Genbank登录号NM_012449);(4)0772P(CA125、MUC16,Genbank登录号AF361486);(5)MPF(MPF、MSLN、SMR、巨核细胞强化因子、间皮素,Genbank登录号NM_005823);(6)Napi3b(NAPI-3B、NPTIIb、SLC34A2、溶质运载体家族34(磷酸钠)、成员2、II型钠依赖性磷酸转运蛋白3b,Genbank登录号NM_006424);(7)Sema5b(FLJ10372、KIAA1445、Mm.42015、SEMA5B、SEMAG、脑信号蛋白5bHlog、sema结构域、七个血小板反应蛋白重复序列(1型和1型样)、跨膜结构域(TM)和短胞质结构域、(脑信号蛋白)5B,Genbank登录号AB040878);(8)PSCAhlg(2700050C12Rik、C530008O16Rik、RIKENcDNA2700050C12、RIKENcDNA2700050C12基因,Genbank登录号AY358628);(9)ETBR(内皮缩血管肽B型受体,Genbank登录号AY275463);(10)MSG783(RNF124,假拟蛋白FLJ20315,Genbank登录号NM_017763);(11)STEAP2(HGNC_8639、IPCA-1、PCANAP1、STAMP1、STEAP2、STMP、前列腺癌相关基因1、前列腺癌相关蛋白1、六次跨膜的前列腺上皮抗原2、六次跨膜的前列腺蛋白,Genbank登录号AF455138);(12)TrpM4(BR22450、FLJ20041、TRPM4、TRPM4B、瞬时受体电势阳离子通道、亚家族M、成员4,Genbank登录号NM_017636);(13)CRIPTO(CR、CR1、CRGF、CRIPTO、TDGF1、畸胎癌衍生生长因子,Genbank登录号NP_003203或NM_003212);(14)CD21(CR2(补体受体2)或C3DR(C3d/EB病毒受体)或Hs.73792,Genbank登录号M26004);(15)CD79b(IGb(免疫球蛋白-相关β)、B29,Genbank登录号NM_000626);(16)FcRH2(IFGP4、IRTA4、SPAP1A(含有磷酸酶锚定蛋白1a的SH2结构域)、SPAP1B、SPAP1C,Genbank登录号NM_030764);(17)HER2(Genbank登录号M11730);(18)NCA(Genbank登录号M18728);(19)MDP(Genbank登录号BC017023);(20)IL20Rα(Genbank登录号AF184971);(21)短小蛋白聚糖(Genbank登录号AF229053);(22)Ephb2R(Genbank登录号NM_004442);(23)ASLG659(Genbank登录号AX092328);(24)PSCA(Genbank登录号AJ297436);(25)GEDA(Genbank登录号AY260763);(26)BAFF-R(Genbank登录号NP_443177.1);(27)CD22(Genbank登录号NP-001762.1);(28)CD79a(CD79A,CD79α,免疫球蛋白相关α,与Igβ(CD79B)发生共价作用并在表面与IgM分子形成复合物、转导参与B细胞分化信号的B细胞特异性蛋白,Genbank登录号NP_001774.1);(29)CXCR5(伯基特淋巴瘤受体1,受CXCL13趋化因子活化的G蛋白偶联受体,在淋巴细胞迁移和体液防御中起作用,在HIV-2感染中、也可能在AIDS、淋巴瘤、骨髓瘤和白血病的发展中起作用,Genbank登录号NP_001707.1);(30)HLA-DOB(能与肽结合并将肽提呈给CD4+T淋巴细胞的II型MHC分子的β亚基(Ia抗原),Genbank登录号NP_002111.1);(31)P2X5(嘌呤能受体P2X配体-门控离子通道5,由胞外ATP门控的离子通道,可能参与突触传递和神经发生,其缺陷可造成特发性逼尿肌不稳定性的生理病变,Genbank登录号NP_002552.2);(32)CD72(B细胞分化抗原CD72,Lyb-2,Genbank登录号NP_001773.1);(33)LY64(淋巴细胞抗原64(RP105),富含亮氨酸的重复序列(LRR)家族的I型膜蛋白,调节B细胞活化和凋亡,其功能缺失与系统性红斑狼疮患者的疾病活动升高相关,Genbank登录号NP_005573.1);(34)FCRH1(Fc受体样蛋白1,推测为含有C2型Ig样和ITAM结构域的免疫球蛋白Fc结构域的受体,可能在B-淋巴细胞分化中起作用,Genbank登录号NP_443170.1);和(35)IRTA2(免疫球蛋白超家族受体易位相关2,推测在B细胞发育和淋巴瘤发生中可能起作用的免疫受体;在一些B细胞恶性肿瘤中发生易位使该基因失调,Genbank登录号NP_112571.1);A是拉伸单元,a是0或1,W各自独立地是氨基酸单元,w是0-12之间的一个整数,Y是间隔单元,和y是0、1或2,p的范围是1~约8,和D是选自式DE和DF的药物部分:其中,DE和DF的波浪线表示与A、W或Y的共价连接位点,各位置相互独立:R2选自H和C1-C8烷基;R3选自H、C1-C8烷基、C3-C8碳环、芳基、C1-C8烷基-芳基、C1-C8烷基-(C3-C8碳环)、C3-C8杂环和C1-C8烷基-(C3-C8杂环);R4选自H、C1-C8烷基、C3-C8碳环、芳基、C1-C8烷基-芳基、C1-C8烷基-(C3-C8碳环)、C3-C8杂环和C1-C8烷基-(C3-C8杂环);R5选自H和甲基;或者R4和R5连接形成碳环,并具有式-(CRaRb)n-,其中Ra和Rb独立地选自H、C1-C8烷基和C3-C8碳环,n选自2、3、4、5和6;R6选自H和C1-C8烷基;R7选自H、C1-C8烷基、C3-C8碳环、芳基、C1-C8烷基-芳基、C1-C8烷基-(C3-C8碳环)、C3-C8杂环和C1-C8烷基-(C3-C8杂环);R8各自独立地选自H、OH、C1-C8烷基、C3-C8碳环和O-(C1-C8烷基);R9选自H和C1-C8烷基;R10选自芳基或C3-C8杂环;Z是O、S、NH或NR12,其中R12是C1-C8烷基;R11选自H、C1-C20烷基、芳基、C3-C8杂环、-(R13O)m-R14或-(R13O)m-CH(R15)2;m是范围在1-1000之间的一个整数;R13是C2-C8烷基;R14是H或C1-C8烷基;各个出现的R15独立地是H、COOH、-(CH2)n-N(R16)2、-(CH2)n-SO3H或-(CH2)n-SO3-C1-C8烷基;各个出现的R16独立地是H、C1-C8烷基或-(CH2)n-COOH;R18选自-C(R8)2-C(R8)2-芳基、-C(R8)2-C(R8)2-(C3-C8杂环)和-C(R8)2-C(R8)2-(C3-C8碳环);和n是0-6之间的一个整数。在一个实施方式中,-Ww-是-Val-Cit-。在另一实施方式中,R3、R4和R7独立地是异丙基或仲丁基,R5是-H。在示范性实施方式中,R3和R4各自是异丙基,R5是-H,R7是仲丁基。在又一实施方式中,R2和R6各自是甲基,R9是-H。在又一实施方式中,各个出现的R8是-OCH3。在示范性实施方式中,R3和R4各自是异丙基,R2和R6各自是甲基,R5是-H,R7是仲丁基,各个出现的R8是-OCH3,R9是-H。在一个实施方式中,Z是-O-或-NH-。在一个实施方式中,R10是芳基。在示范性实施方式中,R10是-苯基。在示范性实施方式中,当Z是-O-时,R11是-H、甲基或叔丁基。在一个实施方式中,当Z是-NH时,R11是-CH(R15)2,其中R15是-(CH2)n-N(R16)2,R16是-C1-C8烷基或-(CH2)n-COOH。在另一实施方式中,当Z是-NH时,R11是-CH(R15)2,其中R15是-(CH2)n-SO3H。式IcADC的示范性实施方式具有以下结构:其中Ab是与一种或多种肿瘤相关抗原受体(1)-(35)结合的抗体;Val是缬氨酸;Cit是瓜氨酸。p代表药物加载量,即式I分子中每个抗体(加载)的药物平均数量。药物加载量的范围可以是每个抗体(如Ab或mAb)1-20个药物(D)。式IADC的组成包括与一系列药物(1-20个)偶联的抗体集合。可用常规方法如UV/可见光光谱法,质谱,ELISA试验和HPLC特征鉴定偶联反应ADC制品中每个抗体(加载)的药物平均数量。也可根据p确定ADC的数量分布。在一些情况下,分离、纯化和特征分析均一的ADC,其中p是得自ADC的某个值,其它药物加载量可用诸如反向HPLC或电泳等方法获得。对于一些抗体-药物偶联物来说,p可能受抗体上连接位点数量的限制。例如,当连接是半胱氨酸的巯基时,如上述示范性实施方式中所述,抗体可仅含有一个或数个半胱氨酸巯基,或可仅含有一个或数个可通过接头连接的具有足够反应活性的巯基。一般地,偶联反应中能与抗体偶联的药物分子数将小于理论上的最大值。例如,抗体可含有不与药物-接头中间体或连接试剂反应的许多赖氨酸残基。仅最具活性的赖氨酸基团可与胺-反应性连接试剂反应。通常,抗体不会含有许多(如果有)可与药物分子连接的游离的反应性半胱氨酸巯基。本发明化合物抗体中大多数半胱氨酸巯基残基以二硫键桥存在,必须用还原剂如二硫苏糖醇(DTT)才能还原。此外,必须将抗体置于变性条件下,以暴露反应性亲核基团如赖氨酸或半胱氨酸。可以几种不同方法控制ADC的加载量(药物/抗体比),包括:(i)相对于抗体限制药物-接头中间体或连接试剂的摩尔量过量,(ii)限制偶联反应的时间或温度,和(iii)部分或限制半胱氨酸巯基修饰的还原条件。应理解,一个以上亲核基团与药物-接头中间体或连接试剂反应,然后与药物分子试剂反应,得到的产物是与抗体连接的分布着一个或多个药物部分的ADC化合物的混合物。可通过抗体特异性和药物特异性的双ELISA抗体试验计算出该混合物中每个抗体(加载)的平均药物数量。该混合物中的单个ADC分子可用质谱鉴定,用HPLC分离,如用疏水性相互作用层析分离(“药物加载量对抗CD30抗体-药物偶联物的药理学、药代动力学和毒性的影响”(Effectofdrugloadingonthepharmacology,pharmacokinetics,andtoxicityofananti-CD30antibody-drugconjugate),Hamblett,K.J.等,摘要号624,美国癌症研究协会(AmericanAssociationforCancerResearch);2004年会,2004年3月27-31日,《AACR论文集》(ProceedingsoftheAACR),第45卷,2004年3月;“控制抗体-药物偶联物中药物连接的位置”(ControllingtheLocationofDrugAttachmentinAntibody-DrugConjugates”,Alley,S.C.等,摘要号627,美国癌症研究协会(AmericanAssociationforCancerResearch);2004年会,2004年3月27-31日,《AACR论文集》(ProceedingsoftheAACR),第45卷,2004年3月)。因此,可利用电泳或层析从偶联混合物中分离得到具有一个加载值的均一ADC。4.3接头单元“接头单元”(LU)是一种双功能化合物,可用于连接药物单元和配体单元以形成药物-接头-配体偶联物,或可用于形成抗肿瘤相关抗原的免疫偶联物。这种免疫偶联物可以将毒性药物选择性递送给肿瘤细胞。在一个实施方式中,药物-接头化合物和药物-接头-配体偶联物的接头单元具有下式:-Aa-Ww-Yy-其中:-A-是拉伸单元;a是0或1;-W-各自独立地是氨基酸单元;w独立地是0-12之间的一个整数,;-Y-是间隔单元;和y是0、1或2。在药物-接头-配体偶联物中,所述接头能够将药物部分和配体单元连接起来。4.3.1拉伸单元拉伸单元(-A-)(当存在时)能够将配体单元与氨基酸单元(-W-)连接起来。在这个方面,配体(L)具有可与拉伸官能团形成连接键的官能团。存在配体上的天然或化学方法产生的有用官能团包括但不限于:巯基(-SH)、氨基、羟基、羧基、糖的异头羟基和羧基。在一个方面,配体的官能团是巯基和氨基。可通过还原配体的分子内二硫键产生巯基。或者,可用2-亚氨基硫烷(iminothiolane)(Traut试剂)或另一种巯基发生剂使配体赖氨酸部分的氨基发生反应生成巯基。在一个实施方式中,拉伸单元与配体单元的硫原子形成连接键。硫原子可来自配体的巯基。在式IIIa和IIIb的方框中描述了本实施方式的代表性拉伸单元,其中L-、-W-、-Y-、-D、w和y的定义如上,R17选自-C1-C10亚烷基-、-C3-C8碳环-、-O-(C1-C8烷基)-、-亚芳基-、-C1-C10亚烷基-亚芳基-、-亚芳基-C1-C10亚烷基-、-C1-C10亚烷基-(C3-C8碳环)-、-(C3-C8碳环)-C1-C10亚烷基-、-C3-C8杂环-、-C1-C10亚烷基-(C3-C8杂环)-、-(C3-C8杂环)-C1-C10亚烷基-、-(CH2CH2O)r-和-(CH2CH2O)r-CH2-;r是1-10之间的一个整数。从式Ia的所有示范性实施方式如III-VI中,应理解即使不明确说明,也可知1-20个药物部分连接于一个配体(p=1-20)。说明性拉伸单元是式IIIa的拉伸单元,其中R17是-(CH2)5-:另一说明性拉伸单元是式IIIa的拉伸单元,其中R17是-(CH2CH2O)r-CH2-;r是2:又一说明性拉伸单元是式IIIb的拉伸单元,其中R17是-(CH2)5-:在另一实施方式中,拉伸单元通过配体单元的硫原子和拉伸单元的硫原子之间的二硫键连接于配体单元。在式IV的方框中描述了本实施方式的代表性拉伸单元,其中R17、L-、-W-、-Y-、-D、w和y的定义如上。在又一实施方式中,拉伸单元的反应性基团含有可与配体的伯氨基或仲氨基形成连接键的反应性位点。这些反应性位点的例子包括但不限于:活化的酯如琥珀酰亚胺酯、4-硝基苯基酯、五氟苯基酯、四氟苯基酯、酸酐、酰基氯、磺酰氯、异氰酸酯和异硫氰酸酯。在式Va和Vb的方框中描述了本实施方式的代表性拉伸单元,其中-R17-、L-、-W-、-Y-、-D、w和y的定义如上;在又一方面,拉伸单元的反应性基团所含反应性位点可与可能存在于配体上的修饰的糖(-CHO)基团起反应。例如,可用试剂如高碘酸钠温和地氧化糖,糖氧化得到的(-CHO)单元可与含有官能团如酰肼、肟、伯胺或仲胺、肼、缩氨基硫脲、肼羧酸酯和芳基酰肼的拉伸单元缩合,如Kaneko,T.等(1991)BioconjugateChem2:133-41所述。在式VIa、VIb和VIc的方框中描述了本实施方式的代表性拉伸单元、其中-R17-、L-、-W-、-Y-、-D、w和y的定义如上。4.3.2氨基酸单元如果存在间隔单元时,此氨基酸单元(-W-)(当存在时)可将拉伸单元连接于间隔单元,如果没有间隔单元时可将拉伸单元连接于药物部分,如果拉伸单元和间隔单元都没有时可将配体单元连接于药物单元。Ww-是二肽、三肽、四肽、五肽、六肽、七肽、八肽、九肽、十肽、十一肽或十二肽单元。-W-单元各自独立地具有以下方框中所示的结构式,w是0-12之间的一个整数:其中R19是氢、甲基、异丙基、异丁基、仲丁基、苄基、对羟基苄基、-CH2OH、-CH(OH)CH3、-CH2CH2SCH3、-CH2CONH2、-CH2COOH、-CH2CH2CONH2、-CH2CH2COOH、-(CH2)3NHC(=NH)NH2、-(CH2)3NH2、-(CH2)3NHCOCH3、-(CH2)3NHCHO、-(CH2)4NHC(=NH)NH2、-(CH2)4NH2、-(CH2)4NHCOCH3、-(CH2)4NHCHO、-(CH2)3NHCONH2、-(CH2)4NHCONH2、-CH2CH2CH(OH)CH2NH2、2-吡啶基甲基-、3-吡啶基甲基-、4-吡啶基甲基-、苯基、环己基,可用一种或多种酶,包括肿瘤相关蛋白酶酶切此氨基酸单元,以释放药物单元(-D),在一个药物单元质子化的实施方式中,体内释放提供了该药物(D)。式(VII)-(IX)代表说明性Ww单元:其中R20和R21如下:其中R20、R21和R22如下:其中R20、R21、R22和R23如下:示范性氨基酸单元包括但不限于:式(VII)单元,其中:R20是苄基,R21是-(CH2)4NH2;R20是异丙基,R21是-(CH2)4NH2;R20是异丙基和R21是-(CH2)3NHCONH2。另一示范性氨基酸单元是式(VIII)的单元,其中R20是苄基,R21是苄基,R22是-(CH2)4NH2。可设计并优化所用的-Ww-单元使它们对特定的酶如肿瘤相关蛋白酶的酶切具有选择性。在一个实施方式中,-Ww–单元是可被组织蛋白酶B、C和D或纤溶蛋白酶催化切割的单元。在一个实施方式中,-Ww-是二肽、三肽、四肽或五肽。当R19、R20、R21、R22或R23不是氢时,R19、R20、R21、R22或R23连接的碳原子是手性碳。R19、R20、R21、R22或R23连接的各个碳原子独立地是(S)或(R)构型。在氨基酸单元的一个方面,此氨基酸单元是缬氨酸-瓜氨酸。在另一方面,此氨基酸单元是苯丙氨酸-赖氨酸(即fk)。在氨基酸单元的又一方面,此氨基酸单元是N-甲基缬氨酸-瓜氨酸。在又一方面,此氨基酸单元是5-氨基戊酸、高苯丙氨酸赖氨酸、四异喹啉羧酸酯赖氨酸、环己基丙氨酸赖氨酸、异哌啶甲酸(isonepecoticacid)赖氨酸、β-丙氨酸赖氨酸、甘氨酸丝氨酸缬氨酸谷氨酰胺和异哌啶甲酸。在某些实施方式中,此氨基酸单元可包含天然氨基酸。在其它实施方式中,此氨基酸单元可包含非天然氨基酸。4.3.3间隔单元当存在氨基酸单元时,此间隔单元(-Y-)(当存在时)将氨基酸单元与药物部分连接在一起。或者当没有氨基酸单元时,此间隔单元将拉伸单元与药物部分连接在一起。当氨基酸单元和拉伸单元都不存在时,此间隔单元也将药物部分与配体单元连接在一起。间隔单元通常有两种类型:自我牺牲型和非自我牺牲型。非自我牺牲型间隔单元是切割,尤其是酶切割药物-接头-配体偶联物或药物-接头化合物的氨基酸单元后,部分或全部间隔单元仍然与药物部分连接的间隔单元。非自我牺牲型间隔单元的例子包括但不限于:(甘氨酸-甘氨酸)间隔单元和甘氨酸间隔单元(见方案1所述)(同上)。当含有甘氨酸-甘氨酸间隔单元或甘氨酸间隔单元的示范性化合物被肿瘤细胞相关蛋白酶、癌细胞相关蛋白酶或淋巴细胞相关蛋白酶酶切时,将甘氨酸-甘氨酸-药物部分或甘氨酸-药物部分与L-Aa-Ww-切断。在一个实施方式中,在靶细胞中发生独立水解反应,将甘氨酸-药物部分连接键切开,释放该药物。在另一实施方式中,-Yy-是对氨基苄基醇(PAB)单元(参见方案2和3),其亚苯基部分被Qm取代,Q是-C1-C8烷基、-O-(C1-C8烷基)、-卤素、-硝基或-氰基;m是0-4之间的一个整数。方案1在一个实施方式中,非自我牺牲型间隔单元(-Y-)是-Gly-Gly-。在另一实施方式中,非自我牺牲型间隔单元(-Y-)是-Gly-。在一个实施方式中,提供不存在间隔单元(y=0)的药物-接头化合物或药物-接头配体偶联物,或其药学上可接受的盐或溶剂合物。或者,含有自我牺牲型间隔单元的示范性化合物无需分步水解而释放-D。在此实施方式中,-Y-是一种PAB基团,通过该PAB基团的氨基氮原子连接于-Ww–,并通过碳酸酯、氨基甲酸酯或醚基直接连接于-D。如果不受限于任何具体理论或机制,方案2描述了通过氨基甲酸酯或碳酸酯基直接连接于-D的PAB基团释放药物的可能机制,这得到Toki等(2002)JOrg.Chem.67:1866-1872的支持。方案2其中Q是-C1-C8烷基,-O-(C1-C8烷基),-卤素,-硝基或-氰基;m是0-4之间的一个整数;p的范围是1~约20。如果不受限于任何具体理论或机制,方案3描述了通过醚或胺连接键直接连接于-D的PAB基团药物释放的可能机制。方案3其中Q是-C1-C8烷基,-O-(C1-C8烷基),-卤素,-硝基或-氰基;m是0-4之间的一个整数;p的范围是1~约20。自我牺牲型间隔单元的其它例子包括但不限于:带电性能类似于PAB基团的芳族化合物,如2-氨基咪唑-5-甲醇衍生物(Hay等(1999)Bioorg.Med.Chem.Lett.9:2237)和邻位或对位氨基苄基缩醛。可采用在酰胺键水解时能环化的间隔单元,如取代的和未取代的4-氨基丁酸酰胺(Rodrigues等,ChemistryBiology,1995,2,223)、合适地取代的双环[2.2.1]和双环[2.2.2]环系统(Storm等,J.Amer.Chem.Soc.,1972,94,5815)和2-氨基苯基丙酸酰胺(Amsberry等,J.Org.Chem.,1990,55,5867)。消除甘氨酸α-位被取代的含胺药物(Kingsbury等,J。Med。Chem.,1984,27,1447)也是用于示范性化合物的自我牺牲型间隔单元的例子。在一个实施方式中,间隔单元是方案4中所述的支链双(羟基甲基)苯乙烯(BHMS)单元,可用于掺入和释放多个药物。方案4其中Q是-C1-C8烷基,-O-(C1-C8烷基),-卤素,-硝基或-氰基;m是0-4之间的一个整数;n是0或1;p的范围是1~约20。在一个实施方式中,-D部分相同。在又一实施方式中,-D部分不同。在一个方面,式(X)-(XII)代表间隔单元(-Yy-):其中Q是-C1-C8烷基,-O-(C1-C8烷基),-卤素,-硝基或-氰基;m是0-4之间的一个整数;式Ia’和Ic抗体-药物偶联物的实施方式包括:其中w和y各自是0,4.4药物单元(部分)抗体-药物偶联物(ADC)的药物部分(D是海兔毒肽/耳抑素类型偶联物(美国专利号5635483;5780588),已证明它们能干扰微管动力学、GTP水解以及核和细胞分裂(Woyke等(2001)Antimicrob.AgentsandChemother.45(12):3580-3584),具有抗癌(美国专利号5663149)和抗真菌活性(Pettit等(1998)Antimicrob.AgentsChemother.42:2961-2965)。D是具有氮原子的药物单元(部分),该氮原子在y=1或2时可与间隔单元形成连接键,在y=0时可与氨基酸单元的C末端羧基形成连接键,在w和y=0时可与拉伸单元的羧基形成连接键,在a、w和y=0时可与药物单元的羧基形成连接键。应理解,在本文中术语“药物单元”和“药物部分”同义,可互换使用。在一个实施方式中,-D是式DE或DF:其中,在各位置独立地为:R2选自H和C1-C8烷基;R3选自H、C1-C8烷基、C3-C8碳环、芳基、C1-C8烷基-芳基、C1-C8烷基-(C3-C8碳环)、C3-C8杂环和C1-C8烷基-(C3-C8杂环);R4选自H、C1-C8烷基、C3-C8碳环、芳基、C1-C8烷基-芳基、C1-C8烷基-(C3-C8碳环)、C3-C8杂环和C1-C8烷基-(C3-C8杂环);R5选自H和甲基;或者R4和R5连接形成碳环,并具有式-(CRaRb)n-,其中Ra和Rb独立地选自H、C1-C8烷基和C3-C8碳环,n选自2、3、4、5和6;R6选自H和C1-C8烷基;R7选自H、C1-C8烷基、C3-C8碳环、芳基、C1-C8烷基-芳基、C1-C8烷基-(C3-C8碳环)、C3-C8杂环和C1-C8烷基-(C3-C8杂环);R8各自独立地选自H、OH、C1-C8烷基、C3-C8碳环和O-(C1-C8烷基);R9选自H和C1-C8烷基;R10选自芳基或C3-C8杂环;Z是O、S、NH或NR12,其中R12是C1-C8烷基;R11选自H、C1-C20烷基、芳基、C3-C8杂环、-(R13O)m-R14或-(R13O)m-CH(R15)2;m是范围在1-1000之间的一个整数;R13是C2-C8烷基;R14是H或C1-C8烷基;各个出现的R15独立地是H、COOH、-(CH2)n-N(R16)2、-(CH2)n-SO3H或-(CH2)n-SO3-C1-C8烷基;各个出现的R16独立地是H、C1-C8烷基或-(CH2)n-COOH;R18选自-C(R8)2-C(R8)2-芳基、-C(R8)2-C(R8)2-(C3-C8杂环)和-C(R8)2-C(R8)2-(C3-C8碳环);和n是0-6之间的一个整数。在一个实施方式中,R3、R4和R7独立地是异丙基或仲丁基,R5是-H。在示范性实施方式中,R3和R4各自是异丙基,R5是H,R7是仲丁基。在另一实施方式中,R2和R6各自是甲基,R9是-H。在又一实施方式中,各个出现的R8是-OCH3。在示范性实施方式中,R3和R4各自是异丙基,R2和R6各自是甲基,R5是H,R7是仲丁基,各个出现的R8是-OCH3,R9是H。在一个实施方式中,Z是-O-或-NH-。在一个实施方式中,R10是芳基在示范性实施方式中,R10是-苯基。在示范性实施方式中,当Z是-O-时,R11是-H、甲基或叔丁基。在一个实施方式中,当Z是-NH时,R11是-CH(R15)2,其中R15是-(CH2)n-N(R16)2,R16是-C1-C8烷基或-(CH2)n-COOH。在另一实施方式中,当Z是-NH时,R11是-CH(R15)2,其中R15是-(CH2)n-SO3H。说明性药物单元(-D)包括具有以下结构的药物单元:及其药学上可接受的盐或溶剂合物。在一个方面,可将亲水基团,例如但不限于如上所示的三乙二醇酯(TEG)连接于药物单元的R11。如果不受限于理论,亲水基团有助于药物单元的内化和不凝聚。4.5配体单元配体单元(L-)的范围包括与给定靶细胞群相关的受体、抗原或其它受体部分结合或反应性缔合或复合的配体单元(L)。配体是与寻求的治疗性或生物学方法修饰的细胞群的一部分结合、复合或反应的分子。在一个方面,配体单元的作用是将药物单元递送给与配体单元反应的特定靶细胞群。这些配体包括但不限于:大分子蛋白如全长抗体、抗体片段、小分子量蛋白、多肽或肽、凝集素、糖蛋白、非肽、维生素、营养转运分子(例如但不限于转铁蛋白)或其它细胞结合分子或物质。配体单元可与拉伸单元、氨基酸单元、间隔单元或药物单元形连接键。配体单元可通过配体的杂原子与接头单元形成连接键。可存在于配体单元上的杂原子包括硫(在一个实施方式中,来自配体的巯基),氧(在一个实施方式中,来自配体的羰基、羧基或羟基)和氮(在一个实施方式中,来自配体的伯氨基或仲氨基)。这些杂原子可存在于天然状态的配体(如天然产生的抗体)上,或者可通过化学修饰引入配体中。在一个实施方式中,配体具有巯基,配体通过此巯基的硫原子连接于接头单元。在又一方面,配体具有一个或多个赖氨酸残基,可化学修饰赖氨酸残基以引入一个或多个巯基。配体单元通过此巯基的硫原子连接于接头单元。可用于修饰赖氨酸的试剂包括但不限于:N-琥珀酰亚胺基S-乙酰基硫代乙酸酯(SATA)和2-亚氨基硫烷盐酸盐(Traut试剂)。在另一实施方式中,配体可具有经化学修饰而导入的一个或多个巯基的糖基团。配体单元通过此巯基的硫原子连接于接头单元,如拉伸单元。在又一实施方式中,配体可具有一个或多个可被氧化产生醛(-CHO)基的糖基团(参见例如,Laguzza等,J.Med.Chem.1989,32(3),548-55)。相应醛可与拉伸单元上的反应位点形成连接键。可与配体的羰基反应的拉伸单元上的反应位点包括但不限于:肼和羟胺。用于修饰蛋白以连接或结合药物单元的其它方案见Coligan等,CurrentProtocolsinProteinScience,第2卷,JohnWiley&Sons(2002),纳入本文作为参考。有用的非免疫反应性蛋白、多肽或肽配体包括但不限于:转铁蛋白、表皮生长因子(“EGF”)、铃蟾肽、胃泌素、胃泌素释放肽、血小板衍生生长因子、IL-2、IL-6、转化生长因子(“TGF”)如TGF-α和TGF-β、牛痘生长因子(“VGF”)、胰岛素和胰岛素样生长因子I和II、凝集素和低密度脂蛋白的脱辅蛋白质。有用的多克隆抗体是获自免疫动物血清的异质抗体分子群。可用本领域熟知的各种方法产生感兴趣抗原的多克隆抗体。例如,为了生产多克隆抗体,可通过注射感兴趣的抗原或其衍生物免疫各种宿主动物,包括但不限于:兔、小鼠、大鼠和豚鼠。可根据宿主种类用各种佐剂来加强免疫应答,这些佐剂包括但不限于:弗氏(完全和不完全)佐剂、矿物凝胶如氢氧化铝、表面活性物质如溶血卵磷脂、普朗尼克多元醇、聚阴离子、肽、油乳化剂、钥孔血蓝素、二硝基酚和可能有用的人佐剂如BCG(卡介菌)和短小棒状杆菌。这些佐剂也是本领域熟知的。有用的单克隆抗体是针对特定抗原决定簇(如癌细胞抗原、病毒抗原、微生物抗原、蛋白、肽、糖、化学物质、核酸、或它们的片段)的抗体的均一群体。可用本领域已知的通过连续培养细胞系产生抗体分子的技术来制备感兴趣抗原的单克隆抗体(mAb)。这些技术包括但不限于:最初由和Milstein(1975,Nature256,495-497)描述的杂交瘤技术,人B细胞杂交瘤技术(Kozbor等,1983,ImmunologyToday4:72),和EBV-杂交瘤技术(Cole等,1985,MonoclonalAntibodiesandCancerTherapy,AlanR.Liss,Inc.,第77-96页)。这些抗体可以是任何免疫球蛋白类型,包括IgG、IgM、IgE、IgA和IgD,以及它们的任何亚型。可在体外或体内培育产生用于本发明的mAb的杂交瘤。有用的单克隆抗体包括但不限于:人单克隆抗体、人源化单克隆抗体、抗体片段或嵌合人-小鼠(或其它物种)单克隆抗体。人单克隆抗体可由本领域已知的任何技术制备(如Teng等,1983,Proc.Natl.Acad.Sci.USA.80,7308-7312;Kozbor等,1983,ImmunologyToday4,72-79;和Olsson等,1982,Meth.Enzymol.92,3-16)。抗体也可以是双特异性抗体。制备双特异性抗体的方法是本领域已知的。全长双特异性抗体的传统生产方法是基于两对免疫球蛋白重链-轻链的共表达,这两条链具有不同特异性(Milstein等,1983,Nature305:537-539)。由于免疫球蛋白重链和轻链的随机配对,这些杂交瘤(四体杂交瘤)可能产生10种不同抗体分子的混合物,其中仅有一种具有正确的双特异性结构。国际公开号WO93/08829和Traunecker等,EMBOJ.10:3655-3659(1991)中描述了类似方法。根据不同方法,将具有所需结合特异性的抗体可变区(抗体-抗原结合位点)与免疫球蛋白恒定区序列融合。优选在免疫球蛋白重链恒定区内融合,以含有至少一部分铰链区、CH2和CH3区。优选在至少一个融合物中使其含有轻链结合所需位点的重链第一恒定区(CH1)。将含有编码免疫球蛋白重链融合物和(如果需要)免疫球蛋白轻链的序列的核酸插入不同的表达载体中,并共转染入合适的宿主生物体。在用于构建的这三条多肽链比例不相等时提供最佳产率的实施方式中,为调整这三条多肽片段的相互比例提供了极大的灵活性。然而,当至少两条多肽链以等比例表达导致高产率或当该比例无特殊意义时,可能将两条或所有三条多肽链的编码序列插入到一个表达载体中。在本方法的一个实施方式中,该双特异性抗体的一条臂为具有第一结合特异性的杂交免疫球蛋白的重链,另一条臂为杂交免疫球蛋白的重链-轻链对(提供第二结合特异性)。此不对称结构有助于使所需双特异性化合物与不需要的免疫球蛋白链组合分离,因为仅在双特异性分子的一半中存在免疫球蛋白轻链,这提供了容易的分离方式(国际公开号WO94/04690),将其全文纳入本文作为参考。产生双特异性抗体的其它详细内容参见例如,Suresh等,MethodsinEnzymology,1986,121:210;Rodrigues等,1993,J.ofImmunology151:6954-6961;Carter等,1992,Bio/Technology10:163-167;Carter等,1995,J.ofHematotherapy4:463-470;Merchant等,1998,NatureBiotechnology16:677-681。采用这些技术,可制备用于治疗或预防本文所述疾病的双特异性抗体。欧洲专利公开号EPA0105360中也描述了双功能抗体。如此参考文献中所述,可用生物手段即细胞融合技术,或化学手段,尤其是交联剂或二硫桥键形成剂产生杂交或双功能抗体,该抗体可包括完整抗体或其一部分。获得这类杂交抗体的方法参见例如国际公开WO83/03679和欧洲专利公开号EPA0217577,将它们纳入本文作为参考。抗体可以是免疫特异性结合癌细胞抗原、病毒抗原或微生物抗原的抗体或者与肿瘤细胞或基质结合的其它抗体的功能活性片段、衍生物或类似物。在这个方面,“功能活性”指该片段、衍生物或类似物能够诱导抗-抗-独特型抗体,它识别的抗原与衍生出该片段、衍生物或类似物的抗体识别的抗原相同。具体说,在一个示范性实施方式中,可通过缺失能特异性识别抗原的CDR序列C末端的构架和CDR来增强免疫球蛋白分子独特型的抗原性。为确定哪个CDR序列结合抗原,可将含有CDR序列的合成肽用于抗原结合试验,所用方法是本领域已知的结合试验方法(如BIA核心试验)(参见例如,Kabat等,1991,《免疫学感兴趣的蛋白序列》(SequencesofProteinsofImmunologicalInterest),第5版,国立卫生研究院(NationalInstituteofHealth),Bethesda,Md;KabatE等,1980,J.ofImmunology125(3):961-969)。其它有用抗体包括抗体片段,例如但不限于:可用胃蛋白酶消化抗体分子产生含有可变区、轻链恒定区和CH1重链结构域的F(ab’)2片段,和可通过还原F(ab’)2片段的二硫桥键产生的Fab片段。其它有用的抗体是抗体的重链和轻链二聚物,或其最小片段,如Fvs或单链抗体(SCA)(如美国专利号4946778;Bird,1988,Science242:423-42;Huston等,1988,Proc.Natl.Acad.Sci.USA85:5879-5883;和Ward等,1989,Nature334:544-54所述),或特异性与抗体相同的其它分子。此外,可用标准重组DNA技术制备含有人和非人部分的重组抗体如嵌合和人源化单克隆抗体是有用的抗体。嵌合抗体是不同部分来源于不同种动物的分子,如具有鼠单克隆可变区和人免疫球蛋白恒定区的分子。(参见例如Cabilly等,美国专利号4816567;和Boss等,美国专利号4,816397,将其全文纳入本文作为参考)。人源化抗体是衍生自非人动物,具有该非人动物的一个或多个互补性决定区(CDR)和人免疫球蛋白分子构架区的抗体分子。(参见例如Queen,美国专利号5,585,089,将其全文纳入本文作为参考)。可用本领域已知的重组DNA技术,例如用以下文献中所述方法来产生这些嵌合单克隆抗体和人源化单克隆抗体:国际公开号WO87/02671;欧洲专利公开号184,187;欧洲专利公开号171496;欧洲专利公开号173494;国际公开号WO86/01533;美国专利号4816567;欧洲专利公开号12,023;Berter等,1988,Science240:1041-1043;Liu等,1987,Proc.Natl.Acad.Sci.USA84:3439-3443;Liu等,1987,J.Immunol.139:3521-3526;Sun等,1987,Proc.Natl.Acad.Sci.USA84:214-218;Nishimura等,1987,Cancer.Res.47:999-1005;Wood等,1985,Nature314:446-449;和Shaw等,1988,J.Natl.CancerInst.80:1553-1559;Morrison,1985,Science229:1202-1207;Oi等,1986,BioTechniques4:214;美国专利号5225539;Jones等,1986,Nature321:552-525;Verhoeyan等(1988)Science239:1534;和Beidler等,1988,J.Immunol.141:4053-4060;各自以全文纳入本文作为参考。完全的人抗体尤其理想,可用不能表达内源性免疫球蛋白重链和轻链基因,但可表达人重链和轻链基因的转基因小鼠生产。以正常方式用选择的抗原如本发明多肽的全部或一部分免疫转基因小鼠。可用常规的杂交瘤技术获得抗该抗原的单克隆抗体。转基因小鼠携带的人免疫球蛋白转基因在B细胞分化期间重排,然后通过类转换和体细胞突变。因此,采用这种技术可能产生治疗上有用的IgG、IgA、IgM和IgE抗体。这种产生人抗体的技术概述参见Lonberg和Huszar(1995,Int.Rev.Immunol.13:65-93)。产生人抗体和人单克隆抗体的此种技术和产生这种抗体的方案的详述参见例如:美国专利号5625126;5633425;5569825;5661016;5545806;各自以全文纳入本文作为参考。可从例如,Abgenix,Inc.(Freemont,CA)和Genpharm(SanJose,CA)购得其它人抗体。可用称为“导向选择”的技术来产生识别所选择表位的完全人抗体。在此方法中,用选择的非人单克隆抗体,如小鼠抗体来指导选择识别相同表位的完全人抗体。(Jespers等(1994)Biotechnology12:899-903)。也可用本领域已知的各种技术,包括噬菌体展示文库来产生人抗体(Hoogenboom和Winter,J.Mol.Biol.,227:381(1991);Marks等,J.Mol.Biol.,222:581(1991);Quan,M.P.和Carter,P.2002.产生用作治疗的单克隆抗体(Theriseofmonoclonalantibodiesastherapeutics).刊于《抗IgE和变应性疾病》(Anti-IgEandAllergicDisease),Jardieu,P.M.和FickJr.,R.B编,MarcelDekker,NewYork,NY,第20章,第427–469页)。在其它实施方式中,所述抗体是抗体或其功能活性片段的融合蛋白,例如,某抗体通过共价键(如肽键)在N-末端或C-末端与不是该抗体的另一蛋白的氨基酸序列(或其部分,优选该蛋白的至少10、20或50个氨基酸部分)融合。抗体或其片段优选在恒定区的N-末端共价连接于其它蛋白。这些抗体包括通过共价连接任何类型的分子修饰的抗体类似物和衍生物,只要这种共价连接允许抗体保持其抗原结合免疫特异性。例如但不限于,所述抗体的衍生物和类似物包括,如通过糖基化、乙酰化、聚乙二醇化(pegylation)、磷酸化、酰胺化、用已知的保护/封闭基团衍生化、蛋白水解切割、连接于细胞抗体单元或其它蛋白等作进一步修饰。可用已知技术进行多种化学修饰中的任何一种,这些技术包括但不限于:特异性化学切割、乙酰化、甲酰化、在衣霉素的存在下代谢合成等。此外,所述类似物或衍生物可含有一个或多个非天然氨基酸。所述抗体包括氨基酸残基中含有能与Fc受体相互作用的修饰(如取代、缺失或加入)的抗体。具体说,这些抗体包括经鉴定含有参与抗-Fc结构域和FcRn受体之间的相互作用的氨基酸残基修饰的抗体(参见例如国际公开号WO97/34631,将其全文纳入本文作为参考)。对癌细胞抗原有免疫特异性的抗体可购自,例如Genentech(SanFrancisco,CA)或由本领域技术人员已知的方法,如化学合成或重组表达技术生产。编码对癌细胞抗原有免疫特异性的抗体的核苷酸序列可获自,如GenBank数据库或类似数据库、发表文献或作常规克隆和测序。在特定实施方式中,可使用已知用于治疗和预防癌症的抗体。对癌细胞抗原有免疫特异性的抗体可购得或由本领域技术人员用已知方法如重组表达技术生产。编码对癌细胞抗原有免疫特异性的抗体的核苷酸序列可获自,如GenBank数据库或类似数据库、发表文献或作常规克隆和测序。可用于治疗癌症的抗体例子包括但不限于:用于治疗转移型乳腺癌患者的人源化抗-HER2单克隆抗体贺赛汀(曲妥珠单抗;Genentech);用于治疗非霍奇金淋巴瘤患者的嵌合性抗-CD20单克隆抗体利妥昔(利妥昔单抗;Genentech);用于治疗卵巢癌的鼠抗体OvaRex(AltaRexCorporation,MA);用于治疗结肠直肠癌的鼠IgG2a抗体单抗17-1A(GlaxoWellcome,NC);用于治疗表皮生长因子阳性癌症如头颈癌的抗EGFRIgG嵌合抗体西妥昔单抗艾比特斯(ImcloneSystemsInc.,NY);用于治疗肉瘤的人源化抗体Vitaxin(MedImmune,Inc.,MD);用于治疗慢性淋巴细胞白血病(CLL)的人源化IgG1抗体坎帕斯I/H(Leukosite,MA);用于治疗急性髓细胞白血病(AML)的人源化抗-CD33IgG抗体SmartMI95(ProteinDesignLabs,Inc.,CA);用于治疗非霍奇金淋巴瘤的人源化抗-CD22IgG抗体LymphoCide(Immunomedics,Inc.,NJ);用于治疗非霍奇金淋巴瘤的人源化抗-HLA-DR抗体SmartID10(ProteinDesignLabs,Inc.,CA);用于治疗非霍奇金淋巴瘤的放射性同位素标记的鼠抗-HLA-Dr10抗体Oncolym(Techniclone,Inc.,CA);用于治疗霍奇金病或非霍奇金淋巴瘤的人源化抗CD2单克隆抗体Allomune(BioTransplant,CA);用于治疗肺癌和结肠直肠癌的抗VEGF人源化抗体阿瓦斯丁(Genentech,Inc.,CA);用于治疗非霍奇金淋巴瘤的抗CD22抗体依帕珠单抗(Immunomedics,Inc.,NJ和Amgen,CA);用于治疗结肠直肠癌的人源化抗CEA抗体CEAcide(Immunomedics,NJ)。用于治疗癌症的其它抗体包括但不限于抗以下抗原的抗体:CA125(卵巢)、CA15-3(癌)、CA19-9(癌)、L6(癌)、LewisY(癌)、LewisX(癌)、甲胎蛋白(癌)、CA242(结直肠)、胎盘碱性磷酸酶(癌)、前列腺特异性抗原(前列腺)、前列酸(prostaticacid)磷酸酶(前列腺)、表皮生长因子(癌)、MAGE-1(癌)、MAGE-2(癌)、MAGE-3(癌)、MAGE-4(癌)、抗转铁蛋白受体(癌)、p97(黑色素瘤)、MUC1-KLH(乳腺癌)、CEA(结直肠)、gp100(黑色素瘤)、MART1(黑色素瘤)、PSA(前列腺)、IL-2受体(T细胞白血病和淋巴瘤)、CD20(非霍奇金淋巴瘤)、CD52(白血病)、CD33(白血病)、CD22(淋巴瘤)、人绒毛膜促性腺素(癌)、CD38(多发性骨髓瘤)、CD40(淋巴瘤)、粘蛋白(癌)、P21(癌)、MPG(黑色素瘤)和Neu癌基因产物(癌)。一些有用的特异性抗体包括但不限于:BR96mAb(Trail,P.A.,Willner,D.,Lasch,S.J.,Henderson,A.J.,Hofstead,S.J.,Casazza,A.M.,Firestone,R.A.,I.,K.E.,“用BR96-多柔比星免疫偶联物治愈异种移植的人癌”(CureofXenograftedHumanCarcinomasbyBR96-DoxorubicinImmunoconjugates)Science1993,261,212-215),BR64(Trail,PA,Willner,D,Knipe,J.,Henderson,A.J.,Lasch,S.J.,Zoeckler,M.E.,Trailsmith,M.D.,Doyle,T.W.,King,H.D.,Casazza,A.M.,Braslawsky,G.R.,Brown,J.P.,Hofstead,S.J.,Greenfield,R.S.,Firestone,R.A.,Mosure,K.,Kadow,D.F.,Yang,M.B.,Hellstrom,K.E.和Hellstrom,I.“接头改变对癌反应性BR64-多柔比星免疫偶联物的稳定性、潜能和效果的影响”(EffectofLinkerVariationontheStability,Potency,andEfficacyofCarcinoma-reactiveBR64-DoxorubicinImmunoconjugates)CancerResearch1997,57,100-105,抗CD40抗原的单克隆抗体如S2C6单抗(Francisco,J.A.,Donaldson,K.L.,Chace,D.,Siegall,C.B.和Wahl,A.F.“抗CD-40抗体SGN-14的激动性能和体内抗肿瘤活性”(Agonisticpropertiesandinvivoantitumoractivityoftheanti-CD-40antibody,SGN-14)CancerRes.2000,60,3225-3231),抗CD70抗原的单克隆抗体,如1F6单抗和2F2单抗,以及抗CD30抗原的单克隆抗体,如AC10(Bowen,M.A.,Olsen,K.J.,Cheng,L.,Avila,D.和Podack,E.R.“大颗粒性淋巴瘤细胞系YT上CD30的功能作用”(FunctionaleffectsofCD30onalargegranularlymphomacelllineYT)J.Immunol.,151,5896-5906,1993:Wahl等,2002CancerRes.62(13):3736-42)。可采用结合肿瘤相关抗原的许多其它内化抗体,它们的综述如下(Franke,A.E.,Sievers,E.L.和Scheinberg,D.A.,“急性髓细胞白血病的细胞表面受体靶向治疗:综述”(Cellsurfacereceptor-targetedtherapyofacutemyeloidleukemia:areview)CancerBiotherRadiopharm.2000,15,459-76;Murray,J.L.,“单克隆抗体治疗实体瘤:即将来临的时代”(Monoclonalantibodytreatmentofsolidtumors:acomingofage)SeminOncol.2000,27,64-70;Breitling,F.和Dubel,S.,《重组抗体》(RecombinantAntibodies),JohnWileyandSons,NewYork,1998)。在某些实施方式中,所述抗体不是曲妥珠单抗(全长,人源化抗HER2(MW145167)),贺赛汀F(ab’)2(用酶学方法衍生自抗HER2(MW100000)),4D5(全长,鼠抗HER2,得自杂交瘤),rhu4D5(瞬时表达的全长人源化抗体),rhuFab4D5(重组人源化Fab(MW47738)),4D5Fc8(全长,鼠抗HER2,具有突变的FcRn结合域)或Hg(“无铰链”全长人源化4D5,重链铰链区的半胱氨酸突变为丝氨酸,在大肠杆菌中表达(因此非糖基化))。在另一特定实施方式中,根据本发明组合物和方法使用治疗或预防自身免疫病的抗体。对负责产生自身免疫性抗体的细胞的抗原免疫特异的抗体可获自任何组织机构(如大学科学家或公司),或由本领域技术人员用已知方法如化学合成或重组表达技术产生。在另一实施方式中,用于治疗自身免疫病的抗体是免疫特异性的,包括但不限于:抗核抗体;抗dsDNA;抗ssDNA,抗心磷脂抗体IgM、IgG;抗磷脂抗体IgM、IgG;抗SM抗体;抗线粒体抗体;甲状腺抗体;微粒体抗体;甲状腺球蛋白抗体;抗SCL-70;抗Jo;抗U1RNP;抗La/SSB;抗SSA;抗SSB;抗壁细胞(PeritalCell)抗体;抗组蛋白;抗RNP;C-ANCA;P-ANCA;抗着丝粒;抗核仁纤维蛋白和抗GBM抗体。在某些实施方式中,有用抗体可结合表达在活化淋巴细胞上的受体或受体复合物。所述受体或受体复合物可包含免疫球蛋白基因超家族成员、TNF受体超家族成员、整联蛋白、细胞因子受体、趋化因子受体、主要组织相容性蛋白、凝集素或补体控制蛋白。合适的免疫球蛋白超家族成员的非限制性例子是:CD2、CD3、CD4、CD8、CD19、CD22、CD28、CD79、CD90、CD152/CTLA-4、PD-1和ICOS。合适的TNF受体超家族成员的非限制性例子是:CD27、CD40、CD95/Fas、CD134/OX40、CD137/4-1BB、TNF-R1、TNFR-2、RANK、TACI、BCMA、护骨素(osteoprotegerin)、Apo2/TRAIL-R1、TRAIL-R2、TRAIL-R3、TRAIL-R4和APO-3。合适的整联蛋白的非限制性例子是:CD11a、CD11b、CD11c、CD18、CD29、CD41、CD49a、CD49b、CD49c、CD49d、CD49e、CD49f、CD103和CD104。合适的凝集素的非限制性例子是C型、S型和I型凝集素。在一个实施方式中,所述配体能结合与自身免疫病相关的活化淋巴细胞。在另一特定实施方式中,对病毒或微生物抗原具有免疫特异性的有用配体是单克隆抗体。该抗体可以是嵌合性、人源化或人单克隆抗体。本文所用术语“病毒抗原”包括但不限于:能够引起免疫应答反应的任何病毒肽、多肽蛋白(如HIVgp120、HIVnef、RSVF糖蛋白、流感病毒神经氨酸酶、流感病毒血凝素、HTLVtax、单纯疱疹病毒糖蛋白(如gB、gC、gD和gE)和乙肝表面抗原)。本文所用术语“微生物抗原”包括但不限于:能够引起免疫应答反应的任何微生物肽、多肽、蛋白、糖、多糖或脂质分子(如细菌、真菌、致病性原生动物或酵母多肽包括例如LPS和荚膜多糖5/8)。病毒或微生物抗原的免疫特异性抗体可购自,例如BDBiosciences(SanFrancisco,CA),ChemiconInternational,Inc.(Temecula,CA)或VectorLaboratories,Inc.(Burlingame,CA),或由本领域技术人员用已知方法如化学合成或重组表达技术产生。编码病毒或微生物抗原的免疫特异性抗体的核苷酸序列可获自,例如GenBank数据库或类似数据库、发表文献,或作常规克隆和测序。在一特定实施方式中,有用配体是根据本文所公开的方法可用于治疗或预防病毒或微生物感染的配体。可用于治疗病毒感染或微生物感染的抗体的例子包括但不限于:用于治疗感染RSV的患者的人源化抗呼吸道合胞病毒(RSV)单克隆抗体SYNAGIS(MedImmune,Inc.,MD);用于治疗HIV感染的CD4融合抗体PRO542(Progenics);用于治疗乙肝病毒的人抗体OSTAVIR(ProteinDesignLabs,Inc.,CA);用于治疗巨细胞病毒(CMV)的人源化IgG1抗体PROTOVIR(ProteinDesignLabs,Inc.,CA);和抗LPS抗体。用于治疗传染病的其它抗体包括但不限于:抗以下病原体的抗原的抗体:致病性细菌菌株(酿脓链球菌(Streptococcuspyogenes),肺炎链球菌(Streptococcuspneumoniae),淋病奈瑟氏球菌(Neisseriagonorrheae),脑膜炎奈瑟氏球菌(Neisseriameningitides),白喉棒杆菌(Corynebacteriumdiphtheriae),肉毒梭菌(Clostridiumbotulinum),产气荚膜羧菌(Clostridiumperfringens),破伤风梭菌(Clostridiumtetani),流感嗜血杆菌(Hemophilusinfluenzae),肺炎克雷伯氏菌(Klebsiellapneumoniae),肺炎克雷伯氏菌臭鼻亚种(Klebsiellaozaenas),肺炎克雷伯氏菌鼻硬结亚种(Klebsiellarhinoscleromotis),金黄色葡萄球菌(Staphylococcaureus),霍乱弧菌(Vibriocolerae),大肠埃希氏菌(Escherichiacoli),铜绿假单胞菌(Pseudomonasaeruginosa),胚胎弯曲杆菌(Campylobacterfetus)(弧菌(Vibrio)),嗜水性气单胞菌(Aeromonashydrophila),蜡状芽孢杆菌(Bacilluscereus),迟钝爱德华氏菌(Edwardsiellatarda),小肠结肠炎耶尔森氏菌(Yersiniaenterocolitica),鼠疫耶尔森氏菌(Yersiniapestis),假结核耶尔森氏菌(Yersiniapseudotuberculosis),痢疾志贺氏菌(Shigelladysenteriae),弗氏志贺氏菌(Shigellaflexneri),索氏志贺氏菌(Shigellasonnei),鼠伤寒沙门氏菌(Salmonellatyphimurium),苍白密螺旋体(Treponemapallidum),极细密螺旋体(Treponemapertenue),斑点病密螺旋体(Treponemacarateneum),奋森氏疏螺旋体(Borreliavincentii),布氏疏螺旋体(Borreliaburgdorferi),出血黄疸钩端螺旋体(Leptospiraicterohemorrhagiae),结核分枝杆菌(Mycobacteriumtuberculosis),卡氏肺孢子虫(Pneumocystiscarinii),土拉热弗朗西丝氏菌(Francisellatularensis),流产布鲁氏菌(Brucellaabortus),猪布鲁氏菌(Brucellasuis),马尔他布鲁氏菌(Brucellamelitensis),分枝杆菌某些种(Mycoplasmaspp.),普氏立克次氏体(Rickettsiaprowazeki),Rickettsiatsutsugumushi,衣原体属某些种(Chlamydiaspp.));致病性真菌(粗球孢子菌(Coccidioidesimmitis),烟曲霉(Aspergillusfumigatus),白色假丝酵母(Candidaalbicans),皮炎芽生菌(Blastomycesdermatitidis),新型隐球菌(Cryptococcusneoformans),荚膜组织胞浆菌(Histoplasmacapsulatum));原生动物(痢疾阿米巴虫(Entomoebahistolytica),刚地弓形虫(Toxoplasmagondii),口腔毛滴虫(Trichomonastenas),人毛滴虫(Trichomonashominis),阴道毛滴虫(Trichomonasvaginalis),冈比亚毛滴虫(Tryoanosomagambiense),罗得西亚毛滴虫(Trypanosomarhodesiense),枯氏毛滴虫(Trypanosomacruzi),杜氏利什曼原虫(Leishmaniadonovani),热带利什曼原虫(Leishmaniatropica),巴西利什曼原虫(Leishmaniabraziliensis),肺炎肺孢子虫(Pneumocystispneumonia),间日疟原虫(Plasmodiumvivax),恶性疟原虫(Plasmodiumfalciparum),三日疟原虫(Plasmodiummalaria));或寄生虫(蠕形住肠线虫(Enterobiusvermicularis),毛首鞭形线虫(Trichuristrichiura),似蚓蛔线虫(Ascarislumbricoides),旋毛形线虫(Trichinellaspiralis),粪类圆线虫(Strongyloidesstercoralis),日本血吸虫(Schistosomajaponicum),曼氏血吸虫(Schistosomamansoni),埃及血吸虫(Schistosomahaematobium)和钩虫)。用于本发明治疗病毒疾病的其它抗体包括但不限于:抗致病性病毒抗原的抗体,包括例如但不限于:痘病毒科、疱疹病毒科、单纯疱疹病毒1、单纯疱疹病毒2、腺病毒科、乳头瘤病毒科、肠道病毒科、小核糖核酸病毒科、细小病毒科、呼吸道肠道病毒科、逆转录病毒科、流感病毒、副流感病毒、腮腺炎、麻疹、呼吸道合胞病毒、风疹、虫媒病毒科、杆状病毒科、沙粒病毒科、甲肝病毒、乙肝病毒、丙肝病毒、戊肝病毒、非甲/非乙肝炎病毒、鼻病毒科、冠状病毒科、轮状病毒科和人免疫缺陷病毒。在尝试发现用于癌症诊断和治疗的有效分子靶点中,研究者已设法鉴定到与一种或多种正常的非癌细胞相比,在一种或多种特定类型的癌细胞表面上特异性表达的跨膜或肿瘤相关多肽。与非癌细胞表面相比,这种肿瘤相关多肽在癌细胞表面的表达更丰富。对这种肿瘤相关细胞表面抗原多肽的鉴定导致能够通过抗体疗法特异性靶向癌细胞以摧毁癌细胞。含有式Ic抗体-药物偶联物(ADC)中的Ab而可用于治疗癌症的抗体包括但不限于:抗肿瘤相关抗原(TAA)的抗体。这种肿瘤相关抗原是本领域已知的,并可制备用于用本领域熟知的方法和信息来产生抗体。TAA的例子包括(1)-(35),但不限于下述TAA(1)-(35)。为了方便,本领域已知的关于这些抗原的信息见下,包括名称、替代名称、Genbank登录号和主要参考文献。抗体靶向的肿瘤相关抗原包括与相对于所列相应序列(SEQIDNO:1-35)中鉴定到的序列或引用文献中鉴定到的序列具有序列相同性至少约70%、80%、85%、90%或95%的所有氨基酸序列变体和同种型。在一些实施方式中,具有氨基酸序列变体的TAA的生物特性基本相同,或其特征与具有所列相应序列(SEQIDNO:1-35)中发现的序列的TAA相同。例如,具有变体序列的TAA通常能够特异性结合于与具有所列相应序列的TAA特异性结合的抗体。特别将本文中特别引用的序列和内容纳入本文作为参考。肿瘤相关抗原(1)-(35):(1)BMPR1B(骨形态发生蛋白受体-IB型,Genbank登录号NM_001203,tenDijke,P.等Science264(5155):101-104(1994),Oncogene14(11):1377-1382(1997));WO2004063362(权利要求2);WO2003042661(权利要求12);US2003134790-A1(第38-39页);WO2002102235(权利要求13;第296页);WO2003055443(第91-92页);WO200299122(实施例2;第528-530页);WO2003029421(权利要求6);WO2003024392(权利要求2;图112);WO200298358(权利要求1;第183页);WO200254940(第100-101页);WO200259377(第349-350页);WO200230268(权利要求27;第376页);WO200148204(实施例;图4)NP_001194骨形态发生蛋白受体,IB型/pid=NP_001194.1-交叉参考:MIM:603248;NP_001194.1;NM_001203_1502aaMLLRSAGKLNVGTKKEDGESTAPTPRPKVLRCKCHHHCPEDSVNNICSTDGYCFTMIEEDDSGLPVVTSGCLGLEGSDFQCRDTPIPHQRRSIECCTERNECNKDLHPTLPPLKNRDFVDGPIHHRALLISVTVCSLLLVLIILFCYFRYKRQETRPRYSIGLEQDETYIPPGESLRDLIEQSQSSGSGSGLPLLVQRTIAKQIQMVKQIGKGRYGEVWMGKWRGEKVAVKVFFTTEEASWFRETEIYQTVLMRHENILGFIAADIKGTGSWTQLYLITDYHENGSLYDYLKSTTLDAKSMLKLAYSSVSGLCHLHTEIFSTQGKPAIAHRDLKSKNILVKKNGTCCIADLGLAVKFISDTNEVDIPPNTRVGTKRYMPPEVLDESLNRNHFQSYIMADMYSFGLILWEVARRCVSGGIVEEYQLPYHDLVPSDPSYEDMREIVCIKKLRPSFPNRWSSDECLRQMGKLMTECWAHNPASRLTALRVKKTLAKMSESQDIKL(SEQIDNO:1)(2)E16(LAT1、SLC7A5,Genbank登录号NM_003486);Biochem.Biophys.Res.Commun.255(2),283-288(1999),Nature395(6699):288-291(1998),Gaugitsch,H.W.等(1992)J.Bio.Chem.267(16):11267-11273);WO2004048938(实施例2);WO2004032842(实施例IV);WO2003042661(权利要求12);WO2003016475(权利要求1);WO200278524(实施例2);WO200299074(权利要求19;第127-129页);WO200286443(权利要求27;第222、393页);WO2003003906(权利要求10;第293页);WO200264798(权利要求33;第93-95页);WO200014228(权利要求5;第133-136页);US2003224454(图3);WO2003025138(权利要求12;第150页);NP_003477溶质运载体家族7(阳离子氨基酸转运子,y+系统),成员5/pid=NP_003477.3–智人交叉参考:MIM:600182;NP_003477.3;NM_015923;NM_003486_1507aaMAGAGPKRRALAAPAAEEKEEAREKMLAAKSADGSAPAGEGEGVTLQRNITLLNGVAIIVGTIIGSGIFVTPTGVLKEAGSPGLALVVWAACGVFSIVGALCYAELGTTISKSGGDYAYMLEVYGSLPAFLKLWIELLIIRPSSQYIVALVFATYLLKPLFPTCPVPEEAAKLVACLCVLLLTAVNCYSVKAATRVQDAFAAAKLLALALIILLGFVQIGKGVVSNLDPNFSFEGTKLDVGNIVLALYSGLFAYGGWNYLNFVTEEMINPYRNLPLAIIISLPIVTLVYVLTNLAYFTTLSTEQMLSSEAVAVDFGNYHLGVMSWIIPVFVGLSCFGSVNGSLFTSSRLFFVGSREGHLPSILSMIHPQLLTPVPSLVFTCVMTLLYAFSKDIFSVINFFSFFNWLCVALAIIGMIWLRHRKPELERPIKVNLALPVFFILACLFLIAVSFWKTPVECGIGFTIILSGLPVYFFGVWWKNKPKWLLQGIFSTTVLCQKLMQVVPQET(SEQIDNO:2)(3)STEAP1(六次跨膜的前列腺上皮抗原,Genbank登录号NM_012449CancerRes.61(15),5857-5860(2001),Hubert,R.S.等(1999)Proc.Natl.Acad.Sci.USA.96(25):14523-14528);WO2004065577(权利要求6);WO2004027049(图1L);EP1394274(实施例11);WO2004016225(权利要求2);WO2003042661(权利要求12);US2003157089(实施例5);US2003185830(实施例5);US2003064397(图2);WO200289747(实施例5;第618-619页);WO2003022995(实施例9;图13A,实施例53;第173页,实施例2;图2A);NP_036581六次跨膜的前列腺上皮抗原交叉参考:MIM:604415;NP_036581.1;NM_012449_1339aaMESRKDITNQEELWKMKPRRNLEEDDYLHKDTGETSMLKRPVLLHLHQTAHADEFDCPSELQHTQELFPQWHLPIKIAAIIASLTFLYTLLREVIHPLATSHQQYFYKIPILVINKVLPMVSITLLALVYLPGVIAAIVQLHNGTKYKKFPHWLDKWMLTRKQFGLLSFFFAVLHAIYSLSYPMRRSYRYKLLNWAYQQVQQNKEDAWIEHDVWRMEIYVSLGIVGLAILALLAVTSIPSVSDSLTWREFHYIQSKLGIVSLLLGTIHALIFAWNKWIDIKQFVWYTPPTFMIAVFLPIVVLIFKSILFLPCLRKKILKIRHGWEDVTKINKTEICSQL(SEQIDNO3)(4)0772P(CA125、MUC16、Genbank登录号AF361486J.Bio.Chem.276(29):27371-27375(2001));WO2004045553(权利要求14);WO200292836(权利要求6;图12);WO200283866(权利要求15;第116-121页);US2003124140(实施例16);US2003091580(权利要求6);WO200206317(权利要求6;第400-408页);交叉参考:GI:34501467;AAK74120.3;AF361486_16995aaPVTSLLTPGLVITTDRMGISREPGTSSTSNLSSTSHERLTTLEDTVDTEAMQPSTHTAVTNVRTSISGHESQSSVLSDSETPKATSPMGTTYTMGETSVSISTSDFFETSRIQIEPTSSLTSGLRETSSSERISSATEGSTVLSEVPSGATTEVSRTEVISSRGTSMSGPDQFTISPDISTEAITRLSTSPIMTESAESAITIETGSPGATSEGTLTLDTSTTTFWSGTHSTASPGFSHSEMTTLMSRTPGDVPWPSLPSVEEASSVSSSLSSPAMTSTSFFSTLPESISSSPHPVTALLTLGPVKTTDMLRTSSEPETSSPPNLSSTSAEILATSEVTKDREKIHPSSNTPVVNVGTVIYKHLSPSSVLADLVTTKPTSPMATTSTLGNTSVSTSTPAFPETMMTQPTSSLTSGLREISTSQETSSATERSASLSGMPTGATTKVSRTEALSLGRTSTPGPAQSTISPEISTETITRISTPLTTTGSAEMTITPKTGHSGASSQGTFTLDTSSRASWPGTHSAATHRSPHSGMTTPMSRGPEDVSWPSRPSVEKTSPPSSLVSLSAVTSPSPLYSTPSESSHSSPLRVTSLFTPVMMKTTDMLDTSLEPVTTSPPSMNITSDESLATSKATMETEAIQLSENTAVTQMGTISARQEFYSSYPGLPEPSKVTSPVVTSSTIKDIVSTTIPASSEITRIEMESTSTLTPTPRETSTSQEIHSATKPSTVPYKALTSATIEDSMTQVMSSSRGPSPDQSTMSQDISTEVITRLSTSPIKTESTEMTITTQTGSPGATSRGTLTLDTSTTFMSGTHSTASQGFSHSQMTALMSRTPGEVPWLSHPSVEEASSASFSLSSPVMTSSSPVSSTLPDSIHSSSLPVTSLLTSGLVKTTELLGTSSEPETSSPPNLSSTSAEILATTEVTTDTEKLEMTNVVTSGYTHESPSSVLADSVTTKATSSMGITYPTGDTNVLTSTPAFSDTSRIQTKSKLSLTPGLMETSISEETSSATEKSTVLSSVPTGATTEVSRTEAISSSRTSIPGPAQSTMSSDTSMETITRISTPLTRKESTDMAITPKTGPSGATSQGTFTLDSSSTASWPGTHSATTQRFPRSVVTTPMSRGPEDVSWPSPLSVEKNSPPSSLVSSSSVTSPSPLYSTPSGSSHSSPVPVTSLFTSIMMKATDMLDASLEPETTSAPNMNITSDESLAASKATTETEAIHVFENTAASHVETTSATEELYSSSPGFSEPTKVISPVVTSSSIRDNMVSTTMPGSSGITRIEIESMSSLTPGLRETRTSQDITSSTETSTVLYKMPSGATPEVSRTEVMPSSRTSIPGPAQSTMSLDISDEVVTRLSTSPIMTESAEITITTQTGYSLATSQVTLPLGTSMTFLSGTHSTMSQGLSHSEMTNLMSRGPESLSWTSPRFVETTRSSSSLTSLPLTTSLSPVSSTLLDSSPSSPLPVTSLILPGLVKTTEVLDTSSEPKTSSSPNLSSTSVEIPATSEIMTDTEKIHPSSNTAVAKVRTSSSVHESHSSVLADSETTITIPSMGITSAVEDTTVFTSNPAFSETRRIPTEPTFSLTPGFRETSTSEETTSITETSAVLFGVPTSATTEVSMTEIMSSNRTHIPDSDQSTMSPDIITEVITRLSSSSMMSESTQMTITTQKSSPGATAQSTLTLATTTAPLARTHSTVPPRFLHSEMTTLMSRSPENPSWKSSPFVEKTSSSSSLLSLPVTTSPSVSSTLPQSIPSSSFSVTSLLTPGMVKTTDTSTEPGTSLSPNLSGTSVEILAASEVTTDTEKIHPSSSMAVTNVGTTSSGHELYSSVSIHSEPSKATYPVGTPSSMAETSISTSMPANFETTGFEAEPFSHLTSGLRKTNMSLDTSSVTPTNTPSSPGSTHLLQSSKTDFTSSAKTSSPDWPPASQYTEIPVDIITPFNASPSITESTGITSFPESRFTMSVTESTHHLSTDLLPSAETISTGTVMPSLSEAMTSFATTGVPRAISGSGSPFSRTESGPGDATLSTIAESLPSSTPVPFSSSTFTTTDSSTIPALHEITSSSATPYRVDTSLGTESSTTEGRLVMVSTLDTSSQPGRTSSSPILDTRMTESVELGTVTSAYQVPSLSTRLTRTDGIMEHITKIPNEAAHRGTIRPVKGPQTSTSPASPKGLHTGGTKRMETTTTALKTTTTALKTTSRATLTTSVYTPTLGTLTPLNASMQMASTIPTEMMITTPYVFPDVPETTSSLATSLGAETSTALPRTTPSVFNRESETTASLVSRSGAERSPVIQTLDVSSSEPDTTASWVIHPAETIPTVSKTTPNFFHSELDTVSSTATSHGADVSSAIPTNISPSELDALTPLVTISGTDTSTTFPTLTKSPHETETRTTWLTHPAETSSTIPRTIPNFSHHESDATPSIATSPGAETSSAIPIMTVSPGAEDLVTSQVTSSGTDRNMTIPTLTLSPGEPKTIASLVTHPEAQTSSAIPTSTISPAVSRLVTSMVTSLAAKTSTTNRALTNSPGEPATTVSLVTHSAQTSPTVPWTTSIFFHSKSDTTPSMTTSHGAESSSAVPTPTVSTEVPGVVTPLVTSSRAVISTTIPILTLSPGEPETTPSMATSHGEEASSAIPTPTVSPGVPGVVTSLVTSSRAVTSTTIPILTFSLGEPETTPSMATSHGTEAGSAVPTVLPEVPGMVTSLVASSRAVTSTTLPTLTLSPGEPETTPSMATSHGAEASSTVPTVSPEVPGVVTSLVTSSSGVNSTSIPTLILSPGELETTPSMATSHGAEASSAVPTPTVSPGVSGVVTPLVTSSRAVTSTTIPILTLSSSEPETTPSMATSHGVEASSAVLTVSPEVPGMVTFLVTSSRAVTSTTIPTLTISSDEPETTTSLVTHSEAKMISAIPTLGVSPTVQGLVTSLVTSSGSETSAFSNLTVASSQPETIDSWVAHPGTEASSVVPTLTVSTGEPFTNISLVTHPAESSSTLPRTTSRFSHSELDTMPSTVTSPEAESSSAISTTISPGIPGVLTSLVTSSGRDISATFPTVPESPHESEATASWVTHPAVTSTTVPRTTPNYSHSEPDTTPSIATSPGAEATSDFPTITVSPDVPDMVTSQVTSSGTDTSITIPTLTLSSGEPETTTSFITYSETHTSSAIPTLPVSPDASKMLTSLVISSGTDSTTTFPTLTETPYEPETTAIQLIHPAETNTMVPRTTPKFSHSKSDTTLPVAITSPGPEASSAVSTTTISPDMSDLVTSLVPSSGTDTSTTFPTLSETPYEPETTATWLTHPAETSTTVSGTIPNFSHRGSDTAPSMVTSPGVDTRSGVPTTTIPPSIPGVVTSQVTSSATDTSTAIPTLTPSPGEPETTASSATHPGTQTGFTVPIRTVPSSEPDTMASWVTHPPQTSTPVSRTTSSFSHSSPDATPVMATSPRTEASSAVLTTISPGAPEMVTSQITSSGAATSTTVPTLTHSPGMPETTALLSTHPRTETSKTFPASTVFPQVSETTASLTIRPGAETSTALPTQTTSSLFTLLVTGTSRVDLSPTASPGVSAKTAPLSTHPGTETSTMIPTSTLSLGLLETTGLLATSSSAETSTSTLTLTVSPAVSGLSSASITTDKPQTVTSWNTETSPSVTSVGPPEFSRTVTGTTMTLIPSEMPTPPKTSHGEGVSPTTILRTTMVEATNLATTGSSPTVAKTTTTFNTLAGSLFTPLTTPGMSTLASESVTSRTSYNHRSWISTTSSYNRRYWTPATSTPVTSTFSPGISTSSIPSSTAATVPFMVPFTLNFTITNLQYEEDMRHPGSRKFNATERELQGLLKPLFRNSSLEYLYSGCRLASLRPEKDSSATAVDAICTHRPDPEDLGLDRERLYWELSNLTNGIQELGPYTLDRNSLYVNGFTHRSSMPTTSTPGTSTVDVGTSGTPSSSPSPTTAGPLLMPFTLNFTITNLQYEEDMRRTGSRKFNTMESVLQGLLKPLFKNTSVGPLYSGCRLTLLRPEKDGAATGVDAICTHRLDPKSPGLNREQLYWELSKLTNDIEELGPYTLDRNSLYVNGFTHQSSVSTTSTPGTSTVDLRTSGTPSSLSSPTIMAAGPLLVPFTLNFTITNLQYGEDMGHPGSRKFNTTERVLQGLLGPIFKNTSVGPLYSGCRLTSLRSEKDGAATGVDAICIHHLDPKSPGLNRERLYWELSQLTNGIKELGPYTLDRNSLYVNGFTHRTSVPTTSTPGTSTVDLGTSGTPFSLPSPATAGPLLVLFTLNFTITNLKYEEDMHRPGSRKFNTTERVLQTLVGPMFKNTSVGLLYSGCRLTLLRSEKDGAATGVDAICTHRLDPKSPGVDREQLYWELSQLTNGIKELGPYTLDRNSLYVNGFTHWIPVPTSSTPGTSTVDLGSGTPSSLPSPTSATAGPLLVPFTLNFTITNLKYEEDMHCPGSRKFNTTERVLQSLLGPMFKNTSVGPLYSGCRLTLLRSEKDGAATGVDAICTHRLDPKSPGVDREQLYWELSQLTNGIKELGPYTLDRNSLYVNGFTHQTSAPNTSTPGTSTVDLGTSGTPSSLPSPTSAGPLLVPFTLNFTITNLQYEEDMHHPGSRKFNTTERVLQGLLGPMFKNTSVGLLYSGCRLTLLRPEKNGAATGMDAICSHRLDPKSPGLNREQLYWELSQLTHGIKELGPYTLDRNSLYVNGFTHRSSVAPTSTPGTSTVDLGTSGTPSSLPSPTTAVPLLVPFTLNFTITNLQYGEDMRHPGSRKFNTTERVLQGLLGPLFKNSSVGPLYSGCRLISLRSEKDGAATGVDAICTHHLNPQSPGLDREQLYWQLSQMTNGIKELGPYTLDRNSLYVNGFTHRSSGLTTSTPWTSTVDLGTSGTPSPVPSPTTAGPLLVPFTLNFTITNLQYEEDMHRPGSRKFNATERVLQGLLSPIFKNSSVGPLYSGCRLTSLRPEKDGAATGMDAVCLYHPNPKRPGLDREQLYWELSQLTHNITELGPYSLDRDSLYVNGFTHQNSVPTTSTPGTSTVYWATTGTPSSFPGHTEPGPLLIPFTFNFTITNLHYEENMQHPGSRKFNTTERVLQGLLKPLFKNTSVGPLYSGCRLTLLRPEKQEAATGVDTICTHRVDPIGPGLDRERLYWELSQLTNSITELGPYTLDRDSLYVNGFNPWSSVPTTSTPGTSTVHLATSGTPSSLPGHTAPVPLLIPFTLNFTITNLHYEENMQHPGSRKFNTTERVLQGLLKPLFKSTSVGPLYSGCRLTLLRPEKHGAATGVDAICTLRLDPTGPGLDRERLYWELSQLTNSVTELGPYTLDRDSLYVNGFTHRSSVPTTSIPGTSAVHLETSGTPASLPGHTAPGPLLVPFTLNFTITNLQYEEDMRHPGSRKFNTTERVLQGLLKPLFKSTSVGPLYSGCRLTLLRPEKRGAATGVDTICTHRLDPLNPGLDREQLYWELSKLTRGIIELGPYLLDRGSLYVNGFTHRNFVPITSTPGTSTVHLGTSETPSSLPRPIVPGPLLVPFTLNFTITNLQYEEAMRHPGSRKFNTTERVLQGLLRPLFKNTSIGPLYSSCRLTLLRPEKDKAATRVDAICTHHPDPQSPGLNREQLYWELSQLTHGITELGPYTLDRDSLYVDGFTHWSPIPTTSTPGTSIVNLGTSGIPPSLPETTATGPLLVPFTLNFTITNLQYEENMGHPGSRKFNITESVLQGLLKPLFKSTSVGPLYSGCRLTLLRPEKDGVATRVDAICTHRPDPKIPGLDRQQLYWELSQLTHSITELGPYTLDRDSLYVNGFTQRSSVPTTSTPGTFTVQPETSETPSSLPGPTATGPVLLPFTLNFTIINLQYEEDMHRPGSRKFNTTERVLQGLLMPLFKNTSVSSLYSGCRLTLLRPEKDGAATRVDAVCTHRPDPKSPGLDRERLYWKLSQLTHGITELGPYTLDRHSLYVNGFTHQSSMTTTRTPDTSTMHLATSRTPASLSGPTTASPLLVLFTINFTITNLRYEENMHHPGSRKFNTTERVLQGLLRPVFKNTSVGPLYSGCRLTLLRPKKDGAATKVDAICTYRPDPKSPGLDREQLYWELSQLTHSITELGPYTLDRDSLYVNGFTQRSSVPTTSIPGTPTVDLGTSGTPVSKPGPSAASPLLVLFTLNFTITNLRYEENMQHPGSRKFNTTERVLQGLLRSLFKSTSVGPLYSGCRLTLLRPEKDGTATGVDAICTHHPDPKSPRLDREQLYWELSQLTHNITELGPYALDNDSLFVNGFTHRSSVSTTSTPGTPTVYLGASKTPASIFGPSAASHLLILFTLNFTITNLRYEENMWPGSRKFNTTERVLQGLLRPLFKNTSVGPLYSGCRLTLLRPEKDGEATGVDAICTHRPDPTGPGLDREQLYLELSQLTHSITELGPYTLDRDSLYVNGFTHRSSVPTTSTGVVSEEPFTLNFTINNLRYMADMGQPGSLKFNITDNVMQHLLSPLFQRSSLGARYTGCRVIALRSVKNGAETRVDLLCTYLQPLSGPGLPIKQVFHELSQQTHGITRLGPYSLDKDSLYLNGYNEPGPDEPPTTPKPATTFLPPLSEATTAMGYHLKTLTLNFTISNLQYSPDMGKGSATFNSTEGVLQHLLRPLFQKSSMGPFYLGCQLISLRPEKDGAATGVDTTCTYHPDPVGPGLDIQQLYWELSQLTHGVTQLGFYVLDRDSLFINGYAPQNLSIRGEYQINFHIVNWNLSNPDPTSSEYITLLRDIQDKVTTLYKGSQLHDTFRFCLVTNLTMDSVLVTVKALFSSNLDPSLVEQVFLDKTLNASFHWLGSTYQLVDIHVTEMESSVYQPTSSSSTQHFYLNFTITNLPYSQDKAQPGTTNYQRNKRNIEDALNQLFRNSSIKSYFSDCQVSTFRSVPNRHHTGVDSLCNFSPLARRVDRVAIYEEFLRMTRNGTQLQNFTLDRSSVLVDGYSPNRNEPLTGNSDLPFWAVILIGLAGLLGLITCLICGVLVTTRRRKKEGEYNVQQQCPGYYQSHLDLEDLQ(SEQIDNO:4)(5)MPF(MPF、MSLN、SMR、巨核细胞强化因子、间皮素、Genbank登录号NM_005823,Yamaguchi,N.等Biol.Chem.269(2),805-808(1994),Proc.Natl.Acad.Sci.USA.96(20):11531-11536(1999),Proc.Natl.Acad.Sci.USA.93(1):136-140(1996),J.Bio.Chem.270(37):21984-21990(1995));WO2003101283(权利要求14);(WO2002102235(权利要求13;第287-288页);WO2002101075(权利要求4;第308-309页);WO200271928(第320-321页);WO9410312(第52-57页);交叉参考:MIM:601051;NP_005814.2;NM_005823_1622aaMALPTARPLLGSCGTPALGSLLFLLFSLGWVQPSRTLAGETGQEAAPLDGVLANPPNISSLSPRQLLGFPCAEVSGLSTERVRELAVALAQKNVKLSTEQLRCLAHRLSEPPEDLDALPLDLLLFLNPDAFSGPQACTRFFSRITKANVDLLPRGAPERQRLLPAALACWGVRGSLLSEADVRALGGLACDLPGRFVAESAEVLLPRLVSCPGPLDQDQQEAARAALQGGGPPYGPPSTWSVSTMDALRGLLPVLGQPIIRSIPQGIVAAWRQRSSRDPSWRQPERTILRPRFRREVEKTACPSGKKAREIDESLIFYKKWELEACVDAALLATQMDRVNAIPFTYEQLDVLKHKLDELYPQGYPESVIQHLGYLFLKMSPEDIRKWNVTSLETLKALLEVNKGHEMSPQVATLIDRFVKGRGQLDKDTLDTLTAFYPGYLCSLSPEELSSVPPSSIWAVRPQDLDTCDPRQLDVLYPKARLAFQNMNGSEYFVKIQSFLGGAPTEDLKALSQQNVSMDLATFMKLRTDAVLPLTVAEVQKLLGPHVEGLKAEERHRPVRDWILRQRQDDLDTLGLGLQGGIPNGYLVLDLSMQEALSGTPCLLGPGPVLTVLALLLASTLA(SEQIDNO:5)(6)Napi3b(NAPI-3B、NPTIIb、SLC34A2、溶质运载体家族34(磷酸钠)、成员2、II型钠依赖型磷酸转运子3b,Genbank登录号NM_006424,J.Bio.Chem.277(22):19665-19672(2002),Genomics62(2):281-284(1999),Feild,J.A.等(1999)Biochem.Biophys.Res.Commun.258(3):578-582);WO2004022778(权利要求2);EP1394274(实施例11);WO2002102235(权利要求13;第326页);EP875569(权利要求1;第17-19页);WO200157188(权利要求20;第329页);WO2004032842(实施例IV);WO200175177(权利要求24;第139-140页);交叉参考:MIM:604217;NP_006415.1;NM_006424_1690aaMAPWPELGDAQPNPDKYLEGAAGQQPTAPDKSKETNKTDNTEAPVTKIELLPSYSTATLIDEPTEVDDPWNLPTLQDSGIKWSERDTKGKILCFFQGIGRLILLLGFLYFFVCSLDILSSAFQLVGGKMAGQFFSNSSIMSNPLLGLVIGVLVTVLVQSSSTSTSIVVSMVSSSLLTVRAAIPIIMGANIGTSITNTIVALMQVGDRSEFRRAFAGATVHDFFNWLSVLVLLPVEVATHYLEIITQLIVESFHFKNGEDAPDLLKVITKPFTKLIVQLDKKVISQIAMNDEKAKNKSLVKIWCKTFTNKTQINVTVPSTANCTSPSLCWTDGIQNWTMKNVTYKENIAKCQHIFVNFHLPDLAVGTILLILSLLVLCGCLIMIVKILGSVLKGQVATVIKKTINTDFPFPFAWLTGYLAILVGAGMTFIVQSSSVFTSALTPLIGIGVITIERAYPLTLGSNIGTTTTAILAALASPGNALRSSLQIALCHFFFNISGILLWYPIPFTRLPIRMAKGLGNISAKYRWFAVFYLIIFFFLIPLTVFGLSLAGWRVLVGVGVPVVFIIILVLCLRLLQSRCPRVLPKKLQNWNFLPLWMRSLKPWDAVVSKFTGCFQMRCCYCCRVCCRACCLLCGCPKCCRCSKCCEDLEEAQEGQDVPVKAPETFDNITISREAQGEVPASDSKTECTAL(SEQIDNO:6)(7)Sema5b(FLJ10372、KIAA1445、Mm.42015、SEMA5B、SEMAG、脑信号蛋白5bHlog、sema结构域、七个血小板反应蛋白重复序列(1型和1型样)、跨膜结构域(TM)和短胞质结构域、(脑信号蛋白)5B、Genbank登录号AB040878,NagaseT.等(2000)DNARes.7(2):143-150);WO2004000997(权利要求1);WO2003003984(权利要求1);WO200206339(权利要求1;第50页);WO200188133(权利要求1;第41-43页,48-58);WO2003054152(权利要求20);WO2003101400(权利要求11);登录号:Q9P283;EMBL;AB040878;BAA95969.1。Genew;HGNC:10737;1093aaMVLAGPLAVSLLLPSLTLLVSHLSSSQDVSSEPSSEQQLCALSKHPTVAFEDLQPWVSNFTYPGARDFSQLALDPSGNQLIVGARNYLFRLSLANVSLLQATEWASSEDTRRSCQSKGKTEEECQNYVRVLIVAGRKVFMCGTNAFSPMCTSRQVGNLSRTTEKINGVARCPYDPRHNSTAVISSQGELYAATVIDFSGRDPAIYRSLGSGPPLRTAQYNSKWLNEPNFVAAYDIGLFAYFFLRENAVEHDCGRTVYSRVARVCKNDVGGRFLLEDTWTTFMKARLNCSRPGEVPFYYNELQSAFHLPEQDLIYGVFTTNVNSIAASAVCAFNLSAISQAFNGPFRYQENPRAAWLPIANPIPNFQCGTLPETGPNENLTERSLQDAQRLFLMSEAVQPVTPEPCVTQDSVRFSHLVVDLVQAKDTLYHVLYIGTESGTILKALSTASRSLHGCYLEELHVLPPGRREPLRSLRILHSARALFVGLRDGVLRVPLERCAAYRSQGACLGARDPYCGWDGKQQRCSTLEDSSNMSLWTQNITACPVRNVTRDGGFGPWSPWQPCEHLDGDNSGSCLCRARSCDSPRPRCGGLDCLGPAIHIANCSRNGAWTPWSSWALCSTSCGIGFQVRQRSCSNPAPRHGGRICVGKSREERFCNENTPCPVPIFWASWGSWSKCSSNCGGGMQSRRRACENGNSCLGCGVEFKTCNPEGCPEVRRNTPWTPWLPVNVTQGGARQEQRFRFTCRAPLADPHGLQFGRRRTETRTCPADGSGSCDTDALVEDLLRSGSTSPHTVSGGWAAWGPWSSCSRDCELGFRVRKRTCTNPEPRNGGLPCVGDAAEYQDCNPQACPVRGAWSCWTSWSPCSASCGGGHYQRTRSCTSPAPSPGEDICLGLHTEEALCATQACPEGWSPWSEWSKCTDDGAQSRSRHCEELLPGSSACAGNSSQSRPCPYSEIPVILPASSMEEATGCAGFNLIHLVATGISCFLGSGLLTLAVYLSCQHCQRQSQESTLVHPATPNHLHYKGGGTPKNEKYTPMEFKTLNKNNLIPDDRANFYPLQQTNVYTTTYYPSPLNKHSFRPEASPGQRCFPNS(SEQIDNO:7)(8)PSCAhlg(2700050C12Rik,C530008O16Rik,RIKENcDNA2700050C12,RIKENcDNA2700050C12基因,Genbank登录号AY358628);US2003129192(权利要求2);US2004044180(权利要求12);US2004044179(权利要求11);US2003096961(权利要求11);US2003232056(实施例5);WO2003105758(权利要求12);US2003206918(实施例5);EP1347046(权利要求1);WO2003025148(权利要求20);交叉参考:GI:37182378;AAQ88991.1;AY358628_1141aaMWVLGIAATFCGLFLLPGFALQIQCYQCEEFQLNNDCSSPEFIVNCTVNVQDMCQKEVMEQSAGIMYRKSCASSAACLIASAGYQSFCSPGKLNSVCISCCNTPLCNGPRPKKRGSSASALRPGLRTTILFLKLALFSAHC(SEQIDNO:8)(9)ETBR(内皮缩血管肽B型受体,Genbank登录号AY275463);NakamutaM.等Biochem.Biophys.Res.Commun.177,34-39,1991;OgawaY.等Biochem.Biophys.Res.Commun.178,248-255,1991;AraiH.等Jpn.Circ.J.56,1303-1307,1992;AraiH.等J.Bio.Chem.268,3463-3470,1993;SakamotoA.,YanagisawaM.等Biochem.Biophys.Res.Commun.178,656-663,1991;ElshourbagyN.A.等J.Bio.Chem.268,3873-3879,1993;HaendlerB.等J.Cardiovasc.Pharmacol.20,s1-S4,1992;TsutsumiM.等Gene228,43-49,1999;StrausbergR.L.等Proc.Natl.Acad.Sci.USA.99,16899-16903,2002;BourgeoisC.等J.Clin.Endocrinol.Metab.82,3116-3123,1997;OkamotoY.等Biol.Chem.272,21589-21596,1997;VerheijJ.B.等Am.J.Med.Genet.108,223-225,2002;HofstraR.M.W.等Eur.J.Hum.Genet.5,180-185,1997;PuffenbergerE.G.等Cell79,1257-1266,1994;AttieT.等,Hum.Mol.Genet.4,2407-2409,1995;AuricchioA.等Hum.Mol.Genet.5:351-354,1996;AmielJ.等Hum.Mol.Genet.5,355-357,1996;HofstraR.M.W.等Nat.Genet.12,445-447,1996;SvenssonP.J.等Hum.Genet.103,145-148,1998;FuchsS.等Mol.Med.7,115-124,2001;PingaultV.等(2002)Hum.Genet.111,198-206;WO2004045516(权利要求1);WO2004048938(实施例2);WO2004040000(权利要求151);WO2003087768(权利要求1);WO2003016475(权利要求1);WO2003016475(权利要求1);WO200261087(图1);WO2003016494(图6);WO2003025138(权利要求12;第144页);WO200198351(权利要求1;第124-125页);EP522868(权利要求8;图2);WO200177172(权利要求1;第297-299页);US2003109676;US6518404(图3);US5773223(权利要求1a;第31-34列);WO2004001004;442aaMQPPPSLCGRALVALVLACGLSRIWGEERGFPPDRATPLLQTAEIMTPPTKTLWPKGSNASLARSLAPAEVPKGDRTAGSPPRTISPPPCQGPIEIKETFKYINTVVSCLVFVLGIIGNSTLLRIIYKNKCMRNGPNILIASLALGDLLHIVIDIPINVYKLLAEDWPFGAEMCKLVPFIQKASVGITVLSLCALSIDRYRAVASWSRIKGIGVPKWTAVEIVLIWVVSVVLAVPEAIGFDIITMDYKGSYLRICLLHPVQKTAFMQFYKTAKDWWLFSFYFCLPLAITAFFYTLMTCEMLRKKSGMQIALNDHLKQRREVAKTVFCLVLVFALCWLPLHLSRILKLTLYNQNDPNRCELLSFLLVLDYIGINMASLNSCINPIALYLVSKRFKNCFKSCLCCWCQSFEEKQSLEEKQSCLKFKANDHGYDNFRSSNKYSSS(SEQIDNO:9)(10)MSG783(RNF124、假拟蛋白FLJ20315,Genbank登录号NM_017763);WO2003104275(权利要求1);WO2004046342(实施例2);WO2003042661(权利要求12);WO2003083074(权利要求14;第61页);WO2003018621(权利要求1);WO2003024392(权利要求2;图93);WO200166689(实施例6);交叉参考:LocusID:54894;NP_060233.2;NM_017763_1783aaMSGGHQLQLAALWPWLLMATLQAGFGRTGLVLAAAVESERSAEQKAIIRVIPLKMDPTGKLNLTLEGVFAGVAEITPAEGKLMQSHPLYLCNASDDDNLEPGFISIVKLESPRRAPRPCLSLASKARMAGERGASAVLFDITEDRAAAEQLQQPLGLTWPVVLIWGNDAEKLMEFVYKNQKAHVRIELKEPPAWPDYDVWILMTVVGTIFVIILASVLRIRCRPRHSRPDPLQQRTAWAISQLATRRYQASCRQARGEWPDSGSSCSSAPVCAICLEEFSEGQELRVISCLHEFHRNCVDPWLHQHRTCPLCVFNITEGDSFSQSLGPSRSYQEPGRRLHLIRQHPGHAHYHLPAAYLLGPSRSAVARPPRPGPFLPSQEPGMGPRHHRFPRAAHPRAPGEQQRLAGAQHPYAQGWGMSHLQSTSQHPAACPVPLRRARPPDSSGSGESYCTERSGYLADGPASDSSSGPCHGSSSDSVVNCTDISLQGVHGSSSTFCSSLSSDFDPLVYCSPKGDPQRVDMQPSVTSRPRSLDSVVPTGETQVSSHVHYHRHRHHHYKKRFQWHGRKPGPETGVPQSRPPIPRTQPQPEPPSPDQQVTGSNSAAPSGRLSNPQCPRALPEPAPGPVDASSICPSTSSLFNLQKSSLSARHPQRKRRGGPSEPTPGSRPQDATVHPACQIFPHYTPSVAYPWSPEAHPLICGPPGLDKRLLPETPGPCYSNSQPVWLCLTPRQPLEPHPPGEGPSEWSSDTAEGRPCPYPHCQVLSAQPGSEEELEELCEQAV(SEQIDNO:10)(11)STEAP2(HGNC_8639、IPCA-1、PCANAP1、STAMP1、STEAP2、STMP、前列腺癌相关基因1、前列腺癌相关蛋白1、六次跨膜的前列腺上皮抗原2、六次跨膜的前列腺蛋白,Genbank登录号AF455138,Lab.Invest.82(11):1573-1582(2002));WO2003087306;US2003064397(权利要求1;图1);WO200272596(权利要求13;第54-55页);WO200172962(权利要求1;图4B);WO2003104270(权利要求11);WO2003104270(权利要求16);US2004005598(权利要求22);WO2003042661(权利要求12);US2003060612(权利要求12;图10);WO200226822(权利要求23;图2);WO200216429(权利要求12;图10);交叉参考:GI:22655488;AAN04080.1;AF455138_1490aaMESISMMGSPKSLSETVLPNGINGIKDARKVTVGVIGSGDFAKSLTIRLIRCGYHVVIGSRNPKFASEFFPHVVDVTHHEDALTKTNIIFVAIHREHYTSLWDLRHLLVGKILIDVSNNMRINQYPESNAEYLASLFPDSLIVKGFNVVSAWALQLGPKDASRQVYICSNNIQARQQVIELARQLNFIPIDLGSLSSAREIENLPLRLFTLWRGPVVVAISLATFFFLYSFVRDVIHPYARNQQSDFYKIPIEIVNKTLPIVAITLLSLVYLAGLLAAAYQLYYGTKYRRFPPWLETWLQCRKQLGLLSFFFAMVHVAYSLCLPMRRSERYLFLNMAYQQVHANIENSWNEEEVWRIEMYISFGIMSLGLLSLLAVTSIPSVSNALNWREFSFIQSTLGYVALLISTFHVLIYGWKRAFEEEYYRFYTPPNFVLALVLPSIVILGKIILFLPCISQKLKRIKKGWEKSQFLEEGIGGTIPHVSPERVTVM(SEQIDNO:11)(12)TrpM4(BR22450、FLJ20041、TRPM4、TRPM4B、瞬时受体电势阳离子通道、亚家族M、成员4,Genbank登录号NM_017636,Xu,X.Z.等Proc.Natl.Acad.Sci.USA.98(19):10692-10697(2001),Cell109(3):397-407(2002),J.Bio.Chem.278(33):30813-30820(2003));US2003143557(权利要求4);WO200040614(权利要求14;第100-103页);WO200210382(权利要求1;图9A);WO2003042661(权利要求12);WO200230268(权利要求27;第391页);US2003219806(权利要求4);WO200162794(权利要求14;图1A-D);交叉参考:MIM:606936;NP_060106.2;NM_017636_11214aaMVVPEKEQSWIPKIFKKKTCTTFIVDSTDPGGTLCQCGRPRTAHPAVAMEDAFGAAVVTVWDSDAHTTEKPTDAYGELDFTGAGRKHSNFLRLSDRTDPAAVYSLVTRTWGFRAPNLVVSVLGGSGGPVLQTWLQDLLRRGLVRAAQSTGAWIVTGGLHTGIGRHVGVAVRDHQMASTGGTKVVAMGVAPWGVVRNRDTLINPKGSFPARYRWRGDPEDGVQFPLDYNYSAFFLVDDGTHGCLGGENRFRLRLESYISQQKTGVGGTGIDIPVLLLLIDGDEKMLTRIENATQAQLPCLLVAGSGGAADCLAETLEDTLAPGSGGARQGEARDRIRRFFPKGDLEVLQAQVERIMTRKELLTVYSSEDGSEEFETIVLKALVKACGSSEASAYLDELRLAVAWNRVDIAQSELFRGDIQWRSFHLEASLMDALLNDRPEFVRLLISHGLSLGHFLTPMRLAQLYSAAPSNSLIRNLLDQASHSAGTKAPALKGGAAELRPPDVGHVLRMLLGKMCAPRYPSGGAWDPHPGQGFGESMYLLSDKATSPLSLDAGLGQAPWSDLLLWALLLNRAQMAMYFWEMGSNAVSSALGACLLLRVMARLEPDAEEAARRKDLAFKFEGMGVDLFGECYRSSEVRAARLLLRRCPLWGDATCLQLAMQADARAFFAQDGVQSLLTQKWWGDMASTTPIWALVLAFFCPPLIYTRLITFRKSEEEPTREELEFDMDSVINGEGPVGTADPAEKTPLGVPRQSGRPGCCGGRCGGRRCLRRWFHFWGAPVTIFMGNVVSYLLFLLLFSRVLLVDFQPAPPGSLELLLYFWAFTLLCEELRQGLSGGGGSLASGGPGPGHASLSQRLRLYLADSWNQCDLVALTCFLLGVGCRLTPGLYHLGRTVLCIDFMVFTVRLLHIFTVNKQLGPKIVIVSKMMKDVFFFLFFLGVWLVAYGVATEGLLRPRDSDFPSILRRVFYRPYLQIFGQIPQEDMDVALMEHSNCSSEPGFWAHPPGAQAGTCVSQYANWLVVLLLVIFLLVANILLVNLLIAMFSYTFGKVQGNSDLYWKAQRYRLIREFHSRPALAPPFIVISHLRLLLRQLCRRPRSPQPSSPALEHFRVYLSKEAERKLLTWESVHKENFLLARARDKRESDSERLKRTSQKVDLALKQLGHIREYEQRLKVLEREVQQCSRVLGWVAEALSRSALLPPGGPPPPDLPGSKD(SEQIDNO:12)(13)CRIPTO(CR、CR1、CRGF、CRIPTO、TDGF1、畸胎癌衍生生长因子,Genbank登录号NP_003203或NM_003212,Ciccodicola,A.等EMBOJ.8(7):1987-1991(1989),Am.J.Hum.Genet.49(3):555-565(1991));US2003224411(权利要求1);WO2003083041(实施例1);WO2003034984(权利要求12);WO200288170(权利要求2;第52-53页);WO2003024392(权利要求2;图58);WO200216413(权利要求1;第94-95、105页);WO200222808(权利要求2;图1);US5854399(实施例2;Col17-18);US5792616(图2);交叉参考:MIM:187395;NP_003203.1;NM_003212_1188aaMDCRKMARFSYSVIWIMAISKVFELGLVAGLGHQEFARPSRGYLAFRDDSIWPQEEPAIRPRSSQRVPPMGIQHSKELNRTCCLNGGTCMLGSFCACPPSFYGRNCEHDVRKENCGSVPHDTWLPKKCSLCKCWHGQLRCFPQAFLPGCDGLVMDEHLVASRTPELPPSARTTTFMLVGICLSIQSYY(SEQIDNO:13)(14)CD21(CR2(补体受体2)或C3DR(C3d/EB病毒受体)或Hs.73792Genbank登录号M26004,Fujisaku等(1989)J.Bio.Chem.264(4):2118-2125);WeisJ.J.等J.Exp.Med.167,1047-1066,1988;MooreM.等Proc.Natl.Acad.Sci.USA.84,9194-9198,1987;BarelM.等Mol.Immunol.35,1025-1031,1998;WeisJ.J.等Proc.Natl.Acad.Sci.USA.83,5639-5643,1986;SinhaS.K.等(1993)J.Immunol.150,5311-5320;WO2004045520(实施例4);US2004005538(实施例1);WO2003062401(权利要求9);WO2004045520(实施例4);WO9102536(图9.1-9.9);WO2004020595(权利要求1);登录号:P20023;Q13866;Q14212;EMBL;M26004;AAA35786.1。1033aaMGAAGLLGVFLALVAPGVLGISCGSPPPILNGRISYYSTPIAVGTVIRYSCSGTFRLIGEKSLLCITKDKVDGTWDKPAPKCEYFNKYSSCPEPIVPGGYKIRGSTPYRHGDSVTFACKTNFSMNGNKSVWCQANNMWGPTRLPTCVSVFPLECPALPMIHNGHHTSENVGSIAPGLSVTYSCESGYLLVGEKIINCLSSGKWSAVPPTCEEARCKSLGRFPNGKVKEPPILRVGVTANFFCDEGYRLQGPPSSRCVIAGQGVAWTKMPVCEEIFCPSPPPILNGRHIGNSLANVSYGSIVTYTCDPDPEEGVNFILIGESTLRCTVDSQKTGTWSGPAPRCELSTSAVQCPHPQILRGRMVSGQKDRYTYNDTVIFACMFGFTLKGSKQIRCNAQGTWEPSAPVCEKECQAPPNILNGQKEDRHMVRFDPGTSIKYSCNPGYVLVGEESIQCTSEGVWTPPVPQCKVAACEATGRQLLTKPQHQFVRPDVNSSCGEGYKLSGSVYQECQGTIPWFMEIRLCKEITCPPPPVIYNGAHTGSSLEDFPYGTTVTYTCNPGPERGVEFSLIGESTIRCTSNDQERGTWSGPAPLCKLSLLAVQCSHVHIANGYKISGKEAPYFYNDTVTFKCYSGFTLKGSSQIRCKADNTWDPEIPVCEKETCQHVRQSLQELPAGSRVELVNTSCQDGYQLTGHAYQMCQDAENGIWFKKIPLCKVIHCHPPPVIVNGKHTGMMAENFLYGNEVSYECDQGFYLLGEKKLQCRSDSKGHGSWSGPSPQCLRSPPVTRCPNPEVKHGYKLNKTHSAYSHNDIVYVDCNPGFIMNGSRVIRCHTDNTWVPGVPTCIKKAFIGCPPPPKTPNGNHTGGNIARFSPGMSILYSCDQGYLLVGEALLLCTHEGTWSQPAPHCKEVNCSSPADMDGIQKGLEPRKMYQYGAVVTLECEDGYMLEGSPQSQCQSDHQWNPPLAVCRSRSLAPVLCGIAAGLILLTFLIVITLYVISKHRERNYYTDTSQKEAFHLEAREVYSVDPYNPAS(SEQIDNO:14)(15)CD79b(CD79B、CD79β、IGb(免疫球蛋白相关β)、B29、Genbank登录号NM_000626或11038674,Proc.Natl.Acad.Sci.USA.(2003)100(7):4126-4131,Blood(2002)100(9):3068-3076,Muller等(1992)Eur.J.Immunol.22(6):1621-1625);WO2004016225(权利要求2,图140);WO2003087768,US2004101874(权利要求1,第102页);WO2003062401(权利要求9);WO200278524(实施例2);US2002150573(权利要求5,第15页);US5644033;WO2003048202(权利要求1,第306和309页);WO99/558658,US6534482(权利要求13,图17A/B);WO200055351(权利要求11,第1145-1146页);交叉参考:MIM:147245;NP_000617.1;NM_000626_1229aaMARLALSPVPSHWMVALLLLLSAEPVPAARSEDRYRNPKGSACSRIWQSPRFIARKRGFTVKMHCYMNSASGNVSWLWKQEMDENPQQLKLEKGRMEESQNESLATLTIQGIRFEDNGIYFCQQKCNNTSEVYQGCGTELRVMGFSTLAQLKQRNTLKDGIIMIQTLLIILFIIVPIFLLLDKDDSKAGMEEDHTYEGLDIDQTATYEDIVTLRTGEVKWSVGEHPGQE(SEQIDNO:15)(16)FcRH2(IFGP4、IRTA4、SPAP1A(含有磷酸酶锚定蛋白1a的SH2结构域)、SPAP1B、SPAP1C,Genbank登录号NM_030764,GenomeRes.13(10):2265-2270(2003),Immunogenetics54(2):87-95(2002),Blood99(8):2662-2669(2002),Proc.Natl.Acad.Sci.USA.98(17):9772-9777(2001),Xu,M.J.等(2001)Biochem.Biophys.Res.Commun.280(3):768-775;WO2004016225(权利要求2);WO2003077836;WO200138490(权利要求5;图18D-1-18D-2);WO2003097803(权利要求12);WO2003089624(权利要求25);交叉参考:MIM:606509;NP_110391.2;NM_030764_1508aaMLLWSLLVIFDAVTEQADSLTLVAPSSVFEGDSIVLKCQGEQNWKIQKMAYHKDNKELSVFKKFSDFLIQSAVLSDSGNYFCSTKGQLFLWDKTSNIVKIKVQELFQRPVLTASSFQPIEGGPVSLKCETRLSPQRLDVQLQFCFFRENQVLGSGWSSSPELQISAVWSEDTGSYWCKAETVTHRIRKQSLQSQIHVQRIPISNVSLEIRAPGGQVTEGQKLILLCSVAGGTGNVTFSWYREATGTSMGKKTQRSLSAELEIPAVKESDAGKYYCRADNGHVPIQSKVVNIPVRIPVSRPVLTLRSPGAQAAVGDLLELHCEALRGSPPILYQFYHEDVTLGNSSAPSGGGASFNLSLTAEHSGNYSCEANNGLGAQCSEAVPVSISGPDGYRRDLMTAGVLWGLFGVLGFTGVALLLYALFHKISGESSATNEPRGASRPNPQEFTYSSPTPDMEELQPVYVNVGSVDVDVVYSQVWSMQQPESSANIRTLLENKDSQVIYSSVKKS(SEQIDNO:16)(17)HER2(ErbB2,Genbank登录号M11730,CoussensL.等Science(1985)230(4730):1132-1139);YamamotoT.等Nature319,230-234,1986;SembaK.等Proc.Natl.Acad.Sci.USA.82,6497-6501,1985;SwierczJ.M.等J.CellBiol.165,869-880,2004;KuhnsJ.J.等J.Bio.Chem.274,36422-36427,1999;ChoH.-S.等Nature421,756-760,2003;EhsaniA.等(1993)Genomics15,426-429;WO2004048938(实施例2);WO2004027049(图1I);WO2004009622;WO2003081210;WO2003089904(权利要求9);WO2003016475(权利要求1);US2003118592;WO2003008537(权利要求1);WO2003055439(权利要求29;图1A-B);WO2003025228(权利要求37;图5C);WO200222636(实施例13;第95-107页);WO200212341(权利要求68;图7);WO200213847(第71-74页);WO200214503(第114-117页);WO200153463(权利要求2;第41-46页);WO200141787(第15页);WO200044899(权利要求52;图7);WO200020579(权利要求3;图2);US5869445(权利要求3;第31-38列);WO9630514(权利要求2;第56-61页);EP1439393(权利要求7);WO2004043361(权利要求7);WO2004022709;WO200100244(实施例3;图4);登录号:P04626;EMBL;M11767;AAA35808.1。EMBL;M11761;AAA35808.1。1255aaMELAALCRWGLLLALLPPGAASTQVCTGTDMKLRLPASPETHLDMLRHLYQGCQVVQGNLELTYLPTNASLSFLQDIQEVQGYVLIAHNQVRQVPLQRLRIVRGTQLFEDNYALAVLDNGDPLNNTTPVTGASPGGLRELQLRSLTEILKGGVLIQRNPQLCYQDTILWKDIFHKNNQLALTLIDTNRSRACHPCSPMCKGSRCWGESSEDCQSLTRTVCAGGCARCKGPLPTDCCHEQCAAGCTGPKHSDCLACLHFNHSGICELHCPALVTYNTDTFESMPNPEGRYTFGASCVTACPYNYLSTDVGSCTLVCPLHNQEVTAEDGTQRCEKCSKPCARVCYGLGMEHLREVRAVTSANIQEFAGCKKIFGSLAFLPESFDGDPASNTAPLQPEQLQVFETLEEITGYLYISAWPDSLPDLSVFQNLQVIRGRILHNGAYSLTLQGLGISWLGLRSLRELGSGLALIHHNTHLCFVHTVPWDQLFRNPHQALLHTANRPEDECVGEGLACHQLCARGHCWGPGPTQCVNCSQFLRGQECVEECRVLQGLPREYVNARHCLPCHPECQPQNGSVTCFGPEADQCVACAHYKDPPFCVARCPSGVKPDLSYMPIWKFPDEEGACQPCPINCTHSCVDLDDKGCPAEQRASPLTSIISAVVGILLVVVLGVVFGILIKRRQQKIRKYTMRRLLQETELVEPLTPSGAMPNQAQMRILKETELRKVKVLGSGAFGTVYKGIWIPDGENVKIPVAIKVLRENTSPKANKEILDEAYVMAGVGSPYVSRLLGICLTSTVQLVTQLMPYGCLLDHVRENRGRLGSQDLLNWCMQIAKGMSYLEDVRLVHRDLAARNVLVKSPNHVKITDFGLARLLDIDETEYHADGGKVPIKWMALESILRRRFTHQSDVWSYGVTVWELMTFGAKPYDGIPAREIPDLLEKGERLPQPPICTIDVYMIMVKCWMIDSECRPRFRELVSEFSRMARDPQRFVVIQNEDLGPASPLDSTFYRSLLEDDDMGDLVDAEEYLVPQQGFFCPDPAPGAGGMVHHRHRSSSTRSGGGDLTLGLEPSEEEAPRSPLAPSEGAGSDVFDGDLGMGAAKGLQSLPTHDPSPLQRYSEDPTVPLPSETDGYVAPLTCSPQPEYVNQPDVRPQPPSPREGPLPAARPAGATLERPKTLSPGKNGVVKDVFAFGGAVENPEYLTPQGGAAPQPHPPPAFSPAFDNLYYWDQDPPERGAPPSTFKGTPTAENPEYLGLDVPV(SEQIDNO:17)(18)NCA(CEACAM6,Genbank登录号M18728);BarnettT.等Genomics3,59-66,1988;TawaragiY.等Biochem.Biophys.Res.Commun.150,89-96,1988;StrausbergR.L.等Proc.Natl.Acad.Sci.USA.99:16899-16903,2002;WO2004063709;EP1439393(权利要求7);WO2004044178(实施例4);WO2004031238;WO2003042661(权利要求12);WO200278524(实施例2);WO200286443(权利要求27;第427页);WO200260317(权利要求2);登录号:P40199;Q14920;EMBL;M29541;AAA59915.1。EMBL;M18728;344aaMGPPSAPPCRLHVPWKEVLLTASLLTFWNPPTTAKLTIESTPFNVAEGKEVLLLAHNLPQNRIGYSWYKGERVDGNSLIVGYVIGTQQATPGPAYSGRETIYPNASLLIQNVTQNDTGFYTLQVIKSDLVNEEATGQFHVYPELPKPSISSNNSNPVEDKDAVAFTCEPEVQNTTYLWWVNGQSLPVSPRLQLSNGNMTLTLLSVKRNDAGSYECEIQNPASANRSDPVTLNVLYGPDVPTISPSKANYRPGENLNLSCHAASNPPAQYSWFINGTFQQSTQELFIPNITVNNSGSYMCQAHNSATGLNRTTVTMITVSGSAPVLSAVATVGITIGVLARVALI(SEQIDNO:18)(19)MDP(DPEP1,Genbank登录号BC017023,Proc.Natl.Acad.Sci.USA.99(26):16899-16903(2002));WO2003016475(权利要求1);WO200264798(权利要求33;第85-87页);JP05003790(图6-8);WO9946284(图9);交叉参考:MIM:179780;AAH17023.1;BC017023_1411aaMWSGWWLWPLVAVCTADFFRDEAERIMRDSPVIDGHNDLPWQLLDMFNNRLQDERANLTTLAGTHTNIPKLRAGFVGGQFWSVYTPCDTQNKDAVRRTLEQMDVVHRMCRMYPETFLYVTSSAGIRQAFREGKVASLIGVEGGHSIDSSLGVLRALYQLGMRYLTLTHSCNTPWADNWLVDTGDSEPQSQGLSPFGQRVVKELNRLGVLIDLAHVSVATMKATLQLSRAPVIFSHSSAYSVCASRRNVPDDVLRLVKQTDSLVMVNFYNNYISCTNKANLSQVADHLDHIKEVAGARAVGFGGDFDGVPRVPEGLEDVSKYPDLIAELLRRNWTEAEVKGALADNLLRVFEAVEQASNLTQAPEEEPIPLDQLGGSCRTHYGYSSGASSLHRHWGLLLASLAPLVLCLSLL(SEQIDNO:19)(20)IL20Rα(IL20Ra、ZCYTOR7,Genbank登录号AF184971);ClarkH.F.等GenomeRes.13,2265-2270,2003;MungallA.J.等Nature425,805-811,2003;BlumbergH.等Cell104,9-19,2001;DumoutierL.等J.Immunol.167,3545-3549,2001;Parrish-NovakJ.等J.Bio.Chem.277,47517-47523,2002;PletnevS.等(2003)Biochemistry42:12617-12624;SheikhF.等(2004)J.Immunol.172,2006-2010;EP1394274(实施例11);US2004005320(实施例5);WO2003029262(第74-75页);WO2003002717(权利要求2;第63页);WO200222153(第45-47页);US2002042366(第20-21页);WO200146261(第57-59页);WO200146232(第63-65页);WO9837193(权利要求1;第55-59页);登录号:Q9UHF4;Q6UWA9;Q96SH8;EMBL;AF184971;AAF01320.1。553aaMRAPGRPALRPLPLPPLLLLLLAAPWGRAVPCVSGGLPKPANITFLSINMKNVLQWTPPEGLQGVKVTYTVQYFIYGQKKWLNKSECRNINRTYCDLSAETSDYEHQYYAKVKAIWGTKCSKWAESGRFYPFLETQIGPPEVALTTDEKSISVVLTAPEKWKRNPEDLPVSMQQIYSNLKYNVSVLNTKSNRTWSQCVTNHTLVLTWLEPNTLYCVHVESFVPGPPRRAQPSEKQCARTLKDQSSEFKAKIIFWYVLPISITVFLFSVMGYSIYRYIHVGKEKHPANLILIYGNEFDKRFFVPAEKIVINFITLNISDDSKISHQDMSLLGKSSDVSSLNDPQPSGNLRPPQEEEEVKHLGYASHLMEIFCDSEENTEGTSFTQQESLSRTIPPDKTVIEYEYDVRTTDICAGPEEQELSLQEEVSTQGTLLESQAALAVLGPQTLQYSYTPQLQDLDPLAQEHTDSEEGPEEEPSTTLVDWDPQTGRLCIPSLSSFDQDSEGCEPSEGDGLGEEGLLSRLYEEPAPDRPPGENETYLMQFMEEWGLYVQMEN(SEQIDNO:20)(21)短小蛋白聚糖(BCAN、BEHAB,Genbank登录号AF229053)GaryS.C.等Gene256,139-147,2000;ClarkH.F.等GenomeRes.13,2265-2270,2003;StrausbergR.L.等Proc.Natl.Acad.Sci.USA.99,16899-16903,2002;US2003186372(权利要求11);US2003186373(权利要求11);US2003119131(权利要求1;图52);US2003119122(权利要求1;图52);US2003119126(权利要求1);US2003119121(权利要求1;图52);US2003119129(权利要求1);US2003119130(权利要求1);US2003119128(权利要求1;图52);US2003119125(权利要求1);WO2003016475(权利要求1);WO200202634(权利要求1);911aaMAQLFLPLLAALVLAQAPAALADVLEGDSSEDRAFRVRIAGDAPLQGVLGGALTIPCHVHYLRPPPSRRAVLGSPRVKWTFLSRGREAEVLVARGVRVKVNEAYRFRVALPAYPASLTDVSLALSELRPNDSGIYRCEVQHGIDDSSDAVEVKVKGVVFLYREGSARYAFSFSGAQEACARIGAHIATPEQLYAAYLGGYEQCDAGWLSDQTVRYPIQTPREACYGDMDGFPGVRNYGVVDPDDLYDVYCYAEDLNGELFLGDPPEKLTLEEARAYCQERGAEIATTGQLYAAWDGGLDHCSPGWLADGSVRYPIVTPSQRCGGGLPGVKTLFLFPNQTGFPNKHSRFNVYCFRDSAQPSAIPEASNPASNPASDGLEAIVTVTETLEELQLPQEATESESRGAIYSIPIMEDGGGGSSTPEDPAEAPRTLLEFETQSMVPPTGFSEEEGKALEEEEKYEDEEEKEEEEEEEEVEDEALWAWPSELSSPGPEASLPTEPAAQEKSLSQAPARAVLQPGASPLPDGESEASRPPRVHGPPTETLPTPRERNLASPSPSTLVEAREVGEATGGPELSGVPRGESEETGSSEGAPSLLPATRAPEGTRELEAPSEDNSGRTAPAGTSVQAQPVLPTDSASRGGVAVVPASGDCVPSPCHNGGTCLEEEEGVRCLCLPGYGGDLCDVGLRFCNPGWDAFQGACYKHFSTRRSWEEAETQCRMYGAHLASISTPEEQDFINNRYREYQWIGLNDRTIEGDFLWSDGVPLLYENWNPGQPDSYFLSGENCVVMVWHDQGQWSDVPCNYHLSYTCKMGLVSCGPPPELPLAQVFGRPRLRYEVDTVLRYRCREGLAQRNLPLIRCQENGRWEAPQISCVPRRPARALHPEEDPEGRQGRLLGRWKALLIPPSSPMPGP(SEQIDNO:21)(22)EphB2R(DRT、ERK、Hek5、EPHT3、Tyro5,Genbank登录号NM_004442)Chan,J.和Watt,V.M.,Oncogene6(6),1057-1061(1991)Oncogene10(5):897-905(1995),Annu.Rev.Neurosci.21:309-345(1998),Int.Rev.Cytol.196:177-244(2000));WO2003042661(权利要求12);WO200053216(权利要求1;第41页);WO2004065576(权利要求1);WO2004020583(权利要求9);WO2003004529(第128-132页);WO200053216(权利要求1;第42页);交叉参考:MIM:600997;NP_004433.2;NM_004442_1987aaMALRRLGAALLLLPLLAAVEETLMDSTTATAELGWMVHPPSGWEEVSGYDENMNTIRTYQVCNVFESSQNNWLRTKFIRRRGAHRIHVEMKFSVRDCSSIPSVPGSCKETFNLYYYEADFDSATKTFPNWMENPWVKVDTIAADESFSQVDLGGRVMKINTEVRSFGPVSRSGFYLAFQDYGGCMSLIAVRVFYRKCPRIIQNGAIFQETLSGAESTSLVAARGSCIANAEEVDVPIKLYCNGDGEWLVPIGRCMCKAGFEAVENGTVCRGCPSGTFKANQGDEACTHCPINSRTTSEGATNCVCRNGYYRADLDPLDMPCTTIPSAPQAVISSVNETSLMLEWTPPRDSGGREDLVYNIICKSCGSGRGACTRCGDNVQYAPRQLGLTEPRIYISDLLAHTQYTFEIQAVNGVTDQSPFSPQFASVNITTNQAAPSAVSIMHQVSRTVDSITLSWSQPDQPNGVILDYELQYYEKELSEYNATAIKSPTNTVTVQGLKAGAIYVFQVRARTVAGYGRYSGKMYFQTMTEAEYQTSIQEKLPLIIGSSAAGLVFLIAVVVIAIVCNRRRGFERADSEYTDKLQHYTSGHMTPGMKIYIDPFTYEDPNEAVREFAKEIDISCVKIEQVIGAGEFGEVCSGHLKLPGKREIFVAIKTLKSGYTEKQRRDFLSEASIMGQFDHPNVIHLEGVVTKSTPVMIITEFMENGSLDSFLRQNDGQFTVIQLVGMLRGIAAGMKYLADMNYVHRDLAARNILVNSNLVCKVSDFGLSRFLEDDTSDPTYTSALGGKIPIRWTAPEAIQYRKFTSASDVWSYGIVMWEVMSYGERPYWDMTNQDVINAIEQDYRLPPPMDCPSALHQLMLDCWQKDRNHRPKFGQIVNTLDKMIRNPNSLKAMAPLSSGINLPLLDRTIPDYTSFNTVDEWLEAIKMGQYKESFANAGFTSFDVVSQMMMEDILRVGVTLAGHQKKILNSIQVMRAQMNQIQSVEV(SEQIDNO:22)(23)ASLG659(B7h,Genbank登录号AX092328)US20040101899(权利要求2);WO2003104399(权利要求11);WO2004000221(图3);US2003165504(权利要求1);US2003124140(实施例2);US2003065143(图60);WO2002102235(权利要求13;第299页);US2003091580(实施例2);WO200210187(权利要求6;图10);WO200194641(权利要求12;图7b);WO200202624(权利要求13;图1A-1B);US2002034749(权利要求54;第45-46页);WO200206317(实施例2;第320-321页,权利要求34;第321-322页);WO200271928(第468-469页);WO200202587(实施例1;图1);WO200140269(实施例3;第190-192页);WO200036107(实施例2;第205-207页);WO2004053079(权利要求12);WO2003004989(权利要求1);WO200271928(第233-234、452-453页);WO0116318;282aaMASLGQILFWSIISIIIILAGAIALIIGFGISGRHSITVTTVASAGNIGEDGILSCTFEPDIKLSDIVIQWLKEGVLGLVHEFKEGKDELSEQDEMFRGRTAVFADQVIVGNASLRLKNVQLTDAGTYKCYIITSKGKKNANLEYKTGAFSMPEVNVDYNASSETLRCEAPRWFPQPTVVWASQVDQGANFSEVSNTSFELNSENVTMKVVSVLYNVTINNTYSCMIENDIAKATGDIKVTESEIKRRSHLQLLNSKASLCVSSFFAISWALLPLSPYLMLK(SEQIDNO:23)(24)PSCA(前列腺干细胞抗原前体,Genbank登录号AJ297436)ReiterR.E.等Proc.Natl.Acad.Sci.USA.95,1735-1740,1998;GuZ.等Oncogene19,1288-1296,2000;Biochem.Biophys.Res.Commun.(2000)275(3):783-788;WO2004022709;EP1394274(实施例11);US2004018553(权利要求17);WO2003008537(权利要求1);WO200281646(权利要求1;第164页);WO2003003906(权利要求10;第288页);WO200140309(实施例1;图17);US2001055751(实施例1;图1b);WO200032752(权利要求18;图1);WO9851805(权利要求17;第97页);WO9851824(权利要求10;第94页);WO9840403(权利要求2;图1B);登录号:O43653;EMBL;AF043498;AAC39607.1。123aaMKAVLLALLMAGLALQPGTALLCYSCKAQVSNEDCLQVENCTQLGEQCWTARIRAVGLLTVISKGCSLNCVDDSQDYYVGKKNITCCDTDLCNASGAHALQPAAAILALLPALGLLLWGPGQL(SEQIDNO:24)(25)GEDA(Genbank登录号AY260763);AAP14954脂肪瘤HMGIC融合伴侣样蛋白/pid=AAP14954.1–智人物种:智人(人)WO2003054152(权利要求20);WO2003000842(权利要求1);WO2003023013(实施例3,权利要求20);US2003194704(权利要求45);交叉参考:GI:30102449;AAP14954.1;AY260763_1236aaMPGAAAAAAAAAAAMLPAQEAAKLYHTNYVRNSRAIGVLWAIFTICFAIVNVVCFIQPYWIGDGVDTPQAGYFGLFHYCIGNGFSRELTCRGSFTDFSTLPSGAFKAASFFIGLSMMLIIACIICFTLFFFCNTATVYKICAWMQLTSAACLVLGCMIFPDGWDSDEVKRMCGEKTDKYTLGACSVRWAYILAIIGILDALILSFLAFVLGNRQDSLMAEELKAENKVLLSQYSLE(SEQIDNO:25)(26)BAFF-R(B细胞活化因子受体、BlyS受体3、BR3,Genbank登录号NP_443177.1);NP_443177BAFF受体/pid=NP_443177.1–智人Thompson,J.S.等Science293(5537),2108-2111(2001);WO2004058309;WO2004011611;WO2003045422(实施例;第32-33页);WO2003014294(权利要求35;图6B);WO2003035846(权利要求70;第615-616页);WO200294852(第136-137列);WO200238766(权利要求3;第133页);WO200224909(实施例3;图3);交叉参考:MIM:606269;NP_443177.1;NM_052945_1184aaMRRGPRSLRGRDAPAPTPCVPAECFDLLVRHCVACGLLRTPRPKPAGASSPAPRTALQPQESVGAGAGEAALPLPGLLFGAPALLGLALVLALVLVGLVSWRRRQRRLRGASSAEAPDGDKDAPEPLDKVIILSPGISDATAPAWPPPGEDPGTTPPGHSVPVPATELGSTELVTTKTAGPEQQ(SEQIDNO:26)(27)CD22(B细胞受体CD22-B同种型,Genbank登录号NP-001762.1);Stamenkovic,I.和Seed,B.,Nature345(6270),74-77(1990);US2003157113;US2003118592;WO2003062401(权利要求9);WO2003072036(权利要求1;图1);WO200278524(实施例2);交叉参考:MIM:107266;NP_001762.1;NM_001771_1847aaMHLLGPWLLLLVLEYLAFSDSSKWVFEHPETLYAWEGACVWIPCTYRALDGDLESFILFHNPEYNKNTSKFDGTRLYESTKDGKVPSEQKRVQFLGDKNKNCTLSIHPVHLNDSGQLGLRMESKTEKWMERIHLNVSERPFPPHIQLPPEIQESQEVTLTCLLNFSCYGYPIQLQWLLEGVPMRQAAVTSTSLTIKSVFTRSELKFSPQWSHHGKIVTCQLQDADGKFLSNDTVQLNVKHTPKLEIKVTPSDAIVREGDSVTMTCEVSSSNPEYTTVSWLKDGTSLKKQNTFTLNLREVTKDQSGKYCCQVSNDVGPGRSEEVFLQVQYAPEPSTVQILHSPAVEGSQVEFLCMSLANPLPTNYTWYHNGKEMQGRTEEKVHIPKILPWHAGTYSCVAENILGTGQRGPGAELDVQYPPKKVTTVIQNPMPIREGDTVTLSCNYNSSNPSVTRYEWKPHGAWEEPSLGVLKIQNVGWDNTTIACARCNSWCSWASPVALNVQYAPRDVRVRKIKPLSEIHSGNSVSLQCDFSSSHPKEVQFFWEKNGRLLGKESQLNFDSISPEDAGSYSCWVNNSIGQTASKAWTLEVLYAPRRLRVSMSPGDQVMEGKSATLTCESDANPPVSHYTWFDWNNQSLPHHSQKLRLEPVKVQHSGAYWCQGTNSVGKGRSPLSTLTVYYSPETIGRRVAVGLGSCLAILILAICGLKLQRRWKRTQSQQGLQENSSGQSFFVRNKKVRRAPLSEGPHSLGCYNPMMEDGISYTTLRFPEMNIPRTGDAESSEMQRPPRTCDDTVTYSALHKRQVGDYENVIPDFPEDEGIHYSELIQFGVGERPQAQENVDYVILKH(SEQIDNO:27)(28)CD79a(CD79A,CD79α,免疫球蛋白相关α,与Igβ(CD79B)发生共价作用并在表面与IgM分子形成复合物、转导参与B细胞分化信号的B细胞特异性蛋白)蛋白序列全部mpggpgv...dvqlekp(1..226;226aa),pI:4.84,MW:25028TM:2[P]基因染色体:19q13.2,Genbank登录号NP_001774.1;WO2003088808,US20030228319;WO2003062401(权利要求9);US2002150573(权利要求4,第13-14页);WO9958658(权利要求13,图16);WO9207574(图1);US5644033;Ha等(1992)J.Immunol.148(5):1526-1531;Mueller等(1992)Eur.J.Biochem.22:1621-1625;Hashimoto等(1994)Immunogenetics40(4):287-295;Preud’homme等(1992)Clin.Exp.Immunol.90(1):141-146;Yu等(1992)J.Immunol.148(2)633-637;Sakaguchi等(1988)EMBOJ.7(11):3457-3464;226aaMPGGPGVLQALPATIFLLFLLSAVYLGPGCQALWMHKVPASLMVSLGEDAHFQCPHNSSNNANVTWWRVLHGNYTWPPEFLGPGEDPNGTLIIQNVNKSHGGIYVCRVQEGNESYQQSCGTYLRVRQPPPRPFLDMGEGTKNRIITAEGIILLFCAVVPGTLLLFRKRWQNEKLGLDAGDEYEDENLYEGLNLDDCSMYEDISRGLQGTYQDVGSLNIGDVQLEKP(SEQIDNO:28)(29)CXCR5(伯基特淋巴瘤受体1,受CXCL13趋化因子活化的G蛋白偶联受体,在淋巴细胞迁移和体液防御中起作用,在HIV-2感染中、也可能在AIDS、淋巴瘤、骨髓瘤和白血病的发展中起作用)蛋白序列全部mnypltl...atslttf(1..372;372aa),pI:8.54MW:41959TM:7[P]基因染色体:11q23.3,Genbank登录号NP_001707.1;WO2004040000;WO2004015426;US2003105292(实施例2);US6555339(实施例2);WO200261087(图1);WO200157188(权利要求20,第269页);WO200172830(第12-13页);WO200022129(实施例1,第152-153页,实施例2,第254-256页);WO9928468(权利要求1,第38页);US5440021(实施例2,第49-52列);WO9428931(第56-58页);WO9217497(权利要求7,图5);Dobner等(1992)Eur.J.Immunol.22:2795-2799;Barella等(1995)Biochem.J.309:773-779;372aaMNYPLTLEMDLENLEDLFWELDRLDNYNDTSLVENHLCPATEGPLMASFKAVFVPVAYSLIFLLGVIGNVLVLVILERHRQTRSSTETFLFHLAVADLLLVFILPFAVAEGSVGWVLGTFLCKTVIALHKVNFYCSSLLLACIAVDRYLAIVHAVHAYRHRRLLSIHITCGTIWLVGFLLALPEILFAKVSQGHHNNSLPRCTFSQENQAETHAWFTSRFLYHVAGFLLPMLVMGWCYVGVVHRLRQAQRRPQRQKAVRVAILVTSIFFLCWSPYHIVIFLDTLARLKAVDNTCKLNGSLPVAITMCEFLGLAHCCLNPMLYTFAGVKFRSDLSRLLTKLGCTGPASLCQLFPSWRRSSLSESENATSLTTF(SEQIDNO:29)(30)HLA-DOB(能与肽结合并将肽提呈给CD4+T淋巴细胞的II型MHC分子的β亚基(Ia抗原)的β亚基)蛋白序列全部mgsgwvp...vllpqsc(1..273;273aa,pI:6.56MW:30820TM:1[P]基因染色体:6p21.3,Genbank登录号NP_002111.1;Tonnelle等(1985)EMBOJ.4(11):2839-2847;Jonsson等(1989)Immunogenetics29(6):411-413;Beck等(1992)J.Mol.Biol.228:433-441;Strausberg等(2002)Proc.Natl.Acad.SciUSA99:16899-16903;Servenius等(1987)J.Bio.Chem.262:8759-8766;Beck等(1996)J.Mol.Biol.255:1-13;Naruse等(2002)TissueAntigens59:512-519;WO9958658(权利要求13,图15);US6153408(第35-38列);US5976551(第168-170列);US6011146(第145-146列);Kasahara等(1989)Immunogenetics30(1):66-68;Larhammar等(1985)J.Bio.Chem.260(26):14111-14119;273aaMGSGWVPWVVALLVNLTRLDSSMTQGTDSPEDFVIQAKADCYFTNGTEKVQFVVRFIFNLEEYVRFDSDVGMFVALTKLGQPDAEQWNSRLDLLERSRQAVDGVCRHNYRLGAPFTVGRKVQPEVTVYPERTPLLHQHNLLHCSVTGFYPGDIKIKWFLNGQEERAGVMSTGPIRNGDWTFQTVVMLEMTPELGHVYTCLVDHSSLLSPVSVEWRAQSEYSWRKMLSGIAAFLLGLIFLLVGIVIQLRAQKGYVRTQMSGNEVSRAVLLPQSC(SEQIDNO:30)(31)P2X5(嘌呤能受体P2X配体-门控离子通道5,受胞外ATP门控的离子通道,可能参与突触传递和神经发生,其缺陷可造成特发性逼尿肌不稳定性的生理病变)蛋白序列全部mgqagck...lephrst(1..422;422aa),pI:7.63,MW:47206TM:1[P]基因染色体:17p13.3,Genbank登录号NP_002552.2;Le等(1997)FEBSLett.418(1-2):195-199;WO2004047749;WO2003072035(权利要求10);Touchman等(2000)GenomeRes.10:165-173;WO200222660(权利要求20);WO2003093444(权利要求1);WO2003087768(权利要求1);WO2003029277(第82页);422aaMGQAGCKGLCLSLFDYKTEKYVIAKNKKVGLLYRLLQASILAYLVVWVFLIKKGYQDVDTSLQSAVITKVKGVAFTNTSDLGQRIWDVADYVIPAQGENVFFVVTNLIVTPNQRQNVCAENEGIPDGACSKDSDCHAGEAVTAGNGVKTGRCLRRENLARGTCEIFAWCPLETSSRPEEPFLKEAEDFTIFIKNHIRFPKFNFSKSNVMDVKDRSFLKSCHFGPKNHYCPIFRLGSVIRWAGSDFQDIALEGGVIGINIEWNCDLDKAASECHPHYSFSRLDNKLSKSVSSGYNFRFARYYRDAAGVEFRTLMKAYGIRFDVMVNGKGAFFCDLVLIYLIKKREFYRDKKYEEVRGLEDSSQEAEDEASGLGLSEQLTSGPGLLGMPEQQELQEPPEAKRGSSSQKGNGSVCPQLLEPHRST(SEQIDNO:31)(32)CD72(B细胞分化抗原CD72,Lyb-2)蛋白序列全部maeaity...tafrfpd(1..359;359aa),pI:8.66,MW:40225TM:1[P]基因染色体:9p13.3,Genbank登录号NP_001773.1;WO2004042346(权利要求33);WO2003026493(第51-52、57-58页);WO200075655(第105-106页);VonHoegen等(1990)J.Immunol.144(12):4870-4877;Strausberg等(2002)Proc.Natl.Acad.SciUSA99:16899-16903;359aaMAEAITYADLRFVKAPLKKSISSRLGQDPGADDDGEITYENVQVPAVLGVPSSLASSVLGDKAAVKSEQPTASWRAVTSPAVGRILPCRTTCLRYLLLGLLLTCLLLGVTAICLGVRYLQVSQQLQQTNRVLEVTNSSLRQQLRLKITQLGQSAEDLQGSRRELAQSQEALQVEQRAHQAAEGQLQACQADRQKTKETLQSEEQQRRALEQKLSNMENRLKPFFTCGSADTCCPSGWIMHQKSCFYISLTSKNWQESQKQCETLSSKLATFSEIYPQSHSYYFLNSLLPNGGSGNSYWTGLSSNKDWKLTDDTQRTRTYAQSSKCNKVHKTWSWWTLESESCRSSLPYICEMTAFRFPD(SEQIDNO:32)(33)LY64(淋巴细胞抗原64(RP105),富含亮氨酸的重复序列(LRR)家族的I型膜蛋白,调节B细胞活化和凋亡,其功能缺失与系统性红斑狼疮患者的疾病活动升高相关)蛋白序列全部mafdvsc...rwkyqhi(1..661;661aa),pI:6.20,MW:74147TM:1[P]基因染色体:5q12,Genbank登录号NP_005573.1;US2002193567;WO9707198(权利要求11,第39-42页);Miura等(1996)Genomics38(3):299-304;Miura等(1998)Blood92:2815-2822;WO2003083047;WO9744452(权利要求8,第57-61页);WO200012130(第24-26页);661aaMAFDVSCFFWVVLFSAGCKVITSWDQMCIEKEANKTYNCENLGLSEIPDTLPNTTEFLEFSFNFLPTIHNRTFSRLMNLTFLDLTRCQINWIHEDTFQSHHQLSTLVLTGNPLIFMAETSLNGPKSLKHLFLIQTGISNLEFIPVHNLENLESLYLGSNHISSIKFPKDFPARNLKVLDFQNNAIHYISREDMRSLEQAINLSLNFNGNNVKGIELGAFDSTVFQSLNFGGTPNLSVIFNGLQNSTTQSLWLGTFEDIDDEDISSAMLKGLCEMSVESLNLQEHRFSDISSTTFQCFTQLQELDLTATHLKGLPSGMKGLNLLKKLVLSVNHFDQLCQISAANFPSLTHLYIRGNVKKLHLGVGCLEKLGNLQTLDLSHNDIEASDCCSLQLKNLSHLQTLNLSHNEPLGLQSQAFKECPQLELLDLAFTRLHINAPQSPFQNLHFLQVLNLTYCFLDTSNQHLLAGLPVLRHLNLKGNHFQDGTITKTNLLQTVGSLEVLILSSCGLLSIDQQAFHSLGKMSHVDLSHNSLTCDSIDSLSHLKGIYLNLAANSINIISPRLLPILSQQSTINLSHNPLDCTCSNIHFLTWYKENLHKLEGSEETTCANPPSLRGVKLSDVKLSCGITAIGIFFLIVFLLLLAILLFFAVKYLLRWKYQHI(SEQIDNO:33)(34)FCRH1(Fc受体样蛋白1,推测为含有C2型Ig样和ITAM结构域的免疫球蛋白Fc结构域的受体,可能在B-淋巴细胞分化中起作用)蛋白序列全部mlprlll...vdyedam(1..429;429aa),pI:5.28,MW:46925TM:1[P]基因染色体:1q21-1q22,Genbank登录号NP_443170.1;WO2003077836;WO200138490(权利要求6,图18E-1-18-E-2);Davis等(2001)Proc.Natl.Acad.SciUSA98(17):9772-9777;WO2003089624(权利要求8);EP1347046(权利要求1);WO2003089624(权利要求7);429aaMLPRLLLLICAPLCEPAELFLIASPSHPTEGSPVTLTCKMPFLQSSDAQFQFCFFRDTRALGPGWSSSPKLQIAAMWKEDTGSYWCEAQTMASKVLRSRRSQINVHRVPVADVSLETQPPGGQVMEGDRLVLICSVAMGTGDITFLWYKGAVGLNLQSKTQRSLTAEYEIPSVRESDAEQYYCVAENGYGPSPSGLVSITVRIPVSRPILMLRAPRAQAAVEDVLELHCEALRGSPPILYWFYHEDITLGSRSAPSGGGASFNLSLTEEHSGNYSCEANNGLGAQRSEAVTLNFTVPTGARSNHLTSGVIEGLLSTLGPATVALLFCYGLKRKIGRRSARDPLRSLPSPLPQEFTYLNSPTPGQLQPIYENVNVVSGDEVYSLAYYNQPEQESVAAETLGTHMEDKVSLDIYSRLRKANITDVDYEDAM(SEQIDNO:34)(35)IRTA2(免疫球蛋白超家族受体易位相关2,推测在B细胞发育和淋巴瘤发生中可能起作用的免疫受体;在一些B细胞恶性肿瘤中发生易位使该基因失调)蛋白序列全部mllwvil...assaphr(1..977;977aa),pI:6.88MW:106468TM:1[P]基因染色体:1q21,Genbank登录号NP_112571.1;WO2003024392(权利要求2,图97);Nakayama等(2000)Biochem.Biophys.Res.Commun.277(1):124-127;WO2003077836;WO200138490(权利要求3,图18B-1-18B-2);977aaMLLWVILLVLAPVSGQFARTPRPIIFLQPPWTTVFQGERVTLTCKGFRFYSPQKTKWYHRYLGKEILRETPDNILEVQESGEYRCQAQGSPLSSPVHLDFSSASLILQAPLSVFEGDSVVLRCRAKAEVTLNNTIYKNDNVLAFLNKRTDFHIPHACLKDNGAYRCTGYKESCCPVSSNTVKIQVQEPFTRPVLRASSFQPISGNPVTLTCETQLSLERSDVPLRFRFFRDDQTLGLGWSLSPNFQITAMWSKDSGFYWCKAATMPHSVISDSPRSWIQVQIPASHPVLTLSPEKALNFEGTKVTLHCETQEDSLRTLYRFYHEGVPLRHKSVRCERGASISFSLTTENSGNYYCTADNGLGAKPSKAVSLSVTVPVSHPVLNLSSPEDLIFEGAKVTLHCEAQRGSLPILYQFHHEDAALERRSANSAGGVAISFSLTAEHSGNYYCTADNGFGPQRSKAVSLSITVPVSHPVLTLSSAEALTFEGATVTLHCEVQRGSPQILYQFYHEDMPLWSSSTPSVGRVSFSFSLTEGHSGNYYCTADNGFGPQRSEVVSLFVTVPVSRPILTLRVPRAQAVVGDLLELHCEAPRGSPPILYWFYHEDVTLGSSSAPSGGEASFNLSLTAEHSGNYSCEANNGLVAQHSDTISLSVIVPVSRPILTFRAPRAQAVVGDLLELHCEALRGSSPILYWFYHEDVTLGKISAPSGGGASFNLSLTTEHSGIYSCEADNGPEAQRSEMVTLKVAVPVSRPVLTLRAPGTHAAVGDLLELHCEALRGSPLILYRFFHEDVTLGNRSSPSGGASLNLSLTAEHSGNYSCEADNGLGAQRSETVTLYITGLTANRSGPFATGVAGGLLSIAGLAAGALLLYCWLSRKAGRKPASDPARSPPDSDSQEPTYHNVPAWEELQPVYTNANPRGENVVYSEVRIIQEKKKHAVASDPRHLRNKGSPIIYSEVKVASTPVSGSLFLASSAPHR(SEQIDNO:35)也参见:WO04/045516(2004年6月3日);WO03/000113(2003年1月3日);WO02/016429(2002年2月28日);WO02/16581(2002年2月28日);WO03/024392(2003年3月27日);WO04/016225(2004年2月26日);WO01/40309(2001年6月7日)和2003年11月17日提交的美国临时专利申请序列号60/520842“治疗血液来源肿瘤的组合物和方法”(COMPOSITIONSANDMETHODSFORTHETREATMENTOFTUMOROFHEMATOPOIETICORIGIN);将所有上述文献以全文纳入本文作为参考。在一个具体的实施方式中,所述配体-接头-药物偶联物具有式IIIa,其中配体为抗体Ab,包括至少与CD30、CD40、CD70、LewisY抗原,w=0,y=0之一结合的抗体,D具有式Ib。示范性的式IIIa偶联物包括R17为-(CH2)5-的偶联物。也包括D具有实施例3中化合物2及其酯结构的式IIIa偶联物。也包括式IIIa中含有约3到8个,在一个方面约3到5个药物部分D的偶联物,即其中p值范围为3到8,如3到5的式Ia偶联物。认为含有本章节中注明的结构特征组合的偶联物也在本发明化合物的范围中。在另一实施方式中,所述配体-接头-药物偶联物具有式IIIa,其中配体为抗体Ab,包括至少与CD30、CD40、CD70、LewisY抗原,w=1,y=0之一结合的抗体,D具有式Ib。包括R17为-(CH2)5-的式IIIa偶联物。也包括其中W为-Val-Cit-,和/或D具有实施例3中化合物2及其酯结构的式IIIa偶联物。也包括式IIIa中含有约3到8个,优选约3到5个药物部分D的偶联物,即其中p值范围为3到8,优选3到5的式Ia偶联物。含有本章节中注明的结构特征组合的偶联物也是范例。在一个实施方式中,所述配体-接头-药物偶联物具有式IIIa,其中配体为包含至少与CD30、CD40、CD70、LewisY抗原,w=1,y=1之一结合的抗体Ab,D具有式Ib。也包括R17为-(CH2)5-的式IIIa偶联物。也包括其中W为-Val-Cit-;Y具有式X;D具有实施例3中化合物2及其酯的结构;p约为3到8,优选约3到5个药物部分D的式IIIa偶联物。认为含有本章节中注明的结构特征组合的偶联物也属于本发明化合物的范围。又一实施方式为抗体-药物偶联物(ADC),或其药学上可接受的盐或溶剂合物,其中Ab为与上述肿瘤相关抗原(1)-(35)之一(TAA化合物)结合的抗体。另一实施方式为TAA化合物或其药学上可接受的盐或溶剂合物的分离纯化形式。另一实施方式为杀伤或抑制肿瘤细胞或癌细胞增殖的方法,包括将一定量TAA化合物或其药学上可接受的盐或溶剂合物给予超增殖疾病患者,所述用量能有效杀伤或抑制肿瘤细胞或癌细胞的增殖。另一实施方式为治疗癌症的方法,包括将一定量TAA化合物或其药学上可接受的盐或溶剂合物给予超增殖疾病患者,所述用量单独或与其它有效量抗癌药联用能有效治疗癌症。另一实施方式为治疗自身免疫病的方法,包括将一定量TAA化合物或其药学上可接受的盐或溶剂合物给予超增殖疾病患者,所述用量能够有效治疗自身免疫病。本发明中适用的抗体可用抗体合成领域的已知方法,具体是化学合成或重组表达方法来生产,优选用重组表达技术生产。4.5.1重组抗体的生产可用抗体合成领域中已知的方法,具体是化学合成或重组表达方法生产本发明的抗体。抗体或其片段、衍生物或类似物的重组表达需要构建编码该抗体的核酸。如果抗体的核苷酸序列已知,编码抗体的核苷酸可用化学合成的寡核苷酸组装(如Kutmeier等,1994,BioTechniques17:242所述),包括合成含有编码抗体的部分序列的重叠寡核苷酸,退火和连接这些寡核苷酸,然后通过如PCR扩增连接的寡核苷酸。或者,可由合适来源产生编码抗体的核酸分子。如果不能买到含有编码具体抗体的核酸的克隆,但抗体的序列已知,那么可以用能与该序列3’和5’末端杂交的合成引物作PCR扩增,或用该具体基因序列的特异性寡核苷酸探针克隆,从合适的来源(如抗体cDNA文库,或从表达该免疫球蛋白的组织或细胞产生的cDNA文库)获得编码该抗体的核酸。如果特异性识别某具体抗原的抗体不可购得(或没有用于克隆编码此免疫球蛋白的核酸的cDNA文库来源),该具体抗原的特异性抗体可通过本领域已知方法产生,如免疫病人或合适的动物模型如兔或鼠,以产生多克隆抗体,或更优选如Kohler和Milstein(1975,Nature256:495-497)所述,或如Kozbor等(1983,ImmunologyToday4:72)或Cole等(1985《单克隆抗体和癌症治疗》(MonoclonalAntibodiesandCancerTherapy),AlanR.Liss,Inc.,第77-96页)所述产生单克隆抗体。或者,可通过筛选Fab表达文库(如Huse等,1989,Science246:1275-1281所述)中能与该具体抗原结合的Fab片段的克隆或通过筛选抗体文库(参见例如Clackson等,1991,Nature352:624;Hane等,1997Proc.Natl.Acad.Sci.USA94:4937)获得编码该抗体的至少Fab部分的克隆。一旦获得至少编码该抗体可变区的核酸序列时,可将其引入含有编码该抗体恒定区核苷酸序列的载体中(参见例如国际公开专利WO86/05807;WO89/01036;和美国专利号5122464)。含有表达完整抗体分子的完全轻链或重链的载体可买到。然后,可利用编码该抗体的核苷酸引入核苷酸取代或缺失,这对取代(或缺失)参与和不含巯基的氨基酸残基形成链内二硫键的一个或多个可变区半胱氨酸残基是必需的。该修饰可通过在核苷酸序列中引入特定突变或缺失的本领域已知的任何方法进行,例如但不限于,化学诱变和体外定点诱变(Hutchinson等,1978,J.Bio.Chem.253:6551)。此外,可使用开发的通过剪接具有合适抗原特异性的鼠抗体分子基因与具有合适生物学活性的人抗体分子基因来产生“嵌合抗体”(Morrison等,1984,Proc.Natl.Acad.Sci.81:851-855;Neuberger等,1984,Nature312:604-608;Takeda等,1985,Nature314:452-454)的技术。嵌合抗体是不同部分来源于不同种动物的分子,如可变区来源于鼠单克隆抗体,恒定区来源于人免疫球蛋白,如人源化抗体。或者,可采取用于生产单链抗体所述的技术(美国专利4,694,778;Bird,1988,Science242:423-42;Huston等,1988,Proc.Natl.Acad.Sci.USA85:5879-5883;和Ward等,1989,Nature334:544-54)来生产单链抗体。通过一氨基酸桥连接Fv区的重链和轻链片段形成一条多肽链,而产生单链抗体。亦可采用在大肠杆菌中组装功能性Fv片段的技术(Skerra等,1988,Science242:1038-1041)。可通过已知技术产生识别特定表位的抗体片段。例如,此种片段包括但不限于:胃蛋白酶消化抗体分子产生的F(ab’)2片段和还原F(ab’)2片段二硫键桥产生的Fab片段。一旦获得编码抗体的核酸序列时,可通过重组DNA技术用本领域熟知技术产生生产抗体的载体。可用本领域技术人员熟知的方法构建包含抗体编码序列和合适转录和翻译控制信号的表达载体。这些方法包括例如:体外重组DNA技术、合成技术、体内基因重组。参见例如Sambrook等(1990,《分子克隆,试验室手册》(MolecularCloning,ALaboratoryManual),第二版,ColdSpringHarborLaboratory,ColdSpringHarbor,NY)和Ausubel等(编,1998,《新编分子生物学试验指南》(CurrentProtocolsinMolecularBiology),JohnWiley&Sons,NY)所述技术。可用常规方法(如电穿孔、脂质体转染和磷酸钙沉淀)将包含某抗体核苷酸序列的表达载体或某抗体核苷酸序列转移至宿主细胞中,然后在常规培养技术下培养转染细胞以产生该抗体。在特定实施方式中,由组成型、可诱导性或组织特异性启动子调节该抗体的表达。用于表达重组抗体的宿主细胞可以是细菌细胞如大肠杆菌,或优选真核细胞,特别是用于表达整个重组免疫球蛋白分子时。具体说,哺乳动物细胞如中国仓鼠卵巢细胞(CHO),与诸如人巨细胞病毒的主要中间早期基因启动子元件的载体结合,成为免疫球蛋白的有效表达系统(Foecking等,198,Gene45:101;Cockett等,1990,BioTechnology8:2)。可用各种宿主表达载体系统表达免疫球蛋白抗体。此类宿主表达系统不仅提供了抗体编码序列可在其中产生接着纯化的运载体,而且提供了当用合适的核苷酸编码序列转化或转染时可原位表达抗体免疫球蛋分子的细胞。这些系统包括但不限于:微生物如用包含免疫球蛋白编码序列的重组噬菌体DNA、质粒DNA或粘粒DNA表达载体转化的细菌(如大肠杆菌和枯草芽孢杆菌);用包含免疫球蛋白编码序列的重组酵母表达载体转化的酵母(如毕赤酵母(SaccharomycesPichia));用包含免疫球蛋白编码序列的重组病毒表达载体(如杆状病毒)感染的昆虫细胞系统;用包含免疫球蛋白编码序列的重组病毒表达载体(如花椰菜花叶病毒(CaMV)和烟草花叶病毒(TMV))感染的或用包含免疫球蛋白编码序列的重组质粒表达载体(如Ti质粒)转化的植物细胞系统;或携带包含哺乳动物细胞基因组衍生启动子(如金属硫蛋白启动子)或哺乳动物病毒的启动子(如腺病毒晚期启动子,牛痘病毒7.5K启动子)的重组表达构建物的哺乳动物细胞系统(如COS、CHO、BH、293、293T、3T3细胞)。细菌系统中,根据所表达抗体的用途可优先选择数种表达系统。例如,当大量产生待表达蛋白时,可能需要能指导高水平融合蛋白产物表达并易于纯化的载体。此类载体包括但不限于:大肠杆菌表达载体pUR278(Ruther等,1983,EMBOJ.2:1791),其中将单个抗体编码序列与载体的lacZ编码区在阅读框内连接从而产生融合蛋白;pIN载体(Inouye&Inouye,1985,NuceicAcidsRes.13:3101-3109;VanHeeke&Schuster,1989,J.Bio.Chem.24:5503-5509)等。pGEX载体也可用于表达外来多肽,如与谷胱甘肽S转移酶(GST)的融合蛋白。通常,此类融合蛋白可溶,并可容易地通过吸附和结合于谷胱甘肽-琼脂糖珠基质然后在游离谷胱甘肽存在下洗脱从裂解细胞中纯化。设计pGEX载体,使其包括凝血酶或Xa因子蛋白酶切割位点,以使克隆的靶基因产物能够从GST部分中释放出来。在昆虫系统中,桃木菌属(Autographacalifornica)核多角体病毒(AcNPV)或果蝇(DrosophilaMelanogaster)的同类病毒可用作表达外源基因的载体。此病毒在表皮球菌(Spodopterafrugiperda)细胞中生长。抗体编码序列能够被单独克隆入病毒的非必需区(如多角体蛋白基因)中置于AcNPV启动子(如多角体蛋白启动子)的控制下。在哺乳动物宿主细胞中,可采用许多基于病毒的表达系统。当腺病毒用作表达载体时,可将感兴趣的抗体编码序列连接于腺病毒转录/翻译控制复合物,如晚期启动子和三重引导序列。然后,可通过体外或体内重组将此嵌合基因插入腺病毒基因组中。插入病毒基因组的非必需区域(如区域E1或E3)中产生活的能在感染宿主中表达免疫球蛋白分子的重组病毒(参见例如Logan&Shenk,1984,Proc.Natl.Acad.Sci.USA81:355-359)。也可能需要特定的起始信号以有效翻译插入的抗体编码序列。这些信号包括ATG起始密码子和毗邻序列。而且,起始密码子必须处于所需编码序列的阅读框中以保证整个插入物的翻译。这些外源性翻译控制信号和起始密码子可以是天然或合成的各种来源。可通过加入合适的转录增强子元件、转录终止子等增强表达的效率(参见Bittner等,1987,MethodsinEnzymol.153:51-544)。此外,可选择宿主细胞系来调节插入序列的表达,或以所需特定方式修饰和加工该基因产物。蛋白产物的这种修饰(如糖基化)和加工(如切割)可能对蛋白功能很重要。不同宿主细胞中蛋白和基因产物的翻译后加工和修饰有特征性和特定的机制。可选择合适的细胞系或宿主系统以保证正确地修饰和加工表达的外来蛋白。为此,可使用具有恰当加工基因产物的初级转录物、糖基化和磷酸化的细胞机制的真核宿主细胞。这些哺乳动物细胞包括但不限于:CHO、VERY、BH、Hela、COS、MDCK、293、293T、3T3、WI38、BT483、Hs578T、HTB2、BT20和T47D、CRL7030和Hs578Bst。优选长期高产量生产重组蛋白和稳定表达。例如,可工程改造稳定表达抗体的细胞系。比起利用包含病毒复制起点的表达载体,可用恰当表达调控元件(如启动子、增强子、序列、转录终止子和聚腺苷酸化位点等)和可选择标记控制的DNA转化宿主细胞。引入外来DNA后,工程改造的细胞可在富营养化培养基中生长1-2天,然后换为选择性培养基。重组质粒中的选择性标记提供选择抗性,并使细胞将质粒稳定地整合入它们的染色体中并生长形成斑点,进而可克隆并扩增成细胞系。这种方法宜用于改造表达抗体的细胞系。这种工程改造的细胞对于筛选和评价与该抗体直接或间接相互作用的肿瘤抗原尤其有用。可使用许多选择系统,包括但不限于:单纯疱疹病毒胸苷激酶(Wigler等,1977,Cell11:223),次黄嘌呤-鸟嘌呤磷酸核糖基转移酶(Szybalska&Szybalski,192,Proc.Natl.Acad.Sci.USA48:202)和腺嘌呤磷酸核糖基转移酶(Lowy等,1980,Cell22:817)基因,可分别用于tk-,hgprt-或aprt-细胞。同样,可利用对代谢物的抗性作为选择以下基因的基础:DHFR,提供甲氨蝶呤抗性(Wigler等,1980,Proc.Natl.Acad.Sci.USA77:357;O’Hare等,1981,Proc.Natl.Acad.Sci.USA78:1527);gpt,提供霉酚酸抗性(Mulligan&Berg,1981,Proc.Natl.Acad.Sci.USA78:2072);neo,提供氨基葡糖苷G418抗性(ClinicalPharmacy12:488-505;Wu和Wu,1991,Biotherapy3:87-95;Tolstoshev,1993,Ann.Rev.Pharmacol.Toxicol.32:573-596;Mulligan,1993,Science260:926-932;和Morgan和Anderson,1993,Ann.Rev.Biochem.62:191-217;May,1993,TIBTECH11(5):155-215)和hygro,提供潮霉素抗性(Santerre等,1984,Gene30:147)。可采用本领域共知的重组DNA技术,如Ausubel等(编.,1993,《新编分子生物学指南》(CurrentProtocolsinMolecularBiology),JohnWiley&Sons,NY;Kriegler,1990,《基因转移和表达,试验室手册》(GeneTransferandExpression,ALaboratoryManual),StocktonPress,NY;和12、13章,Dracopoli等(编),1994,《新编人类遗传学指南》(CurrentProtocolsinHumanGenetics),JohnWiley&Sons,NY.;Colberre-Garapin等,1981,J.Mol.Biol.150:1)所述。抗体的表达水平可通过载体扩增得到提高(综述,参见Bebbington和Hentschel,“在哺乳动物细胞中基于基因扩增用载体表达克隆的基因”(Theuseofvectorsbasedongeneamplificationfortheexpressionofclonedgenesinmammaliancells),刊于DNAcloning,第3卷,(AcademicPress,NewYork,1987))。当表达抗体的载体系统中某标记可扩增时,提高宿主细胞培养物中抑制剂的水平会增加该标记基因的拷贝数。因为扩增区与抗体核苷酸序列相连,抗体的产量也会提高(Crouse等,1983,Mol.Cell.Biol.3:257)。可用两种表达载体共转染宿主细胞,第一种载体编码重链衍生的多肽,第二种载体编码轻链衍生的多肽。这两种载体包含同样的选择性标记从而使轻链和重链多肽的表达相等。或者,可用一个载体同时编码重链和轻链多肽。此种情况下,应将轻链置于重链之前以避免毒性游离重链过量(Proudfoot,1986,Nature322:52;Kohler,1980,Proc.Natl.Acad.Sci.USA77:2197)。重链和轻链的编码序列可包括cDNA或基因组DNA。一旦抗体重组表达时,可用本领域已知的抗体纯化方法,如层析(如离子交换层析、亲和层析尤其是在蛋白A后的特异性抗原亲和层析和分子大小排阻柱层析)、离心、差异性溶解,或其它标准的蛋白纯化技术进行纯化。在又一示范性实施方式中,抗体是单克隆抗体。在任何情况下,杂交抗体具有双重特异性,优选具有对所选半抗原特异性的一个或多个结合位点或对靶抗原,如肿瘤相关抗原,自身免疫病相关抗原、传染性生物相关抗原或其它疾病相关抗原特异性的一个或多个结合位点。4.5.2抗体的生产参考抗-CD30抗体说明抗体的生产,但本领域技术人员明白TNF受体家族其它成员可通过相似方式来生产和修饰。CD30用于抗体生产仅为示范性,并不旨在限制。用于生产抗体的CD30抗原可为,例如包含所需表位的CD30胞外结构域或其部分的可溶形式。或者,在细胞表面表达CD30的细胞(如L540(具有T细胞表型的霍奇金淋巴瘤衍生细胞系)和L428(如具有B细胞表型的霍奇金淋巴瘤衍生细胞系))可用于产生抗体。本领域技术人员明白可用于产生抗体的CD30的其它形式。在另一示范性实施方式中,用于产生抗体的ErbB2抗原可以是,例如包含所需表位的ErbB2胞外结构域或其一部分的可溶形式。或者,在细胞表面表达ErbB2的细胞(如经转染过表达ErbB2的NIH-3T3细胞;或诸如SK-BR-3等癌细胞系,参见Stancovski等Proc.Natl.Acad.Sci.USA88:8691-8695(1991))可用于产生抗体。本领域技术人员明白用于产生抗体的ErbB2的其它形式。(i)多克隆抗体优选用相关抗原和佐剂多点皮下(sc)或腹腔内(ip)注射动物产生多克隆抗体。可利用双功能试剂或衍生剂,如磺基琥珀酰亚胺马来酰亚氨基苯甲酰酯(通过半胱氨酸残基偶联)、N-羟基琥珀酰亚胺(通过赖氨酸残基)、戊二醛、琥珀酸酐、SOCl2、或R和R1是不同烷基的R1N=C=NR,将相关抗原与在待免疫动物中具有免疫原性的蛋白,如钥孔血蓝素、血清白蛋白、牛甲状腺球蛋白或大豆胰蛋白酶抑制剂偶联。混合如100μg或5μg蛋白或偶联物(分别对于兔或鼠)与3体积的福氏完全佐剂,皮内多点注射该溶液用抗原、免疫原性偶联物或衍生物免疫动物。一个月后,用1/5到1/10初始量的肽或偶联物及福氏完全佐剂皮下多点注射作加强免疫。7-14天后动物放血并测定血清抗体滴度。加强免疫动物,直到滴度达到平台。优选用同一抗原与不同蛋白和/或通过不同交联剂偶联的偶联物加强免疫动物。也可在重组细胞培养物中制备作为蛋白融合物的偶联物。同样,凝聚剂如明矾也适用于增强免疫应答。(ii)单克隆抗体单克隆抗体获自一群基本均一的抗体,即组成群体的抗体除少量天然产生的突变外各个抗体都相同。因此,修饰语“单克隆”表明抗体的特性不是互补相关抗体的混合物。例如,可通过Kohler等,Nature,256:495(1975)首先描述的杂交瘤方法或重组DNA方法(美国专利号4816567)制备单克隆抗体。在杂交瘤方法中,如上文所述方法免疫小鼠或其他合适的宿主动物,如仓鼠,以诱生可产生或能够产生与免疫所用蛋白特异性结合的抗体的淋巴细胞。另外,可体外免疫淋巴细胞。利用合适的融合剂,如聚乙二醇,使淋巴细胞与骨髓瘤细胞融合,形成杂交瘤细胞(Goding,《单克隆抗体:原理和实践》(MonoclonalAntibody:PrinciplesandPractice),第59-103页(AcademicPress,1986))。接种如此制备的杂交瘤细胞,并在合适的培养基中培养,该培养基优选含有一种或多种抑制不融合的亲代骨髓瘤细胞生长或存活的物质。例如,若亲代骨髓瘤细胞缺乏次黄嘌呤鸟嘌呤磷酸核糖基转移酶(HGPRT或HPRT),杂交瘤培养基一般包含次黄嘌呤、氨甲喋呤和胸腺密啶核苷(HAT培养基),这些物质能够防止HGPRT-缺陷的细胞生长。优选有效融合、能支持所选抗体产生细胞稳定高水平产生抗体、和对培养基如HAT培养基敏感的骨髓瘤细胞。其中,优选的骨髓瘤细胞系为鼠骨髓瘤细胞系,如衍生自从SalkInstituteCellDistributionCenter,SanDiego,CaliforniaUSA购买的小鼠肿瘤细胞MOPC-21和MPC-11细胞,和获自美国典型培养物保藏中心,Rockville,MarylandUSA的SP-2或X63-Ag8-653细胞。人骨髓瘤和鼠-人混杂骨髓瘤细胞系亦被描述为可用于生产人单克隆抗体(Kozbor,J.Immunol.,133:3001(1984);和Brodeur等,《单克隆抗体生产技术和应用》(MonoclonalAntibodyProductionTechniquesandApplications),第51-63页(MarcelDekker,Inc.,NewYork,1987))。测定杂交瘤细胞培养基中产生的针对该抗原的单克隆抗体。杂交瘤细胞产生的单克隆抗体的结合特异性优选通过免疫沉淀或体外结合试验,如放射性免疫测定(RIA)或酶联免疫吸附试验(ELISA)测定。单克隆抗体结合亲和力可通过,如Munson等,Anal.Biochem.,107:220(1980)所述的斯卡查德分析来(Scatchardanalysis)测定。鉴定杂交瘤细胞产生的抗体具有所需特异性、亲和力和/或活性后,可通过有限稀释法将该克隆亚克隆并用标准方法培养(Goding,《单克隆抗体:原理和实践》(MonoclonalAntibody:PrinciplesandPractice),第59-103页(AcademicPress,1986))。符合此目的的合适培养基包括例如:D-MEM或RPMI-1640培养基。此外,杂交瘤细胞也可作为腹水瘤在动物体内生长。通过常规的抗体纯化步骤,如蛋白A-琼脂糖、羟基磷灰石色谱、凝胶电泳、透析或亲和色谱,从培养基、腹水或血清中适当地分离亚克隆分泌的单克隆抗体。采用常规方法(如采用能够特异性结合编码鼠抗体轻链和重链基因的寡核苷酸探针)不难分离和测序编码单克隆抗体的DNA。杂交瘤细胞可作为此类DNA的优选来源。分离后,可将此DNA置入表达载体中,然后将载体转染入宿主细胞如大肠杆菌细胞、猴COS细胞,中国仓鼠卵巢(CHO)细胞,或不产生抗体蛋白的骨髓瘤细胞中,在重组宿主细胞中合成单克隆抗体。在细菌中重组表达编码抗体的DNA的综述包括Skerra等,Curr.OpinioninImmunol.,5:256-262(1993)和Plückthun,Immunol.Revs.,130:151-188(1992)。在又一实施方式中,可从用McCafferty等,Nature,348:552-554(1990)所述技术产生的抗体噬菌体文库中分离单克隆抗体或抗体片段。Clackson等,Nature,352:624-628(1991)和Marks等,J.Mol.Biol.,222:581-597(1991)分别描述了利用噬菌体文库分离鼠和人抗体。后续出版物描述了通过链改组生产高亲和力(nM范围)的人抗体(Marks等,Bio/Technology,10:779-783(1992)),以及通过组合感染和体内重组方案构建非常大的噬菌体文库(Waterhouse等,Nuc.Acids.Res.,21:2265-2266(1993))。因此,这些技术可替代传统的单克隆抗体杂交瘤技术来分离单克隆抗体。亦可修饰DNA,例如,用人重链和轻链恒定区编码序列取代同源的鼠序列(美国专利号4816567;和Morrison,等(1984)Proc.NatlAcad.Sci.USA81:6851),或将非免疫球蛋白多肽的全部或部分编码序列共价连接于免疫球蛋白编码序列。一般地,此类非免疫球蛋白多肽用于取代抗体恒定区,或用于取代抗体的一个抗原结合位点的可变区,以产生包含对某抗原特异的一个抗原结合位点和对另一不同抗原特异的另一抗原结合位点的嵌合性二价抗体。(iii)人源化抗体人源化抗体可含非人来源的一个或多个氨基酸残基。这些非人氨基酸残基常称为“输入”残基,一般取自“输入”的可变区。基本上按照Winter和同事的方法(Jones等,Nature321:522-525(1986);Riechmann等,Nature,332:323-327(1988);Verhoeyen等,Science239:1534-1536(1988)),用超变区序列取代人抗体的相应序列进行人源化。因此,这类"人源化"抗体是嵌合抗体(美国专利号4,816,567),其中大大少于完整人可变区的部分被非人动物的相应序列取代。实际操作中,人源化抗体一般为一些超变区残基也许还有一些FR残基被啮齿动物抗体类似部位的残基取代的人抗体。对于制备人源化抗体降低抗原性而言,所用人可变区,包括重链和轻链可变区的选择非常重要。根据所谓“最适”方法,用已知的人可变区序列整个文库筛选啮齿动物抗体的可变区序列。然后,接受与啮齿动物序列最接近的人序列作为人源化抗体的人构架区(Sims等,J.Immunol.,151:2296(1993);Chothia等,J.Mol.Biol.,196:901(1987))。另一方法利用获自特定轻链或重链亚群的所有人抗体的共有序列的特定构架区。同样的构架可用于数种不同的人源化抗体(Carter等,Proc.Natl.Acad.Sci.USA,89:4285(1992);Presta等,J.Immunol.,151:2623(1993))。在另一实施方式中,可使人源化抗体保留对抗原的高亲和力和其它有利的生物学性能。可利用亲代和人源化序列的三维模型分析亲代序列和各种概念上的人源化产物的方法制备人源化抗体。三维免疫球蛋白模型通常可得到,是本领域技术人员所熟悉的。可用计算机程序说明和显示所选候选免疫球蛋白序列的可能三维构象结构。检视这些显示物可分析残基在候选免疫球蛋白序列中的可能功能作用,即分析可能影响候选免疫球蛋白与其抗原结合能力的残基。这样,选择并组合接受者和输入序列的FR残基,以获得所需的抗体特性,如提高对靶抗原的亲和力。通常,超变区残基直接并最充分参与影响抗原结合。考虑了各种形式的人源化抗体。例如,人源化抗体可以是抗体片段,如Fab。或者,人源化抗体可为完整抗体,如完整的IgG1抗体。实施例描述了示范性人源化抗体Anti-ErbB2抗体的生产。例如,人源化抗体可包含掺入人重链可变区中的非人超变区残基,还可包含用Kabat等,《免疫学感兴趣的蛋白序列》(SequencesofProteinsofImmunologicalInterest),第5版,公共卫生服务,国立卫生研究院(NationalInstitutesofHealth),Bethesda,MD(1991)所列可变区编号系统在选自69H、71H和73H的位置上的构架区(FR)取代。在一个实施方式中,人源化抗体在69H、71H和73H的两个或全部位置上包含FR取代。另一实施例描述了从贺赛汀制剂中制备纯化的曲妥珠单抗抗体。(iv)人抗体可产生作为人源化抗体替代的人抗体。例如,现在有可能产生经过免疫后不产生内源性免疫球蛋白但能产生人抗体全部组分(repertoire)的转基因动物(如小鼠)。例如,据描述,在嵌合和生殖细胞系突变的小鼠中抗体重链连接区(JH)基因的纯合缺失会完全抑制内源性抗体的产生。将人生殖细胞系免疫球蛋白基因阵列转入此生殖细胞系突变小鼠中将导致在抗原刺激时产生人抗体。参见例如Jakobovits等,Proc.Natl.Acad.Sci.USA,90:2551(1993);Jakobovits等,Nature,362:255-258(1993);Bruggermann等,《免疫学年鉴》(YearinImmuno.),7:33(1993);和美国专利号5,591,669、5,589,369和5,545,807。或者,可利用噬菌体展示技术(McCafferty等,Nature348:552-553(1990))在体外从未免疫供体的免疫球蛋白可变(V)区基因库产生人抗体和抗体片段。按照此技术,将抗体V区基因克隆入丝状噬菌体如M13或fd的主要或次要包膜蛋白基因的阅读框内,并在噬菌体颗粒表面展示为功能性抗体片段。因为该丝状颗粒包含噬菌体基因组的一条DNA链拷贝,基于抗体功能特性的选择也导致选出编码具有这些特性的抗体的基因。因此,噬菌体模拟了B细胞的一些性能。可以各种方式进行噬菌体展示;综述参见,如Johnson,KevinS.和Chiswell,DavidJ.,《结构生物学的当前观点》(CurrentOpinioninStructuralBiology)3:564-571(1993)。V基因节段的几种来源可用于噬菌体展示。Clackson等,Nature,352:624-628(1991)从衍生自免疫小鼠脾脏的V基因小随机组合文库中分离得到了抗-噁唑酮抗体的多样性阵列。可构建未免疫人供体的V基因库,针对各种抗原(包括自身抗原)的抗体可依照Marks等,J.Mol.Biol.222:581-597(1991),或Griffith等,EMBOJ.12:725-734(1993)所述技术分离。参见美国专利号5565332和5573905。如上所述,体外激活的B细胞也可产生人抗体(参见美国专利号5567610和5229275)。人抗CD30抗体见美国专利申请序列号10/338,366所述。(v)抗体片段已开发了产生抗体片段的各种技术。传统上,通过蛋白酶水解消化完整抗体产生这些片段(参见例如Morimoto等,JournalofBiochemicalandBiophysicalMethods24:107-117(1992);和Brennan等,Science,229:81(1985))。然而,现在这些片段可直接用重组宿主细胞生产。例如,可从上述抗体噬菌体文库中分离抗体片段。或者,可直接从大肠杆菌中回收Fab′-SH片段,化学偶联形成F(ab′)2片段(Carter等,Bio/Technology10:163-167(1992))。根据另一方法,F(ab′)2片段可直接分离自重组宿主细胞培养物。本领域技术人员明白产生抗体片段的其它技术。在其它实施方式中,所选抗体是单链Fv片段(scFv)。参见WO93/16185;美国专利号5,571,894;和美国专利号5,587,458。抗体片段亦可为“线性抗体”,如美国专利号5,641,870所述。此类线性抗体片段可以是单特异性或双特异性的。(vi)双特异性抗体双特异性抗体是对至少两个不同表位具有结合特异性的抗体。示范性的双特异性抗体可结合CD30蛋白的两个不同表位。或者,抗-CD30臂可与结合IgG(FcγR)如FcγRI(CD64)、FcγRII(CD32)和FcγRIII(CD16)的Fc受体的一条臂组合,以将细胞防御机制集中到表达CD30的细胞上。双特异性抗体亦可用于将细胞毒剂定位于表达CD30的细胞。全长双特异性抗体的传统生产方法基于两对特异性不同的免疫球蛋白重链-轻链对的共表达(Millstein等,Nature,305:537-539(1983))。由于免疫球蛋白重轻链的随机配对,这些杂交瘤(四体杂交瘤)可能产生10种不同抗体分子的混合物,其中只有一种具有正确的双特异性结构。通常用亲和层析步骤纯化正确分子相当麻烦,且产量低。类似方法公开于WO93/08829和Traunecker等,EMBOJ.,10:3655-3659(1991)。根据不同方法,将具有所需结合特异性的抗体可变区(抗体-抗原结合位点)与免疫球蛋白恒定区序列融合。优选与包含至少一部分绞链区、CH2和CH3的免疫球蛋白重链恒定区融合。优选在至少一个融合物中存在含有轻链结合所需位点的第一重链恒定区(CH1)。将编码免疫球蛋白重链融合物的DNA和(如果需要)编码免疫球蛋白轻链的DNA插入不同的表达载体中,共转染入合适的宿主生物体。在构建中使用不等比例的三种多肽链来优化产量时,以上实施方案为调整三种多肽片段的相互比例提供了最大的灵活性。然而,当至少两条多肽链以等比例表达导致高产率或它们的比例不具特殊意义时,可将两条或全部三条多肽链编码序列插入一个表达载体中。在此方法的一个实施方式中,双特异性抗体由一条臂上有第一结合特异性的杂交免疫球蛋白重链,和另一条臂上的一对杂交免疫球蛋白重链-轻链对(提供第二结合特异性)组成。发现此不对称结构有助于将所需双特异性化合物与不需要的免疫球蛋白链组合物分离,因为免疫球蛋白轻链仅存在于双特异性分子的一半中,这提供了容易的分离方式。该方法发表在WO94/04690中。产生双特异性抗体的其它细节参见例如:Suresh等,MethodsinEnzymology,121:210(1986)。按照美国专利号5,731,168所述另一方法,可工程改造一对抗体分子之间的界面以使从重组细胞培养物中获得异质二聚体的比例最大化。优选界面包含抗体恒定区CH3结构域的至少一部分。本方法中,用较大侧链(如酪氨酸或色氨酸)取代了第一抗体分子界面的一个或多个小侧链氨基酸。通过用较小侧链氨基酸(如丙氨酸或苏氨酸)取代大侧链氨基酸,在第二抗体分子界面上产生了与大侧链尺寸相同或相似的补偿性“空穴”。这提供了提高该异质二聚体产量超过不需要的终产物如同质二聚体的机制。文献报导了从抗体片段产生双特异性抗体的技术。例如,可用化学连接键制备双特异性抗体。Brennan等,Science,229:81(1985)描述了蛋白酶水解切割完整抗体产生F(ab′)2片段的方法。当存在二硫醇复合剂亚砷酸钠时还原这些片段可稳定邻近的二硫醇基团并防止分子间形成二硫键。然后将产生的Fab′片段转变为硫代硝基苯甲酸盐(TNB)衍生物。然后,再通过巯基乙二胺还原将一种Fab′-TNB衍生物转变为Fab′-硫醇,并将其与等摩尔量的其它Fab′-TNB衍生物混合形成双特异性抗体。产生的双特异性抗体可用作选择性固定酶的试剂。最近的进展促进从大肠杆菌中直接回收Fab′-SH片段将其化学偶联形成双特异性抗体。Shalaby等,J.Exp.Med.,175:217-225(1992)描述了完全人源化的双特异性抗体F(ab′)2分子的产生。将大肠杆菌分别分泌的各Fab′片段在体外直接化学偶联形成双特异性分子。已描述了从重组细胞培养物中直接制备和分离双特异性抗体片段的各种技术。例如,用亮氨酸拉链产生双特异性抗体。Kostelny等,J.Immunol.,148(5):1547-1553(1992)。通过基因融合将Fos和Jun蛋白的亮氨酸拉链肽连接于两种不同抗体的Fab’部分。在绞链区还原该抗体同质二聚体以形成单体,然后再氧化形成抗体异质二聚体。此方法也可用于产生抗体同质二聚体。Hollinger等,Proc.Natl.Acad.Sci.USA,90:6444-6448(1993)所述的"双抗体"技术为制造双特异性抗体片段提供了一种替代机制。这种片段包含通过一个接头与轻链可变区(VL)连接的重链可变区(VH),但该接头太短不能使同一条链上的两个结构域配对。因此,迫使一条片段的VH和VL域与另一片段的互补VL和VH域配对,从而形成两个抗原结合位点。另外,也报道了用单链Fv(sFv)二聚体制备双特异性抗体片段的另一方案。参见Gruber等,J.Immunol.,152:5368(1994)。也考虑了二价以上的抗体。例如,可制备三特异性抗体。Tutt等J.Immunol.147:60(1991)。(vii)其它的氨基酸序列修饰考虑了本文所述的抗体氨基酸序列的修饰。例如,可能需要提高抗体的亲和力或其它生物学性能。通过在抗体核酸中引入合适的核苷酸改变或通过肽合成制备抗体的氨基酸序列变体。这些修饰包括例如:缺失和/或插入和/或取代抗体氨基酸序列中的残基。进行缺失、插入和取代的任何组合以达到最终构建物,只要该最终构建物具有所需特性。氨基酸变化也会改变抗体的翻译后加工,如改变糖基化位点的数量或位置。有助于诱变定位的用于鉴定抗体中某些残基或区域的方法称为“丙氨酸扫描诱变”,如Cunningham和WellsScience,244:1081-1085(1989)所述。这里,鉴定了一个残基或一组靶残基(如带电残基如arg、asp、his、lys和glu),并用中性或带负电氨基酸(最优选丙氨酸或聚丙氨酸)取代以影响氨基酸与抗原的相互作用。通过在取代位点引入更多的或其它的变化,精细确定显示对这种取代在功能上敏感的氨基酸位置。因此,虽然引入氨基酸序列变异的位点预先确定,但突变本身的性质无需预先确定。例如,为了分析在某给定位点产生的突变的性能,在目标密码子或区域进行丙氨酸扫描或随机诱变,并筛选表达的抗体变体是否具有所需活性。氨基酸序列插入包括氨基和/或羧基末端融合,长度从一个残基到包含一百个或更多残基的多肽,以及一个或多个氨基酸残基的序列内插入物。末端插入物的例子包括含有N-末端甲硫胺酰残基的抗体或与细胞毒性多肽融合的抗体。抗体分子的其它插入变体包括抗体N-或C-末端与能增加抗体血清半衰期的酶(如ADEPT)或多肽的融合物。另一变体类型是氨基酸取代变体。这些变体的抗体分子中至少一个氨基酸残基被不同残基取代。最感兴趣的取代诱变位点包括超变区,但也考虑了FR区改变。通过选择对以下性质的维持影响显著不同的取代显著改变抗体的生物学性能:a)取代区中多肽骨架结构,如片层或螺旋构象,b)分子中靶位点的带电或疏水性,或c)侧链体积。根据侧链的共同性将天然产生的残基分为以下几组:(1)疏水性:正亮氨酸、甲硫氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸;(2)中性亲水性:半胱氨酸、丝氨酸、苏氨酸;(3)酸性:天冬氨酸、谷氨酸;(4)碱性:天冬酰胺、谷胺酰胺、组氨酸、赖氨酸、精氨酸;(5)影响链取向的残基:甘氨酸、脯氨酸;和(6)芳族:色氨酸、酪氨酸、苯丙氨酸。非保守取代包括将这些组别之一的成员交换为另一组别的成员。尤其优选的取代变体包含取代亲代抗体(如人源化或人抗体)超变区的一个或多个残基。通常,选择用于进一步开发的所得变体的生物学性能将比产生它的亲代抗体有所改进。产生这种取代变体的方便方法包括用噬菌体展示进行亲和力成熟(affinitymaturation)。简要说,突变几个超变区位点(如6-7个位点),以在各位点上产生所有可能的氨基取代。以单价方式展示此法从丝状噬菌体颗粒产生的抗体变体,与M13基因III产物融合包装在各颗粒中。然后如本文所述筛选噬菌体展示的变体的生物学活性(如结合亲合力)。为了鉴定供修饰的超变区候选位点,可进行丙氨酸扫描诱变,以鉴定对抗原结合起显著作用的超变区残基。或者或此外,分析抗原-抗体复合物的晶体结构有益于鉴定抗原-抗体之间的接触点。根据本文所述技术,这种接触残基和相邻残基是取代的候选残基。一旦产生这种变体,如本文所述筛选一组变体,选出在一个或多个相关试验中性能出色的抗体作进一步开发。可能需要修饰本发明抗体的效应器功能,以增强该抗体的抗原依赖性细胞介导的细胞毒性(ADCC)和/或补体依赖性细胞毒性(CDC)。这可通过在抗体的Fc区引入一个或多个氨基酸取代而实现。或者或此外,将半胱氨酸残基引入Fc区,从而在此区形成链间二硫键。如此产生的同质二聚体抗体的内化能力提高和/或补体介导的细胞杀伤和抗体介导的细胞毒性(ADCC)增加。参见Caron等J.ExpMed.176:1191-1195(1992)和Shopes,B.J.Immunol.148:2918-2922(1992)。也可用异质双功能交联剂制备具有增强抗肿瘤活性的同质二聚体抗体,如Wolff等CancerResearch53:2560-2565(1993)所述。另外,抗体可被工程改造为具有双Fc区,并由此获得增强的补体胞溶和ADCC能力。参见Stevenson等Anti-CancerDrugDesign3:219-230(1989)。为了增加抗体的血清半衰期,可在抗体中掺入拯救受体结合表位,如美国专利号5739277所述。本文所用术语"拯救受体结合表位”指负责增加IgG分子体内血清半衰期的IgG分子(如IgG1、IgG2、IgG3或IgG4)的Fc区中的表位。(viii)糖基化变体本发明ADC中的抗体可在其恒定区的保守位点糖基化(Jefferis和Lund,(1997)Chem.Immunol.65:111-128;Wright和Morrison,(1997)TibTECH15:26-32)。免疫球蛋白的寡糖侧链会影响蛋白功能(Boyd等,(1996)Mol.Immunol.3.2:1311-1318;Wittwe和Howard,(1990)Biochem。29:4175-4180),糖蛋白部分之间分子内相互作用可影响其构象和糖蛋白的三维表面(Hefferis和Lund,同上;Wyss和Wagner,(1996)CurrentOpin.Biotech.7:409-416)。根据其特异性识别结构,寡糖也可用于使给定糖蛋白靶向某分子。例如,有报道称在半乳糖苷化的IgG中,寡糖部分翻转(flip)出CH2内部空间,使末端N-乙酰氨基葡萄糖残基能够与甘露糖结合蛋白相结合(Malhotra等,(1995)NatureMed.1:237-243)。由糖肽酶除去中国仓鼠卵巢细胞(CHO)产生的坎帕斯-1H(识别人淋巴细胞CDw52抗原的重组人源化鼠单克隆IgG1抗体)中的寡糖导致补体介导的胞溶(CMCL)完全降低(Boyd等,(1996)Mol.Immunol.32:1311-1318),然而用神经氨酸酶选择性除去唾液酸残基不导致DMCL丧失。有报道称抗体的糖基化也会影响抗体依赖的细胞毒性(ADCC)。具体说,含有受四环素调节表达的β(1,4)-N-乙酰葡萄糖转移酶III(GnTIII),一种催化GlcNAc二分的糖基转移酶的CHO细胞据报道具有改进的ADCC活性(Umana等(1999)MatureBiotech.17:176-180)。糖基化抗体一般为N-连接或O-连接。N-连接指糖部分与天冬酰氨残基的侧链相连。三肽序列天冬酰氨-X-丝氨酸和天冬酰氨-X-苏氨酸(其中X为除脯氨酸外的任一氨基酸)是糖部分与天冬酰氨侧链酶促连接的识别序列。因此,多肽中存在此三肽序列立即产生潜在的糖基化位点。O-连接的糖基化指N-乙酰半乳糖胺、半乳糖或木糖之一与羟基氨基酸相连,羟基氨基酸中最常见的是丝氨酸或苏氨酸,但也可用5-羟脯氨酸或5-羟赖氨酸。抗体的糖基化变体是抗体糖基化模式发生改变的变体。改变意味着该抗体中缺失了一个或多个糖部分,增加了一个或多个糖部分,改变了糖基化组成(糖基化模式),糖基化程度等。可通过改变氨基酸序列,使其包含一个或多个上述三肽序列(N-连接的糖基化位点),方便地在抗体中加入糖基化位点。也可通过在原抗体序列中加入或取代一个或多个丝氨酸或苏氨酸残基(O-连接的糖基化位点)来实现这种改变。类似地,可通过改变抗体天然糖基化位点的氨基酸来去除糖基化位点。通常通过改变编码的核苷酸序列改变氨基酸序列。这些方法包括但不限于:从天然来源中分离(在天然产生的氨基酸序列变体的情况下)或通过寡核苷酸介导(或定点)的诱变、PCR诱变和早期制备的抗体变体或非变体抗体的盒诱变。也可在不改变氨基酸序列或编码的核苷酸序列的情况下改变抗体的糖基化(包括糖基化模式)。糖基化很大程度上取决于用来表达抗体的宿主细胞。由于用于表达重组糖蛋白,如作为潜在治疗手段的抗体的细胞类型鲜有天然细胞,预计抗体糖基化模式可能发生显著变异。参见例如Hse等,(1997)J.Bio.Chem.272:9062-9070。除了选择宿主细胞外,在重组产生抗体期间影响糖基化的因素包括生长模式、培养基配方、培养密度、氧合作用、pH、纯化方案等。提出了各种方法来改变特定宿主生物所获得的糖基化模式,包括引入或过表达参与寡糖产生的某些酶(美国专利号5047335;5510261;5278299)。可用酶,如内切糖苷酶(EndoH)除去糖蛋白上的糖基化,或某些类型的糖基化。此外,可遗传改造重组宿主细胞,如使其加工某种类型多糖的能力缺陷。这些技术和相似技术是本领域熟知的。用常规糖分析技术,包括凝集素色谱、NMR、质谱、HPLC、GPC、单糖组成分析、依次酶促消化和利用高pH阴离子交换色谱根据所带电荷分离寡糖的HPAEC-PAD方法,不难分析抗体的糖基化结构。用于分析目的的释放寡糖方法的也是已知的,包括但不限于:酶处理(通常用肽-N-糖苷酶F/内切-β-半乳糖苷酶进行),用严谨的碱性环境消除以主要释放O-连接糖结构,和用无水肼释放N-连接和O-连接寡糖的化学方法。4.5.2a筛选抗体-药物偶联物(ADC)转基因动物和细胞系尤其可用于筛选具有预防或治疗包括LewisY、CD30、CD40和CD70等蛋白过表达疾病或失调的潜能的抗体-药物偶联物(ADC)。转基因动物和细胞系尤其可用于筛选具有预防或治疗HER2过表达疾病或失调的潜能的抗体-药物偶联物(ADC)(US6632979)。筛选有用的ACD可包括将一定剂量范围的候选ADC给予转基因动物,测定各个时间点ADC对所评价疾病或失调的作用。或者或此外,如果应用,可在接触疾病诱导物之前或同时给予该药物。可系列和个别筛选,或在培养基中平行筛选,或高通量筛选候选ADC。筛选用于预防或治疗疾病或失调的APC的速度仅受限于合成速率或筛选方法,包括检测/测定/分析数据。一个实施方式是筛选方法,该方法包括(a)将稳定的肾细胞癌细胞系细胞植入非人动物体内,(b)将候选ADC药物给予该非人动物和(c)测定候选药物抑制由植入细胞系形成肿瘤的能力。另一实施方式是筛选方法,该方法包括(a)使稳定的霍奇金病细胞系细胞与候选ADC药物接触和(b)评价候选ADC药物阻断CD40配体激活的能力。另一实施方式是筛选方法,该方法包括(a)使稳定的霍奇金病细胞系细胞与候选ADC药物接触和(b)评价候选ADC药物诱导细胞死亡的能力。在一个实施方式中,评价候选ADC药物诱导凋亡的能力。一个实施方式是筛选方法,该方法包括(a)将稳定的癌细胞系细胞植入非人动物体内,(b)将候选ADC药物给予该非人动物和(c)测定候选药物抑制植入细胞系形成肿瘤的能力。本发明也涉及筛选用于治疗特征为HER2过表达的疾病或失调的候选ADC方法,该方法包括(a)使稳定的乳腺癌细胞系细胞与候选药物接触和(b)评价候选ADC抑制该稳定细胞系生长的能力。另一实施方式是筛选方法,该方法包括(a)使稳定癌细胞系细胞与候选ADC药物接触和(b)评价候选ADC阻断配体激活HER2的能力。在一个实施方式中,评价候选ADC阻断调蛋白结合的能力。在另一实施方式中,评价候选ADC阻断配体刺激的酪氨酸磷酸化的能力。另一实施方式是筛选方法,该方法包括(a)使稳定癌细胞系细胞与候选ADC药物接触和(b)评价候选ADC诱导细胞死亡的能力。在一个实施方式中,评价候选ADC诱导凋亡的能力。另一实施方式是筛选方法,该方法包括(a)将候选ADC药物给予其乳腺细胞过表达天然人HER2蛋白或其片段的转基因非人哺乳动物,这种转基因哺乳动物含有稳定整合入其基因组中的具有天然人HER2生物学活性的天然人HER2蛋白或其片段的核酸序列,该核酸序列操作性连接有指导其在乳腺中表达的转录调节序列,并发育成对抗-HER2抗体治疗无反应或反应差的乳腺肿瘤;或给予携带了植入肿瘤的转基因非人哺乳动物;和(b)评价候选ADC对靶疾病或失调的作用。所述疾病或失调可以是但不限于过表达HER2的癌症,如乳腺癌、卵巢癌、胃癌、子宫内膜癌、唾液腺癌、肺癌、肾癌、结肠癌、甲状腺癌、胰腺癌和膀胱癌。该癌症优选每个细胞至少表达约500,000个拷贝,更优选每个细胞至少表达约2,000,000个拷贝HER2的乳腺癌。例如,可用本领域熟知和本文所述的试验方法评价候选ADC药物诱导细胞死亡和/或凋亡的能力。在一个实施方式中,将某剂量范围的化合物给予转基因动物,并评价随时间推移动物对该化合物的生理反应来筛选候选ADC。给药可以是口服,或通过合适的注射,这取决于待评价化合物的化学性质。在一些情况下,可适当地将化合物与能提高该化合物药效的辅助因子联合给药。如果将衍生自所述转基因动物的细胞系用于筛选治疗各种疾病的化合物,可在合适的时间将测试化合物加入细胞培养基中,用合适的生化和/或组织学试验评价随时间推移所述细胞对化合物的反应。在一些情况下,可适当地将感兴趣化合物与能提高该化合物药效的辅助因子一起加入培养基中。因此,本文提供了鉴定特异性靶向和结合靶蛋白的ADC的试验,靶蛋白的存在与细胞功能异常相关,并且参与肿瘤发展因果相关的细胞增殖和/或分化的发病机理。为了鉴定阻断配体活化ErbB(如ErbB2)受体的ADC,可测定化合物阻断ErbB配体与表达ErbB(ErbB2)受体(如与另一ErbB受体偶联,与感兴趣的ErbB受体形成ErbB异质寡聚物)的细胞结合的能力。例如,可将分离自过表达HER2的转基因动物和经转染而表达另一ErbB受体(HER2与其形成异质寡聚物)的细胞与ADC一起孵育,即一起培养,然后接触标记的ErbB配体。然后,可评价该化合物阻断配体与ErbB异质寡聚物中的ErbB受体结合的能力。例如,候选ADC能否抑制调蛋白(HRG)与过表达HER2和从本文所述转基因非人哺乳动物(如小鼠)建立的乳腺肿瘤细胞系结合,可用单层细胞培养物在冰上,24孔板中进行。可将抗ErbB2单克隆抗体加入各孔中,孵育30分钟。然后加入125I-标记的rHRGβ1177-224(25,000cpm),继续孵育4-16小时。制得剂量反应曲线,计算感兴趣化合物的IC50值(细胞毒活性)。或者或此外,可评价ADC阻断ErbB配体刺激ErbB异质寡聚物中的ErbB受体酪氨酸磷酸化的能力。例如,可将本文所述从转基因动物建立的细胞系与测试ADC一起孵育,然后用抗-磷酸酪氨酸单克隆抗体(任选地连接有可检测标记)测定ErbB配体依赖性酪氨酸磷酸化活性。美国专利号5766863所述的激酶受体激活试验也可用于测定ErbB受体激活和化合物对该活性的阻断。在一个实施方式中,可筛选在MCF7细胞中抑制pl80酪氨酸磷酸化激活HRG的ADC,如下所述。例如,可将从HER2-转基因动物建立的细胞系接种在24孔板中,将化合物加入各孔中,室温孵育30分钟;然后将rHRGβ1177-244加入各孔使终浓度为0.2nM,继续孵育约8分钟。吸去各孔中的培养基,加入100μlSDS样品缓冲液(5%SDS、25mMDTT和25mMTris-HCl,pH6.8)终止反应。可在4-12%梯度凝胶(Novex)上对各样品(25μl)进行电泳,然后电泳转移到聚二氟亚乙基膜上。产生抗-磷酸酪氨酸(1μg/ml)免疫印迹显色,用反射光密度计定量主要反应条带的Mr-180,000强度。评价受体磷酸化抑制的替代方法是Sadick等(1998)Jour.ofPharm.andBiomed.Anal.所述的KIRA(激酶受体激活)试验。一些良好建立的已知能抑制p180酪氨酸磷酸化激活HRG的抗HER2单克隆抗体可用作此试验中的阳性对照。可制备由反射光密度计测定的抑制p180酪氨酸磷酸化激活HRG的剂量反应曲线,计算感兴趣化合物的IC50。也可评价测试ADC对衍生自HER2-转基因动物的细胞系的生长抑制作用,如Schaefer等(1997)Oncogene15:1385-1394所述。根据此试验,可用各种浓度的测试化合物处理细胞4天,用结晶紫或氧化还原染料Alamar蓝染色。与化合物一起孵育可显示它对此细胞系的生长抑制作用类似于单克隆抗体2C4对MDA-MB-175细胞所显示的作用(Schaefer等,同上)。在又一实施方式中,外源性HRG不会显著逆转此种抑制。为鉴定特异性靶向感兴趣抗原的生长抑制性化合物,可筛检化合物能否抑制衍生自转基因动物的过表达感兴趣抗原的癌细胞生长,进行美国专利号5677171所述试验。根据此试验,在补充10%胎牛血清、谷胺酰胺和青霉素链霉素的F12和DMEM培养基的1:1混合物中培养过表达感兴趣抗原的癌细胞。将20,000个细胞接种于35mm细胞培养皿(2ml/35mm皿)中,加入各种浓度的测试化合物。6天后,用电子COULTERTM细胞计数仪计数细胞数,与未处理细胞相比。抑制约20-100%或约50-100%细胞生长的化合物可选择为生长抑制性化合物。为了选择诱导细胞死亡的化合物,可与对照相比评估膜完整性丧失,如PI、台盼蓝或7AAD摄取试验所示。PI摄取试验采用分离自转基因动物的感兴趣肿瘤组织的细胞。根据此试验,在补充10%热灭活的FBS(Hyclone)和2mML-谷胺酰胺的Dulbecco改良的Eagle培养基(D-MEM):Ham′sF-12(50:50)中培养细胞。因此,在没有补体和免疫效应细胞的情况下进行该试验。将这些细胞以每皿3×106个的密度接种于100×20mm皿中,使其贴壁过夜。然后去除培养基,仅用新鲜培养基或含有各种浓度的化合物的培养基换液。孵育细胞3天。各处理后,用PBS洗涤单层(细胞),胰酶消化脱附。然后1200rpm、4℃离心细胞5分钟,将沉淀重悬于3ml冰冷的Ca2+结合缓冲液(10mMHepes,pH7.4,140mMNaCl,2.5mMCaCl2)中,等份分装到35mm有筛网盖子的12×75mm试管中(每管1ml,每处理组3管),以去除细胞团。然后将PI加入试管中(10μg/ml)。用FACSCANTM流式细胞仪和FACSCONVERTTMCellQuest软件(BectonDickinson)分析样品。通过PI摄取测定的诱导统计学显著性水平细胞死亡的化合物可选择为细胞死亡诱导化合物。为了选择诱导凋亡的化合物,用从转基因动物的感兴趣肿瘤组织建立的细胞进行膜联蛋白结合试验。培养细胞,接种于平皿,如前一段所述。然后去除培养基,仅用新鲜培养基或含有10μg/ml抗体-药物偶联物(ADC)的培养基换液。孵育3天后,用PBS洗涤单层(细胞),胰酶消化脱附。然后如上所述离心细胞,重悬于Ca2+结合缓冲液中,等份分装入试管中,用于细胞死亡试验。然后将标记的膜联蛋白(如膜联蛋白V-FITC)(1μg/ml)加入试管中。用FACSCANTM流式细胞仪和FACSCONVERTTMCellQuest软件(BectonDickinson)分析样品。与对照相比诱导统计学显著性水平膜联蛋白结合的化合物选择为凋亡诱导化合物。4.5.3体外细胞增殖试验通常,用以下方法测定抗体-药物偶联物(ADC)的细胞毒性或细胞抑制活性:在细胞培养基中使具有受体蛋白的哺乳动物细胞接触ADC的抗体;培养细胞约6小时~5天;测定细胞活力。用基于细胞的体外试验测定本发明ADC引起的活力(增殖)、细胞毒性和凋亡诱导(胱冬酶激活)。用细胞增殖试验测定抗体-药物偶联物的体外效果(实施例18,图7-10)。发光细胞活力试验(试剂盒)可购得(PromegaCorp.,Madison,WI),同类试验方法依据鞘翅目荧光素酶的重组表达(美国专利号5583024;5674713和5700670)。此细胞增殖试验根据作为代谢活性细胞指标的ATP存在量测定培养物中活细胞的数量(Crouch等(1993)J.Immunol.Meth.160:81-88,美国专利号6602677)。在96孔板中进行试验,使其适应自动化高通量筛选(HTS)(Cree等(1995)AnticancerDrugs6:398-404)。同类试验方法包括将一种试剂(试剂)直接加入培养在补充血清培养基的细胞中。不需要洗涤细胞、去除培养基和多次移液操作步骤。加入试剂混合后,该系统可在384孔板中10分钟内检测到少至15细胞/孔。可用ADC连续处理细胞,或者处理后使细胞与ADC分离。通常,简单地处理细胞即3小时,与连续处理细胞显示效果相同。同类的"加入-混合-测定"模式导致细胞裂解和产生与ATP存在量成比例的发光信号。ATP量与培养基中存在的细胞数量成正比。试验产生"荧光型"发光信号,由荧光素酶反应产生,其半衰期通常大于5小时,这取决于所用细胞类型和培养基。以相对发光单位(RLU)反映活细胞数。底物甲虫荧光素经重组萤火虫荧光素酶的氧化而脱羧,伴随ATP转化为AMP并产生光子。延长的半衰期不需要用试剂注射器,为连续或分批模式处理多块板提供了灵活性。此细胞增殖试验可用于各种多孔板,如96或384孔板。可用发光计或CCD照相机摄像装置记录数据。发光输出表示为随时间测定的相对光单位(RLU)。用细胞增殖试验,上述四种不同乳腺肿瘤细胞系的体外细胞杀伤试验(图7-10)测定抗体-药物偶联物的抗增殖作用。确立已知过表达HER2受体蛋白的SK-BR-3和BT-474的IC50值。表2a显示在细胞增殖试验中示范性抗体-药物偶联物对SK-BR-3细胞的效果(IC50)测量值。表2b显示在细胞增殖试验中示范性抗体-药物偶联物对BT-474细胞的效果(IC50)测量值。抗体-药物偶联物:曲妥珠单抗-MC-vc-PAB-MMAF,3.8MMAF/Ab;曲妥珠单抗-MC-(N-Me)vc-PAB-MMAF,3.9MMAF/Ab;曲妥珠单抗-MC-MMAF,4.1MMAF/Ab;曲妥珠单抗-MC-vc-PAB-MMAE,4.1MMAE/Ab;曲妥珠单抗-MC-vc-PAB-MMAE,3.3MMAE/Ab和曲妥珠单抗-MC-vc-PAB-MMAF,3.7MMAF/Ab不抑制MCF-7细胞的增殖(图9)。抗体-药物偶联物:曲妥珠单抗-MC-vc-PAB-MMAE,4.1MMAE/Ab;曲妥珠单抗-MC-vc-PAB-MMAE,3.3MMAE/Ab;曲妥珠单抗-MC-vc-PAB-MMAF,3.7MMAF/Ab;曲妥珠单抗-MC-vc-PAB-MMAF,3.8MMAF/Ab;曲妥珠单抗-MC-(N-Me)vc-PAB-MMAF,3.9MMAF/Ab和曲妥珠单抗-MC-MMAF,4.1MMAF/Ab不抑制MDA-MB-468细胞的增殖(图10)。MCF-7和MDA-MB-468细胞不过表达HER2受体蛋白。因此,本发明的抗HER2抗体-药物偶联物显示只选择性抑制表达HER2的细胞。表2aSK-BR-3细胞表2bBT474细胞H=曲妥珠单抗7C2=结合与曲妥珠单抗不同表位的抗-HER2鼠抗体。Fc8=不结合FcRn的突变体Hg=“无铰链”的全长人源化4D5,其重链铰链区的半胱氨酸突变为丝氨酸。在大肠杆菌中表达(因此非糖基化)。抗TFFab=抗组织因子抗体片段*对MDA-MB-468细胞的活性令人惊讶和出乎意料地发现,表2a和2b中ADC的体外细胞增殖活性结果总地显示出,每个抗体的平均药物部分数量低的ADC也显示了药效,如IC50<0.1μgADC/ml。该结果说明至少对于曲妥珠单抗ADC来说,每个抗体的药物部分的最佳比例可小于8,可约为2~5。4.5.4体内血浆清除率和稳定性在大鼠和食蟹猴中研究了ADC的药代动力学血浆清除率和稳定性。测量随时间推移的血浆浓度。表2c显示抗体-药物偶联物和其它给药样品在大鼠中的药代动力学数据。大鼠是ErbB受体抗体的非特异性模型,因为已知大鼠不表达HER2受体蛋白。表2c大鼠中的药代动力学特性H=曲妥珠单抗通过半胱氨酸[cys]连接,除非另有说明剂量2mg/kg,除非另有说明AUCinf是从给药到无限时间的血浆浓度时间曲线下面积,是对测量物(药物,ADC)的总接触的一种衡量。CL定义为单位时间中被清除的测量物的血浆体积,通过体重标准化表示。T1/2期是药物在体内消除期间的半衰期。偶联物%是与所检测的总抗体相比,ADC的相对量,用独立ELISA免疫亲和试验检测(“生物技术产品的分析方法”(AnalyticalMethodsforBiotechnologyProducts),Ferraiolo等,第85-98页,刊于《药物的药代动力学特性》(PharmacokineticsofDrugs)(1994)P.G.Welling和L.P.Balant编,《试验药理学手册》(HandbookofExperimentalPharmacology),第110卷,Springer-Verlag测定。偶联物%的计算简单,为ADC的AUCinf÷总抗体的AUCinf,是接头稳定性的通用指标,尽管其它因素和机制也可能起作用。图11显示将抗体-药物偶联物:H-MC-vc-PAB-MMAF-TEG和H-MC-vc-PAB-MMAF给予Sprague-Dawley大鼠后的血浆浓度清除率研究图。测量了随时间推移的总抗体和ADC的浓度。图12显示以不同剂量给予ADC时两阶段血浆浓度清除率研究图,测量了随时间推移的总抗体和ADC的浓度。体内药效用高表达HER2的转基因外植体小鼠模型测量了本发明ADC的体内药效。在对贺赛汀治疗无反应或反应差的Fo5mmtv转基因小鼠中增殖获得同种异体移植物。用ADC处理对象一次,监测该对象3-6周,测定肿瘤加倍的时间、细胞杀伤的对数和肿瘤缩小。然后进行剂量反应和多剂量试验。肿瘤在表达neu的突变激活形式的转基因小鼠中容易生长,HER2的大鼠同源物而不是在乳腺癌中过表达的HER2未发生突变,在过表达非突变HER2的转基因小鼠中肿瘤形成能力小得多(Webster等(1994)Semin.CancerBiol.5:69-76)。为增强非突变HER2的肿瘤形成,用HER2cDNA质粒产生转基因小鼠,该质粒中,上游ATG缺失而防止了上游ATG密码子启动的翻译,否则会降低下游真正的HER2启动子的翻译起始频率(例如,参见Child等(1999)J.Bio.Chem.274:24335-24341)。此外,将一种嵌合内含子加在5’端,也应能增强表达水平,如以前的报道(Neuberger和Williams(1988)NucleicAcidsRes.16:6713;Buchman和Berg(1988)Mol.Cell.Biol.8:4395;Brinster等(1988)Proc.Natl.Acad.Sci.USA85:836)所述。该嵌合内含子衍生自Promega的载体,pCI-neo哺乳动物表达载体(bp890-1022)。此cDNA3’-端侧接有人生长激素外显子4和5,以及聚腺苷酸序列。而且,使用FVB小鼠,因为该品系能较易生长肿瘤。采用MMTV-LTR启动子保证HER2在乳腺中组织特异性表达。用AIN76A饲养动物,以提高其肿瘤形成的易感性(Rao等(1997)BreastCancerRes.andTreatment45:149-158)。表2d在同种异体移植物小鼠模型-MMTV-HER2Fo5乳腺肿瘤,无胸腺裸小鼠中测量的肿瘤在第1天(T=0)单剂量,除非另有说明H=通过半胱氨酸[cys]连接的曲妥珠单抗,除非另有说明7C2=结合与曲妥珠单抗不同表位的抗-HER2鼠抗体。Fc8=不结合FcRn的突变体Hg=“无铰链”的全长人源化4D5,其重链铰链区的半胱氨酸突变为丝氨酸。在大肠杆菌中表达(因此非糖基化)。2H9=抗EphB2R11D10=抗0772P术语Ti是在T=0时研究组中患有肿瘤的动物数÷该组总动物数。术语PR是肿瘤部份缓解的动物数÷在T=0时该组患有肿瘤的动物数。术语CR是肿瘤完全缓解的动物数÷在T=0时该组患有肿瘤的动物数。术语“Log细胞杀伤”是肿瘤体积加倍的时间天数减去对照肿瘤体积加倍的时间天数除以3.32乘对照动物(给予运载体)肿瘤体积加倍的时间。Log细胞杀伤的计算考虑了因治疗所致的肿瘤生长延迟和对照组的肿瘤体积加倍时间。利用Log细胞杀伤的值将ADC的抗肿瘤活性分为:图13显示在第0天给予携带MMTV-HER2Fo5乳腺肿瘤同种异体移植物的无胸腺裸小鼠以下物质后平均肿瘤体积随时间的改变:运载体、曲妥珠单抗-MC-vc-PAB-MMAE(1250μg/m2)和曲妥珠单抗-MC-vc-PAB-MMAF(555μg/m2)。(H=曲妥珠单抗)。与对照(运载体)生长水平相比,ADC治疗延迟了肿瘤生长。图14显示在第0天给予携带MMTV-HER2Fo5乳腺肿瘤同种异体移植物的无胸腺裸小鼠10mg/kg(660μg/m2)曲妥珠单抗-MC-MMAE和1250μg/m2曲妥珠单抗-MC-vc-PAB-MMAE后平均肿瘤体积随时间的改变。图15显示在第0天给予携带MMTV-HER2Fo5乳腺肿瘤同种异体移植物的无胸腺裸小鼠650μg/m2曲妥珠单抗-MC-MMAF后平均肿瘤体积随时间的改变。表2d和图13-15显示ADC在最初来源于MMTV-HER2转基因小鼠的HER2阳性肿瘤(Fo5)的同种异体移植物中具有强抗肿瘤活性。在此模型中,单用抗体(如曲妥珠单抗)不具有显著的抗肿瘤活性(Erickson等美国专利号6632979)。如图13-15所示,与对照(运载体)生长水平相比,ADC治疗延迟了肿瘤生长。令人惊讶和出乎意料地发现,表2d中ADC的体内抗肿瘤活性结果总地表明,每个抗体的平均药物部分数量少的ADC也显示具有效果,如肿瘤加倍时间>15天和细胞杀伤的对数平均值>1.0。图1显示对于此抗体-药物偶联物曲妥珠单抗-MC-vc-PAB-MMAF而言,平均肿瘤体积减小,在MMAF:曲妥珠单抗比为2和4时肿瘤不发展,而当该比为5.9和6时肿瘤发展,但发展速度低于运载体(缓冲液)。在此种小鼠异种移植模型中肿瘤发展速度大约相同,即运载体和曲妥珠单抗都是3天。该结果提示至少对于曲妥珠单抗ADC来说,每个抗体的药物部分最佳比例可小于8,可约为2~4。4.5.5啮齿动物毒性在急性毒性大鼠模型中评价抗体-药物偶联物和ADC-阴性对照“运载体”。用ADC治疗雄性和雌性Sprague-Dawley大鼠,然后观察和分析其对各种器官的作用研究ADC毒性。粗观察结果包括体重改变以及病损和出血迹象。对给药动物进行临床病理学参数(血清化学成分和血液学)、组织病理学和尸体检查。考虑到相对于仅给予运载体的动物,给予ADC后动物的体重损失或体重改变是全身性或局部毒性的一种粗通用指标。图17-19显示给予各种剂量ADC和对照(运载体)后对大鼠体重的作用。通过肝脏酶增加、有丝分裂细胞数和凋亡图像以及肝细胞坏死数量增加衡量肝毒性。通过白细胞、主要粒细胞(中性粒细胞)和/或血小板的消耗,以及涉及的淋巴器官,即萎缩或凋亡活性来观察血液淋巴毒性。也通过胃肠道病损如有丝分裂细胞数增加和凋亡图像以及退行性结肠炎观察毒性。所研究的表明肝脏损伤的酶包括:AST(天冬氨酸转氨酶)–定位:胞质;肝脏、心脏、骨骼肌、肾脏–肝脏:血浆比为7000:1–T1/2:17小时ALT(丙氨酸转氨酶)–定位:胞质;肝脏、肾脏、心脏、骨骼肌–肝脏:血浆比为3000:1–T1/2:42小时;昼夜变化GGT(g-谷氨酰基转移酶)–定位:分泌或吸收能力高的细胞质膜;肝脏、肾脏、肠–肝损伤的较差预示物;通常在胆管疾病中升高在雌性Sprague-Dawley大鼠中研究曲妥珠单抗-MC-val-cit-MMAF、曲妥珠单抗-MC(Me)-val-cit-PAB-MMAF、曲妥珠单抗-MC-MMAF和曲妥珠单抗-MC-val-cit-PAB-MMAF的毒性特征(实施例19)。人源化曲妥珠单抗抗体一点也不与大鼠组织结合,认为任何毒性都是非特异性的。将剂量水平为840和2105μg/m2MMAF的变体与2105ug/m2曲妥珠单抗-MC-val-cit-PAB-MMAF作比较。第1、2、3、4、6和7组(分别为运载体、9.94&24.90mg/kg曲妥珠单抗-MC-val-cit-MMAF、10.69mg/kg曲妥珠单抗-MC(Me)-val-cit-PAB-MMAF和10.17&25.50mg/kg曲妥珠单抗-MC-MMAF)动物在研究期间体重增加。第5和8组(分别是26.78mg/kg曲妥珠单抗-MC(Me)-val-cit-PAB-MMAF和21.85mg/kg曲妥珠单抗-MC-val-cit-PAB-MMAF)动物在研究期间体重减少。在研究第5天,在第2、6和7组动物的体重改变与第1组动物没有明显不同。第3、4、5和8组动物的体重改变与第1组动物相比有统计学差异(实施例19)。在两种剂量水平时,用曲妥珠单抗-MC-MMAF(第6和7组)治疗的大鼠与用运载体治疗的对照动物无区别;即此偶联物在此模型中显示出优异的安全性。用曲妥珠单抗-MC-val-cit-MMAF(无自我牺牲型PAB部分;第2和3组)治疗的大鼠显示对MMAF偶联物的典型剂量依赖性改变;与全长MC-val-cit-PAB-MMAF偶联物相比改变程度较低(第8组)。在第3组动物(高剂量曲妥珠单抗-MC-val-cit-MMAF)中,第5天的血小板计数约为基线值的30%,相比而言第8组动物(高剂量曲妥珠单抗-MC-val-cit-PAB-MMAF)为15%。呈剂量依赖方式的肝脏酶AST和ALT升高,胆红素和血小板减少程度增加在用曲妥珠单抗-MC(Me)-val-cit-PAB-MMAF治疗的动物(第4和5组)中最明显;第5组动物(高剂量组)在第5天显示ALT水平约为基线值的10倍,在尸检时血小板降低了约90%。也用高剂量的曲妥珠单抗-MC-MMAF(实施例19,高剂量研究:第2、3、4组)和运载体对照(第1组)治疗雌性SpragueDawley大鼠。观察到温和的毒性信号,包括肝脏酶ALT、AST和GGT呈剂量依赖性升高。在第5天,最高剂量组动物显示ALT升高2倍,AST升高5倍;GGT也升高(6U/L)。在第12天,酶水平显示正常趋势。在第5天,所有三个剂量组动物有轻微的粒细胞增多,所有动物的血小板计数基本维持不变。形态改变轻微;以4210μg/m2剂量水平治疗的动物(第2组)肝脏、脾脏、胸腺、肠和骨髓的组织学(改变)不明显。分别在5500μg/m2剂量水平治疗的动物(第3组)的胸腺和肝脏中观察到凋亡和有丝分裂活性略为增加。骨髓是正常细胞,但显示有明显的粒细胞增多,这与这些动物的外周血计数中观察到的绝对粒细胞增多一致。用最高剂量治疗的第4组动物性质上显示出相同特征;与第3组动物相比,肝脏中的有丝分裂活性看起来有所增加。在脾脏和肝脏中也观察到髓外造血作用。EphB2R是1型TM酪氨酸激酶受体,小鼠和人之间紧密同源,在结肠直肠癌细胞中过表达。2H9是EphB2R的抗体。单纯抗体对肿瘤生长没有作用,但2H9-val-cit-MMAE杀伤表达EphB2R的细胞,在携带CXF1103人结肠肿瘤的小鼠异种移植物模型中显示具有疗效(Mao等(2004)CancerRes.64:781-788)。2H9和7C2都是小鼠IgG1抗-HER2抗体。比较了2H9-MC-val-cit-PAB-MMAF(3.7MMAF/Ab)、7C2-MC-val-cit-PAB-MMAF(4MMAF/Ab)和曲妥珠单抗-MC-val-cit-PAB-MMAF(5.9MMAF/Ab)的的毒性特征。各免疫偶联物或免疫偶联物的药物部分结构上的差异可能影响其药代动力学特性,并最终影响安全性。人源化曲妥珠单抗抗体与大鼠组织一点也不结合,故认为任何毒性都是非特异性的。食蟹猴毒性/安全性类似于大鼠毒性/安全性的研究,用ADC治疗食蟹猴,然后测定肝脏酶,并检查和分析对各种器官的作用。粗观察结果包括体重改变以及病损和出血迹象。对给药动物进行临床病理学参数(血清化学成分和血液学)、组织病理学和尸体检查(实施例19)。抗体-药物偶联物H-MC-vc-PAB-MMAE(H=通过半胱氨酸连接的曲妥珠单抗)在任何测试的剂量水平时都没有显示肝脏毒性。外周血粒细胞在给予一次剂量1100mg/m2后耗尽,给药14天后完全恢复。抗体-药物偶联物H-MC-vc-PAB-MMAF显示在550(瞬时)和880mg/m2剂量水平时肝脏酶升高,没有粒细胞减少迹象,血小板呈剂量依赖性短时(第2和3组)下降。4.6合成本发明化合物可用以下方案5-16中所述的合成方法制备示范性化合物和示范性偶联物。如下所详述,利用含有能与药物和配体结合的反应位点的接头方便地制备示范性化合物或示范性偶联物。在一个方面,接头的反应位点含有能与配体(例如但不限于抗体)上存在的亲核基团反应的亲电子基团。抗体上有用的亲核基团包括但不限于:巯基、羟基和氨基。抗体亲核基团的杂原子可与接头上的亲电子基团反应,形成共价键连接于接头单元。有用的亲电子基团包括但不限于:马来酰亚胺和卤代乙酰胺基团。亲电子基团提供了方便的抗体连接位点。在另一实施方式中,接头的反应位点含有能与抗体上存在的亲电子基团反应的亲核基团。抗体上有用的亲电子基团包括但不限于:醛和酮的羰基。接头亲核基团的杂原子可与抗体上的亲电子基团反应形成共价键连接于抗体单元。接头上有用的亲核基团包括但不限于:酰肼、肟、氨基、肼、缩氨基硫脲、羧酸肼和芳基酰肼。抗体上的亲电子基团提供了方便的接头连接位点。在接头中,也可用羧酸官能团和氯甲酸酯官能团作为反应位点,因为它们可与药物的仲氨基反应形成酰胺连接键。接头上有用的反应位点还有碳酸酯官能团,例如但不限于对硝基苯基碳酸酯,它可与药物例如但不限于N-甲基缬氨酸的氨基反应,形成氨基甲酸酯连接键。一般地,可通过在两个或多个氨基酸和/或肽片段之间形成肽键来制备基于肽的药物。可根据例如,肽化学领域熟知的液相合成法(参见E.和K.Lübke,“肽”(Thepeptides),第1卷,第76-136页,1965,AcademicPress)制备这种肽键。以下方案8-9中描述了具有亲电子马来酰亚胺基团的说明性拉伸单元的合成。方案10描述了用于合成接头的通用合成方法。方案11显示了具有val-cit基团、亲电子马来酰亚胺基团和PAB自我牺牲型间隔基团的接头单元的构建。方案12描述了具有phe-lys基团、亲电子马来酰亚胺基团、具有和没有PAB自我牺牲型间隔基团的接头的合成。方案13提供了合成药物-接头化合物方案的概要,而方案14提供了制备药物-接头化合物的替代途径。方案15描述了含有BHMS基团的支链接头的合成。方案16概述了抗体与药物-接头化合物连接形成药物-接头-抗体偶联物,方案14介绍了例如但不限于每抗体2或4个药物的药物-接头-抗体偶联物的合成。如下所详述,用含有结合药物和配体的两个或多个反应位点的接头方便地制备示范性偶联物。在一个方面,接头的反应位点含有能与配体如抗体上存在的亲核基团反应的亲电子基团。抗体上有用的亲核基团包括但不限于:巯基、羟基和氨基。抗体亲核基团的杂原子能与接头上的亲电子基团反应形成共价键连接于接头单元。有用的亲电子基团包括但不限于:马来酰亚胺和卤代乙酰胺基团。亲电子基团提供了方便的抗体连接位点。在另一实施方式中,接头的反应位点含有能与配体如抗体上存在的亲电子基团反应的亲核基团。抗体上有用的亲电子基团包括但不限于:醛和酮的羰基。接头亲核基团的杂原子可与抗体上的亲电子基团反应形成共价键连接于抗体单元。接头上有用的亲核基团包括但不限于:酰肼、肟、氨基、肼、缩氨基硫脲、羧酸肼和芳基酰肼。抗体上的亲电子基团提供了方便的接头连接位点。4.6.1药物部分的合成一般地,可通过在两个或多个氨基酸和/或肽片段之间形成肽键来制备基于肽的药物。可根据例如,肽化学领域熟知的液相合成法(参见E.和K.Lübke,“肽”(Thepeptides),第1卷,第76-136页,1965,AcademicPress)制备这种肽键。可根据以下通用方法制备耳抑素/海兔毒肽药物部分:美国专利号5635483;美国专利号5780588;Pettit等(1989)J.Am.Chem.Soc.111:5463-5465;Pettit等(1998)Anti-CancerDrugDesign13:243-277;和Pettit等(1996)J.Chem.Soc.PerkinTrans.15:859-863。在一个实施方式中,混合化学量大约相等的二肽和三肽,优选在单罐反应中合适的缩合条件下制备药物。以下方案5-7中介绍了此方法。方案5介绍了用作合成式Ib药物化合物中间体的N-末端三肽单元F的合成。方案5如方案5所示,在合适的偶联条件下,如在PyBrop和二异丙基乙胺的存在下,或用DCC将保护氨基酸A(其中PG代表胺保护基团,R4选自氢、C1-C8烷基、C3-C8碳环、-O-(C1-C8烷基)、-芳基、烷基-芳基、烷基-(C3-C8碳环)、C3-C8杂环、烷基-(C3-C8杂环),R5选自H和甲基;或者R4和R5一起具有式-(CRaRb)n-,其中Ra和Rb独立地选自氢、C1-C8烷基和C3-C8碳环,n选自2、3、4、5和6,并与它们连接的碳原子形成环)偶联于叔丁酯B(其中R6选自-H和-C1-C8烷基;R7选自氢、C1-C8烷基、C3-C8碳环、-O-(C1-C8烷基)、-芳基、烷基-芳基、烷基-(C3-C8碳环)、C3-C8杂环和烷基-(C3-C8杂环))(参见例如,Miyazaki,K.等Chem.Pharm.Bull.1995,43(10),1706-1718)。合适的保护基团PG,和能够保护具有保护基团的氨基的合适的合成方法是本领域熟知的。参见例如Greene,T.W.和Wuts,P.G.M.,《有机合成中的保护基团》(ProtectiveGroupsinOrganicSynthesis),第2版,1991,JohnWiley&Sons。示范性的保护氨基酸A是PG-异亮氨酸,尤其是PG-缬氨酸,而其它合适的保护氨基酸包括但不限于:PG-环己基甘氨酸、PG-环己基丙氨酸、PG-氨基环丙烷-1-羧酸、PG-氨基异丁酸、PG-苯丙氨酸、PG-苯基甘氨酸和PG-叔丁基甘氨酸。Z是示范性保护基团。Fmoc是另一示范性保护基团。示范性叔丁酯B是dolaisoleuine叔丁酯。例如,可用层析法纯化二肽C,然后,当PG是苄氧基羰基时用H2和10%Pd-C的乙醇溶液脱保护,或用二乙胺去除Fmoc保护基团。得到的胺D容易与氨基酸BB形成肽键(其中R1选自-H、-C1-C8烷基和-C3-C8碳环;R2选自-H和-C1-C8烷基;或R1和R2一起具有式-(CRaRb)n-,其中Ra和Rb独立地选自-H、-C1-C8烷基和-C3-C8碳环,n选自2、3、4、5和6,并与它们连接的氮原子形成环;R3选自氢、C1-C8烷基、C3-C8碳环、-O-(C1-C8烷基)、-芳基、烷基-芳基、烷基-(C3-C8碳环)、C3-C8杂环和烷基-(C3-C8杂环))。N,N-二烷基氨基酸是示范性氨基酸BB,如市售的N,N-二甲基缬氨酸。可用已知方法通过还原性双烷化来制备其它N,N-二烷基氨基酸(参见例如Bowman,R.E,Stroud,H.HJ.Chem.Soc.,1950,1342-1340)。Fmoc-Me-L-缬氨酸和Fmoc-Me-L-甘氨酸是两个示范性氨基酸BB,用于合成N-单烷基衍生物。用以三乙胺作为碱的偶联试剂DEPC使胺D和氨基酸BB反应提供三肽E。然后用HCl使E的C-末端保护基团脱保护,以提供式F的三肽化合物。分别在下面的通用步骤A和通用步骤B中概述方案5中所示的说明性DEPC偶联法和PyBrop偶联法。在下面的通用步骤C中概述了通过催化性氢化使Z-保护的胺脱保护的说明性方法。通用步骤A:用DEPC合成肽。用质子惰性有机溶剂,如二氯甲烷(0.1-0.5M)稀释N-保护的或N,N-双取代的氨基酸或肽D(1.0当量)和胺BB(1.1当量)。然后加入有机碱如三乙胺或二异丙基乙胺(1.5当量),然后加入DEPC(1.1当量)。在HPLC或TLC监测下搅拌得到的溶液(优选在氩气下)长达12小时。室温下真空去除溶剂,用例如HPLC或快速柱层析(硅胶柱)纯化粗产物。混合相关馏分,真空下浓缩产生三肽E,真空干燥过夜。通用步骤B:用PyBrop合成肽。用质子惰性有机溶剂如二氯甲烷或DME稀释任选含有羧基保护基团的氨基酸B(1.0当量),提供浓度为0.5~1.0mM的溶液,然后加入二异丙基乙胺(1.5当量)。加入一部分固体Fmoc-或Z-保护的氨基酸A(1.1当量),然后将PyBrop(1.2当量)加入得到的混合物中。用TLC或HPLC监测该反应,之后的操作步骤类似于通用步骤A。通用步骤C:通过催化性氢化去除Z。在合适的容器如厚壁圆底烧瓶中用乙醇稀释Z-保护的氨基酸或肽C,提供浓度为0.5-1.0mM的溶液。加入10%碳载钯(5-10%w/w),将反应混合物置于氢气下。用HPLC监测反应进程,通常在1-2小时内完成。通过预先洗涤的硅藻土垫过滤反应混合物,过滤后再用极性有机溶剂如甲醇洗涤硅藻土。真空浓缩洗脱溶液,用有机溶剂优选甲苯稀释得到的残留物。然后在真空下去除有机溶剂,得到脱保护的胺C。方案6显示用于制备式K的C-末端二肽的方法和用于将式K二肽与式F三肽偶联以制成式Ib药物化合物的方法。方案6可用肽化学熟知的缩合剂,如在三乙胺的存在下的DEPC将修饰氨基酸Boc-DolaproineG(参见例如Pettit,G.R.等Synthesis,1996,719-725)与式H的胺缩合容易地制备二肽K,如方案5所示。然后,可用通用步骤D将式K二肽与式F的三肽偶联,制成Fmoc-保护的式L药物化合物,然后用通用步骤E使其脱保护,提供式(Ib)药物化合物。通用步骤D:药物合成。用质子惰性有机溶剂如二氯甲烷稀释二肽K(1.0当量)和三肽F(1当量)的混合物,形成0.1M溶液,然后加入强酸如三氟乙酸(1/2v/v),在0℃、氮气下搅拌得到的混合物2小时。可用TLC或优选HPLC监测反应。真空下去除溶剂,优选用甲苯使得到的残留物共沸干燥两次。得到的残留物在高真空下干燥12小时,然后用质子惰性有机溶剂如二氯甲烷稀释。加入有机碱如三乙胺或二异丙基乙胺(1.5当量),然后加入PyBrop(1.2当量)或DEPC(1.2当量),这取决于残基上的化学官能团。用TLC或HPLC监测反应混合物,完成后,将反应进行后续步骤,与通用步骤A所述相似或相同。通用步骤E:用二乙胺去除Fmoc。用质子惰性有机溶剂如二氯甲烷稀释Fmoc-保护的药物L,将二乙胺(1/2v/v)加入得到的溶液中。用TLC或HPLC监测反应进程,一般在2小时内完成。真空浓缩反应混合物,优选用甲苯共沸干燥得到的残留物,然后高真空干燥,得到具有脱保护氨基的药物Ib。方案7显示了用于制备式(Ib)MMAF衍生物的方法。方案7用肽化学中熟知的缩合剂,如三乙胺存在下的DEPC将修饰的氨基酸Boc-DolaproineG(参见例如Pettit,G.R.等Synthesis,1996,719-725)与式M的保护氨基酸缩合容易地制备二肽O,如方案5和6所示。然后,可用通用步骤D将式O二肽与式F的三肽偶联,制成Fmoc-保护的式P的MMAF化合物,然后可用通用步骤E使其脱保护,提供式(Ib)MMAF药物化合物。因此,上述方法可用于制备可用于本发明的药物。4.6.2药物接头的合成为制备本发明的药物-接头化合物,使药物与接头上的反应位点反应。通常,当间隔单元(-Y-)和拉伸单元(-A-)都存在时,接头可具有以下结构:或者,当没有间隔单元(-Y-)时,接头可具有以下结构:当拉伸单元(-A-)和间隔单元(-Y-)都不存在时,接头也可具有以下结构:当氨基酸单元(W)和间隔单元(Y)都不存在时,接头也可具有以下结构:通常,合适的接头含有连接于任选的拉伸单元和任选的间隔单元的氨基酸单元。反应位点1在间隔单元末端,反应位点2在拉伸单元末端。如果没有间隔单元,反应位点1在氨基酸单元的C末端。在本发明的示范性实施方式中,反应位点1能与药物的氮原子反应,反应位点2能与配体上的巯基反应。反应位点1和2能与不同官能团反应。在本发明的一个方面,反应位点1是在本发明的另一方面,反应位点1是在本发明的又一方面,反应位点1是对硝基苯基碳酸酯,具有下式:在本发明的一个方面,反应位点2是巯基接受基团。合适的巯基接受基团包括卤代乙酰胺基团,具有下式其中X代表离去基团,优选O-甲磺酰基、O-甲苯磺酰基、-Cl、-Br或-I;或者马来酰亚胺基团,具有下式:有用的接头可从商业来源,如MolecularBiosciencesInc.(Boulder,CO)购得,或按以下方案8-10中所总结的方法制备。方案8其中X是-CH2-或-CH2OCH2-;当X是-CH2-时n是0-10之间的一个整数;或者当X是-CH2OCH2-时n是1-10之间的一个整数。方案9所示方法在Mitsunobu条件下将马来酰亚胺与甘油混合,制得聚乙二醇马来酰亚胺拉伸单元(参见例如,Walker,M.A.J.Org.Chem.1995,60,5352-5),然后装入对硝基苯基碳酸酯反应位点基团。方案9其中E是-CH2-或-CH2OCH2-;e是0-8之间的一个整数;或者,可制备PEG-马来酰亚胺和PEG-卤代乙酰胺拉伸单元,如Frisch等,BioconjugateChem.1996,7,180-186所述。方案10说明了含有马来酰亚胺拉伸基团和任选的对氨基苄基醚自我牺牲型间隔基团的说明性接头单元的通用合成方法。方案10其中Q是-C1-C8烷基、-O-(C1-C8烷基)、-卤素、-硝基或-氰基;m是0-4之间的一个整数;n是0-10之间的一个整数。可用下述购自MolecularBiosciences(Boulder,CO)的市售中间体、用有机合成的已知技术将有用的拉伸基团掺入到接头中。可通过使以下中间体与氨基酸单元的N-末端反应将式(IIIa)拉伸基团引入接头中,如方案11和12所述:其中n是1-10之间的一个整数,T是-H或-SO3Na;其中n是0-3之间的一个整数;可通过使以下中间体与氨基酸单元的N-末端反应将式(IIIb)拉伸单元引入接头中:其中X是-Br或-I;和可通过使以下中间体与氨基酸单元的N-末端反应将式(IV)拉伸单元引入接头中:可通过使以下中间体与氨基酸单元的N-末端反应将式(Va)拉伸单元引入接头中:可根据已知方法合成其它有用的拉伸基团。可按照Jones,D.S.等,TetrahedronLetters,2000,41(10),1531-1533;和Gilon,C.等,Tetrahedron,1967,23(11),4441-4447所述方法用N-Boc-羟胺处理卤代烷来制备下式氨氧基拉伸基团。其中-R17-选自-C1-C10亚烷基-、-C3-C8碳环-、-O-(C1-C8烷基)-、-亚芳基-、-C1-C10亚烷基-亚芳基-、-亚芳基-C1-C10亚烷基-、-C1-C10亚烷基-(C3-C8碳环)-、-(C3-C8碳环)-C1-C10亚烷基-、-C3-C8杂环-、-C1-C10亚烷基-(C3-C8杂环)-、-(C3-C8杂环)-C1-C10亚烷基-、-(CH2CH2O)r-、-(CH2CH2O)r-CH2-;r是1-10之间的一个整数;可从异氰硫基羧酸氯化物制备下式的异硫氰酸酯拉伸基团,如Angew.Chem.,1975,87(14):517所述。其中-R17-如本文所述。方案11显示了获得含有马来酰亚胺拉伸单元和任选的对氨基苄基自我牺牲型间隔单元的val-cit二肽接头的方法。方案11其中Q是-C1-C8烷基、-O-(C1-C8烷基)、-卤素、-硝基或-氰基;m是0-4之间的一个整数。方案12说明了含有马来酰亚胺拉伸单元和对氨基苄基自我牺牲型间隔单元的phe-lys(Mtr)二肽接头单元的合成。原材料AD(lys(Mtr))可购自(Bachem,Torrance,CA),或可根据Dubowchik等TetrahedronLetters(1997)38:5257-60所述制备。方案12其中Q是-C1-C8烷基、-O-(C1-C8烷基)、-卤素、-硝基或-氰基;m是0-4之间的一个整数。如方案13所示,接头可与式(Ib)药物化合物的氨基反应形成含有酰胺或氨基甲酸酯基团的药物-接头化合物,将药物单元连接于接头单元。当反应位点1是羧酸基团时,如接头AJ,可用HATU或PyBrop和合适的胺碱进行偶联反应,产生药物-接头化合物AK,其在药物单元和接头单元之间含有酰胺键。当反应位点1是碳酸酯时,如接头AL,可用DMF/吡啶混合物中的HOBt将该接头偶联于药物,而提供药物-接头化合物AM,其在药物单元和接头单元之间含有氨基甲酸酯键。或者,当反应位点1是良好的离去基团时,如接头AN,可通过亲核取代过程将该接头与药物的氨基偶联,提供在药物单元和接头单元之间具有胺连接(AO)的药物-接头化合物。方案13中描述了用于将药物与配体连接形成药物-接头化合物的说明性方法,在通用步骤G-H中简述。方案13通用步骤G:用HATU形成酰胺。用合适的有机溶剂如二氯甲烷稀释药物(Ib)(1.0当量)和含有羧酸反应位点的N-保护的接头(1.0当量),用HATU(1.5当量)和有机碱,优选吡啶(1.5当量)处理得到的溶液。在惰性气体,优选氩气下搅拌反应混合物6小时,期间用HPLC监测反应混合物。浓缩反应混合物,用HPLC纯化得到的残留物,产生式AK酰胺。步骤H:用HOBt形成氨基甲酸酯。用质子惰性有机溶剂如DMF稀释含有对硝基苯基碳酸酯反应位点的接头AL(1.1当量)和药物(Ib)(1.0当量)的混合物,提供浓度为50-100mM的溶液,用HOBt(2.0当量)处理得到的溶液,置于惰性气体,优选氩气下。搅拌反应混合物15分钟,然后加入有机碱如吡啶(1/4v/v),用HPLC监测反应进程。一般在16小时中消耗掉此接头。然后在真空下浓缩反应混合物,用例如HPLC纯化得到的残留物,产生氨基甲酸酯AM。方案14中简述了制备药物-接头化合物的替代方法。用方案14的方法,将药物连接于没有连接拉伸单元的部分接头单元(如ZA)。这提供了中间体AP,它具有含Fmoc-保护的N-末端氨基酸单元。然后去除Fmoc基团,将得到的胺中间体AQ用PyBrop或DEPC催化的偶联反应连接于拉伸单元。方案14中介绍了含有溴代乙酰胺拉伸单元AR或PEG马来酰亚胺拉伸单元AS的药物-接头化合物的构建。方案14其中Q是-C1-C8烷基、-O-(C1-C8烷基)、-卤素、-硝基或-氰基;m是0-4之间的一个整数。方案15中显示了制备含有支链间隔基团的接头单元的方法。方案15方案15介绍了含有马来酰亚胺拉伸单元和双(4-羟甲基)苯乙烯(BHMS)单元的val-cit二肽接头的合成。改进了以前文献报道的BHMS中间体(AW)的合成方法(参见Firestone等的国际公开号WO9813059和Crozet,M.P.;Archaimbault,G.;Vanelle,P.;Nouguier,R.TetrahedronLett.(1985)26:5133-5134),并将其用作原材料,市售的二乙基(4-硝基苄基)膦酸酯(AT)和市售的2,2-二甲基-1,3-二噁烷-5-酮(AU)。可用方案9所述方法从中间体AW制备接头AY和BA。4.6.3树枝状接头接头可以是通过分枝状多功能接头部分将一个以上的药物部分共价连接于配体,例如但不限于抗体的树枝类型接头(Sun等(2002)Bioorganic&MedicinalChemistryLetters12:2213-2215;Sun等(2003)Bioorganic&MedicinalChemistry11:1761-1768)。树枝状接头可提高药物与抗体,即加载的摩尔比,这关系到药物-接头-配体偶联物的药效。因此,当半胱氨酸工程改造的抗体仅携带一个反应性半胱氨酸巯基时,可通过树枝状接头连接大量药物部分。以下树枝状接头试剂的示范性实施方式允许多达9个亲核药物部分试剂通过与氯乙基氮芥官能团反应相偶联:4.6.4药物部分与抗体偶联方案16介绍了每个抗体约含2~4个药物的药物-接头-配体偶联物的制备方法。用还原剂如二硫苏糖醇(DTT)处理抗体,还原一些或全部的半胱氨酸二硫残基,形成高亲核性的半胱氨酸巯基(-CH2SH)。因此,根据Klussman等(2004),BioconjugateChemistry15(4):765-773中第766页的偶联方法,使部分还原的抗体与含有亲电子官能团如马来酰亚胺或α-卤代羰基的药物-接头化合物或接头试剂反应。方案16例如,用过量的100mM二硫苏糖醇(DTT)处理抗体如AC10的500mM硼酸钠和500mM氯化钠溶液(pH8.0)。37℃孵育约30分钟后,通过在SephadexG25树脂上洗脱交换缓冲液,用含有1mMDTPA的PBS洗脱。通过该溶液的280nm吸光度确定还原抗体浓度以及通过与DTNB(Aldrich,Milwaukee,WI)反应和412nm吸光度确定巯基浓度核实巯基/抗体值。在冰上冷却溶于PBS的还原抗体。将已知浓度的溶于乙腈和水的药物接头如MC-val-cit-PAB-MMAE的DMSO溶液加入预冷的还原抗体的PBS溶液中。约1小时后,加入过量马来酰亚胺终止反应,给未反应的抗体巯基加帽。离心超滤浓缩反应混合物,纯化ADC如AC10-MC-vc-PAB-MMAE,并通过G25树脂用PBS溶液洗脱脱盐,在无菌条件下通过0.2μm滤器过滤,冷冻储存。制备具有各种接头和药物部分MMAE和MMAF的各种抗体-药物偶联物(ADC)。下表是按照实施例27的方法制备,用HPLC和药物加载量试验特征鉴定的一组示范性ADC。4.7.组合物和给药方法在其它实施方式中,描述了包含有效量的示范性化合物和/或示范性偶联物和药学上可接受的运载体或介质的组合物。为方便起见,将药物单元和药物-接头化合物称为示范性化合物,而药物-配体偶联物和药物-接头-配体偶联物称为示范性偶联物。这些化合物适用于兽医或人类给药。本发明组合物可以是给予患者的任何组合物形式。例如,该组合物可以是固体、液体或气体(气雾剂)形式。一般的给药途径包括但不限于:口服、局部、胃肠道外、舌下、直肠、阴道、眼部、肿瘤内和鼻内。胃肠道外给药包括皮下注射、静脉内、肌肉内、胸内注射或输液技术。在一个方面,胃肠道外给予该组合物。在又一方面,静脉内给予示范性化合物和/或示范性偶联物或组合物。可配制药物组合物,使得在给予患者该组合物后示范性化合物和/或示范性偶联物可被生物利用。组合物可采取单一或多剂量单位的形式,例如,片剂可以是单剂量单位,气雾剂形式的示范性化合物和/或示范性偶联物的容器可容纳多个剂量单位。用于制备该药物组合物的材料在其用量下应无毒。本领域普通技术人员将明白该药物组合物中活性成分的最佳剂量取决于各种因素。相关因素包括但不限于:动物类型(如人)、示范性化合物或示范性偶联物的具体形式、给药方式和采用的组成。药学上可接受的运载体可为颗粒状,因此该组合物可以是,例如片剂或粉末形式。运载体是液体时,该组合物可以是,例如口服糖浆或注射液。此外,运载体可以是气态或微粒,以提供用于(例如)吸入给药的气雾剂组合物。当口服给药时,该组合物优选固体或液体形式,半固体、半液体、悬浮液和凝胶形式也包括在本文所考虑的固体或液体形式中。作为口服给药的固体组合物,可将该组合物制成粉剂、颗粒剂、压缩片剂、丸剂、胶囊、口香糖、糯米纸囊剂等。这种固体组合物一般含有一种或多种惰性稀释剂。此外,可存在一种或多种以下物质:粘合剂如羧甲基纤维素、乙基纤维素、微晶纤维素或明胶;赋形剂如淀粉、乳糖或糊精、崩解剂如藻酸、藻酸钠、原始凝胶(Primogel)、玉米淀粉等;润滑剂如硬脂酸镁或Sterotex;助流剂如胶体二氧化硅;甜味剂如蔗糖或糖精、调味剂如薄荷、甲基水杨酸或橙味剂;以及着色剂。当组合物是胶囊,如明胶胶囊形式时,除上述类型的材料外,它还可含有液态运载体如聚乙二醇、环式糊精或脂肪油。该组合物可以是液体形式,如酏剂、糖浆、溶液、乳液或悬浮剂。液体可用于口服给药或注射递送。当口服给药时,组合物可含有甜味剂、防腐剂、染料/着色剂和味道增强剂中的一种或多种。注射给药的组合物中,也可包含表面活性剂、防腐剂、湿润剂、分散剂、悬浮剂、缓冲液、稳定剂和等渗剂中的一种或多种。无论是溶液、悬浮液或其它类似形式的液体组合物也可包含一种或多种以下物质:无菌稀释剂如注射用水,盐溶液,优选生理盐水、林格溶液、等渗氯化钠,可用作溶剂或悬浮介质的不挥发性油如合成的甘油单酯或甘油二酯,聚乙二醇,甘油,环式糊精,丙二醇或其它溶剂;抗菌剂如苄基醇或对羟基苯甲酸甲酯;抗氧化剂如抗坏血酸或亚硫酸氢钠;螯合剂如乙二胺四乙酸;缓冲液如乙酸盐、柠檬酸盐或磷酸盐缓冲液,以及调节张力的物质如氯化钠或右旋糖。可将胃肠道外组合物包装在由玻璃、塑料或其它材料制成的安瓿、一次性注射器或多剂量小瓶中。生理盐水是示范性辅佐剂。注射组合物优选无菌。在治疗具体疾病或病症中示范性化合物和/或示范性偶联物的有效量取决于疾病或病症的性质,可用标准临床技术测定有效量。此外,可任选地进行体外或体内试验以帮助鉴定最佳剂量范围。用于组合物的准确剂量也取决于给药途径,和疾病或失调的严重性,应根据医生的判断和各个患者的情况来决定。该组合物含有有效量的示范性化合物和/或示范性偶联物,以获得合适剂量。此用量一般至少约为该组合物重量0.01%的示范性化合物和/或示范性偶联物。当口服给药时,此用量可约为该组合物重量的0.1%-80%。在一个方面,口服组合物可含有约占该组合物重量4%-50%的示范性化合物和/或示范性偶联物。在又一方面,制备本发明组合物,以使胃肠道外单位剂量含有约0.01重量%-2重量%的示范性化合物和/或示范性偶联物。对于静脉内给药而言,该组合物可含有每千克动物体重约0.01-100mg的示范性化合物和/或示范性偶联物。在一个方面,该组合物可包含约每千克动物体重1-100mg的示范性化合物和/或示范性偶联物。在另一方面,给药量约为0.1-25mg/kg体重的示范性化合物和/或示范性偶联物。通常,给予患者的示范性化合物和/或示范性偶联物剂量一般约为0.01mg/kg动物体重-2000mg/kg动物体重。在一个方面,给予患者的剂量约为0.01mg/kg动物体重-10mg/kg动物体重,在另一方面,给予患者的剂量约为0.1mg/kg动物体重-250mg/kg动物体重,在又一方面,给予患者的剂量约为0.1mg/kg动物体重-20mg/kg动物体重,在又一方面,给药剂量约为0.1mg/kg动物体重-10mg/kg动物体重,在又一方面,给药剂量约为1mg/kg动物体重-10mg/kg动物体重。示范性化合物和/或示范性偶联物或组合物可通过任何方便的途径,例如通过输液或推注给药,通过上皮或粘膜层(如口腔粘膜、直肠和肠粘膜等)吸收。可以全身或局部给药。已知各种递送系统,如包裹在脂质体、微粒、微胶囊、胶囊等中,它们可用于给予示范性化合物和/或示范性偶联物或组合物。在某些实施方式中,将一种以上的示范性化合物和/或示范性偶联物或组合物给予患者。在特定实施方式中,可能需要将一种或多种示范性化合物和/或示范性偶联物或组合物局部给予需要治疗的部位。这可通过,例如但不限于:手术期间局部输注;局部施用,如术后与创伤敷料联用;注射;导管方式;栓剂方式;或植入方式(植入物为多孔性、非多孔性或明胶材料,包括膜如硅塑(sialastic)膜或纤维)来实现。在一个实施方式中,可通过直接注射于癌、肿瘤或赘生物或瘤前组织的部位(或之前部位)给药。在另一实施方式中,可通过直接注射于自身免疫病病变部位(或之前部位)给药。在某些实施方式中,可能需要通过合适途径将一种或多种示范性化合物和/或示范性偶联物或组合物引入中枢神经系统中,这些途径包括心室内和鞘内注射。通过心室内导管,例如连接有储器,如Ommaya储药器的心室内导管有助于心室内注射。例如也可通过使用吸入器或喷雾器,与促气雾剂一起配制,或通过碳氟化合物或合成肺部表面活性剂灌注进行肺部给药。在又一实施方式中,示范性化合物和/或示范性偶联物或组合物可以控释系统递送,例如但不限于:使用泵或各种聚合材料。在又一实施方式中,可将控释系统置于示范性化合物和/或示范性偶联物或组合物的靶(如脑)的附近,因而仅需要全身给药剂量的一部分(参见例如Goodson,《控释的医学应用》(MedicalApplicationsofControlledRelease),同上,第2卷,第115-138页(1984))。可用Langer综述(Science249:1527-1533(1990))中讨论的其它控释系统。术语“运载体”指稀释剂、辅佐剂或赋形剂,将示范性化合物和/或示范性偶联物与运载体一起给药。这种药物运载体可以是液体,如水和油,包括石油、动物、植物或合成来源的液体,如花生油、大豆油、矿物油、芝麻油等。运载体可以是盐水、阿拉伯树胶、明胶、淀粉糊、滑石粉、角蛋白、胶体氧化硅、尿素等。此外,可使用辅助剂、稳定剂、增稠剂、润滑剂和着色剂。在一个实施方式中,当给予患者时,示范性化合物和/或示范性偶联物或组合物和药学上可接受的运载体无菌。当静脉内给予示范性化合物和/或示范性偶联物时,水是示范性运载体。盐水溶液以及右旋糖和甘油的水溶液也可用作液体运载体,尤其是注射溶液。合适的药物运载体还包括赋形剂如淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石粉、氯化钠、脱脂奶粉、甘油、丙烯、二醇、水、乙醇等。如果需要,本发明组合物也可含有少量湿润剂或乳化剂,或pH缓冲剂。本发明组合物可采取溶液,悬液,乳液,片剂,丸剂,微型片剂(pellet),胶囊,含有液体、粉剂、缓释剂、栓剂、乳剂、气雾剂、喷雾剂、悬浮剂的胶囊形式或其它适合使用的形式。合适的药物运载体的其它例子见E.W.Martin的《雷明顿药物科学》(Remington’sPharmaceuticalSciences)。在一个实施方式中,根据常规方法将示范性化合物和/或示范性偶联物配成适合静脉内给予动物,尤其是人的药物组合物。用于静脉内给药的运载体一般是无菌等渗缓冲水溶液。需要时,该组合物也可包含增溶剂。用于静脉内给药的组合物可任选地包含局部麻醉剂如利多卡因,以缓解注射部位的疼痛。通常,在标明活性物质用量的密封容器如安瓿或药囊中以单位剂型单独或混合形式,例如,作为冻干粉末或无水浓缩物提供。当通过输注给予示范性化合物和/或示范性偶联物时,可用,例如含有药物级无菌水或盐水的输液瓶配药。当通过注射给予示范性化合物和/或示范性偶联物时,可提供装有注射用无菌水或盐水的安瓿,以便在给药前混合这些成分。用于口服递送的组合物可以是例如片剂、锭剂、水性或油性悬液、颗粒、粉剂、乳液、胶囊、糖浆或酏剂形式。口服给药的组合物可含有一种或多种以下任选的物质,例如甜味剂如果糖,阿斯巴甜或糖精;调味剂如薄荷、冬青油或樱桃油;着色剂;和防腐剂,以提供药学可口的制剂。而且,以片剂或丸剂形式给药时,可包衣该组合物以延迟在胃肠道中的崩解和吸收,从而在延长时间中提供缓释作用。渗透活性驱动化合物周围的选择性通透膜也适用于口服给药的化合物。在这些递送平台中,胶囊周围环境的液体被该驱动化合物吸收而膨胀,通过孔隙释放药物或药物组合物。这些递送平台可提供基本零级动力学的递送模式,与立即释放剂型的峰值模式相反。也可采用延时(释放)材料如单硬脂酸甘油酯或硬脂酸甘油酯。该组合物可用于局部给药,此时运载体可以是溶液、乳液、软膏或凝胶基质形式。如果用于透皮给药,该组合物可以是透皮贴剂或离子电渗装置形式。局部剂型可包含浓度约为0.05%-50%w/v(每单位体积组合物中的重量),另一方面为0.1%-10%w/v的示范性化合物和/或示范性偶联物。该组合物可用于直肠给药,其形式为,例如在直肠中融化并释放示范性化合物和/或示范性偶联物的栓剂。该组合物可包含改变固体或液体剂量单位的物理形式的各种材料。例如,该组合物可包含在活性成分周围形成包衣外壳的材料。形成包衣外壳的材料一般是惰性的,可选自例如:糖、虫胶和其它肠溶包衣物质。或者,可将活性成分包装在明胶胶囊中。该组合物可由气态剂量单位组成,例如,可以是气雾剂形式。术语气雾剂用来指各种系统,从胶体性质系统到由密封包装组成的系统。可通过液化气或压缩气体或通过适合地分散活性成分的泵系统进行递送。无论是固体、液体或气体形式,本组合物可包括用于治疗癌症、自身免疫病或传染病的药物。4.8示范性偶联物的治疗用途示范性化合物和/或示范性偶联物可用于治疗患者的癌症、自身免疫病或传染病。4.8.1治疗癌症示范性化合物和/或示范性偶联物可用于抑制肿瘤细胞或癌细胞的增殖,引起肿瘤或癌细胞凋亡,或治疗患者的癌症。因此,可使用各种形式的示范性化合物和/或示范性偶联物治疗动物癌症。可用药物-接头-配体偶联物将药物或药物单元递送到肿瘤细胞或癌细胞中。如果不受限于理论,在一个实施方式中,示范性偶联物的配体单元与癌细胞或肿瘤相关抗原结合或缔合,通过受体介导的胞吞作用使示范性偶联物被肿瘤细胞或癌细胞摄入。可使其与肿瘤细胞或癌细胞的抗原结合,或与肿瘤细胞或癌细胞相关的胞外基质蛋白结合。一旦进入细胞,接头单元中的一个或多个特异性肽序列就受到一种或多种肿瘤细胞或癌细胞相关蛋白酶的水解,导致药物或药物-接头化合物释放。然后,释放的药物或药物-接头化合物在细胞内自由迁移,诱导细胞毒性或细胞抑制活性。在另一实施方式中,示范性偶联物在肿瘤细胞或癌细胞外被切下药物或药物单元后,药物或药物-接头化合物即可透入细胞中。在一个实施方式中,配体单元与肿瘤细胞或癌细胞结合。在另一实施方式中,配体单元与肿瘤细胞或癌细胞表面上的肿瘤细胞或癌细胞抗原结合。在另一实施方式中,配体单元与肿瘤细胞或癌细胞相关的胞外基质蛋白的肿瘤细胞或癌细胞抗原结合。配体单元对具体肿瘤细胞或癌细胞的特异性对确定哪些肿瘤或癌症能最有效地治疗很重要。例如,具有BR96配体单元的示范性偶联物可用于治疗(BR96)抗原阳性癌,包括肺癌、乳腺癌、结肠癌、卵巢癌和胰腺癌。含有抗CD30或抗CD40配体单元的示范性偶联物可用于治疗血液恶性肿瘤。可用示范性偶联物治疗的癌症的其它具体类型包括但不限于表3所列的癌症。表3实体瘤,包括但不限于:纤维肉瘤粘液肉瘤脂肪肉瘤软骨肉瘤成骨肉瘤脊索瘤血管肉瘤内皮肉瘤淋巴管肉瘤淋巴管内皮肉瘤滑膜瘤间皮瘤尤因瘤平滑肌肉瘤横纹肌肉瘤结肠癌结直肠癌肾癌胰腺癌骨癌乳腺癌卵巢癌前列腺癌食道癌胃癌口腔癌鼻癌喉癌鳞状细胞癌基底细胞癌腺癌汗腺瘤皮脂腺癌乳头状癌乳头状腺癌囊腺癌髓样癌支气管癌肾细胞癌肝癌胆管癌绒毛膜癌精原细胞瘤胚性癌肾母细胞瘤宫颈癌子宫癌睾丸癌小细胞肺癌膀胱癌肺癌上皮癌胶质瘤成胶质细胞瘤星形细胞瘤髓母细胞瘤颅咽管瘤室管膜瘤松果体瘤成血管细胞瘤听神经瘤少突神经胶质瘤脑脊膜瘤皮肤癌黑色素瘤神经母细胞瘤视网膜母细胞瘤血液癌症,包括但不限于:急性淋巴母细胞白血病“ALL”急性淋巴母细胞B-细胞白血病急性淋巴母细胞T-细胞白血病急性髓母细胞白血病“AML”急性前髓细胞白血病“APL”急性单核母细胞白血病急性红白血病急性原巨核细胞白血病急性骨髓单核细胞白血病急性非淋巴细胞白血病急性不分化性白血病慢性髓细胞白血病“CML”慢性淋巴细胞白血病“CLL”毛细胞白血病多发性骨髓瘤急性和慢性白血病:淋巴母细胞性骨髓性淋巴细胞性髓细胞白血病淋巴瘤:霍奇金病非霍奇金淋巴瘤多发性骨髓瘤瓦尔登斯特伦巨球蛋白血症重链病真性红细胞增多症示范性偶联物提供偶联物特异性靶向肿瘤或癌症,从而降低了这些化合物的全身毒性。接头单元稳定了血液中的示范性偶联物,但它在细胞中可被肿瘤特异性蛋白酶切割,而释放药物。4.8.2癌症的多手段治疗可给予示范性偶联物和/或示范性化合物来治疗或预防癌症,包括但不限于:肿瘤、转移或特征为细胞生长失控的其它疾病或失调。在其它实施方式中,提供了治疗或预防癌症的方法,该方法包括将有效量的示范性偶联物和化疗药给予需要的患者。在一个实施方式中,化疗药是用于治疗未发现是难治癌症的药物。在另一实施方式中,化疗药是用于治疗已发现是难治癌症的药物。可将示范性偶联物给予也用外科手术治疗的癌症患者。在一个实施方式中,其它治疗方法是放疗。在特定实施方式中,示范性偶联物与化疗药或与放疗一起给予。在另一特定实施方式中,在给予示范性偶联物之前或之后,在给予示范性偶联物之前或之后(在一个方面)至少1小时、5小时、12小时、1天、1周、1月,在另一方面是几个月(如长达三个月)后给予化疗药或放疗。可经一系列步骤给予化疗药。可给予表4中所列的任何一种化疗药或组合。关于放疗,根据待治疗癌症类型使用放疗方案。例如但不限于,给予X-射线辐射;具体是高能兆伏级(辐射能量大于1MeV)用于深部肿瘤,电子束和中电压X-射线辐射可用于皮肤癌。也可给予发射γ-射线的放射性同位素,如镭、钴和其它元素的放射性同位素。此外,提供用示范性化合物和/或示范性偶联物治疗癌症的方法,作为在证明或可证明化疗或放疗毒性太高,如对所治疗对象产生不可接受的或不能承受的副作用时,化疗或放疗的替代疗法。可任选地用另一种癌症治疗方法如手术、放疗或化疗治疗动物,这取决于发现哪种治疗是可接受和可承受的。示范性化合物和/或示范性偶联物也可以体外或离体方式使用,如用于治疗某些癌症,包括但不限于:白血病和淋巴瘤,这种治疗包括自身干细胞移植。方法包括收集动物的自身造血干细胞和清除所有癌细胞等多步过程,然后,给予高剂量的示范性化合物和/或示范性偶联物(伴随或不伴随高剂量放疗)根除残留的剩余骨髓细胞群,将干细胞移植物输注回动物。然后在骨髓功能恢复和动物复原时提供支持性护理。4.8.3癌症的多种药物治疗公开了治疗癌症的方法,该方法包括将有效量的示范性偶联物和另一抗癌治疗制剂给予需要它的患者。合适的抗癌药包括但不限于:甲氨蝶呤、紫杉醇、L-天冬酰胺酶、巯基嘌呤、硫鸟嘌呤、羟基脲、阿糖胞苷、环磷酰胺、异环磷酰胺、亚硝基脲、顺铂、卡铂、丝裂霉素、达卡巴嗪、丙卡巴肼、拓扑替康、氮芥、环磷酰胺、依托泊甙、5-氟尿嘧啶、BCNU、伊立替康、喜树碱、博来霉素、多柔比星、黄胆素、道诺霉素、放线菌素d、普卡霉素、米托蒽醌、天冬酰胺酶、长春碱、长春新碱、长春瑞滨、紫杉醇和多西他赛。在一个方面,抗癌剂包括但不限于:表4所列药物。表44.8.4自身免疫病的治疗示范性偶联物可用于杀伤产生自身免疫病的细胞或抑制其复制或治疗自身免疫病。因此,示范性偶联物可以各种形式用于治疗患者的自身免疫病。药物-接头-配体偶联物可用于将药物递送给靶细胞。如果不受限于理论,在一个实施方式中,药物-接头-配体偶联物与靶细胞表面上的抗原结合,然后,通过受体介导的胞吞作用将示范性偶联物摄入靶细胞。一旦进入细胞,接头单元内一个或多个特定肽序列被酶解或水解切割,导致药物释放。然后,释放的药物在胞质中自由迁移,诱导细胞毒性或细胞抑制活性。在另一实施方式中,示范性偶联物在靶细胞外被切下药物,然后药物穿透入细胞。在一个实施方式中,配体单元与自身免疫性抗原结合。在一个方面,该抗原位于参与自身免疫病的细胞表面上。在另一实施方式中,配体单元与细胞表面上的自身免疫性抗原结合。在一个实施方式中,配体与自身免疫病相关的活化淋巴细胞结合。在又一实施方式中,示范性偶联物杀伤或抑制产生与具体自身免疫病相关的自身免疫性抗体的细胞增殖。可用示范性偶联物治疗的自身免疫病的具体类型包括但不限于:Th2淋巴细胞相关疾病(如特应性皮炎、特应性哮喘、鼻结膜炎、变应性鼻炎、Omenn综合征、全身性硬化和移植物抗宿主病);Th1淋巴细胞相关疾病(如类风湿性关节炎、多发性硬化、牛皮癣、斯耶格伦综合征、桥本甲状腺炎、格雷夫斯病、原发性胆汁性肝硬化、韦格纳肉芽肿病和结核病);活化B淋巴细胞相关疾病(如系统性红斑狼疮、肺出血-肾炎综合征、类风湿性关节炎和I型糖尿病);以及表5所述疾病。表5活动性慢性肝炎阿狄森病变态性肺泡炎变态性反应变态性鼻炎阿尔波特综合征过敏性反应强直性脊柱炎抗磷脂综合征关节炎蛔虫病黑霉菌病特应性变态反应特应性皮炎特应性鼻炎贝切特病鸟爱好者肺支气管哮喘卡普兰综合征心肌病乳糜泻恰加斯病慢性肾小球肾炎寇甘综合征冷凝集素病先天性风疹感染CREST综合征克罗恩氏病冷球蛋白血症库兴综合征皮肌炎盘状狼疮德雷斯勒综合征伊-朗综合征艾柯病毒感染脑脊髓炎内分泌性眼病爱波斯坦-巴尔病毒感染马肺气肿病(EquineHeaves)红斑病伊凡斯综合征费尔提综合征纤维肌痛富克斯睫状体炎胃萎缩胃肠道变态反应巨细胞动脉炎肾小球肾炎肺出血-肾炎综合征移植物抗宿主病格雷夫斯病Guillain-Barre病桥本甲状腺炎溶血性贫血亨诺-许兰紫癜特发性肾上腺萎缩特发性肺纤维化(PulmonaryFibritis)IgA肾病炎性肠病胰岛素依赖性糖尿病青少年关节炎青少年糖尿病(I型)朗-伊综合征蹄叶炎扁平苔藓狼疮样肝炎狼疮淋巴细胞减少梅尼埃病混合型结缔组织病多发性硬化重症肌无力恶性贫血多腺体综合征早老性痴呆原发性丙种球蛋白缺乏症原发性胆汁性肝硬化牛皮癣牛皮癣性关节炎雷诺氏现象习惯性流产莱特尔综合征风湿热类风湿性关节炎Sampter综合征血吸虫病施密特综合征硬皮病许曼综合征斯耶格伦综合征全身肌强直综合征交感性眼炎系统性红斑狼疮高安动脉炎颞动脉炎甲状腺炎血小板减少甲状腺毒症中毒性表皮坏死松解症B型胰岛素抗性I型糖尿病溃疡性结肠炎葡萄膜炎白斑病瓦尔登斯特伦巨球蛋白血症韦格纳肉芽肿病4.8.5自身免疫病的多种药物治疗也公开了治疗自身免疫病的方法,该方法包括将有效量的示范性偶联物和已知用于治疗自身免疫病的另一种治疗制剂给予需要的患者。在一个实施方式中,抗自身免疫病药包括但不限于表6所列药物。表6环孢菌素环孢菌素A麦考酚酸吗乙酯西罗莫司他克莫司enanercept氯泼尼松硫唑嘌呤甲氨蝶呤环磷酰胺氯泼尼松氨基己酸氯喹羟化氯喹氢化可的松地塞米松苯丁酸氮芥DHEA达那唑溴麦角环肽美洛昔康英夫利昔单抗4.8.6传染病的治疗示范性偶联物可用于杀伤或抑制产生传染病的细胞增殖或治疗传染病。因此,示范性偶联物可以各种形式用于治疗患者的传染病。药物-接头-配体偶联物可用于将药物递送给靶细胞。在一个实施方式中,配体单元能与传染病细胞结合。在一个实施方式中,该偶联物杀伤产生具体传染病的细胞或抑制其增殖。可用示范性偶联物治疗的传染病的具体类型包括但不限于表7所述疾病。表7细菌病:白喉百日咳神秘菌血症尿路感染胃肠炎蜂窝织炎会厌炎气管炎腺样肥大咽后脓肿脓疱病臁疮肺炎心内膜炎脓毒性关节炎肺炎球菌腹膜炎菌血症(Bactermia)脑膜炎急性化脓性脑膜炎尿道炎子宫颈炎直肠炎咽炎输卵管炎附睾炎淋病梅毒李斯特氏菌病炭疽病诺卡菌病沙门氏菌病伤寒痢疾结膜炎窦炎普鲁氏菌病兔热病(Tullaremia)霍乱黑死病破伤风坏死性肠炎放线菌病混合型厌氧性感染梅毒回归热钩端螺旋体病莱姆病鼠咬热结核病淋巴结炎麻风病衣原体衣原体肺炎沙眼包涵体性结膜炎全身性真菌病:组织胞浆菌病球孢子菌病芽生菌病孢子丝菌病隐球酵母病全身性念珠菌病曲霉病毛霉菌病足分支菌病广色霉菌病立克次氏体病:斑疹伤寒洛矶山斑疹热埃里希体病东方蜱传播的立克次氏体病立克次氏体痘昆士兰热巴尔通体病寄生虫病:疟疾巴倍斯焦虫病非洲昏睡病恰加斯病利什曼病杜姆杜马病弓形体病脑膜脑炎角膜炎阿米巴病贾第虫病隐孢子虫病等孢球虫病无孢子虫病微孢子虫病蛔虫病鞭虫感染钩虫感染蛲虫感染眼幼虫迁移性匍行疹旋毛虫病麦地那龙线虫病淋巴丝虫病罗阿丝虫病盘尾丝虫病犬心虫病血吸虫病游泳者痒病(Swimmer’sItch)东方肺吸虫东方肝吸虫肝片吸虫病姜片虫病后睾吸虫病绦虫感染包虫病泡状棘球蚴病病毒病:麻疹亚急性硬化性全脑炎感冒腮腺炎风疹玫瑰疹传染性红斑水痘呼吸道合胞病毒感染哮吼细支气管炎传染性单核细胞增多症脊髓灰质炎疱疹性咽峡炎手足口病博恩霍尔姆病生殖器疱疹生殖器疣无菌性脑膜炎心肌炎心包炎胃肠炎获得性免疫缺陷综合征(AIDS)人免疫缺陷病毒(HIV)雷耶综合征川畸综合征流行性感冒支气管炎病毒“游走性”肺炎(Viral“Walking”Pneumonia)急性发热性呼吸系统疾病急性咽结膜热流行性角膜结膜炎单纯疱疹病毒1(HSV-1)单纯疱疹病毒2(HSV-2)带状疱疹细胞肥大包涵体病狂犬病进行性多灶性白质脑病库鲁病致命的家族性失眠症克罗伊茨费尔特-雅各病Gerstmann-Straussler-Scheinker病热带痉挛性下肢轻瘫西方马脑炎加利福尼亚脑炎圣路易脑炎黄热病登革热淋巴细胞性脉络丛脑膜炎拉沙热出血热汉特病毒(Hantvirus)肺综合征马尔堡病毒感染埃博拉病毒感染天花4.8.7传染病的多种药物治疗本文公开了治疗传染病的方法,该方法包括将示范性偶联物和作为抗传染病药的另一治疗制剂给予需要的患者。在一个实施方式中,抗传染病药是但不限于:表8所列药物。表8β-内酰胺抗生素类:青霉素G青霉素V氯唑西林双氯西林甲氧西林萘夫西林苯唑西林氨苄西林阿莫西林巴氨西林阿洛西林羧苄西林美洛西林哌拉西林替卡西林氨基糖苷类:阿米卡星庆大霉素卡那霉素新霉素奈替米星链霉素妥布霉素大环内酯类:阿奇毒素克拉霉素红霉素林可霉素克林霉素四环素类:地美环素多西环素米诺环素土霉素四环素喹诺酮类:西诺沙星萘啶酸氟喹诺酮类:环丙沙星依诺沙星格帕沙星左氧氟沙星洛美沙星诺氟沙星氧氟沙星司帕沙星曲伐沙星多肽类:杆菌肽多粘菌素E多粘菌素B磺胺类:硫代异噁唑磺胺甲基异噁唑磺胺嘧啶磺胺甲二唑硫代乙酰胺其它抗菌药:甲氧苄啶磺胺甲二唑(Sulfamethazole)氯霉素去甲万古霉素异甲硝唑奎奴普丁达福普汀利福平大观霉素呋喃妥因抗病毒药:通用抗病毒药:碘苷(Idoxuradine)阿糖腺苷曲氟尿苷阿昔洛韦泛昔洛韦(Famcicyclovir)喷昔洛韦(Pencicyclovir)伐昔洛韦(Valacyclovir)更昔洛韦(Gancicyclovir)膦甲酸利巴韦林金刚烷胺金刚乙胺西多福韦反义寡核苷酸免疫球蛋白干扰素用于HIV感染的药物替诺福韦Emtricitabine齐多夫定去羟肌苷扎西他滨司他夫定拉米夫定奈韦拉平地拉韦啶沙奎那韦利托那韦茚地那韦奈非那韦5.实施例实施例1–化合物AB的制备用DMF(120mL,0.2M)稀释Fmoc-val-cit-PAB-OH(14.61g,24.3mmol,1.0当量,Firestone等的美国专利号6214345),将二乙胺(60mL)加入此溶液中。用HPLC监测此反应,发现在2小时内完成。浓缩反应混合物,超声处理10分钟时用乙酸乙酯(大约100mL)沉淀得到的残留物。加入醚(200mL),再将沉淀超声处理5分钟。不要搅拌,让溶液静置30分钟,然后过滤,在高真空下干燥,产生Val-cit-PAB-OH,无需进一步纯化即可用于下一步骤。产率:8.84g(96%)。用DMF(110mL)稀释Val-cit-PAB-OH(8.0g,21mmol),用MC-Osu处理得到的溶液(Willner等,(1993)BioconjugateChem.4:521;6.5g,21mmol,1.0当量)。根据HPLC,反应在2小时后完成。浓缩反应混合物,用乙酸乙酯(50mL)沉淀得到的油。超声处理15分钟后,加入醚(400mL),再超声处理混合物,直到所有大颗粒被打碎。然后过滤溶液,干燥固体,得到灰白色固体中间体。产率:11.63g(96%);ES-MSm/z757.9[M-H]用DMF(120mL,0.2M)稀释Fmoc-val-cit-PAB-OH(14.61g,24.3mmol,1.0当量,美国专利号6214345,授予Firestone等),将二乙胺(60mL)加入此溶液中。用HPLC监测此反应,发现在2小时内完成。浓缩反应混合物,超声处理10分钟时用乙酸乙酯(大约100mL)沉淀得到的残留物。加入醚(200mL),再将沉淀超声处理5分钟。不要搅拌,让溶液静置30分钟,然后过滤,在高真空下干燥,产生Val-cit-PAB-OH,无需进一步纯化即可用于下一步骤。产率:8.84g(96%)。用DMF(110mL)稀释Val-cit-PAB-OH(8.0g,21mmol),用MC-Osu处理得到的溶液(Willner等,(1993)BioconjugateChem.4:521;6.5g,21mmol,1.0当量)。根据HPLC,反应在2小时后完成。浓缩反应混合物,用乙酸乙酯(50mL)沉淀得到的油。超声处理15分钟后,加入醚(400mL),再超声处理混合物,直到所有大颗粒被打碎。然后过滤溶液,干燥固体,得到灰白色固体中间体。产率:11.63g(96%);ES-MSm/z757.9[M-H]。用DMF(120mL,0.12M)稀释灰白色固体中间体(8.0g,14.0mmol),将双(4-硝基苯基)碳酸酯(8.5g,28.0mmol,2.0当量)和DIEA(3.66mL,21.0mmol,1.5当量)加入得到的溶液中。根据HPLC,该反应在1小时内完成。浓缩反应混合物,产生用EtOAc沉淀的油状物,然后用EtOAc(约25mL)研磨。再用醚(约200mL)沉淀溶质,研磨15分钟。过滤固体,在高真空下干燥,产生化合物AB,根据HPLC其纯度为93%,无需进一步纯化即可用于下一步骤。产率:9.7g(94%)。实施例2–制备化合物1用二氯甲烷(3mL)稀释苯丙氨酸叔丁酯盐酸盐(868mg,3mmol)、N-Boc-Dolaproine(668mg,1当量)、DEPC(820μL,1.5当量)和DIEA(1.2mL)。室温(约28摄氏度)2小时后,用二氯甲烷(20mL)稀释反应混合物,用NaHCO3饱和水溶液(2×10mL)、NaCl饱和水溶液(2×10mL)依次洗涤。分离并浓缩有机层。将得到的残留物重悬于乙酸乙酯,通过乙酸乙酯快速层析纯化。混合并浓缩相关馏分,产生二肽,为白色固体:684mg(46%)。ES-MSm/z491.3[M+H]+。对于在叔丁酯存在下选择性Boc切割,用二噁烷(2mL)稀释上述二肽(500mg,1.28mmol)。加入4MHCl/二噁烷(960μL,3当量),室温搅拌反应混合物过夜。RP-HPLC观察到BOC脱保护几乎完全,叔丁酯被切割的量最小。在冰浴上冷却混合物,加入三乙胺(500μL)。10分钟后,从冰浴中取出混合物,用二氯甲烷(20mL)稀释,用NaHCO3饱和水溶液(2×10mL)、NaCl饱和水溶液(2×10mL)依次洗涤。浓缩有机层,产生黄色泡沫:287mg(57%)。无需进一步纯化即可使用该中间体。在室温下用TFA(3mL)、二氯甲烷(3mL)处理三肽Fmoc-Meval-val-dil-O-t-Bu(其制备如WO02/088172,题为“五肽化合物及其相关用途”(PentapeptideCompoundsandUsesRelatedThereto)所述;0.73mmol)2小时。浓缩混合物至干燥,残留物与甲苯(3×20mL)共蒸发,在真空下干燥过夜。用二氯甲烷(5mL)稀释残留物,加入该脱保护的二肽(287mg,0.73mmol),然后加入DIEA(550μL,4当量),DEPC(201μL,1.1当量)。室温两小时后,用乙酸乙酯(50mL)稀释反应混合物,用10%柠檬酸水溶液(2×20mL)、NaHCO3饱和水溶液(2×10mL)、NaCl饱和水溶液(10mL)依次洗涤。分离并浓缩有机层。将得到的残留物重悬于乙酸乙酯,通过乙酸乙酯快速层析纯化。混合并浓缩相关馏分,产生Fmoc-Meval-val-dil-dap-phe-O-t-Bu,为白色固体:533mg(71%)。Rf0.4(EtOAc)。ES-MSm/z1010.6[M+H]+。用二氯甲烷(3mL)、二乙胺(1mL)稀释该产物(200mg,0.2mmol)。室温搅拌反应混合物过夜。去除溶剂,产生油状物,用硅胶快速层析以分步梯度的0-10%MeOH二氯甲烷溶液纯化,产生化合物1,为白色固体:137mg(87%)。Rf0.3(10%MeOH/CH2Cl2)。ES-MSm/z788.6[M+H]+。实施例3-制备化合物2通过4MHCl/二噁烷(4ml)室温处理7小时由化合物1(30mg,0.038mmol)制备化合物2。去除溶剂,真空干燥残留物过夜。产生化合物2,为吸湿性白色固体:35mg(120%,以盐酸盐计算)。ES-MSm/z732.56[M+H]+。实施例4-制备化合物3在室温下用4MHCl/二噁烷(4ml)处理Fmoc-Meval-val-dil-dap-phe-O-t-Bu(实施例2,50mg)16小时。去除溶剂,真空干燥残留物过夜。产生50mg吸湿性白色固体中间体。用二氯甲烷(1mL)稀释该白色固体中间体(20mg,0.02mmol);加入DEPC(5μL,0.03mmol,1.5当量),然后加入DIEA(11μL,0.06mmol,3当量),和叔丁胺(3.2μL,0.03mmol,1.5当量)。室温2小时后,RP-HPLC发现该反应未完成。加入更多DEPC(10μL)和叔丁胺(5μL),再搅拌反应4小时。用二氯甲烷(15mL)稀释反应混合物,用水(5mL)、0.1MHCl水溶液(10mL)、NaCl饱和水溶液(10mL)依次洗涤。分离并浓缩有机层。用二氯甲烷稀释得到的残留物,通过快速层析以分步梯度的0–5%MeOH二氯甲烷溶液纯化。混合并浓缩相关馏分,产生Fmoc保护的中间体,为白色固体:7.3mg(36%)。Rf0.75(10%MeOH/CH2Cl2)。在室温下,用二氯甲烷(0.5mL)稀释Fmoc保护的中间体,并用二乙胺(0.5mL)处理3小时。浓缩反应混合物至干燥。用硅胶快速层析以分步梯度的0-10%MeOH二氯甲烷溶液分离产物,产生化合物3,为白色固体:4mg(70%)。Rf0.2(10%MeOH/CH2Cl2)。ES-MSm/z787[M+H]+,809[M+Na]+。实施例5-制备化合物4用二氯甲烷(5mL)稀释Boc-L-苯丙氨酸(265mg,1mmol,1当量)和三甘醇单甲基醚(164μL,1mmol,1当量)。然后加入DCC(412mg,2mmol,2当量),再加入DMAP(10mg)。室温搅拌反应混合物过夜。滤除沉淀。真空下去除溶剂,用乙酸乙酯稀释残留物,用乙酸乙酯硅胶快速层析纯化。拉出含有产物的馏分,浓缩,真空干燥产生白色固体:377mg(91%)。Rf0.5(EtOAc)。ES-MSm/z434[M+Na]+。用二噁烷(10mL)和4MHCl/二噁烷(6mL)室温下处理上述材料6小时去除Boc保护基团。真空去除溶剂,真空干燥残留物,产生白色固体。用二氯甲烷(3mL)稀释三甘醇单甲基醚苯甲酸酯的盐酸盐(236mg,0.458mmol,1当量)和N-Boc-Dolaproine(158mg,0.55mmol,1.2当量)。将DEPC(125μL,1.5当量)加入混合物,然后加入DIEA(250μL,3当量)。室温2小时后,用乙酸乙酯(30mL)稀释反应混合物,用NaHCO3饱和水溶液(2×10mL)、10%柠檬酸水溶液(2×10mL)、NaCl饱和水溶液(10mL)依次洗涤。分离并浓缩有机层。将得到的残留物重悬于乙酸乙酯,通过乙酸乙酯硅胶快速层析纯化。混合并浓缩相关馏分,产生白色泡沫中间体:131mg(50%)。Rf0.25(EtOAc)。ES-MSm/z581.3[M+H]+。在二氯甲烷(2mL)、TFA(0.5mL)中室温2小时完成Boc脱保护。真空去除溶剂,残留物与甲苯(3×25mL)共蒸发,然后真空干燥产生138mg二肽TFA盐。用二氯甲烷(2mL)稀释Fmoc-Meval-val-dil-OH(实施例2,147mg,0.23mmol,1当量)和二肽TFA盐(138mg)。将DEPC(63μL,1.5当量)加入混合物中,然后加入DIEA(160μL,4当量)。室温2小时后,用二氯甲烷(30mL)稀释反应混合物,用10%柠檬酸水溶液(2×20mL),NaCl饱和水溶液(20mL)依次洗涤。分离并浓缩有机层。将得到的残留物重悬于二氯甲烷,通过硅胶快速层析以分步梯度的0-5%MeOH二氯甲烷溶液纯化。混合并浓缩相关馏分,产生白色泡沫:205mg(81%)。Rf0.4(10%MeOH/CH2Cl2)。ES-MSm/z1100.6[M+H]+,1122.4[M+Na]+。通过用二乙胺(2mL)的二氯甲烷(6mL)溶液处理去除Fmoc保护基团。室温6小时后,真空去除溶剂,用硅胶快速层析以分步梯度的0-10%MeOH二氯甲烷溶液分离产物。混合并浓缩相关馏分。从二氯甲烷/己烷1:1中蒸发后,获得化合物4,为白色泡沫:133mg(80%)。Rf0.15(10%MeOH/CH2Cl2)。ES-MSm/z878.6[M+H]+。实施例6-制备化合物5将Fmoc-Meval-val-dil-OH(实施例2,0.50g,0.78mmol)和dap-phe-OMe·HCl(0.3g,0.78mmol,根据Pettit,G.R.等Anti-CancerDrugDesign1998,13,243-277制备)溶解于CH2Cl2(10mL),然后加入二异丙基乙胺(0.30mL,1.71mmol,2.2当量)。加入DEPC(0.20mL,1.17,1.5当量),将反应物置于Ar中。根据HPLC,反应在1小时内完成。将混合物浓缩成油状物,用SiO2层析(300×25mm柱)纯化,用100%EtOAc洗脱。分离得到产物,为白色泡沫状固体。产率:0.65g(87%)。ES-MSm/z968.35[M+H]+,991.34[M+Na]+;UVλmax215,265nm。用二乙胺(2mL)处理Fmoc保护肽(0.14g,0.14mmol)的二氯甲烷(5mL)溶液,将反应物置于室温下2小时。将根据HPLC监测完成的反应浓缩为油状物,溶解于2mLDMSO中,注入制备型HPLC中(C12-RP柱,5μ,以10-100%线性梯度的MeCN水溶液(含有0.1%TFA)洗脱40分钟,然后以100%溶液洗脱20分钟,流速为25mL/分钟)。蒸发含有产物的馏分,产生三氟乙酸盐白色粉末。产率:0.126g(98%)。Rf0.28(100%EtOAc);ES-MSm/z746.59[M+H]+,768.51[M+Na]+;UVλmax215nm。实施例7-制备化合物6将化合物5的三氟乙酸盐(0.11g,0.13mmol)、化合物AB(0.103g,0.14mmol,1.1当量)和HOBt(3.4mg,26μmol,0.2当量)悬浮于DMF/吡啶(分别为2mL/0.5mL)中。加入二异丙基乙胺(22.5μL,0.13mmol,1.0当量),在氩气下搅拌黄色溶液。3小时后,再加入1.0当量DIEA。24小时后,反应混合物中包含0.5当量活化接头。总共40小时后,反应完成。蒸发反应物,溶解于DMSO中,注入制备型HPLC(C12-RP柱,5μ,以10-100%线性梯度的MeCN水溶液(含有0.1%TFA)洗脱40分钟,然后以100%溶液洗脱20分钟,流速为50mL/分钟)中。蒸发所需馏分,产生黄色油状产物。加入二氯甲烷(约2mL)和过量醚,产生白色沉淀化合物6,过滤并干燥。产率:90mg(52%)。ES-MSm/z1344.32[M+H]+,1366.29[M+Na]+;UVλmax215,248nm。实施例8-制备化合物7用DMF(1.5mL)稀释化合物4(133mg,0.15mmol,1当量)、化合物AB(123mg,0.167mmol,1.1当量)和HOBt(4mg,0.2当量)。2分钟后,加入吡啶(5mL),用RP-HPLC监测反应。显示反应在18小时内完成。用二氯甲烷(20mL)稀释反应混合物,用10%柠檬酸水溶液(2×10mL)、水(10mL)、NaCl饱和水溶液(10mL)依次洗涤。分离并浓缩有机层。将得到的残留物重悬于二氯甲烷,通过硅胶快速层析以分步梯度的0-10%MeOH二氯甲烷溶液纯化。混合并浓缩相关馏分,产生化合物7,为白色泡沫:46mg(21%)。Rf0.15(10%MeOH/CH2Cl2)。ES-MSm/z1476.94[M+H]+。实施例9-制备MC-Val-Cit-PAB-MMAF叔丁酯8在氩气下将化合物1(83mg,0.11mmol)、化合物AB(85mg,0.12mmol,1.1当量)和HOBt(2.8mg,21μmol,0.2当量)溶解于无水DMF(1.5mL)和吡啶(0.3mL)中。30小时后,通过HPLC发现该反应基本完成。蒸发混合物,溶解于最小量的DMSO中,用制备型HPLC(C12-RP柱,5μ,以10-100%线性梯度的MeCN水溶液(含有0.1%TFA)洗脱40分钟,然后以100%溶液洗脱20分钟,流速为25mL/分钟)纯化,产生化合物8,为白色固体。产率:103mg(71%)。ES-MSm/z1387.06[M+H]+,1409.04[M+Na]+;UVλmax205,248nm。实施例10-制备MC-val-cit-PAB-MMAF9将化合物8(45mg,32μmol)悬浮在二氯甲烷(6mL)中,然后加入TFA(3mL)。得到的溶液静置2小时。真空浓缩反应混合物,用制备型HPLC(C12-RP柱,5μ,以10-100%线性梯度的MeCN水溶液(含有0.1%TFA)洗脱40分钟,然后以100%溶液洗脱20分钟,流速为25mL/分钟)纯化。浓缩所需馏分,获得马来酰亚氨基己酰基-缬氨酸-瓜氨酸-对羟甲基氨基苯-MMAF(MC-val-cit-PAB-MMAF)9,为灰白色固体。产率:11mg(25%)。ES-MSm/z1330.29[M+H]+,1352.24[M+Na]+;UVλmax205,248nm。实施例11-制备MC-val-cit-PAB-MMAF叔丁基酰胺10用吡啶/DMF(6mL)稀释化合物3(217mg,0.276mmol,1.0当量)、化合物AB(204mg,0.276mmol,1.0当量)和HOBt(11mg,0.0828mmol,0.3当量)。将DIEA(0.048mL)加入此混合物,搅拌该混合物约16小时。真空下使挥发性有机物挥发。用Chromatotron(放射状薄层层析)以分步梯度的(0-5-10%甲醇的DCM溶液)纯化粗残留物,产生MC-val-cit-PAB-MMAF叔丁基酰胺10。产率:172mg(45%);ES-MSm/z1386.33[M+H]+,1408.36[M+Na]+;UVλmax215,248nm。实施例12–通过偶联AC10和MC-MMAE制备AC10-MC-MMAE用过量100mM二硫苏糖醇(DTT)处理溶解于500mM硼酸钠和500mM氯化钠,pH8.0中的AC10。37℃孵育约30分钟后,在SephadexG25树脂上洗脱交换缓冲液,用含有1mMDTPA的PBS洗脱。测定该溶液280nm吸光度确定还原抗体浓度和与DTNB(Aldrich,Milwaukee,WI)反应测定412nm吸光度确定的巯基浓度测定巯基/抗体值。在冰上冷却溶解于PBS的还原抗体。将溶解于DMSO的药物接头试剂、马来酰亚氨基己酰基-单甲基耳抑素E即MC-MMAE,在乙腈和水中稀释为已知浓度,加入预冷的还原抗体AC10的PBS溶液。约1小时后,加入过量马来酰亚胺终止反应,并给未反应的抗体巯基加帽。离心超滤浓缩反应混合物,纯化AC10-MC-MMAE,并通过G25树脂的PBS溶液洗脱脱盐,在无菌条件下通过0.2μm滤器过滤,冷冻储存。实施例13-通过偶联AC10和MC-MMAF制备AC10-MC-MMAF按照实施例12的方案,通过偶联AC10和MC-MMAF制备AC10-MC-MMAF。实施例14-通过偶联AC10和MC-val-cit-PAB-MMAE制备AC10-MC-val-cit-PAB-MMAE按照实施例12的方案,通过偶联AC10和MC-val-cit-PAB-MMAE制备AC10-MC-val-cit-PAB-MMAE。实施例15-通过偶联AC10和MC-val-cit-PAB-MMAF(9)制备AC10-MC-val-cit-PAB-MMAF按照实施例12的方案,通过偶联AC10和MC-val-cit-PAB-MMAF(9)制备AC10-MC-val-cit-PAB-MMAF。实施例16-测定所选化合物的细胞毒性在LewisY阳性细胞系OVCAR-3、H3396乳腺癌、L2987肺癌和LS174t结肠癌上评价MMAF和化合物1-5的细胞毒活性。可测定对LewisY阳性细胞系的细胞毒性。为评价化合物1-5的细胞毒性,以每孔约5-10,000个细胞的密度将细胞接种到150μl培养基中,然后在试验开始时用分级剂量的化合物1-5(4复孔)处理。细胞毒试验通常在加入测试化合物后进行96小时。在最后4-6小时孵育期间,可向各孔中加入50μl刃天青染料,以测定培养结束时的活细胞。用荧光分光光度计以激发波长535nm和发射波长590nm测定染料的还原。在分析中,可比较刃天青被处理细胞还原的程度与被未处理对照细胞还原的程度。在1小时接触试验中,细胞可用药物脉冲处理1小时,然后洗涤;可在孵育96小时后测定细胞毒作用。实施例17-所选化合物的体外细胞毒数据表10显示如通用步骤I所述测定了化合物7-10的cAC10偶联物对CD30+细胞系Karpas299的作用。显示了两个单独试验的数据。发现化合物7和9的cAC10偶联物比cAC10-val-cit-MMAE的活性略高。表10偶联物IC50(ng/mL)cAC10-val-cit-MMAE6cAC10-71.0cAC10-815cAC10-90.5cAC10-1020在其他试验中,BR96-val-cit-MMAF的效果比游离的MMAF至少高250倍。通用步骤I-细胞毒性测定。为评价示范性偶联物7-10的细胞毒性,以每孔约5-10,000的密度将细胞接种到150μl培养基中,然后在试验开始时用分级剂量的示范性偶联物7-10(4复孔)处理。细胞毒试验通常在加入测试化合物后进行96小时。在最后4-6小时孵育期间,在各孔中加入50μl刃天青染料,以测定培养结束时的活细胞。用荧光分光光度计以激发波长535nm和发射波长590nm测定染料的还原。在分析中,可比较刃天青被处理细胞还原的程度与被未处理对照细胞还原的程度。实施例18-体外细胞增殖试验可用以下方案(PromegaCorp.TechnicalBulletinTB288;Mendoza等(2002)CancerRes.62:5485-5488)的细胞增殖试验测定ADC的效果:1.将培养基含有约104细胞(SKBR-3、BT474、MCF7或MDA-MB-468)的100μl细胞培养物等份加入到96孔不透明板的各孔中。2.制备含有培养基但没有细胞的对照孔。3.将ADC加入试验孔中,孵育3-5天。4.将该板平衡到室温约30分钟。5.加入CellTiter-Glo试剂,其体积与各孔中存在的细胞培养基的体积相等。6.在轨道摇床上混合诸成分2分钟,诱导细胞裂解。7.室温孵育该板10分钟,以稳定发光信号。8.记录发光信号,以RLU=相对发光单位作图。实施例19-大鼠的血浆清除率在Sprague-Dawley大鼠(CharlesRiverLaboratories,各250-275克)中研究了抗体-药物偶联物和总抗体的血浆清除药代动力学特征。动物通过尾静脉推注(IVPush)给药。在各个时间点经颈静脉插管或断尾法(tailstick)收集约300μl全血至锂/肝素抗凝的容器中,各个时间点如下:给药后0(给药前)、10和30分钟;1、2、4、8、24和36小时;以及2、3、4、7、14、21、28天。用ELISA-ECD/GxhuFc-HRP测定总抗体。用ELISA-MMAE/MMAF/ECD-Bio/SA-HRP测定抗体-药物偶联物。实施例20-猴的血浆清除率可在食蟹猴中研究抗体-药物偶联物和总抗体的血浆清除药代动力学特征。图12显示将H-MC-vc-MMAE以不同剂量:0.5、1.5、2.5和3.0mg/kg在第1天和第21天给予食蟹猴后的二级血浆浓度清除率研究。测定随时间推移的总抗体和ADC的浓度。(H=曲妥珠单抗)。实施例21-对转基因外植体小鼠体内肿瘤体积的效果适合于转基因试验的动物可购自如Taconic(Germantown,N.Y.)等标准商业来源。许多品系是合适的,但优选FVB雌性小鼠,因为它们更易于肿瘤形成。FVB雄性可用于交配,切除输精管的CD.1雄性可用于激发假孕。切除输精管的小鼠可购自任何商品供应商。奠基鼠可繁育FVB小鼠或129/BL6×FVBp53杂合小鼠。p53等位基因杂合小鼠可用于增加肿瘤形成。一些F1肿瘤来自杂交品系。建立肿瘤鼠可仅为FVB。可用单次剂量或多剂量的ADCIV注射治疗带有肿瘤(从Fo5mmtv转基因小鼠产生的同种异体移植物)的动物。评估注射后各个时间点的肿瘤体积。实施例22-通过叔丁酯合成MC-MMAF合成1:将MeVal-Val-Dil-Dap-Phe-OtBu(化合物1,128.6mg,0.163mmol)悬浮于CH2Cl2(0.500mL)中。加入6-马来酰亚氨基己酸(68.9mg,0.326mmol)和1,3-二异丙基碳二亚胺(0.0505mL,0.326mmol),然后加入吡啶(0.500mL)。搅拌反应混合物1.0小时。HPLC分析表明完全消耗了起始化合物1。减压蒸发掉挥发性有机物。通过快速柱层析以分步梯度的0-5%甲醇CH2Cl2溶液分离产物。共回收到96mg纯净的MC-MeVal-Val-Dil-Dap-Phe-OtBu(12)(60%产率)。ES-MSm/z981.26[M+H]+;1003.47[M+Na]+;979.65[M-H]-。在室温下将MC-MeVal-Val-Dil-Dap-Phe-OtBu(化合物12,74mg,0.0754mmol)悬浮于CH2Cl2(2.0mL)和TFA(1mL)中。2.5小时后,HPLC分析表明完全消耗了原材料。减压蒸发掉挥发性有机物,通过制备型RP-HPLC用PhenomenexC12SynergiMax-RP柱(250×21.20mm)分离产物。洗脱:线性梯度10%-90%MeCN/0.05%TFA(水溶液)洗脱30分钟,再用90%MeCN/0.05%TFA(水溶液)等度洗脱20分钟。ES-MSm/z925.33[M+H]+;947.30[M+Na]+;923.45[M-H]-。实施例23a-通过二甲氧基苄基酯合成MC-MMAF(11)合成2:制备Fmoc-L-苯丙氨酸-2,4-二甲氧基苄基酯(Fmoc-Phe-ODMB)在3颈5-L圆底烧瓶中装入Fmoc-L-苯丙氨酸(200g,516mmolBachem)、2,4-二甲氧基苄基醇(95.4g,567mmol,Aldrich)和CH2Cl2(2.0L)。在N2下用20分钟将N,N-二甲基甲酰胺叔丁基缩醛(155mL,586mmol,Fluka)加入得到的悬液中,产生清澈的溶液。室温下搅拌该反应物过夜,然后,TLC分析(0.42,庚烷/EtOAc=2:1)表明反应完成。减压浓缩反应混合物,产生淡黄色油状物,再溶解于CH2Cl2(200mL)中,通过硅胶短塞(25cm×25cm,CH2Cl2)纯化,产生无色泡沫(250g)。将MeCN(1L)加入得到的泡沫中能完全溶解该物质。然后浓缩干燥,再溶解于MeCN(1L),搅拌得到的悬液1小时,过滤,用MeCN(2×200mL)洗涤滤饼,产生Fmoc-L-苯丙氨酸-2,4-二甲氧基苄基酯,为白色固体(113.58g,41%,95.5%AUC,HPLC分析)。数据:HPLC。制备L-苯丙氨酸-2,4-二甲氧基苄基酯(Phe-ODMB)在500-mL圆底烧瓶中装入Fmoc-L-苯丙氨酸-2,4-二甲氧基苄基酯(26.00g,48.3mmol)、CH2Cl2(150mL)和二乙胺(75mL,Acros)。室温搅拌混合物,用HPLC监测反应完成。4小时后,浓缩混合物(水浴温度<30℃)。将残留物重悬于CH2Cl2(200mL)并浓缩。重复该步骤一次。将MeOH(20mL)加入残留物,这引起凝胶形成。用CH2Cl2(200mL)稀释该残留物,浓缩,真空下过夜产生浑浊油状物。将残留物悬浮于CH2Cl2(200mL)中,然后加入甲苯(120mL)。浓缩该混合物,真空下过夜产生残留物。数据:HPLC,1HNMR。制备Fmoc-Dolaproine(Fmoc-Dap)将Boc-Dolaproine(58.8g,0.205mol)悬浮于4NHCl的1,4-二噁烷(256mL,1.02mol,Aldrich)溶液。搅拌1.5小时后,TLC分析表明反应完成(10%MeOH/CH2Cl2),浓缩反应物至接近干燥。再加入1,4-二噁烷(50mL),浓缩该混合物至干燥,真空干燥过夜。将得到的白色固体溶于H2O(400mL)中,转移到装有机械搅拌器和温度探头的3-L三颈圆底烧瓶中。用1分钟加入N,N-二异丙基乙胺(214.3mL,1.23mol,Acros),导致放热,温度从20.5升至28.2℃(内部)。冰浴冷却该混合物,加入1,4-二噁烷(400mL)。用15分钟从加料漏斗加入Fmoc-OSu(89.90g,0.267mol,AdvancedChemTech)的1,4-二噁烷(400mL)溶液,将反应温度维持在9℃以下。让混合物回复到室温,搅拌19小时,然后用旋转蒸发法将该混合物浓缩成水性浆液(390g)。用H2O(750mL)和Et2O(750mL)稀释悬液,形成许多白色沉淀。分层,固体保持在有机层中。用浓盐酸(30mL)酸化水层,并用EtOAc(3×500mL)萃取。用MgSO4干燥合并的萃取物,过滤并浓缩产生59.25g黄色油状物A。用NaHCO3饱和溶液(200mL)萃取一次Et2O萃取物,固体保持在水层中。用浓盐酸(50mL)酸化水性悬液,用Et2O(50mL)萃取,固体保持在有机层中。过滤有机层,浓缩产生32.33g黄色油状物B。混合这两种油状物(A和B),用硅胶快速层析纯化,用CH2Cl2(3.5L)洗脱,然后用3%MeOH/CH2Cl2(9L)洗脱,产生68.23g白色泡沫状Fmoc-dolaproine(81%,HPLC测定纯度为97.5%(AUC))。制备Fmoc-Dap-Phe-ODMB将粗Phe-ODMB(48.3mmol)悬浮于无水DMF(105mL,Acros)中5分钟,加入Fmoc-Dap(19.80g,48.3mmol)。冰浴冷却混合物,加入TBTU(17.08g,53.20mmol,MatrixInnovations)。用3分钟通过注射器加入N,N-二异丙基乙胺(25.3mL,145.0mmol,Acros)。1小时后,移开冰浴,使混合物温暖30分钟。将该混合物倾入水(1L)中,用乙酸乙酯(300mL)萃取。分层后,再用乙酸乙酯(2×150mL)萃取水层。用盐水(150mL)洗涤合并的有机层,干燥(MgSO4)并过滤(滤纸),以去除不溶物(无机物和一些二苯并富烯)。浓缩后,残留物(41g)吸附在二氧化硅(41g)上,用层析(22cm×8cm柱;65%庚烷/EtOAc(2.5L);33%庚烷/EtOAc(3.8L)纯化,产生29.4g白色泡沫状产物(86%,HPLC测定纯度为92%)。数据:HPLC,1HNMR,TLC(1:1EtOAc/庚烷Rf=0.33,香兰素染色为红色)。制备Dap-Phe-ODMB在1-L圆底烧瓶中装入Fmoc-Dap-Phe-ODMB(27.66g)、CH2Cl2(122mL)和二乙胺(61mL,Acros)。室温搅拌该溶液,用HPLC监测反应完成。7小时后,浓缩混合物(水浴温度<30℃)。将残留物悬浮于CH2Cl2(300mL)中并浓缩。重复该步骤两次。将MeOH(20mL)和CH2Cl2(300mL)加入残留物,浓缩该溶液。将残留物悬浮于CH2Cl2(100mL)和甲苯(400mL)中,浓缩,真空下过夜产生的残留物,得到乳膏样残留物。数据:HPLC,1HNMR,MS。制备Fmoc-MeVal-Val-Dil-Dap-Phe-ODMB将粗制Dap-Phe-ODMB(39.1mmol)悬浮于无水DMF(135mL,Acros)中5分钟,加入Fmoc-MeVal-Val-Dil-OH(24.94g,39.1mmol,制备参见实施例2)。冰浴冷却混合物,加入TBTU(13.81g,43.0mmol,MatrixInnovations)。用2分钟通过注射器加入N,N-二异丙基乙胺(20.5mL,117.3mmol,Acros)s。1小时后,移开冰浴,使混合物温暖30分钟。将该混合物倾入水(1.5L)中,用乙酸乙酯(480mL)稀释。静置15分钟后,分层,用乙酸乙酯(300mL)萃取水层。用盐水(200mL)洗涤混合的有机层,干燥(MgSO4)并过滤(滤纸),以去除不溶物(无机物和一些二苯并富烯)。浓缩后,从烧瓶上刮下残留物(49g),使其吸附在二氧化硅(49g)上,用层析(直径15cm×10cm柱;2:1EtOAc/庚烷(3L),EtOAc(5L);250mL馏分)纯化,产生31.84g白色泡沫状Fmoc-MeVal-Val-Dil-Dap-Phe-ODMB(73%,HPLC测定纯度为93%(AUC))。数据:HPLC,TLC(2:1EtOAc/庚烷,Rf=0.21,香兰素染色为红色)。制备MeVal-Val-Dil-Dap-Phe-ODMB在1-L圆底烧瓶中装入Fmoc-MeVal-Val-Dil-Dap-Phe-ODMB(28.50g)、CH2Cl2(80mL)和二乙胺(40mL)。室温搅拌混合物过夜,然后减压浓缩。将残留物吸附在二氧化硅(30g)上,用快速层析(直径15cm×8cm柱;2%MeOH/DCM(2L),3%MeOH/DCM(1L),6%MeOH/DCM(4L);250mL馏分)纯化,产生15.88g白色泡沫状MeVal-Val-Dil-Dap-Phe-ODMB(69%,HPLC测定纯度为96%(AUC))。数据:HPLC,TLC(6%MeOH/DCM,Rf=0.24,香兰素染色为红色)。制备MC-MeVal-Val-Dil-Dap-Phe-ODMB室温在50-mL圆底烧瓶中装入MeVal-Val-Dil-Dap-Phe-ODMB(750mg,0.85mmol)、无水DMF(4mL)、马来酰亚氨基己酸(180mg,0.85mmol)和TBTU(300mg,0.93mmol,MatrixInnovations)。通过注射器加入N,N-二异丙基乙胺(450μL,2.57mmol)。1.5小时后,将该混合物倾入水(50mL)中,用乙酸乙酯(30mL)稀释。加入NaCl以改善分层。分层后,用乙酸乙酯(25mL)萃取水层。干燥(MgSO4)、过滤和浓缩混合的有机层。用快速层析[100mL二氧化硅;25%庚烷/EtOAc(100mL),10%庚烷/EtOAc(200mL),EtOAc(1.5L)]纯化得到的油状物(1g),产生白色泡沫状MC-MeVal-Val-Dil-Dap-Phe-ODMB(13)(521mg,57%,HPLC测定纯度为94%(AUC))。数据:1HNMR,HPLC。制备MC-MeVal-Val-Dil-Dap-Phe-OH(MC-MMAF)(11)在50-mL圆底烧瓶中装入溶解于2.5%TFA/CH2Cl2(20mL)中的MC-MeVal-Val-Dil-Dap-Phe-ODMB(化合物13,428mg,0.39mmol)。该溶液在2分钟后变成粉-紫色。用HPLC和TLC(6%MeOH/DCM,KMnO4染色)监测反应完成。40分钟后,加入三滴水,浓缩混浊的粉-紫色混合物,产生521mg粉红色残留物。用层析(15%IPA/DCM)纯化产生270mgMC-MMAF(73%,HPLC测定纯度为92%),为白色固体。实施例23b-合成mc-MMAF的类似物将MeVal-Val-Dil-Dap-Phe-OtBu(化合物1,35mg,0.044mmol)悬浮于DMF(0.250mL)中。加入4-(2,5-二氧-2,5-二氢-吡咯-1-基)-苯甲酸(11mg,0.049mmol)和HATU(17mg,0.044mmol),然后加入DIEA(0.031mL,0.17mmol)。搅拌此反应混合物2.0小时。HPLC分析表明完全消耗了起始化合物1。通过制备型RP-HPLC,用PhenomenexC12SynergiMax-RP柱(250×21.20mm)分离产物。洗脱:线性梯度10%-80%MeCN/0.05%TFA(水溶液)洗脱8分钟,然后再用80%MeCN/0.05%TFA(水溶液)等度洗脱12分钟。总共分离得到20mg纯净产物(14)(0.02mmol,产率46%)。ES-MSm/z987.85[M+H]+;1019.41[M+Na]+;985.54[M-H]-。将MB-MeVal-Val-Dil-Dap-Phe-OtBu(化合物14,38mg,0.0385mmol)悬浮于CH2Cl2(1mL)和TFA(1mL)中。搅拌混合物2.0小时,然后减压蒸发掉挥发性有机物。通过制备型RP-HPLC,用PhenomenexC12SynergiMax-RP柱(250×21.20mm)纯化产物。洗脱:线性梯度10%-80%MeCN/0.05%TFA(水溶液)洗脱8分钟,然后再用80%MeCN/0.05%TFA(水溶液)等度洗脱12分钟。总共分离得到14.4mgMB-MMAF产物(0.015mmol,产率40%)。ES-MSm/z930.96[M+H]+952.98[M+Na]+;929.37[M-H]-。实施例23c-制备MC-MeVal-Cit-PAB-MMAF(16)将DIEA(4.48mL,25.71mmol)加入Fmoc-MeVal-OH(3.03g,8.57mmol)和N,N’-二琥珀酰亚胺基碳酸酯(3.29g,12.86mmol)的CH2Cl2(80mL)室温悬浮液中。搅拌此反应混合物3.0小时,然后倾入分液漏斗,用0.1MHCl(水溶液)萃取有机混合物。减压浓缩粗制有机残留物,通过硅胶快速柱层析用20-100%乙酸乙酯/己烷线性梯度分离产物。总共回收2.18g纯净的Fmoc-MeVal-OSu(4.80mmol,产率56%)。将L-瓜氨酸(0.85g,4.84mmol)和NaHCO3(0.41g,4.84mmol)的H2O(13mL)溶液加入Fmoc-MeVal-OSu(2.18g,4.84mmol)的DME(13mL)和THF(6.5mL)的室温悬浮液中。室温搅拌该悬浮液16小时,然后将其萃取到叔BuOH/CHCl3/H2O中,用1MHCl酸化至pH=2-3。分离、干燥和减压浓缩有机相。用二乙醚研磨残留物,产生2.01gFmoc-MeVal-Cit-COOH,无需进一步纯化即可使用。将粗制Fmoc-MeVal-Cit-COOH悬浮于2:1CH2Cl2/MeOH(100mL)中,加入对氨基苄基醇(0.97g,7.9mmol)和EEDQ(1.95g,7.9mmol)。搅拌此悬浮液125小时,然后减压去除挥发性有机物,通过硅胶快速柱层析用10%MeOH/CH2Cl2纯化残留物。回收到纯净的Fmoc-MeVal-Cit-PAB-OH(0.55g,0.896mmol,产率18.5%)。ES-MSm/z616.48[M+H]+。将STRATOSPHEREStm(哌嗪-树脂-结合)(>5mmol/g,150mg)加入Fmoc-MeVal-Cit-PAB-OH(0.55g,0.896mmol)的CH2Cl2(40mL)悬液中。室温搅拌16小时后,通过硅藻土(用MeOH预洗涤)过滤该混合物,减压浓缩。用二乙醚和己烷研磨残留物。产生固体物质MeVal-Cit-PAB-OH,将它悬浮于CH2Cl2(20mL)中,加入MC-OSu(0.28g,0.896mmol)、DIEA(0.17mL,0.99mmol)和DMF(15mL)。搅拌此悬浮液16小时,但反应混合物的HPLC分析显示反应不完全,因此减压浓缩悬液得到6mL体积,然后加入10%NaHCO3(水溶液),再搅拌该悬液16小时。减压去除溶剂,通过硅胶快速柱层析用0-10%MeOH/CH2Cl2梯度纯化残留物,产生42mg(0.072mmol,产率8%)MC-MeVal-Cit-PAB-OH。将DIEA(1.06mL,6.06mmol)加入MC-MeVal-Cit-PAB-OH(2.37g,4.04mmol)和双(硝基苯基)碳酸酯(2.59g,8.52mmol)的CH2Cl2(10mL)悬浮溶液中。搅拌此悬液5.5小时,减压浓缩,用二乙醚研磨纯化。将MC-MeVal-Cit-PAB-OCO-pNP(147mg,0.196mmol)悬浮于1:5吡啶/DMF溶液(3mL)中,加入HOBt(5mg,0.039mmol)、DIEA(0.17mL,0.978mmol)和MMAF(化合物2,150mg,0.205mmol)。室温搅拌此反应混合物16小时,然后通过制备型RP-HPLC(x3),用PhenomenexC12SynergiMax-RP柱(250×21.20mm)纯化。洗脱:线性梯度10%-90%MeCN/0.05%TFA(水溶液)洗脱30分钟,然后再用90%MeCN/0.05%TFA(水溶液)等度洗脱20分钟。获得的MC-MeVal-Cit-PAB-MMAF(16)是淡黄色固体(24.5mg,0.0182,产率0.45%)。ES-MSm/z1344.95[M+H]+;1366.94[M+Na]+。实施例23d-制备环庚基-Val-Cit-PAB-MMAF(17)的琥珀酰亚胺酯将化合物1(300mg,0.38mmol)、Fmoc-Val-Cit-PAB-pNP(436mg,0.57mmol,1.5当量)悬浮于5mL无水吡啶中。加入HOBt(10mg,0.076mmol,0.2当量),然后加入DIEA(199μl,1.14mmol,3当量)。超声处理反应混合物10分钟,然后室温搅拌过夜。减压去除吡啶,将残留物重悬于CH2Cl2中。通过硅胶快速层析以分步梯度的0-10%MeOHCH2Cl2溶液分离混合物。拉出含有产物的馏分,浓缩,真空下干燥过夜,产生317mg(产率59%)Fmoc-Val-Cit-PAB-MMAF-OtBu。ES-MSm/z1415.8[M+H]+。在20%TFA/CH2Cl2(10mL)中搅拌Fmoc-Val-Cit-PAB-MMAF-OtBu(100mg)2小时。用CH2Cl2(50mL)稀释混合物。用水(2×30mL)和盐水(1×30mL)依次洗涤有机层。浓缩有机相,加到含10%MeOH/CH2Cl2的硅胶垫上。用30%MeOH/CH2Cl2洗脱得到产物。真空下干燥过夜后,获得Fmoc-Val-Cit-PAB-MMAF,为白色固体,38mg,产率40%。ES-MSm/z1357.7[M-H]-。将67mgFmoc-Val-Cit-PAB-MMAF悬浮于CH2Cl2(2mL)二乙胺(2mL)和DMF(2mL)。室温搅拌混合物2小时。减压去除溶剂。将残留物与吡啶(2mL)共蒸发,然后与甲苯(2×5mL)共蒸发,真空干燥。获得淡褐色油状Val-Cit-PAB-MMAF,无需进一步纯化即可使用。将用67mgFmoc-Val-Cit-PAB-MMAF制备的所有Val-Cit-PAB-MMAF悬浮于吡啶(2mL)中,加入二琥珀酰亚胺基辛二酸酯(74mg,0.2mmol,4当量)的吡啶(1mL)溶液中。室温搅拌反应混合物。3小时后,加入醚(20mL)。收集沉淀,用额外量的醚洗涤。将淡红色固体悬浮于30%MeOH/CH2Cl2中,通过硅胶垫过滤以30%MeOH/CH2Cl2作为洗脱液。获得的化合物17为白色固体,20mg(产率29%)。ES-MSm/z1388.5[M-H]-实施例24-mcMMAF抗体-药物偶联物的体内效果cAC10-mcMMAF在Karpas-299ALCL异种移植物中的效果:为评价平均每个抗体4个药物部分(cAC10-mcF4)的cAC10-mcMMAF的体内效果,将Karpas-299人ALCL细胞植入免疫缺陷型C.B-17SCID小鼠(每只小鼠5x106细胞)皮下。用式(0.5×L×W2)(其中L和W是两个双向测量值的较长值和较短值)测量肿瘤体积。当研究动物中平均肿瘤体积达到约100mm3(范围48-162)时,将小鼠分为3组(每组5只小鼠),不治疗,或通过尾静脉静脉内单次注射给予1或2mg/kg的cAC10-mcF4(图1)。在开始治疗后7天内,未治疗小鼠中肿瘤快速生长到平均体积>1,000mm3。相反,所有cAC10-mcF4治疗的肿瘤显示出快速消退,1mg/kg组中3/5,2mg/kg组中5/5获得完全肿瘤消退反应。虽然2mg/kg组中完全反应鼠之一在约4周后肿瘤复发,但是此组中其余4/5反应鼠以及1mg/kg组中3只完全反应鼠在治疗后10周都未检测到肿瘤。cBR96-mcMMAF在L2987NSCLC异种移植物中的效果:cBR96是识别LeY抗原的嵌合抗体。为评价每个抗体4个药物(cBR96-mcF4)的cBR96-mcMMAF的体内效果,将L2987非小细胞肺癌(NSCLC)肿瘤片段植入无胸腺裸小鼠中。当肿瘤平均生长到约100mm3时,将小鼠分为3组:未治疗组和2个治疗组。对于治疗组而言,如图3a所示,将cBR96-mcF4给予小鼠,剂量为每4天3或10mg/kg/注射,共注射4次(q4dx4)。如图3b所示,将cBR96-mcF4或非结合对照偶联物,cAC10-mcF4给予小鼠,剂量为每4天10mg/kg/注射,共注射4次(q4dx4)。如图3a和3b所示,与对照相比,BR96-mcF4产生显著的肿瘤生长延迟。图2显示了cAC10-mcMMAF对皮下(植入)L540CY的体内单次剂量的药效试验。此研究中,未治疗组中有4只小鼠,各治疗组中有10只。实施例25–MC-MMAF抗体-药物偶联物的体外效果cAC10-抗体-药物偶联物对CD30+细胞系的活性。图4a和4b显示代表性试验中的剂量反应曲线,其中用连续稀释的cAC10-mcMMAF(图4a)或cAC10–vcMMAF(图4b)培育Karpas299(间变性大细胞淋巴瘤)和L428(霍奇金淋巴瘤)培养物96小时。用50μM刃天青[7-羟基-3H-吩噁嗪-3-酮10-氧化物]标记该培养物4小时,测量荧光。在GraphPadPrism4.00版中用4-参数剂量反应曲线拟合法还原所得数据。IC50值定义为与未处理对照培养物相比生长降低50%时的浓度。各浓度测定四次。cBR96-抗体-药物偶联物对Ley+细胞系的活性。图5a和5b显示代表性试验中的剂量反应曲线,其中用连续稀释的cBR96-mcMMAF(图5a)或–vcMMAF(图5b)培育H3396(乳腺癌)和L2987(非小细胞肺癌)培养物96小时。用50μM刃天青标记该培养物4小时,测定荧光。在GraphPadPrism4.00版中用4-参数剂量反应曲线拟合法还原所得数据。IC50值定义为与未处理对照培养物相比生长降低50%时的浓度。各浓度测定四次。c1F6-抗体-药物偶联物对CD70+肾细胞癌细胞系的活性。图6a和6b显示代表性试验中的剂量反应曲线,其中用连续稀释的c1F6-mcMMAF(图6a)或–vcMMAF(图6b)培育Caki-1和786-O细胞培养物96小时。用50μM刃天青标记该培养物4小时,测定荧光。在GraphPadPrism4.00版中用4-参数剂量反应曲线拟合法还原所得数据。IC50值定义为与未处理对照培养物相比生长降低50%时的浓度。各浓度测定四次。实施例26-纯化曲妥珠单抗将一小瓶440mg(huMAb4D5-8,rhuMAbHER2,美国专利号5821337)抗体)溶解于50mLMES缓冲液(25mMMES,50mMNaCl,pH5.6)中,加到以相同缓冲液中平衡的阳离子交换柱(SepharoseS,15cm×1.7cm)上。然后用相同缓冲液(柱体积的5倍)洗涤该柱。将缓冲液的NaCl浓度提高到200mM洗脱曲妥珠单抗。收集含有该抗体的馏分,稀释到10mg/mL,用含有50mm磷酸钾,50mMNaCl,2mMEDTA,pH6.5的缓冲液透析。实施例27-通过偶联曲妥珠单抗和MC-MMAE制备曲妥珠单抗-MC-MMAE用过量100mM二硫苏糖醇(DTT)处理溶解于500mM硼酸钠和500mM氯化钠,pH8.0中的曲妥珠单抗。37℃孵育约30分钟后,在SephadexG25树脂上洗脱交换缓冲液,用含有1mMDTPA的PBS洗脱。测定该溶液280nm吸光度确定的还原抗体浓度和通过与DTNB(Aldrich,Milwaukee,WI)反应测定412nm吸光度确定巯基浓度测定巯基/抗体值。将还原抗体溶于冰冷却的PBS。溶于DMSO的药物接头试剂、马来酰亚氨基己酰基-单甲基耳抑素E(MMAE)即MC-MMAE,以乙腈和水稀释为已知浓度,加入预冷的还原性抗体曲妥珠单抗的PBS溶液。约1小时后,加入过量马来酰亚胺终止反应,并给未反应的抗体巯基加帽。离心超滤浓缩反应混合物,纯化曲妥珠单抗-MC-MMAE,并通过G25树脂的PBS溶液洗脱脱盐,在无菌条件下通过0.2μm滤器过滤,冷冻储存。实施例28-通过偶联曲妥珠单抗和MC-MMAF制备曲妥珠单抗-MC-MMAF按照实施例27的步骤,通过偶联曲妥珠单抗和MC-MMAF制备曲妥珠单抗-MC-MMAF。实施例29-通过偶联曲妥珠单抗和MC-val-cit-PAB-MMAE制备曲妥珠单抗-MC-val-cit-PAB-MMAE按照实施例27的步骤,通过偶联曲妥珠单抗和MC-val-cit-PAB-MMAE制备曲妥珠单抗-MC-val-cit-PAB-MMAE。实施例30-通过偶联曲妥珠单抗和MC-val-cit-PAB-MMAF9制备曲妥珠单抗-MC-val-cit-PAB-MMAF9按照实施例27的步骤,通过偶联曲妥珠单抗和MC-val-cit-PAB-MMAF9制备曲妥珠单抗-MC-val-cit-PAB-MMAF9。实施例31–大鼠毒性在成年Sprague-Dawley大鼠(每只75-125克,CharlesRiver实验室(Hollister,CA)中评价游离药物和ADC的急性毒性反应曲线。第一天注射动物,获得基线、第三和第五天获得完整的化学和血液学曲线,第五天进行完整的尸检。对所有动物进行肝酶测定,对每组随机选取三只动物的下述组织进行常规组织学检验:胸骨、肝脏、肾脏、胸腺、脾脏、大小肠。各试验组结果如下:对于曲妥珠单抗-MC-val-cit-MMAF、曲妥珠单抗-MC(Me)-val-cit-PAB-MMAF、曲妥珠单抗-MC-MMAF和曲妥珠单抗-MC-val-cit-PAB-MMAF来说,利用MMAF分子量731.5和贺赛汀分子量145167来计算μgMMAF/m2。体表面积计算如下:[{(体重(g)的0.667次方)×11.8}/10000](《工业和审稿人指南》(GuidanceforIndustryandReviewers),2002)。以10mL/kg剂量于实验第一天通过单次尾静脉内推注给予制剂溶液。第一天和其后每日注射前测量动物体重。用含有EDTA的试管收集全血作血液学分析。将全血收集在血清分离试管中作临床化学分析。在研究第-4、3和5天注射前收集血样。尸检前将全血收集到含有肝素钠的试管中,血浆冻存于-70℃,用于后续可能分析。收集以下组织并置于中性福尔马林缓冲液中作尸检:肝脏、肾脏、心脏、胸腺、脾脏、大脑、胸骨和包括胃、大小肠的胃肠道切片。检查胸骨、小肠、大肠、肝、胸腺、脾脏和肾脏。将各时间点肝相关血清酶水平与雌性Sprague-Dawley大鼠的正常范围(第5和第95百分点)作比较。将各时间点白细胞和血小板计数与雌性Sprague-Dawley大鼠的正常范围(第5和第95百分点)作比较。正常雌性Sprague-Dawley大鼠中的高剂量研究:提交11只动物的组织进行常规组织学分析。这些动物为用曲妥珠单抗-MC-MMAF免疫偶联物进行急性剂量范围毒性研究的一部分。给药后跟踪动物12天。实施例32-食蟹猴毒性/安全性将三组各四只(2雄2雌)幼年(naive)食蟹猴(Macacafascicularis,Cynomolgusmonkey)用于曲妥珠单抗-MC-vc-PAB-MMAE和曲妥珠单抗-MC-vc-PAB-MMAF研究。试验第1和第22天进行静脉内给药。H=曲妥珠单抗剂量表示为动物体表面积以与其它物种相关,即μg/m2剂量与动物种类无关,因此可进行种间比较。ADC制剂含有PBS、5.4mM磷酸钠、4.2mM磷酸钾、140mM氯化钠,pH6.5。给药前,以及每次给药后5分钟、6小时、10小时、和1、3、5、7、14、21天收集血液进行血液学分析。用光散射法测定红细胞(RBC)和血小板(PLT)数。用过氧化物酶/嗜碱法测定白细胞数。阳离子染色加光散射法测定网织红细胞数。在Advia120装置上进行细胞计数。用UV/NADH以U/L测定ALT(丙氨酸转氨酶)和AST(天冬氨酸转氨酶);在OlympusAU400装置上,利用总抗体ELISA-ECD/GxhuFc-HRP偶联物抗体ELISA-MMAE/MMAF//ECD-Bio/SA-HRP试验进行IFCC方法测定。实施例33–人源化抗-ErbB2单克隆抗体4D5的产生和特征鉴定根据Fendly等(1990)CancerResearch50:1550-1558所述产生特异性结合ErbB2胞外结构域的鼠单克隆抗体4D5。简要说,用含有25mMEDTA磷酸盐缓冲液(PBS)收集根据Hudziak等Proc.Natl.Acad.Sci.(USA)84:7158-7163(1987)所述产生的NIH3T3/HER2-3400细胞(表达大约1×105ErbB2分子/细胞),用于免疫BALB/c小鼠。在第0、2、5、7周将含107细胞的0.5mlPBS注射入小鼠腹腔。在第9和13周,给产生能免疫沉淀32P-标记的ErbB2抗血清的小鼠腹腔注射用麦芽凝集素-琼脂糖(WGA)纯化的ErbB2膜提取物。然后,静脉注射0.1mlErbB2制备物,取脾细胞与小鼠骨髓瘤细胞系X63-Ag8.653融合。用ELISA和放射性免疫沉淀筛选杂交瘤上清ErbB2-结合抗体。表位作图和特征鉴定用竞争结合分析(Fendly等CancerResearch50:1550-1558(1990))测定单克隆抗体4D5结合的ErbB2表位。用PANDEXTM筛选仪定量荧光以测定完整细胞上的直接荧光,进行交叉阻断研究。用已确立的方法(Wofsy等SelectedMethodsinCellularImmunology,第287页,Mishel和Schiigi(编)SanFrancisco:W.J.FreemanCo.(1980))将异硫氰酸荧光素酯(FITC)偶联于单克隆抗体。胰酶处理铺满的NIH3T3/HER2-3400单层细胞,洗涤一次,以1.75×106细胞/ml重悬于含0.5%牛血清白蛋白(BSA)和0.1%NaN3的冷PBS中。加入乳胶颗粒(IDC,Portland,OR)至终浓度为1%,以减少PANDEXTM培养板薄膜的堵塞。将20μl细胞悬液和20μl纯化单克隆抗体(100μg/ml-0.1μg/ml)加入PANDEXTM培养板孔中冰上孵育30分钟。将20μl预定稀释度的FITC-标记单克隆抗体加入各孔,孵育30分钟,洗涤,用PANDEXTM定量荧光。与不相关单克隆抗体对照相比,如果其它抗体各阻断了结合达50%或更大,则认为这些单克隆抗体识别共有表位。本实验中,单克隆抗体4D5指定表位I(529-625氨基酸残基,包含在ErbB2胞外结构域中。用乳腺癌肿瘤细胞系SK-BR-3(参见Hudziak等(1989)Molec.Cel.Biol.9(3):1165-1172)评价了单克隆抗体4D5的生长抑制特征。简要说,用0.25%(vol/vol)胰酶处理使SK-BR-3细胞脱附,以每毫升4×105细胞的密度悬浮于完全培养基中。将100μl等分(4×104细胞)接种于96-孔微量稀释培养板,细胞贴壁后只加入100μl培养基或含单克隆抗体(终浓度5μg/ml)的培养基。72小时后,用PBS(pH7.5)洗板两次,结晶紫(0.5%的甲醇溶液)染色,如Sugarman等(1985)Science230:943-945所述分析相对细胞增殖。单克隆抗体4D5抑制了约56%SK-BR-3细胞的增殖。也评价单克隆抗体4D5抑制MCF7细胞全细胞裂解物中Mr180,000范围蛋白在HRG-刺激下酪氨酸磷酸化能力(Lewis等(1996)CancerResearch56:1457-1465)。报道称MCF7细胞表达所有已知的ErbB2受体,但水平较低。由于ErbB2、ErbB3和ErbB4分子大小基本相同,不可能通过Western印迹分析评价全细胞裂解物来辨别哪种蛋白酪氨酸磷酸化。然而,这些细胞对于HRG酪氨酸磷酸化试验很理想,因为在所用实验条件下没有外源加入的HRG时,这些细胞中Mr180,000范围的酪氨酸磷酸化蛋白水平低至不可检测。在24孔板中接种MCF7细胞,各孔加入ErbB2单克隆抗体,室温孵育30分钟;然后每孔加入rHRGβ1177-244使终浓度为0.2nM,继续孵育8分钟。小心吸干每孔中的培养基加入100μlSDS样品缓冲液(5%SDS,25mMDTT和25mMTris-HCl,pH6.8)终止反应。在4-12%梯度凝胶(Novex)上电泳各样品(25μl),然后电转移至聚偏二氟乙烯膜上。用抗磷酸化酪氨酸抗体(4G10,购自UBI,以1μg/ml使用)使免疫印迹显色,用反射光密度计定量处的主要反应条带的强度,如前所述(Holmes等(1992)Science256:1205-1210;Sliwkowski等J.Bio.Chem.269:14661-14665(1994))。单克隆抗体4D5显著抑制Mr180,000处的HRG-诱导的酪氨酸磷酸化信号的产生。但没有HRG时,不能刺激Mr180,000范围蛋白的酪氨酸磷酸化。另外,该抗体与EGFR(Fendly等CancerResearch50:1550-1558(1990))、ErbB3或ErbB4无交叉反应。单克隆抗体4D5能够阻断刺激的酪氨酸磷酸化。评价在存在或没有外源性rHRGβ1时单克隆抗体4D5对MDA-MB-175和SK-BR-3细胞的生长抑制作用(Schaefer等Oncogene15:1385-1394(1997))。MDA-MB-175细胞的ErbB2水平比正常乳腺上皮细胞高4-6倍并且在MDA-MB-175细胞中ErbB2-ErbB4受体发生组成型酪氨酸磷酸化。无论外源性HRG存在与否,单克隆抗体4D5能够抑制MDA-MB-175细胞增殖。4D5对细胞增殖的抑制取决于ErbB2表达水平(Lewis等CancerImmunol.Immunother.37:255-263(1993))。在SK-BR-3细胞中检测到的最大抑制率为66%。然而,外源性HRG可克服这种作用。利用"基因转化诱变"方法人源化鼠单克隆抗体4D5,如美国专利号5821337所述,特别将其全部内容纳入作为参考。用于以下实验的人源化单克隆抗体4D5称为huMAb4D5-8。此抗体是IgG1同种型。引用的参考文献本发明不限于实施例中所公开的具体实施方式范围,它们旨在说明本发明的少数方面,功能上等价的任何实施方式都在本发明范围内。实际上,除了本文所示和所述的以外,本领域技术人员将明白本发明的各种修改都属于本发明范围。将本文引用的所有参考文献内容纳入本文作为参考用于所有目的,就好像各出版物或专利或专利申请被特别地和单独地将其内容纳入本文作为参考用于所有目的那样。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1