抗FOLR1免疫偶联物给药方案的制作方法
本发明的领域总体上涉及施用用于治疗疾病如癌症的抗FOLR1免疫偶联物的方法。所述方法提供使不想要的副作用最小化的给药方案。
发明背景
癌症是发达国家中死亡的主导原因之一,仅在美国每年就有超过一百万人被诊断患有癌症并且有500,000例死亡。总的来说,估计超过三分之一的人会在他们的一生中出现某种形式的癌症。癌症有200多种不同类型,其中四种——乳腺癌、肺癌、结肠直肠癌和前列腺癌——占所有新发病例的一半以上(Jemal等,2003,Cancer J.Clin.53:5-26)。
叶酸受体1(FOLR1)(也被称为叶酸受体-α或叶酸结合蛋白)是在细胞质膜上表达的N-糖基化蛋白。FOLR1具有对叶酸和若干还原的叶酸衍生物的高亲和力。FOLR1介导生理叶酸(5-甲基四氢叶酸)向细胞内部的递送。
FOLR1在绝大多数的卵巢癌以及在许多子宫癌、子宫内膜癌、胰腺癌、肾癌、肺癌和乳腺癌中过度表达,而在正常组织上的FOLR1表达仅限于肾近端小管、肺的肺泡肺细胞、膀胱、睾丸、脉络丛以及甲状腺中的上皮细胞顶端膜上(Weitman SD等,Cancer Res 52:3396-3401(1992);Antony AC,Annu Rev Nutr 16:501-521(1996);Kalli KR等,Gynecol Oncol 108:619-626(2008))。FOLR1的这种表达模式使其成为FOLR1引导的癌症治疗的理想靶标。
因为卵巢癌在晚期之前通常是无症状的,所以它经常是在晚期被诊断出来,并且用目前可用的程序(通常是手术减积之后的化学治疗药物)治疗时具有不良预后(von Gruenigen V等,Cancer 112:2221-2227(2008);Ayhan A等,Am J Obstet Gynecol 196:81 e81-86(2007);Harry VN等,Obstet Gynecol Surv 64:548-560(2009))。因此,对用于卵巢癌的更有效的治疗剂存在明显的尚未满足的医疗需求。
抗体正成为用于治疗这类癌症的有希望的方法。此外,包含偶联至另一种化合物例如细胞毒素的抗体的免疫偶联物也正作为潜在治疗剂而被研究。具体地说,包含美登木素(maytansinoid)(其是植物来源的抗真菌剂和抗肿瘤剂)的免疫偶联物已显示具有一些有益活性。从卵叶美登木(Maytenus ovatus)和布昌南美登木(Maytenus buchananii)的醇提取物分离三种安莎(ansa)大环内酯由S.M.Kupchan等首次报道且连同证明在微克/kg剂量范围下其在鼠模型中的抗白血病作用一起是美国专利号3,896,111的主题。然而,美登木素具有不可接受的毒性,引起中枢和周围神经病变以及副作用:具体为恶心、呕吐、腹泻、肝功能测试的升高以及不太常见的虚弱和嗜睡。这种总体毒性通过将美登木素偶联至抗体来降低至一定程度,因为抗体偶联物具有在抗原阴性细胞上相较于抗原阳性细胞低若干数量级的毒性。然而,仍然需要鉴定抗FOLR1免疫偶联物的在人中治疗上有效但避免副作用的具体剂量方案。
发明概述
本文提供以治疗上有效的给药方案施用抗FOLR1免疫偶联物的方法,所述给药方案使不想要的副作用最小化。如以下更详细地描述,将相同剂量的抗FOLR1免疫偶联物施用至不同患者引起所述免疫偶联物的药物代谢动力学(例如,Cmax和AUC)的显著变化。本发明人已经发现并且本文提供的实验证明眼毒性与高Cmax和高初始AUC值相关。然而,高Cmax和初始AUC值对于功效来说是不需要的。因此,本文描述用于治疗患有癌症的患者的方法,所述方法包括向所述患者施用有效剂量的结合FOLR1的免疫偶联物,其中所述免疫偶联物以约3.0mg/kg至约7.0mg/kg的剂量施用,其中千克体重被调整为理想体重(IBW)、瘦体重(LBW)或调整的理想体重(ADJ或AIBW)。缩写“ADJ”和“AIBW”可互换地用于指调整的理想体重。在一些实施方案中,千克被调整为AIBW(ADJ)。此外,本文描述用于治疗患有癌症的患者的方法,所述方法包括向所述患者施用有效剂量的结合FOLR1的免疫偶联物,其中所述免疫偶联物按四周计划表一周一次施用持续三周(例如,在四周计划表的第1天、第8天和第15天)。本文还描述用于治疗患有癌症的患者的方法,所述方法包括向所述患者施用有效剂量的结合FOLR1的免疫偶联物,其中所述免疫偶联物以约1至约7mg/kg的剂量施用,其中千克被调整为IBW、LBW或AIBW(ADJ),并且其中所述免疫偶联物按四周计划表一周一次施用持续三周(例如,在四周计划表的第1天、第8天和第15天)。本文所述的方法可引起毒性(例如,眼毒性)的降低。
此外,本文描述用于治疗患有癌症的患者的方法,所述方法包括向所述患者施用有效剂量的结合FOLR1的免疫偶联物,其中导致毒性的Cmax值和初始AUC值未被超过。例如,在一些实施方案中,施用产生约90-160μg/mL的Cmax,并且在一些实施方案中,施用产生约110-160μg/mL的Cmax。在一些实施方案中,施用产生不超过2785hr·μg/mL的AUC0-24。在一些实施方案中,施用产生不超过2741hr·μg/mL的AUC0-24。在一些实施方案中,施用产生不超过2700hr·μg/mL的AUC0-24。在一些实施方案中,施用产生不超过160μg/mL的Cmax。在一些实施方案中,施用产生不超过150μg/mL的Cmax。
在一些实施方案中,施用产生约1000-3500hr·μg/mL的AUC0-24。在一些实施方案中,施用产生约1000-3000hr·μg/mL的AUC0-24。在一些实施方案中,施用产生约1000-2785hr·μg/mL的AUC0-24。在一些实施方案中,施用产生约1000-2741hr·μg/mL的AUC0-24。在一些实施方案中,施用产生约1000-2700hr·μg/mL的AUC0-24。在一些实施方案中,施用产生约1000-2500hr·μg/mL的AUC0-24。在一些实施方案中,施用产生不超过1500-3500hr·μg/mL的AUC0-24。在一些实施方案中,施用产生不超过1500-3000hr·μg/mL的AUC0-24。在一些实施方案中,施用产生不超过1500-2785hr·μg/mL的AUC0-24。在一些实施方案中,施用产生不超过1500-2741hr·μg/mL的AUC0-24。在一些实施方案中,施用产生不超过1500-2700hr·μg/mL的AUC0-24。在一些实施方案中,施用产生约1500-2500hr·μg/mL的AUC0-24。
在一些实施方案中,施用产生110-160μg/mL的Cmax。在一些实施方案中,施用产生110-150μg/mL的Cmax。在一些实施方案中,施用产生110-140μg/mL的Cmax。在一些实施方案中,施用产生120-160μg/mL的Cmax。在一些实施方案中,施用产生约120-150μg/mL的Cmax。在一些实施方案中,施用产生约120-140μg/mL的Cmax。在一些实施方案中,施用产生90-160μg/mL的Cmax。在一些实施方案中,施用产生约90-150μg/mL的Cmax。在一些实施方案中,施用产生约90-140μg/mL的Cmax。在一些实施方案中,施用产生100-160μg/mL的Cmax。在一些实施方案中,施用产生约100-150μg/mL的Cmax。在一些实施方案中,施用产生约100-140μg/mL的Cmax。
所述抗FOLR1免疫偶联物可包含带电荷的接头。在一些实施方案中,所述抗FOLR1免疫偶联物包含抗体huMov19、接头磺基-SPDB以及美登木素DM4。
在一些实施方案中,所述免疫偶联物包含抗体或其抗原结合片段,所述抗体或其抗原结合片段竞争性地抑制具有SEQ ID NO:3和SEQ ID NO:5的可变区序列的抗体与FOLR1的结合。在一些实施方案中,所述抗体或其片段包含huMOV19的CDR(即,SEQ ID NO:6-10和12或SEQ ID NO:6-9、11和12)。在一些实施方案中,所述抗体或其抗原结合片段包含huMOV19的可变区序列(即,SEQ ID NO:3和5)。在一些实施方案中,所述抗体或片段不包含鼠Mov19的六个CDR(即,SEQ ID NO:6-9、16和12)。在一些实施方案中,所述抗体是huMov19。在一些实施方案中,所述免疫偶联物包含美登木素。在一些实施方案中,美登木素是DM4。在一些实施方案中,所述免疫偶联物包含为磺基-SPDB的接头。在一些实施方案中,所述免疫偶联物是IMGN853(huMov19-磺基-SPDB-DM4)。
在一些实施方案中,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)以约1至7mg/kg的剂量施用,其中千克体重被调整为IBW、LBW、BSA或AIBW(ADJ)。在一些实施方案中,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)以约1.0mg/kg的剂量施用,其中千克体重被调整为IBW、LBW、BSA或AIBW(ADJ)。在一些实施方案中,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)以约1.1mg/kg的剂量施用,其中千克体重被调整为IBW、LBW、BSA或AIBW(ADJ)。在一些实施方案中,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)以约1.5mg/kg的剂量施用,其中千克体重被调整为IBW、LBW、BSA或AIBW(ADJ)。在一些实施方案中,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)以约1.8mg/kg的剂量施用,其中千克体重被调整为IBW、LBW、BSA或AIBW(ADJ)。在一些实施方案中,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)以约2.0mg/kg的剂量施用,其中千克体重被调整为IBW、LBW、BSA或AIBW(ADJ)。在一些实施方案中,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)以约2.5mg/kg的剂量施用,其中千克体重被调整为IBW、LBW、BSA或AIBW(ADJ)。在一些实施方案中,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)以约2.8mg/kg的剂量施用,其中千克体重被调整为IBW、LBW、BSA或AIBW(ADJ)。在一些实施方案中,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)以约3.0mg/kg的剂量施用,其中千克体重被调整为IBW、LBW、BSA或AIBW(ADJ)。在一些实施方案中,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)以约3.3mg/kg的剂量施用,其中千克体重被调整为IBW、LBW、BSA或AIBW(ADJ)。在一些实施方案中,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)以约3.75mg/kg的剂量施用,其中千克体重被调整为IBW、LBW、BSA或AIBW(ADJ)。在一些实施方案中,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)以约4.0mg/kg的剂量施用,其中千克体重被调整为IBW、LBW、BSA或AIBW(ADJ)。在一些实施方案中,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)以约4.1mg/kg的剂量施用,其中千克体重被调整为IBW、LBW、BSA或AIBW(ADJ)。在一些实施方案中,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)以约4.2mg/kg的剂量施用,其中千克体重被调整为IBW、LBW、BSA或AIBW(ADJ)。在一些实施方案中,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)以约5mg/kg的剂量施用,其中千克体重被调整为IBW、LBW、BSA或AIBW(ADJ)。在一些实施方案中,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)以约5.5mg/kg的剂量施用,其中千克体重被调整为IBW、LBW、BSA或AIBW(ADJ)。在一些实施方案中,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)以约5.6mg/kg的剂量施用,其中千克体重被调整为IBW、LBW、BSA或AIBW(ADJ)。在一些实施方案中,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)以约6mg/kg的剂量施用,其中千克体重被调整为IBW、LBW、BSA或AIBW(ADJ)。在一些实施方案中,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)以约6.5mg/kg的剂量施用,其中千克体重被调整为IBW、LBW、BSA或AIBW(ADJ)。在一些实施方案中,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)以约7mg/kg的剂量施用,其中千克体重被调整为IBW、LBW、BSA或AIBW(ADJ)。在一些实施方案中,千克体重被调整为AIBW(ADJ)。
根据本文所述的方法,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)可约每4周一次施用。在一些实施方案中,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)约每3周一次施用。在一些实施方案中,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)约每2周一次施用。在一些实施方案中,所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)约每1周一次施用。
在一些实施方案中,所述免疫偶联物按四周计划表以约1至7mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述免疫偶联物按四周计划表以约1.5mg/kg至约6mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述免疫偶联物按四周计划表以约1.5、2.0、2.5、3、3.75、4.0、4.1、4.2、5.0、5.5或6.0mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述免疫偶联物按四周计划表以约1.1、1.8、2.5、3.3或4.2mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物按四周计划表以约1.0mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物按四周计划表以约1.1mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物按四周计划表以约1.5mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物按四周计划表以约1.8mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物按四周计划表以约2mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物按四周计划表以约2.5mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物按四周计划表以约2.8mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述抗FOLR1结合剂按四周计划表以约3.0mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物按四周计划表以约3.3mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物按四周计划表以约3.75mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述抗FOLR1结合剂按四周计划表以约4.0mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物按四周计划表以约4.1mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物按四周计划表以约4.2mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物按四周计划表以约5mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述抗FOLR1结合剂按四周计划表以约5.5mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物按四周计划表以约5.6mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物按四周计划表以约6mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物按四周计划表以约6.5mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物按四周计划表以约7mg/kg的剂量一周一次施用持续三周。
在一些实施方案中,所述免疫偶联物(例如,huMov19-磺基-SPDB-DM4)以约1至7mg/kg的剂量施用,其中千克被调整为IBW、LBW、BSA或AIBW(ADJ),并且其中所述免疫偶联物按四周计划表一周一次施用持续三周。在一些实施方案中,所述免疫偶联物(例如,huMov19-磺基-SPDB-DM4)以约1.5mg/kg至约6mg/kg的剂量施用,其中千克被调整为IBW、LBW、BSA或AIBW(ADJ),并且其中所述免疫偶联物按四周计划表一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物(例如,huMov19-磺基-SPDB-DM4)以约1mg/kg的剂量施用,其中千克被调整为IBW、LBW、BSA或AIBW(ADJ),并且其中所述免疫偶联物按四周计划表一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物(例如,huMov19-磺基-SPDB-DM4)以约1.1mg/kg的剂量施用,其中千克被调整为IBW、LBW、BSA或AIBW(ADJ),并且其中所述免疫偶联物按四周计划表一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物(例如,huMov19-磺基-SPDB-DM4)以约1.5mg/kg的剂量施用,其中千克被调整为IBW、LBW、BSA或AIBW(ADJ),并且其中所述免疫偶联物按四周计划表一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物(例如,huMov19-磺基-SPDB-DM4)以约1.8mg/kg的剂量施用,其中千克被调整为IBW、LBW、BSA或AIBW(ADJ),并且其中所述免疫偶联物按四周计划表一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物(例如,huMov19-磺基-SPDB-DM4)以约2mg/kg的剂量施用,其中千克被调整为IBW、LBW、BSA或AIBW(ADJ),并且其中所述免疫偶联物按四周计划表一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物(例如,huMov19-磺基-SPDB-DM4)以约2.5mg/kg的剂量施用,其中千克被调整为IBW、LBW、BSA或AIBW(ADJ),并且其中所述免疫偶联物按四周计划表一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物(例如,huMov19-磺基-SPDB-DM4)以约2.8mg/kg的剂量施用,其中千克被调整为IBW、LBW、BSA或AIBW(ADJ),并且其中所述免疫偶联物按四周计划表一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物(例如,huMov19-磺基-SPDB-DM4)以约3mg/kg的剂量施用,其中千克被调整为IBW、LBW、BSA或AIBW(ADJ),并且其中所述免疫偶联物按四周计划表一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物(例如,huMov19-磺基-SPDB-DM4)以约3.3mg/kg的剂量施用,其中千克被调整为IBW、LBW、BSA或AIBW(ADJ),并且其中所述免疫偶联物按四周计划表一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物(例如,huMov19-磺基-SPDB-DM4)以约3.75mg/kg的剂量施用,其中千克被调整为IBW、LBW、BSA或AIBW(ADJ),并且其中所述免疫偶联物按四周计划表一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物(例如,huMov19-磺基-SPDB-DM4)以约4mg/kg的剂量施用,其中千克被调整为IBW、LBW、BSA或AIBW(ADJ),并且其中所述免疫偶联物按四周计划表一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物(例如,huMov19-磺基-SPDB-DM4)以约4.1mg/kg的剂量施用,其中千克被调整为IBW、LBW、BSA或AIBW(ADJ),并且其中所述免疫偶联物按四周计划表一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物(例如,huMov19-磺基-SPDB-DM4)以约4.2mg/kg的剂量施用,其中千克被调整为IBW、LBW、BSA或AIBW(ADJ),并且其中所述免疫偶联物按四周计划表一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物(例如,huMov19-磺基-SPDB-DM4)以约5mg/kg的剂量施用,其中千克被调整为IBW、LBW、BSA或AIBW(ADJ),并且其中所述免疫偶联物按四周计划表一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物(例如,huMov19-磺基-SPDB-DM4)以约5.5mg/kg的剂量施用,其中千克被调整为IBW、LBW、BSA或AIBW(ADJ),并且其中所述免疫偶联物按四周计划表一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物(例如,huMov19-磺基-SPDB-DM4)以约5.6mg/kg的剂量施用,其中千克被调整为IBW、LBW、BSA或AIBW(ADJ),并且其中所述免疫偶联物按四周计划表一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物(例如,huMov19-磺基-SPDB-DM4)以约6mg/kg的剂量施用,其中千克被调整为IBW、LBW、BSA或AIBW(ADJ),并且其中所述免疫偶联物按四周计划表一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物(例如,huMov19-磺基-SPDB-DM4)以约6.5mg/kg的剂量施用,其中千克被调整为IBW、LBW、BSA或AIBW(ADJ),并且其中所述免疫偶联物按四周计划表一周一次施用持续三周。在一些实施方案中,所述抗FOLR1免疫偶联物(例如,huMov19-磺基-SPDB-DM4)以约7mg/kg的剂量施用,其中千克被调整为IBW、LBW、BSA或AIBW(ADJ),并且其中所述免疫偶联物按四周计划表一周一次施用持续三周。在一些实施方案中,千克被调整为AIBW(ADJ)。
在一些实施方案中,施用所述FOLR1结合剂以获得在实施例1-6中获得且在图1-2和7-12中示出的AUC。
在一些实施方案中,施用所述FOLR1结合剂以获得在实施例1-6中获得且在图1-6和9-12中示出的Cmax。
在一些实施方案中,静脉内施用所述抗FOLR1结合剂(例如,huMov19-磺基-SPDB-DM4)。
本文所述的方法可用于治疗癌症。在一些实施方案中,所述癌症选自由以下组成的组:卵巢癌、脑癌、乳腺癌、子宫癌、子宫内膜癌、胰腺癌、肾癌(例如,肾细胞癌)以及肺癌(例如,非小细胞肺癌、肺腺癌或细支气管肺泡癌(BAC))。在一些实施方案中,所述癌症是卵巢癌或肺癌。在一些实施方案中,所述癌症是上皮性卵巢癌。
在一些实施方案中,所述癌症表达FOLR1多肽或核酸。在一些实施方案中,所述癌症具有增加的FOLR1多肽表达水平,如通过免疫组织化学(IHC)所测量。例如,在一些实施方案中,所述癌症是通过IHC测量以1异质或更高的水平表达FOLR1多肽的癌症。在一些实施方案中,所述癌症是通过IHC测量以1均质或更高的水平表达FOLR1多肽的癌症。在一些实施方案中,所述癌症是通过IHC测量以2异质或更高的水平表达FOLR1多肽的癌症。在一些实施方案中,所述癌症是通过IHC测量以2均质或更高的水平表达FOLR1多肽的癌症。在一些实施方案中,所述癌症是通过IHC测量以3异质或更高的水平表达FOLR1多肽的癌症。在一些实施方案中,所述癌症是通过IHC测量以3均质或更高的水平表达FOLR1多肽的癌症。在一些实施方案中,所述癌症是通过IHC测量以2异质或更高的水平表达FOLR1多肽的肺癌。在一些实施方案中,所述癌症是通过IHC测量以3异质或更高的水平表达FOLR1多肽的肺癌。在一些实施方案中,所述癌症是以2异质或更高的水平表达FOLR1多肽的上皮性卵巢癌(例如,铂抗性或复发性或难治性的)。在一些实施方案中,所述癌症是以3异质或更高的水平表达FOLR1多肽的上皮性卵巢癌(例如,铂抗性或复发性或难治性的)。在一些实施方案中,所述癌症是以1异质或更高的水平表达FOLR1多肽的子宫内膜癌。在一些实施方案中,所述癌症是以2异质或更高的水平表达FOLR1多肽的子宫内膜癌。
在一些实施方案中,所述方法还包括向患者施用类固醇。类固醇可作为预治疗(即在施用抗FOLR1结合剂之前)施用。类固醇可以是地塞米松。
本文所述的方法可引起肿瘤大小降低。本文所述的方法可引起卵巢癌患者中CA125水平降低。在一个实例中,在治疗之前且随后在治疗之后一次或多次测量来自卵巢癌患者的样本中的CA125水平,并且CA125水平随时间推移的降低指示治疗功效。本文所述的方法可引起癌症治疗之间时间增加。本文所述的方法可引起无进展生存期(PFS)增加。本文所述的方法可引起无疾病生存期(DFS)增加。本文所述的方法可引起总生存期(OS)增加。本文所述的方法可引起完全反应(CR)增加。本文所述的方法可产引起部分反应(PR)增加。本文所述的方法可引起稳定疾病(SD)增加。本文所述的方法可引起进行性疾病(PD)的减少增加。本文所述的方法可引起进展时间(TTP)减少。
具体地说,本文提供的给药方案实现功效(例如,PR)与降低的毒性之间的最佳平衡,如例如在实施例1-4和图1-7中所展示。
附图简述
图1A和1B提供由施用IMGN853(0.15mg/kg至7.0mg/kg)产生的药物代谢动力学数据,如在实施例1中所述。图1B提供包括来自图1A的数据和从另外患者获得的另外数据的药物代谢动力学数据的稍后总结。
图2A-2C示出在一系列Cmax和AUC0-24以及AUC0-168值的情况下患者中的反应和眼毒性的出现。
图3示出在不同剂量下测量的Cmax值的范围。
图4示出Cmax对患者体重的依赖性。
图5示出与替代给药方法相关的Cmax和AUC0-24的变化。
图6示出使用替代给药方法Cmax对体重的预计依赖性。
图7示出在基于总体重(实际)接受3.3、5或7mg/kg IMGN853的24名患者中观察到的AUC0-24值的图。将这些值与在所有患者已基于总体重用5mg/kg(TBW 5mg/kg)治疗的情况下的预计值以及在所有患者基于调整的理想体重以5、5.4或6mg/kg(ADJ 5、5.4或6)给药的情况下的预计值进行比较。还示出以5mg/kg/调整的理想体重(5ADJ实际)治疗的7名患者的实际数据。具有或预计具有高于眼毒性阈值的AUC值的患者的百分比在图下方的表中示出。
图8示出对于所有患者以3.3-7.0mg/kg给药的AUC0-24值。TBW组用于计算在所指示的剂量水平下的预测AUC0-24值。还绘制了针对所指示剂量的实际患者AUC0-24数据,包括迄今为止5.0和6.0调整的理想体重(AIBW)组中给药的患者。
图9示出用单一剂量的2.8mg/kg、5.6mg/kg或8.5mg/kg的免疫偶联物治疗的小鼠中IMGN853的抗肿瘤活性、预测的血浆浓度以及其他药物代谢动力学参数。
图10示出用8.5mg/kg的单一剂量、2.8mg/kg的三个每日剂量或每三天2.8mg/kg的三个剂量治疗的小鼠中IMGN853的抗肿瘤活性、预测的血浆浓度以及其他药物代谢动力学参数。
图11示出每日用5.6mg/kg或1.4mg/kg的单一剂量持续三天治疗的小鼠中IMGN853的抗肿瘤活性、预测的血浆浓度以及其他药物代谢动力学参数。
图12示出用每周8.5mg/kg或2.8mg/kg的单一剂量持续三周治疗的小鼠中IMGN853的抗肿瘤活性、预测的血浆浓度以及其他药物代谢动力学参数。
发明详述
本发明提供用于FOLR1结合免疫偶联物的新给药方案。
I.定义
为了有助于理解本发明,在下文中定义一些术语和短语。
除非另外指明,否则如本文使用的术语“人叶酸受体1”、“FOLR1”或“叶酸受体α(FR-α)”是指任何天然人FOLR1。因此,所有这些术语可指如本文所指示的蛋白质或核酸序列。术语“FOLR1”涵盖“全长”未加工的FOLR1以及由细胞内的加工所产生的任何形式的FOLR1。所述术语还涵盖FOLR1的天然存在的变体,例如,剪接变体、等位基因变体以及同种型。本文所述的FOLR1多肽可从多种来源如人组织类型或从另一种来源分离,或通过重组或合成方法来制备。FOLR1序列的实例包括但不限于NCBI参考号P15328、NP_001092242.1、AAX29268.1、AAX37119.1、NP_057937.1和NP_057936.1。
术语“抗体”意指通过在免疫球蛋白分子的可变区内的至少一个抗原识别位点来识别并特异性地结合靶标(如蛋白质、多肽、肽、糖类、多核苷酸、脂质或前述的组合)的免疫球蛋白分子。如本文所用,术语“抗体”涵盖完整的多克隆抗体、完整的单克隆抗体、抗体片段(如Fab、Fab'、F(ab')2以及Fv片段)、单链Fv(scFv)突变体、多特异性抗体(如从至少两个完整的抗体产生的双特异性抗体)、嵌合抗体、人源化抗体、人抗体、包含抗体的抗原决定部分的融合蛋白,以及包含抗原识别位点的任何其它修饰的免疫球蛋白分子,只要所述抗体表现出所需的生物活性。抗体可以是以下五种主要类别的免疫球蛋白中的任一种:IgA、IgD、IgE、IgG以及IgM(基于其重链恒定区的鉴定而分别被称为α、δ、ε、γ和μ),或其亚类(同种型)(例如,IgG1、IgG2、IgG3、IgG4、IgA1和IgA2)。不同类别的免疫球蛋白具有不同的且众所周知的亚单位结构和三维构型。抗体可为裸的或与其他分子如毒素、放射性同位素等等偶联的。
“阻断性”抗体或“拮抗剂”抗体是抑制或减小其结合的抗原如FOLR1的生物活性的抗体。在一些实施方案中,阻断性抗体或拮抗剂抗体基本上或完全地抑制抗原的生物活性。生物活性可被降低10%、20%、30%、50%、70%、80%、90%、95%或甚至100%。
术语“抗FOLR1抗体”或“结合FOLR1的抗体”是指能够以足够的亲和力结合FOLR1的抗体,以使得所述抗体在靶向FOLR1中适用作诊断剂和/或治疗剂。抗FOLR1抗体与不相关的非FOLR1蛋白的结合程度可小于约10%的抗体与FOLR1的结合,如例如通过放射性免疫测定法(RIA)所测量的。在某些实施方案中,结合FOLR1的抗体具有≤1μM、≤100nM、≤10nM、≤1nM或≤0.1nM的解离常数(Kd)。
术语“抗体片段”是指完整抗体的一部分并且是指完整抗体的抗原决定可变区。抗体片段的实例包括,但不限于Fab、Fab'、F(ab')2以及Fv片段、线性抗体、单链抗体以及由抗体片段形成的多特异性抗体。
“单克隆抗体”是指在单一抗原决定簇或表位的高度特异性识别和结合中涉及的均质抗体群。这与通常包含针对不同抗原决定簇的不同抗体的多克隆抗体形成对照。术语“单克隆抗体”涵盖完整与全长单克隆抗体以及抗体片段(如Fab、Fab'、F(ab')2、Fv)、单链(scFv)突变体、包含抗体部分的融合蛋白、以及包含抗原识别位点的任何其它修饰的免疫球蛋白分子。此外,“单克隆抗体”是指以任何数量的方式形成的这类抗体,包括但不限于通过杂交瘤、噬菌体选择、重组表达以及转基因动物。
术语“人源化抗体”是指作为包含最少非人(例如,鼠)序列的特异性免疫球蛋白链、嵌合免疫球蛋白或其片段的非人(例如,鼠)抗体形式。通常,人源化抗体是其中来自互补决定区(CDR)的残基被来自非人物种(例如,小鼠、大鼠、兔、仓鼠)的CDR的具有所需的特异性、亲和力以及能力的残基置换的人免疫球蛋白(Jones等,1986,Nature,321:522-525;Riechmann等,1988,Nature,332:323-327;Verhoeyen等,1988,Science,239:1534-1536)。在一些情况下,人免疫球蛋白的Fv框架区(FR)残基被来自非人物种的抗体中的具有所需特异性、亲和力以及能力的相应残基置换。人源化抗体可通过Fv框架区中的和/或所置换的非人残基内的另外残基的取代来进行进一步修饰,以便改善和优化抗体特异性、亲和力和/或能力。一般来说,人源化抗体将基本上包含所有的至少一个并且通常两个或三个可变结构域,所述可变结构域含有所有或基本上所有对应于非人免疫球蛋白的CDR区,而所有或基本上所有FR区是人免疫球蛋白共有序列的那些。人源化抗体还可包含免疫球蛋白恒定区或结构域的至少一部分(Fc),通常为人免疫球蛋白的一部分。用于产生人源化抗体的方法的实例描述于美国专利5,225,539中。在一些实施方案中,“人源化抗体”是表面重构的抗体。
抗体的“可变区”是指单独或组合的抗体轻链的可变区或抗体重链的可变区。重链和轻链的可变区各自由通过三个互补决定区(CDR)(还被称为高变区)连接的四个框架区(FR)组成。每个链中的CDR通过FR紧密保持在一起,并且与来自另一链的CDR一起有助于抗体的抗原结合位点的形成。存在至少两种用于确定CDR的技术:(1)基于跨物种序列变异的方法(即,Kabat等.Sequences of Proteins of Immunological Interest,(第5版,1991,National Institutes of Health,Bethesda Md.));和(2)基于抗原-抗体复合物的晶体学研究的方法(Al-lazikani等(1997)J.Molec.Biol.273:927-948))。此外,在本领域中有时使用这两种方法的组合来确定CDR。
当提及可变结构域中的残基时,通常使用Kabat编号系统(大约轻链的残基1-107和重链的残基1-113)(例如,Kabat等,Sequences of Immunological Interest.第5版.Public Health Service,National Institutes of Health,Bethesda,Md.(1991))。
如Kabat中的氨基酸位置编号是指Kabat等,Sequences of Proteins of Immunological Interest,第5版.Public Health Service,National Institutes of Health,Bethesda,Md.(1991)中用于抗体的编译的重链可变结构域或轻链可变结构域的编号系统。使用这种编号系统,实际线性氨基酸序列可包含对应于可变结构域的FR或CDR的缩短或向其中的插入的几个或另外氨基酸。例如,重链可变结构域可包含在H2的残基52之后的单一氨基酸插入(根据Kabat的残基52a)和在重链FR残基82之后的多个插入残基(例如,根据Kabat的残基82a、82b以及82c等等)。对于给定抗体,可通过在具有同源性的区域处抗体序列与“标准”Kabat编号的序列的比对来确定残基的Kabat编号。而Chothia是指结构环的位置(Chothia和Lesk J.Mol.Biol.196:901-917(1987))。当使用Kabat编号规则编号时,取决于Chothia CDR-H1环的长度,所述环的末端在H32与H34之间变化(这是因为Kabat编号方案将插入安置在H35A和H35B处;如果35A和35B都不存在,那么所述环在32处终止;如果仅35A存在,那么所述环在33处终止;如果35A与35B都存在,那么所述环在34处终止)。AbM高变区代表Kabat CDR与Chothia结构环之间的折衷,并且被Oxford Molecular's AbM抗体建模软件使用。
术语“人抗体”意指由人产生的抗体或使用本领域中已知的任何技术制备的具有对应于由人产生的抗体的氨基酸序列的抗体。人抗体的这个定义包括完整或全长抗体、其片段和/或包含至少一个人重链和/或轻链多肽的抗体,例如像包含鼠轻链多肽和人重链多肽的抗体。
术语“嵌合抗体”是指其中免疫球蛋白分子的氨基酸序列衍生自两种或更多种物种的抗体。通常,轻链与重链二者的可变区对应于衍生自一种哺乳动物(例如,小鼠、大鼠、兔等等)的抗体的具有所需特异性、亲和力以及能力的可变区,而恒定区与衍生自另一物种(通常是人)的抗体中的序列是同源的以避免在所述物种中引起免疫反应。
术语“表位”或“抗原决定簇”在本文中可互换使用并且是指能够被特定抗体识别并特异性地结合的抗原的那部分。当所述抗原是多肽时,表位可由连续氨基酸和通过蛋白质的三级折叠而并置的非连续氨基酸形成。由连续氨基酸形成的表位通常在蛋白质变性时保留,而通过三级折叠形成的表位通常在蛋白质变性时丧失。在独特的空间构象中表位通常包含至少3个并且更通常至少5个或8至10个氨基酸。
“结合亲和力”总体上是指一个分子(例如,抗体)的单一结合位点与它的结合配偶体(例如,抗原)之间的非共价相互作用的总和的强度。除非另外指明,否则如本文所用,“结合亲和力”是指反映结合对的成员(例如,抗体与抗原)之间的1:1相互作用的固有结合亲和力。分子X对它的配偶体Y的亲和力通常可以由解离常数(Kd)表示。亲和力可通过本领域中已知的常用方法(包括本文所述的那些)进行测量。低亲和力抗体通常缓慢地结合抗原并且倾向于容易解离,而高亲和力抗体通常更快地结合抗原并且倾向于保持结合时间更长。测量结合亲和力的多种方法是本领域已知的,其中的任何方法可用于本发明的目的。具体的说明性实施方案在下文进行描述。
当本文提及结合亲和力时使用的“或更好”是指在分子与它的结合配偶体之间更强的结合。当本文使用时,“或更好”是指由更小的数值Kd值表示的更强的结合。例如,对抗原具有“0.6nM或更好”的亲和力的抗体,所述抗体对所述抗原的亲和力是<0.6nM,即0.59nM、0.58nM、0.57nM等或小于0.6nM的任何值。
所谓“特异性地结合”通常意指抗体经由它的抗原结合结构域域而结合表位,并且所述结合需要在所述抗原结合结构域域与所述表位之间的一些互补性。根据这一定义,当抗体经由它的抗原结合结构域域结合一个表位比它将结合随机的、不相关的表位更容易时,可以说所述抗体是“特异性地结合”所述表位。术语“特异性”在本文用于形容某一抗体结合某一表位的相对亲和力。例如,可以认为抗体“A”比抗体“B”对给定表位具有更高的特异性,或可以说抗体“A”以比它对相关表位“D”的更高的特异性而结合表位“C”。
所谓“优先结合”意指抗体特异性地结合一个表位比它将结合相关的、相似的、同源的或类似的表位更容易。因此,“优先结合”给定表位的抗体将比结合相关表位更可能结合所述给定表位,即使这种抗体可能与所述相关表位交叉反应。
如果抗体优先地结合给定表位到它在某种程度上阻断参考抗体结合所述表位的程度,那么可以说它“竞争性地抑制”所述参考抗体与所述表位的结合。竞争性抑制可以通过本领域已知的任何方法来确定,例如,竞争性ELISA测定。可以说抗体竞争性地抑制参考抗体与给定表位的结合至少90%、至少80%、至少70%、至少60%或至少50%。
如本文所用,短语“基本上相似”或“基本上相同”表示两个数值(通常一个数值与本发明的抗体相关并且另一个数值与参考/比较抗体相关)之间的足够高的相似度,以使得本领域技术人员将认为在通过所述值(例如,Kd值)测量的生物学特性的背景下这两个值之间的差异几乎没有或没有生物学和/或统计性显著性。所述两个值之间的差异可以随着参考/比较抗体的值的变化而小于约50%、小于约40%、小于约30%、小于约20%或小于约10%。
被“分离的”多肽、抗体、多核苷酸、载体、细胞或组合物是呈在自然界中未发现的形式的多肽、抗体、多核苷酸、载体、细胞或组合物。分离的多肽、抗体、多核苷酸、载体、细胞或组合物包括已经被纯化到不再呈它们在自然界被发现的形式的程度的那些。在一些实施方案中,被分离的抗体、多核苷酸、载体、细胞或组合物是基本上纯的。
如本文所用,“基本上纯的”是指至少50%纯的(即,不含污染物)、至少90%纯的、至少95%纯的、至少98%纯的或至少99%纯的材料。
如本文使用的术语“免疫偶联物”或“偶联物”是指连接至细胞结合剂(即抗FOLR1抗体或其片段)并由以下通式定义的化合物或其衍生物:C-L-A,其中C=细胞毒素,L=接头,并且A=抗FOLR1抗体或抗体片段。免疫偶联物还可由以下呈相反顺序的通式来定义:A-L-C。
术语“IMGN853”是指本文所述的含有huMov19抗体、磺基SPDB接头及DM4美登木素的免疫偶联物。huMov19抗体包含具有SEQ ID NO:3的氨基酸序列的可变重链以及具有SEQ ID NO:5的氨基酸序列的可变轻链。
“接头”是能够将化合物(通常是药物,如美登木素)以稳定的、共价的方式连接至细胞结合剂如抗FOLR1抗体或其片段的任何化学部分。在化合物或抗体保持活性的条件下,接头可易感于或基本上抵抗酸诱导的裂解、光诱导的裂解、肽酶诱导的裂解、酯酶诱导的裂解以及二硫键裂解。适合的接头是本领域熟知的并且包括,例如,二硫基、硫醚基、酸不稳定性基团、光不稳定性基团、肽酶不稳定性基团以及酯酶不稳定性基团。接头还包括如本文所描述的和本领域已知的带电荷的接头及其亲水形式。
术语“癌症”和“癌性的”是指或描述哺乳动物中的生理状态,其中细胞群体以未调控的细胞生长为特征。癌症的实例包括但不限于癌瘤(carcinoma)、淋巴瘤、胚细胞瘤、肉瘤以及白血病。这类癌症的更具体的实例包括,鳞状细胞癌、小细胞肺癌、非小细胞肺癌、肺腺癌、肺鳞状癌、腹膜癌、肝细胞癌、胃肠癌、胰腺癌、成胶质细胞瘤、宫颈癌、卵巢癌、肝癌、膀胱癌、肝癌、乳腺癌、结肠癌、结肠直肠癌、子宫内膜或子宫癌、唾液腺癌、肾癌、肝癌、前列腺癌、外阴癌、甲状腺癌、肝癌以及不同类型的头颈部鳞癌。所述癌症可以是表达FOLR1的癌症。
“肿瘤(Tumor)”和“赘生物(neoplasm)”是指由过度细胞生长或增殖所引起的任何组织块,是良性的(非癌的)或恶性的(癌的),包括癌前病变。
术语“癌细胞”、“肿瘤细胞”以及语法同等术语是指来源于肿瘤或癌前病变的总细胞群,包括非致瘤性细胞(包括肿瘤细胞群块)和致瘤性干细胞(癌干细胞)二者。如本文所用,术语“肿瘤细胞”当仅仅是指缺乏更新和分化能力的那些肿瘤细胞时,将由术语“非致瘤性”修饰,以区分那些肿瘤细胞和癌干细胞。
术语“受试者”是指待成为具体治疗的接受者的任何动物(例如,哺乳动物),包括但不限于人、非人灵长类、啮齿类等。通常,提及人受试者时术语“受试者”和“患者”在本文可互换使用。
术语“理想体重”(IBW)是指与总体重不相关的尺寸描述符。IBW是针对性别和身高以及任选地骨架尺寸校正的重量的估计。可例如使用公式IBW=0.9H-88(对于男性)和IBW=0.9H-92(对女性)计算IBW,其中H=身高(cm)。
术语“瘦体重”(LBW)是指可考虑部分脂肪质量(FMfrac)的尺寸描述符。LBW等于总体重减去FMfrac与重量的乘积。可例如使用公式LBW=1.10×重量(kg)–128([重量(kg)]2/[100×身高(米)]2)(对于男性)和LBW=1.07×重量(kg)–148([重量(kg)]2/[100×身高(米)]2)(对于女性)计算LBW。
术语“调整的理想体重”(AIBW)或“调整的体重”(ADJ)是指考虑性别、总体重和身高的尺寸描述符。AIBW和ADJ在整个说明书中可互换地使用。可例如使用公式ADJ=IBW+0.4(重量(kg)–IBW)计算AIBW(ADJ)。
IBW、LBW和AIBW(ADJ)在Green和Duffull,British Journal of Clinical Pharmacology 58:119-133(2004)中更详细地讨论,其以引用的方式整体并入本文。
与一种或多种另外治疗剂“联合”施用包括同时(并行)施用和以任何顺序的连续施用。
术语“药物制剂”是指处于允许活性成分的生物活性有效的形式并且不含有对进行所述制剂施用的受试者具有不可接受的毒性的另外组分的制剂。所述制剂可为无菌的。
如本文所公开的抗体或免疫偶联物的“有效量”是足以执行明确说明的目的的量。根据所说明的目的,“有效量”可凭经验且以常规方式来确定。
术语“治疗有效量”是指有效“治疗”受试者或哺乳动物中的疾病或病症的抗体或其他药物的量。在癌症的情况下,药物的治疗有效量可减少癌细胞的数量;减小肿瘤大小;抑制(即,在某种程度上减慢并且在某一实施方案中停止)癌细胞对周边器官的浸润;抑制(即,在某种程度上减慢并在某一实施方案中停止)肿瘤转移;在某种程度上抑制肿瘤生长;在某种程度上减轻与癌症相关的一种或多种症状;和/或产生有利反应如增加的无进展生存期(PFS)、无疾病生存期(DFS)或总生存期(OS)、完全反应(CR)、部分反应(PR)或在一些情况下,稳定疾病(SD)、进行性疾病的减少(PD)、进展时间减少(TTP)、在卵巢癌的情况下CA125的减少或其任何组合。
参见本文中“治疗”的定义。在药物可防止生长和/或杀灭现有的癌细胞的程度上,它可为细胞抑制的和/或细胞毒性的。在某些实施方案中,增加的FOLR1水平的鉴定允许施用减少量的FOLR1靶向性治疗剂,以实现与更高剂量所见到的相同的治疗效果。“预防有效量”是指在剂量和持续时间上有效实现所需预防结果所需要的量。通常但不一定地,由于预防剂量在疾病前或疾病早期阶段用于受试者,所以预防有效量将小于治疗有效量。
术语“良好反应”通常是指在受试者中引起有利的状态。关于癌症治疗,所述术语是指在受试者身上提供治疗效果。在癌症中的积极治疗效果可以按许多方式来测量(参见,W.A.Weber,J.Nucl.Med.50:1S-10S(2009))。例如,肿瘤生长抑制、分子标记物表达、血清标记物表达以及分子成像技术全部都可用来评定抗癌治疗的治疗功效。关于肿瘤生长抑制,根据NCI标准,T/C≤42%是抗肿瘤活性的最低水平。T/C<10%被认为是高抗肿瘤活性水平,其中T/C(%)=处理物的中位肿瘤体积/对照物的中位肿瘤体积×100。有利反应可例如通过以下各项来评定:增加的无进展生存期(PFS)、无疾病生存期(DFS)或总生存期(OS)、完全反应(CR)、部分反应(PR)或在一些情况下,稳定疾病(SD)、进行性疾病的减少(PD)、进展时间减少(TTP)、在卵巢癌的情况下CA125的减少或其任何组合。
PFS、DFS和OS可通过由美国国家癌症研究所(National Cancer Institute)和美国食品和药品管理局(U.S.Food and Drug Administration)对于新药物的批准所设定的标准进行测量。参见Johnson等,(2003)J.Clin.Oncol.21(7):1404-1411。
“无进展生存期”(PFS)是指从招募至疾病进展或死亡的时间。通常使用卡普兰-迈耶(Kaplan-Meier)方法和实体肿瘤反应评价标准(RECIST)1.1标准中测量PFS。通常,无进展生存期是指其中患者保持存活而无癌症恶化的情况。
“肿瘤进展时间”(TTP)被定义为从招募至疾病进展的时间。通常使用RECIST 1.1标准测量TTP。
“完全反应”或“完全缓解”或“CR”指示响应于治疗肿瘤或癌症的所有病征的消失。这并不总是意味着癌症已被治愈。
“部分反应”或“PR”是指响应于治疗,一种或多种肿瘤或病灶的大小或体积或体内癌症的程度的降低。
“稳定疾病”是指无进展或复发的疾病。在稳定疾病中,既不存在足够的肿瘤萎缩来有资格作为部分反应,也不存在足够的肿瘤增加来被称为进行性疾病。
“进行性疾病”是指现有非靶病变的又一个新病变或肿瘤的出现和/或明确进展。进行性疾病还可指自治疗开始由于肿瘤的治疗或扩散所致的超过20%的肿瘤生长。
“无疾病生存期”(DFS)是指在治疗期间或之后患者保持无疾病的时间长度。
“总生存期”(OS)是指从患者招募至死亡或在最后已知存活的日期审查的时间。OS包括相较于原初或未治疗的个体或患者预期寿命的延长。总生存期是指其中患者保持存活持续限定时间段如(例如从诊断或治疗时间)一年、五年等的情况,
“CA125水平的降低”可根据妇科癌症协作组(GCIG)准则进行评定。例如,可在治疗之前测量CA125水平以建立基线CA125水平。可在治疗期间或之后一次或多次测量CA125水平,并且CA125水平随时间推移相较于基线水平的降低被视为CA125水平的降低。
术语如“治疗(treating)”或“治疗(treatment)”或“治疗(to treat)”或“缓和(alleviating)”或“缓和(to alleviate)”是指治愈、减缓、减轻所诊断的病理病状或病症的症状和/或阻止其进展的治疗措施。因此,需要治疗的那些包括已经诊断患有或疑似患有所述病症的那些。在某些实施方案中,如果患者显示出一种或多种下列情况,那么受试者被成功地根据本发明的方法针对癌症“治疗”:癌细胞的数量减少或完全不存在;肿瘤尺寸减小;抑制或不存在癌细胞浸润至周边器官,包括例如癌症扩散至软组织和骨骼;抑制或不存在肿瘤转移;抑制或不存在肿瘤生长;与特定癌症相关的一种或多种症状减轻;发病率和死亡率降低;生命质量改善;致瘤性、致瘤性发生频率或肿瘤的致瘤能力减少;肿瘤中癌症干细胞的数量或发生频率减少;致瘤性细胞分化成非致瘤性状态;增加的无进展生存期(PFS)、无疾病生存期(DFS)或总生存期(OS)、完全反应(CR)、部分反应(PR)、稳定疾病(SD)、进行性疾病的减少(PD)、进展时间减少(TTP)、在卵巢癌的情况下CA125的减少或其任何组合。
预防(Prophylactic)或防止(preventative)措施是指防止和/或减缓所靶向的病理病状或病症的发展的治疗措施。因此,需要预防或防止措施的那些包括易患所述病症的那些和其中待预防所述病症的那些。
术语“预先治疗(pre-treat)”和“预先治疗(pre-treatment)”是指在施用抗FOLR1治疗剂之前发生的治疗措施。例如,如在本文中更详细地描述,预防剂如类固醇可在施用抗FOLR1治疗剂之前约一周、约五天、约三天、约两天或约一天或24小时内施用。预防剂还可在与抗FOLR1治疗剂同一天在抗FOLR1治疗剂之前施用。
术语“最大浓度”(Cmax)是指在药物剂量之后测量的血液中的药物的最高浓度。
术语“曲线下面积”(AUC)是指在药物的剂量之后血流中的药物的总量。AUC可在特定时间段内定义。因此,例如,AUC0-∞是指在药物的剂量之后无限时间内血流中的药物的总量。在另一个实例中,AUC0-24是指在药物的剂量之后24小时的时段内血流中的药物的总量。在另一个实例中,AUC0-168是指在药物的剂量之后168小时(或一周)的时段内血流中的药物的总量。
“在稳态下的表观分布体积”(Vss)是指体内的药物总量与血浆中的药物的浓度之比,或如果整体体内的药物处于与血浆中的相同浓度,则是指对包含药物的整个量必要的“表观”体积。
“化学治疗剂”是不管作用机制如何,适用于治疗癌症的化合物。化学治疗剂包括例如CD20的拮抗剂,如利妥昔单抗和环磷酰胺、阿霉素、长春新碱、强的松、氟达拉滨、依托泊苷、甲氨蝶呤、来那度胺、苯丁酸氮芥、倍他斯汀(bentamustine)和/或这些化学治疗剂的修饰的型式。
术语“多肽”、“肽”以及“蛋白质”在本文可互换使用,以指具有任何长度的氨基酸的聚合物。所述聚合物可以是直链的或支链的,它可包含修饰的氨基酸,并且它可被非氨基酸间断。所述术语还涵盖已经天然修饰或通过干预修饰的氨基酸聚合物;例如,二硫键形成、糖基化、脂质化、乙酰化、磷酸化,或任何其他操作或修饰,如与标记组分偶联。在所述定义内还包括,例如,含有氨基酸的一种或多种类似物(包括,例如,非天然氨基酸,等)的多肽、以及本领域已知的其他修饰。应了解,因为本发明的多肽是基于抗体,所以在某些实施方案中,所述多肽可作为单链或缔合的链而存在。
在两种或更多种核酸或多肽的情形中的术语“相同的”或“同一性”百分比是指当针对最大对应进行比较和比对时(如果必要,引入空位),两个或更多个序列或子序列是相同的或具有相同的指定百分比的核苷酸或氨基酸残基,而不考虑任何保守性氨基酸取代作为序列同一性的一部分。可使用序列比较软件或算法或通过目视检查来测量同一性百分比。可用于获得氨基酸或核苷酸序列的比对的不同算法和软件是本领域已知的。序列比对算法的一个这样的非限制性实例是在Karlin等,1990,Proc.Natl.Acad.Sci.,87:2264-2268中进行描述、在Karlin等,1993,Proc.Natl.Acad.Sci.,90:5873-5877中进行修改并且并入至NBLAST和XBLAST程序(Altschul等,1991,Nucleic Acids Res.,25:3389-3402)中的算法。在某些实施方案中,可如Altschul等,1997,Nucleic Acids Res.25:3389-3402中所述而使用Gapped BLAST。BLAST-2、WU-BLAST-2(Altschul等,1996,Methods in Enzymology,266:460-480)、ALIGN、ALIGN-2(Genentech,South San Francisco,California)或Megalign(DNASTAR)是可用于比对序列的另外可公开获得的软件程序。在某些实施方案中,两个核苷酸序列之间的同一性百分比使用GCG软件中的GAP程序来确定(例如,使用NWSgapdna.CMP矩阵和40、50、60、70或90的空位权重以及1、2、3、4、5或6的长度权重)。在某些替代实施方案中,合并Needleman和Wunsch算法(J.Mol.Biol.(48):444-453(1970))的GCG软件包中的GAP程序可用于确定两个氨基酸序列之间的同一性百分比(例如,使用Blossum 62矩阵或PAM250矩阵和16、14、12、10、8、6或4的空位权重以及1、2、3、4、5的长度权重)。或者,在某些实施方案中,使用Myers和Miller算法(CABIOS,4:11-17(1989))来确定核苷酸或氨基酸序列之间的同一性百分比。例如,可使用ALIGN程序(版本2.0)和使用具有残基表、12的空位长度罚分以及4的空位罚分的PAM120来确定同一性百分比。可由本领域技术人员确定用于通过具体比对软件达到最大比对的适当参数。在某些实施方案中,使用比对软件的默认参数。在某些实施方案中,第一氨基酸序列与第二氨基酸序列的同一性百分比“X”计算为100×(Y/Z),其中Y是在所述第一序列和第二序列的比对中评分为一致匹配的氨基酸残基的数目(如通过目视检查或具体序列比对程序来比对),并且Z是所述第二序列中的残基的总数目。如果第一序列的长度比第二序列长,那么所述第一序列与第二序列的同一性百分比将比所述第二序列与所述第一序列的同一性百分比长。
作为非限制性实例,在某些实施方案中,可以使用Bestfit程序(Wisconsin序列分析包,Unix版本8,Genetics Computer Group,University Research Park,575 Science Drive,Madison,WI 53711)来确定任何特定多核苷酸是否与参考序列具有一定百分比的序列同一性(例如,至少80%同一性、至少85%同一性、至少90%同一性并且在一些实施方案中至少95%、96%、97%、98%或99%同一性)。Bestfit使用Smith和Waterman的局部同源性算法(Advances in Applied Mathematics 2:482 489(1981)),以找到两个序列之间具有同源性的最佳片段。当根据本发明使用Bestfit或任何其他序列比对程序来确定特定序列是否与参考序列具有例如95%同一性时,设定参数,以使得在参考核苷酸序列的全长上计算同一性百分比并且允许同源性中的空位高达所述参考序列中核苷酸总数的5%。
在一些实施方案中,本发明的两种核酸或多肽是基本上相同的,意味着当针对最大对应进行比较和比对时,如使用序列比较算法或通过目视检查所测量,它们具有至少70%、至少75%、至少80%、至少85%、至少90%并且在一些实施方案中至少95%、96%、97%、98%、99%核苷酸或氨基酸残基同一性。同一性可以存在于长度为至少约10、约20、约40至约60个残基或其间的任何整数值的序列的区域,并且可存在于比60至80个残基长的区域,例如,至少约90至100个残基,并且在一些实施方案中,所述序列在所比较的序列的全长(例如像核苷酸序列的编码区)上基本上相同。
“保守性氨基酸取代”是以下取代,其中一个氨基酸残基被具有相似侧链的另一个氨基酸残基置换。具有相似侧链的氨基酸残基的家族已经在本领域中进行了定义,包括碱性侧链(例如,赖氨酸、精氨酸、组氨酸)、酸性侧链(例如,天冬氨酸、谷氨酸)、不带电荷的极性侧链(例如,甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、非极性侧链(例如,丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)、β分支侧链(例如,苏氨酸、缬氨酸、异亮氨酸)以及芳香族侧链(例如,酪氨酸、苯丙氨酸、色氨酸、组氨酸)。例如,以苯丙氨酸取代酪氨酸是保守性取代。在一些实施方案中,本发明的多肽和抗体的序列中的保守性取代不会消除含有所述氨基酸序列的多肽或抗体与抗原(即,所述多肽或抗体所结合的FOLR1)的结合。鉴定不会消除抗原结合的核苷酸和氨基酸保守性取代的方法是本领域熟知的(参见,例如,Brummell等,Biochem.32:1180-1 187(1993);Kobayashi等.Protein Eng.12(10):879-884(1999);以及Burks等.Proc.Natl.Acad.Sci.USA 94:.412-417(1997))。
除非上下文另外清楚地规定,如本公开和权利要求中使用的单数形式“一个(种)(a)、”“一个(种)(an)”以及“所述(the)”包括复数形式。
应了解,无论本文何处用语言“包括”来描述实施方案,都还提供以“由……组成”和/或“主要由……组成”措辞来描述其它相似的实施方案。
如本文的短语如“A和/或B”中使用的术语“和/或”意图包括“A和B”、“A或B”、“A”以及“B”。同样地,如在短语如“A、B和/或C”中使用的术语“和/或”意图涵盖以下各实施方案中的每一种:A、B以及C;A、B或C;A或C;A或B;B或C;A和C;A和B;B和C;A(单独);B(单独);以及C(单独)。
II.FOLR1结合剂
本文描述的方法提供施用特异性地结合FOLR1的药剂(“FOLR1结合剂”)(例如,抗体或其抗原结合片段或多肽)。在某些实施方案中,FOLR1结合剂是抗体、免疫偶联物或多肽。人FOLR1的氨基酸和核苷酸序列在本领域是已知的并且在本文中还如由SEQ ID NO:1和SEQ ID NO:2所示出来提供。因此,在一些实施方案中,FOLR1结合剂可结合在SEQ ID NO:1内发现的表位。
治疗上有效的抗FOLR1抗体的实例可在美国申请公布号US 2012/0009181中找到,所述申请以引用的方式并入本文。治疗上有效的抗FOLR1抗体的实例是huMov19(M9346A)。SEQ ID NO:3-5的多肽包含huMov19(M9346A)的重链的可变结构域以及分别huMov19的可变结构域轻链型式1.00、可变结构域轻链型式1.60。在某些实施方案中,huMov19抗FOLR1抗体包含由SEQ ID NO:3表示的可变结构域重链和由SEQ ID NO:5表示的可变结构域轻链(huMov19的型式1.60)。在某些实施方案中,huMov19(M9346A)抗体由在2010年4月7日根据布达佩斯条约(Budapest Treaty)的条款寄存在美国典型培养物保藏所(ATCC)(位于10801 University Boulevard,Manassas,VA 20110)并具有ATCC寄存号PTA-10772和PTA-10773或10774的质粒编码。以下提供适用于本发明的治疗方法的FOLR1免疫偶联物的实例。
在一些实施方案中,FOLR1结合剂是人源化抗体或其抗原结合片段。在一些实施方案中,所述人源化抗体或片段是表面重构的抗体或其抗原结合片段。在其他实施方案中,所述FOLR1结合剂是完全人抗体或其抗原结合片段。
在某些实施方案中,所述FOLR1结合剂具有一种或多种以下作用:诱导稳定疾病、抑制肿瘤细胞的增殖、通过降低肿瘤中的癌症干细胞的频率来降低肿瘤的致瘤性、抑制肿瘤生长、增加生存期、引发肿瘤细胞的细胞死亡、致瘤性细胞分化成非致瘤性状态或预防肿瘤细胞的转移。
在某些实施方案中,FOLR1结合剂是具有抗体依赖性细胞毒性(ADCC)活性的抗体。
在一些实施方案中,FOLR1结合剂能够减小肿瘤体积。FOLR1结合剂减小肿瘤体积的能力可例如通过测量%T/C值来评定,所述值是所治疗的受试者的中值肿瘤体积除以对照受试者的中值肿瘤体积所得的值。在某些实施方案中,特异性地结合人FOLR1的免疫偶联物或其他药剂经由细胞毒性剂触发细胞死亡。例如,在某些实施方案中,将人FOLR1抗体的抗体与美登木素偶联,所述美登木素通过蛋白质内化而在表达FOLR1的肿瘤细胞中活化。在某些实施方案中,FOLR1结合剂能够抑制肿瘤生长。在某些实施方案中,FOLR1结合剂能够抑制体内肿瘤生长(例如,在异种移植物小鼠模型中和/或患有癌症的人中)。
FOLR1结合分子可以是特异性地结合FOLR1的抗体或抗原结合片段,所述抗体或抗原结合片段包含uMov19(M9346A)的CDR,每个CDR具有多至四个(即0、1、2、3或4)保守氨基酸取代,例如,其中所述抗体或片段不包含鼠Mov19的六个CDR(即,SEQ ID NO:6-9、16和12)。多肽可包含本文所描述的单个可变轻链或可变重链中的一个。抗体和多肽还可包含可变轻链和可变重链。
在一些实施方案中,所述FOLR1结合分子是包含SEQ ID NO:6-10的序列和SEQ ID NO:12的序列的抗体或抗原结合片段。在一些实施方案中,所述FOLR1结合分子是包含SEQ ID NO:6-9的序列和SEQ ID NO:11和12的序列的抗体或抗原结合片段。
还提供包括与SEQ ID NO:3、SEQ ID NO:4或SEQ ID NO:5具有至少约90%序列同一性的多肽的多肽。在某些实施方案中,所述多肽包括与SEQ ID NO:3、SEQ ID NO:4或SEQ ID NO:5具有至少约95%、至少约96%、至少约97%、至少约98%或至少约99%序列同一性的多肽。因此,在某些实施方案中,所述多肽包括(a)与SEQ ID NO:3具有至少约95%序列同一性的多肽,和/或(b)与SEQ ID NO:4或SEQ ID NO:5具有至少约95%序列同一性的多肽。在某些实施方案中,所述多肽包括(a)具有SEQ ID NO:3的氨基酸序列的多肽;和/或(b)具有SEQ ID NO:4或SEQ ID NO:5的氨基酸序列的多肽。在某些实施方案中,所述多肽是抗体和/或所述多肽特异性地结合FOLR1。在某些实施方案中,所述多肽是特异性地结合FOLR1的鼠、嵌合或人源化抗体。在某些实施方案中,与SEQ ID NO:3、SEQ ID NO:4or SEQ ID NO:5具有一定百分比的序列同一性的多与S肽EQ ID NO:3、SEQ ID NO:4或SEQ ID NO:5的不同仅在于保守性氨基酸取代。
多肽可包含本文所描述的单独轻链或重链中的一种。抗体和多肽还可包含轻链与重链二者。
单克隆抗体可使用杂交瘤方法(如由Kohler和Milstein(1975)Nature 256:495所描述的那些)来制备。使用所述杂交瘤方法,将小鼠、仓鼠或其它适当的宿主动物如以上所描述进行免疫,以引发淋巴细胞产生特异性地结合免疫抗原的抗体。淋巴细胞还可在体外进行免疫。在免疫之后,将淋巴细胞分离并且使用(例如)聚乙二醇与适合的骨髓瘤细胞系融合以形成杂交瘤细胞,然后可从未融合的淋巴细胞和骨髓瘤细胞选择所述杂交瘤细胞。然后可以对产生特异性地针对选定抗原的单克隆抗体的杂交瘤(如通过免疫沉淀法、免疫印迹法或通过体外结合测定(例如,放射免疫测定法(RIA);酶联免疫吸附测定(ELISA))确定)使用标准方法(Goding,Monoclonal Antibodies:Principles and Practice,Academic Press,1986)在体外培养物中繁殖或在动物中体内作为腹水肿瘤来进行繁殖。然后可以如针对多克隆抗体所描述的那样从培养基或腹水积水纯化所述单克隆抗体。
或者,还可使用如美国专利4,816,567中所描述的重组DNA方法来制备单克隆抗体。将编码单克隆抗体的多核苷酸从成熟的B细胞或杂交瘤细胞分离,如通过RT-PCR使用特异性地扩增编码所述抗体的重链和轻链的基因的寡核苷酸引物;并且使用常规工序确定它们的序列。然后将编码重链和轻链的分离的多核苷酸克隆至适合的表达载体中,所述表达载体当转染至不另外产生免疫球蛋白的宿主细胞(如大肠杆菌细胞、猿COS细胞、中国仓鼠卵巢(CHO)细胞或骨髓瘤细胞)中时,由所述宿主细胞产生单克隆抗体。此外,可如所描述从表达所需的物种的CDR的噬菌体展示文库分离所需的物种的重组单克隆抗体或其片段(McCafferty等,1990,Nature,348:552-554;Clackson等,1991,Nature,352:624-628;以及Marks等,1991,J.Mol.Biol.,222:581-597)。
可使用重组DNA技术以许多不同的方式对编码单克隆抗体的多核苷酸进一步修饰以产生替代抗体。在一些实施方案中,(例如)小鼠单克隆抗体的轻链和重链的恒定结构域可被取代为:1)(例如)人抗体的那些区以产生嵌合抗体或2)非免疫球蛋白多肽以产生融合抗体。在一些实施方案中,所述恒定区被截短或去除以便产生单克隆抗体的所需的抗体片段。可变区的定点或高密度诱变可用于优化单克隆抗体的特异性、亲和力等。
在一些实施方案中,针对人FOLR1的单克隆抗体是人源化抗体。在一些实施方案中,人源化抗体是表面重构的抗体。在某些实施方案中,当施用至人受试者时,这类抗体在治疗上用于减少抗原性和HAMA(人抗小鼠抗体)反应。可使用本领域已知的不同技术来产生人源化抗体。在某些替代实施方案中,FOLR1的抗体是人抗体。
可使用本领域中已知的各种技术来直接制备人抗体。可生成体外免疫的或从产生针对靶标抗原的抗体的免疫个体分离的永生化人B淋巴细胞(参见,例如,Cole等,Monoclonal Antibodies and Cancer Therapy,Alan R.Liss,第77页(1985);Boemer等,1991,J.Immunol.,147(1):86-95;以及美国专利5,750,373)。此外,所述人抗体可选自噬菌体文库,其中所述噬菌体文库表达人抗体,如(例如)以下中所描述:Vaughan等,1996,Nat.Biotech.,14:309-314;Sheets等,1998,Proc.Nat’l.Acad.Sci.,95:6157-6162;Hoogenboom和Winter,1991,J.Mol.Biol.,227:381;以及Marks等,1991,J.Mol.Biol.,222:581)。还在美国专利号5,969,108、6,172,197、5,885,793、6,521,404;6,544,731;6,555,313;6,582,915;6,593,081;6,300,064;6,653,068;6,706,484;以及7,264,963;以及Rothe等,2007,J.Mol.Bio.,doi:10.1016/j.jmb.2007.12.018(所述文献各自以引用的方式整体并入本文)中描述了用于抗体噬菌体文库的产生和使用的技术。亲和力成熟策略和链改组策略(Marks等,1992,Bio/Technology 10:779-783,以引用的方式整体并入)是本领域已知的并且可用于产生高亲和力人抗体。
还可在含有人免疫球蛋白基因座的转基因小鼠中来制备人源化抗体,在免疫时所述小鼠能够在不产生内源性免疫球蛋白的情况下产生人抗体的全部谱系。此方法描述于美国专利5,545,807;5,545,806;5,569,825;5,625,126;5,633,425;以及5,661,016中。
本发明还涵盖特异性地识别FOLR1的双特异性抗体。双特异性抗体是能够特异性地识别和结合至少两种不同表位的抗体。所述不同表位可在相同分子(例如,相同FOLR1)内或在不同分子上,以使得(例如)两种抗体均可特异性地识别和结合FOLR1以及,例如,1)白细胞上的效应分子如T细胞受体(例如CD3)或Fc受体(例如CD64、CD32或CD16)或2)如在以下详细描述的细胞毒性剂。
本发明的多肽可以是重组多肽、天然多肽或合成多肽,包括针对人FOLR1的抗体或其片段。
可进一步修饰多肽和类似物以便包含非蛋白质通常部分的另外化学部分。这些衍生的部分可改善蛋白质的溶解度、生物半衰期或吸收。所述部分还可减少或消除蛋白质的任何希望的副作用等。关于那些部分的综述可在REMINGTON'S PHARMACEUTICAL SCIENCES,第20版,Mack Publishing Co.,Easton,PA(2000)中找到。
本领域已知的用于纯化抗体和其它蛋白质的方法还包括,例如,美国专利公布号2008/0312425、2008/0177048以及2009/0187005中所描述的那些,所述专利各自特此以引用的方式整体并入本文。
III.免疫偶联物
本文还描述用于施用偶联物(本文还被称为免疫偶联物)的方法,所述偶联物包含与药物或前药连接或偶联的如本文所公开的抗FOLR1抗体、抗体片段以及它们的功能等效物。适合的药物或前药是本领域已知的。药物或前药可以是细胞毒性剂。在本发明的细胞毒性偶联物中使用的细胞毒性剂可为导致细胞的死亡或诱导细胞死亡或以某种方式降低细胞活力的任何化合物,并且包括,例如,美登木素和美登木素类似物。其它适合的细胞毒性剂是,例如,苯并二氮卓、紫杉烷类、CC-1065和CC-1065类似物、倍癌霉素和倍癌霉素类似物、烯二炔类(如卡奇霉素)、多拉司他汀以及多拉司他汀类似物(包括奥利斯他汀)、托马霉素衍生物、来普霉素(leptomycin)衍生物、甲氨蝶呤、顺铂、卡铂、道诺霉素(daunorubicin)、阿霉素(doxorubicin)、长春新碱(vincristine)、长春花碱(vinblastine)、美法仑(melphalan)、丝裂霉素(mitomycin)C、苯丁酸氮芥(chlorambucil)以及吗啉代阿霉素(morpholino doxorubicin)。
这类偶联物可以通过使用连接基以便将药物或前药连接至抗体或功能等效物来制备。适合的连接基是本领域熟知的并且包括(例如)二硫基、硫醚基、酸不稳定性基团、光不稳定性基团、肽酶不稳定性基团以及酯酶不稳定性基团。
药物或前药可(例如)通过二硫键连接至抗FOLR1抗体或其片段。接头分子或交联剂包括可与抗FOLR1抗体或其片段反应的反应性化学基团。用于与细胞结合剂反应的反应性化学基团可以是N-琥珀酰亚胺酯和N-磺基琥珀酰亚胺酯。此外,接头分子包含反应性化学基团,所述反应性化学基团可以是可以与药物反应以形成二硫键的二硫代吡啶基。接头分子包括,例如,3-(2-吡啶基二硫代)丙酸N-琥珀酰亚胺酯(SPDP)(参见,例如,Carlsson等,Biochem.J.,173:723-737(1978))、4-(2-吡啶基二硫代)丁酸N-琥珀酰亚胺酯(SPDB)(参见,例如,美国专利号4,563,304)、4-(2-吡啶基二硫代)2-磺基丁酸N-琥珀酰亚胺酯(磺基-SPDB)(参见美国公布号20090274713)、4-(2-吡啶基二硫代)戊酸N-琥珀酰亚胺酯(SPP)(参见,例如CAS登录号341498-08-6)、2-亚氨基硫烷或乙酰基琥珀酸酐。例如,抗体或细胞结合剂可以用交联剂进行修饰并且然后使由此产生的含有游离或受保护的硫醇基的抗体或细胞结合剂与含有二硫键或硫醇基的美登木素反应以产生偶联物。所述偶联物可以通过色谱法进行纯化,所述色谱法包括但不限于HPLC、尺寸排阻、吸附、离子交换和亲和捕捉、渗析或切向流过滤。
在本发明的另一方面,抗FOLR1抗体经由二硫键和聚乙二醇间隔基连接至细胞毒性药物,从而增强免疫偶联物的效力、溶解度或功效。这类可裂解的亲水性接头在WO2009/0134976中进行描述。这种接头设计的另外益处是抗体-药物偶联物的所需的高单体比和最小聚集。在这方面具体涵盖经由二硫基(-S-S-)连接的细胞结合剂与药物的偶联物,所述二硫基带有聚乙二醇间隔基((CH2CH2O)n=1-14),其中描述了药物负载在2至8的窄范围,其显示对癌细胞相对高效力的生物活性并且具有高偶联产率和高单体比的所需生物化学特性,同时具有最小蛋白质聚集。
还可制备具有不可裂解的接头的抗体-美登木素偶联物。这类交联剂在本领域中有所描述(参见美国公布号20050169933)并且包括但不限于,4-(马来酰亚胺基甲基)环己烷羧酸N-琥珀酰亚胺酯(SMCC)。在一些实施方案中,如文献中所描述的将抗体用交联剂如4-(N-马来酰亚胺基甲基)-环己烷-1-羧酸琥珀酰亚胺酯(SMCC)、磺基-SMCC、马来酰亚胺基苯甲酰基-N-羟基琥珀酰亚胺酯(MBS)、磺基-MBS或碘乙酸琥珀酰亚胺酯进行修饰,以引入1-10个反应性基团(Yoshitake等,Eur.J.Biochem.,101:395-399(1979);Hashida等,J.Applied Biochem.,56-63(1984);以及Liu等,Biochem.,18:690-697(1979))。使经修饰的抗体然后与含有硫醇的美登木素衍生物反应以产生偶联物。偶联物可以通过经由Sephadex G25柱的凝胶过滤或通过渗析或切向流过滤来进行纯化。经修饰的抗体用含有硫醇的美登木素(1至2摩尔当量/马来酰亚胺基)进行处理并且抗体-美登木素偶联物通过经由Sephadex G-25柱的凝胶过滤、陶瓷羟基磷灰石柱色谱法、渗析或切向流过滤或其方法的组合来进行纯化。通常,平均每个抗体连接1-10个美登木素。一种方法是用4-(N-马来酰亚胺基甲基)-环己烷-1-羧酸琥珀酰亚胺酯(SMCC)修饰抗体以便引入马来酰亚胺基,接着经修饰的抗体与含有硫醇的美登木素反应以得到硫醚连接的偶联物。再次得到具有每个抗体分子1至10个药物分子的偶联物。以相同方式制备抗体、抗体片段以及其它蛋白质的美登木素偶联物。
在本发明的另一方面,FOLR1抗体通过PEG间隔基的中间性经由不可裂解的键连接至药物。包含在药物与抗FOLR1抗体或片段之间形成接头的亲水性PEG链的适合的交联剂也是本领域已知的,或是商业上可获得的(例如,来自Quanta Biodesign,Powell,Ohio)。适合的含有PEG的交联剂还可以使用本领域技术人员已知的标准合成化学技术从商业上可获得的PEG本身来合成。可以通过在美国专利公布20090274713中和在WO2009/0134976中详细描述的方法使药物与含有双功能PEG的交联剂反应以得到下式的化合物:Z–Xl–(–CH2–CH2–O–)n–Yp–D,所述化合物可以然后与细胞结合剂反应以提供偶联物。或者,所述细胞结合可以用双功能PEG交联剂进行修饰以便引入硫醇反应性基团(如马来酰亚胺或卤代乙酰胺),所述硫醇反应性基团可以然后用含有硫醇的美登木素进行处理以提供偶联物。在另一种方法中,所述细胞结合可以用双功能PEG交联剂进行修饰以便引入硫醇部分,所述硫醇部分然后可以用硫醇反应性美登木素(如携带马来酰亚胺或卤代乙酰胺的美登木素)进行处理以提供偶联物。
适合的含有PEG的接头的实例包括具有用于与抗FOLR1抗体或其片段反应的N-琥珀酰亚胺酯部分或N-磺基琥珀酰亚胺酯部分以及用于与化合物反应的基于马来酰亚胺基或卤代乙酰基的部分的接头。可通过本文所描述的方法将PEG间隔基并入本领域已知的任何交联剂中。
在一些实施方案中,所述接头是含有如例如在美国专利公布号2012/0282282中所描述的至少一个带电荷基团的接头,所述专利的内容以引用的方式完全并入本文。在一些实施方案中,所述带电荷的或预带电荷(pro-charged)的交联剂是含有磺酸酯、磷酸酯、羧基或季胺取代基的那些,所述取代基显著增加经修饰的细胞结合剂和细胞结合剂-药物偶联物的溶解度,尤其是对于连接有2至20种药物/抗体的单克隆抗体-药物偶联物。从含有预带电荷的部分的接头制备的偶联物在偶联物在细胞中代谢之后将产生一个或多个带电荷的部分。在一些实施方案中,所述接头选自由以下组成的组:4-(2-吡啶基二硫代)-2-磺基戊酸N-琥珀酰亚胺酯(磺基-SPP)和4-(2-吡啶基二硫代)-2-磺基丁酸N-琥珀酰亚胺酯(磺基-SPDB)。
本文所公开的许多接头在美国专利公布号2005/0169933、2009/0274713和2012/0282282以及在WO2009/0134976中进行详细描述,所述专利的内容以引用的方式整体并入本文。
本发明包括以下方面,其中约2至约8个药物分子(“药物负载”)(例如,美登木素)连接至抗FOLR1抗体或其片段。如本文所用,“药物负载”是指可以连接至细胞结合剂(例如,抗FOLR1抗体或其片段)的药物分子(例如,美登木素)的数目。一方面,可以连接至细胞结合剂的药物分子的数目可以平均为约2至约8个(例如,1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8.0、8.1)。可使用N2’-脱乙酰基N2’-(3-巯基-1-氧代丙基)-美登素(DM1)和N2’-脱乙酰基-N2’-(4-巯基-4-甲基-1-氧代戊基)美登素(DM4)。
因此,一方面,免疫偶联物包含每个抗体1个美登木素。另一方面,免疫偶联物包含每个抗体2个美登木素。另一方面,免疫偶联物包含每个抗体3个美登木素。另一方面,免疫偶联物包含每个抗体4个美登木素。另一方面,免疫偶联物包含每个抗体5个美登木素。另一方面,免疫偶联物包含每个抗体6个美登木素。另一方面,免疫偶联物包含每个抗体7个美登木素。另一方面,免疫偶联物包含每个抗体8个美登木素。
一方面,免疫偶联物包含每个抗体约1至约8个美登木素。另一方面,免疫偶联物包含每个抗体约2至约7个美登木素。另一方面,免疫偶联物包含每个抗体约2至约6个美登木素。另一方面,免疫偶联物包含每个抗体约2至约5个美登木素。另一方面,免疫偶联物包含每个抗体约3至约5个美登木素。另一方面,免疫偶联物包含每个抗体约3至约4个美登木素。
一方面,包含免疫偶联物的组合物具有每个抗体平均连接约2至约8个(例如,1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8.0、8.1)个药物分子(例如,美登木素)。一方面,包含免疫偶联物的组合物具有每个抗体平均约1至约8个药物分子(例如,美登木素)。一方面,包含免疫偶联物的组合物具有每个抗体平均约2至约7个药物分子(例如,美登木素)。一方面,包含免疫偶联物的组合物具有每个抗体平均约2至约6个药物分子(例如,美登木素)。一方面,包含免疫偶联物的组合物具有每个抗体平均约2至约5个药物分子(例如,美登木素)。一方面,包含免疫偶联物的组合物具有每个抗体平均约3至约5个药物分子(例如,美登木素)。一方面,包含免疫偶联物的组合物具有每个抗体平均约3至约4个药物分子(例如,美登木素)。
一方面,包含免疫偶联物的组合物具有每个抗体平均连接约2±0.5、约3±0.5、约4±0.5、约5±0.5、约6±0.5、约7±0.5或约8±0.5个药物分子(例如,美登木素)。一方面,包含免疫偶联物的组合物具有每个抗体平均约3.5±0.5个药物分子(例如,美登木素)。
抗FOLR1抗体或其片段可以通过使双功能交联试剂与所述抗FOLR1抗体或其片段反应来进行修饰,从而导致接头分子共价连接至抗FOLR1抗体或其片段。如本文所用,“双功能交联试剂”是将细胞结合剂共价连接至药物(如本文所描述的药物)的任何化学部分。在另一种方法中,连接部分的一部分由药物提供。在这方面,药物包含为用于将细胞结合剂连接至药物的更大接头分子的一部分的连接部分。例如,为了形成美登木素DM1,对在美登素的C-3羟基处的侧链进行修饰以具有游离的巯基(SH)。美登素的这种硫醇化的形式可以与经修饰的细胞结合剂反应以形成偶联物。因此,最终接头是由两种组分组装,其中之一由交联试剂提供,而另一者由来自DM1的侧链提供。
药物分子还可以通过中间载体分子如血清白蛋白而连接至抗体分子。
如本文所用,表达“连接至细胞结合剂”或“连接至抗FOLR1抗体或其片段”是指包含经由适合的连接基结合至细胞结合剂抗FOLR1抗体或片段的至少一种药物衍生物或其前体的偶联物分子。示例性连接基是SPDB或磺基-SPDB。
在某些实施方案中,在本发明中有用的细胞毒性剂是美登木素和美登木素类似物。适合的美登木素的实例包括美登醇和美登醇类似物的酯。包括抑制微管形成并且对哺乳动物细胞具有高毒性的任何药物,如美登醇和美登醇类似物。
适合的美登醇酯的实例包括具有修饰的芳香环的那些和具有在其它位置处的修饰的那些。这类适合的美登木素在美国专利号4,424,219;4,256,746;4,294,757;4,307,016;4,313,946;4,315,929;4,331,598;4,361,650;4,362,663;4,364,866;4,450,254;4,322,348;4,371,533;5,208,020;5,416,064;5,475,092;5,585,499;5,846,545;6,333,410;7,276,497以及7,473,796中进行公开。
在某些实施方案中,本发明的免疫偶联物利用含有硫醇的美登木素(DM1)(正式称为N2’-脱乙酰基-N2’-(3-巯基-1-氧代丙基)-美登素)作为细胞毒性剂。DM1由以下结构式(I)表示:
在另一个实施方案中,本发明的偶联物利用含有硫醇的美登木素N2’-脱乙酰基-N2’(4-甲基-4-巯基-1-氧代戊基)-美登素(例如,DM4)作为细胞毒性剂。DM4由以下结构式(II)表示:
另一种包含含有位阻硫醇键的侧链的美登木素是N2’-脱乙酰基-N-2’(4-巯基-1-氧代戊基)-美登素(称为DM3),由以下结构式(III)表示:
美国专利号5,208,020和7,276,497中所教导的每一种美登木素也可以用于本发明的偶联物中。在这方面,5,208,020和7,276,697的全部公开内容以引用的方式并入本文。
美登木素上的许多位置可以用作化学连接所述连接部分的位置。例如,具有羟基的C-3位置、用羟甲基修饰的C-14位置、用羟基修饰的C-15位置以及具有羟基的C-20位置都预期是有用的。在一些实施方案中,C-3位置用作化学连接所述连接部分的位置,并且在一些具体实施方案中,美登醇的C-3位置用作化学连接所述连接部分的位置。
以下示出一些偶联物的结构表示:
本发明中还包括由任何上述结构描绘的任何化合物或偶联物的任何立体异构体及其混合物。
用于产生这类抗体-美登木素偶联物的一些描述提供于美国专利号6,333,410、6,441,163、6,716,821以及7,368,565中,所述专利各自整体并入本文。
一般来说,可以将抗体在水缓冲液中的溶液与摩尔过量的携带反应性基团的具有二硫化物部分的美登木素一起孵育。反应混合物可以通过添加过量的胺(如乙醇胺、牛磺酸)来淬灭。美登木素-抗体偶联物然后可以通过凝胶过滤来纯化。
每个抗体分子所结合的美登木素分子的数目可以通过用分光光度法测量在252nm和280nm下吸光度的比率来确定。美登木素分子/抗体的平均数目可以是例如1-10或2-5。美登木素分子/抗体的平均数目可以是例如约3至约4。美登木素分子/抗体的平均数目可以是约3.5。
对于抗体与美登木素或其他药物的偶联物,可体外评价它们抑制各种非需要的细胞系的增殖的能力。例如,细胞系如人淋巴瘤细胞系Daudi和人淋巴瘤细胞系Ramos可以容易地用于评估这些化合物的细胞毒性。待评估的细胞可以暴露于化合物4至5天并且通过已知方法以直接测定来测量细胞的存活分数。然后可以从所述测定的结果计算IC50值。
根据本文所描述的一些实施方案,免疫偶联物可以被内化至细胞中。因此当免疫偶联物被表达FOLR1的细胞吸收或内化时,它可发挥治疗作用。在一些具体实施方案中,免疫偶联物包含通过可裂解的接头连接至细胞毒性剂的抗体、抗体片段或多肽,并且所述细胞毒性剂从所述抗体、抗体片段或多肽裂解,其中它被表达FOLR1的细胞内化。
在一些实施方案中,所述免疫偶联物能够减小肿瘤体积。例如,在一些实施方案中,用免疫偶联物治疗产生小于约50%、小于约45%、小于约40%、小于约35%、小于约30%、小于约25%、小于约20%、小于约15%、小于约10%或小于约5%的%T/C。在一些特定实施方案中,所述免疫偶联物可减小KB、OVCAR-3、IGROV-1和/或OV-90异种移植物模型中的肿瘤大小。在一些实施方案中,所述免疫偶联物能够抑制转移。
III.施用FOLR1结合剂的方法
本发明的FOLR1结合剂(包括抗体、免疫偶联物以及多肽)在多种应用中有用,包括但不限于,治疗性治疗方法,如癌症的治疗。在某些实施方案中,所述药剂适用于抑制肿瘤生长、诱导分化、抑制转移、减小肿瘤体积和/或降低肿瘤的致瘤性。所述使用方法可以是体内方法。
根据本文所述的方法,所述FOLR1结合剂可以特定剂量施用。例如,所述FOLR1结合剂(例如,IMGN853)可以约0.15mg/kg至约7mg/kg的剂量施用,其中千克体重被调整为理想体重(IBW)、瘦体重(LBW)或调整的理想体重(AIBW或ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约3.0mg/kg至约6.0mg/kg的剂量施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约3.3mg/kg至约6.0mg/kg的剂量施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约0.15mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约0.5mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约1.0mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约1.1mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约1.5mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约1.8mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约2.0mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约2.5mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约2.8mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约3.0mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约3.3mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约3.75mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约4.2mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约4.5mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约4.8mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约5.0mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约5.5mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约5.6mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约6.0mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约6.1mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约6.2mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约6.3mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约6.4mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约6.5mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约6.6mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约6.7mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约6.8mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约6.9mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)以约7.0mg/kg施用,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,千克体重被调整为AIBW(ADJ)。
此外,所述FOLR1结合剂可以特定剂量间隔施用。例如,所述FOLR1结合剂可从约一周四次至约每四周一次施用。因此,在一些实施方案中,所述FOLR1结合剂约每三周一次施用。在一些实施方案中,所述FOLR1结合剂约每两周半一次施用。在一些实施方案中,所述FOLR1结合剂约每两周一次施用。在一些实施方案中,所述FOLR1结合剂约每十天一次施用。在一些实施方案中,所述FOLR1结合剂约每周一次施用。
所述FOLR1结合剂还可在约3周(即约21天)周期内施用。例如,所述FOLR1结合剂可在约3周内施用两次。因此,在一些实施方案中,所述FOLR1结合剂可在21天周期的约第1天和第8天施用。在其他实施方案中,所述FOLR1结合剂可在约3周内施用三次。因此,在一些实施方案中,所述FOLR1结合剂可在21天周期的约第1天、第8天和第15天施用。
所述FOLR1结合剂还可在约4周(即约28天)周期内施用。例如,所述FOLR1结合剂可在约4周内施用三次。因此,在一些实施方案中,所述FOLR1结合剂可在28天周期的约第1天、第8天和第15天施用。
根据本文所述的方法,所述FOLR1结合剂可以特定剂量施用。例如,所述FOLR1结合剂(例如,IMGN853)可按四周计划表以约0.15mg/kg至约7mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约3.0mg/kg至约6.0mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约3.3mg/kg至约6.0mg/kg的剂量一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约0.15mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约0.5mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约1.0mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约1.1mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约1.5mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约1.8mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约2.0mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约2.5mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约2.8mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约3.0mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约3.3mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约3.75mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约4.2mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约4.5mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约4.8mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约5.0mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约5.5mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约5.6mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约6.0mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约6.1mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约6.2mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约6.3mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约6.4mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约6.5mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约6.6mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约6.7mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约6.8mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约6.9mg/kg一周一次施用持续三周。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约7.0mg/kg一周一次施用持续三周。
根据本文所述的方法,所述FOLR1结合剂(例如,IMGN853)可按四周计划表以约0.15mg/kg至约7mg/kg的剂量一周一次施用持续三周,其中千克体重被调整为理想体重(IBW)、瘦体重(LBW)或调整的理想体重(AIBW或ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约3.0mg/kg至约6.0mg/kg的剂量一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约3.3mg/kg至约6.0mg/kg的剂量一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约0.15mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约0.5mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约1.0mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约1.1mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约1.5mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约1.8mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约2.0mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约2.5mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约2.8mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约3.0mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约3.3mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约3.75mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约4.2mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约4.5mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约4.8mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约5.0mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约5.5mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约5.6mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约6.0mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约6.1mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约6.2mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约6.3mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约6.4mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约6.5mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约6.6mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约6.7mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约6.8mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约6.9mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,所述FOLR1结合剂(例如,IMGN853)按四周计划表以约7.0mg/kg一周一次施用持续三周,其中千克体重被调整为IBW、LBW或AIBW(ADJ)。在一些实施方案中,千克体重被调整为AIBW(ADJ)。
在一些实施方案中,所述FOLR1结合剂可以产生特定Cmax的剂量施用。例如,在一些实施方案中,所述FOLR1结合剂以产生约110至约160μg/mL的Cmax的剂量施用。在一些实施方案中,所述FOLR1结合剂以产生约110至约150μg/mL的Cmax的剂量施用。在一些实施方案中,所述FOLR1结合剂以产生约110至约140μg/mL的Cmax的剂量施用。在一些实施方案中,所述FOLR1结合剂以产生约120至约160μg/mL的Cmax的剂量施用。在一些实施方案中,所述FOLR1结合剂以产生约120至约150μg/mL的Cmax的剂量施用。在一些实施方案中,所述FOLR1结合剂以产生约120至约140μg/mL的Cmax的剂量施用。在一些实施方案中,所述FOLR1结合剂以产生约90至约160μg/mL的Cmax的剂量施用。在一些实施方案中,所述FOLR1结合剂以产生约90至约150μg/mL的Cmax的剂量施用。在一些实施方案中,所述FOLR1结合剂以产生约90至约140μg/mL的Cmax的剂量施用。在一些实施方案中,所述FOLR1结合剂以产生约100至约160μg/mL的Cmax的剂量施用。在一些实施方案中,所述FOLR1结合剂以产生约100至约150μg/mL的Cmax的剂量施用。在一些实施方案中,所述FOLR1结合剂以产生约100至约140μg/mL的Cmax的剂量施用。
在某些实施方案中,所述FOLR1结合剂可以产生特定AUC的剂量施用。例如,在某些实施方案中,所述FOLR1结合剂以产生不超过2785hr·μg/mL的AUC0-24的剂量施用。在某些实施方案中,所述FOLR1结合剂以产生不超过2741hr·μg/mL的AUC0-24的剂量施用。在某些实施方案中,所述FOLR1结合剂以产生不超过2700hr·μg/mL的AUC0-24的剂量施用。在一些实施方案中,施用产生约1000-3500hr·μg/mL的AUC0-24。在一些实施方案中,施用产生约1000-3000hr·μg/mL的AUC0-24。在一些实施方案中,施用产生约1000-2785hr·μg/mL的AUC0-24。在一些实施方案中,施用产生约1000-2741hr·μg/mL的AUC0-24。在一些实施方案中,施用产生约1000-2700hr·μg/mL的AUC0-24。在一些实施方案中,施用产生约1000-2500hr·μg/mL的AUC0-24。在一些实施方案中,施用产生不超过1500-3500hr·μg/mL的AUC0-24。在一些实施方案中,施用产生不超过1500-3000hr·μg/mL的AUC0-24。在一些实施方案中,施用产生不超过1500-2785hr·μg/mL的AUC0-24。在一些实施方案中,施用产生不超过1500-2741hr·μg/mL的AUC0-24。在一些实施方案中,施用产生不超过1500-2700hr·μg/mL的AUC0-24。在一些实施方案中,施用产生约1500-2500hr·μg/mL的AUC0-24。
在某些实施方案中,用FOLR1结合剂或拮抗剂(例如,抗FOLR1抗体)治疗的疾病是癌症。在某些实施方案中,所述癌症以FOLR1结合剂(例如,抗体)所结合的表达FOLR1的细胞为特征。在某些实施方案中,肿瘤过度表达人FOLR1。
本发明提供治疗癌症的方法,所述方法包括向受试者(例如,需要治疗的受试者)施用治疗有效量的FOLR1结合剂。可通过本发明涵盖的方法治疗的癌症包括但不限于赘生物、肿瘤、转移或以不受控制的细胞生长为特征的任何疾病或病症。所述癌症可以是原发性或转移性癌症。可通过本发明涵盖的方法治疗的癌症的具体实例包括但不限于,卵巢癌、肺癌、结肠直肠癌、胰腺癌、肝癌、乳腺癌、脑癌、肾癌、前列腺癌、胃肠癌、黑色素瘤、宫颈癌、膀胱癌、成胶质细胞瘤、子宫内膜癌以及头颈癌。在某些实施方案中,所述癌症是卵巢癌。在某些实施方案中,所述癌症是子宫内膜癌。在某些实施方案中,所述癌症是肺癌。在某些实施方案中,所述肺癌是非小细胞肺癌。在某些实施方案中,所述非小细胞肺癌是肺腺癌。
在一些实施方案中,癌症是表达FOLR1(多肽或核酸)的癌症。在一些实施方案中,向具有增加的FOLR1表达水平的患者施用所述FOLR1结合剂,例如如在美国公布申请号2012/0282175或国际公布申请号WO 2012/135675中所描述,所述申请两者均以引用的方式整体并入本文。因此,在一些实施方案中,FOLR1表达通过免疫组织化学(IHC)来测量并且通过与展示确定分数的对照(例如,校准的对照)进行比较来给出染色强度分数和/或染色均匀度分数(例如,如果强度与3级校准的对照相当,则将3的强度分数给予测试样本,或者如果强度与2级校准的对照相当,则将2的强度给予测试样本)。异质或均质的染色均匀度也指示增加的FOLR1表达。染色强度和染色均匀度分数可单独或组合(例如,2均质、2异质、3均质、3异质等)使用。在另一个实例中,FOLR1表达的增加可通过检测相对于对照值(例如,在来自未患有癌症或患有FOLR1值未升高的癌症的受试者的组织或细胞中的表达水平)至少2倍、至少3倍或至少5倍)增加来测定。
在一些实施方案中,所述癌症是通过IHC测定以1异质或更高的水平表达FOLR1的癌症。在一些实施方案中,所述癌症是通过IHC测定以2异质或更高的水平表达FOLR1的癌症。在一些实施方案中,所述癌症是通过IHC测定以3异质或更高的水平表达FOLR1的癌症。在一些实施方案中,所述癌症是通过IHC测定以2异质或更高的水平表达FOLR1的肺癌。在一些实施方案中,所述癌症是通过IHC测定以3异质或更高的水平表达FOLR1的肺癌。在一些实施方案中,所述癌症是通过IHC测定以2异质或更高的水平表达FOLR1的卵巢癌。在一些实施方案中,所述癌症是通过IHC测定以3异质或更高的水平表达FOLR1的卵巢癌。在一些实施方案中,所述癌症是通过IHC测定以1异质或更高的水平表达FOLR1的子宫内膜癌。在一些实施方案中,所述癌症是通过IHC测定以2异质或更高的水平表达FOLR1的子宫内膜癌。
在某些实施方案中,抑制肿瘤生长的方法包括向受试者施用治疗有效量的FOLR1结合剂。在某些实施方案中,受试者是人。在某些实施方案中,所述受试者具有肿瘤或肿瘤已去除。
此外,本发明提供一种降低受试者中的肿瘤的致瘤性的方法,所述方法包括向所述受试者施用治疗有效量的FOLR1结合剂。在某些实施方案中,所述肿瘤包含癌干细胞。在某些实施方案中,肿瘤中癌症干细胞的频率通过施用所述药剂降低。
本发明还提供包含一种或多种本文所描述的FOLR1结合剂的药物组合物。在某些实施方案中,所述药物组合物还包含药学上可接受的媒介物。这些药物组合物可用于抑制肿瘤生长和治疗人患者中的癌症。
在某些实施方案中,通过将本发明的纯化的抗体或药剂与药学上可接受的媒介物(例如载体、赋形剂)组合来制备制剂以供储存和使用(Remington,The Science and Practice of Pharmacy第20版Mack Publishing,2000)。适合的药学上可接受的媒介物包括,但不限于,无毒缓冲剂,如磷酸、柠檬酸以及其它有机酸;盐,如氯化钠;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(例如,十八烷基二甲基苄基氯化铵;氯化六甲双铵;氯化苯甲烷铵;氯化苄乙氧铵;苯酚、丁醇或苄醇;对羟基苯甲酸烷基酯,如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;邻苯二酚;间苯二酚;环己醇;3-戊醇和间甲酚);低分子量多肽(例如,小于约10个氨基酸残基);蛋白质如血清白蛋白、明胶或免疫球蛋白;亲水聚合物如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;碳水化合物类,如单糖、二糖、葡萄糖、甘露糖或糊精;螯合剂,如EDTA;糖类,如蔗糖、甘露糖醇、海藻糖或山梨糖醇;成盐反离子,如钠;金属络合物(例如Zn-蛋白质络合物);以及非离子型表面活性剂,如TWEEN或聚乙二醇(PEG)。
本文描述的药物组合物可以任何数量的方式进行施用以用于局部或全身治疗。施用可以是局部(如施用至粘膜,包括阴道递送和直肠递送),如透皮贴剂、软膏剂、洗剂、乳膏剂、凝胶剂、滴剂、栓剂、喷雾剂、液体和粉末;肺部(例如,通过吸入或吹入粉末或气雾剂,包括通过喷雾器;气管内的、鼻内的、表皮的以及透皮的);口服;或肠胃外,包括静脉内、动脉内、皮下、腹膜内或肌内注射或输注;或颅内(例如,鞘内或心室内)施用。在一些具体实施方案中,施用是静脉内。
在药物组合制剂或给药方案中,抗体或免疫偶联物可与第二化合物组合作为组合疗法。在一些实施方案中,第二化合物是类固醇。在一些实施方案中,所述方法涵盖施用类固醇和免疫偶联物,相较于单独施用免疫偶联物其产生头痛的减少。
类固醇可与免疫偶联物同时、在施用免疫偶联物之前和/或在施用免疫偶联物之后施用。在一些实施方案中,类固醇在施用免疫偶联物之前约一周、约五天、约三天、约两天或约一天或24小时内施用。在一些实施方案中,类固醇在施用免疫偶联物的一天内施用。在一些实施方案中,多次施用类固醇。在一些实施方案中,类固醇在施用免疫偶联物之前约一天和在与施用免疫偶联物同一天施用。类固醇可经由任何数量的方式来施用,所述方式包括例如局部、肺部、口服、胃肠外或颅内施用。在一些实施方案中,施用是口服。在一些实施方案中,施用是静脉内。在一些实施方案中,施用是口服和静脉内两者。
在药物组合制剂或给药方案中,抗体或免疫偶联物还可与预防或治疗头痛的止痛剂或其他药剂组合作为组合疗法。例如,可除了施用抗体或免疫偶联物之外施用对乙酰氨基酚(acetaminophin)和/或苯海拉明。止痛剂可在施用免疫偶联物之前、同时或之后施用并且可经由任何适当的施用途径。在一些实施方案中,口服施用止痛剂。
在一些实施方案中,所述方法包括施用为抗体或免疫偶联物的第一化合物、为类固醇的第二化合物以及为止痛剂的第三化合物。在一些实施方案中,所述方法包括施用为IMGN388的第一化合物、为地塞米松的第二化合物以及为对乙酰氨基酚和/或苯海拉明的第三化合物。
在药物组合制剂或给药方案中,抗体或免疫偶联物可与具有抗癌特性的第二化合物组合作为组合疗法。所述药物组合制剂或给药方案的第二化合物可对所述组合的ADC具有互补活性以使得它们不会不利地影响彼此。还提供包含FOLR1结合剂和第二抗癌剂的药物组合物。
***
本公开的实施方案可进一步通过参考以下非限制性实施例来限定,所述实施例详细描述了本公开的某些抗体的制备和用于使用本公开的抗体的方法。对于本领域技术人员将显而易见的是:可在不背离本公开的范围的情况下实践对材料与方法的许多修改。
实施例
应理解,本文所描述的实施例和实施方案仅是出于说明的目的,并且根据其的各种修改或变化将建议给本领域技术人员并且包括在本申请的精神和范围内。
实施例1
人癌症患者中的IMGN853给药试验
IMGN853是包含叶酸受体1(FOLR1)结合抗体和强效美登木素DM4的抗体-药物偶联物(ADC)。IMGN853先前已在国际公布申请号WO 2011/106528、WO 2012/135675和WO 2012/138749以及美国公布申请号2012/0009181、2012/0282175以及2012/0282282中进行了描述,所述申请各自以引用的方式整体并入本文。IMGN853是huMov19-sSPDB-DM4,并且huMov19抗体包含具有SEQ ID NO:3的氨基酸序列的可变重链和具有SEQ ID NO:5的氨基酸序列的可变轻链。FOLR1蛋白在许多实体肿瘤上,特别是上皮性卵巢癌(EOC)、子宫内膜癌、非小细胞肺癌(NSCLC)和透明细胞肾细胞癌上以升高的水平表达。
开始测定IMGN853的最大耐受剂量(MTD)和推荐的2期剂量(RP2D)以及评估其安全性、药物代谢动力学(PK)、药效学(PD)以及功效的研究。所述研究包括两个组成部分:加速的剂量滴定组成部分,其中向患有任何类型的表达FOLR1的难治性实体肿瘤(包括上皮性卵巢癌(EOC)和其他FOLR1阳性实体肿瘤)的患者施用IMGN853免疫偶联物;以及剂量递增组成部分。
对于所述研究的加速滴定部分,在每个21天(3周)周期的第1天静脉内(IV)给予IMGN853。已经在临床试验的加速部分中以在0.15至7.0mg/kg IMGN853范围内的七个剂量水平招募了二十九名患者,并且存在对23名患者当前可用的安全性数据。在最初4个剂量组中治疗的患者中不存在报道的任何等级的研究药物相关的AE。在高达5.0mg/kg的剂量下,IMGN853相关的AE是轻微至中度。在5.0与7.0mg/kg剂量水平下,10名患者中的4名以及5名患者中的5名分别报道了眼毒性。
表1:按照肿瘤类型招募
在23名患者中测量药物暴露并且发现总体上线性地增加,其中在≥2.0mg/kg剂量下具有大约5天的的半衰期。患有浆液性子宫内膜癌的一名患者在5mg/kg下也具有CA125反应和未确认的部分反应。患有卵巢癌的三名患者报道了确认的CA125反应(各一名在7mg/kg、5mg/kg下以及一名在3.3mg/kg下)。接受在大于或等于5.0mg/kg剂量下的IMGN853的患者在抗FOLR1免疫偶联物(例如,IMGN853)使用之前30至60分钟接受地塞米松,10mg IV(或类似的类固醇等效物)。
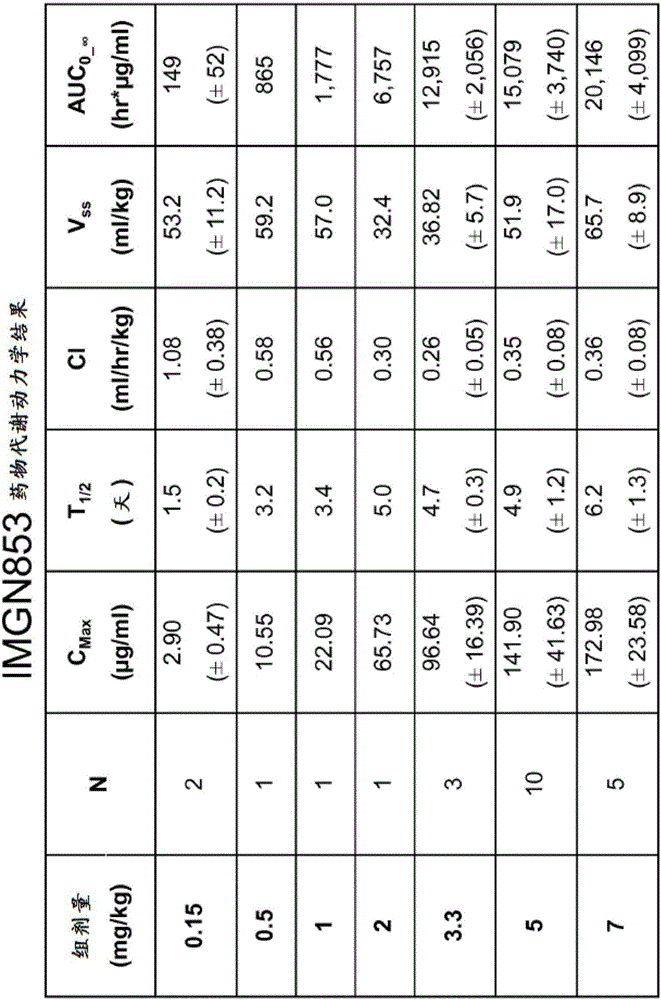
针对IMGN853 1期实验的周期1(仅每个患者的给药的第一周期)报道药物代谢动力学(PK)参数。(图1A和1B。)显示IMGN853的清除率在低剂量下是快速的(CL=1.1mL/hr/kg),其中半衰期是大约35.4小时或1.5天。清除率在更高剂量下降低(CL=0.4mL/her/kg),并且半衰期在≥2.0mg/kg的剂量下增加至约4天或约5天。显示暴露(AUC)和Cmax也在更高剂量下总体上增加。
在7.0mg/kg剂量下,所有5患者经历了眼毒性。报道一名患者具有被认为确实与研究治疗相关的3级剂量限制的点状角膜炎以及2级视力模糊。另外,存在一名患者各自具有3级、2级和1级视力模糊;所有事件被认为可能或确实与IMGN853治疗相关。因此,根据此施用计划表(即,每三周一次)的最大耐受剂量被认为超过7.0mg/kg剂量水平,并且保持在7.0mg/kg剂量水平下的所有患者被剂量降低至先前剂量水平(5.0mg/kg)并且在5mg/kg剂量下评估7名另外患者。与先前治疗的3名患者一起,将10名患者在5mg/kg的剂量下治疗。在5mg/kg水平下的总计10名患者之中,3名具有视力模糊,包括具有3级视力模糊的1名患者,并且2名患者具有角膜改变。其他相关3级不良事件包括升高的碱性磷酸酶和3级低磷血症。另外患者被招募至3.3mg/kg剂量水平,以进一步探索并确认在最初分配至此剂量的3名患者情况下观察到的安全性特征。当前在3.3mg/kg下治疗的另外6名患者的安全性审查正在进行并且IMGN853是良好耐受的。迄今为止,在3.3mg/kg剂量水平下治疗的九名患者中的三名报道了IMGN853相关AE,包括2级周围神经病变(1患者)、2级恶心、疲劳以及AST升高(1名患者),并且1名患者具有2级呕吐。
一旦确定MTD,所述研究将进行至剂量递增期。三个递增组将评估具有FOLR1蛋白质阳性的患者(1)铂抗性上皮性卵巢癌;(2)复发性或难治性上皮性卵巢癌,以及(3)复发性或难治性非小细胞肺癌(NSCLC)。组2和3将分别通过剂量前和剂量后肿瘤活检和/或通过FLT-PET成像具有IMGN853 PD评定。IMGN853将在至少3.3mg/kg的剂量下施用并且可包括5.0mg/kg或高达6.0mg/kg或甚至7.0mg/kg的剂量。最初,IMGN853应在1mg/min的速率下施用;在30分钟之后,如果良好耐受,速率可增加至3mg/min。如果在3mg/min下30分钟之后良好耐受,速率可增加至5mg/min。随后输注可在耐受的速率下递送。
对于在3.3mg/kg或更高下给药的所有IMGN853,将使用实施例2中所描述的方案纳入预防性类固醇治疗(例如,在需要IMGN853施用之前30至60分钟在10mg地塞米松IV(或类似的类固醇等效物)下纳入类固醇治疗并且在IMGN853施用之前推荐预防性苯海拉明HCl和对乙酰氨基酚)。重复周期直到(i)患者的疾病恶化,(ii)患者经历不可接受的毒性,(iii)患者撤出知情同意书,(iv)患者发展将阻碍进一步研究治疗的共病病状,或(v)患者由于非依从或管理原因中断。
使用RECIST和妇科癌症协作组(GCIG)标准(在适当时)评定反应。
实施例2
对于输注反应的基于IMGN853类固醇的预防
为了减小输注反应的可能性,可使用任何以下基于类固醇的预防方案。
(1)患者在抗FOLR1免疫偶联物(例如,IMGN853)施用之前接受地塞米松,10mg IV(或类似的类固醇等效物)30至60分钟。
(2)患者在抗FOLR1免疫偶联物(例如,IMGN853)施用之前接受地塞米松,10mg IV(或类似的类固醇等效物)和苯海拉明HCl(25-50mg IV或PO),有或无对乙酰氨基酚(325-650mg IV或PO)30至60分钟。推荐此预防方案且在听凭研究者的安排。
(3)患者在施用抗FOLR1免疫偶联物(例如,IMGN853)之前的那一天通过口BID接受地塞米松8mg(或类似的类固醇等效物)。在施用抗FOLR1免疫偶联物(例如,IMGN853)的当天,在抗FOLR1免疫偶联物(例如,IMGN853)施用之前30-60分钟,患者接受地塞米松,10mg IV(或类似的类固醇等效物)、苯海拉明HCl(25-50mg IV或PO),有或无对乙酰氨基酚(325-650mg IV或PO)。
(4)在输注类固醇(例如,地塞米松)之前24小时内口服施用。
实施例3
IMGN853暴露与眼毒性的关系
对于用在实施例1和2中描述的IMGN853方案治疗的每个患者,在每个周期内的不同时间点测量IMGN853的血浆浓度,在输注结束时开始且持续至第21天。药物代谢动力学(PK)参数分析鉴定了Cmax与眼毒性出现之间的明显关联,其通过角膜沉积和视敏度的损失来表征。如通过在最初24小时中曲线下面积(AUC0-24)所测量在早期暴露水平下也观察到统计上显著的关联。(参见图2A-2C。)
在3.3至7.0mg/kg组中,在Cmax值处于或高于147.7μg/ml的9/10患者中观察到眼毒性,由图2A中的虚线指示。Cmax值低于147.7μg/ml的患者未发展眼毒性。AUC0-24处于或高于2785hr*μg/ml的所有(9/9)患者(在图2B中由虚线指示)发展眼毒性,而低于其的没有一人具有任何眼毒性。在≥3.3mg/kg的剂量下观察到功效信号并且不与眼毒性的报道相关。具有活性信号的患者中的最低Cmax值是91.25μg/ml。
在24名患者用3.3mg/kg、5.0mg/kg或7.0mg/kg IMGN853治疗之后,使用Fisher精确检验,高于阈值的Cmax值与眼毒性相关(逆),p=0.00004。使用Fisher精确检验,高于2,741hr*μg/ml的阈值水平的AUC0-24值也与眼毒性相关(逆),p=0.00001。基于这些结果和使用标定时间和浓度值进行的计算,据测定Cmax大于约150μg/ml或AUC0-24值大于2785hr*μg/ml的患者最可能具有增加的眼毒性速率,并且具有活性信号的患者具有至少约90μg/mg的Cmax水平。开发策略来修改给药以便降低在每种剂量水平内观察到的可变性并且实现在每种患者体重下针对最佳功效和最小毒性的Cmax水平。
实施例4
IMGN853替代给药方法
如上文在实施例3中所描述,在所有剂量水平下观察到高于150μg/ml的Cmax值与高于2785hr*μg/ml的AUC0-24值之间的关联和眼毒性的发生。此外,初始PK参数分析证明,虽然Cmax随IMGN853的剂量成比例地增加,但存在剂量水平内的Cmax、AUC0-24和分布体积的显著变化(图3)。
Cmax的变化在5mg/kg组中特别显著,其中在10名患者中分析PK。在周期内不存在明显患者中Cmax变化,并且输注时间在患者之间是类似的并且不与Cmax变化相关。协变量分析证明重量与Cmax之间的关联。(图4)。
体积分布(Vss)指示生物制剂的血浆体积并且不会随重量线性增加。当Cmax值通过Vss标准化时,变化减少。这些数据表明探索除了基于总体重之外的替代给药方法可在组内产生更均匀的给药。为此,对于在3.3(n=3)、5.0(n=10)和7mg/kg(n=5)剂量组中治疗的所有患者使用替代给药计算估计Cmax值。将计算的Cmax值标准化为5mg/kg剂量水平并且与从总体重(TBW)给药获得的Cmax值进行比较。还考虑体表面积(BSA);然而,基于BSA给药的Cmax值降低Cmax,但变化仅受最小影响的并且仍然观察到体重与Cmax之间的正相关,但是在较小程度上。评估了三种另外替代配方:(1)理想体重(IBW),瘦体重(LBW)以及调整的体重(ADJ)。IBW、LBW、ADJ和BSA中的每个的配方在以下提供:
理想体重(IBW)
IBW(男性)=0.9H-88
IBW(女性)=0.9H-92
(其中H=身高(cm))
瘦体重(LBW)
男性=1.10×重量(kg)–128([重量(kg)]2/[100×身高(米)]2)
女性=1.07×重量(kg)–148([重量(kg)]2/[100×身高(米)]2)
调整的理想体重(AIBW或ADJ)
IBW+0.4(实际重量(kg)–IBW)
体表面积(BSA)–Mosteller公式
BSA(m2)=(身高(cm)×重量(kg)/3600)1/2
体表面积(BSA)–博伊德公式(Boyd Formula)
BSA(m2)=(0.0003207×身高(cm)0.3×重量(克)(0.7285-(0.0188xLOG(克))]
对于IBW、LBW、AIBW(ADJ)和TBW平均Cmax值分别是93.06、82.72、110.77和137.46μg/ml。另外,所有三个替代度量降低Cmax的标准偏差(对于TBW 21.7、20.5、22.9对33.7μg/ml)。(参见图5。)
如上文所提及,对于TBW对Cmax观察到正相关。IBW和LBW对重量曲线的相关性分析证实对重量的负相关。AIBW给药(ADJ)体重具有小体重依赖性(参见图6),类似于BSA但具有更少PK变化。
IBW、LBW或AIBW给药(ADJ)相较于TBW给药产生更低重量依赖性。基于当前数据,AIBW给药(ADJ)重量产生Cmax的最小变化。
在基于总体重(参见图7“TBW实际”)接受3.3、5或7mg/kg IMGN853的24名患者中观察到AUC0-24值。此外,在基于调整的理想体重(参见图7“5ADJ实际”)接受5mg/kg IMGN853的7名患者中观察到AUC0-24值。将在24名患者情况下获得的这些实际值与在那些相同患者已全部基于总体重用5mg/kg(图7“TBW 5mg/kg”)治疗情况下或在它们已全部基于调整的理想体重用5、5.4或6mg/kg(图7“ADJ 5mg/kg”、“ADJ 5.4mg/kg”以及“ADJ 6mg/kg”)治疗的情况下将获得的预计值进行比较。如在图7的表中所示,基于AIBW(ADJ)施用5mg/kg IMGN853使预计超过与眼毒性相关的AUC0-24 2741hr*μg/ml的阈值水平的患者的数量最小化。此外,基于AIBW(ADJ)接受5mg/kg IMGN853的7名患者中的仅14%达到高于2741hr*μg/ml的AUC0-24水平,而38%的基于TBW接受3.3、5或7mg/kg IMGN853的患者超过此水平。使用标定时间和浓度值计算AUC0-24的原始分析,并且产生2785hr*μg/ml的值。当使用实际时间重新计算时,结果是对AUC0-24值和2741hr*μg/ml的阈值的测定的稍微修改。
随后将患者基于调整的理想体重用5mg/kg、基于调整的理想体重6mg/kg、基于总体重5mg/kg或基于总体重7mg/kg治疗。在这些患者中观察到的AUC0-24值在图8(“实际”)中示出,并且将这些值与在所有这些患者已基于调整的理想体重用5mg/kg、基于调整的理想体重6mg/kg、基于总体重5mg/kg或基于总体重7mg/kg进行治疗的情况下将获得的预计值(“Proj”)进行比较。基于调整的理想体重给药减少早期暴露水平的变化并且减少眼不良事件,如在以下表2中所示。具体地说,基于调整的理想体重仅一名接受5mg/kg的患者经历1级视觉障碍并且基于调整的理想体重接受6mg/kg的三名患者经历1-2级眼毒性。相比之下,基于总体重5mg/kg或更多的剂量与具有眼不良事件的更多患者且与3级眼不良事件的出现相关。
表2:在基于调整的理想体重给药的情况下报道的眼不良事件(OAE)(全部可逆)
1不存在4级不良事件。
2一名患者报道视觉障碍。
31名患者中2级视力模糊和点状角膜炎;一名患者中2级视网膜病变;以及1名患者中1级视力模糊和飞蚊症(floater)。
实施例5
IMGN853替代计划表
在Q3W给药(递增剂量)之后基于IMGN853的丰富和稀疏(峰和谷)浓度-时间曲线产生了群体PK模型。如上所述的IMGN853的PK似乎在所研究的剂量范围内是线性的。
对于以下候选方案此模型用于刺激IMGN853的稳态暴露:
1至2.5mg/kg QW(在0.15mg/kg增量下的10个剂量水平)
2至5mg/kg Q2W(在0.3mg/kg增量下的10个剂量水平)
1至2.5mg/kg QWx4随后Q2Wx4(在0.15mg/kg增量下的10个剂量水平)
1至2.5mg/kg QWx3在4W(在0.15mg/kg增量下的10个剂量水平)
QWx4随后Q2Wx4给药方案随时间推移产生最少积聚(即,积聚指数为1),而QW给药方案产生最高积聚(即,积聚指数为1.97)。在4W中QWx3允许总体暴露增加至约3倍,而将Cmax限制至低于在眼毒性情况下观察到的水平(表3)。
表3
群体PK模型还用于经由Monte Carlo重新取样刺激500名患者的假设群。产生描述统计学以便确定在具有Cmax<150μg/ml的所述百分比的受试者的情况下的给药方案以优化IMGN853的安全性特征。对于4W方案中的QWx3,1.5、2.0和2.5mg/kg剂量水平分别产生99%、95%和90%的群体具有Cmax<150μg/ml。
实施例6
多剂量IMGN853的体内抗肿瘤活性和预测的药物代谢动力学
通过ELISA在注射后不同时间点测定在雌性CD-1小鼠中以10mg/kg的剂量静脉内施用的完整IMGN853偶联物的血浆浓度。使用非分室药物代谢动力学分析程序(201)的标准算法WinNonlin,Professional 6.1版(Pharsight,Mountain View,CA)进行药物代谢动力学(PK)分析。估计了最大浓度(Cmax)、浓度-时间曲线下总面积(AUC0-∞)、终末消除期中的半衰期(t1/2)、总血液清除率(CL)以及在稳态下的分布体积(Vss)。通过使用来自施用后第1至28天的浓度数据来评估用于测定偶联物t1/2的一级速率常数的值。通过使用来自施用后第1至28天的浓度数据来评估用于测定抗体t1/2的一级速率常数的值。基于在10mg/kg剂量下产生的测量值,在单剂量计划表和多剂量计划表的情况下,使用不同剂量水平用WinNonlin进行PK刺激。相较于在雌性SCID小鼠中在NCI-H2110(非小细胞肺癌,NSCLC)异种移植物中的不同剂量水平和计划表下的IMGN853的抗肿瘤活性评估所得参数。
当将IMGN853作为单一注射施用,在NCI-H2110模型中观察到剂量依赖性抗肿瘤活性。所有剂量水平(2.8、5.6和8.5mg/kg)是高度活性的,其中T/C值<10%,但在增加的IMGN853剂量的情况下,存在完全肿瘤消退(CR)的数量的增加。此预测的血浆PK参数还显示Cmax(最大血浆浓度)、Cavg(平均血浆浓度)以及暴露(AUC0-540小时)的剂量依赖性增加。因此,显示单一剂量的IMGN853的活性基于血浆PK参数是剂量依赖性的和可预测的,如图9中所示。
相较于单剂量活性,IMGN853的多剂量计划表显示活性不依赖于Cmax(图10)。每日或每3天计划表,在2.8mg/kg x3的剂量下施用的IMGN853(8.4mg/kg的总剂量)与在8.5mg/kg的单剂量IMGN853具有类似的活性。有趣的是,偶联物的总暴露(AUC)和平均血浆浓度(Cavg)在治疗组之间是相当的,而Cmax在8.5mg/kg单剂量组中最高。使用多剂量计划表观察到的活性表明此给药方法具有更大活性,因为存在在研究结束时仍存在的无肿瘤动物,对在单一高剂量组中的无肿瘤动物。
对于针对NCI-H2110异种移植物的活性评估另外的IMGN853剂量水平和计划表,其中结果一致地证明多剂量施用是同等活性的或具有比单剂量IMGN853更好的活性。作为单剂量的5.6mg/kg IMGN853施用的IMGN853的预测的平均血浆浓度与每日1.4mg/kg持续3天的平均血浆浓度相当。尽管具有较低总剂量(4.2mg/kg)、Cmax和暴露(AUC0-540),但1.4mg/kg qd x3具有相当的体内抗肿瘤活性(图11)。这些结果表明维持特定最小血浆浓度对于活性来说是关键的。
还发现具有与单一高剂量的IMGN853匹配的总剂量的IMGN853的每周计划表具有相当的体内活性(图12)。再次,维持高于最小阈值的平均血浆浓度对于活性来说是所需的,其中单剂量IMGN853(8.5mg/kg)产生稍微更高的Cavg和AUC但具有相当的总体活性。使用单剂量对多剂量计划表的预测药物代谢动力学参数的关键差异是Cmax的显著降低。每周给药Cmax被预测为比单剂量IMGN853的Cmax低几乎60%。因为不存在达到更高Cmax的明显活性益处,所以避免高血浆浓度可在降低毒性方面有益的。
****
应当理解,详述部分、而不是概述和摘要部分意图用于解释权利要求。概述和摘要部分提出一个或多个而不是所有如由发明人考虑到的本发明的示例性实施方案,并且因此不意图以任何方式限制本发明和所附权利要求。
以上已经借助于说明指定功能及其关系的实施的功能性组成模块描述了本发明。这些功能性组成模块的界限已经出于描述的方便而在本文进行任意界定。只要指定功能及其关系适当地履行,可以界定替代界限。
具体实施方案的前文描述将如此全面地揭示本发明的总体性质,以至于其他人可以在不脱离本发明的总体概念、在无过度实验的情况下,通过应用本领域的技术内的知识而容易地针对不同应用来修改和/或改编这类具体实施方案。因此,基于本文所呈现的教义和指导,这类改编和修改意图处于所公开的实施方案的等同物的意义和范围内。应理解本文的措辞或术语是出于描述而不是限制的目的,以使得本说明书的术语或措辞应由技术人员根据所述教义和指导进行解释。
本发明的广度和范围不应该受任何以上所描述的示例性实施方案限制,而仅应该根据以下权利要求和它们的等同物进行界定。
序列
SEQ ID NO:1-人叶酸受体1
MAQRMTTQLLLLLVWVAVVGEAQTRIAWARTELLNVCMNAKHHKEKPGPEDKLHEQCRPWRKNACCSTNTSQEAHKDVSYLYRFNWNHCGEMAPACKRHFIQDTCLYECSPNLGPWIQQVDQSWRKERVLNVPLCKEDCEQWWEDCRTSYTCKSNWHKGWNWTSGFNKCAVGAACQPFHFYFPTPTVLCNEIWTHSYKVSNYSRGSGRCIQMWFDPAQGNPNEEVARFYAAAMSGAGPWAAWPFLLSLALMLLWLLS
SEQ ID NO:2-人叶酸受体1核酸序列
atggctcagcggatgacaacacagctgctgctccttctagtgtgggtggctgtagtaggggaggctcagacaaggattgcatgggccaggactgagcttctcaatgtctgcatgaacgccaagcaccacaaggaaaagccaggccccgaggacaagttgcatgagcagtgtcgaccctggaggaagaatgcctgctgttctaccaacaccagccaggaagcccataaggatgtttcctacctatatagattcaactggaaccactgtggagagatggcacctgcctgcaaacggcatttcatccaggacacctgcctctacgagtgctcccccaacttggggccctggatccagcaggtggatcagagctggcgcaaagagcgggtactgaacgtgcccctgtgcaaagaggactgtgagcaatggtgggaagattgtcgcacctcctacacctgcaagagcaactggcacaagggctggaactggacttcagggtttaacaagtgcgcagtgggagctgcctgccaacctttccatttctacttccccacacccactgttctgtgcaatgaaatctggactcactcctacaaggtcagcaactacagccgagggagtggccgctgcatccagatgtggttcgacccagcccagggcaaccccaatgaggaggtggcgaggttctatgctgcagccatgagtggggctgggccctgggcagcctggcctttcctgcttagcctggccctaatgctgctgtggctgctcagc
SEQ ID NO:3-huMov19 vHC
QVQLVQSGAEVVKPGASVKISCKASGYTFTGYFMNWVKQSPGQSLEWIGRIHPYDGDTFYNQKFQGKATLTVDKSSNTAHMELLSLTSEDFAVYYCTRYDGSRAMDYWGQGTTVTVSS
SEQ ID NO:4-huMov19 vLCv1.00
DIVLTQSPLSLAVSLGQPAIISCKASQSVSFAGTSLMHWYHQKPGQQPRLLIYRASNLEAGVPDRFSGSGSKTDFTLNISPVEAEDAATYYCQQSREYPYTFGGGTKLEIKR
SEQ ID NO:5-huMov19 vLCv1.60
DIVLTQSPLSLAVSLGQPAIISCKASQSVSFAGTSLMHWYHQKPGQQPRLLIYRASNLEAGVPDRFSGSGSKTDFTLTISPVEAEDAATYYCQQSREYPYTFGGGTKLEIKR
SEQ ID NO:6-huMov19 vLC CDR1
KASQSVSFAGTSLMH
SEQ ID NO:7-huMov19 vLC CDR2
RASNLEA
SEQ ID NO:8-huMov19 vLC CDR3
QQSREYPYT
SEQ ID NO:9-huMov19 vHC CDR1
GYFMN
SEQ ID NO:10-huMov19 vHC CDR2-Kabat定义
RIHPYDGDTFYNQKFQG
SEQ ID NO:11-huMov19 vHC CDR2-Abm定义
RIHPYDGDTF
SEQ ID NO:12-huMov19 vHC CDR3
YDGSRAMDY
SEQ ID NO:13-huMov19 HC氨基酸序列
QVQLVQSGAEVVKPGASVKISCKASGYTFTGYFMNWVKQSPGQSLEWIGRIHPYDGDTFYNQKFQGKATLTVDKSSNTAHMELLSLTSEDFAVYYCTRYDGSRAMDYWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:14-huMov19 LCv1.00
DIVLTQSPLSLAVSLGQPAIISCKASQSVSFAGTSLMHWYHQKPGQQPRLLIYRASNLEAGVPDRFSGSGSKTDFTLNISPVEAEDAATYYCQQSREYPYTFGGGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:15-huMov19 LCv1.60
DIVLTQSPLSLAVSLGQPAIISCKASQSVSFAGTSLMHWYHQKPGQQPRLLIYRASNLEAGVPDRFSGSGSKTDFTLTISPVEAEDAATYYCQQSREYPYTFGGGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:16-muMov19 vHC CDR2-Kabat定义
RIHPYDGDTFYNQNFKD
- 还没有人留言评论。精彩留言会获得点赞!