SOMCL-9112固体分散体、其制备方法及包含其的SOMCL-9112固体制剂与流程
本发明属于药物制剂领域,涉及一种SOMCL-9112固体分散体、其制备方法、包含所述固体分散体的固体药物制剂以及所述固体分散体用于制备治疗癌症的药物的用途。
背景技术:
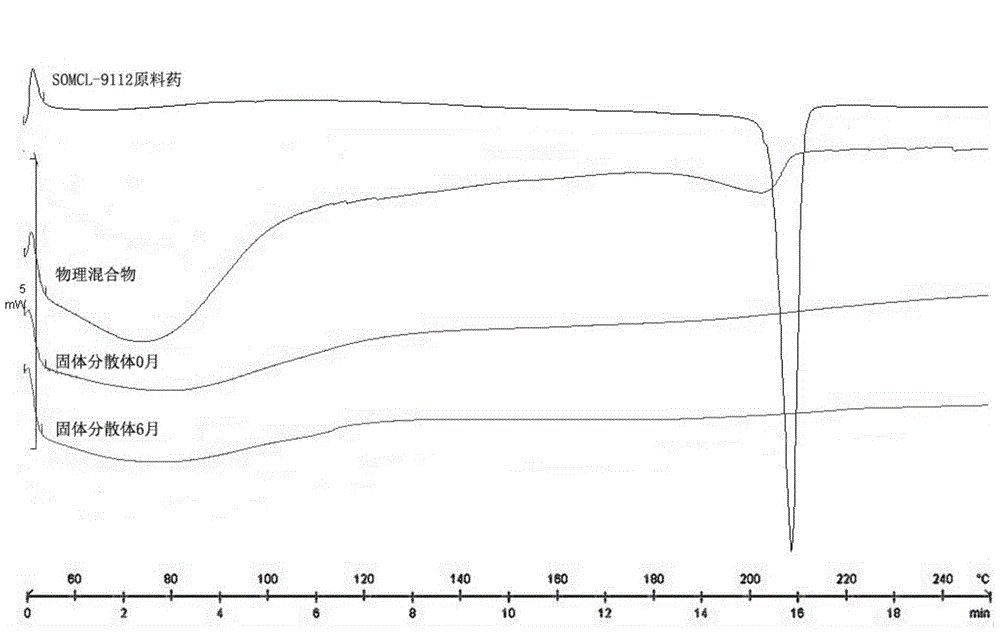
:SOMCL-9112,化学名称为4-(4-氟-3-(5-甲基-3-(三氟甲基)-5,6,7,8-4H-[1,2,4]三唑并[4,3-a]哌嗪-7-羰基)苄基)酞嗪-1(2H)-酮,分子式:C23H18F4N6O2,分子量:486.4,具有下述化学结构:在CN103833756A及PCT/CN2013/079998中公开和列举了SOMCL-9112和其用途,SOMCL-9112在前期研究中作为新型高选择性聚腺苷二磷酸核糖聚合酶-1(PARP1)抑制剂在治疗与PARP相关的疾病中的用途,尤其是治疗癌症,如乳腺癌、胰腺癌、卵巢癌等。SOMCL-9112特别有效地治疗其细胞在同源重组(HR)依赖性DNA双链断裂(DSB)修复通路中有缺陷的癌症。BRCA1(NM_007295)和BRCA2(NM_000059)遗传乳腺癌/卵巢癌基因仅是HR依赖性DNADSB修复通路众多蛋白质中的两种。用PARP抑制剂治疗brca1-/-和/或brca2-/-型乳腺癌或卵巢癌可比没有缺陷性同源重组(HR)依赖性DNA双链断裂(DSB)修复通路的癌症疗效更好;可能实现有效的单药治疗和/或联合治疗。SOMCL-9112在pH1.2~6.8缓冲盐水溶液中平衡溶解度低于0.10mg/ml,为水难溶性药物。当使用Caco-2细胞系研究时,SOMCL-9112与低渗透性阳性对照阿替洛尔的渗透系数相当,Caco-2Papp值为0.72×10-6cm/s(参见实验实施例1)。根据药物的溶解度和渗透量测量结果预测,SOMCL-9112在体内吸收差,生物利用度低。患者口服SOMCL-9112的生物利用度在一定程度上取决于该药物在GI肠道中的溶出率和溶解度。通过测定SOMCL-9112血浆中药物浓度并计算药时曲线下面积可评估不同制剂给药后SOMCL-9112的生物利用度。在大鼠PK试验中,SOMCL-9112纳米晶制剂的体内暴露量极低(参见实验实施例2),给药后24h药时曲线下面积仅为126h*ng/ml,影响药物正常 疗效的发挥,因此对提高SOMCL-9112的生物利用度进行了研究。目前,将难溶性药物进行前药修饰,制成盐以被广泛应用于提高其溶解度与生物利用度。但上述方法存在一定的局限性,如操作复杂,中间产物多,成本高等,难以实现大规模的工业化生产。1961年Sekiguchi等首次将固体分散体技术应用于提高难溶性药物的溶解度和生物利用度,诸多药剂研究者对固体分散体进行了广泛而深入的研究,进一步证明将难溶性药物制成固体分散体是提高其溶解度和生物利用度最具开发潜力的方法之一,目前采用固体分散体技术制备的药物制剂已有商业化先例如Kaletra(洛匹那韦/利托那韦)。技术实现要素:本发明开发了一种具有高生物利用度的SOMCL-9112药物制剂,在实现充足药物载量和稳定性的前提下满足临床给药的需求。本发明中SOMCL-9112固体分散体在模拟胃肠液中可形成稳定的平均粒径~100nm的混合型胶束,可将SOMCL-9112溶解度由~10μg/ml提升至大于300μg/ml,通过胶束増溶原理提高药物溶解度和防止药物沉淀进而提高药物的生物利用度。提高的生物利用度有助于降低取得使用常规制剂观察到的相当暴露量的SOMCL-9112所需的剂量,可降低药物有效治疗剂量、提高药物疗效,节约药物成本、减少药物的毒副作用。根据本发明的第一个方面,提供了一种SOMCL-9112固体分散体,其包括下述原料,按重量百分比制成:本发明提供的SOMCL-9112固体分散体中,以非晶形式存在的SOMCL-9112在SOMCL-9112中所占的比例范围为70%~100%,优选80%以上,更优选90%以上,再优选95%以上,最优选SOMCL-9112大体上全部以非晶形式存在。该SOMCL-9112固体分散体可以以非晶形式稳定其中的SOMCL-9112并可以降低SOMCL-9112转化或逆转成其它形式的可能。本发明提供的SOMCL-9112固体分散体可克服常规固体分散体物理稳定性差,易老化的缺点。在本发明的一个实施例中,SOMCL-9112和可药用基质聚合物制备的固体分散体在加速条件下放置6个月后药物仍为稳定的非晶形式,稳定性良好。所述可药用基质聚合物具有至少约50℃的Tg,可为选自共聚维酮、聚维酮、羟丙基甲基纤维素邻苯二甲酸酯(HPMPCP)、醋酸羟丙基甲基纤维素琥珀酸酯(HPMCAS)、 2-羟基-β-环糊精(HPBCD)、羟丙基甲基纤维素(羟丙甲纤维素、HPMC)、聚甲基丙烯酸酯、聚乙烯己内酰胺-聚醋酸乙烯酯-聚乙二醇接枝共聚物(Soluplus)、羟丙基纤维素(HPC)和醋酸邻苯二甲酸纤维素(CAP)中的一种或多种,优选为选自共聚维酮、Soluplus和醋酸羟丙基甲基纤维素琥珀酸酯中的一种或多种。共聚维酮为水溶性有机高分子化合物,是N-乙烯基吡咯烷酮(NVP)与醋酸乙烯酯(VA)的线型共聚物。其中,VA含量标称为约40%(但可能不同,例如35~41%)。其平均分子量(Mw)为24000至30000。进一步优选的,SOMCL-9112与可药用基质聚合物重量比为1:0.25~1:10,优选为1:0.3~1:7,更优选为1:0.5~1:5,更优选为1:2~1:4。本发明中,所述表面活性剂可进一步增强本发明固体分散体的治疗潜力的提高。合适的表面活性剂包括:阴离子型表面活性剂,如十二烷基硫酸钠(月桂基硫酸钠)、多库酯钠;阳离子型表面活性剂,如溴棕三甲铵、苄索氯铵、十六烷基氯化吡啶鎓和月桂酸;非离子型表面活性剂,如聚氧乙烯烷基醚、聚氧乙烯山梨糖醇酐脂肪酸酯(具体如吐温80、60、40和20)、聚氧乙烯蓖麻油衍生物(具体如CremophorRH40)、聚氧乙烯硬脂酸酯和泊洛沙姆;优选为十二烷基硫酸钠。所述助流剂为选自胶态二氧化硅、动物或植物脂肪、蜡等中的一种或多种。增塑剂的存在可提高该固体分散体的可加工性。合适的增塑剂为选自柠檬酸乙酰三丁酯、柠檬酸乙酰三乙酯、苯甲酸苄酯、三氯叔丁醇、糊精、邻苯二甲酸二丁酯、邻苯二甲酸二乙酯、邻苯二甲酸二甲酯、甘油、单硬脂酸甘油酯、甘露醇、矿物油、羊毛脂醇、棕榈酸、聚乙二醇、聚乙酸邻苯二甲酸乙烯酯、丙二醇、2-吡咯烷酮、山梨糖醇、硬脂酸、三醋精、柠檬酸三丁酯、三乙醇胺和柠檬酸三乙酯中的一种或多种。本发明的固体分散体中根据需要还可以包含其他添加剂,例如润滑剂、填充剂、崩解剂、稳定剂(例如抗氧剂、光稳定剂、自由基清除剂、对抗微生物攻击的稳定剂等)等。所述其他添加剂的具体选择范围和用量是本领域技术人员的常规选择。崩解剂促进固体制剂在胃中快速崩解,并保持释放出的颗粒彼此分隔。适宜的崩解剂包括交联聚合物,例如交联羧甲基纤维素钠、交联聚乙烯吡咯烷酮(即交联聚维酮PVPP)。适宜的填充剂为选自乳糖、蔗糖、甘露醇、磷酸氢钙、微晶纤维素、淀粉、异麦芽糖等中的一种或多种。适宜的润滑剂为选自聚乙二醇(例如分子量为1000至6000)、硬脂酸镁、硬脂酸钙、硬脂酰富马酸钠等中的一种或多种。本发明提供的SOMCL-9112固体分散体在模拟胃肠液中可形成稳定的平均粒径~100nm的混合型胶束,可将SOMCL-9112溶解度由~10μg/ml提升至大于300μg/ml。较普 通固体分散体而言,形成的混合型胶束可通过胶束増溶原理在增加药物溶解度的同时避免药物沉淀,克服了普通固体分散体药物容易沉淀的缺点。本发明所提供的固体分散体可通过提高药物溶解度和防止药物沉淀,提高药物的生物利用度。本发明的另一方面提供了上述SOMCL-9112固体分散体的制备方法,包括如下步骤:(1)通过熔解或溶解将原料均匀混合,得到均匀分散体;(2)使均匀分散体固化以得到SOMCL-9112以非晶形式存在的SOMCL-9112固体分散体。上述SOMCL-9112固体分散体的制备方法可以采用溶剂蒸发法或熔体挤出法,优选熔体挤出法。所述熔体挤出法是通过施加热和/或机械应力来制造熔体,“熔体”指液体状态或似橡胶状态,其中可能一组分均匀包埋于其它组分中。一般,一种组分熔化,其它组分溶于熔化物中,形成熔体。形成熔体通常涉及药用基质聚合物的软化点,熔体的制备可通过多种方法来发生。在熔体形成之前、形成期间或形成之后可进行组分的混合。例如,首先进行组分的混合,然后加热或同时混合和加热。通常,熔体中活性物质应均匀分散,熔体呈糊状或粘稠状。通常,加热温度为70℃-250℃,优选80℃-200℃,最优选为100℃-180℃。使用熔体挤出法,步骤(1)、(2)中该熔体产生、挤出可在用于该目的的常规装置中进行。特别适合的是挤压机和捏合机。适宜的挤压机可以以杆式挤出,包括单螺杆挤压机、双螺杆挤压机或其它多螺杆挤压机,优选双螺杆挤压机,其可以顺转或逆转,并任意地装有捏合盘。应该理解,工作温度也将由挤压机类型或所使用的挤压机的构造类型来决定。在挤压机中组分的熔化、混合和溶解所需要的部分能量可通过加热元件来提供。挤压机中材料的摩擦和剪切也可给混合物提供大量的能量,帮助组分均匀熔体的形成。挤出物可利用挤压机的成型模块实现,在固化前或固化后挤出物可切成块。在一个实施方式中,所述SOMCL-9112固体分散体的制备方法,包括如下步骤:(1a)将原料混合,加热以产生熔体;(2a)挤出该熔体以固化产生SOMCL-9112固体分散体。步骤(1a)所述加热温度为70℃-250℃,优选80℃-200℃,最优选为100℃-180℃。在另一实施方式中,所述SOMCL-9112固体分散体的制备方法,包括如下步骤:(1b)将原料溶解于溶剂中;(2b)蒸发溶剂以产生SOMCL-9112以非晶形式存在的SOMCL-9112固体分散体。步骤(1b)中可以根据可药用基质聚合物来选择适合的溶剂,所述溶剂选自丙酮、丙酮/二氯甲烷、甲醇/二氯甲烷、丙酮/水、丙酮/甲醇、丙酮/乙醇、二氯甲烷/乙醇或乙醇/ 水等,其中,“/”表示二者的混合溶剂。步骤(2b)中蒸发溶剂的方法包括旋转蒸发、喷雾干燥、冻干和薄膜蒸发。或者,可以通过低温冰冻接着冻干来实现除去溶剂。也可以使用其它技术,如熔体挤出、溶剂控制的沉淀、pH控制的沉淀和低温共研磨等。本发明的再一方面提供了一种SOMCL-9112固体制剂,其包括所述SOMCL-9112固体分散体和非必需的药用添加剂。所述药用添加剂可以为选自助流剂、崩解剂、填充剂、润滑剂和包衣剂等中的一种或多种。所述助流剂、崩解剂、填充剂和润滑剂的描述与前述相同。膜包衣可改善味道和提供精致的外观。如果需要,膜包衣可以是肠溶包衣。膜包衣通常包含聚合成膜材料,例如羟丙甲基纤维素、羟丙基纤维素和丙烯酸酯或甲基丙烯酸酯共聚物。除成膜聚合物外,膜包衣还可包含增塑剂如聚乙二醇,表面活性剂例如吐温类,以及任选的颜料例如二氧化钛或铁氧化物。膜包衣也可包含作为抗粘剂的滑石粉。此类添加剂可占固体制剂总重量大约0到大约20%。片剂的膜包衣还可助于可吞咽的舒适性。本发明还提供了制备所述SOMCL-9112固体制剂的方法,包括如下步骤:将该SOMCL-9112固体分散体处理后与药用添加剂混合,制成制剂。所述处理是指,将SOMCL-9112固体分散体制成适合制成制剂的粉末或颗粒,处理的方法包括例如粉碎、碾磨或研磨。所述SOMCL-9112固体制剂可包含2至1500mgSOMCL-9112。患者可以是成年人或儿童,但也预期其它哺乳动物的治疗。在这些方面的一个实施例中,所用可药用基质聚合物是共聚维酮,本发明的SOMCL-9112固体分制剂与其它方式获得的制剂相比具有更高的生物利用度(在这些方面的一个实施例中,SOMCL-9112固体制剂的相对生物利用度是纳米晶混悬液的724.6%(实验实施例2),SOMCL-9112固体制剂的绝对生物利用度是40.2%(实验实施例3)。提高的生物利用度有助于降低取得使用常规制剂如SOMCL-9112IR片剂观察到的相当暴露量的SOMCL-9112所需的剂量,可降低药物有效治疗剂量、提高药物疗效,节约药物成本、减少药物的毒副作用。本发明提供的SOMCL-9112固体制剂是适合经粘膜给药于患者的制剂,即可给药于粘膜以透膜吸收。为此,合适的给药途径包括通过吸入给药,以及口服、鼻内和直肠给药。特别优选口服给药。技术人员可根据给药途径选择片剂、胶囊剂或其它制剂形式。但是,不排除其它给药途径,例如肠道外。例如,根据本发明的SOMCL-9112固体制剂可以为片剂、胶囊剂、颗粒剂、散剂等。本发明还提供了所述SOMCL-9112的固体分散体在制备治疗癌症的药物中的用途。SOMCL-9112对聚-ADP-核糖聚合酶(PARP)具有显著抑制作用,这种作用可用于制备治疗癌症的药物,例如乳腺癌或卵巢癌,特别是具有缺陷性同源重组(HR)依赖性DNA双链断裂(DSB)修复通路的癌症,如brca1-/-和/或brca2-/-癌症。考虑到提高SOMCL-9112治疗潜力的目的,本发明试图实现在足够高载药量制剂中提高SOMCL-9112的生物利用度。本发明载药量可达60%,但药物载量越大,不稳定的可能性越大,因此,尽管可以产生具有60%药物载量的制剂,优选采用较低载药量以保持稳定性。本文所用术语“聚合物”是指由通过共价键连接的重复结构单元构成的大分子。该术语包括线型和支化聚合物、环状聚合物,如环寡糖(包括环糊精)、均聚物和共聚物,无论是天然、合成还是半合成来源的。本文所用术语“基质聚合物”是指表现出低吸湿性和高软化温度的材料,包括聚合物或两种或更多聚合物的共混物。本文所用术语“高软化温度”是指材料通过差式扫描量热法(DSC)测得玻璃态转化温度(Tg)或熔点(Tm)>100℃,其中,Tg是适合非晶状态或形式的聚合物的量度,Tm是适合结晶状态或形式的聚合物的量度。本文所用术语“表面活性剂”是指可药用的表面活性剂。本发明的制剂不包含或包含一种以上HLB值约大于4的表面活性剂。HLB系统是表面活性剂的数值属性,亲脂性物质获得低HLB值,亲水性物质获得高HLB值。本文所用术语“固体分散体”是指将SOMCL-9112分散在赋形剂载体中的体系。就该体系中的药物状态而言,固体分散体在这种意义上可包括其中药物以结晶或非结晶药物的离散域或以独立分子分散在赋形剂载体内的组合物。就整个药物-赋形剂复合物而言,固体分散体可以是相对较大的固体物质,如丸粒、片剂、薄膜或条束;或它们可作为由微米级或纳米级初级粒子或其聚集体构成的自由流动粉末存在。本发明中,固体分散体的定义不包括来自干混或湿混或干掺合操作的物理混合物以及SOMCL-9112晶体与其它辅料的简单混合物。本文所用术语“AUC”是指药时曲线下面积,使用其常规含义,即,如从0至24小时的血浆浓度-时间曲线下的面积。AUC具有浓度乘以时间的单位。一旦确定了试验浓度-时间点,即可方便的计算AUC,例如通过计算机程序或通过梯形法计算。附图说明图1是本发明制备实施例1制备的SOMCL-9112固体分散体0月及加速条件6月的XRPD衍射图。图2是本发明制备实施例1制备的SOMCL-9112固体分散体0月及加速条件6月的DSC图。图3是本发明制备实施例1制备的SOMCL-9112固体分散体分别经模拟胃液和模拟肠液稀释后的粒径图:(A)模拟胃液;(B)模拟肠液。图4是本发明制备实施例5、6、7和对比实施例1制备的各种SOMCL-9112制剂的体外溶出(n=6)。图5是本发明制备实施例5、6、7制备的各种SOMCL-9112制剂加速条件放置6月后的体外溶出与0月体外溶出对比图(n=6)。具体实施方式下面结合具体的实施例,并参照数据进一步详述本发明。应理解,这些实施例只是为了举例说明本发明,旨在说明本发明的具体配方组成、制备方法及其功能和效果,而非以任何方式限制本发明的范围。在以下实施例中,未详细描述的各种过程和方法是本领域中公知的常规方法。本发明中,所用试剂、设备的来源和商品名,均在首次出现时标明,其后所用相同试剂如无特殊说明,均与首次标明的内容相同,常规未标注试剂购自国药集团化学试剂有限公司。其中,SOMCL-9112原料药由上海药物研究所自行合成。实验动物:健康SD大鼠6只,雄性,体重200-220g;比格犬6只,雄性,体重10~12kg。来源均为上海药物研究所实验动物中心。受试动物在试验日前3-7天均在试验场所进行适应性饲养。制备实施例制备实施例1处方1:制备方法:将共聚维酮(73.5份重量)(N-乙烯基吡咯烷酮/醋酸乙烯酯共聚物重量比60:40,德国巴斯夫公司制造,型号:VA64)、十二烷基硫酸钠(0.5份重量)(安徽山河 药用辅料股份有限公司制造)与SOMCL-9112(25.0重量份)和胶态二氧化硅(1.0重量份)(德国赢创工业集团制造,型号:Aerosil)混合,然后将该粉末状混合物装入挤出转速100rpm和温度170℃的双螺杆挤出机(螺杆直径11mm,ThermoScientific公司),混合物经螺杆呈条状挤出;将热熔挤出的条状物经粉碎处理后过60目筛,得到SOMCL-9112固体分散体。本实施例制备得到的SOMCL-9112固体分散体粉末X射线衍射和差式扫描量热分析(DSC)显示药物以非晶形式分散在载体材料中(0月),加速条件(40℃±2℃、75%±5%RH)6月放置后固体分散体粉末X射线衍射和DSC结果显示药物仍以非晶形式分散在载体材料中(图1、图2)。取本实施例制得的SOMCL-9112固体分散体粉末分别加pH1.2模拟胃液(每升含2gKCl和7ml盐酸)和pH6.8模拟肠液(每升含6.8g磷酸二氢钾和0.944g氢氧化钠)溶解后测定所形成聚合物胶束的粒径(ZetasizerNanoZS激光粒度仪,英国马尔文仪器有限公司),在模拟胃液中测得本品平均粒径为125.5nm;在模拟肠液中测得本品平均粒径为116.9nm(图3)。取本实施例制得的SOMCL-9112固体分散体和SOMCL-9112原料药粉末于水、pH1.2模拟胃液、pH4.5磷酸盐缓冲液和pH6.8模拟肠液中测定SOMCL-9112的溶解度(37℃、100rpm振摇8h),其中,固体分散体组于4h、8h取样,测定结果见表1。该实施例显示本发明制备的SOMCL-9112固体分散体可显著提高SOMCL-9112的溶解度,并且药物在8h时仍可保持良好的溶解度,可有效防止药物沉淀,确保药物在体内有效吸收。表1SOMCL-9112原料药及固体分散体溶解度测定1每升含2g氯化钾和7ml盐酸2每升含12.9g柠檬酸和0.63g磷酸氢二钠3每升含6.8g磷酸二氢钾和0.944g氢氧化钠将本实施例制备的固体分散体粉末于加速条件(40℃±2℃、75%±5%RH)6月放置 后测定溶解度(37℃、100rpm振摇8h),在水中溶解度为453.1μg/ml;在上述pH1.2模拟胃液中溶解度为430.4μg/ml;在上述pH4.5磷酸盐缓冲液中溶解度为312.6μg/ml;在上述pH6.8模拟肠液中溶解度为418.3μg/ml。表明加速条件放置6月后,本发明的固体分散体对SOMCL-9112仍有良好的増溶作用。根据上述粉末X射线衍射、DSC结果和溶解度测定结果,本实施例制备的固体分散体稳定性良好。制备实施例2处方2:制备方法:将聚乙烯己内酰胺-聚醋酸乙烯酯-聚乙二醇接枝共聚物(70.0份重量)(Soluplus,德国巴斯夫公司制造)、CremerphorRH40(4.0份重量)(德国巴斯夫公司制造)与SOMCL-9112(25.0重量份)和胶态二氧化硅(1.0重量份)混合,然后将该粉末状混合物装入挤出转速150rpm和温度160℃的双螺杆挤出机(螺杆直径11mm),混合物经螺杆呈条状挤出;将热熔挤出的条状物经粉碎处理后过60目筛,得到SOMCL-9112固体分散体。取本实施例制得的SOMCL-9112固体分散体于水、pH1.2模拟胃液、pH4.5磷酸盐缓冲液和pH6.8模拟肠液中测定SOMCL-9112的溶解度(37℃、100rpm振摇8h)。经测定SOMCL-9112固体分散体在水中的溶解度为421.7μg/ml,在pH1.2模拟胃液中的溶解度为411.4μg/ml,在pH4.5磷酸盐缓冲液中的溶解度为308.5μg/ml,在pH6.8模拟肠液中的溶解度为403.1μg/ml。该实施例显示制备SOMCL-9112固体分散体可显著提高SOMCL-9112的溶解度。制备实施例3处方3:制备方法:将醋酸羟丙基甲基纤维素琥珀酸酯(64.0份重量)(HPMCAS,日本信越化学株式会社制造)、十二烷基硫酸钠(2.0份重量)(德国巴斯夫公司制造)、柠檬酸三乙酯(3.0份重量)(安徽丰原药业股份有限公司)与SOMCL-9112(30.0重量份)和胶态二氧化硅(1.0重量份)混合,然后将该粉末状混合物装入挤出转速100rpm和温度140℃的双螺杆挤出机(螺杆直径11mm),混合物经螺杆呈条状挤出;将热熔挤出的条状物经粉碎处理后过60目筛,得到SOMCL-9112固体分散体。取本实施例制得的SOMCL-9112固体分散体于pH6.8模拟肠液中测定SOMCL-9112的溶解度(37℃、100rpm振摇8h),经测定SOMCL-9112固体分散体在pH6.8模拟肠液中的溶解度为379.4μg/ml。该实施例显示制备SOMCL-9112固体分散体可显著提高SOMCL-9112的溶解度。制备实施例4处方4:制备方法:将共聚维酮(N-乙烯基吡咯烷酮/醋酸乙烯酯共聚物重量比60:40)(70.0份重量)与SOMCL-9112(30.0重量份)溶解于丙酮/乙醇(体积比4:1)混合溶剂中,然后将该溶剂用旋转蒸发仪于30℃挥干,将所得物质于40℃真空干燥箱干燥12h以上挥去残留有机溶剂,将所得固体物质经粉碎处理后过60目筛,得到SOMCL-9112固体分散体。取本实施例制得的SOMCL-9112固体分散体于水、pH1.2模拟胃液、pH4.5磷酸盐缓冲液和pH6.8模拟肠液中测定SOMCL-9112的溶解度(37℃、100rpm振摇8h)。经测定SOMCL-9112固体分散体在水中的溶解度为463.5μg/ml,在pH1.2模拟胃液中的溶解度为425.7μg/ml,在pH4.5磷酸盐缓冲液中的溶解度为321.6μg/ml,在pH6.8模拟肠液中的溶解度为422.6μg/ml。该实施例显示制备SOMCL-9112固体分散体可显著提高SOMCL-9112的溶解度。制备实施例5取制备实施例1所得的SOMCL-9112固体分散体(80.0份重量),与甘露醇(14.2份重量)(法国罗盖特公司制造)、交联聚维酮(4.8份重量)(PVPP,美国国际特品公司制 造)和硬脂富马酸钠(1.0份重量)(德国JRS集团药用辅料公司制造)混合均匀,采用单冲压片机压制成500.0mg的片剂。然后将药片置于包衣锅中,于60℃温度下用薄膜包衣用水性分散液(Opadry,上海卡乐康包衣技术有限公司制造)对药片进行薄膜包衣。制备实施例6取制备实施例2所得的SOMCL-9112固体分散体(80.0份重量),与微晶纤维素(13.8份重量)(台湾名台化工股份有限公司制造)、十二烷基硫酸钠(1.2份重量)、交联羧甲基纤维素钠(4.0份重量)(德国JRS集团药用辅料公司制造)和硬脂酸镁(1.0份重量)(安徽山河药用股份有限公司制造)混合均匀,采用单冲压片机压制成250.0mg的片剂。然后将药片置于包衣锅中,于60℃温度下用薄膜包衣用水性分散液(Opadry,上海卡乐康包衣技术有限公司制造)对药片进行薄膜包衣。制备实施例7取制备实施例3所得的SOMCL-9112固体分散体(66.7份重量),与乳糖(26.3份重量)(荷兰DFEPharma公司制造)、交联聚维酮(6.0份重量)和硬脂酸镁(1.0份重量)混合均匀,采用填充式胶囊灌装机以1#胶囊按250mg/粒灌装胶囊。对比实施例对比实施例1取SOMCL-9112原料药(20.0份重量),与聚乙烯己内酰胺-聚醋酸乙烯酯-聚乙二醇接枝共聚物(Soluplus,56.0份重量)、微晶纤维素(13.8份重量)、十二烷基硫酸钠(2.4份重量)、胶态二氧化硅(0.8份重量)、交联聚维酮(6.0份重量)和硬脂酸镁(1.0份重量)混合均匀,采用单冲压片机压制成250.0mg的常规IR片剂。然后将药片置于包衣锅中,于60℃温度下用薄膜包衣用水性分散液(Opadry,上海卡乐康包衣技术有限公司制造)对药片进行薄膜包衣。对比实施例2取SOMCL-9112原料药(0.5份重量)分散在0.2%泊洛沙姆407(99.5份重量)(德国巴斯夫公司制造)溶液中,高剪切3min,再采用微射流均质机NanoDB在20000PSI压力下均质10min(gapD8),即制得平均粒径为359nm的纳米晶体混悬液对比实施例3取SOMCL-9112原料药(1.0份重量),与丙二醇(25.0份重量)(美国陶氏化学公司制造)、MCT(15.0份重量)(铁岭北亚药用油有限公司制造)和SolutolHS15(59.0份重量)(德国巴斯夫公司制造)置适宜容器中,在50~70℃下以300rpm速度搅拌至SOMCL-9112完全溶解,即得含SOMCL-9112浓度为10mg/ml(1%重量百分比)的 SOMCL-9112液体制剂。实验实施例实验实施例1平衡溶解度及渗透率考察平衡溶解度考察:考察SOMCL9112原料在一系列溶剂中的溶解度,主要溶剂包括水、pH1.2模拟胃液、pH4.5磷酸盐缓冲液、pH6.8模拟肠液,取SOMCL-9112原料药约0.5g,加入上述溶剂各100ml,于37℃摇床100rpm振摇24h,取上清液以8000rpm离心15min后以HPLC测定SOMCL-9112的浓度。SOMCL-9112在不同介质中的溶解度见表2。表2SOMCL-9112在不同溶剂中的溶解度溶剂平衡溶解度(μg/ml),24h水14.8pH1.2模拟胃液10.3pH4.5磷酸盐缓冲液18.6pH6.8模拟肠液16.2渗透率考察:采用Caco-2细胞模型评价SOMCL-9112的渗透性。采用LC/MS/MS法测定SOMCL-9112、阳性对照药阿替洛尔、普萘洛尔和地高辛的浓度,计算表观渗透系数(Papp)和表观渗透系数的比率(Pappratio=Papp(B→A)/Papp(A→B),并据此来评判该化合物的渗透性及其是否为P-gp的底物。结果见表3。表3SOMCL-9112在Caco-2细胞模型中渗透率考察结果(n=3,±SD)注释:A=顶端,B=基底外侧上述结果表明SOMCL-9112具有低渗透性的特征,且在2.00-50.0μM范围内在Caco-2细胞上有显著的外排作用。实验实施例2体外溶出试验考察取上述制备实施例5、制备实施例6和制备实施例7、对比实施例1制得的制剂,根据中国药典2010年版二部附录XC)第二法装置(桨法)进行溶出度试验。将单个剂量单位的制剂在37℃和75rpm搅拌速度下置于900mlpH6.8的模拟肠液中,在15、30、60、90和120min后,取出8ml样品并给予同体积的补液。将取出的样品稀释4倍后照紫外-可见分光光度法(中国药典2010年版二部附录ⅣA),在240nm的波长处分别测定吸光度,计算相应制剂的溶出量,并绘制溶出曲线(见图4)。将本发明制备实施例5、6、7制备的SOMCL-9112固体制剂于40±2℃,75%±5%RH加速条件下放置6月后采用上述相同条件测定药物的溶出行为,并绘制溶出曲线(见图5)。由结果可见,本发明制备实施例5、6、7制备的SOMCL-9112固体制剂较IR常规制剂可显著提高SOMCL-9112的溶出速度和溶解度,且加速条件放置后本发明的制剂溶出行为未发生显著改变,对药物増溶效果良好,稳定性良好。实验实施例3相对生物利用度研究取上述制备实施例1、对比实施例2制得的制剂灌胃给予空腹SD大鼠(上海药物研究所实验动物中心)(n=3)。制备实施例1样品给药方法为临用前以纯化水混悬成含SOMCL-91122mg/ml的溶液,各制剂给药剂量为20mg/kg。试验前禁食12h,自由饮水。给药后2h统一进食。在给药前(0h)及给药后0.25,0.5,1.0,2.0,3.0,4.0,6.0,8.0和24h经大鼠眼球后静脉丛取静脉血0.3ml,置肝素化试管中,11000rpm离心5min,分离血浆,于–20℃冰箱中冷冻保存待测。取上述对比实施例2制剂(含SOMCL-91122mg/ml),静脉注射给予空腹SD大鼠(上海药物研究所实验动物中心)(n=3),给药剂量为10mg/kg。在给药前(0h)及给药后5min,0.25,0.5,1.0,2.0,4.0,6.0,8.0和24h经大鼠眼球后静脉丛取静脉血0.3ml,置肝素化试管中,11000rpm离心5min,分离血浆,于–20℃冰箱中冷冻保存待测。以LC-MS测定样品中SOMCL-9112的浓度。采用Phoenix1.3软件(美国Pharsight公司)的非房室模型计算SD大鼠给药后SOMCL-9112的药代动力学参数,数据概要见表4。表4SOMCL-9112SD大鼠体内药物动力学数据概要(n=3)由结果可见,本发明制备的制剂可较SOMCL-9112的纳米晶制剂显著提高SOMCL-9112在SD大鼠体内的暴露量,可显著提高SOMCL-9112的相对生物利用度。实验实施例4绝对生物利用度研究取上述制备实施例5制得的制剂口服给予空腹比格犬(上海药物研究所实验动物中心)(n=3)。制备实施例5制剂给药量为100mg/只。试验前禁食12h,给药后4后提供食物,整个试验过程不禁水。用30ml水送服这些制剂。在给药前(0h)及给药后0.25、0.5、1.0、2.0、3.0、4.0、6.0、8.0、12和24h取血样0.8ml;置肝素抗凝试管中,3500rpm离心10min,分离血浆,–70℃冰箱中冷冻保存待测。取上述对比实施例3制剂,以生理盐水稀释8倍后以SOMCL-91125mg/kg的剂量(2ml/kg)静脉注射给予空腹比格犬(n=3)。给药前(0h)及给药后5min、0.25、0.5、1.0、2.0、3.0、4.0、6.0、8.0、12和24h取血样0.8ml,置肝素抗凝试管中,3500rpm离心10min,分离血浆,–70℃冰箱中冷冻保存待测。以LC-MS测定样品中SOMCL-9112的浓度。采用Phoenix1.3软件(美国Pharsight公司)的非房室模型计算比格犬给药后SOMCL-9112的药代动力学参数,数据概要见表5。表5SOMCL-9112的药物动力学数据概要(n=3)由结果可见,本发明的SOMCL-9112固体制剂可显著提高SOMCL-9112的生物利用度,体内吸收良好。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1