一种穿心莲内酯肠溶微丸定位制剂的制作方法
本发明涉及一种药物制剂,特别涉及一种穿心莲内酯肠溶微丸定位制剂。
背景技术:
穿心莲内酯(Andrographolide,分子式C20H30O5)为爵床科植物穿心莲中提取得到的二萜内酯类化合物,是中药穿心莲的主要有效成分之一;具有祛热解毒,消炎止痛的功效,被誉为天然抗生素药物。该药为二萜类内酯化合物,作为为植物提取物,具有副作用低,抗炎效果好,来源广泛且价位较低等优势。
最近的研究发现,穿心莲内酯对炎症性肠病,如溃疡性结肠炎和克罗恩病(Crohn’s disease)有很好的效果。结肠位于消化道后半段,普通口服制剂给药时药物很难达到结肠,灌肠给药则既不方便又痛苦,因此应运而生的是肠道特别是结肠靶向制剂技术。口服结肠定位释药系统(oral colon‐specific drug delivery system,OCSDDS)是通过药物传递技术,使药物在胃、十二指肠等消化道前半段不释放药物,药物转运至回盲部后才开始释放而发挥局部或者全身治疗效果的定位给药系统。OCSDDS常用的技术有pH依赖型、酶降解型、时间依赖型。
pH依赖型利用人体胃肠道各部位pH值差别来实现结肠定位释放。健康人胃的pH最低,为1~3,十二指肠为4~6,空肠为6~7,回肠为7~7.5,结肠为7~8。
目前常用的肠溶材料,其pH值不尽相同,第一种是pH≥5.5开始溶解,第二种在pH≥6.0开始溶解,第三种在pH≥7.0开始溶解。目前pH依赖型结肠靶向制剂基本采用第三种肠溶聚合物,包裹药物,可以实现药物在胃肠道上半部不释放,到回盲部开始释放。中国专利CN1981743,CN101209246,CN103315959介绍的都是这一技术。但临床研究结果表明,不同个体间胃肠道pH差距较大,而且炎症性肠病患者与健康人之间也存在差距。炎症性肠病患者的结肠pH值比健康人低。因此单独使用这类聚合物时,药物在有的患者体内不释放,直接排除体外。
关于穿心莲内酯肠溶靶向制剂,现有技术中报道了酶降解型定位技术。在 空白丸芯上涂覆穿心莲内酯制成载药微丸,然后其表面包裹含有单糖类致孔剂的水不溶性聚合物。这种聚合物膜在胃和小肠不释放,到结肠后膜中单糖被结肠酶降解,形成孔道,药物逐渐溶解释放。这种技术虽然克服了pH依赖型的个体间差异的缺陷,但同样存在问题,主要是所用的单糖如瓜尔豆胶等在水中溶解,使得药物进入体内后很快从单糖分子溶解后留下的孔隙中释放出来,难以保证到结肠的药物量。另外单糖分子结构是刚性的,镶嵌在聚合物链之间,影响了聚合物链的伸展性,破坏了聚合物膜的完整性,使得包衣膜发脆,容易破裂,在运输过程中,在胃肠蠕动下膜提前破裂的风险。
技术实现要素:
针对上述问题,本品采用特殊的pH依赖型技术,即2种pH依赖性聚合物联合使用,实现不同结肠pH值的人体都可达到肠溶靶向,特别是结肠靶向目的,详述如下:
穿心莲内酯肠溶靶向微丸,其特征在于由空白丸芯、药物层和肠溶包衣层组成,药物层含:穿心莲内酯、pH≥7.0条件下溶解的聚合物a;穿心莲内酯与聚合物a重量比为1:2‐1:0.2,优选1:1.5‐1.0.5,药物层a增重为20wt%-100wt%,优选30wt%-80wt%;肠溶包含pH≥5.5条件下溶解的聚合物b,其包衣层增重,5wt%-30wt%,优选8wt%-20wt%,最优选10wt%-18wt%。
其中,聚合物a为甲基丙烯酸和甲基丙烯酸甲酯共聚物,优选甲基丙烯酸和甲基丙烯酸甲酯1:2共聚物;聚合物b为甲基丙烯酸和丙烯酸乙酯共聚物,优选甲基丙烯酸和丙烯酸乙酯1:1共聚物。
聚合物a优先选用,德国尤特奇公司生产的Eudragit S100,聚合物b的优先选用德国尤特奇公司生产的Eudragit L系列聚合物,最优选Eudragit L100‐55
其中,药物层还含有增塑剂、抗粘剂、色素、亲水性聚合物和表面活性剂其中表面活性剂选自十二烷基硫酸钠硫酸钠或吐温80,加入量是穿心莲内酯的0‐5wt%,优选1‐3wt%。
所述增塑剂选自如下一种或几种,柠檬酸三乙酯、癸二酸二丁酯、丙二醇、PEG,其用量为聚合物a用量的10wt%‐70wt%,优选10wt%‐20wt%;抗粘剂选自滑石粉,用量为聚合物a的25wt%‐100wt%,优选30wt%‐50wt%或单硬脂酸甘油酯,用量为聚合物a的2wt%‐20wt%,优选5‐10wt%。
丸芯粒径为200~600微米,优选300~500微米,丸芯占处方量的10wt%-70wt%,优选20wt%-60wt%。其中丸芯为常规制药丸芯,优选空白蔗糖丸芯或微晶纤维素丸芯。
丸芯:穿心莲内酯:聚合物a:增塑剂:抗粘剂:表面活性剂=200:(10‐100):(10‐100):(1‐15):(1‐30):(0‐3);
优先,丸芯:穿心莲内酯:聚合物a:增塑剂:抗粘剂:表面活性剂=200:(15‐66):(13‐74):(2‐13.5):(3‐27):(0‐1.32);
最优选,丸芯:穿心莲内酯:聚合物a:增塑剂:抗粘剂:表面活性剂=200:200:(20‐50):(30‐60):(5‐10):(5‐20):(0.5‐1.2);
其中肠溶包衣层中还含有增塑剂和抗粘剂,其增塑剂和抗粘剂的选用如上所述,其中增塑剂用量为聚合物b的15wt%、抗粘剂用量为聚合物b的30wt%。
以下提供7组丸芯与药物层优选处方:
以上穿心莲内酯肠溶靶向微丸,其制备方法如下:
(1)丸芯上药
A、将聚合物a分散于药用溶剂中,机械搅拌使之充分溶解;向聚合物a溶液中加入辅料;再加入穿心莲内酯,搅拌均匀,得到聚合物a包衣液;
B、称取空白丸芯置于流化床中,调节空气量使微丸处于理想流化状态,开启加热装置,待物料温度达到预先设定值时开启蠕动泵,使所述聚合物a包衣液通过喷枪雾化均匀分散在所述空白丸芯表面,得到载药微丸;
(2)肠溶包衣层的制备
A、将聚合物b分散于药用有机溶剂或水中,机械搅拌使之充分溶解,向聚合物b溶液中加入辅料,搅拌均匀,得到聚合物b包衣液;
B、采用流化床设备进行包衣,将所述载药微丸投入流化床底喷装置中,将所述聚合物b包衣液均匀喷涂,形成肠溶包衣层;肠溶包衣层增重为5wt%‐30wt%。
制备方法优选:
(1)丸芯上药
A、将聚合物a分散于药用乙醇中,使聚合物a浓度为5wt%,机械搅拌使之充分溶解;继续搅拌均匀,向聚合物a溶液中加入作为辅料的增塑剂、抗粘剂和表面活性剂十二烷基硫酸钠;再加入穿心莲内酯,搅拌均匀,得到聚合物a包衣液;
B、称取200‐600微米空白蔗糖丸芯置于流化床中,调节空气量使微丸处于理想流化状态,开启加热装置,保持微丸物料温度为25‐35℃,待物料温度达到预先设定值时开启蠕动泵,使所述聚合物a包衣液通过喷枪雾化均匀分散在所述空白丸芯表面,得到载药微丸;
(2)肠溶包衣层的制备
A、将聚合物b分散于药用乙醇中,高速剪切机械搅拌使之充分溶解,向聚合物b溶液中加入作为辅料的增塑剂、抗粘剂,搅拌均匀,得到聚合物b包衣液;
B、采用流化床设备进行包衣,将所述载药微丸投入流化床底喷装置中,将所述聚合物b包衣液均匀喷涂,形成肠溶包衣层;肠溶包衣层增重为8wt%‐20wt%。
一种穿心莲内酯肠溶靶向制剂,将上述的微丸采用常规方法制备成颗粒剂或胶囊剂。
有益效果
本申请采用特殊的pH依赖型技术,即2种pH依赖性聚合物联合使用,实现不同肠道及结肠pH值的人体都可达到结肠靶向目的。①在微丸表面包裹第一种肠溶材料,如Eudragit L100-55,保证药物在胃内不释放,到十二指肠后很快溶解掉,露出药物层。②中间药物层是第三种肠溶材料,如Eudragit S100为骨架均匀分布药物而成。当微丸到十二指肠,外层保护衣膜溶解后药物逐渐溶出,但药物层中Eudragit S100阻滞效果,在低pH条件下药物溶出释放量很少,只有到小肠末端pH接近7时药物才快速释放。
本申请制备的穿心莲内酯肠溶靶向微丸具有3层结构,空白内核、药物层和Eudragit L外层。当药物制剂进入胃时,因pH低于5.5,第一层膜保持完整,但 到十二指肠后,膜在较短时间内溶解,露出第二层。第二层中Eudragit S起缓释和肠溶双重作用。穿心莲内酯是均匀分散在Eudragit S中。到十二指肠外层溶解后,穿心莲内酯接触体液随即开始释放,但这个部位pH值低,Eudragit S溶解量有限,药物释放量很少,释放速度很慢。随着药物往胃肠道下半部转移,pH值逐渐升高,Eudragit S溶解速度加快,药物释放速度逐渐升高,这样大部分药物在回肠和结肠部位释放,对肠壁炎症发挥药效。
我们采用的内核丸芯粒径为200~600微米,与临床常用的微丸丸芯(500~1000微米)比较明显粒径小,这有利于提高药物的比表面积,增加药物与炎症部位的接触面积,保证了穿心莲内酯对炎症性肠病的治疗效果。在处方中丸芯约占10wt%-70wt%。
Eudragit系列聚合物作为膜材料进行微丸包衣,处方中加入增塑剂和抗粘剂。其中增塑剂主要作用是降低玻璃化温度和最低成膜温度,还可以增加聚合物膜柔性。抗粘剂主要作用是为了避免膜变粘,引起丸芯之间相互粘连。
表面活性剂可以增加亲润药物的作用。
体外释放度实验
将上述优选处方中的两个处方制备得到的微丸进行体外释放测定,相当于150mg穿心莲内酯的肠溶靶向微丸装入胶囊后测定释放度。采用中国药典溶出度第一法,转速为100转/分钟,不同pH盐溶液为释放介质(1000mL)。按中国药典规定取样后用HPLC测定不同时间段内药物释放量。
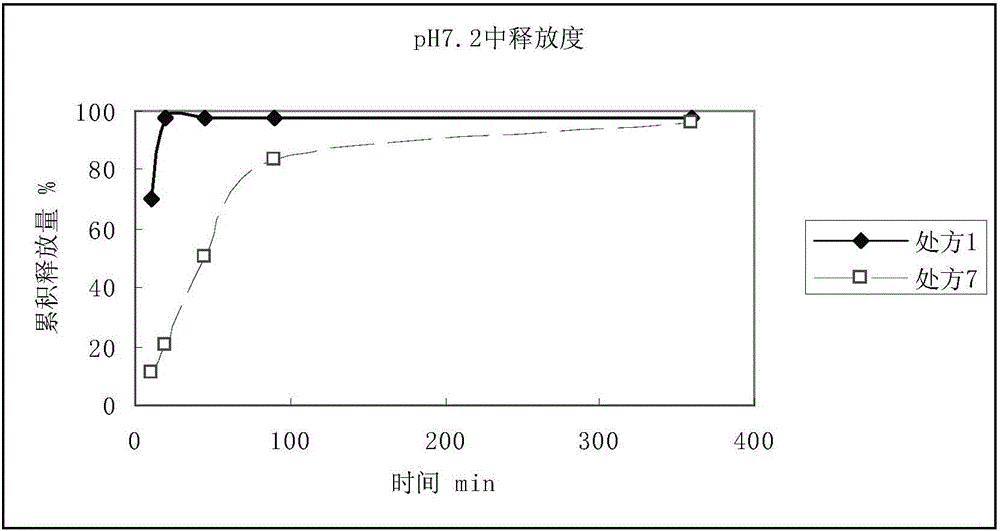
结果见附图,其中处方1为所有处方中释放速度最快的,处方7为最慢的,其他处方介于两者之间。
附图说明
图1、模拟肠液的pH6.5磷酸盐缓冲液中药物累积释放量
图2、模拟结肠液的pH7.2磷酸盐缓冲液中药物累积释放量
图3、两组大鼠给药后血浆中穿心莲内酯平均血药浓度‐时间曲线图(n=4)
图4、两组大鼠给药后穿心莲内酯在近端小肠的分布量图(n=3)
图5、两组大鼠给药后穿心莲内酯在远端小肠的分布量图(n=3)
图6、两组大鼠给药后穿心莲内酯在结肠的分布量图(n=3)
具体实施方式
实施例1
穿心莲内酯肠溶靶向微丸,由空白丸芯、药物层和肠溶包衣层组成,药物层由如下配比组成:
其中丸芯为600微米空白蔗糖丸芯;增塑剂为柠檬酸三乙酯、抗粘剂为滑石粉;表面活性剂为十二烷基硫酸钠硫酸钠;
肠溶包衣层含Eudragit L100‐55、增塑剂、抗粘剂,其中增塑剂、抗粘剂的选择与上述药物层相同,增塑剂用量为Eudragit L100‐55的15wt%、抗粘剂用量为Eudragit L100‐55的30wt%;其包衣增重为5wt%。
实施例2
穿心莲内酯肠溶靶向微丸,由空白丸芯、药物层和肠溶包衣层组成,药物层由如下配比组成:
其中丸芯为200微米微晶纤维素;增塑剂为癸二酸二丁酯、抗粘剂为单硬脂酸甘油酯;表面活性剂为吐温80;
肠溶包衣层含Eudragit L100‐55、增塑剂、抗粘剂,其中增塑剂、抗粘剂的选择与上述药物层相同,增塑剂用量为Eudragit L100‐55的15wt%、抗粘剂用量为Eudragit L100‐55的30wt%;其包衣增重为30wt%。
实施例3
穿心莲内酯肠溶靶向微丸,由空白丸芯、药物层和肠溶包衣层组成,药物层由如下配比组成:
其中丸芯为400微米空白蔗糖丸芯;增塑剂为丙二醇、抗粘剂为滑石粉;表面活性剂为十二烷基硫酸钠硫酸钠;
肠溶包衣层含Eudragit L100‐55、增塑剂、抗粘剂,其中增塑剂、抗粘剂的选择与上述药物层相同,增塑剂用量为Eudragit L100‐55的15wt%、抗粘剂用量为Eudragit L100‐55的30wt%;其包衣增重为8wt%。
实施例4
穿心莲内酯肠溶靶向微丸,由空白丸芯、药物层和肠溶包衣层组成,药物层由如下配比组成:
其中丸芯为500微米空白蔗糖丸芯;增塑剂为丙二醇、抗粘剂为滑石粉;
肠溶包衣层含Eudragit L30D‐55、增塑剂、抗粘剂,其中增塑剂、抗粘剂的选择与上述药物层相同,增塑剂用量为Eudragit L L30D‐55的15wt%、抗粘剂用量为Eudragit L L30D‐55的30wt%;其包衣增重为20wt%。
实施例5
穿心莲内酯肠溶靶向微丸,由空白丸芯、药物层和肠溶包衣层组成,药物层由如下配比组成:
其中丸芯为500微米空白蔗糖丸芯;增塑剂为PEG、抗粘剂为滑石粉;
肠溶包衣层含Eudragit L100‐55、增塑剂、抗粘剂,其中增塑剂、抗粘剂的选择与上述药物层相同,增塑剂用量为Eudragit L100‐55的15wt%、抗粘剂用量为Eudragit L100‐55的30wt%;其包衣增重为28wt%。
实施例6
穿心莲内酯肠溶靶向微丸,由空白丸芯、药物层和肠溶包衣层组成,药物层由如下配比组成:
其中丸芯为500微米空白蔗糖丸芯;增塑剂为PEG、抗粘剂为滑石粉;
肠溶包衣层含Eudragit L100‐55、增塑剂、抗粘剂,其中增塑剂、抗粘剂的选择与上述药物层相同,增塑剂用量为Eudragit L100‐55的15wt%、抗粘剂用量为 Eudragit L100‐55的30wt%;其包衣增重为15wt%。
实施例7
穿心莲内酯肠溶靶向微丸,由空白丸芯、药物层和肠溶包衣层组成,药物层由如下配比组成:
其中丸芯为500微米空白蔗糖丸芯;增塑剂为柠檬酸三乙酯、抗粘剂为滑石粉;
肠溶包衣层含Eudragit L100‐55、增塑剂、抗粘剂,其中增塑剂、抗粘剂的选择与上述药物层相同,增塑剂用量为Eudragit L100‐55的15wt%、抗粘剂用量为Eudragit L100‐55的30wt%;其包衣增重为15wt%。
实施例8
穿心莲内酯肠溶靶向微丸,由空白丸芯、药物层和肠溶包衣层组成,药物层由如下配比组成:
其中丸芯为600微米空白蔗糖丸芯;增塑剂为柠檬酸三乙酯、抗粘剂为滑石粉;表面活性剂为十二烷基硫酸钠硫酸钠;
肠溶包衣层含Eudragit L100‐55、增塑剂、抗粘剂,其中增塑剂、抗粘剂的选择与上述药物层相同,增塑剂用量为Eudragit L100‐55的15wt%、抗粘剂用量为Eudragit L100‐55的30wt%;其包衣增重为8wt%。
实施例9
穿心莲内酯肠溶靶向微丸,由空白丸芯、药物层和肠溶包衣层组成,药物层含:穿心莲内酯、pH≥7.0条件下溶解的聚合物a;穿心莲内酯与聚合物a重量比为1:2,药物层增重为20wt%;
肠溶包含pH≥5.5条件下溶解的聚合物b,其包衣增重为8wt%。增塑剂、抗粘剂,其用量配比与药物层中聚合物a与增塑剂和抗粘剂的用量配比相同。
其中聚合物a为甲基丙烯酸和甲基丙烯酸甲酯共聚物;聚合物b为甲基丙烯酸和丙烯酸乙酯共聚物。
上述增塑剂为柠檬酸三乙酯、抗粘剂为滑石粉。
实施例10
穿心莲内酯肠溶靶向微丸,由空白丸芯、药物层和肠溶包衣层组成,药物层含:穿心莲内酯、pH≥7.0条件下溶解的聚合物a;穿心莲内酯与聚合物a重量比为1:0.2,增重为100wt%;肠溶包含pH≥5.5条件下溶解的聚合物b,其包衣增重为20wt%,。
其中聚合物a为甲基丙烯酸和甲基丙烯酸甲酯1:2共聚物;聚合物b为甲基丙烯酸和丙烯酸乙酯1:1共聚物。
上述增塑剂为癸二酸二丁酯、抗粘剂为单硬脂酸甘油酯
实施例11
穿心莲内酯肠溶靶向微丸,由空白丸芯、药物层和肠溶包衣层组成,药物层含:穿心莲内酯、pH≥7.0条件下溶解的聚合物a;穿心莲内酯与聚合物a重量比为1:1.5,药物层增重为30wt%;肠溶包含pH≥5.5条件下溶解的聚合物b,其包衣增重为10wt%。增塑剂、抗粘剂,其用量配比与药物层中聚合物a与增塑剂和抗粘剂的用量配比相同。
其中聚合物a为甲基丙烯酸和甲基丙烯酸甲酯1:2共聚物;聚合物b为甲基丙烯酸和丙烯酸乙酯1:1共聚物。
实施例12
一种穿心莲内酯肠溶靶向微丸,由空白丸芯、药物层和肠溶包衣层组成,药物层含:穿心莲内酯、pH≥7.0条件下溶解的聚合物a、增塑剂、抗粘剂、色素、亲水性聚合物和表面活性剂;穿心莲内酯与聚合物a比例为1:2,药物层增重为100wt%;增塑剂选自如柠檬酸三乙酯,其用量为聚合物a用量的10wt%;抗粘剂选自滑石粉,用量为聚合物a的25wt%。
肠溶包衣为pH≥5.5条件下溶解的聚合物b,其包衣增重为20%。增塑剂、抗粘剂,其用量配比与药物层中聚合物a与增塑剂和抗粘剂的用量配比相同。
其中聚合物a为甲基丙烯酸和甲基丙烯酸甲酯1:2共聚物;聚合物b为甲基丙烯酸和丙烯酸乙酯1:1共聚物。
上述增塑剂为柠檬酸三乙酯、抗粘剂为滑石粉。
实施例13
穿心莲内酯肠溶靶向微丸,由空白丸芯、药物层和肠溶包衣层组成,药物层含:穿心莲内酯、pH≥7.0条件下溶解的聚合物a、增塑剂、抗粘剂;穿心莲内酯与聚合物a重量比为1.0.5,药物层增重为80wt%;所述增塑剂选自癸二酸二丁酯,其用量为聚合物a用量的70wt%;抗粘剂选自滑石粉,用量为聚合物a的100wt%。
肠溶包含pH≥5.5条件下溶解的聚合物b,其包衣增重为18wt%。增塑剂、抗粘剂,其用量配比与药物层中聚合物a与增塑剂和抗粘剂的用量配比相同。
其中聚合物a为甲基丙烯酸和甲基丙烯酸甲酯1:2共聚物;聚合物b为甲基丙烯酸和丙烯酸乙酯1:1共聚物。
上述增塑剂为柠檬酸三乙酯、抗粘剂为滑石粉。
实施例14
穿心莲内酯肠溶靶向微丸,由空白丸芯、药物层和肠溶包衣层组成,药物层含:穿心莲内酯、pH≥7.0条件下溶解的聚合物a、增塑剂、抗粘剂;穿心莲内酯与聚合物a重量比为1:1,药物层增重为50wt%;述增塑剂选自丙二醇,其用量为聚合物a用量的20wt%;抗粘剂选自滑石粉,用量为聚合物a的30wt%。
肠溶包含pH≥5.5条件下溶解的聚合物b,其包衣增重为15wt%。增塑剂、抗粘剂,其用量配比与药物层中聚合物a与增塑剂和抗粘剂的用量配比相同。
其中聚合物a为甲基丙烯酸和甲基丙烯酸甲酯1:2共聚物;聚合物b为甲基丙烯酸和丙烯酸乙酯1:1共聚物。
上述增塑剂为柠檬酸三乙酯、抗粘剂为滑石粉。
实施例15
穿心莲内酯肠溶靶向微丸,由空白丸芯、药物层和肠溶包衣层组成,药物层含:穿心莲内酯、pH≥7.0条件下溶解的聚合物a、增塑剂、抗粘剂;穿心莲内酯与聚合物a重量比为1:1.5,药物层增重为60wt%;述增塑剂选自PEG,其用量为聚合物a用量的50wt%;抗粘剂选自滑石粉,用量为聚合物a的80wt%。
肠溶包含pH≥5.5条件下溶解的聚合物b,其包衣增重为16wt%。增塑剂、抗粘剂,其用量配比与药物层中聚合物a与增塑剂和抗粘剂的用量配比相同。
其中聚合物a为甲基丙烯酸和甲基丙烯酸甲酯1:2共聚物;聚合物b为甲基丙烯酸和丙烯酸乙酯1:1共聚物
上述增塑剂为柠檬酸三乙酯、抗粘剂为滑石粉。
实施例16
穿心莲内酯肠溶靶向微丸,由空白丸芯、药物层和肠溶包衣层组成,药物层含:穿心莲内酯、pH≥7.0条件下溶解的聚合物a、增塑剂、抗粘剂;穿心莲内酯与聚合物a重量比为1:1.5,药物层增重为60wt%;述增塑剂选自PEG,其用量为聚合物a用量的50wt%;抗粘剂选自单硬脂酸甘油酯,用量为聚合物a的2wt%。
肠溶包含pH≥5.5条件下溶解的聚合物b,其包衣增重为16wt%。增塑剂、抗粘剂,其用量配比与药物层中聚合物a与增塑剂和抗粘剂的用量配比相同。
其中聚合物a为甲基丙烯酸和甲基丙烯酸甲酯1:2共聚物;聚合物b为甲基丙烯酸和丙烯酸乙酯1:1共聚物。
上述增塑剂为柠檬酸三乙酯、抗粘剂为滑石粉。
实施例17
穿心莲内酯肠溶靶向微丸,由空白丸芯、药物层和肠溶包衣层组成,药物层含:穿心莲内酯、pH≥7.0条件下溶解的聚合物a、增塑剂、抗粘剂;穿心莲内酯与聚合物a重量比为1:1.5,药物层增重为60wt%;述增塑剂选自PEG,其用量为聚合物a用量的50wt%;抗粘剂选自单硬脂酸甘油酯,用量为聚合物a的20wt%。
肠溶包含pH≥5.5条件下溶解的聚合物b,其包衣增重为16wt%。增塑剂、抗粘剂,其用量配比与药物层中聚合物a与增塑剂和抗粘剂的用量配比相同。
其中聚合物a为甲基丙烯酸和甲基丙烯酸甲酯1:2共聚物;聚合物b为甲基丙烯酸和丙烯酸乙酯1:1共聚物。
上述增塑剂为柠檬酸三乙酯、抗粘剂为滑石粉。
实施例18
实施例1-17所述的微丸的制备方法为:
1)丸芯上药:
A、将聚合物a分散于一定量的药用有机溶剂中,高速剪切机械搅拌使之充分溶解;向聚合物溶液中加入增塑剂,抗粘剂;再加入穿心莲内酯搅拌均匀;包衣时保持机械搅拌,使包衣液为均匀混悬液;
B、称取空白丸芯置于流化床中,调节空气量使微丸处于理想流化状态,开启加热装置,待物料温度达到预先设定值时开启蠕动泵,使包衣液通过喷枪雾化均匀分散在丸芯表面;
2)肠溶外层的制备
A、将聚合物b分散于一定量的药用有机溶剂或水中,高速剪切机械搅拌使之充分溶解,向聚合物溶液中加入增塑剂,抗粘剂搅拌均匀;
B、肠溶外层采用流化床设备上进行包裹,将载药微丸投入流化床底喷装置中,将聚合物b包衣液均匀喷涂;微丸肠溶衣膜增重为5wt%。
实施例18
实施例1-17所述的微丸的制备方法为:
1)丸芯上药:
A、将聚合物a分散于一定量的药用有机溶剂中,高速剪切机械搅拌使之充分溶解;向聚合物溶液中加入增塑剂,抗粘剂;再加入穿心莲内酯搅拌均匀;包衣时保持机械搅拌,使包衣液为均匀混悬液;
B、称取空白丸芯置于流化床中,调节空气量使微丸处于理想流化状态,开启加热装置,待物料温度达到预先设定值时开启蠕动泵,使包衣液通过喷枪雾化均匀分散在丸芯表面;
2)肠溶外层的制备
A、将聚合物b分散于一定量的药用有机溶剂或水中,高速剪切机械搅拌使之充分溶解,向聚合物溶液中加入增塑剂,抗粘剂搅拌均匀;
B、肠溶外层采用流化床设备上进行包裹,将载药微丸投入流化床底喷装置中,将聚合物b包衣液均匀喷涂;微丸肠溶衣膜增重为30wt%。
实施例19
实施例1-17所述的微丸的制备方法为:
1)丸芯上药:
A、将聚合物a分散于一定量的药用乙醇中,使聚合物浓度为5wt%,高速剪切机械搅拌使之充分溶解;继续搅拌均匀,向聚合物溶液中加入下表中增塑剂,抗粘剂和表面活性剂十二烷基硫酸钠硫酸钠。再加入穿心莲内酯搅拌均匀;包衣时保持机械搅拌,使包衣液为均匀混悬液;
B、称取200微米空白蔗糖丸芯置于流化床中。调节空气量使微丸处于理想流化状态,开启加热装置,保持微丸物料温度为25℃,待物料温度达到预先设定值时开启蠕动泵,使包衣液通过喷枪雾化均匀分散在 丸芯表面;
2)肠溶外层的制备
A、将聚合物b分散于一定量的药用乙醇中,高速剪切机械搅拌使之充分溶解,向聚合物溶液中加入增塑剂,抗粘剂搅拌均匀;
B、肠溶外层采用流化床设备上进行包裹,将载药微丸投入流化床底喷装置中,将聚合物b包衣液均匀喷涂;微丸肠溶衣膜增重为8wt%。
实施例20
实施例1-17所述的微丸的制备方法为:
1)丸芯上药:
A、将聚合物a分散于一定量的药用乙醇中,使聚合物浓度为5wt%,高速剪切机械搅拌使之充分溶解;继续搅拌均匀,向聚合物溶液中加入下表中增塑剂,抗粘剂和表面活性剂十二烷基硫酸钠硫酸钠。再加入穿心莲内酯搅拌均匀;包衣时保持机械搅拌,使包衣液为均匀混悬液;
B、称取600微米空白蔗糖丸芯置于流化床中。调节空气量使微丸处于理想流化状态,开启加热装置,保持微丸物料温度为35℃,待物料温度达到预先设定值时开启蠕动泵,使包衣液通过喷枪雾化均匀分散在丸芯表面;
2)肠溶外层的制备
A、将聚合物b分散于一定量的药用乙醇中,高速剪切机械搅拌使之充分溶解,向聚合物溶液中加入增塑剂,抗粘剂搅拌均匀;
B、肠溶外层采用流化床设备上进行包裹,将载药微丸投入流化床底喷装置中,将聚合物b包衣液均匀喷涂;微丸肠溶衣膜增重为20wt%。
实施例21
实施例1-17所述的微丸的制备方法为:
1)丸芯上药:
A、将聚合物a分散于一定量的药用乙醇中,使聚合物浓度为5wt%,高速剪切机械搅拌使之充分溶解;继续搅拌均匀,向聚合物溶液中加入下表中增塑剂,抗粘剂和表面活性剂十二烷基硫酸钠硫酸钠。再加入穿心莲内酯搅拌均匀;包衣时保持机械搅拌,使包衣液为均匀混悬液;
B、称取400微米空白蔗糖丸芯置于流化床中。调节空气量使微丸处于理想流化状态,开启加热装置,保持微丸物料温度为32℃,待物料温度达到预先设定值时开启蠕动泵,使包衣液通过喷枪雾化均匀分散在丸芯表面;
2)肠溶外层的制备
A、将聚合物b分散于一定量的药用乙醇中,高速剪切机械搅拌使之充分溶解,向聚合物溶液中加入增塑剂,抗粘剂搅拌均匀;
B、肠溶外层采用流化床设备上进行包裹,将载药微丸投入流化床底喷装置中,将聚合物b包衣液均匀喷涂;微丸肠溶衣膜增重为15wt%。
实施例21
将实施例1-17所述的微丸,制备得到常规颗粒剂或胶囊剂。
实施例22
穿心莲内酯滴丸与穿心莲内酯肠溶微丸制剂的药代动力学比较
1.供试品及制剂
穿心莲内酯标准品(中国药品生物制品鉴定所,纯度:98.7%,批号:110797-201108);
穿心莲内酯肠溶微丸按照实施例1所述的处方、实施例18所述制备方法制备;
穿心莲内酯滴丸(素丸)与穿心莲内酯肠溶微丸主成分含量基本一致。
2.实验动物分组、给药及血浆样品采集
8只Wistar大鼠随机均分为两组,分别按100mg/kg(以穿心莲内酯计)灌胃给予穿心莲内酯滴丸及穿心莲内酯肠溶微丸制剂。采集给药后0.083,0.25,0.5,1,1.5,2,3,4,6,8,12,24h血样,–20℃下冷冻保存。
3.测试方法
3.1分析仪器
美国应用生物系统公司液相质谱联用系统API 4000Qtrap(含2台岛津LC-20AD泵,SIL-20AC恒温自动进样器,CTO-20A柱温箱,CBM-20A控制器,ESI和APCI接口离子源,Analyst Software 1.5.2色谱工作站);沃特世公司超高压液相质谱联用系统Waters Quattro Premier XE/Acquity UPLC(Masslynx V4.1色谱 工作站)。
3.2血浆样品处理
取给药大鼠血浆样品100μL置塑料EP管中,加入10μL内标溶液(白果酸内酯1.0μg/mL),再加入10μL甲醇/水(1:1)溶液,充分涡旋1min,再加500μL乙酸乙酯,充分涡旋3min,15000r/min离心10min,取400μL上清溶液,氮气吹干,用100μL甲醇/水(1:1)溶液,涡旋1min,取上清进样10μL。
3.3LC-MS/MS条件
3.3.1色谱条件
3.3.2质谱条件(负离子检测模式)
4.实验结果
两组大鼠给药后血浆中穿心莲内酯平均血药浓度-时间曲线见图3。使用DAS3.0软件计算两组大鼠给药后血浆中穿心莲内酯的主要药动学参数(见表1、表2)。药动学实验结果看,穿心莲内酯肠溶微丸制剂表现出明显的吸收迟滞,其Tmax约为滴丸剂的5.4倍,具有统计学差异(P<0.05),且肠溶微丸制剂给药后4h内的大鼠血药浓度小于滴丸组,无明显突释,Cmax也小于滴丸组,肠溶微丸组穿心莲内酯的平均滞留时间(MRT)也明显长于滴丸组(P<0.05),基本符合结肠靶向制剂的药动学特征。
表1穿心莲内酯肠溶微丸制剂组大鼠的主要药动学参数
表2穿心莲内酯滴丸组大鼠的主要药动学参数
实施例23
穿心莲内酯滴丸与穿心莲内酯肠溶微丸制剂的肠组织分布比较
1.供试品及制剂
穿心莲内酯标准品(中国药品生物制品鉴定所,纯度:98.7%,批号:110797-201108),
穿心莲内酯肠溶微丸按照实施例1所述的处方、实施例18所述制备方法制备;
穿心莲内酯滴丸(素丸)与穿心莲内酯肠溶微丸主成分含量基本一致。
2.实验动物分组、给药及血浆样品采集
30只大鼠随机均分为2个制剂组(穿心莲内酯肠溶微丸制剂和穿心莲内酯滴丸),每个制剂组内再设5个时间点组(3只/组),分别按100mg/kg(以穿心莲内酯计)灌胃给予穿心莲内酯滴丸及穿心莲内酯肠溶微丸制剂,于给药后0.5,1.5,4,8,24h分别将大鼠处死,迅速采集大鼠近端小肠、远端小肠及结肠组织,洗净后称重,用生理盐水进行匀浆(按组织重量/g:生理盐水/mL=1:2),–20℃冷冻保存。
3.测试方法
3.1分析仪器
UPLC-30A超快速液相色谱仪(日本岛津公司)与AB SCIEX 5500QRTAP质谱(美国AB应用生物系统公司)联用系统。
3.2组织样品处理
取各肠道组织样品100μL,加入内标(地高辛100ng/mL)100μL、甲醇:水(1:1)100μL、乙酸乙酯2mL,涡旋3min,12500rpm/min离心取上清液,氮气吹干,100μL甲醇:水(1:1)复溶,涡旋1min,取上清进样10μL。
3.3LC-MS/MS条件
3.3.1色谱条件
色谱柱为ACQUITY UPLC BEH Shield RP 18(1.7μm,2.1×100mm),流动相为0.1%甲酸水-甲醇(47%:53%),流速0.4mL/min
3.3.2质谱条件(负离子检测模式)
※该准分子离子为[M+HCOO]-形式
4.实验结果
两组大鼠给药后近端小肠、远端小肠、结肠中穿心莲内酯的组织分布图见图4~图6。结果表明,给予穿心莲内酯肠溶微丸制剂和滴丸制剂后,穿心莲内酯微丸组在小肠近端和小肠远端1.5h内的分布量小于滴丸剂组,呈现出一定的分布迟滞。在结肠段,肠溶微丸组各时间点的穿心莲内酯分布量明显高于滴丸剂组,可初步证明,穿心莲内酯肠溶微丸具有一定的肠靶向性。
- 还没有人留言评论。精彩留言会获得点赞!