一种制备狂犬病活载体疫苗的方法及其产品和用途与流程
本发明涉及利用病毒载体生产狂犬病活载体疫苗的方法及其产品和用途,特别是一种利用腺病毒载体表达狂犬病病毒G蛋白和细菌鞭毛蛋白制备狂犬病活载体疫苗的方法及其产品和用途。
背景技术:
狂犬病(rabies)是由狂犬病病毒(rabies virus,RV)感染引起的人兽共患急性接触性病传染病,一旦发病,则100%死亡。全球每年约有55000人死于该病,我国近5年每年死亡约3000人左右,仅次于印度,主要由犬咬伤引起。因此,预防狂犬病的主要措施是对犬、猫和野生动物进行狂犬病疫苗的免疫接种。目前我国兽用的狂犬病疫苗主要有灭活苗和弱毒苗。尽管传统疫苗在狂犬病预防控制中仍占主导地位,但由于生产成本昂贵,以及灭活不彻底而造成散毒的潜在危险等因素的存在,限制了其的广泛使用。因此,研制安全、高效的新型狂犬病分子疫苗仍显得非常必要。
活载体疫苗是近年来研究的热点之一,被认为是一种很有开发前景的疫苗。制苗时往活载体中插入外源保护性目的基因,由于外源基因已经成为作为载体的病毒或细菌的自身结构的一部分,故所产生的免疫应答水平通常不低于完整病毒或细菌相应成分所引起的免疫强度。重组痘病毒载体和重组腺病毒载体具有宿主范围广,对外界有一定的抵抗力,被认为是基因工程疫苗的优良载体。虽然对重组痘病毒载体的研究起步最早,但由于痘苗病毒能在哺乳动物体内复制,人们对它的生物安全性存在某种疑问,担心与天花病毒类似的痘苗病毒在动物上应用会进化出对人类有致病性的新病毒。而复制缺陷型腺病毒常缺失对于病毒复制所必需的病毒早期基因E1区,使其在动物体内不能复制,因此研制重组复制缺陷型腺病毒狂犬病疫苗更为安全和有效。
狂犬病毒有5种结构蛋白,其中糖蛋白G与病毒的感染和免疫有密切关系。研究表明G是唯一诱导中和抗体的蛋白,也能刺激细胞免疫应答,可抵抗狂犬病毒外周和脑内途径的攻击。近年来研制的狂犬病基因工程重组疫苗,大都以糖蛋白cDNA 作为目的基因。这些重组疫苗虽然可以刺激特异性抗体的产生,并产生一定水平的保护力,但是,单一的糖蛋白G其总体诱导产生的抗体水平并不高,有待于提高其水平。
细菌的鞭毛蛋白是鞭毛丝状部的主要成分,在细菌性病原体的毒力和细菌的运动中起着重要作用。在大多数沙门氏菌株中,有两个基因(fljB和fliC)可以编码鞭毛抗原。fliC编码一相鞭毛蛋白FliC,fljB编码二相鞭毛蛋白FljB。鞭毛蛋白也是一种病原相关分子模式(pathogen-associated molecular pattern,PAMP),可以与哺乳动物细胞上的TLR5结合介导信号的传导。先天性免疫系统能够通过TLRs识别细菌上保守的PAMPs,如脂多糖和鞭毛蛋白。这些结构能够诱导强烈的炎症反应,并最终激活获得性免疫反应。
活载体疫苗具有安全、高效、生产费用低廉等优点,但目前尚未有狂犬病活载体疫苗疫苗上市。综合狂犬病分子疫苗的研究现状,我们认为以腺病毒为表达载体的基因工程重组狂犬病疫苗(或称活载体疫苗)将具有良好的应用前景。
技术实现要素:
本发明的目的是提供一种利用腺病毒载体表达狂犬病病毒G蛋白和细菌鞭毛蛋白制备狂犬病活载体疫苗的方法,从而获得安全、高效的狂犬病疫苗。
本发明的目的是通过以下技术方案实现的:
本发明的一种利用腺病毒载体表达狂犬病病毒G蛋白和细菌鞭毛蛋白制备狂犬病活载体疫苗的方法,包括如下步骤:
(1)制备目的基因:
设计引物,通过PCR的方法扩增出狂犬病病毒(Rabies Virus,RV)的抗原蛋白G基因与细菌鞭毛蛋白FIjB或FIiC基因;
(2)构建重组复制缺陷型腺病毒穿梭载体:
将步骤(1)扩增的到的抗原蛋白G基因与细菌鞭毛蛋白FIjB或FIiC基因一同插入到复制缺陷型腺病毒穿梭载体特异性启动子和终止子之间,检测抗原蛋白G基因以及FIjB或FIiC基因是否已经整合到腺病毒穿梭载体中,构建得到含有G-FIjB或G-FIiC的重组复制缺陷型腺病毒穿梭载体,命名为PAdTrack-CMV/G-FIjB或PAdTrack-CMV/G-FIiC;
(3)获得复制缺陷型腺病毒质粒:
将获得的重组复制缺陷型腺病毒穿梭载体PAdTrack-CMV/G-FIjB或 PAdTrack-CMV/G-FIiC与腺病毒骨架载体PAdEasy-1通过在大肠杆菌中进行质粒间同源重组从而得到重组腺病毒质粒;
(4)用重组腺病毒质粒产生基因组结构均一的重组腺病毒,包括以下操作:
1)用Pac I酶切步骤(3)得到的重组腺病毒质粒,
2)转染293细胞,
3)接种293细胞,
4)获得基因组结构均一的重组腺病毒,收集病毒感染的病变细胞,连同上清冻存,即得。
在本发明中,优选的,步骤(1)中用于扩增抗原蛋白基因G和细菌鞭毛蛋白FIjB和FIiC基因的扩增引物为:
GF:5’GCAGATCTGCCACCATGGTTCCTCAAGCTCTTTTG3’(含有Bgl Ⅱ酶切位点)
GR:5’GCGTCGACTCACAGTCTGATCTCACC 3’(含有Sal Ⅰ酶切位点)
FIjBF:5’ATTGTCGACGCCACCATGGCACAAGTAATCAACACT 3’(含有Sal Ⅰ位点)
FIjBR:5’GCTCTAGATTAACGTAACAGAGACAGC 3’(含有Xba Ⅰ酶切位点)
FIiCF:5’ATTGTCGACGCCACCATGGCACAAGTCATTAATACA 3’(含有Sal Ⅰ位点)
FIiCR:5’GCAAGCTTTTAACGCAGTAAAGAGAG 3’(含有HindⅢ酶切位点)
其中,ATG为起始密码子;狂犬病病毒G基因以狂犬病毒aG毒株为模板使用引物对GF/GR进行扩增;细菌鞭毛蛋白FIjB或FIiC基因分别以鼠伤寒沙门氏菌的鞭毛蛋白基因为模板使用引物对FIjBF/FIjBR或FIiCF/FIiCR进行扩增。
在本发明中,优选的,在步骤(2)中,所述的腺病毒载体启动子为CMV;终止子为PolyA;所述的重组复制缺陷型腺病毒穿梭载体的构建包括以下操作:
1)将扩增得到的目的基因G经Bgl Ⅱ、Sal Ⅰ双酶切,形成带有粘性末端的目的基因片段;
2)同时,将腺病毒穿梭载体PAdTrack-CMV经Bgl Ⅱ、Sal Ⅰ双酶切,得到线性化的载体;
3)使用T4DNA连接酶对上述产物进行粘端连接;
4)按常规方法将连接产物转化大肠埃希氏菌,在含卡那抗性的琼脂平板上筛选, 挑选克隆后,提取质粒;
5)采用酶切、PCR扩增方法鉴定,得到阳性重组质粒,命名为PAdTrack-CMV/G;
6)将回收得到的目的基因FIjB经Sal Ⅰ、Xba Ⅰ双酶切,目的基因FIiC经Sal Ⅰ、HindⅢ双酶切,形成带有粘性末端的目的基因片段;
7)同时,将阳性重组质粒PAdTrack-CMV/G经Sal Ⅰ、Xba Ⅰ双酶切或Sal Ⅰ、HindⅢ双酶切,得到线性化的载体;
8)使用T4DNA连接酶对步骤(6)和(7)的产物进行粘端连接;按常规方法将连接产物转化大肠埃希氏菌JM109,在含卡那抗性的琼脂平板上筛选,挑选克隆后,提取质粒;采用酶切、PCR扩增方法鉴定,得到阳性重组质粒,命名为PAdTrack-CMV/G-FIjB或PAdTrack-CMV/G-FIiC。
在本发明中,优选的,在步骤(3)中,获得复制缺陷型腺病毒质粒的过程包括以下操作:
1)将重组复制缺陷型腺病毒穿梭载体PAdTrack-CMV/G-FIjB或PAdTrack-CMV/G-FIiC用Pme I单酶切以线性化;
2)取PAdEasy-1与步骤1)得到的线性化后的重组复制缺陷型腺病毒穿梭载体混合,高压电转化大肠杆菌BJ5183;
3)电转后将细胞在培养液中复苏,取细胞涂入含卡那霉素的培养板中,培养;
4)挑选卡那霉素抗性克隆,小量提取质粒DNA,用0.8%琼脂糖凝胶进行电泳迁移率分析,并进行限制性内切酶图谱分析;
5)将所得的重组腺病毒质粒高压电转化入宿主菌,在此宿主菌中可获得大量高质量的质粒,挑取目的克隆。其中,优选的,所述的宿主菌为DH10B。
在本发明中,优选的,在步骤(4)中,用重组腺病毒质粒产生基因组结构均一的重组腺病毒的各操作的具体做法为:
1)取步骤(3)得到的重组腺病毒质粒,用Pac I酶切,完全消化以切去包括Ori和Kan抗性基因在内的质粒构件,并暴露其反转末端重复序列(ITR);
2)脂质体介导的转染,在组织培养皿中接种293细胞进行转染;
3)取病毒上清接种293细胞,以含2%小牛血清的完全DMEM培养液于培养箱中培养,逐日观察细胞病变,到293细胞完全病变;
4)收集病毒感染的病变细胞,检测抗原蛋白G-FIjB和G-FIiC基因是否获得表达,最后连同上清液冻存。
在本发明中,优选的,步骤2)中,所述的脂质体介导的转染包括以下操作步 骤:
①稀释Pac I酶切线性化的重组腺病毒质粒至DMEM培养液中;
②然后将脂质体悬液加至DMEM培养液中,充分将二者混匀,室温下温育;
③在此期间吸弃细胞原培养液,用DMEM培养液洗细胞一次;
④往每平皿中加DNA/脂质体复合物,在5%CO2培养箱中温育后吸弃含DNA/脂质体复合物的培养液,
⑤补加含10%小牛血清的DMEM完全培养液,继续培养,脂质体转染后收集细胞,反复冻融。
在本发明中,优选的,步骤4)中通过观测绿色荧光蛋白表达的办法,包括利用倒置显微镜观测细胞病变和荧光显微镜观测报告基因绿色荧光蛋白的表达来确定抗原蛋白G-FIjB和G-FIiC基因是否获得表达。
在本发明中,优选的,步骤(2)中通过采用PCR和限制性内切酶鉴定,进行琼脂糖凝胶电泳分析检测的方法来确定抗原蛋白G基因以及FIjB或FIiC基因是否已经整合到腺病毒载体中。
进一步的,本发明还提出了由以上任一项所述的方法制备得到的狂犬病活载体疫苗以及所述的狂犬病活载体疫苗在制备预防或治疗狂犬病的药物中的用途。
本发明将狂犬病毒G蛋白基因分别与细菌鞭毛蛋白FIjB或FIiC基因通过IRES序列连接,构建得到含有狂犬病毒G基因和鞭毛蛋白FIjB以及G基因和鞭毛蛋白FIiC的重组腺病毒质粒,进而得到基因组结构均一的重组腺病毒。本发明方法制备得到的狂犬病活载体疫苗,其以狂犬病毒糖蛋白G为基础,同时在鞭毛蛋白的参与下,可诱导机体产生更为全面的免疫应答,获得更好的免疫效果。
构建重组腺病毒工作中的限速步骤是将目的基因整合入腺病毒基因组,目前这一关键过程中大都是以哺乳动物细胞中同源重组方式实现的,有一定的难度。同时,因重组效率不高,所得的重组病毒常常需要空斑纯化,故实验周期较长,而且也不能保证重组腺病毒基因组结构的均一性。本发明利用生长周期快,操作简便的大肠杆菌细菌实现质粒间同源,从而很快的获得均一的重组腺病毒载体。
综上所述,本发明得到的重组复制缺陷型腺病毒狂犬病疫苗较之现有狂犬病疫苗更为安全和有效,且制作周期较短。
附图说明
图1为重组穿梭载体PAdTrack-CMV/G-FIjB和PAdTrack-CMV/G-FIiC酶切及PCR鉴定图;
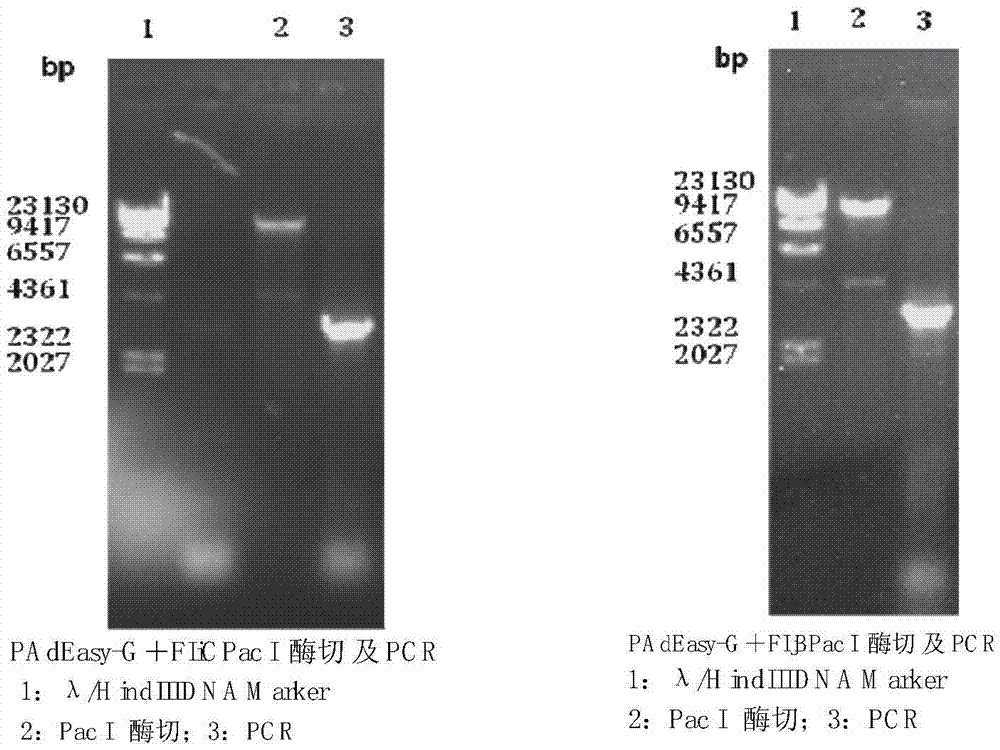
图2为重组腺病毒质粒鉴定图;
图3为利用倒置显微镜观测细胞病变图和利用荧光显微镜观测绿色荧光蛋白的表达图;
图4为表达重组腺病毒穿梭载体的构建图;
图5为中和抗体检测结果。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
实施例1狂犬病活载体疫苗的制备
用本实施例方法可以制备得到用于直接接种动物的复制缺陷型腺病毒狂犬病活载体疫苗。包括以下过程,参照图4:
一、制备目的基因
设计引物,通过PCR的方法扩增出狂犬病病毒(Rabies Virus,RV)抗原蛋白G基因与细菌鞭毛蛋白FIjB基因或FIiC基因;所设计的抗原蛋白基因G和细菌鞭毛蛋白FIjB基因或FIiC基因的扩增引物为:
GF:5’GCAGATCTGCCACCATGGTTCCTCAAGCTCTTTTG3’(含有Bgl Ⅱ酶切位点)
GR:5’GCGTCGACTCACAGTCTGATCTCACC 3’(含有Sal Ⅰ酶切位点)
FIjBF:5’ATTGTCGACGCCACCATGGCACAAGTAATCAACACT 3’(含有Sal Ⅰ位点)
FIjBR:5’GCTCTAGATTAACGTAACAGAGACAGC 3’(含有Xba Ⅰ酶切位点)
FIiCF:5’ATTGTCGACGCCACCATGGCACAAGTCATTAATACA 3’(含有Sal Ⅰ位点)
FIiCR:5’GCAAGCTTTTAACGCAGTAAAGAGAG 3’(含有HindⅢ酶切位点)
其中,ATG为起始密码子;狂犬病病毒G基因以狂犬病毒aG毒株为模板使用引物对GF/GR进行扩增;细菌鞭毛蛋白FIjB或FIiC基因分别以鼠伤寒沙门氏菌的鞭毛蛋白基因为模板使用引物对FIjBF/FIjBR或FIiCF/FIiCR进行扩增。
GF位于狂犬病毒aG株全序列3318处;GR位于狂犬病毒aG株全序列4893处;
FIjBF位于鞭毛蛋白FIjB基因的1处;FIjBR位于鞭毛蛋白FIjB基因的1521处;
FIiCF位于鞭毛蛋白FIiC基因的1处;FIjBR位于鞭毛蛋白FIiC基因的1488处。
二、构建重组复制缺陷型腺病毒穿梭载体
将扩增得到的狂犬病毒G基因与细菌鞭毛蛋白FIjB或FIiC基因分别插入到复制缺陷型腺病毒穿梭载体特异性启动子CMV和终止子之间PolyA,构建成含有基因G-FIjB或G-FIiC的重组复制缺陷型腺病毒穿梭载体,命名为
PAdTrack-CMV/G-FIjB或PAdTrack-CMV/G-FIiC;
具体包括以下操作步骤:
1)将回收得到的目的基因G经Bgl Ⅱ、Sal Ⅰ双酶切,形成带有粘性末端的目的基因;
2)同时,将腺病毒穿梭载体PAdTrack-CMV经Bgl Ⅱ、Sal Ⅰ双酶切,得到线性化的载体;
3)使用T4DNA连接酶对上述产物进行粘端连接;
4)按常规方法将连接产物转化大肠埃希氏菌JM109,在含卡那抗性的琼脂平板上筛选,挑选克隆后,提取质粒;
5)采用酶切、PCR扩增方法鉴定,得到阳性重组质粒PAdTrack-CMV/G。
6)将回收得到的目的基因FIjB经Sal Ⅰ、Xba Ⅰ双酶切,目的基因FIiC经Sal Ⅰ、HindⅢ双酶切,形成带有粘性末端的目的基因。
7)同时,将阳性重组质粒PAdTrack-CMV/G经Sal Ⅰ、Xba Ⅰ双酶切或Sal Ⅰ、HindⅢ双酶切,得到线性化的载体。
8)使用T4DNA连接酶对上述产物进行粘端连接;按常规方法将连接产物转化大肠埃希氏菌JM109,在含卡那抗性的琼脂平板上筛选,挑选克隆后,提取质粒;采用酶切、PCR扩增方法鉴定,得到阳性重组质粒PAdTrack-CMV/G-FIjB或 PAdTrack-CMV/G-FIiC。
所述的检测G-FIjB或G-FIiC基因已经整合到腺病毒载体中,采用PCR和限制性内切酶鉴定,进行琼脂糖凝胶电泳分析。将所获得的含有目的基因G-FIjB的重组穿梭载体PAdTrack-CMV/G-FIjB经Bgl Ⅱ、Xba I双酶切鉴定可切出约3.0KB的目的片段,同时PCR鉴定也可扩增出大小相符的G基因和FIjB基因目的片段(图1左);将所获得的含有目的基因G-FIiC的重组穿梭载体PAdTrack-CMV/G-FIiC经Bgl Ⅱ、HindⅢ双酶切鉴定可切出约3.0KB的目的片段,同时PCR鉴定也可扩增出大小相符的G基因和FIiC基因目的片段(图1右),通过与标准分子量对比可判断。
三、获得复制缺陷型腺病毒质粒
将获得的重组复制缺陷型腺病毒穿梭载体PAdTrack-CMV/G-FIjB或PAdTrack-CMV/G-FIiC与腺病毒骨架载体PAdEasy-1通过在大肠杆菌中质粒间同源重组从而得到重组腺病毒质粒,具体包括以下操作步骤:
1)将重组穿梭载体分别用Pme I单酶切以线性化;
2)取0.1mg PAdEasy-1与1.0mg线性化重组穿梭载体混合,高压电转化大肠杆菌BJ5183;
3)电转后将细胞在LB培养液中于37℃复苏30min,取细胞涂入含50mg/Ml卡那霉素的培养板中,于37℃培养16~20h;
4)挑选卡那霉素抗性克隆,小量提取质粒DNA,用0.8%琼脂糖凝胶进行电泳迁移率分析,并进行限制性内切酶图谱分析,结果如图2所示,从图2可以看到同源重组后检测目的基因已经整合入腺病毒载体,通过琼脂糖凝胶电泳分析可见重组质粒明显落后于骨架载体,限制性内切酶酶切后可见约4.5KB和33KB的条带,其结果与预期相符;得到的阳性重组质粒命名为PAdEasy-G+FIiC或PAdEasy-G+FIjB;
5)将所得的重组腺病毒质粒以高压电转化入宿主菌DH10B(Rec A,End A),在此宿主菌中可获得大量高质量的质粒,挑取目的克隆。
四、用重组腺病毒质粒产生基因组结构均一的重组腺病毒,包括以下操作:
1)酶切,取从DH10B中提取的各重组腺病毒质粒PAdEasy-G+FIiC或PAdEasy-G+FIjB 4μg,用Pac I酶切,完全消化以切去Ori和Kan抗性基因等质粒构件,并暴露其反转末端重复序列ITR;
2)转染,脂质体介导的转染,在35mm组织培养皿中接种293细胞进行转染,所述的脂质体介导的转染包括以下分操作:
①稀释Pac I酶切线性化的重组腺病毒质粒4μg至250ul DMEM培养液中;
②然后将脂质体LipofectAMINE2000悬液10μl加至250ul DMEM培养液中,充分将二者混匀,室温下温育20min;
③在此期间吸弃细胞原培养液,用DMEM培养液洗细胞一次;
④往每平皿加500ul DNA/脂质体复合物,在37℃,5%CO2培养箱中温育3~5h后吸弃含DNA/脂质体复合物的培养液,
⑤补加3ml含10%小牛血清的DMEM完全培养液,继续培养7天,脂质体转染后,收集细胞,反复冻融3次。
3)接种,取病毒上清接种293细胞,以含2%小牛血清的完全DMEM培养液于37℃、5%CO2培养箱中培养,逐日观察细胞病变CPE,至293细胞完全病变;
4)冻存,收集病毒感染的病变细胞,连同上清冻存于-20℃,构建得到的含有抗原蛋白G基因与细菌鞭毛蛋白FIjB或FIiC基因的重组腺病毒,命名为Ad-RV-G-FljB或Ad-RV-G-FliC。
同时按照上述方法构建了仅含有抗原蛋白G基因的重组腺病毒,命名为Ad-RV-G。
检测G-FIjB或G-FIiC基因是否获得表达,采用观测绿色荧光蛋白表达的办法包括利用倒置显微镜观测细胞病变,可见对照细胞正常生长,而转染细胞出现明显的细胞病变。利用荧光显微镜可直接观测到报告基因绿色荧光蛋白的表达。其结果图3所示。
将经检测合格的重组腺病毒制成狂犬病活载体疫苗,直接注射动物进行免疫。
实施例2狂犬病活载体疫苗的免疫效力实验动物试验数据
用实施例1构建的Ad-RV-G、Ad-RV-G-FljB、Ad-RV-G-FliC三种重组腺病毒活载体分别在0、14天免疫6-8周龄的Balb/c小白鼠,在免疫后7、14、21、28、35、42分别采血,用RFFIT法测定中和抗体,结果如图5所示。结果显示,3种重组腺病毒在2次免疫后,中和抗体均开始上升,其中重组腺病毒Ad-RV-G-FljB刺激产生的中和抗体水平最高,而重组腺病毒Ad-RV-G-FliC产生的中和抗体水平较低,但均高于Ad-RV-G。结果表明,将鞭毛蛋白FljB或FliC与狂犬病毒G蛋白共表达的重组腺病毒具有明显的佐剂增强效应,其免疫产生的中和抗体水平能够抵抗狂犬病毒致死剂量的攻击。
免疫42天用30LD50的狂犬病毒攻击,观察14天,结果所有免疫小鼠获得 100%。以上结果说明本发明的一种基于重组腺病毒表达狂犬病毒G蛋白和鞭毛蛋白的狂犬病活载体疫苗具有良好的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种在无血清全悬浮培养的mdck细胞生长的禽流感病毒的制备方法及获得的禽流感病毒的制作方法
- 腺相关病毒载体的高效生产的制作方法
- 一种靶向Mesothelin的复制缺陷性重组慢病毒CAR-T转基因载体及其构建方法和应用
- Cyp3a5蛋白、编码基因、重组载体及其在制备抗肿瘤复发或转移药物中的应用
- 一种靶向cd30的复制缺陷性重组慢病毒car-t转基因载体及其构建方法和应用
- 一种靶向cd22的复制缺陷性重组慢病毒car-t转基因载体及其构建方法和应用
- 一种特异性抑制平滑肌细胞增殖和迁移的腺病毒载体及其应用
- 一种提高AdEasy腺病毒载体系统重组效率的方法
- 用于转导脂肪组织的腺相关病毒载体的制作方法
- 肿瘤靶向腺病毒复合载体及其制备方法和用图