一种胸腺五肽缓释微球及其制备方法和用途与流程
本发明涉及胸腺五肽缓释微球及其制备方法和用途。
背景技术:
蛋白多肽类药物具有疗效高、剂量小的优势,现代生物技术的飞速发展使大规模生产高效的生物活性蛋白多肽类药物成为可能,使其在临床上的应用越来越广泛。但是,蛋白多肽类药物存在稳定性差、体内易降解、半衰期很短的缺点,导致临床应用时,给药形式有限,给药途径单一,目前的临床剂型多数为注射溶液剂和冻干粉针剂,使用时需长期频繁注射,患者顺应性较差。以生物可降解药用高分子材料为载体制备该类药物的缓释微球,可使药物缓慢释放,降低毒/副作用,缓释期可达数天或数月,明显减少服药次数,优化整体治疗费用,有利于临床治疗。
微球是指药物溶解或者分散在高分子材料基质中形成的球状实体微粒,粒径一般在1~250μm之间(理想直径应小于125μm)。以生物可降解药用高分子材料为载体的微球,能够将蛋白多肽类药物包裹在微球中进行保护,借助高分子材料的降解来释放药物,根据所选载体材料的规格和降解速率,缓释周期可达数天或数月。
胸腺五肽(thymopentin,tp-5)是胸腺生成素的活性片段,具有调节和增强人体细胞免疫功能的作用。临床应用范围广泛,主要用于治疗慢性乙型肝炎、各种原发性或继发性t细胞缺陷疾病、某些自身免疫性疾病、各种细胞免疫功能低下的疾病以及肿瘤的辅助治疗。
目前已有将胸腺五肽制成缓释微球的研究。但现有胸腺五肽缓释微球存在孔隙率高、载药量低等问题。例如,李洪报道的胸腺五肽缓释微球,根据其包封率的结果,可以计算其载药量仅有1.76%(参见中国现代应用药学杂志,2009年7月,第26卷,第7期,第582-584页)。cn1714861a中公开的胸腺五肽缓释微球中载药量较低,孔隙率较大。
技术实现要素:
鉴于以上情况,本发明提供一种胸腺五肽缓释微球,其具有低孔隙率,高载药量。并且,发明人进一步研究发现,载药量的提高、孔隙率的降低,改变了胸腺五肽缓释微球的释放周期和体内释药特征。
为此,本发明一方面提供一种胸腺五肽缓释微球,包含胸腺五肽和生物可降解药用高分子材料,其特征在于,所述缓释微球的载药量为5%以上;优选为8%以上;更优选为10%以上;进一步优选为12%以上;最优选为15%以上。孔隙率为30%以下;优选为25%以下;更优选为20%以下;进一步优选为15%以下;进一步优选为10%以下;最优选为6%以下。
优选地,上述的胸腺五肽缓释微球中,生物可降解药用高分子材料占所述缓释微球的重量百分比为60%-95%。
优选地,上述的胸腺五肽缓释微球中,所述生物可降解药用高分子材料为选自天然生物可降解药用高分子材料和合成生物可降解药用高分子材料中的至少一种;其中,天然生物可降解药用高分子材料包含胶原、明胶、透明质酸类、海藻酸盐、丝素蛋白、白蛋白、玉米醇溶蛋白、淀粉、纤维素、聚糖(如甲壳素)、以及它们的衍生物;合成生物可降解药用高分子材料包含聚酯类、聚酸酐类、聚原酸酯类、聚磷酸酯类、聚氨酯类。
优选地,上述生物可降解药用高分子材料为聚酯类。
更优选地,上述聚酯类包括聚丙交酯乙交酯(plga)、聚丙交酯(pla)、聚乙交酯(pga)、聚氰基丙烯酸烷酯(paca)、聚己内酯(pcl)、聚羟基丁酸酯(phb)、聚羟基丁酸戊酸共聚酯(phbv)、聚羟戊酸(pva)、聚癸酸(pda)、聚羟基丁酸酯-羟基戊酸酯、聚乳酸-羟甲基乙醇酸(plhmga)、聚乳酸-聚乙二醇嵌段共聚物(pla-peg)、聚乳酸羟基乙酸-多聚赖氨酸-聚乙二醇共聚物(plga-pll-peg)、乳酸-聚乙二醇(聚丙二醇)共聚物(pela)中的至少一种。
进一步优选地,上述聚酯类为聚丙交酯乙交酯(plga)。
优选地,上述胸腺五肽缓释微球中,所述生物可降解药用高分子材料为聚丙交酯乙交酯(plga),所述聚丙交酯乙交酯(plga)中乳酸与羟基乙酸聚合摩尔比例为50:50~90:10,粘度为0.1~2.0dl/g。
优选地,上述胸腺五肽缓释微球的孔隙率为3~6%或12.7%;所述聚丙交酯乙交酯(plga)中乳酸与羟基乙酸的聚合摩尔比例为50:50,所述聚丙交酯乙交酯(plga)的粘度为0.59dl/g或0.38dl/g。
优选地,上述的胸腺五肽缓释微球中,还包括乳化稳定剂。
更优选地,所述乳化稳定剂为选自聚乙烯醇(pva)、聚乙烯吡咯烷酮(pvp)、聚甲基丙烯酸钠、聚丙烯酸钠和羧甲基纤维素钠中的至少一种。
更优选地,所述乳化稳定剂为聚乙烯醇(pva)和聚乙烯吡咯烷酮(pvp)中的至少一种。
优选地,上述胸腺五肽缓释微球中,所述生物可降解药用高分子材料占所述缓释微球的重量百分比为60.0%-94.75%,优选为60.0%-91.75%,更优选60.0%-89.75%,更优选60.0%-87.75%,更优选60.0%-84.75%。
优选地,所述乳化稳定剂占所述缓释微球的重量百分比为0.25%-20%。
本发明第二个方面提供上述胸腺五肽缓释微球的制备方法,包括w/o/w法、s/o/w法、w/o/o法、s/o/o法。
优选地,上述制备方法为w/o/w法。
更优选地,上述w/o/w法为w/o/w复乳溶剂挥发法。
优选地,上述的制备方法采用w/o/w复乳溶剂挥发法,包括如下步骤:将生物可降解药用高分子材料溶解在有机溶剂中,优选为选自二氯甲烷、氯仿、乙酸乙酯、二氧六环、甲苯、甲醇、苯甲醇、乙醚、丙酮、四氢呋喃中的至少一种有机溶剂中,作为油相,将胸腺五肽溶解于水中作为内水相,渗透压调节剂和任选的乳化稳定剂溶于水中作为外水相,将内水相加入油相中制成初乳(w/o),再转入外水相制成复乳(w/o/w),将复乳转移至水溶液中,搅拌,收集所得微球,洗涤,冷冻干燥,即得缓释微球。
更优选地,上述渗透压调节剂为选自氯化钠、磷酸盐、葡萄糖、羟丙基-β-环糊精和聚乙烯亚胺中的至少一种。
本发明的第三个方面是提供上述的胸腺五肽缓释微球在制备注射给药、口服给药、眼部给药的药物制剂中的用途。
胸腺五肽缓释微球在体内的分析方法为:将荧光素与胸腺五肽通过化学键连接,通过上述胸腺五肽缓释微球的制备方法制备成制剂给药,测定血浆荧光强度。
在本发明中,载药量是指缓释微球中所含药物占微球总重的比例,它决定了缓释微球制剂单次给药尤其是注射给药的剂量。
如果没有特别地指出,本文所用的科学和技术术语以及名称都具有与本发明所属领域普通技术人员常规理解相同的意思。
本发明的胸腺五肽缓释微球具有如下优点:
1)本发明的胸腺五肽缓释微球载药量高,单次注射微球总量小,即可实现长周期治疗有效量的药物释放。
2)通过使胸腺五肽缓释微球的孔隙率控制在本发明的范围内,可以实现缓释微球的体内释药曲线符合higuchi动力学模型或零级模型。从而可根据胸腺五肽日需求量等要求选择具有合适体内释放特征的微球,或联合使用两种或多种释放特征的微球。
3)生物可降解药用高分子材料通常具有特定的降解速率,从而具有特定的释药周期。而本发明人意外地发现,通过使孔隙率和载药量控制在本发明的范围内,可以延长生物可降解药用高分子材料原本的释放周期,制得满足各种临床应用需求的胸腺五肽缓释微球。
附图说明
图1:本发明实施例所制得的各孔隙率水平的胸腺五肽/plga微球扫描电镜(sem)照片。
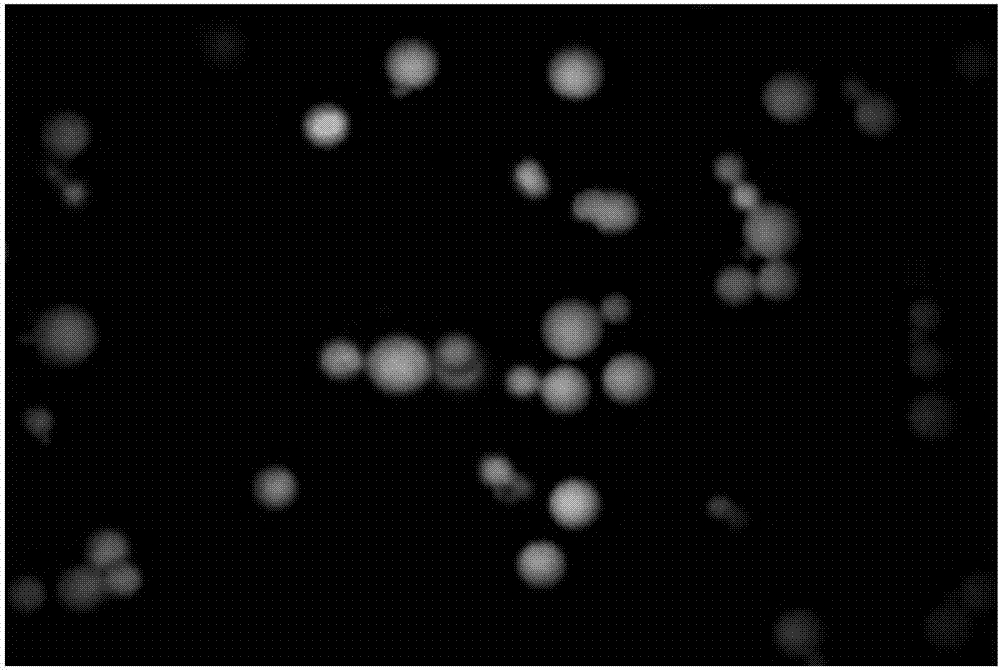
图2:本发明实施例所制得的异硫氰酸荧光素标记的胸腺五肽/plga微球荧光显微镜照片。
图3:本发明实施例所制得的异硫氰酸荧光素标记的胸腺五肽/plga微球肌肉注射给药后大鼠体内的释药曲线图。其中,横坐标为时间(d),纵坐标为体内累积释药百分率(%)。
图4:本发明实施例所制得的异硫氰酸荧光素标记的胸腺五肽/plga微球肌肉注射给药后大鼠体内的日均释药百分率柱形图。其中,横坐标为时间(d),纵坐标为体内日均释药百分率(%/d)。其中各柱形从左到右依次代表t1-1、t1-2、t2-1、t2-2、t2-3的体内日均释药百分率。
具体实施方式
以下通过实施例对本发明进行示例性说明,但本发明的范围并不局限于实施例。
实施例1
采用w/o/w复乳溶剂挥发法,将外水相渗透压调节剂氯化钠按10、20、40、60、80mg/ml投料,生物可降解药用高分子材料plga的单体聚合摩尔比为50:50,粘度为0.59dl/g。按如下方法制备微球样品:
称取2.0gplga(聚合摩尔比例50:50,粘度0.59dl/g)溶解于8.0ml二氯甲烷中,制成复乳中油相;将600mgtp-5溶于1.2ml注射用水中制成内水相;将内水相加入至作为中油相的二氯甲烷有机相中,置于高剪切乳化分散机中,以17,000rpm处理2.0min,形成w/o型初乳;以含0.5%聚乙烯醇(pva)为乳化剂、预定量的氯化钠(nacl)为渗透压调节剂的80ml水溶液做为外水相,将初乳倒入该溶液中,以8,000rpm处理5.0min,高速乳化形成w/o/w型复乳;将复乳转移入300ml含0.5%pva的固化液中,冰浴条件下以350rpm转速机械搅拌1.5h,再移至25℃的水浴中,以350rpm转速机械搅拌2.5h;离心,收集所得微球,蒸馏水洗涤多次后,再离心收集,冷冻干燥即得。
所得tp-5/plga微球呈白色粉末状,流动性良好,对应于外水相氯化钠浓度10、20、40、60、80mg/ml,分别标记为微球h1、h2、h3、h4、h5。
实施例2
采用w/o/w复乳溶剂挥发法,将异硫氰酸荧光素标记的胸腺五肽(fitc-tp5,多肽固相合成法制得,纯度≥95%,避光保存)和胸腺五肽(tp-5)按照1:5重量比投料混合,外水相氯化钠浓度为40mg/ml,生物可降解药用高分子材料plga的单体聚合摩尔比为50:50,粘度为0.59dl/g。按如下方法避光条件下制备微球样品:
称取2.0gplga(聚合摩尔比例50:50,粘度0.59dl/g)溶解于8.0ml二氯甲烷中,制成复乳中油相;将100mgfitc-tp5和500mgtp-5共同溶于1.2ml注射用水中制成内水相;将内水相加入至作为中油相的二氯甲烷有机相中,置于高剪切乳化分散机中,以17,000rpm处理2.0min,形成w/o型初乳;以含0.5%聚乙烯醇(pva)为乳化剂、含40mg/ml氯化钠(nacl)为渗透压调节剂的80ml水溶液做为外水相,将初乳倒入该溶液中,以8,000rpm处理5.0min,高速乳化形成w/o/w型复乳;将复乳转移入300ml含0.5%pva的固化液中,冰浴条件下以350rpm转速机械搅拌1.5h,再移至25℃的水浴中,以350rpm转速机械搅拌2.5h;离心,收集所得微球,蒸馏水洗涤多次后,再离心收集,冷冻干燥即得。
所得混合荧光微球呈橙色粉末状,流动性良好,标记为m3。
实施例3
采用w/o/w复乳溶剂挥发法,将外水相渗透压调节剂氯化钠按70、100mg/ml投料,生物可降解药用高分子材料plga的单体聚合摩尔比为50:50,粘度为0.38dl/g。按如下方法避光条件下制备微球样品:
称取2.0gplga(聚合摩尔比例50:50,粘度0.38dl/g)溶解于6.5ml二氯甲烷和1.5ml乙酸乙酯的混合溶剂中,制成复乳中油相;将600mg异硫氰酸荧光素标记的胸腺五肽(fitc-tp5,多肽固相合成法制得,纯度≥95%,避光保存)溶于1.2ml注射用水中制成内水相;将内水相加入至作为中油相的混合溶剂有机相中,置于高剪切乳化分散机中,以17,000rpm处理2.0min,形成w/o型初乳;以含0.5%聚乙烯醇(pva)为乳化剂、预定浓度的氯化钠(nacl)为渗透压调节剂的80ml水溶液做为外水相,将初乳倒入该溶液中,以8,000rpm处理5.0min,高速乳化形成w/o/w型复乳;将复乳转移入300ml含0.5%pva的固化液中,冰浴条件下以350rpm转速机械搅拌1.5h,再移至25℃的水浴中,以350rpm转速机械搅拌2.5h;离心,收集所得微球,蒸馏水洗涤多次后,再离心收集,冷冻干燥即得。
所得微球呈橙色粉末状,流动性良好,对应于外水相氯化钠浓度70、100mg/ml,分别标记为t1-1,t1-2。
实施例4
采用w/o/w复乳溶剂挥发法,将外水相氯化钠按40、60、80mg/ml投料,生物可降解药用高分子材料plga的单体聚合摩尔比为50:50,粘度为0.59dl/g。按如下方法避光条件下制备微球样品:
称取2.0gplga(聚合摩尔比例50:50,粘度0.59dl/g)溶解于8.0ml二氯甲烷中,制成复乳中油相;将600mg异硫氰酸荧光素标记的胸腺五肽(fitc-tp5,多肽固相合成法制得,纯度≥95%,避光保存)溶于1.2ml注射用水中制成内水相;将内水相加入至作为中油相的二氯甲烷有机相中,置于高剪切乳化分散机中,以17,000rpm处理2.0min,形成w/o型初乳;以含0.5%聚乙烯醇(pva)为乳化剂、预定浓度的氯化钠(nacl)为渗透压调节剂的80ml水溶液做为外水相,将初乳倒入该溶液中,以8,000rpm处理5.0min,高速乳化形成w/o/w型复乳;将复乳转移入300ml含0.5%pva的固化液中,冰浴条件下以350rpm转速机械搅拌1.5h,再移至25℃的水浴中,以350rpm转速机械搅拌2.5h;离心,收集所得微球,蒸馏水洗涤多次后,再离心收集,冷冻干燥即得。
所得微球呈橙色粉末状,流动性良好,对应于外水相氯化钠浓度40、60、80mg/ml,分别标记为t2-1,t2-2,t2-3。
实施例5
采用w/o/w复乳溶剂挥发法,生物可降解药用高分子材料plga的单体聚合摩尔比为75:25,粘度为0.55dl/g。按如下方法制备微球样品:
称取2.0gplga溶解于8.0ml二氯甲烷中,制成复乳中油相;将600mgtp-5溶于1.2ml注射用水中制成内水相;将内水相加入至作为中油相的二氯甲烷有机相中,置于高剪切乳化分散机中,以17,000rpm处理2.0min,形成w/o型初乳;以含2%聚乙烯醇(pva)为乳化剂、30mg/ml的氯化钠为渗透压调节剂的80ml水溶液做为外水相,将初乳倒入该溶液中,以8,000rpm处理5.0min,高速乳化形成w/o/w型复乳,固化,冰浴机械搅拌1.5h,再移至25℃的水浴中机械搅拌2.5h,洗涤,离心,收集,冷冻干燥即得。
所得tp-5/plga微球粉末流动性良好,载药量18.98%,孔隙率为17.41%。
实施例6
采用w/o/w复乳溶剂挥发法,生物可降解药用高分子材料pla,粘度为0.26dl/g。按如下方法制备微球样品:
称取1.0gpla溶解于5.0ml乙酸乙酯中,制成复乳中油相;将300mgtp-5溶于1ml注射用水中制成内水相;将内水相加入至作为中油相的乙酸乙酯有机相中,剪切形成w/o型初乳;以含5%聚乙烯吡咯烷酮(pvp)为乳化剂、50mg/ml的氯化钠(nacl)为渗透压调节剂的80ml水溶液做为外水相,将初乳倒入该溶液中,高速乳化形成w/o/w型复乳;固化,于25℃机械搅拌5h,洗涤,离心,收集,冷冻干燥即得。
所得tp-5/pla微球粉末流动性良好,载药量19.57%,孔隙率为8.01%。
试验例
试验例1:各微球粒径、载药量、孔隙率的测定
①微球粒径测定
采用激光散射粒径测定仪测定微球的平均粒径。
②微球的载药量测定
取微球适量(约相当于2mg活性药物),置于25ml容量瓶中,加入2ml乙腈-水(9:1),超声分散2min,加入含0.02%吐温-20的ph7.0磷酸盐缓冲液稀释至刻度,摇匀,经0.22μm微孔滤膜过滤后,取续滤液作为供试液;另取对照品适量,同法制成浓度为80μg/ml的对照溶液;量取供试液和对照液各20μl,照hplc外标法计算微球中活性药物的含量。
胸腺五肽(tp-5)的色谱条件:色谱柱为agilenteclipsexdb-c18,5μm,4.6×250mm;流动相为ph7.0磷酸盐缓冲液:甲醇(88:12v/v);流速lml/min;检测波长230nm;
异硫氰酸荧光素标记的胸腺五肽(fitc-tp5)的色谱条件:色谱柱:agilenteclipsexdb-c18,5μm,4.6×250mm;流动相为ph7.0磷酸盐缓冲液:甲醇(60:40v/v);流速lml/min;检测波长230nm;
微球的载药量计算公式如下:载药量=(微球中所含药物重量/微球总重)×100%。
③微球的孔隙率测定
采用poremastergt-60全自动压汞仪通过压汞法测定微球的孔隙率。
表1:胸腺五肽/plga微球h1、h2、h3、h4、h5的粒径、载药量、孔隙率测定结果。
注:渗透压差的计算公式:δπ=(π内-π外);渗透压以毫渗透量浓度来表示,毫渗透量浓度(mosm/l)=(每升溶剂中溶解的溶质克数/分子量)×n×1000,因此内水相渗透压为1000×c/679.8(c为内水相药物浓度,mg/ml),外水相渗透压为1000×2×c/58.5(c为外水相氯化钠浓度,mg/ml),而pva分子量在3万~7万,其产生的渗透压可忽略不计。
结果表明,在不同的内外水相渗透压差条件下,即通过外水相添加不同浓度的氯化钠,能够制备不同孔隙率和载药量水平的微球。
表2:异硫氰酸荧光素标记的胸腺五肽与胸腺五肽按重量比1:5混合制备的混合荧光微球m3的粒径、载药量、孔隙率测定结果。
结果表明,混合荧光标记微球m3的载药量结果与fitc-tp5:tp-5=1:5(重量比)的投料比例一致。通过与同等条件下制备的无荧光标记微球h3的粒径、载药量、孔隙率的比较,表明两种微球基本无差别,同时证明异硫氰酸荧光素标记的胸腺五肽/plga微球可代表胸腺五肽/plga微球用于体内释放研究。
表3:异硫氰酸荧光素标记的胸腺五肽制备的fitc-tp5/plga微球t1-1、t1-2、t2-1、t2-2、t2-3的孔隙率、粒径、载药量的测定结果。
试验例2:微球的体内释放试验
①实验样品
参比制剂:异硫氰酸荧光素标记的胸腺五肽,溶于生理盐水配制浓度为0.2mg/ml(以胸腺五肽计)溶液(fitc-tp5solution)。
受试制剂:如下异硫氰酸荧光素标记的胸腺五肽/plga微球,溶于0.5%cmc-na中,制成40mg/ml微球混悬液(以胸腺五肽计)。
t1-1:粒径24μm,孔隙率3.0%。
t1-2:粒径28μm,孔隙率5.8%。
t2-1:粒径47μm,孔隙率12.7%。
t2-2:粒径45μm,孔隙率3.9%。
t2-3:粒径50μm,孔隙率4.5%。
②给药方案
雄性健康sd大鼠30只,体重190~210g,禁食(不禁水)12h以上,随机分为6组,每组5只,分别为普通注射液参比组,微球受试制剂t1-1、t1-2、t2-1、t2-2、t2-3组,均采用单次肌肉注射,以tp-5计,给药剂量如下:
参比组:1mg/kg,
t1-1、t1-2组:均为20mg/kg,
t2-1、t2-2、t2-3组:均为40mg/kg。
注:试验时考虑到t1-1、t1-2组微球采用的plga材料粘度低,预计释放周期可能较短,故将其剂量减半,剂量本身不会影响体内释药特征的研究。
③样品测定
普通注射液参比组于给药后0,5,10,15,30min,1,2,4,6,10,24h,微球受试组于给药后0,0.5,1,2,4,10,24h,4,7,14,21,28,35,42,49,56,63d,于眼眶静脉丛采血约0.3ml,于肝素化具塞离心管中,4500rpm离心10min分离血浆,取100μl于96孔板中采用酶标仪测定其荧光强度,扣除空白后根据建立的体内分析方法按照体内标准曲线:a=25112c+6.1962,计算体内fitc-tp5的浓度。
④数据处理
根据参比组、各受试微球组不同时间点的血药浓度数据,采用das2.0药动学处理软件,计算主要参数auc。
通过微球组与注射液组auc(0-∞)计算微球相对生物利用度fr=auc(0-∞)(ms)/auc(0-∞)(injection)×1.0/dosage(ms)×100%。结果表明,微球的相对生物利用度均>100%。
微球受试组采用auc%法计算不同时间的累积释药百分率,公式auc%=auc(0-t)/auc(0-∞)×100%,以累积释药百分率为纵坐标,时间为横坐标分别绘制五组受试微球的体内累积释药曲线,如图4所示。试验结果表明,孔隙率不仅会影响体内释药周期,还明显地影响微球的体内释放特征。
分别运用higuchi、零级和一级数学模型,对受试微球的体内释药模型进行动力学方程拟合,结果如表4所示。结果显示,孔隙率在12.7%时体内释药符合higuchi模型,孔隙率在3~6%范围时,体内释药均符合零级模型。结果提示,孔隙率在本发明范围内时,微球的体内释药曲线可呈现higuchi动力学模型或零级模型。
以微球体内累积释放曲线为基础,计算不同时间段的日均释放百分率,分别绘制受试微球日均释放百分率柱形图,如图4所示。试验结果表明,不同孔隙率微球具有不同的体内释药速率。
表4:胸腺五肽/plga微球的体内累积释药曲线的动力学模型拟合
- 还没有人留言评论。精彩留言会获得点赞!