NaucleamideG在制备抗炎药物中的应用的制作方法
本发明属于医药技术领域,具体涉及一种从植物胆木茎中分离得到的新生物碱苷类化合物Naucleamide G在制备抗炎药物中的应用。
背景技术:
抗炎药物一般是通过调节对炎症具有重要作用的促炎性因子(TNF-α、IL-1β、IL-6等)的水平,从而发挥其抗炎作用。关于抗炎机制方面的研究,文献对很多信号通路在炎症方面的作用进行了描述(Guha M,Mackman N.LPS induction of gene expression in human monocytes.Cell Signal.2001,13:85-94),其中,核因子-κB(NF-κB)与丝裂原激活的蛋白激酶(MAPK)是与炎症相关的两条重要通路。研究表明,NF-κB主要是通过IκB激酶(IKK)介导的IκB-α的磷酸化与降解而激活的;在MAPK信号通路中,ERK、JNK和p38是与炎症关系密切的三个亚族,也被认为是抗炎药物作用的重要靶点。
胆木(Nauclea officinalis)为茜草科乌檀属植物,分布于我国的海南、广西和广东一带,其茎、皮均可入药,性味苦寒,具有清热解毒,消肿止痛之功效。我国南方民间常用于感冒发热、肺炎、肠炎、痢疾等病的治疗(《中华本草》,1999,6:456)。同时,胆木也是一味黎族医学中常用的植物药,收载于《黎族医药》。目前,国内有“胆木注射液”和“胆木浸膏片”两种中药制剂,临床用于急性扁桃炎、急性咽炎、急性结膜炎和上呼吸道感染。文献报道胆木中主要含有生物碱、五环三萜等多种化学成分,以生物碱类成分居多(宣伟东.中药胆木和云南狗牙花活性成分研究,复旦大学,2005;胡欣.乌檀化学成分分离分析与相关成分活性、药动学研究.沈阳药科大学,2007;孙静勇.胆木和山香圆化学成分及其生物活性成分研究.山东大学,2008)。胆木制剂的主要工艺过程是水煎醇沉,其制剂中活性物质尚不明确。
发明人前期研究了胆木提取物的抗炎活性,结果表明,胆木提取物具有较好的抗炎活性(Zhai X T,Zhang Z Y,Jiang C H,et al.Journal of Ethnopharmacology 2016,183:159-165)。本专利是前期研究的继续。
发明人前期利用柱色谱技术结合Waters自动纯化系统从胆木中分离出了一个全新的化合物,命名为Naucleamide G(朱粉霞,王静静,宋捷,等.胆木的化学成分研究.药学学报.2013,48(2): 276-280),其分子式为C25H32N2O8,分子量为488.53,结构式如下图所示:
技术实现要素:
本发明的目的在于提供Naucleamide G在制备抗炎药物中的应用。
本发明的第一方面,发明人研究了Naucleamide G对LPS刺激的RAW 264.7细胞中炎症因子IL-1β和TNF-α的生成以及IL-1β和TNF-αmRNA表达的影响,从而研究了Naucleamide G的抗炎活性。
本发明的第二方面,发明人研究了Naucleamide G在LPS刺激的RAW 264.7细胞中发挥抗炎作用的分子机制。Naucleamide G经LPS刺激的RAW 264.7细胞体外实验,发现该化合物可以抑制NF-κB信号通路中IKKα、IκB-α和p65的磷酸化;此外,Naucleamide G也能够抑制MAPK信号通路中ERK、JNK和p38的磷酸化。
研究结果表明,本发明中的化合物Naucleamide G能够显著地抑制IL-1β和TNF-α生成及其mRNA的表达,对炎症有明显的抑制作用,因此可以用于制备抗炎药物。此外,抗炎机制研究表明,Naucleamide G能够抑制LPS刺激的RAW 264.7细胞中的NF-κB和MAPK信号通路,从而解释了Naucleamide G发挥抗炎作用的分子机制。
附图说明
图1是Naucleamide G对LPS刺激的RAW 264.7细胞活力的影响;
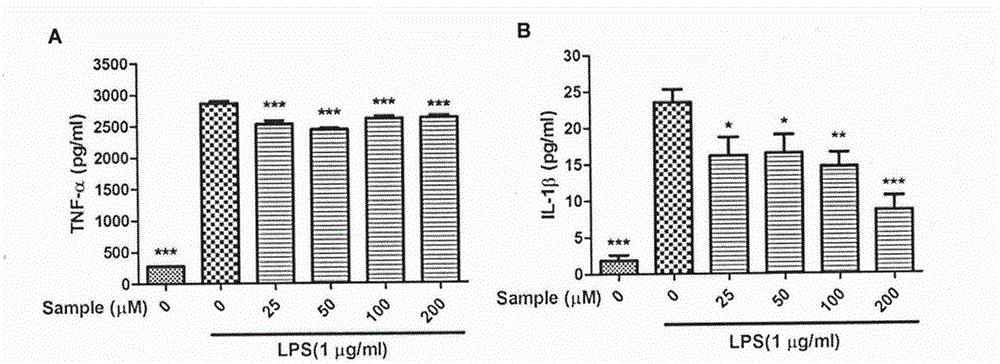
图2是Naucleamide G对LPS刺激的RAW 264.7细胞中炎症因子生成的影响,其中A是Naucleamide G对IL-1β水平的影响,B是Naucleamide G对TNF-α水平的影响;
图3是Naucleamide G对IL-1β和TNF-αmRNA表达的影响,其中A是Naucleamide G对IL-1βmRNA生成的影响,B是Naucleamide G对TNF-αmRNA生成的影响;
图4是Naucleamide G对LPS刺激的RAW 264.7细胞中NF-κB信号通路的抑制作用, 其中A是Naucleamide G对IκB磷酸化的影响,B是Naucleamide G对p65磷酸化的影响,C是Naucleamide G对IKKα磷酸化的影响;
图5是Naucleamide G对LPS刺激的RAW 264.7细胞中MAPK信号通路的抑制作用,其中A是Naucleamide G对ERK磷酸化的影响,B是Naucleamide G对JNK磷酸化的影响,C是Naucleamide G对p38磷酸化的影响。
具体实施方法
下面通过实施例和附图进一步描述本发明,但本发明的实施不仅限于此。本发明所用试剂和原料均可购得或按文献方法制备。
实施例中未注明具体条件的试验方法,通常按照常规条件,或按照制造厂商所建议的条件。
实施例:本发明化合物Naucleamide G对LPS刺激的RAW264.7细胞中炎症具有良好的抑制作用。
(一)细胞培养
小鼠RAW 264.7巨噬细胞,购自中科院上海细胞库。在37℃,5%CO2条件下,用含10%HyClone胎牛血清、100U/mL青霉素及100mg/mL链霉素的DMEM不完全培养基培养,0.5%胰酶消化传代。所有操作均为无菌操作。
(二)细胞活力实验
RAW 264.7细胞接种于96孔板中(4×106个/mL),每组六个复孔,每孔含200μL不完全高糖DMEM培养基。细胞贴壁后,用PBS洗涤细胞一遍,对照组加入不完全高糖培养基,诱导组加入含1μg/mL LPS的不完全高糖培养基,给药组加入25、50、100和200μM的Naucleamide G溶液和含1μg/mL LPS的不完全高糖培养基,于37℃,5%CO2孵育箱中培养24h后,加20μL 5mg/mL MTT培养4h,弃去培养液,细胞用PBS洗涤一遍,加150μL DMSO,微波震荡15min,用酶标仪检测570nm和490nm处的OD值。细胞活力=[(OD570-OD490)sample/(OD570-OD490)control]×100%。
结果如图1所示,25~200μM浓度的Naucleamide G对细胞活性的影响与对照组和诱导组相比较无明显差异(P>0.05),表明Naucleamide G没有显著的细胞毒性。
(三)Naucleamide G对LPS刺激的RAW 264.7细胞中IL-1β生成的影响
本实验通过ELISA试剂盒检测异Naucleamide G加药组对LPS刺激的RAW 264.7细胞产生IL-1β的影响。RAW 264.7细胞接种于96孔板中(4×106个/mL),每组六个复孔,每孔含200μL不完全高糖DMEM培养基。细胞贴壁后,用PBS洗涤细胞一遍,对照组加入不完全高糖培养基,诱导组加入含1μg/mL LPS的不完全高糖培养基,给药组加入25、50、100和200μM的Naucleamide G溶液和含1μg/mL LPS的不完全高糖培养基,于37℃,5%CO2孵育箱中培养24h后,吸50μL上清液,根据ELISA试剂盒(杭州联科生物技术有限公司)的操作说明书进行操作,检测IL-1β含量。
结果如图2A所示,LPS诱导组的IL-1β水平显著高于对照组(P<0.01);给药组的IL-1β水平与诱导组相比,有显著差异(P<0.05);当Naucleamide G浓度达到50μM水平以上时,其对IL-1β抑制作用成剂量依赖性,与诱导组相比,50、100和200μM水平的Naucleamide G对IL-1β生成的抑制率分别为29.82%,37.77%和63.39%。
(四)Naucleamide G对LPS刺激的RAW 264.7细胞中TNF-α产生的影响
本实验通过ELISA试剂盒检测异Naucleamide G加药组对LPS刺激的RAW 264.7细胞产生TNF-α的影响。RAW 264.7细胞接种于96孔板中(4×106个/mL),每组六个复孔,每孔含200μL不完全高糖DMEM培养基。细胞贴壁后,用PBS洗涤细胞一遍,对照组加入不完全高糖培养基,诱导组加入含1μg/mL LPS的不完全高糖培养基,给药组加入25、50、100和200μM的Naucleamide G溶液和含1μg/mL LPS的不完全高糖培养基,于37℃,5%CO2孵育箱中培养24h后,吸50μL上清液,根据ELISA试剂盒(杭州联科生物技术有限公司)的操作说明书进行操作,检测TNF-α含量。
实验结果如图2B所示,LPS诱导组的TNF-α水平显著高于空白对照组(P<0.01);给药组的TNF-α水平与诱导组相比,有显著差异(P<0.05),上述结果表明Naucleamide G能显著抑制LPS诱导RAW 264.7细胞产生TNF-α。
(五)Naucleamide G对IL-1βmRNA表达的影响
本实验使用Trizol试剂提取对照组、诱导组和Naucleamide G给药组的RAW 264.7细胞产生的IL-1βmRNA,利用RT-PCR确定mRNA的相对含量。RAW 264.7细胞接种于96孔板中(4×106个/mL),每组六个复孔,每孔含200μL不完全高糖DMEM培养基。细胞贴 壁后,用PBS洗涤细胞一遍,对照组加入不完全高糖培养基,诱导组加入含1μg/mL LPS的不完全高糖培养基,给药组加入25、50、100和200μM的Naucleamide G溶液和含1μg/mL LPS的不完全高糖培养基,于37℃,5%CO2孵育箱中培养24h后,根据Trizol试剂供应商(美国Invitrogen公司)提供的方法提取RNA,并测定在260nm和280nm的吸收值,确定RNA的浓度和纯度;随后,利用RT-PCR扩增RNA,以GAPDH为内参,采用2-ΔΔCt法计算IL-1βmRNA的相对表达量。
实验结果如图3A所示,结果表明,25~200μM水平的Naucleamide G能够显著抑制IL-1βmRNA的表达,并且抑制作用呈剂量依赖性,当Naucleamide G浓度达到200μM水平时,与LPS诱导组相比,IL-1βmRNA的表达被抑制了77.53%。
(六)Naucleamide G对TNF-αmRNA表达的影响
本实验使用Trizol试剂提取对照组、诱导组和Naucleamide G给药组的RAW 264.7细胞产生的IL-1βmRNA,利用RT-PCR确定mRNA的相对含量。RAW 264.7细胞接种于96孔板中(4×106个/mL),每组六个复孔,每孔含200μL不完全高糖DMEM培养基。细胞贴壁后,用PBS洗涤细胞一遍,对照组加入不完全高糖培养基,诱导组加入含1μg/mL LPS的不完全高糖培养基,给药组加入25、50、100和200μM的Naucleamide G溶液和含1μg/mL LPS的不完全高糖培养基,于37℃,5%CO2孵育箱中培养24h后,根据Trizol试剂供应商(美国Invitrogen公司)提供的方法提取RNA,并测定在260nm和280nm的吸收值,确定RNA的浓度和纯度;随后,利用RT-PCR扩增RNA,以GAPDH为内参,采用2-ΔΔCt法计算TNF-αmRNA的相对表达量。
实验结果如图3B所示,结果表明,25~200μM水平的Naucleamide G能够显著抑制TNF-αmRNA的表达,并且抑制作用呈剂量依赖性,当Naucleamide G浓度达到200μM水平时,与LPS诱导组相比,TNF-αmRNA的表达被抑制了76.31%。
(七)Naucleamide G对NF-κB通路的抑制作用
RAW 264.7细胞接种于96孔板中(4×106个/mL),每组六个复孔,每孔含200μL不完全高糖DMEM培养基。细胞贴壁后,用PBS洗涤细胞一遍,对照组加入不完全高糖培养基,诱导组加入含1μg/mL LPS的不完全高糖培养基,给药组加入25、50、100和200μM的Naucleamide G溶液和含1μg/mL LPS的不完全高糖培养基,于37℃,5%CO2孵育箱中培 养24h后,胰酶消化,于冷PBS中洗涤2遍,各加入200ul冰预冷裂解缓冲液,混匀后冰浴30min,每隔5min涡旋震荡10s,充分裂解,4℃离心10min,上清液分装,存于-70℃保存,待检测。利用Western blot法,以GAPDH为内参,计算IκBα、p-IκBα、IKKα、p-IKKα、p65、p-p65的相对表达量。
实验结果如图4所示,结果表明,Naucleamide G能够显著地降低LPS-刺激的RAW 264.7细胞中p-IκBα、p-IKKα和p-p65的表达,并且抑制作用呈剂量依赖性。Naucleamide G水平在25、50、100、200μM时,磷酸化蛋白与总蛋白的比例分别如下,p-IκBα/IκBα为:0.95±0.02、0.72±0.03、0.68±0.03、0.49±0.03;p-IKKα/IKKα为:0.85±0.04、0.69±0.03、0.47±0.02、0.35±0.02;p-p65/p65为:0.96±0.02,0.90±0.02,0.82±0.04,0.50±0.02。
(八)Naucleamide G对MAPK通路的抑制作用
RAW 264.7细胞接种于96孔板中(4×106个/mL),每组六个复孔,每孔含200μL不完全高糖DMEM培养基。细胞贴壁后,用PBS洗涤细胞一遍,对照组加入不完全高糖培养基,诱导组加入含1μg/mL LPS的不完全高糖培养基,给药组加入25、50、100和200μM的Naucleamide G溶液和含1μg/mL LPS的不完全高糖培养基,于37℃,5%CO2孵育箱中培养24h后,胰酶消化,于冷PBS中洗涤2遍,各加入200ul冰预冷裂解缓冲液,混匀后冰浴30min,每隔5min涡旋震荡10s,充分裂解,4℃离心10min,上清液分装,存于-70℃保存,待检测。利用Western blot法,以GAPDH为内参,计算ERK、p-ERK、JNK、p-JNK、p38、p-p38的相对表达量。
实验结果如图5所示,25~200μM水平的Naucleamide G剂量依赖性的抑制ERK的磷酸化(图5A);Naucleamide G在25μM水平时,对JNK和p38的磷酸化没有抑制作用,但是,当浓度达到50μM水平时,Naucleamide G显著地抑制p-JNK和p-p38的表达水平,且抑制作用呈剂量依赖性(图5B,C)。
上述实验结果表明,Naucleamide G可显著抑制LPS刺激的RAW 264.7细胞中IL-1β和TNF-α的生成,同时也抑制了IL-1β和TNF-αmRNA的表达,这些结果说明Naucleamide G具有良好的抗炎活性,且无细胞毒性,因此可用于制备抗炎药物。抗炎机制方面的研究结果显示,Naucleamide G能够抑制RAW 264.7细胞中LPS刺激的NF-κB和MAPK通路的激活,从而部分解释了Naucleamide G抗炎作用的分子机制。
以上已对本发明创造的较佳实例进行了具体说明,但本发明创造不限于所述实施例, 熟悉本领域的技术人员在不违背本发明创造精神的前提下还可做出其他的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!