一种他达拉非口腔溶膜剂及制备方法与流程
本发明提供一种他达拉非的新药物制剂,具体地说,提供一种他达拉非口腔溶膜剂及其制备方法。属于药物制剂领域。
背景技术:
:
勃起功能障碍(erectile dysfunction,ED)是一种临床常见病,全球约有1.5亿ED患者,严重威胁了广大男性的身心健康。更为严重的是,ED发病率呈逐年上升趋势,预计到2020年ED患者将达到3亿。ED的影响因素很多,与年龄、精神心理、心血管、内分泌、生活方式、药物和伤病手术等有密切联系并与年龄增长有明显的关系。ED不但常常伴发糖尿病、血管病变以及肥胖等慢性疾病,而且还是心血管事件的早期“报警”症状。ED作为一种身心疾病,导致患者及伴侣的生活质量降低,同时也给患者带来了极大的精神痛苦,造成患者自我评价和自信心下降,继而影响患者的人际关系。
WHO推荐的ED一线治疗方法为口服药物治疗,首选磷酸二酯酶5(phosphodiesterase 5,PDE5)抑制剂。此外,还有阴茎海绵体内药物注射疗法、睾酮替代治疗、手术治疗、干细胞治疗和基因治疗等。而PDE5抑制剂因其疗效好、持久、安全性高成为一线治疗用药。
磷酸二酯酶(phosphodiesterase,PDE)在生物体中广泛存在,分布在不同组织中的核苷酸代谢酶系,有多种生物功能。PDE家族共包括PDE1,PDE2,PDE3,PDE4,PDE5,PDE6,PDE7,PDE8,PDE9,PDE10和PDE11。有些磷酸二酯酶如PDE1又可以细分为PDE1a,PDE1b和PDE1c几个亚型。PDE5主要分布于脑、肾脏、胰腺、阴茎和肺部。当性刺激时,副交感神经、非肾上腺素非胆碱能(NANC)神经和血管内皮细胞在一氧化氮合酶(NOS)的作用下释放一氧化氮(NO),NO激活鸟苷酸环化酶,使GTP转化为cGMP,cGMP升高引起细胞浆内钙离子浓度降低,使平滑肌松弛,阴茎血流增加,海绵体内压升高,致海绵体静脉闭塞功能启动,阴茎开始勃起。PDE5可降解cGMP,使阴茎疲软。
PDE5抑制剂通过一氧化氮/环磷酸鸟苷(NO/cGMP)通路,能竞争性抑制PDE5而抑制cGMP的水解,提高阴茎海绵体平滑肌细胞内cGMP浓度,达到治疗勃起功能障碍(ED)的效果。
目前已上市的PDE5抑制剂有西地那非、伐地那非、他达拉非和阿伐那非。由于西地那非和伐地那非对PDE5的选择性不高,对分布于视网膜的PDE6也有抑制活性,其PDE6与PDE5的选择性都远远不如他达拉非,导致其会出现视觉异常等副作用,而他达拉非表现出非常好的对PDE5的选择性,对PDE1、PDE4和PDE6等同工酶,他达拉非的作用较弱,他达拉非的PDE6与PDE5的IC50比值为780,是西地那非的118倍,伐地那非的269倍。因此他达拉非对分布于视网膜中的PDE6抑制作用较小,可能不会有西地那非和伐地那非出现的视觉异常等副作用。
美国FDA在2003年批准他达拉非用于治疗男性勃起功能障碍(ED)症后,又增加了两个适应证:良性前列腺肥大和肺动脉高压(PAH)症。
目前,国内市售的他达拉非制剂的剂型主要为片剂,商品名为希爱力(Cialis)由Lilly公司生产规格有:5mg;10mg;20mg。
片剂作为口服固体常规制剂被患者广泛接受,但是他达拉非水溶性非常差,制成片剂对原料本身要求非常高,比如颗粒的流动性,粒径的大小,尤其是对于小规格(5mg)片剂,制备过程中一点小小的偏差都会导致含量均匀性发生问题,在制粒混合的过程中由于机械搅拌的作用,局部温度非常高对原料的稳定性也是很大的考验,并且片剂在体内有崩解的过程,这个过程的长短除了处方工艺的本身的影响,个体不同也会带来很大的差异。因此如何解决药物的溶解性,提高或保持药物应有的生物利用度,缩短药物起效时间,一直是他达拉非制剂的关键和难点。
技术实现要素:
:
为克服现有的他达拉非制剂存在的缺陷,本发明的目的在于提供一种他达拉非口腔溶膜制剂,即他达拉非口溶膜,用于治疗勃起功能障碍(erectile dysfunction,ED)。本发明技术方案如下:
本发明提供了一种他达拉非口溶膜,由他达拉非、成膜材料、增塑剂和任选存在的矫味剂、任选存在的着色剂、任选存在的芳香剂制成,其特征在于所述的成膜材料包括如下组分:(a)选自多聚糖中一种或两种以上组分;(b)选自有机酸中一种或两种以上的组分;和(c)选自羟烷基纤维素中一种或两种以上。
上述所述的他达拉非口溶膜,其中所述的多聚糖,优选为直链多聚糖,更优选地,所述的多聚糖选自普鲁兰、直链淀粉、葡果多聚糖中一种或两种以上。
上述所述的他达拉非口溶膜,其中所述的有机酸,例如选自水杨酸、酒石酸、柠檬酸、草酸、乙酸中一种或两种以上。
上述所述的他达拉非口溶膜,其中所述的羟烷基纤维素,是优选支链上至少含有1个或1个以上羟基的纤维素,例如选自羟丙纤维素、羟丙甲纤维素、羟乙基纤维素中一种或两种以上。
优选地,上述所述的他达拉非口溶膜,其中所述的成膜材料中,按重量比计,组分(a)为9%~20%,组分(b)为0.5%~9.25%,组分(c)为0.5%~1.25%。例如,作为一个具体实施方案,优选所述的成膜材料中,按重量比计,组分(a)为9%,组分(b)为0.5%,组分(c)为0.5%。
作为本发明一具体实施方式,上述所述的他达拉非口溶膜,其中按重量百分比计,所述的他达拉非口溶膜由含如下组分而制成:他达拉非5%~20%,成膜材料10%~30%,增塑剂0.1%~5%,芳香剂0.01%~1%,矫味剂0.01%~1%,着色剂0.01%~1%,乙醇溶液50%~80%。
其中,
所述的增塑剂,例如可以选自聚乙二醇(PEG)、甘油、柠檬酸三乙酯中的一种或两种以上;
所述的矫味剂,例如可以选自三氯蔗糖、阿斯巴甜、甘露醇、乙酰舒泛钾、糖精中的一种或两种以上;
所述的芳香剂,没有特别限制,可以是本领域中常规的芳香剂药用辅料,例如橘子香精等;所述的着色剂,没有特别限制,可以是本领域中常规的着色剂药用辅料,例如蓝色色素等。
作为本发明另一目的,还提供了一种制备上述所述的他达拉非口溶膜的方法,包括原料药处理、均质乳化、涂布干燥、切割分卷和包装,其特征在于均质乳化工序中按先后顺序包括如下步骤:(1)增塑剂和乙醇溶液混合后进行均质均匀;(2)加入矫味剂继续均质均匀;(3)加入他达拉非继续均质均匀;(4)加入成膜材料继续均质均匀;(5)加入芳香剂和着色剂后继续均质均匀。
其中,所述的原料药处理,是将他达拉非原料药的粒径(D90)控制在5um以下。
上述所述的乙醇溶液,优选地,其中,乙醇和水体积比为1∶1~1∶4。
其中,上述均质乳化工序中,浆液配制过程优选是在常温至30℃下均质搅拌溶解。
作为本发明一具体实施方式,上述所述的他达拉非口溶膜,可通过如下方法制得:①原料药的处理;②均质乳化工序;③涂布干燥工序;④切割分卷;⑤包装。
其中,所述的原料药的处理,是将他达拉非原料药先经过机械粉碎,再经过气流粉碎,粒径(D90)控制在5um以下。
所述的均质乳化工序,具体为:
设置水浴温度为35℃,将处方量的纯化水,乙醇和增塑剂加入均质锅内,均质搅拌均匀(3000rpm)。
缓慢加入矫味剂,设置均质温度为25℃,均质速度3500rpm,全部加完后,降下盖子继续均质搅拌30min,结束后确认是否充分溶解,否则继续均质,利用真空脱气约20min至溶液澄清。
抬起盖子,缓慢加入处理后的原料他达拉非,均质速度3500rpm,加入时间约30min,降下盖子,继续均质搅拌30min,观察溶解分散情况,可适当延长均质时间。
真空脱气泡约30min,抬起锅盖,边均质边缓慢逐步依次加入成膜材料,均质速度3500rpm,全部加完后,放下锅盖继续均质搅拌1小时(4000rpm)
从观察口倒入芳香剂和着色剂,根据混合分散情况,继续均质1~1.5小时(4500rpm)。
手动真空除气泡,约30min-60min,缓慢搅拌,自然脱气过夜。
然后,经涂布干燥工序、切割分卷和包装,制得他达拉非口溶膜。
本发明的他达拉非口溶膜剂,与现有他达拉非片剂相比,配制过程简单,温度可控,均匀度好,在口腔中快速崩解,生物利用度高。
特别是,本发明的他达拉非口溶膜,成膜材料使用了组分(a)、组分(b)和组分(c),令人意外地发现,三种组分制成的成膜材料,使得微粉化后的他达拉非能更均匀的分散在成膜材料中,并能极大地提高了他达拉非的溶解度,而且使得形成的膜剂更加坚韧,成型更好,加速考察6个月的数据显示其水分含量只有极小的下降,保证制得的膜剂具有良好的稳定性。
表1:不同成膜基质制得的他达拉非口溶膜水分含量对比
并且,由于他达拉非的低溶解性,在很多制剂中,为了提高它的溶出速度,往往需要添加表面活性剂,如专利(CN201310153588.X)中为了达到增溶目的,在处方中加入了十二烷基硫酸钠,但表面活性剂一般都有皮肤和黏膜刺激性,尤其在口服制剂中,如咀嚼片和口溶膜,表面活性剂的加入大大影响了其口感,患者顺应性差,而本发明的他达拉非口溶膜,不仅具有较高的溶出度,而且避免了表面活性剂的使用,通过所述的特定的三种组分的成膜基质制成的成膜材料,将微粉化后的他达拉非包裹住,极大的提高其溶解度,通过溶出试验也证明了其快速的溶出性质。
此外,本发明还通过对原料的处理,原料的粒径控制在合适范围,采用固体分散技术提高原料在液体中的分散均匀性,保证含量均匀性的同时可以提高药物的溶出速度。相比于他达拉非片剂,本发明的他达拉非口溶膜在口腔中在唾液的作用下便发生崩解,然后随着唾液的吞咽进入胃部,而片剂的崩解在进入胃之后,较快的崩解可以大大提高药物的溶出速度;对比片剂,本发明的口溶膜还携带服用方便,顺应性更好,不需要水也能方便的服用。
附图说明
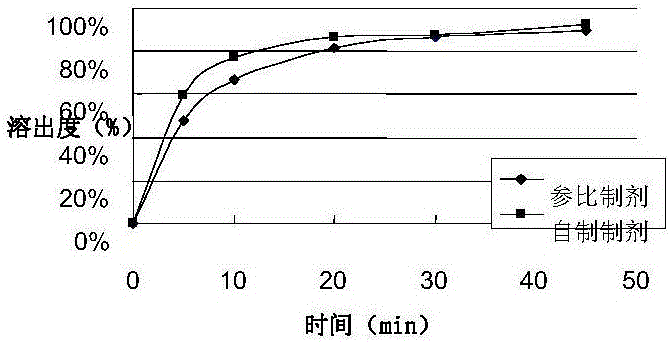
图1:pH1.2中溶出曲线对比图
图2:pH4.0中溶出曲线对比图
图3:pH6.8中溶出曲线对比图
图4:水中溶出曲线对比图
具体实施方式
为了更好地说明本发明所述他达拉非口溶膜及制备方法,结合实施例作进一步说明。
实施例1
处方:
制备方法:
①原料药的处理
他达拉非原料药先经过机械粉碎,再经过气流粉碎,粒径(D90)控制在5um以下。
②均质乳化工序
设置水浴温度为35℃,将处方量的249.56g纯化水,66g乙醇和0.4g增塑剂加入均质锅内,均质搅拌均匀(3000rpm)。
缓慢加入22g矫味剂,设置均质温度为25℃,均质速度3500rpm,全部加完后,降下盖子继续均质搅拌30min,结束后确认是否充分溶解,否则继续均质,利用真空脱气约20min至溶液澄清。
抬起盖子,缓慢加入处理后的原料他达拉非20g,均质速度3500rpm,加入时间约30min,降下盖子,继续均质搅拌30min,观察溶解分散情况,可适当延长均质时间。
真空脱气泡约30min,抬起锅盖,边均质边缓慢逐步依次加入成膜材料(普鲁兰40g,羟丙基纤维素2g),均质速度3500rpm,全部加完后,放下锅盖继续均质搅拌1小时(4000rpm)
从观察口倒入芳香剂0.04g和着色剂2g,根据混合分散情况,继续均质1~1.5小时(4500rpm)。
手动真空除气泡,约30min-60min,缓慢搅拌,自然脱气过夜。
③涂布干燥工序
设置涂布厚度600-650μm,运行速度为25cm/min,干燥温度为50-55℃,将混悬药液均匀涂布于背衬膜上。
④切割分卷
设置分切宽度为30mm,将涂布好的药卷分切为若干宽度为30mm的小卷。
⑤包装(5mg/片)
设置冲切长度为25mm/片,包装速度为1200片/min,将分切好的小卷逐一冲切包装为大小为30mm×25mm的小片。
实施例2
处方:
制备方法:
按照实施例1所述制备工艺操作,包装规格为20mg/片。
实施例3
处方:
制备方法:
按照实施例1所述制备工艺操作,包装规格为20mg/片。
实施例4
处方:
制备方法:
按照实施例1所述制备工艺操作,包装规格为5mg/片。
实施例5
处方:
制备方法:
按照实施例1所述制备工艺操作,包装规格为20mg/片。
本发明采用原辅料混悬涂布法生产他达拉非口腔溶膜剂,即他达拉非口溶膜,生产工艺稳定可控,已实现1万片以上生产规模,连续生产出的样品稳定性符合要求,为了考察本发明制剂和目前所市售的他达拉非制剂作为参比制剂(市售他达拉非片剂“希爱力”)在不同pH条件下的释放行为,对实施例1连续制备的3批他达拉非口溶膜(受试制剂)和参比制剂分别在含有0.5%十二烷基硫酸钠的pH1.2;pH4.5;pH7.5和水条件下进行了释放曲线测定,结果如图1-4所示。体外释放试验显示在10分钟的释放度超过80%,30分钟的释放度超过90%,其与原研片剂溶出行为一致;在国外的人体生物等效性试验以及国内进行的动物体内药代动力学试验均显示产品与原研他达拉非片剂生物等效,满足作为药品生产和注册的要求。
表2:国外人体生物等效性研究结果
表3:动物生物等效性研究结果
按照实施例1,连续制备3批他达拉非口溶膜,置于温度30℃,相对湿度65%条件下放置6个月,考察外观性状、含量,有关物质,溶出度,结果见下表4。
表4:稳定性试验结果
- 还没有人留言评论。精彩留言会获得点赞!